Химические свойства водорода и воды – взаимодействие с металлами, физические особенности
4.3
Средняя оценка: 4.3
Всего получено оценок: 910.
4.3
Средняя оценка: 4.3
Всего получено оценок: 910.
Водород – это газ, именно он находится на первом месте в Периодической системе. Название этого широко распространенного в природе элемента в переводе с латыни означает «порождающий воду». Так какие физические и химические свойства водорода нам известны?
Водород: общая информация
При обычных условиях водород не имеет ни вкуса, ни запаха, ни цвета.
Рис. 1. Формула водорода.Поскольку атом имеет один энергетический электронный уровень, на котором могут находиться максимум два электрона, то для устойчивого состояния атом может как принять один электрон (степень окисления -1), так и отдать отдать один электрон (степень окисления +1), проявляя постоянную валентность I. Именно поэтому символ элемента водорода помещают не только в IA группу (главную подгруппу I группы) вместе со щелочными металлами, но и в VIIA группу (главную подгруппу VII группы) вместе с галогенами.
У водорода есть три изотопа, каждый из которых имеет собственное название: протий, дейтерий, тритий. Количество последнего на Земле ничтожно.
Химические свойства водорода
В простом веществе H2 связь между атомами прочная (энергия связи 436 кДж/моль), поэтому активность молекулярного водорода невелика. При обычных условиях он взаимодействует только с очень активными металлами, а единственным неметаллом, с которым водород вступает в реакцию, является фтор:
F2+H2=2HF (фтороводород)
С другими простыми (металлами и неметаллами) и сложными (оксидами, органическими неопределенными соединениями) веществами водород реагирует либо при облучении и повышении температуры, либо в присутствии катализатора.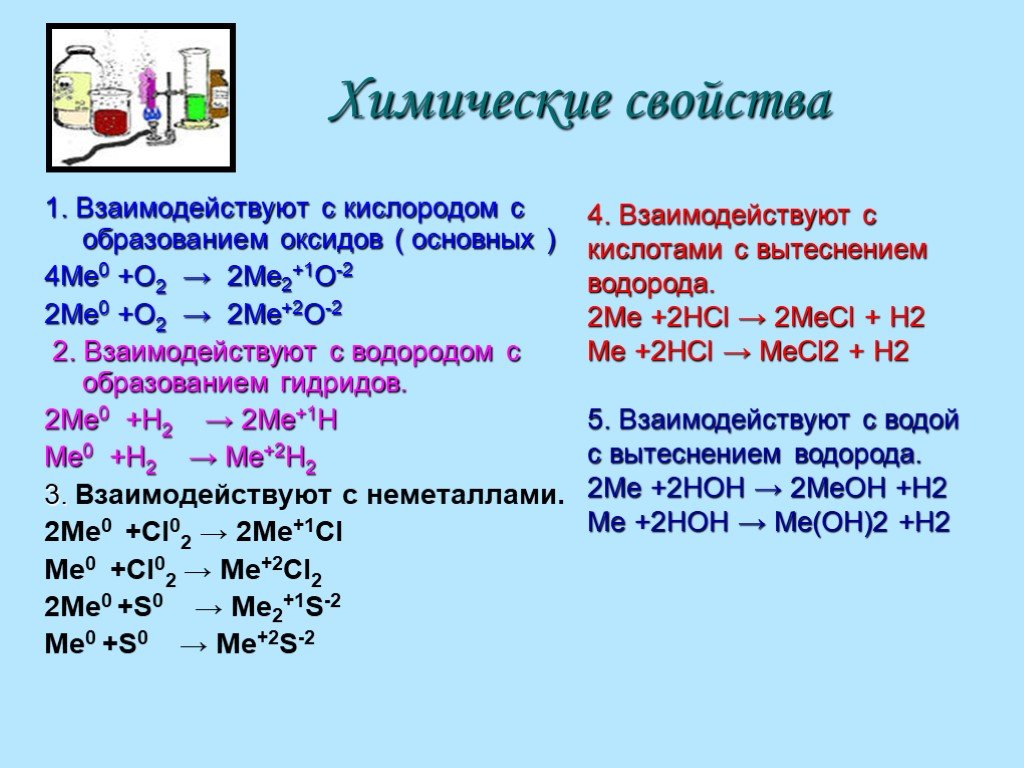
Водород горит в кислороде с выделением значительного количества теплоты:
2H2+O2=2H2O
Смесь водорода с кислородом (2 объема водорода и 1 объем кислорода) при поджигании сильно взрывается и поэтому носит название гремучего газа. При работе с водородом следует соблюдать правила техники безопасности.
В присутствии катализаторов газ может реагировать с азотом:
3H2+N2=2NH3
– по этой реакции при повышенных температурах и давлении в промышленности получают аммиак.
В условиях высокой температуры водород способен реагировать с серой, селеном, теллуром. а при взаимодействии с щелочными и щелочноземельными металлами происходит образование гидридов:
2Li+2H2=2LiH
– в данном случае водород играет роль окислителя.
Водород имеет особенность при повышении температуры восстанавливать оксиды многих металлов, в результате чего образуется вода. Например:
Например:
CuO+H2=H2O+Cu
– в данном процессе водород является восстановителем
Что мы узнали?
Водород – самый распространенный элемент в космосе. В учебной статье рассматриваются химические свойства водорода и взаимодействие с металлами этого газа. В нормальных условиях он способен реагировать с очень малым количеством металлов и неметаллов, а при измененных условиях вступает в реакции с азотом, серой, селеном, щелочными металлами, а также способен восстанавливать оксиды.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
10/10
Александр Котков
10/10
Сергей Ефремов
7/10
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 910.
А какая ваша оценка?
Урок 22. Химические свойства водорода – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 22 «Химические свойства водорода» из курса «Химия для чайников» узнаем с какими веществами реагирует водород; выясним, какими химическими свойствами обладает водород.
Водород вступает в химические реакции с простыми и сложными веществами. Однако при обычных условиях водород малоактивен. Для его взаимодействия с другими веществами необходимо создать условия: повысить температуру, применить катализатор и др.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода).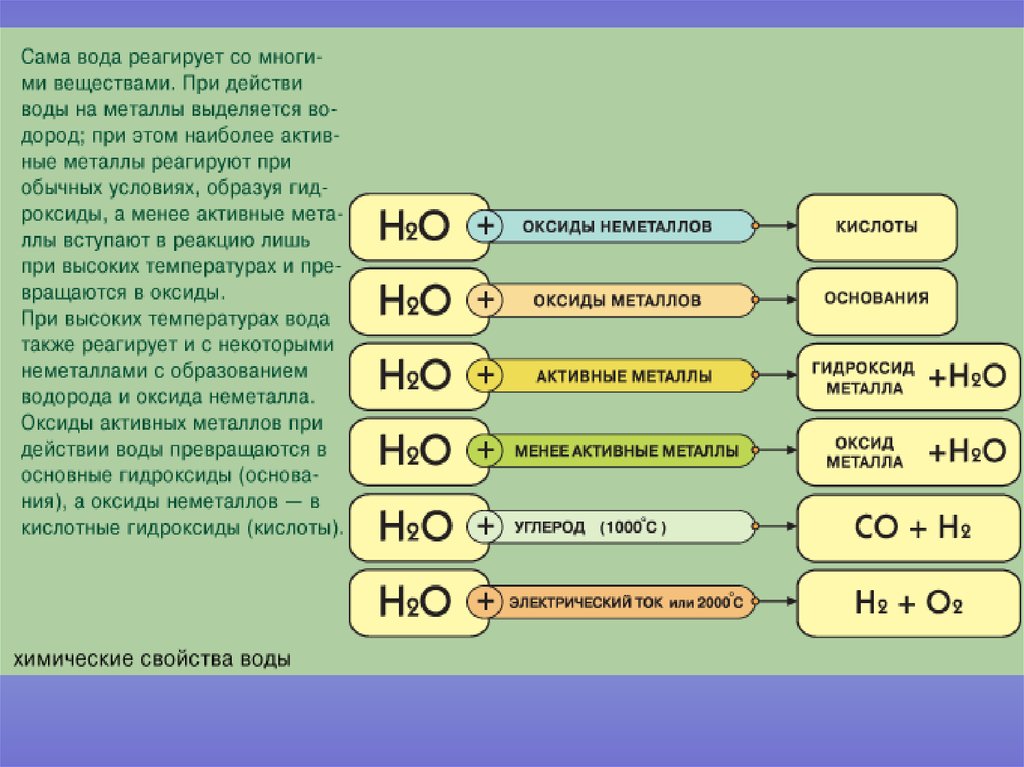 Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
На заметку: Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
Если струю водорода направить на расплавленную в пробирке серу, то у ее отверстия ощутится запах тухлых яиц. Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
На заметку: Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Реакции водорода со сложными веществами
Водород реагирует при повышенной температуре не только с простыми, но и со сложными веществами. Рассмотрим в качестве примера его реакцию с оксидом меди(II) CuO (рис. 96).
Пропустим водород над нагретым порошком оксида меди(II) CuO. По мере протекания реакции цвет порошка изменяется с черного на коричнево красный. Это цвет простого вещества меди Cu. В ходе реакции на холодных частях пробирки появляются капельки жидкости. Это еще один продукт реакции — вода H2O. Отметим, что в отличие от простого вещества меди вода — сложное вещество.
Уравнение реакции оксида меди(II) с водородом:
Водород в реакции с оксидом меди(II) проявляет способность отнимать у оксида металла кислород, тем самым восстанавливать металл из этого оксида. В результате происходит восстановление меди из сложного вещества CuO до металлической меди (Cu).
Реакции восстановления — это реакции, в ходе которых сложные вещества отдают атомы кислорода другим веществам.
Вещество, отнимающее атомы кислорода, называют восстановителем. В реакции с оксидом меди(II) восстановитель — водород. Так же реагирует водород и с оксидами некоторых других металлов, например PbO, HgO, MoO3, WO3 и др. Окисление и восстановление всегда взаимосвязаны между собой. Если одно вещество (Н2) окисляется, то другое (CuO) — восстанавливается, и наоборот.
Краткие выводы урока:
- При нагревании водород реагирует с кислородом, хлором, азотом, серой.
- Восстановление — это отдача атомов кислорода сложными веществами другим веществам.

- Процессы окисления и восстановления взаимосвязаны между собой.
Надеюсь урок 22 «Химические свойства водорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 23. Понятие о кислотах →
← Урок 21. Водород — самый лёгкий газ
Реакция алюминия с водородом и другими веществами
Похоже, вы зашли на наш сайт из Германия . Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Химические свойства наиболее распространенных металлов
Алюминий — активный металл, стабилен на воздухе и быстро окисляется при нормальной температуре, образуя плотную оксидную пленку, защищающую металл от дальнейшего повреждения.
[Депозитные фотографии]Взаимодействие алюминия с другими веществами
В обычных условиях вода не влияет на этот металл даже в кипящем состоянии. Если с поверхности алюминия снять защитную оксидную пленку, металл вступает в энергичное взаимодействие с водяным паром воздуха, превращаясь в рассыпчатую массу гидроксида алюминия с выделением водорода и тепла. Уравнение реакции:
Если с поверхности алюминия снять защитную оксидную пленку, металл вступает в энергичное взаимодействие с водяным паром воздуха, превращаясь в рассыпчатую массу гидроксида алюминия с выделением водорода и тепла. Уравнение реакции:
2Al + 6H₂O = 2Al(OH)₃ + 3H₂
Гидроксид алюминия [Википедия]Если с алюминия снять защитную оксидную пленку, металл вступает в бурное взаимодействие с кислородом. Алюминиевый порошок сгорает, образуя оксид. Уравнение реакции:
4Al + 3O₂ = 2Al₂O₃
Этот металл также активно взаимодействует со многими кислотами. В реакции с соляной кислотой наблюдается выделение водорода. Уравнение реакции:
2Al + 6HCl = 2AlCl3 + 3H₂
В обычных условиях концентрированная азотная кислота не взаимодействует с алюминием, так как азотная кислота, как сильный окислитель, делает оксидную пленку еще прочнее. По этой причине азотную кислоту хранят и транспортируют в алюминиевой таре.
По этой причине азотную кислоту хранят и транспортируют в алюминиевой таре.
Алюминий при обычной температуре пассивен к разбавленной азотной и концентрированной серной кислоте. В горячей серной кислоте металл растворяется, и уравнение реакции:
2Al + 4H₂SO4 = Al₂(SO4)₃ + S + 4H₂O
Взаимодействие алюминия с неметаллами
Реагирует с галогенами, серой, азот, углерод и все неметаллы. Для реакции требуется тепло, после чего происходит взаимодействие с выделением большого количества тепла.
Взаимодействие алюминия с водородом
Алюминий не реагирует напрямую с водородом, хотя существует твердое полимерное соединение алан, в котором существуют так называемые трехцентровые связи. При температуре свыше 100 градусов Цельсия алан необратимо распадается на простые вещества. Гидрид алюминия бурно реагирует с водой.
Алюминий не реагирует с водородом напрямую — металл образует соединения, отдавая электроны, которые получают другие элементы. Атом водорода не получает электронов, которые металлы отдают с образованием соединений — атомы водорода можно только «заставить» принять электроны с образованием твердых ионных соединений (гидридов) очень реакционноспособными металлами (калием, натрием, магнием, кальцием). Прямой синтез гидрида алюминия из водорода и алюминия требует огромного давления около 2 миллиардов атмосфер и температуры более 800 К. Здесь вы узнаете о химических свойствах других металлов.
Гидрид алюминия бурно реагирует с водой.
Алюминий не реагирует с водородом напрямую — металл образует соединения, отдавая электроны, которые получают другие элементы. Атом водорода не получает электронов, которые металлы отдают с образованием соединений — атомы водорода можно только «заставить» принять электроны с образованием твердых ионных соединений (гидридов) очень реакционноспособными металлами (калием, натрием, магнием, кальцием). Прямой синтез гидрида алюминия из водорода и алюминия требует огромного давления около 2 миллиардов атмосфер и температуры более 800 К. Здесь вы узнаете о химических свойствах других металлов.
Следует отметить, что водород является единственным газом, который значительно растворяется в алюминии и его сплавах. Растворимость водорода изменяется пропорционально величине температуры и квадратному корню из давления. Растворимость водорода в жидком алюминии значительно выше, чем в твердом алюминии; это свойство незначительно изменяется в зависимости от химического состава сплавов.
Алюминий и его водородная пористость
Алюминиевая пена [Викимедиа]Образование в алюминии пузырей водорода напрямую зависит от скорости охлаждения и закалки, а также наличия очагов образования выделения водорода — оксидов, попавших внутрь сплава. Чтобы алюминий стал пористым, содержание растворенного водорода должно значительно превышать растворимость водорода в твердом алюминии. Если нет центров образования выделения водорода, требуется относительно высокая концентрация вещества.
Расположение водорода в закаленном алюминии зависит от уровня его содержания в жидком алюминии и условий, в которых происходило закаливание. Поскольку водородная пористость является результатом механизмов образования и роста, контролируемых диффузией, такие процессы, как уменьшение концентрации водорода и увеличение скорости твердения, подавляют образование и рост пор.
Существуют различные источники поступления водорода в алюминий .
Плавильный материал — металлолом, слитки, литейные отходы, оксиды, песок и смазки, используемые при механической обработке. Эти загрязняющие вещества являются потенциальными источниками водорода, образующегося при химическом распаде водяного пара или восстановлении органических веществ.
Плавильные инструменты — скребки, пики и лопаты являются источником водорода. Оксиды и остатки флюсов на инструментах поглощают влагу из окружающего воздуха. Кирпичи для печей, распределительные каналы, ковши для отбора проб, желоба для извести и растворы цемента являются потенциальными источниками водорода.
Атмосфера печи — если плавильная печь работает на мазуте или природном газе, возможно неполное сгорание топлива с образованием свободного водорода.
Флюсы представляют собой гигроскопичные соли , способные мгновенно поглощать воду. По этой причине влажный флюс неизбежно добавляет водород в сплав, который образуется при химическом распаде воды.
Литейные формы — в процессе заполнения литейной формы жидкий алюминий течет турбулентно и захватывает воздух внутри себя. Если воздух не выйдет из формы до того, как алюминий начнет затвердевать, алюминий попадет в металл.
У нас есть для вас еще статьи по химии:
- Сухой лед: экстремальная заморозка Как заморозить что-нибудь без жидкого азота
- Курение тыквы на Хэллоуин Как сделать дым из тыквы
Вы можете провести десятки химических опытов дома!
Трансмутация
Узнать больше
Попробуй
реакции между металлами и водой или паром
Обратите внимание, что с магнием не происходит никакой реакции.
Что происходит с магнием, так это то, что небольшая начальная реакция покрывает его поверхность очень тонким слоем нерастворимого гидроксида магния, и это останавливает дальнейшее попадание воды на магний.
Если вы поместите небольшую, но очень чистую спираль магния в воду и оставите ее на полчаса или около того, на поверхности образуются пузырьки водорода, которые часто всплывают на поверхность магния.
Реакция магния с водяным паром
ОднакоМагний сгорает в паре с образованием оксида магния и водорода. При этих более высоких температурах вы получаете оксид магния, а не гидроксид магния. Это также относится к другим металлам, которые нам нужно будет вводить в реакцию с паром.
Следующий фрагмент видео показывает кипящую трубку со спиралью из магниевой ленты внутри. На дне трубки находится смоченный в воде комок минеральной ваты.
Магний нагревают до тех пор, пока он не начнет реагировать, а затем перемещают тепло для получения большого количества пара.
Реакции других металлов из ряда реактивности
Если они вообще собираются реагировать, эти металлы должны быть сильно нагреты в паре. В школьной лаборатории обычная единица оборудования:
.Металл сильно нагревается, тепло уходит обратно по трубке и превращает воду в минеральной вате в пар. Время от времени вы можете поместить бунзеновскую трубку обратно под минеральную вату на несколько секунд, чтобы увеличить поток пара.
Важно понимать, что просто появления нескольких пузырьков в собирающей трубке недостаточно, чтобы показать, что водород производится. Пар вытеснит весь воздух, который изначально был в трубке, в сборную трубку.
Это означает, что вы должны собрать почти полную пробирку газа, независимо от того, будет реакция или нет.
Но если вы соберете больше, чем пробирка газа, то должен быть произведен водород. И, конечно же, вы можете проверить это с помощью зажженной шины, когда она издаст небольшой щелчок.
В конце эксперимента необходимо вынуть подающую трубку из воды до того, как вы прекратите нагрев, иначе вы рискуете засосать холодную воду обратно в очень горячую трубку. Он треснет — иногда сильно!
Результаты
Можно было бы ожидать, что алюминий будет довольно реактивным, учитывая его положение в ряду реактивности, но это не так. Алюминий имеет очень тонкий, но очень прочный слой оксида алюминия на поверхности, что замедляет его реакции.
Даже если вы используете алюминиевый порошок, вы получите медленное производство водорода. Также образуется белый оксид алюминия.
2Al + 3H 2 O Al 2 O 3 + 3H 2
Цинк и Железо ведут себя именно так, как и следовало ожидать, давая хороший поток водорода.
Образуется оксид цинка, который имеет желтый цвет в горячем состоянии и белый при охлаждении.
Zn + H 2 O ZnO + H 2
Железо имеет три разных оксида, и тот, который образуется при пропускании над ним пара или при сжигании на воздухе, представляет собой черный оксид Fe 3 O 4 . Название описывает формулу триоксида железа — три железа и четыре кислорода.
3Fe + 4H 2 O Fe 3 O 4 + 4H 2
Свинец — еще один неудобный. Он находится чуть выше водорода в ряду реактивности, поэтому можно ожидать медленной реакции. По факту никакой реакции.
Технически он стоит выше водорода в ряду реактивности, но за исключением единственной реакции с концентрированной соляной кислотой, которую вы встретите на следующей странице в этой последовательности, для большинства целей вы можете считать свинец в ряду ниже водорода. .
На самом деле, большинство современных учебных программ вообще не включают свинец в ряд реактивности, чтобы избежать этой проблемы.


Leave A Comment