Пропан взаимодействует с кислородом в реакции горения при сварочных работах
Физико-технические особенности сварочных газов
Нефтеуглеводороды, в частности, пропан, бутан и их смеси, ацетилен, а также водород нашли широкое применение в различных сферах производства в качестве основных и вспомогательных соединений. Различные газы успешно используются как в качестве источников тепловой энергии, так и хладагентов. Одним из направлений их применения является сварочное дело и резка металла. Выбор газа в основном зависит от требуемой температуры сгорания.
Пропан и пропан-бутановые смеси
Углеводородные газы из группы алканов используются в тех случаях, когда нет необходимости в слишком высокой температуре газопламенной обработки: сварка тонкой стали и легкоплавких металлов, кислородная резка, пайка припоями и др. Пропан и бутан – это неядовитые и достаточно инертные газы, получаемые в качестве побочных продуктов при переработке нефти.
Чаще всего используются пропан-бутановые смеси в соотношении 3:7 соответственно. Они обладают повышенной теплотворной способностью, а тепловая мощь сгорания в кислороде эффективнее, чем у ацетилена, но из-за небольшой скорости, с которой распространяется пламя, температура пламени меньше. В случае утечки газы скапливаются внизу помещения и могут, что может привести к образованию взрывоопасных концентраций.
Ацетилен
Ацетилен относится к ненасыщенным углеводородам, чем обусловлена его химическая активность. Соединение вступает в многочисленные реакции присоединения, цикломеризации, димеризации, окисления. Отличается резким запахом. Температура сжижения около -82 °С. При его сгорании требуется больше кислорода, чем для пропана и бутана. Для ацетилена свойственна высокая интенсивность горения, которая снижается при наличии в нем побочных веществ.
Водород
В промышленности газ получают различными способами: железопаровым, электролизом, конверсией. В зависимости концентрация чистого вещества находится в пределах 95 – 99,8 об. %. Температура сжижения -252 °С. Используется при кислородной разделительной резке в присутствии воды, сварке свинца, безокислительной пайке стали.
Технические характеристики газов: сравнительная таблица
|
Параметр |
Пропан-бутановая смесь |
Ацетилен |
Водород |
|
Плотность при температуре 20 °С и давлении 0,1 МПа, кг/м3 |
|
1,091 |
0,084 |
|
Температура воспламенения в кислороде, °С |
500 |
240-630 |
510 |
|
Низшая теплотворная способность, кДж/м3 |
88800 |
52800 |
10800 |
|
Скорость распространения пламени в смеси с кислородом, м/с |
4,5 |
13,5 |
— |
Меры безопасности
В связи с большой взрывоопасностью сварочных газов предъявляются особые требования к условиям и помещениям проведения работ, хранению газовых баллонов.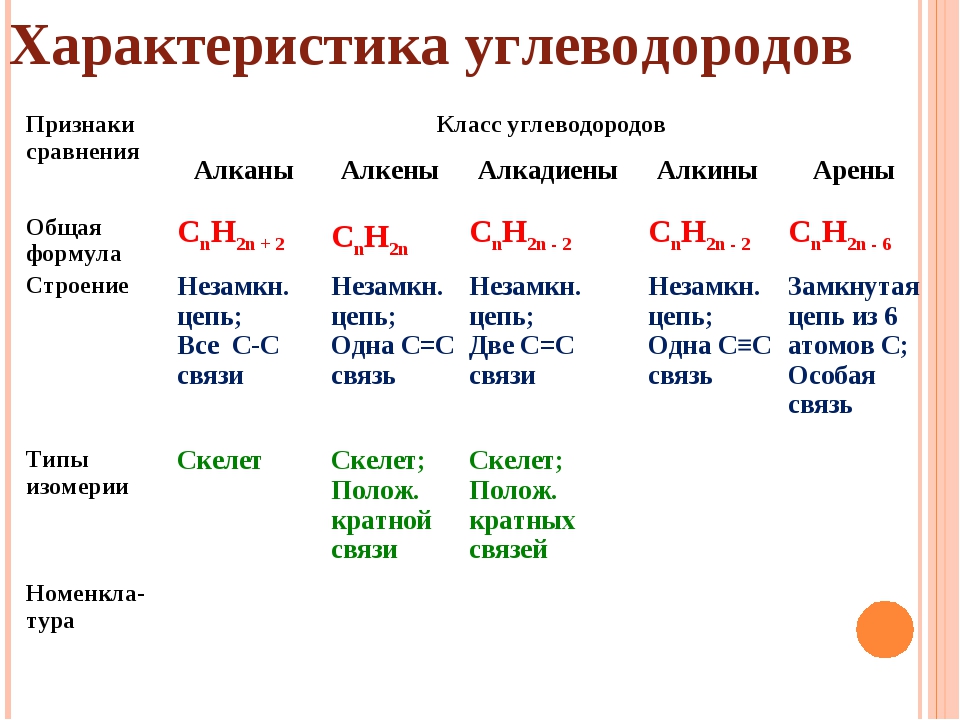 Особое внимание уделяется отсутствию источников возникновения пламени, искры, легковоспламеняющихся веществ. Помещения оборудуются специальными осветительными приборами, системами вентиляции и кондиционирования. Сварочные работы проводятся в присутствии более двух человек при обязательном оформлении наряда-допуска.
Особое внимание уделяется отсутствию источников возникновения пламени, искры, легковоспламеняющихся веществ. Помещения оборудуются специальными осветительными приборами, системами вентиляции и кондиционирования. Сварочные работы проводятся в присутствии более двух человек при обязательном оформлении наряда-допуска.
Каталог технических газов от нашей компании
Пропан: химические свойства, строение, получение, применение
Пропан — это органическое соединение, третий представитель алканов в гомологическом ряду. При комнатной температуре он представляет собой газ без цвета и запаха. Химическая формула пропана — C3H8. Пожаро- и взрывоопасен. Обладает небольшой токсичностью. Он оказывает слабое воздействие на нервную систему и обладает наркотическими свойствами. Строение Пропан — это предельный углеводород, состоящий из трех атомов углерода.
По этой причине он имеет изогнутую форму, но из-за постоянного вращения вокруг осей связей существует несколько молекулярных конформаций.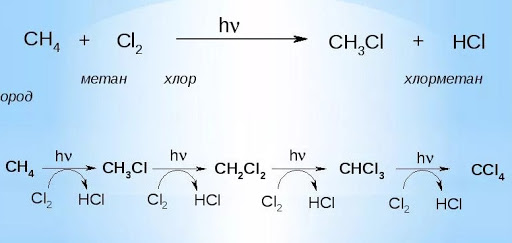
В промышленности пропан почти не синтезируют искусственно. Его выделяют из природного газа и нефти с помощью перегонки. Для этого существуют специальные производственные установки. В лаборатории пропан можно получить следующими химическими реакциями: Гидрирование пропена. Данная реакция идет только при повышении температуры и при наличии катализатора (Ni, Pt, Pd). Восстановление галогенидов алканов. Для разных галогенидов применяются разные реагенты и условия. Синтез Вюрца. Его суть в том, что две молекулы галогенаклкана связываются в одну, реагируя с щелочным металлом. Декарбоксилирование масляной кислоты и ее солей. Физические свойства пропана Как уже упоминалось, пропан — это газ без цвета и запаха. Он не растворяется в воде и других полярных растворителях.
Химические свойства пропана
Они представляют собой типичные свойства алканов. Каталитическое дегидрирование. Осуществляется при 575 °C с использованием катализатора оксида хрома (III) или оксида алюминия. Галогенирование. Для хлорирования и бромирования нужно ультрафиолетовое излучение или повышенная температура. Хлор преимущественно замещает крайний атом водорода, хотя в некоторых молекулах происходит замещение среднего. Повышение температуры может привести к увеличению доли выхода 2-хлорпропана. Хлорпропан может галогенироваться и дальше с образованием дихлорпропана, трихлорпропана и так далее. Механизм реакций галогенирования — цепной. Под действием света или высокой температуры молекула галогена распадается на радикалы. Они вступают во взаимодействие с пропаном, отнимая у него атом водорода.
Свойства алканов — урок. Химия, 8–9 класс.
Физические свойства алканов
С ростом числа атомов углерода в гомологическом ряду алканов возрастают:
- температуры кипения;
- температуры плавления;
- плотность.
Метан, этан, пропан и бутан представляют собой бесцветные газы, не имеющие запаха.
Пентан и следующие алканы — бесцветные

Алканы с большим числом атомов углерода (\(> 15\)) — твёрдые легкоплавкие вещества без запаха.
Все алканы практически не растворяются в воде.
Химические свойства алканов
1. Реакции замещения.
Алканы реагируют при освещении с галогенами (хлором и бромом). При этом постепенно происходит замещение атомов водорода в молекуле алкана на атомы галогена:
2. Реакции дегидрирования.
При нагревании все алканы способны разлагаться с отщеплением водорода:
3. Реакции разложения.
При сильном нагревании алканы разлагаются на уголь и водород:
4. Реакция горения.
Все алканы горят. При этом образуются углекислый газ и вода и выделяется большое количество тепла:
Нахождение в природе и применение алканов
Газообразные алканы (метан — бутан) входят в состав природного газа. Жидкие и твёрдые алканы содержатся в нефти.
Жидкие и твёрдые алканы содержатся в нефти.
Применение алканов основано на их свойствах.
Выделение большого количества теплоты позволяет использовать насыщенные углеводороды в качестве топлива.
Способность вступать в химические реакции даёт возможность применять алканы в качестве сырья для производства разнообразных органических веществ.
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 200 с.
этана, бутана, пропана, циклогексана, изобутана, гексана, метилциклогексана, метана, изопентана, гептана, октана и др.
Дегидрирование предельных углеводородов, принадлежащих к классу алканов, протекает при высоких температурах (до 650 °С) и в присутствии таких катализаторов, как платина, палладий, никель, железо, оксиды хрома, железа и цинка). Основными факторами, влияющими на дегидрирование алканов, являются длина цепи и температура процесса.
Дегидрирование этана, пропана и бутана протекает при температуре 500 °С в присутствии никелевого катализатора с образованием соответствующих алкенов – этена, пропена и бутена. Причем в случае дегидрирования бутана образуется смесь алкенов, состоящая из бутена-1 и бутена-2.
Если проводить дегидрирование бутана при температуре 500 — 650 °С на оксиде хрома, то можно получить бутадиен-1,3.
Одним из методов промышленного получения изобутилена – ценного сырья для нефтехимии, является дегидрирование изобутана. Процесс протекает на алюмохромовом катализаторе при температуре 550 — 600 °С.
Алканы, имеющие в своей цепи более 4-х атомов углерода, в процессе дегидрирования образуют устойчивые циклоалканы. Если в основной цепочке алкана имеется 6 и более атомов углерода (гексан, гептан, октан и т.д.), то при температуре 300 — 400 °С, платиновом катализаторе и, например, при наличии алкильных радикалов получаются только 6-членные циклы. Далее эти циклоалканы дегидрируются до более устойчивых соединений – аренов. Примером такой реакции является получение бензола из гексана.
Примером такой реакции является получение бензола из гексана.
В случае дегидрирования пентана и других алканов с пятью атомами углерода в основной цепочке образуются пятичленные циклы.
Помимо этого существует процесс дегидрирования метана по межмолекулярному механизму, который протекает при температуре 1500 °С и в качестве конечно продукта получается ацетилен.
Очень важным промышленным процессом дегидрирования является синтез мономера изопрена, из которого получают ценный изопреновый каучук. На первой стадии данного процесса происходит дегидрирование изопентана до изоамиленов при температуре 530 — 610 ºС в присутствии алюмохромового катализатора. Особенность первой стадии заключается в том, что дегидрирование осуществляется в кипящем слое катализатора, то есть когда частицы катализатора поддерживаются в парящем состоянии за счет восходящего потока воздуха. На второй стадии изоамилены дегидрируются на железокалиевом катализаторе при температуре 550 — 650 ºС в присутствии водяного пара.
Дегидрирование алкилароматических соединений
Каталитическое дегидрирование спиртов
Реакторы дегидрирования:
Что будет, если в колу добавить пропан
Этот эксперимент очень интересный и выглядит эффектно. Его следует осуществлять на улице подальше от огня и каких-либо строений. Хорошо подойдёт поляна перед лесом или берег какого-нибудь водоёма, но не пляж на котором полно людей. Необходимо приготовить за ранние средства защиты. В качестве, которых понадобятся прорезиненные перчатки для предотвращения обморожений, если вдруг газ попадет на руки и очки с защитными стёклами чтобы избежать травмы глаз. Для проведения эксперимента необходима литровая пластиковая бутылка с напитком кока-колы и пропан. Перед тем как смешивать эти два компонента, кока-колы немного отливают. Достаточно одного стакана для того чтобы освободилось место для пропана. Температура газировки выполняет не последнюю роль. А для более впечатляющего эффекта кока-кола должна быть хорошо нагретой.
И так что будет, если в колу добавить пропан? А произойдёт следующее, как только бутылку с напитком и добавленным пропанам перевернут, она вспениться и точно реактивный самолёт устремиться ввысь. При этом скорость будет просто реактивной. Как же образуется такая мощность?! Вся тайна заключается в физических процессах, а именно в низкой температуре закипания пропана. Пока сжиженный газ размещается на поверхности кока-колы, он закипает с меньшей силой. Доступ к смешиванию пропана и кока-колы не происходит за счёт термоизолирующей прослойки. Но только стоит перевернуть открытую бутылку, как происходит мгновенное перемешивание компонентов. Кока-кола в этот момент отдаёт всю свою положительную температуру пропану, а он, в свою очередь быстро распространившись, увеличивается в объёме сильнее, чем в пятьсот крат.
Взрывоопасный удар давления выталкивает кока-колу из пластиковой бутылки, и заставляет её двигаться с реактивной скоростью. На мощность взлёта бутылки оказывает влияние не только количество добавленного пропана, но и температура содержащиеся в ней газировки. Если же бутылка нагрета от 20 до 25 градусов по Цельсию она перемещается немного медленно, что делает процесс эксперимента практически безопасным для наблюдающего окружения. Но стоит подогреть кока-колу, как мощность полёта возрастает и в воздухе происходит взрыв.
Если же бутылка нагрета от 20 до 25 градусов по Цельсию она перемещается немного медленно, что делает процесс эксперимента практически безопасным для наблюдающего окружения. Но стоит подогреть кока-колу, как мощность полёта возрастает и в воздухе происходит взрыв.
Для достижения подобного эффекта и в целях экономии бюджета кока-колу можно заменить горячей водой. Газ для эксперимента можно позаимствовать из баллонов для заправки зажигалок, автомобиля, туристических горелок или использовать бытовой газовый баллон. Ни в коем случае нельзя наполнять пропаном стеклянную бутылку с кока-колой или водой, так как это может повлечь угрозу для жизни.
Урегулировать цены на газ пропан на АЗС
В последнее время наблюдается резкое повышение цены на газ пропан на АЗС по всей территории страны. А именно рост цен начался в 10-х числах июле и продолжается до настоящего времени. По состоянию на 04.07.2016 средняя цена на АЗС по Украине составляла 8,40 грн. а по состоянию на 11.07.2016 цена была уже 9,55 грн. По состоянию на 05.09.2016 цена уже составляет 11,76 грн. ( Динамика цен на газ ).
а по состоянию на 11.07.2016 цена была уже 9,55 грн. По состоянию на 05.09.2016 цена уже составляет 11,76 грн. ( Динамика цен на газ ).
Как видно рост розничной цены на газ пропан на АЗС составил 40%. Как известно в большой степени цену на газ формирует это стоимость нефти на мировом рынке и курс доллара к гривне. Если проанализировать изменение динамику цены на нефть то в период с 10.07.2016 по 05.09.2016. Можно увидеть, что на начало периода, а именно по состоянию на 11.07.2016 стоимость была 48,35$ за баррель, на конец периода на 07.09.2016 цена составила 47,83$ за баррель. Максимальная цена нефть составила 50,74$ по состоянию на 19.08.2016. А минимальная цена составила 41,88$ по состоянию на 02.08.2016. Как видно, что динамика цен не могла способствовать удержанию газа на 40 % на АЗС Украины. (Динамика цены на нефть )
Рассмотрим изменение курса доллара к гривне за аналогичный период. По состоянию на 11.07.2016 курс доллара/гривне составил 24,85. По состоянию на 07. 09.2015 курс доллара/гривне составил 26,80 грн. Т.е можно увидеть , что гривна девальвировала на 1,95 грн, т.е девальвация составила около 8%.
09.2015 курс доллара/гривне составил 26,80 грн. Т.е можно увидеть , что гривна девальвировала на 1,95 грн, т.е девальвация составила около 8%.
По состоянию на 04.07.2016. Цена на газ составляла 8,40 грн на АЗС при курсе доллара к гривне 24,85 . (Динамика курс $/гривне )
Посчитаем стоимость 1 л газа на АЗС в долларовом эквиваленте, 8,4/24,85=0,34, т.е цена составила цента.
Так как существенного изменения цены на нефть в период с 11.07.2016 по 07.09.2016 не было, берем во внимание изменения курса доллара к гривне и просчитаем экономически обоснованную стоимость на сегодняшний день. 0,34 $* 26.8= 9,11 грн за 1 л газа.
Для аналогии можно проанализировать цены на бензин на АЗС Украины (цены на бензин на АЗС ).
В связи с вышеперечисленным возникает вопрос по какой причине цены на ГАЗ ПРОПАН НА АЗС в несколько раз превышают экономически обоснованных, и почему не реагирует антимонопольный комитет и другие контролирующие органы, так как монопольный сговор виден на лицо, так как если данные органы не контролируют цены, то возникает резонный вопрос функционирование данных органов за счет бюджетных средств уплаченных налогоплательщиками Украины.
В связи с этим прошу в кратчайшие сроки разобраться в сложившейся ситуацией, и принять необходимые меры для приведение цен к экономически обоснованным.
P.S. А так при каждодневным посещение АЗС при виде новых цен, складывается впечатление, что государство хочет залезть мне в карман.
Пропан-бутановая смесь
Пропан-бутановая смесь
Описание:
Заправка газгольдера в Московской области
Системы автономной газификации – экономически выгодное капиталовложение, позволяющее полностью решить пробелы с газоснабжением дома там, где проведение газа невозможно. Использование сжиженного пропана для обогрева дома в несколько раз выгоднее, нежели пользование отопительным электрооборудованием. Для эффективной эксплуатации автономной системы требуется регулярная заправка газгольдера жидким топливом, которое преобразуется в газ (доставка и заправка занимает некоторое время, поэтому важно контролировать уровень наполненности емкости).
Компания ООО «ДИАР» предлагает услуги по заправке систем автономной газификации пропаном техническим и пропан-бутановой смесью. Также мы производим такие услуги, как заправка и доставка газа (Московская область и Москва).
В зависимости от объема газгольдера, а также расхода топлива, резервуар потребуется заправить от 1 до 3 раз в году. Как правило, одной заправки хватает на 2-6 месяцев беспрерывного пользования зимой. Если вы решили воспользоваться услугой заправки газгольдеров, стоимость должна включать не только заправочные работы и цену сжиженного газа, но и транспортировку.
Выгодное сотрудничество
Торговый дом «ДИАР» нацелен на честное и долговременное сотрудничество. Заправка газгольдера на даче или промышленном объекте в Московской области производится по цене, включающую стоимость газа, транспортировки и закачки. Стоит отметить, что мы работаем по всей области и близлежащим областям вне зависимости от транспортной доступности. Наша техника проедет до любых труднодоступных мест и доплаты «за неудобства» мы не требуем.
При выборе исполнителя, поставляющего заправку газом газгольдера (цыстерны СУГ), цена вопроса является одним из основных критериев. Мы обладаем собственной базой для распределения СУГ, поэтому можем предложить лучшую стоимость на сжиженый газ в Москве и Московской области.
Помимо приемлемо низкой цены, сотрудничество с нашей компанией предполагает ряд преимуществ:
Мы готовы привезти СУГ в любую точку Москвы и области, вне зависимости от качества дорожного покрытия.
- Заправка газгольдеров сжиженным газом выполняется со строгим контролем литража. Наши машины оборудованы счетчиками, позволяющими точно определить объем пропана.
- Клиент может выбрать газ на собственное усмотрение: пропан технический или пропан-бутановую смесь.
- Чтобы доставить топливо на дом нам потребуется не более 24 часов. Все заявки без исключения выполняются за 1 день.
При этом стоимость заправки газгольдера в Московской облати зависит от текущей цены пропана (ПТ или СПБТ) и расстояния до заправляемого объекта. Рассчитать точную стоимость заправки СУГ и предоставляемых услуг (с учетом цены транспортировки) помогут наши менеджеры. Просто позвоните нам по номерам указанным выше и сообщите адрес доставки и необходимое количество пропана СУГ. Мы посчитаем цену транспортировки и сообщим Вам.
Рассчитать точную стоимость заправки СУГ и предоставляемых услуг (с учетом цены транспортировки) помогут наши менеджеры. Просто позвоните нам по номерам указанным выше и сообщите адрес доставки и необходимое количество пропана СУГ. Мы посчитаем цену транспортировки и сообщим Вам.
Где еще используют пропан, конечно на АГЗС, для заправки автомобилей оборудованных ГБО.
Смесь Пропана и бутана (liquefied petroleum gas — LPG), чаще всего именуемая автолюбителями «пропан» или «газ» это не только дешевая, но и, на сегодняшний день, наименее загрязняющая экологию Земли версия топлива. По данным многочисленных исследований, при сгорании смеси СПБТ выделяется меньшее, чем при применении дизельного топлива или бензина количество углекислого газа, вызывающего парниковый эффект. Кроме того, в продуктах сгорания обнаружилось намного меньше вредных веществ, чем в таких же отходах традиционного топлива.
Хорошее соотношение цены и качества, а также тот момент, что фальсифицировать такое топливо труднее, чем другие виды топлива, делает его достаточно привлекательным для автомобилистов.
Идея использования смеси пропана и бутана как топлива была предложена еще в 1911 году. Изобретатель – ученый Вальтер Снеллинг предложил сжижать и использовать в качестве топлива летучую фракцию природного газа, которую до этого, чтобы не создавать в баллонах опасного повышенного давления. Ее просто испаряли, выпуская непосредственно в атмосферу.
Постановление о газификации автотранспорта в СССР вышло еще в 1936 году, но до восьмидесятых годов двадцатого века, машин передвигавшихся с помощью такого топлива было относительно мало. В это время такое топливо стали применять не только для автомобилей, но и для других видов транспорта. Начиная с девяностых годов и по сегодняшний день, применение сжиженного газа для автомобилей продолжает набирать обороты.
Производство автомобилей, работающих только на газе, относительно невелико. В большинстве случаев пропан применяется в машинах оснащенных сразу двумя топливными системами. Как и для других видов топлива, для газового топлива существуют зимние и летние варианты смесей.
Газовое оборудование в автомобиле работает по относительно несложной схеме. Сжиженный газ хранится в баллоне. При этом над жидкой фракцией постоянно находится «подушка» из газообразного вещества. При открытии вентиля, газ под давлением выходит из баллона и попадает в редуктор. Система мембранных клапанов служит для снижения его давления. Далее газ поступает в смеситель, где происходит смешение его с воздухом, после чего получившаяся смесь направляется в двигатель.
Пропан-бутан — относительно бензина и дизеля дешевое топливо. Для того чтобы пользоваться им, необходимо установить в автомобиле специальную газобаллонную систему для использования сжиженного газа. При этом чаще всего, не убирается бензиновая система питания. Это оборудование, позволяет переключаться с газа на бензин, не выходя из салона автомобиля, что повышает безотказность автомобиля в пути.
Такое топливо характеризуется даже более высоким, чем у бензина октановым числом. Это повышает его антидетонационную стойкость. То есть опасаться, что газ будет более взрывоопасным топливом, чем другие виды топлива, не приходится. При применении пропана шатунно-поршневая группа меньше изнашивается. По свидетельству автолюбителей, на пропане двигатель работает лучше, более плавно реагирует на нажатие педали акселератора.
То есть опасаться, что газ будет более взрывоопасным топливом, чем другие виды топлива, не приходится. При применении пропана шатунно-поршневая группа меньше изнашивается. По свидетельству автолюбителей, на пропане двигатель работает лучше, более плавно реагирует на нажатие педали акселератора.
Газ, заправляемый в автомобили, обладает достаточной чистотой. В нем практически нет примесей, а значит, он сгорает весь. Это значит, что на поршнях, свечах и клапанах не будет образовываться нагар. Попадая в цилиндр только в газообразной фазе, пропан не смывает с его стенок масло.
Используя газовую смесь можно увеличить дальность пробега машины без дополнительных дозаправок. Специальная емкость, равная объемом стандартному бензобаку, заполненная сжиженной газовой смесью, обеспечит вдвое большую дальность хода автомобиля, чем полный бак бензина.
При применении смеси пропан и бутана (СПБТ) в качестве топлива намного меньше страдает экология, чем при использовании бензина или дизельного топлива. При их сгорании в атмосферу выделяются меньшее количество токсичных веществ. В отличие от этилированного бензина такая газовая смесь не содержит вредного для человеческого организма свинца.
Из недостатков можно отметить:
— финансовую составляющую (25-35 тыс. руб в среднем), но если Вы много катаетесь, то они быстро у Вас окупятся;
— небольшую потерю мощности двигателя;
— баллон занимает определенное место;
— ну и естественно «время», согласно новым законам установку ГБО, как и внесение любых других изменений в конструкцию автомобиля необходимо регистрировать в ГИБДД, без этот Вы не поставите авто на учет, за это предусмотренны штрафы. Придется немного побегать, минимум 3 раза, но это совсем не сложно, от Вас лишь требуеться взять документы в одном месте и отнести их в другое)) .
Для того что бы оформить ГБО на автомобиль необходимо (коротко и понятно):
1. Выбираем сервис по установке ГБО (обязательно аккредитованную организацию), где будем производить установку газа на авто, едем туда и берем «Заключение предварительной экспертизы» — (предварительно что то оплачиваем, у всех разные условия), на то что на Ваш автомобиль можно ставить ГБО и он для этого предназначен.
2. Едем первый раз в ГИБДД на первичный осмотр автомобиля (графики приема в ГАИ, лучше уточнить заранее, нужны все документы на авто и их копии, а так же «заключение ПЭ» из сервиса), там заполняете заявление, инспектор Фоткает Ваш авто, подписывает документы и отправляет Вас на установку.
3. Ставим ГБО на автомобиль (т.е. вносим изменения в конструкцию автомобиля)!
4. Заново проходим тех. осмотр (делаем диагностическую карту) на автомобиль! (в ГИБДД лучше узнать где пройти, чтоб потом не было вопросов, некоторым принципиален тот или иной сервис, ну Вы понимаете о чем мы)).
5. После прохождения ТО Звоним заранее и Снова едем в сервис, где ставили газ, они должны приготовить Вам еще один пакет документов (протокол проверки безопасности конструкции ТС).
6. Едем второй раз на повторный осмотр в то же самое ГИБДД, оплачиваем госпошлину, подписываем там бумаги и тд., инспектор сново фоткает авто.
7. Перерыв — Ждем от ГИБДД (30-45 дней) «свидетельство о переоборудовании автомобиля».
8. Едем третий раз в ГИБДД забираем «свидетельство о переоборудовании» и если располагаете временем, то в этот же день вносим изменения в ПТС, получаем новое СТС (платим госпошлину за новые документы на машину).
Все просто, удачи Вам на дорогах!!!
Молекула гексана
Для просмотра молекулы пропана в 3D — >> в 3D с Jsmol
Химические и физические свойства молекулы пропана
А трехуглеродный алкан, пропан иногда полученные из других нефтепродуктов в процессе добычи нефти или природного переработка газа. Пропан имеет химическое Формула: C 3 H 8
Когда обычно продается как топливо, он также известен как сжиженная нефть газ (сжиженный нефтяной газ или сжиженный нефтяной газ) и представляет собой смесь пропана с меньшими количества пропилена, бутана и бутилена, плюс одорант этилмеркаптана, чтобы позволить обычно без запаха пропан нужно нюхать.Он используется в качестве топлива при приготовлении пищи на многих барбекю и переносные печи и в автотранспортных средствах. Пропан питает некоторые автобусы, погрузчики и такси и используется для обогрева и приготовление пищи в транспортных средствах для отдыха и в кемпингах. Во многих в сельских районах США пропан также используется в печах, водопроводных обогреватели, сушилки для белья и другие тепловыделяющие устройства. Грузовики наполняют большие резервуары, которые установлены на постоянной основе. на имущество (иногда свиней называют ) или обмен бутылки с пропаном.
Свойства и реакции
Пропан претерпевает реакции горения аналогичным образом. к другим алканам. При избытке кислорода пропан ожоги с образованием воды и углекислого газа.
- C 3 H 8 + 5 O 2 â † ’3 CO 2 + 4 H 2 O + тепло
Когда кислорода недостаточно для полного сгорания, пропан горит с образованием воды и углерода монооксид.
- 2 C 3 H 8 + 7 O 2 â † ’6C O + 8 H 2 O + тепло
В отличие от природного газа, пропан тяжелее воздуха (в 1,5 раза плотнее). В неочищенном состоянии пропан сливается и образует лужи на этаж. Жидкий пропан превратится в пар при атмосферном давлении. давление и выглядит белым из-за конденсации влаги из воздух.
При правильном сгорании пропан производит около 2500 БТЕ. на кубический фут газа (91 600 БТЕ на галлон жидкости).В общая теплота сгорания одного нормального кубометра пропана составляет около 50 мегаджоулей (â ‰ ˆ13,8 кВтч) или 101 МДж / м3 в единицах СИ.
Пропан нетоксичен; однако при злоупотреблении в качестве ингалянта он представляет собой умеренный риск удушья из-за кислородного голодания. Также необходимо отметить, что товарный продукт содержит углеводороды. помимо пропана, что может увеличить риск. Пропан и его смеси может вызвать легкое обморожение при быстром расширении.
Пропан сгорает намного чище, чем бензин. не такой чистый, как природный газ. Наличие связей C-C, плюс кратные связи пропилена и бутилена создают органические выхлопы помимо углекислого газа и водяного пара во время типичного горение. Эти связи также вызывают горение пропана с видимое пламя.
См. Также:
Список литературы
1-молекула пропана — PubChem
Центр обработки данных по двум альтернативным видам топлива — Пропан
Пропан (C3H8)
Пропан представляет собой трехуглеродный алкан, обычно газ, но сжимаемый до переносимой жидкости.Его получают из других нефтепродуктов при переработке нефти или природного газа. Он обычно используется в качестве топлива для двигателей, газовых горелок, барбекю, переносных печей и центрального отопления жилых домов.
При использовании в качестве автомобильного топлива он обычно известен как сжиженный нефтяной газ (LPG или LP-газ), который может представлять собой смесь пропана с небольшими количествами пропилена, бутана и бутилена. Также добавляется одорант этантиол, чтобы люди могли легко почувствовать запах газа в случае утечки.
ЭтимологияЕго название произошло от части пропионовой кислоты (которая также имеет 3 атома углерода) и суффикса -ane.
Свойства и реакции
Пропан вступает в реакции горения аналогично другим алканам. В присутствии избытка кислорода пропан горит с образованием воды и диоксида углерода.
- C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O + тепло
Пропан + Кислород → Двуокись углерода + Вода
Когда кислорода недостаточно для полного сгорания, происходит неполное сгорание, когда пропан горит и образует воду, монооксид углерода, диоксид углерода и углерод.
- C 3 H 8 + 3,5 O 2 → CO 2 + CO + C + 4 H 2 O + тепло
Пропан + Кислород → Двуокись углерода + Окись углерода + Углерод + Вода
В отличие от природного газа, пропан тяжелее воздуха (в 1,5 раза плотнее). В сыром виде пропан сливается и образует лужи на полу. Жидкий пропан превращается в пар при атмосферном давлении и становится белым из-за конденсации влаги из воздуха.
При правильном сгорании пропан производит около 50 МДж / кг.Общая теплота сгорания одного нормального кубического метра пропана составляет около 91 мегаджоуля
Пропан нетоксичен; однако при злоупотреблении в качестве ингалянта он создает умеренный риск удушья из-за кислородного голодания. Коммерческие продукты содержат углеводороды помимо пропана, что может увеличить риск. Обычно хранящийся под давлением при комнатной температуре, пропан и его смеси расширяются и охлаждаются при высвобождении и могут вызвать легкое обморожение.
Сжигание пропана намного чище, чем сгорание бензина, но не так чисто, как сгорание природного газа.Присутствие связей C-C, а также множественные связи пропилена и бутилена создают органические выхлопы помимо диоксида углерода и водяного пара во время обычного горения. Эти связи также вызывают горение пропана с видимым пламенем.
Коэффициенты выбросов парниковых газов для пропана составляют 62,7 кг CO 2 / mBTU или 1,55 кг CO 2 на литр или 73,7 кг / ГДж.
В отличие от природного газа, пропан тяжелее воздуха (в 1,5 раза плотнее). В сыром виде пропан сливается и образует лужи на полу.Жидкий пропан превращается в пар при атмосферном давлении и становится белым из-за конденсации влаги из воздуха.
При правильном сгорании пропан производит около 50 МДж / кг. Общая теплота сгорания одного нормального кубического метра пропана составляет около 91 мегаджоуля
Пропан нетоксичен; однако при злоупотреблении в качестве ингалянта он создает умеренный риск удушья из-за кислородного голодания. Коммерческие продукты содержат углеводороды помимо пропана, что может увеличить риск. Обычно хранящийся под давлением при комнатной температуре, пропан и его смеси расширяются и охлаждаются при высвобождении и могут вызвать легкое обморожение.
Сжигание пропана намного чище, чем сгорание бензина, но не так чисто, как сгорание природного газа. Присутствие связей C-C, а также множественные связи пропилена и бутилена создают органические выхлопы помимо диоксида углерода и водяного пара во время обычного горения. Эти связи также вызывают горение пропана с видимым пламенем.
Коэффициенты выбросов парниковых газов для пропана составляют 62,7 кг CO 2 / mBTU или 1,55 кг CO 2 на литр или 73,7 кг / ГДж.
ИспользуетПропан используется в качестве топлива для приготовления пищи на многих барбекю, переносных печах и в автомобилях. Вездесущий стальной контейнер объемом 4,73 галлона (20 фунтов) часто называют «баком для барбекю». Пропан остается популярным выбором для барбекю и переносных печей, потому что его низкая температура кипения -42 ° C (-43,6 F) заставляет его испаряться, как только он выходит из контейнера под давлением. Следовательно, карбюратор или другое испарительное устройство не требуется; простая дозирующая форсунка.Пропан используется в некоторых локомотивах, автобусах, вилочных погрузчиках, такси и машинах для обработки льда, а также используется для обогрева и приготовления пищи в транспортных средствах для отдыха и кемпингах. Во многих сельских районах Северной Америки пропан используется в печах, кухонных плитах, водонагревателях, сушилках для стирки и других устройствах, вырабатывающих тепло. В этом случае он обычно хранится в большом стационарном баллоне, который перезаряжается грузовиком для доставки пропана. По состоянию на 2000 год 6,9 миллиона американских домохозяйств использовали пропан в качестве основного топлива для отопления.
Коммерчески доступное «пропановое» топливо или СНГ не является чистым. Обычно в США и Канаде это в основном пропан (не менее 90%), остальное — в основном бутан и пропилен (максимум 5%), а также отдушки. Это стандарт HD-5 (Heavy Duty — максимальное допустимое содержание пропилена 5%), разработанный для двигателей внутреннего сгорания. LPG при извлечении из природного газа не содержит пропилена. LPG, очищенный от сырой нефти, действительно содержит пропилен. Не все продукты с маркировкой «пропан» соответствуют этому стандарту.В Мексике, например, содержание бутана намного выше.
Топливо бытовое и промышленное
В Северной Америке местные грузовики для доставки, называемые «бобтейлами», со средним размером резервуара 3000 галлонов, заполняют большие резервуары (иногда называемые свиней ), которые постоянно установлены на территории, или другие служебные грузовики меняют пустые баллоны пропана на заполненные баллоны. Большие тягачи с прицепом, называемые «грузовыми лайнерами», со средним объемом цистерны 10 000 галлонов, транспортируют пропан от трубопровода или нефтеперерабатывающего завода до местного завода по доставке.Бобтейл и транспорт не являются уникальными для североамериканского рынка, хотя такая практика не так распространена в других местах, и транспортные средства обычно называются танкерами . Во многих странах пропан доставляется потребителям через небольшие или средние индивидуальные резервуары.
Использование пропана быстро растет в непромышленных регионах мира. Пропан заменяет древесину и другие традиционные источники топлива в таких местах, где его теперь иногда называют «кухонным газом». Североамериканские грили-барбекю, работающие на пропане, нельзя использовать за границей.«Пропан», продаваемый за границей, на самом деле представляет собой смесь пропана и бутана. Чем теплее страна, тем выше содержание бутана, обычно 50/50, а иногда и 75% бутана. Использование калибровано для форсунок разного размера, имеющихся в грилях за пределами США. Американцы, которые везут свои грили за границу, например, военнослужащие, могут найти пропан, соответствующий требованиям США, на военных почтовых биржах AAFES.
Отрасли промышленности Северной Америки, использующие пропан, включают производство стекла, печи для обжига кирпича, птицефабрики и другие отрасли, которым требуется переносное тепло.
Холодильное оборудование
Пропан также играет важную роль в обеспечении автономного охлаждения, обычно с помощью газоабсорбционного холодильника.
Смеси чистого, сухого «изопропана» (R-290a) (коммерческий термин, используемый для описания смесей изобутан / пропан) и изобутана (R-600a) имеют незначительный озоноразрушающий потенциал и очень низкий потенциал глобального потепления и могут служить функциональной заменой R -12, R-22, R-134a и другие хлорфторуглеродные или гидрофторуглеродные хладагенты в обычных стационарных системах охлаждения и кондиционирования воздуха.
В автотранспортных средствахТакая замена широко запрещена или не рекомендуется в автомобильных системах кондиционирования воздуха на том основании, что использование горючих углеводородов в системах, изначально предназначенных для перевозки негорючего хладагента, представляет значительный риск пожара или взрыва.
Продавцы и сторонники углеводородных хладагентов выступают против таких запретов на том основании, что таких инцидентов было очень мало по сравнению с количеством автомобильных систем кондиционирования воздуха, заполненных углеводородами.Одно конкретное испытание было проведено профессором Университета Нового Южного Уэльса, который непреднамеренно проверил наихудший сценарий внезапной и полной утечки хладагента в пассажирский салон с последующим возгоранием. Он и еще несколько человек в машине получили ожоги лица, ушей и рук, а несколько наблюдателей получили порезы от разбитого стекла окна переднего пассажира.
Топливо автомобильное
Пропан также все чаще используется в качестве автомобильного топлива.В США 190 000 дорожных транспортных средств используют пропан, а 450 000 вилочных погрузчиков используют его в качестве источника энергии. Это третье по популярности автомобильное топливо в Америке после бензина и дизельного топлива. В других частях света пропан, используемый в транспортных средствах, известен как автогаз. Около 9 миллионов автомобилей по всему миру используют автогаз.
Преимущество пропана — его жидкое состояние при умеренном давлении. Это обеспечивает быструю заправку, доступную конструкцию топливного бака и диапазон, сопоставимый с бензином (хотя и меньший).Между тем, он заметно чище (как при обращении, так и при сгорании), приводит к меньшему износу двигателя (из-за отложений углерода) без разбавления моторного масла (часто с увеличенными интервалами замены масла), и до недавнего времени это было относительно выгодной сделкой в Северной Америке. Октановое число заметно выше 110. Однако общественные заправочные станции все еще редки. Многие переделанные автомобили имеют приспособления для доливки из «бутылок для барбекю». Специализированные автомобили часто входят в состав коммерческих автопарков и имеют частные заправочные станции.
Пропан обычно хранится и транспортируется в стальных баллонах в виде жидкости с паровым пространством над жидкостью. Давление пара в цилиндре зависит от температуры. Когда газообразный пропан всасывается с высокой скоростью, скрытая теплота испарения, необходимая для создания газа, вызывает охлаждение баллона. (Вот почему вода часто конденсируется на стенках бутылки, а затем замерзает). В крайних случаях это может вызвать такое сильное снижение давления, что процесс больше не будет поддерживаться.Кроме того, легкие высокооктановые соединения испаряются раньше, чем более тяжелые, низкооктановые. Таким образом, свойства воспламенения изменяются по мере опорожнения бака. По этим причинам жидкость часто отбирают с помощью погружной трубки.
Прочие
- Пропан используется в качестве сырья для производства основных нефтехимических продуктов при паровом крекинге.
- Пропан используется в некоторых огнеметах в качестве топлива или сжатого газа.
- Некоторое количество пропана становится сырьем для пропилового спирта, обычного растворителя.
- Пропан — основное топливо для воздушных шаров.
- Используется в производстве полупроводников для осаждения карбида кремния.
- Пропан смешивается с силиконом с образованием пропеллента (продается как зеленый газ), который используется для питания газового оружия, используемого в боевых играх страйкбола.
- Жидкий пропан обычно используется в тематических парках и в киноиндустрии в качестве недорогого высокоэнергетического топлива для взрывов и других особых эффектов.
Пропан тяжелее воздуха.Если произойдет утечка в системе пропанового топлива, газ будет иметь тенденцию просачиваться в любое закрытое пространство и, таким образом, представляет опасность взрыва и возгорания. Типичный сценарий — протекающий баллон, хранящийся в подвале; Утечка пропана дрейфует по полу к контрольной лампе печи или водонагревателя и приводит к взрыву или пожару.
Пропан покупается и хранится в жидкой форме (СНГ), поэтому энергия топлива может храниться в относительно небольшом пространстве. Сжатый природный газ (СПГ), в основном метан, является еще одним газом, используемым в качестве топлива, но его нельзя сжижать путем сжатия при нормальных температурах (которые намного выше критической температуры метана, и поэтому для хранения требуется очень высокое давление (что создает опасность того, что в случае аварии баллон для сжатого природного газа может взорваться с большой силой или протечь достаточно быстро, чтобы превратиться в самоходную ракету).Следовательно, СПГ гораздо менее эффективно хранить из-за необходимого большого объема резервуара. Таким образом, пропан гораздо чаще используется в качестве топлива для транспортных средств, чем природный газ, и ему требуется всего 1220 килопаскалей (177 фунтов на квадратный дюйм) давления, чтобы поддерживать его в жидком состоянии при температуре 37,8 ° C (100 F).
Измерение остатка пропанового бакаУровень жидкости в баллоне с пропаном можно измерить с помощью внутреннего магнитного «поплавка». Затем внешний датчик может определить местоположение поплавка в баке. Эта система с магнитным поплавком не может точно измерить общее количество пропана, поскольку газообразная часть пропана внутри резервуара не учитывается при измерении.
Самый точный способ измерить количество пропана, оставшегося в пропановом баллоне, — это взвесить его. На боковой стороне резервуара должны быть выбиты буквы TW, за которыми следует номер. Это число представляет собой вес пустого бака в фунтах или его собственный вес. Типичный 5-галлонный баллон с пропаном может иметь собственный вес 10 фунтов. Если этот резервуар весил 20 фунтов, это означает, что в резервуаре хранится 10 фунтов пропана
Галлон пропана содержит 91 690 БТЕ. Умножение этого числа на количество галлонов в резервуаре дает 152 205 БТЕ тепловой энергии (1.66 91 690 = 152 205).
Затем можно рассчитать время работы конкретного прибора, если известно потребление прибора в БТЕ. Это число, выраженное в БТЕ в час, обычно можно найти на приборе или у производителя. Продолжая этот пример, устройство, потребляющее 12 000 БТЕ в час, обеспечит 12,68 часа работы (152 205 12 000 ≈ 12,68).
ИсточникиПропан производится как побочный продукт двух других процессов: переработки природного газа и нефтепереработки.
Обработка природного газа включает удаление бутана, пропана и больших количеств этана из сырого газа для предотвращения конденсации этих летучих веществ в трубопроводах природного газа. Кроме того, нефтеперерабатывающие заводы производят пропан как побочный продукт при крекинге нефти в бензин или топочный мазут.
Предложение пропана не может быть легко скорректировано с учетом возросшего спроса из-за побочного продукта производства пропана. Около 90% пропана в США производится внутри страны.
Соединенные Штаты импортируют около 10% пропана, потребляемого ежегодно, из которых около 70% поступает из Канады по трубопроводам и железной дороге. Остальные 30% импортируемого пропана поступают в США из других источников морским транспортом.
После производства североамериканский пропан хранится в огромных соляных пещерах, расположенных в форте Саскачеван, Альберта, Канада; Мон-Бельвье, штат Техас, и Конвей, штат Канзас. Эти соляные пещеры были выдолблены в 1940-х годах и могут хранить до 80 миллионов баррелей пропана или больше.Когда пропан необходим, большая часть его транспортируется по трубопроводам в другие районы Среднего Запада, Севера и Юга для использования потребителями. Пропан также доставляется баржами и железнодорожными вагонами в определенные районы США.
Галоген-опосредованное окислительное дегидрирование пропана с использованием йода или расплавленного йодида лития
Бартоломью Ч., Фаррауто Р. Дж. (2005) Введение и основы (Глава 1). В кн .: Основы промышленных каталитических процессов. Wiley Online
Cavani F, Ballarini N, Cericola A (2007) Catal Today 127: 113
CAS Статья Google ученый
Sattler JJHB, Руис-Мартинес Дж., Сантильян-Хименес Э., Weckhuysen BM (2014) Chem Rev 114: 10613
CAS Статья Google ученый
Carrero CA, Schloegl R, Wachs IE, Schomaecker R (2014) ACS Catal 4: 3357
CAS Статья Google ученый
Nager M (1963) Процесс дегидрирования, Патент США 3080435, 1963
Nager M (1965) Производство ароматических углеводородов, Патент США 3168584, 1965
Dahl IM, Grande K, Jens K-J, Rytter E, Slagtern Å (1991) Appl Catal 77: 163
CAS Статья Google ученый
Чекрышкин Ю.С., Роздяловская Т.А., Федоров А.А., Лисичкин Г.В. (2007) Russ Chem Rev 76: 153
CAS Статья Google ученый
Kenney CN (1975) Catal Rev 11: 197
CAS Статья Google ученый
Villadsen J, Livejerg H (1978) Catal Rev 17: 203
CAS Статья Google ученый
Sundermeyer W (1965) Angew Chem Int Ed Engl 4: 222
Статья Google ученый
Lovering DG (1982) Технология расплавленных солей. Пленум, Нью-Йорк
Google ученый
Ито Т., Лансфорд Дж. Х. (1985) Nature 314: 721
CAS Статья Google ученый
Morales E, Lunsford JH (1989) J Catal 118: 255
CAS Статья Google ученый
Conway SJ, Lunsford JH (1991) J Catal 131: 513
CAS Статья Google ученый
Ван DJ, Росинек М.П., Лансфорд Дж. Х. (1995) J Catal 151: 155
CAS Статья Google ученый
Gaab S, Machli M, Find J, Grasselli RK, Lercher JA (2003) Top Catal 23: 151
CAS Статья Google ученый
Левелес Л., Сешан К., Леркер Дж. А., Леффертс Л. (2003) Дж. Катал 218: 307
CAS Статья Google ученый
Левелес Л., Сешан К., Леркер Дж. А., Леффертс Л. (2003) Дж. Катал 218: 296
CAS Статья Google ученый
Gaab S, Find J, Müller T, Lercher J (2007) Top Catal 46: 101
CAS Статья Google ученый
Tope B, Zhu Y, Lercher JA (2007) Catal Today 123: 113
CAS Статья Google ученый
Kumar PK, Gaab S, Muller TE, Lercher JA (2008) Top Catal 50: 156
CAS Статья Google ученый
Gärtner CA, van Veen AC, Lercher JA (2014) J Am Chem Soc 136: 12691
Статья Google ученый
Гейл Р.Дж., Ловеринг Д.Г. (2013) Методы расплавленной соли, том 1. Спрингер, Нью-Йорк
Google ученый
Lantelme F, Groult H (eds) (2013) Химия расплавленных солей. Эльзевир, Амстердам
Google ученый
Блум Х (1967) Химия расплавленных солей. В. А. Бенджамин, Нью-Йорк
Google ученый
Янц Г.Дж. (1967) Справочник по расплавленным солям. Academic Press, Нью-Йорк
Google ученый
Ding K, Metiu H, Stucky GD (2013) ChemCatChem 5: 1906
CAS Статья Google ученый
Gaspar NJ, Pasternak IS, Vadekar M (1974) Can J Chem Eng 52: 793
CAS Статья Google ученый
Golden DM, Benson SW (1969) Chem Rev 69: 125
CAS Статья Google ученый
Nangia PS, Benson SW (1964) J Am Chem Soc 86: 2770
CAS Статья Google ученый
Nangia PS, Benson SW (1964) J Am Chem Soc 86: 2773
CAS Статья Google ученый
Шум LGS, Бенсон С.В. (1983) Int J Chem Kinet 15: 323
CAS Статья Google ученый
Raley JH, Mullineaux RD, Bittner CW (1963) J Am Chem Soc 85: 3174
CAS Статья Google ученый
Shum LGS, Benson SW (1983) Int J Chem Kinet 15: 341
CAS Статья Google ученый
Adams CT, Brandenberger SG, DuBois JB, Mill GS, Nager M, Richardson DB (1977) J Org Chem 42: 1
CAS Статья Google ученый
Скарченко В.К. (1977) Russ Chem Rev 46: 731
Статья Google ученый
Почему из пропана образуется вода
Пропан — это газ, с которым многие люди знакомы, но мало кто понимает. Если человек хочет узнать больше о пропане, горении и причинах образования воды, важно понять, как атомы взаимодействуют во время горения.Образование воды происходит за счет комбинации кислорода, пропана и углекислого газа в процессе сгорания.
Описание
Пропан — это газ, который образуется при добыче нефти. Пропан — это трехуглеродный алкан (молекула, состоящая из трех атомов углерода и пяти атомов водорода). Поскольку пропан нетоксичен и обеспечивает экологически чистое горение, его используют для обогрева домов и приготовления пищи. Пропан также используется во множестве других применений, таких как сварка, и как альтернатива бензину.Пропан тяжелее воздуха и будет «скапливаться» на низких участках, создавая потенциально опасную ситуацию.
Состав
Реакции пропана происходят из-за отдачи и поглощения атомов. Протоны и электроны несут положительный (протоны) или отрицательный (электроны) заряд, который определяет свойства связанных с ними атомов. Химические реакции происходят всякий раз, когда возникает химический дисбаланс в той или иной форме; реакция изменяет свойства связанного соединения. Так при горении могут образовываться вода и углекислый газ.
Сгорание
Вода становится побочным продуктом пропана в процессе сгорания. Горение происходит при содержании от 1,8% до 8,6% пропана и от 91,4% до 98,2% воздуха. Больше или меньше пропана, и сгорание не может происходить полностью. Это приводит к неправильному уравнению и создает смертельный газ — оксид углерода. Уравнение полного сгорания пропана выглядит следующим образом: 3CH8 + 5O2> 3CO2 + 4h3O.
Производство воды
Трехуглеродный алкан пропана (3CH8) добавляется к пяти молекулам кислорода (O5).Когда смесь нагревается, происходит горение, и атомы начинают бурно взаимодействовать. Электроны и протоны толкают и притягивают друг друга, пока не будет восстановлен баланс, образуя углекислый газ (3CO2) и воду (4h3O). Этот процесс продолжается до тех пор, пока не закончится пропан, кислород или тепло. В результате сгорание пропана приводит к образованию относительно большого количества воды.
Удобство использования
Вода, полученная при смешивании пропана со слишком низким содержанием кислорода, непригодна для большинства применений, например для питьевой воды.На самом деле водяного пара настолько мало, что обычно вода сгорает вместе с пропаном. На самом деле испаряющаяся вода в сочетании с выбросами углекислого газа заставляет пропан гореть видимым пламенем.
Реакции горения
Реакции горенияВсе реакции горения укладываются в схему:
топливо + O 2 -> CO 2 + H 2 O
Коэффициенты сбалансированного уравнения будут меняться в зависимости от топливо. Топливо может быть практически любым, включая метан (CH 4 ), пропан (C 3 H 8 ), бутан (C 4 H 10 ), октан (C 8 H 18 ) или сахар (C 6 H 12 O 6 ).
Вычисленное уравнение для метана: CH 4 + 2 O 2 -> CO 2 + 2 H 2 O
Вычисленное уравнение для октана это
2 C 8 H 18 + 25 О 2 -> 16 СО 2 + 18 H 2 O
Сгорание метана или октана экзотермическое; это выпускает энергия.
CH 4 + 2 O 2 -> CO 2 + 2 H 2 O + энергия
Энергия продуктов равна ниже энергий реагентов. Избыточная энергия выделяется в виде тепла и света.
Материя имеет тенденцию переходить в более низкие энергетические состояния. Хорошая аналогия для реакция мяч падает с холма. Экзотермический реакции более вероятны. Эндотермический реакции поглощают энергию.В этих реакции продукты имеют более высокую энергию, чем реагенты. Эндотермические реакции менее вероятны. Ты редко можно увидеть, как мяч самопроизвольно поднимается в гору. Эндотермические реакции могут происходить, когда энтропия вызывает реакцию (толкает мяч в гору). Эти реакции встречаются гораздо реже. В химической горячей упаковке происходит экзотермическая реакция. (Лыжники знают о грелках для рук и ног.) В химической холодильной упаковке происходит эндотермическая реакция.
Энергия активации
Если вы смешиваете метан и кислород вместе, реакции не происходит сразу. Есть преграда для реакции. Этот барьер обусловлен тем, что для получения CO 2 и H 2 O мы должны разорвать 4 связи углерод-водород и несколько связей кислород-кислород. Однако, исходя из этих первоначальных инвестиций в энергию, мы получить больше выплата энергии, когда связи углерод-кислород и водород-кислород сформирован.
Энергетический барьер называется энергией активации. Чистая энергия из реакция — это энергия, которая выделяется при горении метана. Как преодолеть первоначальный энергетический барьер? Обычно мы зажигаем реагенты зажигалкой или искрой. Как только мы начнем реакцию, высвободившаяся энергия может позволить другим реакции преодолеть их энергию активации, и пожар начнется.
(экзотермическая реакция)
Пожалуйста, посмотрите анимацию 11.1: Реакции и энергия на вашем CD
Селективность для частичной или полной реакции
Использование пропанового топлива в топливных элементах с высокотемпературной (120 ° C) мембраной с полимерным электролитом (PEM), для которых не требуется катализатор на основе металла платиновой группы, исследуется в нашей лаборатории.Теория функционала плотности (DFT) была использована для определения энергий адсорбции пропана, энергий десорбции и энергий переходного состояния для реакций дегидрирования и гидроксилирования на поверхности анодного катализатора Ni (100). Фактор Больцмана для гидроксилирования пропильного компонента с образованием пропанола и его последующей десорбции сравнивали с таковым для дегидрирования пропильного компонента. Большое соотношение соответствующих факторов Больцмана указывает на то, что образование полностью прореагировавшего продукта (диоксида углерода) гораздо более вероятно, чем образование частично прореагировавших продуктов (спиртов, альдегидов, карбоновых кислот и монооксида углерода).Это открытие свидетельствует о том, что основная часть химической энергии пропанового топлива преобразуется в электрическую или тепловую энергию в топливном элементе, а не остается неиспользованной при образовании частично прореагировавших частиц.
1. Введение
Топливные элементы преобразуют химическую энергию топлива в электрическую. Теоретически они могут производить больше электроэнергии из топлива, чем батареи или процессы сгорания. Пропан был топливом, исследованным для топливных элементов, описанных в этой работе.В настоящее время грузовики доставляют сжиженный нефтяной газ (СУГ) (в основном пропан) в сельские районы, где есть дороги. Стоимость доставки обычной электроэнергии в сельских районах примерно на порядок выше, чем в городских, даже несмотря на то, что цены, взимаемые коммунальными предприятиями за электроэнергию, часто аналогичны. Следовательно, в сельской местности можно допустить более высокие капитальные затраты на топливные элементы, чем в городских. Это указывает на то, что нишевый рынок пропановых топливных элементов в сельской местности будет прибыльным до появления прибыльного рынка в городских районах.
В большинстве топливных элементов в качестве топлива используется водород или метанол. У них есть несколько недостатков. К сожалению, инфраструктуры для их распространения и хранения не существует. Кроме того, оба они производятся из природного газа (в основном метана) с использованием сложных реакторных систем, которые имеют большие капитальные затраты. Они также имеют большие эксплуатационные расходы, поскольку 25% природного газа расходуется на обеспечение эндотермического тепла для реакции парового риформинга. Газообразный водород требует сложных систем хранения [1].Ни один из этих недостатков не возникает, когда пропан вступает в реакцию непосредственно на аноде топливного элемента.
Тип пропанового топливного элемента, который мы исследуем, представляет собой топливный элемент с высокотемпературной полимерной электролитной мембраной (PEM), работающий при температуре около 120 ° C. Он имеет ряд преимуществ по сравнению с обычными топливными элементами на основе ПЭМ, которые работают при температуре около 80 ° C. Основным из них является удаление воды в жидкой фазе, что устраняет накопление кислотных частиц и возникающую в результате коррозию. В менее агрессивной среде металлы платиновой группы, используемые в качестве катализаторов в обычных топливных элементах PEM, могут быть заменены менее дорогими металлами, такими как никель (на аноде) и серебро (на катоде).К сожалению, протонная проводимость электролита Nafion, используемого в обычных топливных элементах PEM, уменьшается на порядок при повышении рабочей температуры с 80 до 120 ° C. Чтобы обойти эту трудность, мы начали экспериментальную программу по разработке модифицированной мембраны из фосфата циркония, ZrP, которая, по-видимому, подходит для работы при 120 ° C (Al-Othman et al. [2, 3]).
Основная проблема топливных элементов, использующих пропан и другие углеводороды в качестве топлива, заключается в том, что плотности тока (скорости реакции) невелики.В течение 1960-х годов было выполнено обширное исследование топливных элементов с прямым углеводородом (DHFC), включая пропановые топливные элементы [4–6]. С тех пор было проведено относительно немного экспериментальных исследований. К ним относятся углеводороды, подаваемые на анод твердооксидных топливных элементов [7], операции при 300 ° C с использованием Sn толщиной 1 мм 0,9 In 0,1 P 2 O 7 [8], кинетика и механизмы [9] –11], а также использование полимерных электролитов [12–14].
Реакции топливных элементов можно исследовать на разных уровнях детализации.Общая реакция пропана в высокотемпературном пропановом топливном элементе PEM показана как Полная реакция полуэлемента для анода пропанового топливного элемента показана как где (g) — газовая фаза, (ZrP) — Zr (HPO 4 ) 2 H 2 O – глицериновый электролит, а (Ni) — никелевый металлический анодный электрокатализатор. Никель был выбран в качестве анодного электрокатализатора, поскольку было известно, что он является эффективным неплатиновым катализатором в щелочных топливных элементах [15]. Механизм, по которому ожидается реакция пропана в (2), показан на рисунке 1.Механизм реакции на рисунке 1 аналогичен механизму реакции для метана, о котором сообщили Bagotzky et al. [16]. Пропан в газовой фазе сначала адсорбируется на электрокатализаторе из металлического никеля. Затем его дегидрируют с образованием адсорбированного пропила. Представленное здесь исследование в первую очередь касается последующих реакций адсорбированных пропильных частиц. Он может реагировать с гидроксильной группой с образованием пропанола (спирта), C 3 H 7 OH (Ni), с последующей десорбцией в газовую фазу.В качестве альтернативы атом водорода может быть удален с образованием адсорбированной разновидности аллила, C 3 H 6 (Ni). Подходящая комбинация последующих реакций дегидрирования и гидроксилирования может привести к завершению реакции и образованию CO 2 . На аноде происходит только одна электрохимическая реакция, H −− > H + + e — . Рисунок 1 показывает, что большинство элементарных реакций топливного элемента на никелевом анодном электрокатализаторе пропанового топливного элемента не связаны с переносом заряда.
Общей целью этой работы было исследование реакций в сети, показанной на рисунке 1. Одна конкретная цель состояла в том, чтобы определить, остаются ли углеводородные промежуточные продукты реакции на поверхности катализатора, где серия реакций дегидрирования может сочетаться с реакции гидроксилирования с образованием полностью прореагировавшего продукта диоксида углерода. Нежелательной альтернативой было бы, чтобы углеводородные поверхностные частицы сохраняли свои атомы водорода и образовывали частично прореагировавшие продукты, такие как спирты, альдегиды и карбоновые кислоты.Для топливных элементов желательна полная реакция, поскольку часть химической энергии топлива остается неиспользованной при образовании частично прореагировавших продуктов.
Состав катализатора, по-видимому, является фактором, определяющим, прореагировали ли продукты частично или полностью. Несколько экспериментов с платиновым анодом показали, что CO 2 был преобладающим продуктом, образующимся в определенных ситуациях. Единственным описанным продуктом был CO 2 , когда углеводородным топливом был (а) этилен, подаваемый в топливный элемент с серной кислотой [17], (б) пропан, подаваемый в топливный элемент с фосфорной кислотой [18], и (c) метан подается в ПЭМТЭ [19].Когда в PEMFC с платиновым анодом подавался пропан, основным продуктом был CO 2 при потенциалах ячейки менее 0,1 В и CO, когда потенциал ячейки был больше 0,4 В [20]. В отличие от платино-рутениевого анода, когда метан подавался в PEMFC, образовывались все возможные продукты частичной реакции: CH 3 OH, CH 2 O, COOH, CO и CO 2 . [19]. Эта работа была выполнена, чтобы получить указание на то, будут ли получены полные или частичные продукты реакции при использовании никелевого катализатора.
2. Методология и детали вычислений
Программное обеспечение SIESTA, основанное на теории функционала плотности Кона-Шэма, использовалось для выполнения квантово-химических вычислений (Soler et al. [21]). В качестве функционального типа обменной корреляции использовался метод обобщенного градиентного приближения (GGA) с параметризацией Беке, Ли, Янга и Парра (BLYP). В этих расчетах использовался базовый набор по умолчанию, двойной поляризационный набор ζ , состоящий из компактного и рассеянного орбитального базиса.Допуск матрицы плотности был установлен равным 10 -3 . Это значение устанавливает максимально допустимую разницу между выходом и входом для каждого элемента матрицы плотности в цикле самосогласованного поля (SCF). Использовалась (/ -points) сетка Monkhorst-Pack -point. Сходимость в зависимости от числа точек тщательно отслеживалась. Увеличение размера сетки с 32 до 48 изменило энергии адсорбции на незначительную величину (~ 4 × 10 -5 эВ или ~ 8 × 10 -3 кДж / моль).В некоторых расчетах координаты атомов могли расслабиться (изменить положение), чтобы определить геометрию, имеющую минимальную энергию. Когда разница в энергии между последовательными вычислениями была меньше 10 -3 эВ и когда максимальная атомная сила была меньше 0,01 эВ / Å, критерии сходимости были достигнуты, и атомная геометрия была оптимизирована.
Псевдопотенциал для никеля был сгенерирован с помощью программы ATOM SIESTA. Обменная корреляция Perdew Burke Ernzerhof (PBE) [22] использовалась для генерации электронной конфигурации.Усовершенствованный метод Труллье-Мартинса (tm2) был использован для создания файла псевдопотенциалов для никеля в его неполяризованной электронной конфигурации в основном состоянии. Входной файл псевдопотенциала для металла требовал указания определенного радиуса сердцевины. Получено методом проб и ошибок. Если исходное значение было слишком маленьким (1,5 для металлов, используемых в этом исследовании), псевдопотенциал не мог быть создан. После того, как значение этого параметра будет немного больше минимально допустимого, программа сгенерирует точное значение для.Это значение (3,34 бора для никеля) было использовано для создания псевдопотенциала. Выходной файл псевдопотенциала использовался для всех последующих вычислений, включающих атомы никеля. Чтобы подтвердить достоверность нашего метода генерации псевдопотенциала и полученных псевдопотенциалов, были выполнены расчеты энергии для элементарной ячейки Ni с использованием нашего пользовательского псевдопотенциала Ni. Постоянная решетки (ЖК), которая имела минимальную полную энергию для элементарной ячейки Ni, составляла 0,370 нм. Разница в 4.9%, когда значение 3,70 нм сравнивается с экспериментальной ЖК для Ni (0,352 нм), измеренной с помощью дифракции рентгеновских лучей (XRD; Haynes [23]). Эта ошибка меньше, чем ошибка 6%, о которой сообщалось при использовании функционала PBE (Perdew et al. [24]).
Расчеты DFT были выполнены для системы периодически повторяющихся объектов, определенных в отношении элементарных ячеек кристалла никеля. Каждый объект состоял из одной молекулы пропана, слоя атомов никеля и вакуумного пространства. Пластинка состояла из одного слоя кристаллических элементарных ячеек (двух слоев атомов Ni), расположенных в плоскости -.Ячейки были расположены 3 ячейки 3 ячейки с 4 атомами на ячейку (= 36 атомов на пластину). Поверхность (100) использовалась для всех никелевых слябов. Вакуумное пространство имело толщину девять пустых элементарных ячеек и располагалось над никелевой пластиной по направлению. Вакуумное пространство занимало расстояние от верхней поверхности никелевого сляба в одном периодическом объекте до нижней поверхности следующего никелевого сляба над ним в следующем периодическом объекте. В идеале вакуумный слой может предотвращать или минимизировать взаимодействия между периодическими объектами в направлении, перпендикулярном поверхности.Выбор пластин с 36 атомами никеля на пластину типичен для количества атомов металла во многих расчетах пластин методом DFT [25–28].
Поверхность пластины должна быть достаточно большой по отношению к поверхностным компонентам, чтобы избежать как (а) взаимодействий между поверхностными частицами на одной пластине и атомами никеля в соседних пластинах, так и (б) взаимодействий адсорбат-адсорбат. Поскольку на поверхности наших пластин было 18 атомов, доля пропана составляла менее 0,2. Было показано Grabow et al.[29], что взаимодействия адсорбат-адсорбат могут влиять на энергию связи на целых 1 эВ, когда фракционное покрытие поверхности увеличивается с 0,2 до 1. Наше низкое покрытие поверхности сводит к минимуму вклад абсорбата-адсорбата в энергию адсорбции.
Чтобы подтвердить, что слябы были достаточно толстыми, чтобы предсказать адсорбцию пропана на Ni (100), толщина слябов была увеличена с 2 до 4 атомов (увеличение количества атомов на пластину с 36 до 72). Увеличение толщины сляба изменило значение энергии адсорбции пропана только на 7.3% (~ 0,04 эВ или ~ 4 кДж / моль). Это относительно небольшое изменение указывает на то, что расчеты с использованием пластин, содержащих два слоя атомов, достаточно точны для качественного прогнозирования тенденций в энергии адсорбции пропана.
Еще один расчет энергии адсорбции пропана был выполнен на двухслойной пластине Ni (100), в которой нижний слой был закреплен в положениях объемного никеля, а верхнему слою позволяли расслабиться. По сравнению с расчетом, в котором атомам в обоих слоях позволяли релаксировать, изменение энергии также было очень небольшим (4 × 10 -4 эВ ~ 0.04 кДж / моль).
Энергии адсорбции () адсорбатов (первоначально адсорбированные реагенты и последующие адсорбированные промежуточные частицы) на металлических пластинах были рассчитаны по следующему уравнению: где — полная энергия для абсорбата плюс металлическая пластина, — полная энергия для конфигурации адсорбат плюс металлическая пластина, которая имеет минимальную энергию, — это энергия изолированной молекулы реагента в газовой фазе, — это энергия для металла. slab, и — энергия адсорбции компонентов на поверхности металлической пластины (или теплота адсорбции).
Энергия переходного состояния для каждой реакции была получена расчетом как функция либо от длины связи C – H, либо от длины связи O – H. Для каждого расчета либо длина связи C – H, либо длина связи O – H поддерживалась постоянной, в то время как все другие длины связей и все валентные углы в адсорбированных частицах ослаблялись, чтобы получить конфигурацию адсорбата, имеющую минимальную энергию для этого конкретного C– Длина связи H или O – H. Впоследствии полученные энергии, которые были рассчитаны для каждой длины связи C – H или O – H, сравнивали в зависимости от длины их связи.Конфигурация адсорбированных частиц, имеющих максимальную энергию, была переходным состоянием (TS).
Энергии переходных состояний были получены с использованием следующего уравнения: Вариации электрического потенциала плит не учитывались (нулевое электрическое поле).
3. Результаты и обсуждение
Механизм дегидрирования для превращения пропана в газовой фазе в адсорбированные пропильные частицы показан на рисунке 2. Формула — (Ni – Ni) — SLAB представляет собой 36- атомная плита из атомов Ni в двух слоях, в которых атомы Ni в каждом слое имеют четырехкратную симметрию.Адсорбированный пропан (рис. 3 (а)) ориентирован параллельно поверхности никелевого сляба. То есть плоскость, проведенная через три атома углерода в адсорбированном пропане (рис. 3 (а)), перпендикулярна поверхности Ni (100). Центральный атом углерода пропана имеет координацию сверху с атомом никеля под ним. Относительно центрального атома углерода два концевых атома углерода пропана симметричны и приподняты над поверхностью пластины. Атомы водорода, которые связаны с центральным атомом углерода пропана, также координированы с тем же атомом Ni, что и центральный атом углерода пропана.На рисунке 3 расстояние связи C – H между центральным атомом углерода и его атомами водорода составляет 0,110 нм по сравнению с 0,112 нм, когда пропан находится в газовой фазе.
Энергия адсорбции пропана на Ni, 0,534 эВ (51,2 кДж / моль), также показана на рисунке 3. Другие расчетные значения адсорбции пропана на металлах включают значения 33–38 кДж / моль на Pt, показанные как Nykänen и Honkala [30], значение 55 кДж / моль на Pd, показанное Antony et al. [31] и 39,8–42,1 на Pd, показанные Као и Мэдиксом [32].Экспериментальные значения адсорбции пропана на металлах включают калориметрические измерения 32 кДж / моль на пленке Mo, проведенные Smutek и Černý [33], и измерения температуры запрограммированной десорбции на Pd, показанные на уровне 41,5 кДж / моль, показанные Kao и Madix [32]. ] и 45 кДж / моль, как показано Antony et al. [31]. Нюканен и Хонкала [30] отметили, что существует значительная неопределенность в измерениях тепла, выполненных с помощью десорбции с программированием температуры. Кроме того, можно ожидать, что энергия адсорбции на Ni будет отличаться от энергии адсорбции на Mo или Pd.Тем не менее, указанная здесь энергия адсорбции пропана на Ni имеет ту же величину, что и значения, полученные для других металлов расчетом или измерением.
Переходное состояние (TS) между адсорбированной молекулой пропана и адсорбированной пропиловой составляющей показано на рисунке 3 (b). Важной особенностью TS является то, что как пропильная разновидность, так и ее отдельный атом водорода остаются настроенными на один и тот же атом Ni в пластине (структура A 3 на Рисунке 2). Структура TS не является ни симметричной, ни параллельной поверхности никелевого сляба.Плоскость, проведенная через три атома углерода в структуре TS (рис. 3 (b)), пересекается с поверхностью пластины Ni (100) под углом, отличным от 90 °. Расстояние углерод-водород для водорода, удаляемого от центрального атома углерода пропана, показано на расстоянии 0,170 нм в TS. Это существенно больше, чем расстояние C – H 0,110 нм в адсорбированном пропане.
На рисунке 4 представлены энергии четырех частиц, показанных на рисунке 2. Степень реакции дегидрирования определяется расстоянием связи C – H между центральным атомом углерода пропана и удаляемым атомом водорода.Изменение энергии при адсорбции пропана на пластине Ni (100) составляет 0,531 эв (51,2 кДж / моль). Высота барьера между адсорбированной молекулой пропана и ее TS для адсорбированных частиц пропила составляет 0,734 эВ (70,8 кДж / моль). Энергия реакции адсорбированной молекулы пропана с адсорбированными частицами пропила и адсорбированным атомом водорода составляет 0,163 эВ (15,7 кДж / моль). Энергия переходного состояния = 0,734 эВ, полученная нами путем изменения расстояния связи C – H, является близким приближением к истинной энергии переходного состояния, которая была бы получена из расчета седловой точки.
Механизм диссоциации воды показан на рисунке 5. Структуры адсорбированных частиц, полученных из воды, показаны на рисунке 6. Вид сверху на молекулу адсорбированной воды предполагает, что тройная природа трех атомов в Молекула воды (один атом кислорода и два атома водорода), по-видимому, скоординирована поверх одного атома Ni на поверхности Ni (100). Расстояние связи O – H в адсорбированной воде 0,100 нм отличается от расстояния в газовой фазе 0.145 нм.
Переходное состояние (TS) от адсорбированной воды к комбинации адсорбированных гидроксильных частиц и адсорбированного атома водорода показано на рисунке 6 (b). Расстояние связи O – H в TS увеличилось до 0,160 нм, что является существенным изменением по сравнению с расстоянием связи O – H 0,100 нм в адсорбированной воде.
Энергии четырех частиц на Рисунке 5 показаны на Рисунке 7 как функция реакции диссоциации, измеренной расстоянием связи O – H.Изменение энергии при адсорбции воды на поверхности Ni (100) составляет 0,798 эв (77,0 кДж / моль). Высота барьера между адсорбированной молекулой воды и ее TS адсорбированному гидроксильному радикалу составляет 0,655 эВ (63,2 кДж / моль). В литературе имеется множество сообщений о диссоциации воды на металлах. Например, исследование методом DFT [34] 6 различных металлов, Os, Ru, P, Ir, Rh и Pt, показало, что высота барьера находится в диапазоне от 0,343 до 1,25 эВ. Другой пример — исследование Pozzo et al. [35], сравнивающие диссоциацию воды на поверхностях Rh (111) и Ni (111).Они сообщили о высоте барьера 0,92 и 0,89 для реакции диссоциации воды на ОН и Н на Rh (111) и Ni (111) соответственно. Изменение энергии во время реакции адсорбированной молекулы воды с образованием адсорбированных гидроксильных частиц и адсорбированного атома водорода составляет 0,386 эВ (37,2 кДж / моль). Высота барьера для комбинации образования гидроксильных частиц и атомов водорода (Рисунок 7) примерно на 10% меньше, чем для комбинации образования пропильных частиц и атомов водорода (Рисунок 4).Если бы сравнение двух разных высот отдельных барьеров было единственным соображением, это могло бы предположить, что было бы легче образовать гидроксильные частицы, чем пропильные, и что гидроксильные частицы могли бы быть более многочисленными на поверхности Ni (100), чем пропильные частицы.
Механизм второй реакции дегидрирования, превращения адсорбированных пропильных частиц в адсорбированные аллильные частицы, показан на рисунке 8. Показаны структуры адсорбированных пропильных частиц и TS от адсорбированных пропильных частиц до адсорбированных аллильных частиц. на рисунке 9.Центральный атом углерода адсорбированного пропильного радикала на рисунке 9 (а) находится над одним из атомов Ni в пластине Ni (100). Плоскость, проведенная через три атома углерода пропильных частиц, пересекает поверхность Ni (100) под углом, который сильно отличается от 90 °, что указывает на то, что пропильные частицы не расположены симметрично на Ni (100). поверхность.
Переходное состояние (TS) от адсорбированных пропильных частиц к адсорбированным аллильным частицам показано на рисунке 9 (b).Центральный атом углерода TS находится поверх атома Ni на поверхности. Атом водорода, который удаляется из центрального атома углерода, связан мостиком с двумя атомами Ni, которые примыкают к атому Ni, на котором аллильный центральный атом углерода находится наверху. Расстояние между центральным атомом углерода в TS и отделенным водородом в TS увеличилось примерно до 0,180 нм, что является существенным изменением по сравнению с расстоянием между связями C – H в адсорбированных частицах пропила.
Энергии трех частиц при переходе от пропила к аллилу на рисунке 8 показаны на рисунке 10 в зависимости от реакции дегидрирования, измеренной расстоянием связи C – H.Существует разница в энергии примерно 16 эВ между комбинацией пропильных частиц и пластины, представленной на рисунках 8 и 10, и комбинацией пропильного радикала, водородного радикала и пластины, представленной на рисунках 2 и 4. Высота барьера между адсорбированные частицы пропила и переходное состояние (TS) к адсорбированным частицам аллила и атому водорода составляет 1,22 эВ (~ 118 кДж / моль).
Механизм реакции синтеза между адсорбированными пропильными частицами и адсорбированными гидроксильными частицами с образованием пропанола показан на рисунке 11.Структуры адсорбированных пропильных и гидроксильных разновидностей показаны на рисунке 12 (а). Центральный атом углерода адсорбированных частиц пропила на рисунке 9 (а) находится над одним из атомов Ni на поверхности Ni (100). Плоскость, проведенная через три атома углерода пропильного радикала, пересекает поверхность пластины Ni (100) под углом, который сильно отличается от 90 °, что указывает на то, что пропильный радикал не расположен симметрично на поверхности Ni (100). Расстояние связи C – O между центральным атомом углерода в пропильных частицах и атомом кислорода в гидроксильных частицах равно 0.4 нм.
Переходное состояние (TS) во время реакции адсорбированных пропильных частиц и адсорбированных гидроксильных частиц с образованием адсорбированной молекулы пропанола показано на рисунке 12 (b). Расстояние связи C – O в TS уменьшилось до 0,215 нм с 0,4 нм для расстояния C – O, когда два вида находились в своих наиболее стабильных независимых состояниях. Следует отметить, что и атом углерода в пропильной части, и атом кислорода в гидроксильной части координированы с одним и тем же атомом Ni в TS до реакции синтеза и образования связи C – O.Похоже, что они должны адсорбироваться на одном и том же атоме, чтобы быть геометрически достаточно близкими для того, чтобы могла произойти реакция образования связи.
Энергии четырех компонентов (пропил, гидроксил, адсорбированный пропанол и пропанол в газовой фазе) показаны на Рисунке 13 как функция расстояния C – O. Энергия реакции от комбинации адсорбированных частиц пропила плюс адсорбированных гидроксильных частиц с образованием адсорбированной молекулы пропанола составляет 0,507 эВ (48,9 кДж / моль). Высота барьера для образования пропанола из комбинации адсорбированных пропильных частиц и адсорбированных гидроксильных частиц составляет 1.59 эВ (~ 153 кДж / моль). Напротив, высота барьера для образования разновидностей аллила (1,22 эВ), обсужденная выше, примерно на 25% меньше, чем высота образования пропанола (1,59 эВ). Кроме того, для десорбции пропанола с поверхности Ni в газовую фазу необходимо обеспечить дополнительное количество энергии 0,819 эВ (~ 79,0 Дж / моль).
Фактор Больцмана, exp (/ RT), представляет собой вероятность того, что молекулы обладают достаточной энергией для достижения переходного состояния, где — высота барьера для реакции.Его можно использовать для оценки соотношения двух скоростей реакции. Превращение пропильных частиц в аллильные [с высотой барьера] является желаемой реакцией, поскольку частицы остаются на поверхности и, следовательно, сохраняют возможность превращения в конечном итоге в CO 2 , полный продукт реакции. Реакция пропильного радикала с гидроксильными частицами с образованием пропанола в газовой фазе [с высотой барьера] является нежелательной реакцией, потому что пропанол является частично прореагировавшим продуктом, который сохраняет химическую энергию, которая могла быть преобразована в электрическую энергию путем дальнейшей реакции на углекислый газ.
Высоту барьера для превращения адсорбированных частиц пропила в адсорбированные частицы аллила () = 1,22 эВ можно сравнить с высотой барьера для превращения адсорбированных частиц пропила в газофазный пропанол. Для превращения пропильных частиц в молекулы пропанола в газовой фазе используются две стадии реакции. Во-первых, это реакция адсорбированного пропила с гидроксильным радикалом с образованием адсорбированного пропанола = 1,59 эВ. Затем происходит десорбция пропанола в газовую фазу = 0.82 эВ. Поскольку для одного преобразования требуются два шага, а для другого — один, сравнение двух разных высот отдельных барьеров не описывает это явление. Комбинация exp [/ RT] = exp (-1,59 / RT) * exp (-0,82 / RT), дающая = 2,41 эВ, представляет собой произведение двух явлений.
Соотношение двух скоростей реакции Соотношение, рассчитанное при 150 ° C (423 K), составило 1,4 * 10 14 . Этот результат указывает на то, что пропанол — маловероятный продукт. Нам неизвестны какие-либо экспериментальные результаты топливных элементов по селективности для CO 2 на никелевом аноде.Однако платина находится в том же столбце периодической таблицы, что и никель, и платина часто используется в качестве электрода топливного элемента. Эти расчетные результаты для поверхности Ni (100) согласуются с экспериментальными результатами на платиновых катализаторах, в которых диоксид углерода был преобладающим продуктом. Это исследование показывает, что диоксид углерода также может быть преобладающим продуктом на никеле и что образование значительных количеств частично оксигенированных продуктов маловероятно.
4. Заключение
Представленные здесь результаты DFT показывают, что реакция адсорбированных пропильных частиц с образованием адсорбированных аллильных частиц на поверхности никелевого (100) анодного катализатора гораздо более вероятна, чем их реакция с поверхностными гидроксильными частицами с образованием газовая фаза пропанол.Это предполагает, что продукты реакции из пропанового топливного элемента, имеющего анод с никелевым электрокатализатором, скорее всего, будут полностью реагировать (CO 2 ), а не частично (спирты, альдегиды, карбоновые кислоты и CO), тем самым преобразовывая практически все химическая энергия пропана в электрическую и тепловую энергию.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Глава 11: Горение (Обновлено 31.05.10)
Глава 11: Горение (Обновлено 31.05.10) Глава 11: Сжигание
(Спасибо Дэвид
Bayless за письменную помощь.
этот раздел)
Введение — До этого точка тепла Q во всех задачах и примерах была либо заданной значение или было получено из отношения Первого закона.Однако в различных тепловые двигатели, газовые турбины и паровые электростанции тепло полученные в процессе сгорания с использованием твердого топлива (например, уголь или дрова). жидкое топливо (например, бензин, керосин или дизельное топливо), или газообразное топливо (например, природный газ или пропан).
В этой главе мы познакомимся с химией и термодинамика горения типовых углеводородных топлив — (C x H y ), в котором окислителем является кислород, содержащийся в атмосферном воздухе. Обратите внимание, что мы не будем рассматривать сжигание твердого топлива или сложные смеси и смеси углеводородов, входящих в состав бензин, керосин или дизельное топливо.
Атмосферный воздух содержит примерно 21% кислорода (O 2 ) по объему. Остальные 79% «прочих газов» в основном азот (N 2 ), т. предположим, что воздух на 21% состоит из кислорода и на 79% азота. объем. Таким образом, каждый моль кислорода, необходимый для окисления углеводорода, равен сопровождается 79/21 = 3,76 моля азота. Используя эту комбинацию молекулярная масса воздуха становится 29 [кг / кмоль]. Обратите внимание, что это предполагается, что азот обычно не подвергается каким-либо химическим воздействиям. реакция.
Процесс горения — Основной процесс сгорания можно описать с помощью топлива ( углеводород) плюс окислитель (воздух или кислород) под названием Реагенты , которые подвергаются химическому процессу, выделяя тепло, чтобы сформировать Продукты горения таким образом, чтобы масса сохранялась. в простейший процесс сгорания, известный как стехиометрический Сгорание , весь углерод в топливе образует диоксид углерода (CO 2 ) и весь водород образует воду (H 2 O) в продуктах, поэтому мы можем записать химическую реакцию следующим образом:
где z известен как стехиометрический коэффициент для окислителя (воздуха)
Обратите внимание, что эта реакция дает пять неизвестных: z, a, b, c, d, поэтому нам нужно решить пять уравнений.Стехиометрический горение предполагает отсутствие в продуктах избыточного кислорода, поэтому d = 0. Остальные четыре уравнения мы получаем в результате уравновешивания числа атомов каждого элемента в реагентах (углерод, водород, кислород и азота) с числом атомов этих элементов в товары. Это означает, что никакие атомы не разрушаются и не теряются в реакция горения.
Элемент | Количество в реактивах | = | Количество товаров | Сокращенное уравнение |
Углерод (C) | x | а | а = х | |
Водород (H) | л | 2б | b = y / 2 | |
Кислород (O) | 2z | 2a + b | г = а + б / 2 | |
Азот (N) | 2 (3.76) z | 2c | c = 3.76z |
Обратите внимание, что образующаяся вода может находиться в паре или жидкая фаза, в зависимости от температуры и давления продукты сгорания.
В качестве примера рассмотрим стехиометрическое горение метана (CH 4 ) в атмосферном воздухе. Приравнивание моляра коэффициенты реагентов и продуктов получаем:
Теоретическое соотношение воздух и воздух-топливо — минимальное количество воздуха, которое позволит полностью сгорать топливо называется Теоретический Air (также именуемый Стехиометрический воздух ).В этом случае продукты не содержат кислорода. Если мы поставляем меньше теоретического воздуха, тогда продукты могут содержать углерод монооксида (CO), поэтому обычной практикой является подача более теоретический воздух, чтобы предотвратить это явление. Это превышение Воздух приведет к появлению кислорода в продукты.
Стандартная мера количества воздуха, используемого в процесс сгорания топлива воздух-топливо Коэффициент (AF), определяемый следующим образом:
Таким образом, учитывая только реагенты метана при сжигании теоретическим воздухом, представленным выше, получаем:
Решенная задача 11.1- дюйма В этой задаче мы хотим разработать уравнение горения и определить соотношение воздух-топливо для полного сгорания н-бутана (C 4 H 10 ) с а) теоретическим воздухом и б) 50% избытком воздуха.
Анализ продуктов сгорания — Горение всегда происходит при повышенных температурах и мы предполагаем, что все продукты сгорания (включая воду пар) ведут себя как идеальные газы. Поскольку у них другой газ постоянных, удобно использовать уравнение состояния идеального газа в условия универсальной газовой постоянной:
В анализе продуктов сгорания нет представляет ряд интересных объектов:
1) Что такое процентный объем конкретных продуктов, в частности углекислого газа (CO 2 ) и углерода монооксид (CO)?
2) Что такое роса точка водяного пара в продуктах сгорания? Это требует оценка парциального давления паровой составляющей воды продукты.
3) Существуют экспериментальные методы объемного анализ продуктов сгорания, обычно проводится на Dry Основа , дающая процент объема всех компонентов, кроме водяного пара. Это позволяет просто метод определения действительного воздушно-топливного отношения и использованного избыточного воздуха в процессе горения.
Для идеальных газов мы находим, что мольная доля y i i-го компонента в смеси газов при определенном давлении P
а температура T равна объемной доле этого компонента.
Поскольку из молярного отношения идеального газа: P.V = N.R u .T,
у нас:
Кроме того, поскольку сумма объемов компонентов V и должны равняться общему объему V, имеем:
Используя аналогичный подход, определяем частичную давление компонента с использованием закона парциальных давлений Дальтона:
Решенная проблема 11.2 — В эта проблема Пропан (C 3 H 8 ) сжигается с 61% избытком воздуха, который поступает в камеру сгорания при 25 ° С.Предполагая полное сгорание и полное давление 1 атм. (101,32 кПа), определите а) соотношение воздух-топливо [кг-воздух / кг-топливо], б) процентное содержание двуокиси углерода в продуктах, и c) температура точки росы продуктов.
Решенная проблема 11,3 — дюйма эта проблема Этан (C 2 H 6 ) сжигается атмосферным воздухом, и объемный анализ сухие продукты сгорания дает: 10% CO 2 , 1% CO, 3% O 2 и 86% № 2 .Развивать уравнение горения, и определить а) процент превышения воздух, б) соотношение воздух-топливо и в) точка росы при сгорании. товары.
Анализ горения по первому закону — Основная цель горения — выработка тепла за счет изменения энтальпия от реагентов к продуктам. Из Первого Закона уравнение в контрольном объеме без учета кинетической и потенциальной энергии изменений и, если не делать никаких работ, имеем:
, где суммирование ведется по всем продукты (p) и реагенты (r).N означает количество молей каждого компонента, а h [кДж / кмоль] относится к молярной энтальпии каждый компонент.
Поскольку существует ряд различных веществ нам нужно установить общее эталонное состояние для оценки энтальпия, обычно выбирают 25 ° C и 1 атм, что составляет обычно обозначается надстрочным индексом o. Проф. С. Бхаттачарджи из Государственный университет Сан-Диего разработал экспертную систему на базе Интернета в < www.thermofluids.net > позвонил ТЕСТ ( T he E xpert S система для гермодинамики Т ) в которую он включил набор таблиц свойств идеального газа, все основанные на по энтальпии h o = 0 по этой общей ссылке.Мы адаптировали некоторые из этих таблиц специально для этого раздела, и их можно найти в следующая ссылка:
Горение Таблицы молярной энтальпии
В качестве примера снова рассмотрим полное сгорание метана (CH 4 ) с теоретическим воздухом:
Обратите внимание, что в реагентах и продуктах В приведенном выше примере у нас есть базовые элементы O 2 и N 2 как а также соединения CH 4 , CO 2 и H 2 O.Когда соединение образуется, изменение энтальпии называется Энтальпия формации , обозначенной h f o , и для нашего примера:
Вещество
Формула
hfo [кДж / кмоль]
Двуокись углерода
CO 2 (г)
-393 520
Водяной пар
H 2 O (г)
-241 820
Вода
H 2 O (л)
-285 820
Метан
CH 4 (г)
-74,850
где (г) относится к газу, а (л) относится к жидкость.
Знак минус означает, что процесс Экзотермический , т.е. при образовании соединения выделяется тепло. Обратите внимание, что энтальпия образования основных элементов O 2 и N 2 составляет нуль.
Сначала рассмотрим случай, когда достаточно теплопередача таким образом, чтобы и реагенты, и продукты находились на 25 ° C и давление 1 атм, и что водный продукт является жидким. С нет заметного изменения энтальпии, уравнение энергии становится:
Это тепло (Qcv) называется энтальпией . горения или нагрева Стоимость топлива.Если продукты содержат жидкую воду, тогда она выше Теплотворная способность (как в нашем примере), однако, если продукт содержит водяной пар, то это нижний предел . Теплотворная способность топлива. В энтальпия сгорания — это наибольшее количество тепла, которое может быть высвобождается заданным топливом.
Адиабатическая температура пламени — Противоположная крайность приведенного выше примера, в котором мы оценили энтальпия горения — это случай адиабатического процесса, в котором тепло не выделяется.Это приводит к значительному повышению температуры. увеличение количества продуктов сгорания (обозначается адиабатическим Температура пламени ), которая может быть уменьшается за счет увеличения воздушно-топливной смеси.
Решенная задача 11.4 — Определить температура адиабатического пламени для полного сгорания Метан (CH 4 ) с 250% теоретического воздуха в адиабатическом контрольном объеме.
Это уравнение может быть решено только итеративным методом. метод проб и ошибок с использованием таблиц Sensible Энтальпия против температуры для всех четырех компоненты продукции — CO 2 , H 2 O, O 2 , и N 2 .Быстрый приближение к температуре адиабатического пламени может быть получено следующим образом: при условии, что продукты полностью состоят из воздуха. Такой подход был представил нам Potter и Somerton в их Schaum’s Очерк термодинамики для инженеров , в котором они предположили, что все продукты имеют номер N 2 . Мы считаем, что более удобно использовать воздух, предполагая репрезентативное значение из Специального Теплоемкость воздуха : C p, 1000K = 1,142 [кДж / кг.K].
Таким образом, суммируя все моли продуктов, получаем:
Используя таблицы Sensible Энтальпия в зависимости от температуры , мы оценили энтальпия всех четырех продуктов при температуре 1280К.Этот в результате общая энтальпия составила 802 410 [кДж / кмоль топлива], что составляет чрезвычайно близко к требуемому значению, что оправдывает такой подход.
Задача 11.5 — — Определите адиабатическую температуру пламени для полное сгорание пропана (C 3 H 8 ) с 250% теоретического воздуха в адиабатическом контрольном объеме [T = 1300 КБ].
______________________________________________________________________________________
Инженерная термодинамика, Израиль
Уриэли под лицензией Creative
Общедоступное авторское право — Некоммерческое использование — Совместное использование 3.

Leave A Comment