Глюкоза выход энергетический — Справочник химика 21
Теперь можно подвести итог тому, каков энергетический выход при окислении молекулы глюкозы, осуществляемом в максимально отлаженной энергетической системе, функционирующей в эукариотных клетках гликолиз—>ЦТК— -дыхательная цепь митохондрий. На первом этапе в процессе гликолитического разложения молекулы глюкозы образуются по 2 молекулы пирувата, АТФ и НАД Н2. Конечными продуктами реакции окислительного декарбоксилирования 2 молекул пирувата, катализируемой пируватдегидрогеназным комплексом, являются 2 молекулы ацетил-КоА и НАД Н2. Окисление 2 молекул ацетил-КоА в ЦТК приводит к образованию 6 молекул НАД Н2 и по 2 молекулы ФАД Н2 [c.366]Энергетический выход процесса таков образование 2 молекул АТФ на молекулу глюкозы. Энергетическая эффективность процесса, т.е. эффективность запасания выделяемой свободной энергии в молекулах АТФ, составляет примерно 40 %.

При получении этилового спирта из сахар-содержащих культур ОТЖИМ содержащего сахар сока ведется стандартными способами, Простые сахара из сахарного тростника можно получить механическим отжимом сока, а в случае сахарной свеклы— диффузионным методом. Крахмалистое сырье нужно механически измельчить до консистенции жидкого теста, а затем нагреть для разрушения крахмальных зерен. Далее можно применить различные варианты гидролиза, основанного на использовании разных сочет аний кислот и/или применении ферментов. Обычно для разжижения исходного продукта применяют термофильную (90 °С) бактериальную амилазу. На следующем этапе для осахаривания при 50—60 °С (т, е. гидролиза декстринов до глюкозы) используют глюкоамилазу. В пересчете на образовавшуюся глюкозу выход составляет 51% (по массе). Однако, поскольку около 5% сахара расходуется растущими клетками на энергетические нужды, а также на синтез других органических соединений (глицерола, уксусной кислоты, ацетальдегида и ряда других соединений, в основном высших спиртов), предельный выход составляет около 48% в пересчете на исходный сахар.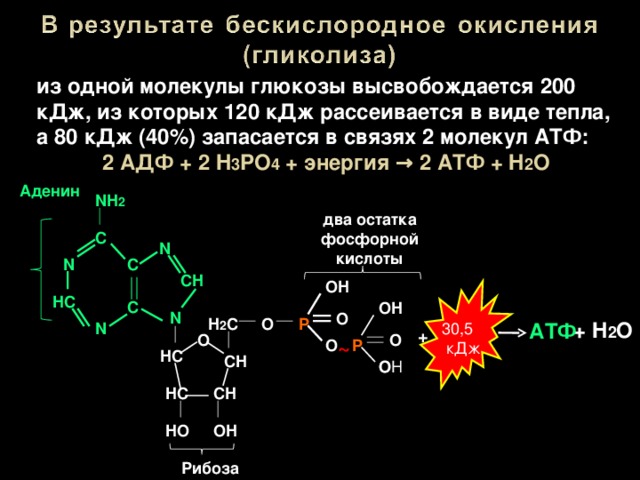
Как видно из уравнения, с точки зрения энергетического выхода оба процесса (гомоферментативное молочнокислое и спиртовое брожение) одинаковы. В обоих случаях сбраживание 1 молекулы глюкозы приводит к образованию 2 молекул АТФ. Процессы различаются природой конечных акцепторов электронов. Кроме того, если при гомоферментативном молочнокислом брожении образовавшаяся молочная кислота в целом по степени окисленности-восстановленности не отличается от молекулы гексозы (имеет место лишь внутримолекулярное перераспределение окисленности и [c.219]
У других гетероферментативных молочнокислых бактерий больший удельный вес занимают процессы, ведущие к накоплению уксусной кислоты. Образование уксусной кислоты из ацетилфосфата сопряжено с синтезом АТФ. Если брожение идет с образованием этанола, то выход энергии равен 1 молекуле АТФ на молекулу сброженной глюкозы если образуется уксусная кислота, то общий энергетический баланс процесса составляет 2 молекулы АТФ на молекулу глюкозы, т.е. такой же, как при гликолизе.
Образование уксусной кислоты из ацетилфосфата сопряжено с синтезом АТФ. Если брожение идет с образованием этанола, то выход энергии равен 1 молекуле АТФ на молекулу сброженной глюкозы если образуется уксусная кислота, то общий энергетический баланс процесса составляет 2 молекулы АТФ на молекулу глюкозы, т.е. такой же, как при гликолизе.
Таким образом, энергетический выход при окислении жирной кислоты в три раза больше, чем при окислении глюкозы (38 АТФ). Основную роль в окислении жирных кислот играет печень. [c.200]
Таким образом, в расчете на 1 моль глюкозы в аэробных условиях образуется 40 моль АТФ, из которых для составления полного энергетического баланса необходимо вычесть 2 моль АТФ, затрачиваемых на начальных реакциях гликолиза (1-я и 3-я стадии). В итоге чистый энергетический выход аэробного гликолиза составляет 38 моль АТФ на 1 моль глюкозы.
Собственно энергетической стороной процессов брожения яв—ляется их окислительная часть, поскольку реакции, ведущие к выделению энергии, — это реакции окисления. Существует несколько исключений ИЗ этого правила некоторые анаэробы часть энергии при сбраживании субстрата получают также в результате его расщепления, катализируемого лиазами. Примитивность процессов брожения заключается в том, что из субстрата в результате его анаэробного преобразования извлекается лишь незначительная доля той химической энергии, которая в нем содержится. Продукты, образующиеся в процессе брожения, все еще содержат в себе значительное количество энергии, заключавшейся в исходном субстрате. Чтобы четче представить разницу в энергетическом выходе процессов брожения н дыхания, приведем данные по изменению уровней стандартной свободной энергии для процессов гомоферментативного молочнокислого брожения и дыхания при одинаковом исходном энергетическом субстрате (глюкоза)
Существует несколько исключений ИЗ этого правила некоторые анаэробы часть энергии при сбраживании субстрата получают также в результате его расщепления, катализируемого лиазами. Примитивность процессов брожения заключается в том, что из субстрата в результате его анаэробного преобразования извлекается лишь незначительная доля той химической энергии, которая в нем содержится. Продукты, образующиеся в процессе брожения, все еще содержат в себе значительное количество энергии, заключавшейся в исходном субстрате. Чтобы четче представить разницу в энергетическом выходе процессов брожения н дыхания, приведем данные по изменению уровней стандартной свободной энергии для процессов гомоферментативного молочнокислого брожения и дыхания при одинаковом исходном энергетическом субстрате (глюкоза)
Как видно из приведенного уравнения, с точки зрения энергетического выхода оба процесса (гомоферментативное молочнокислое и спиртовое брожение) одинаковы. В обоих случаях сбраживание 1 молекулы глюкозы приводит к образованию 2 молекул АТФ.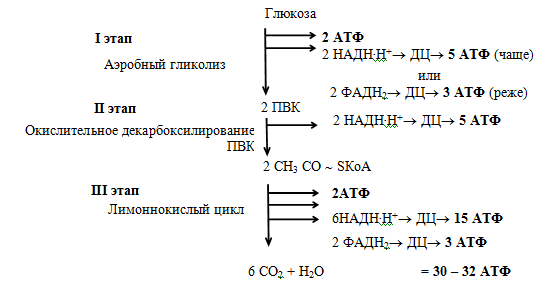
 Окисление 2 молекул аце-тил-КоА в ЦТК приводит к образованию 6 молекул НАД-Нг и по 2 молекулы ФАД-Нг и АТФ. Перенос каждой пары электронов с НАД-Нг, если принять Р/О равным 3, приводит к синтезу 30 молекул АТФ (2 молекулы НАД-Нг дает процесс гликолиза, 2 молекулы НАД-Нг — окислительное декарбоксилирование пирувата, 6 молекул НАД-Нг — ЦТК). Перенос каждой пары электронов с ФАД-Нг приводит к синтезу 2 молекул АТФ, т. е. при двух оборотах цикла эти дает 4 молекулы АТФ. К этому следует прибавить 2 молекулы АТФ, образуемые в процессе гликолиза, и 2 молекулы АТФ, синтезируемые в ЦТК на этапе превращения сукцинил-КоА в янтарную кислоту. Итак, полное окисление 1 молекулы глюкозы в максимальном варианте приводит к образованию 38 молекул АТФ.
Окисление 2 молекул аце-тил-КоА в ЦТК приводит к образованию 6 молекул НАД-Нг и по 2 молекулы ФАД-Нг и АТФ. Перенос каждой пары электронов с НАД-Нг, если принять Р/О равным 3, приводит к синтезу 30 молекул АТФ (2 молекулы НАД-Нг дает процесс гликолиза, 2 молекулы НАД-Нг — окислительное декарбоксилирование пирувата, 6 молекул НАД-Нг — ЦТК). Перенос каждой пары электронов с ФАД-Нг приводит к синтезу 2 молекул АТФ, т. е. при двух оборотах цикла эти дает 4 молекулы АТФ. К этому следует прибавить 2 молекулы АТФ, образуемые в процессе гликолиза, и 2 молекулы АТФ, синтезируемые в ЦТК на этапе превращения сукцинил-КоА в янтарную кислоту. Итак, полное окисление 1 молекулы глюкозы в максимальном варианте приводит к образованию 38 молекул АТФ. Энергетический выход гликолиза. При окислении одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. При этом за счет первого и второго субстратного фосфорилирования образуются четыре молекулы АТР. Однако две молекулы АТР тратятся на фосфорилирование гексозы на I этапе гликолиза. Таким образом, чистый выход глико-литического субстратного фосфорилирования составляет две молекулы АТР. [c.140]
Таким образом, чистый выход глико-литического субстратного фосфорилирования составляет две молекулы АТР. [c.140]
Итак, при окислении глюкозы в процессе дыхания при функционировании гликолиза и цикла Кребса в общей сложности образуются 38 молекул АТР (8 АТР связаны с гликолизом). Если принять, что энергия третьей сложноэфирной фосфатной связи АТР равняется 41,87 кДж/моль (10 ккал/моль), то энергетический выход гликолитического пухи аэробного дыхания составляет 1591 кДж/моль (380 ккал/моль), причем основное количество этой энергии — 1256 кДж/моль
Наконец, у бактерий Zymomonas mobilis с неясным систематическим положением, используемых в Мексике для получения национального спиртного напитка пульке , разложение глюкозы до пировинофадной кислоты идет по пути Энтнера—Дудорова. Дальнейшее превращение пирувата происходит с участием пируватдекарбоксилазы и алкогольдегидрогеназы. Выход продуктов брожения такой же, как при спиртовом брожении по гликолитическому пути по 2 молекулы спирта и СО2 на 1 молекулу сброженной глюкозы, но энергетический выход в два раза ниже, чем при гликолизе всего 1 молекула АТФ на 1 молекулу сброженной глюкозы.
Половина молекул ацетил-СоА расщепляется до ацетата через ацетилфосфат с образованием АТР. Другая половина молекул восстанавливается в две стадии в этанол, используя две молекулы NADH, образовавшиеся ранее при окислении триозофосфата [уравнение (9-27)]. Общий энергетический выход процесса составляет три молекулы АТР на одну молекулу глюкозы. Эффективность получается равной 3-34,5/225 = 46%. Часть глюкозы превращается также и в D-молочную и янтарную кислоты (рис. 9-9, е), отсюда и название смешанное кислое брожение. [c.350]
Убыль свободной энергии при превращении остатка глюкозы гликогена в молочную кислоту составляет 57 ккал. В трех одновременно синтезируемых молекулах АТФ остается пакопленной энергия 34,5 ккал, которая используется организмом для его жизнедеятельных функций, между прочим, для произведения мышечной работы (об этом процессе см. Аденозинтрифосфорная кислота ). Из приведенного выше видно, что при гликолизе в мышцах энергетический выход составляет 60%. [c.254]
[c.254]
При полном сгорании глюкозы в калориметрической бомбе выделяется количество тепла (—ДН), равное 674 ккал1моль. Изменение энтропии (tAs) (см. том I) составляет 12 ккал, так что общее понижение свободной энергии (—ДО) равно 686 ккал. Из них в биохимическом окислении глюкозы можно регенерировать примерно 67% в форме, пригодной для использования для произведения механической работы- или эндэргонных химических синтезов. Этот энергетический выход значительно превышает коэффициент полезного действия наилучших тепловых двигателей, построенных до настоящего времени. Основной функцией лимонной кислоты, безусловно, является производство энергии кроме того, она служит исходным соединением для получения промежуточных продуктов, необходимых для синтеза аминокислот и жирных кислот. [c.257]
Таким образом, еще до полной активации цикла Кребса потенциальный выход АТФ достигает 21 моля на 1 моль глюкозоб-фосфата и пролина. За счет гликолиза мышца позвоночного при сравнимых условиях получает 3 моля АТФ на 1 моль глю-козо-6-фосфата. Следовательно, благодаря сопряжению катаболизма глюкозы и пролина энергетический выход у насекомого в 6—7 раз превышает энергетический выход классического процесса в мышце позвоночного. [c.90]
Следовательно, благодаря сопряжению катаболизма глюкозы и пролина энергетический выход у насекомого в 6—7 раз превышает энергетический выход классического процесса в мышце позвоночного. [c.90]
Вместе с тем для ряда микрообъектов и, в частности, тех же животных клеток характерным является высокая пластичность энергетического обмена, заключающаяся в переключении его в условиях недостатка кислорода с дыхания на гликолиз. Этот процесс характеризуется изменением величины коэффициента метаболизма по кислороду (и, соответственно, также и по глюкозе). Хотя эти изменения могут и не отразиться на общем выходе биомассы, но полученная в таких условиях культура будет отличаться по своим физиологическим свойствам. В связи с этихМ возникает вопрос о пороговом значении коэффициента массопе-редачч. Ниже этого значения рост популяции будет ограничиваться недостатком энергии, возникающим при снижении скорости дыхания и уже не восполняемого за счет гликолиза, компенсаторные возможности которого не безграничны.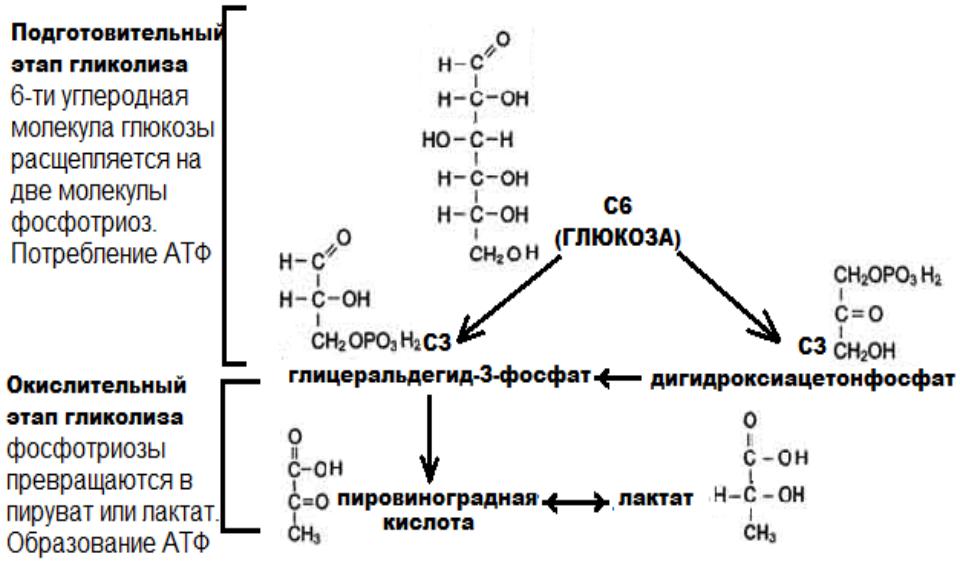 [c.280]
[c.280]
Была создана соответствующая установка, рассчитанная на переработку 885 т газетной бумаги в депь при выходе конечного продукта (глюкозы) 238 т 4%-ного раствора в день. Проектная производительность установки, работающей на сконцентрированных гидролизатах, содержащих не менее 14,3% сахаров, равнялась 81,5 т 95%)-него спирта в день, а ежедневное производство кормовых дрожжей, потребляющих отходы спиртового брожения,— 32,8 т. На основании показателей энергетического баланса производственных и эксплуатационных расходов, а также затрат, необходимых для организации производственного комплекса, этот способ утилизации газетной бумаги был признан рентабельным (Wilke et al., 1976). [c.180]
Ацетильный остаток окисляется в цитратном цикле. За счет окисления 8 моль ацетил-КоА, образующихся из пальмитиновой кислоты, может синтезироваться 96 моль АТФ. Полный выход АТФ при окислении 1 моль пальмитил-КоА составляет 131 моль. В АТФ запасается около 60 % всей энергии распада пальмитиновой кислоты до СО и Н О. При расчете на один атом углерода выход АТФ составляет 8Д для окисления пальмитата и 6,3 для окисления глюкозы таким образом, энергетическая емкость жирных кислот существенно больше, чем глюкозы. [c.291]
При расчете на один атом углерода выход АТФ составляет 8Д для окисления пальмитата и 6,3 для окисления глюкозы таким образом, энергетическая емкость жирных кислот существенно больше, чем глюкозы. [c.291]
Таким образом, одна высокоэнергетическая фосфатная связь расходуется при включении глюкозо-6-фосфата в гликоген. Выход энергии при распаде гликогена чрезвычайно высок. Около 90% остатков подвергаются фосфоролитическому расщеплению с образованием глюкозо-1-фосфа-та, который превращается в глюкозо-б-фосфат без энергетических затрат. Остальные 10% остатков принадлежат ветвям и расщепляются гидролитически. Одна молекула АТР используется для фосфорилирования каждой из этих молекул глюкозы в глюкозо-б-фосфат. Полное окисление глюкозо-б-фосфата дает тридцать семь [c.122]
Гликолиз
Гликолиз — Материал из Википедии
Глико́лиз (фосфотриозный путь, или шунт
Эмбдена — Мейерхофа, или путь
Эмбдена-Мейергофа-Парнаса ) — ферментативный
процесс последовательного расщепления
глюкозы в клетках, сопровождающийся
синтезом АТФ. Гликолиз при аэробных
условиях ведёт к образованию пировиноградной
кислоты (пирувата), гликолиз в анаэробных
условиях ведёт к образованию молочной
кислоты (лактата). Гликолиз является
основным путём катаболизма глюкозы в
организме животных.
Гликолиз при аэробных
условиях ведёт к образованию пировиноградной
кислоты (пирувата), гликолиз в анаэробных
условиях ведёт к образованию молочной
кислоты (лактата). Гликолиз является
основным путём катаболизма глюкозы в
организме животных.
Название «гликолиз» происходит от греч. γλυκός, glykos — сладкий и греч. λύσης, lysis — растворение.Содержание [убрать]
1 Общий обзор
2 Локализация
3 Результат
4 Путь
5 Дальнейшее развитие
6 Регуляция гликолиза
6.1 Регуляция гексокиназы
6.2 Регуляция фосфофруктокиназы
6.3 Пируваткиназа
7 Значение
8 См. также
9 Ссылки
Общий обзор
Гликолитический путь представляет собой 10 последовательных реакций, каждая из которых катализируется отдельным ферментом.
Процесс гликолиза условно можно разделить
на два этапа. Первый этап, протекающий
с расходом энергии 2 молекул АТФ,
заключается в расщеплении молекулы
глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое
окисление глицеральдегид-3-фосфата,
сопровождающееся синтезом АТФ. Сам по
себе гликолиз является полностью
анаэробным процессом, то есть не требует
для протекания реакций присутствия
кислорода.
На втором этапе происходит НАД-зависимое
окисление глицеральдегид-3-фосфата,
сопровождающееся синтезом АТФ. Сам по
себе гликолиз является полностью
анаэробным процессом, то есть не требует
для протекания реакций присутствия
кислорода.
Гликолиз — один из древнейших метаболических процессов, известный почти у всех живых организмов. Предположительно гликолиз появился более 3,5 млрд лет назад у первичных прокариотов.
[править]
Локализация
В клетках эукариотических организмов
десять ферментов, катализирующих распад
глюкозы до ПВК, находятся в цитозоле,
все остальные ферменты, имеющие отношение
к энергетическому обмену, — в митохондриях
и хлоропластах. Поступление глюкозы в
клетку осуществляется двумя путями:
натрий-зависимый симпорт (преимущественно
для энтероцитов и эпителия почечных
канальцев) и облегчённая диффузия
глюкозы с помощью белков-переносчиков.
Работа этих белков-транспортёров
контролируется гормонами и, в первую
очередь, инсулином. Сильнее всего инсулин
стимулирует транспорт глюкозы в мышцах
и жировой ткани.
[править]
Результат
Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД∙H.
Полное уравнение гликолиза имеет вид:
Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2h3O + 2Н+.
При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким:
Глюкоза + 2АДФ + 2Фн = 2лактат + 2АТФ + 2h3O.
Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ.
У аэробных организмов конечные продукты
гликолиза подвергаются дальнейшим
превращениям в биохимических циклах,
относящихся к клеточному дыханию. В
итоге после полного окисления всех
метаболитов одной молекулы глюкозы на
последнем этапе клеточного дыхания —
окислительном фосфорилировании,
происходящем на митохондриальной
дыхательной цепи в присутствии кислорода,
— дополнительно синтезируются ещё 34
или 36 молекулы АТФ на каждую молекулу
глюкозы.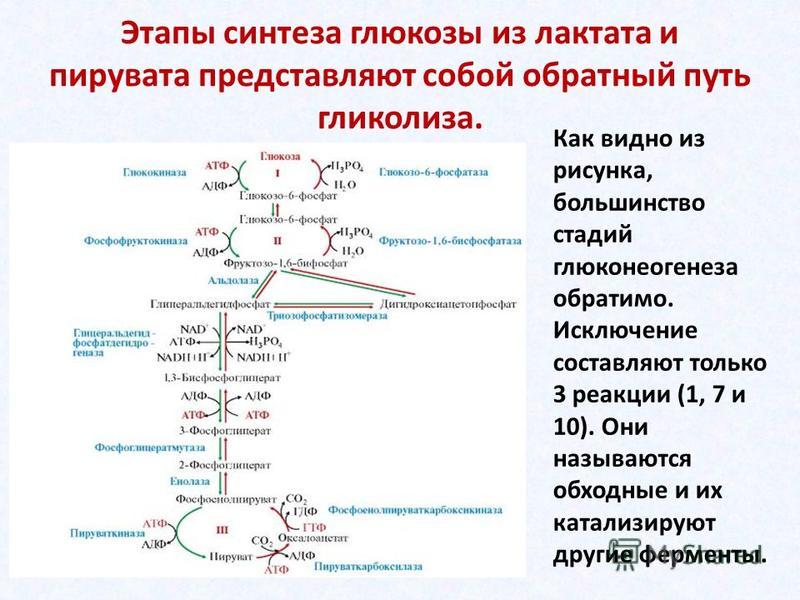
[править]
Путь
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецефичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы — глюкозо-6-фосфат (Г-6-Ф):
Для протекания реакции необходимо наличие в среде ионов Mg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует
две цели: во-первых, из-за того что
плазматическая мембрана, проницаемая
для нейтральной молекулы глюкозы, не
пропускает отрицательно заряженные
молекулы Г-6-Ф, фосфорилированная глюкоза
оказывается запертой внутри клетки.
Во-вторых, при фосфорилировании глюкоза
переводится в активную форму, способную
участвовать в биохимических реакциях
и включаться в метаболические циклы.
Фосфорилирование глюкозы — это
единственная реакция в организме, в
которой глюкоза участвует как таковая.
Печёночный изофермент гексокиназы — глюкокиназа — имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф):
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата (6):
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7) — образуется молекула АТФ:
Это первая реакция субстратного
фосфорилирования. С этого момента
процесс расщепления глюкозы перестаёт
быть убыточным в энергетическом плане,
так как энергетические затраты первого
этапа оказываются компенсированными:
синтезируются 2 молекулы АТФ (по одной
на каждый 1,3-дифосфоглицерат) вместо
двух потраченных в реакциях 1 и 3. Для
протекания данной реакции требуется
присутствие в цитозоле АДФ, то есть при
избытке в клетке АТФ (и недостатке АДФ)
её скорость снижается. Поскольку АТФ,
не подвергающийся метаболизму, в клетке
не депонируется а просто разрушается,
то эта реакция является важным регулятором
гликолиза.
С этого момента
процесс расщепления глюкозы перестаёт
быть убыточным в энергетическом плане,
так как энергетические затраты первого
этапа оказываются компенсированными:
синтезируются 2 молекулы АТФ (по одной
на каждый 1,3-дифосфоглицерат) вместо
двух потраченных в реакциях 1 и 3. Для
протекания данной реакции требуется
присутствие в цитозоле АДФ, то есть при
избытке в клетке АТФ (и недостатке АДФ)
её скорость снижается. Поскольку АТФ,
не подвергающийся метаболизму, в клетке
не депонируется а просто разрушается,
то эта реакция является важным регулятором
гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфоглицерат (8):
Енолаза образует фосфоенолпируват (9):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):
Реакция протекает под действием
пируваткиназы. Это последняя ключевая
реакция гликолиза.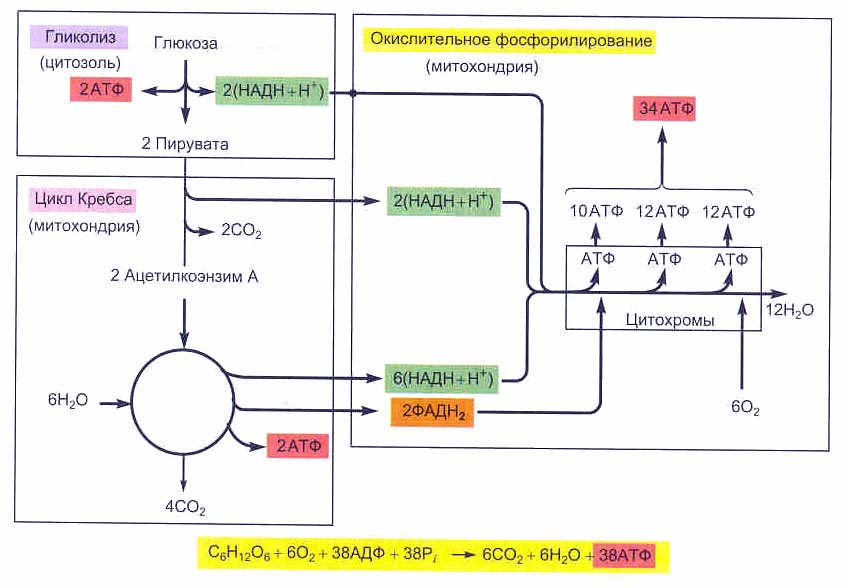 Изомеризация енольной
формы пирувата в пируват происходит
неферментативно.
Изомеризация енольной
формы пирувата в пируват происходит
неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10, в которых и происходит к субстратное фосфорилирование АДФ.
[править]
Дальнейшее развитие
Окончательная судьба пирувата и НАД∙H, образованных в процессе гликолиза зависит от организма и условий внутри клетки, в особенности от наличия или отсутствия кислорода или других акцепторов электронов.
У анаэробных организмов пируват и НАД∙H далее подвергаются брожению. При молочнокислом брожении, например, у бактерий пируват под действием фермента лактатдегидрогеназы восстанавливается в молочную кислоту. У дрожжей сходным процессом является спиртовое брожение, где конечными продуктами будут этанол и углекислый газ. Известно также маслянокислое и лимоннокислое брожение.
Маслянокислое брожение:
глюкоза → масляная кислота + 2 CO2 + 2 h3O.
Спиртовое брожение:
глюкоза → 2 этанол + 2 CO2.
Лимоннокислое брожение:
глюкоза → лимонная кислота + 2 h3O.
Брожение имеет важное значение в пищевой промышленности.
У аэробов пируват как правило попадает в цикл трикарбоновых кислот (цикл Кребса), а НАД∙H в итоге окисляется кислородом на дыхательной цепи в митохондриях в процессе окислительного фосфорилирования.
Несмотря на то, что метаболизм человека преимущественно аэробный, в интенсивно работающих скелетных мышцах наблюдается анаэробное окисление. В условиях ограниченного доступа кислорода пируват превращается в молочную кислоту, как происходит при молочнокислом брожении у многих микроорганизмов:
ПВК + НАД∙Н + H+ → лактат + НАД+.
Боли в мышцах, возникающие через некоторое время после непривычной интенсивной физической нагрузки, связаны с накоплением в них молочной кислоты.
Образование молочной кислоты является
тупиковой ветвью метаболизма, но не
является конечным продуктом обмена
веществ. Под действием лактатдегидрогеназы
молочная кислота окисляется снова,
образуя пируват, который и участвует в
дальнейших превращениях.
[править]
Регуляция гликолиза
Различают местную и общую регуляцию.
Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки.
Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм.
Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза.
Инсулин стимулирует гликолиз через:
активацию гексокиназной реакции;
стимуляцию фосфофруктокиназы;
стимуляцию пируваткиназы.
Также на гликолиз влияют и другие гормоны. Например, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоны являются стимуляторами.
Регуляция гликолиза осуществляется
через несколько ключевых этапов. Реакции,
катализируемые гексокиназой (1),
фосфофруктокиназой (3) и пируваткиназой
(10) отличаются существенным уменьшением
свободной энергии и являются практически
необратимыми, что позволяет им быть
эффективными точками регуляции гликолиза.
[править]
Регуляция гексокиназы
Гексокиназа ингибируется продуктом реакции — глюкозо-6-фосфатом, который аллостерически связывается с ферментом, изменяя его активность.
По причине того, что основная масса Г-6-Ф в клетке производится путём расщепления гликогена, гексокиназная реакция, по сути, для протекания гликолиза не является необходимой, и фосфорилирования глюкозы в регуляции гликолиза исключительной важности не имеет. Гексокиназная реакция является важным этапом регуляции концентрации глюкозы в крови и в клетке.
При фосфорилировании глюкоза теряет способность транспортироваться через мембрану молекулами-переносчиками, что создаёт условия для накопления её в клетке. Ингибирование гексокиназы Г-6-Ф ограничивает поступление глюкозы в клетку, предотвращая её чрезмерное накопление.
Глюкокиназа (IV изотип гексокиназы)
печени не ингибируется глюкозо-6-фосфатом,
и клетки печени продолжают накапливать
глюкозу даже при высоком содержании
Г-6-Ф, из которого в дальнейшем синтезируется
гликоген. По сравнению с другими изотипами
глюкокиназа отличается высоким значением
константы Михаэлиса, то есть на полную
мощность фермент работает только в
условиях высокой концентрации глюкозы,
которая бывает почти всегда после приёма
пищи.
По сравнению с другими изотипами
глюкокиназа отличается высоким значением
константы Михаэлиса, то есть на полную
мощность фермент работает только в
условиях высокой концентрации глюкозы,
которая бывает почти всегда после приёма
пищи.
Глюкозо-6-фосфат может превращаться обратно в глюкозу при действии глюкозо-6-фосфатазы. Ферменты глюкокиназа и глюкозо-6-фосфатаза участвуют в поддержании нормальной концентрации глюкозы в крови.
[править]
Регуляция фосфофруктокиназы
Интенсивность протекания фосфофруктокиназной реакции решающим образом сказывается на всей пропускной способности гликолиза, а стимуляция фосфофруктокиназы считается наиболее важным этапом регуляции.
Фосфофруктокиназа (ФФК) — это тетрамерный фермент, существующий поочерёдно в двух конформационных состояниях (R и T), которые находятся в равновесии и попеременно переходят из одного в другое. АТФ является одновременно и субстратом, и аллостерическим ингибитором ФФК.
В каждой из субъединиц ФФК имеется по
два центра связывания АТФ: субстратный
сайт и сайт ингибирования. Субстратный
сайт одинаково способен присоединять
АТФ при любой конформации тетрамера. В
то время как сайт ингибирования связывает
АТФ исключительно, когда фермент
находится в конформационном состоянии
T. Другим субстратом ФФК является
фруктозо-6-фосфат, который присоединяется
к ферменту предпочтительно в R-состоянии.
При высокой концентрации АТФ сайт
ингибирования занимается, переходы
между конформациями фермента становятся
невозможными, и большинство молекул
фермента оказываются стабилизированными
в T-состоянии, неспособном присоединить
Ф-6-Ф. Однако ингибирование фосфофруктокиназы
АТФ подавляется АМФ, который присоединяется
к R-конформациям фермента, стабилизируя
таким образом состояние фермента для
связывания Ф-6-Ф.
Субстратный
сайт одинаково способен присоединять
АТФ при любой конформации тетрамера. В
то время как сайт ингибирования связывает
АТФ исключительно, когда фермент
находится в конформационном состоянии
T. Другим субстратом ФФК является
фруктозо-6-фосфат, который присоединяется
к ферменту предпочтительно в R-состоянии.
При высокой концентрации АТФ сайт
ингибирования занимается, переходы
между конформациями фермента становятся
невозможными, и большинство молекул
фермента оказываются стабилизированными
в T-состоянии, неспособном присоединить
Ф-6-Ф. Однако ингибирование фосфофруктокиназы
АТФ подавляется АМФ, который присоединяется
к R-конформациям фермента, стабилизируя
таким образом состояние фермента для
связывания Ф-6-Ф.
Наиболее важным же аллостерическим регулятором гликолиза и глюконеогенеза является фруктозо-2,6-бифосфат, который не является промежуточным звеном этих циклов. Фруктозо-2,6-бифосфат аллостерически активирует фосфофруктокиназу.
Синтез фруктозо-2,6-бифосфата катализируется
особым бифункциональным ферментом —
фосфофруктокиназой-2/фруктозо-2,6-бифосфатазой
(ФФК-2/Ф-2,6-БФаза). В нефосфорилированной
форме белок известен как фосфофруктокиназа-2
и имеет каталитическую активность по
отношению к фруктозо-6-фосфату, синтезируя
фруктозо-2-6-бифосфат. В результате чего
значительно стимулируется активность
ФФК и сильно ингибируется активность
фруктозо-1,6-бифосфатазы. То есть при
условии активности ФФК-2 равновесие
этой реакции между гликолизом и
глюконеогенезом смещается в сторону
первого — синтезируется фруктозо-1,6-бифосфат.
В нефосфорилированной
форме белок известен как фосфофруктокиназа-2
и имеет каталитическую активность по
отношению к фруктозо-6-фосфату, синтезируя
фруктозо-2-6-бифосфат. В результате чего
значительно стимулируется активность
ФФК и сильно ингибируется активность
фруктозо-1,6-бифосфатазы. То есть при
условии активности ФФК-2 равновесие
этой реакции между гликолизом и
глюконеогенезом смещается в сторону
первого — синтезируется фруктозо-1,6-бифосфат.
В фосфорилированном виде бифункциональный фермент не обладает киназной активностью, а наоборот в его молекуле активируется сайт, который гидролизует Ф2,6БФ на Ф6Ф и неорганический фосфат. Метаболический эффект фосфорилирования бифункционального фермента состоит в том, что аллостерическая стимуляция ФФК прекращается, аллостерическое ингибирование Ф-1,6-БФазы ликвидируется и равновесие смещается в сторону глюконеогенеза. Продуцируется Ф6Ф и затем — глюкоза.
Взаимопревращения бифункционального
фермента осуществляются цАМФ-зависимой
протеинкиназой (ПК), которая в свою
очередь регулируется циркулирующими
в крови пептидными гормонами.
Когда в крови снижается концентрация глюкозы, тормозится также и образование инсулина, а выделение глюкагона напротив стимулируется, и его концентрация в крови резко повышается. Глюкагон (и другие контринсулярные гормоны) связываются с рецепторами плазматической мембраны клеток печени, вызывая активацию мембранной аденилатциклазы. Аденилатциклаза катализирует превращение АТФ в циклический АМФ. цАМФ связывается с регуляторной субъединицей протеинкиназы, вызывая высвобождение и активизацию её каталитических субъединиц, которые фосфорилирует ряд ферментов, включая и бифункциональную ФФК-2/Ф-2,6-БФазу. При этом в печени прекращается потребление глюкозы и активизируются глюконеогенез и гликогенолиз, восстанавливая нормогликемию.
[править]
Пируваткиназа
Следующим шагом, где осуществляется регуляция гликолиза, является последняя реакция — этап действия пируваткиназы. Для пируваткиназы также описан ряд изоферментов, имеющих особенности регуляции.
Печёночная пируваткиназа (L-тип)
регулируется при фосфорилировании,
аллстерическими эффекторами и путём
регуляции экспрессии генов. Фермент
ингибируется АТФ и ацетил-КоА и
активируется фруктозо-1,6-бифосфатом.
Ингибирование пируваткиназы АТФ
происходит подобно действию АТФ на ФФК.
Связывание АТФ с сайтом ингибирования
фермента уменьшает его сродство к
фосфоенолпирувату. Печёночная
пируваткиназа фосфорилируется и
ингибируется протеинкиназой, и таким
образом также находится под гормональным
контролем. Кроме того, активность
печёночной пируваткиназы регулируется
и количественно, то есть изменением
уровня его синтеза. Это медленная,
долговременная регуляция. Увеличение
в рационе углеводов стимулирует
экспрессию генов, кодирующих пируваткиназу,
в результате уровень фермента в клетке
повышается.
Фермент
ингибируется АТФ и ацетил-КоА и
активируется фруктозо-1,6-бифосфатом.
Ингибирование пируваткиназы АТФ
происходит подобно действию АТФ на ФФК.
Связывание АТФ с сайтом ингибирования
фермента уменьшает его сродство к
фосфоенолпирувату. Печёночная
пируваткиназа фосфорилируется и
ингибируется протеинкиназой, и таким
образом также находится под гормональным
контролем. Кроме того, активность
печёночной пируваткиназы регулируется
и количественно, то есть изменением
уровня его синтеза. Это медленная,
долговременная регуляция. Увеличение
в рационе углеводов стимулирует
экспрессию генов, кодирующих пируваткиназу,
в результате уровень фермента в клетке
повышается.
М-тип пируваткиназы, найденный в головном мозге, мышцах и других глюкозо-потребных тканях не регулируется протеинкиназой. Это принципиально в том, что метаболизм этих тканей определяется только внутренними потребностями и не зависит от уровня глюкозы в крови.
Мышечная пируваткиназа не подвержена
внешним влияниям, таким как понижение
уровня глюкозы в крови или выброс
гормонов. Внеклеточные условия, которые
приводят к фосфорилированию и ингибированию
печёночного изофермента, не изменяют
активность пируваткиназы М-типа. То
есть интенсивность гликолиза в
поперечнополосатой мускулатуре
определяется только условиями внутри
клетки и не зависит от общей регуляции.
Внеклеточные условия, которые
приводят к фосфорилированию и ингибированию
печёночного изофермента, не изменяют
активность пируваткиназы М-типа. То
есть интенсивность гликолиза в
поперечнополосатой мускулатуре
определяется только условиями внутри
клетки и не зависит от общей регуляции.
[править]
Значение
Гликолиз — катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтеза аланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках.
[править]
См. также
Гликолиз и дыхание • Джеймс Трефил, энциклопедия «Двести законов мироздания»
В основе метаболизма животных и других организмов лежат химические процессы извлечения энергии, накопленной углеводами.
В процессе фотосинтеза солнечная энергия запасается в химических связях углеводных молекул, из которых наиболее важную роль играет шестиуглеродный сахар глюкоза. После того как другие живые организмы используют эти молекулы в пищу, запасенная энергия выделяется и используется для метаболизма. Это происходит во время процессов гликолиза и дыхания. Весь химический процесс можно коротко описать так:
глюкоза + кислород → углекислый газ + вода + энергия
Чтобы лучше понять эти процессы, представьте себе, что организм «сжигает» углеводы, чтобы получить энергию.
Термин «гликолиз» образован при соединении слова лизис, означающего «расщепление», со словом глюкоза. Как следует из названия, процесс начинается с химического извлечения энергии посредством расщепления молекулы глюкозы на две части, каждая из которых содержит три атома углерода. В процессе гликолиза из каждой молекулы глюкозы получается две трехуглеродные молекулы пировиноградной кислоты. Кроме того, энергия глюкозы запасается в молекулах (см. Биологические молекулы), которые мы называем «энергетической валютой» клетки, — двух молекулах АТФ и двух молекулах НАДФ. Таким образом, уже на первой стадии гликолиза энергия высвобождается в такой форме, которая может быть использована клетками организма.
Кроме того, энергия глюкозы запасается в молекулах (см. Биологические молекулы), которые мы называем «энергетической валютой» клетки, — двух молекулах АТФ и двух молекулах НАДФ. Таким образом, уже на первой стадии гликолиза энергия высвобождается в такой форме, которая может быть использована клетками организма.
Дальнейший ход событий зависит от наличия или отсутствия кислорода в среде. При отсутствии кислорода пировиноградная кислота превращается в другие органические молекулы в ходе так называемых анаэробных процессов. Например, в клетках дрожжей пировиноградная кислота превращается в этанол. У животных, к которым относится и человек, при истощении запасов кислорода в мышцах пировиноградная кислота превращается в молочную кислоту — именно она вызывает так хорошо знакомое всем нам ощущение мышечной скованности после тяжелой физической нагрузки.
При наличии же кислорода энергия выделяется в процессе аэробного дыхания, когда пировиноградная кислота расщепляется на молекулы углекислого газа и воды с одновременным высвобождением оставшейся энергии, запасенной в углеводной молекуле. Дыхание происходит в специализированной клеточной органелле — митохондрии. Вначале отщепляется один углеродный атом пировиноградной кислоты. При этом образуется углекислый газ, энергия (она запасается в одной молекуле НАДФ) и двухуглеродная молекула — ацетильная группа. Затем реакционная цепь поступает в метаболический координационный центр клетки — цикл Кребса.
Дыхание происходит в специализированной клеточной органелле — митохондрии. Вначале отщепляется один углеродный атом пировиноградной кислоты. При этом образуется углекислый газ, энергия (она запасается в одной молекуле НАДФ) и двухуглеродная молекула — ацетильная группа. Затем реакционная цепь поступает в метаболический координационный центр клетки — цикл Кребса.
Цикл Кребса (его также называют циклом лимонной кислоты или циклом трикарбоновых кислот) является примером хорошо знакомого в биологии явления — химической реакции, которая начинается, когда определенная входящая молекула соединяется с другой молекулой, выполняющей функцию «помощника». Такая комбинация инициирует серию других химических реакций, в которых образуются молекулы-продукты и в конце воссоздается молекула-помощник, которая может начать весь процесс вновь. В цикле Кребса роль входящей молекулы играет ацетильная группа, образующаяся при расщеплении пировиноградной кислоты, а роль молекулы-помощника — четырехуглеродная молекула щавелевоуксусной кислоты. Во время первой химической реакции цикла эти две молекулы соединяются с образованием шестиуглеродных молекул лимонной кислоты (этой кислоте цикл обязан одним из своих названий). Далее происходят восемь химических реакций, в которых сначала образуются молекулы-переносчики энергии и углекислый газ, а затем новая молекула щавелевоуксусной кислоты. Для переработки энергии, запасенной в одной молекуле глюкозы, цикл Кребса нужно пройти дважды. Чистая прибыль оказывается равной двум молекулам АТФ, четырем молекулам углекислого газа и десяти другим молекулам-переносчикам энергии (о них немного позже). Углекислый газ, в конечном счете, диффундирует из митохондрии и выделяется при выдохе.
Во время первой химической реакции цикла эти две молекулы соединяются с образованием шестиуглеродных молекул лимонной кислоты (этой кислоте цикл обязан одним из своих названий). Далее происходят восемь химических реакций, в которых сначала образуются молекулы-переносчики энергии и углекислый газ, а затем новая молекула щавелевоуксусной кислоты. Для переработки энергии, запасенной в одной молекуле глюкозы, цикл Кребса нужно пройти дважды. Чистая прибыль оказывается равной двум молекулам АТФ, четырем молекулам углекислого газа и десяти другим молекулам-переносчикам энергии (о них немного позже). Углекислый газ, в конечном счете, диффундирует из митохондрии и выделяется при выдохе.
Цикл Кребса принципиально важен для жизни не только потому, что в нем образуется энергия. Помимо глюкозы в него могут вступать многие другие молекулы, также образующие пировиноградную кислоту. Например, когда вы соблюдаете диету, организму не хватает потребляемой вами глюкозы для поддержания метаболизма, поэтому в цикл Кребса, после предварительного расщепления, вступают липиды (жиры). Вот почему вы теряете вес. Кроме того, молекулы могут покидать цикл Кребса, чтобы принять участие в построении новых белков, углеводов и липидов. Таким образом, цикл Кребса может принимать энергию, сохраненную в разной форме во многих молекулах, и создавать на выходе разнообразные молекулы.
Вот почему вы теряете вес. Кроме того, молекулы могут покидать цикл Кребса, чтобы принять участие в построении новых белков, углеводов и липидов. Таким образом, цикл Кребса может принимать энергию, сохраненную в разной форме во многих молекулах, и создавать на выходе разнообразные молекулы.
С энергетической точки зрения чистый результат цикла Кребса состоит в том, чтобы завершить извлечение энергии, запасенной в химических связях глюкозы, передать небольшую часть этой энергии молекулам АТФ и запасти остальную энергию в других молекулах-переносчиках энергии. (Говоря об энергии химических связей, не надо забывать, что для разделения соединенных атомов необходимо совершить работу.) На заключительном этапе дыхания эта оставшаяся энергия высвобождается из молекул-переносчиков и также запасается в АТФ. Молекулы, запасающие энергию, перемещаются внутри митохондрии, пока не столкнутся со специализированными белками, погруженными во внутренние мембраны митохондрии. Эти белки отнимают электроны у переносчиков энергии и начинают передавать их по цепи молекул — наподобие цепочки людей, передающих ведра с водой на пожаре, — извлекая энергию, запасенную в химических связях. Извлеченная на каждом этапе энергия запасается в форме АТФ. На последнем этапе электроны соединяются с атомами кислорода, которые далее объединяются с ионами водорода (протонами), образуя воду. В цепи переноса электронов образуется не менее 32 молекул АТФ — 90% энергии, хранившейся в исходной молекуле глюкозы.
Извлеченная на каждом этапе энергия запасается в форме АТФ. На последнем этапе электроны соединяются с атомами кислорода, которые далее объединяются с ионами водорода (протонами), образуя воду. В цепи переноса электронов образуется не менее 32 молекул АТФ — 90% энергии, хранившейся в исходной молекуле глюкозы.
Превращение энергии в цикле Кребса включает в себя довольно сложный процесс хемиосмотического сопряжения. Этот термин указывает на то, что в высвобождении энергии наряду с химическими реакциями участвует осмос — медленное просачивание растворов через органические перегородки. По сути дела, электроны с переносчиков энергии, являющихся продуктом цикла Кребса, переносятся по транспортной цепочке и поступают на белки, погруженные в мембрану, которая разделяет внутренний и внешний компартменты (отсеки) митохондрии. Энергия электронов используется для перемещения ионов водорода (протонов) во внешний компартмент, служащий «энергохранилищем» — наподобие водохранилища, образовавшегося перед плотиной.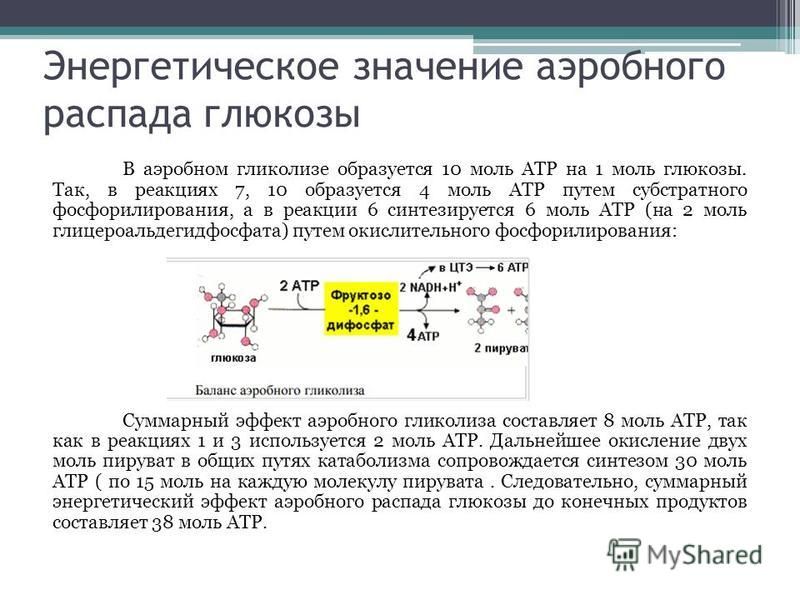 При оттоке протонов через мембрану энергия используется для образования АТФ, подобно тому как вода перед плотиной используется для производства электричества при падении на генератор. Наконец, во внутреннем компартменте митохондрии ионы водорода соединяются с молекулами кислорода с образованием воды — одного из конечных продуктов метаболизма.
При оттоке протонов через мембрану энергия используется для образования АТФ, подобно тому как вода перед плотиной используется для производства электричества при падении на генератор. Наконец, во внутреннем компартменте митохондрии ионы водорода соединяются с молекулами кислорода с образованием воды — одного из конечных продуктов метаболизма.
Этот рассказ о гликолизе и дыхании иллюстрирует, насколько далеко зашли современные представления о живых системах. Простое высказывание о конкретном процессе — например, что для метаболизма необходимо «сжигать» углеводы — влечет за собой невероятно подробное описание сложных процессов, происходящих на молекулярном уровне и с участием огромного количества различных молекул. Осмысление современной молекулярной биологии в чем-то сродни чтению классического русского романа: вам легко понять каждое взаимодействие между персонажами, но, дойдя до страницы 1423, вы вполне можете забыть, кем приходится Петр Петрович Алексею Алексеевичу. Точно так же каждая химическая реакция в только что описанной цепи кажется понятной, но дочитав до конца вы будете поражены непостижимой сложностью процесса. В качестве утешения замечу, что я чувствую себя так же.
В качестве утешения замечу, что я чувствую себя так же.
См. также:
Журнал СТМ — Html View
М.М. Лукина, М.В. Ширманова, Т.Ф. Сергеева, Е.В. Загайнова
Ключевые слова: метаболический имиджинг; энергетический метаболизм; время жизни флюоресценции; редокс-отношение; НАДН; ФАД; окислительное фосфорилирование; гликолиз; опухолевые клетки.
Рассмотрены основные подходы к изучению энергетического обмена в опухолевых клетках, основанные на флюоресцентной визуализации кофакторов НАДН и ФАД. Понятие «метаболический имиджинг» охватывает ряд современных флюоресцентных методов, позволяющих регистрировать НАДН и ФАД по интенсивности и/или времени жизни флюоресценции. Данные кофакторы играют важную роль в реакциях энергетического метаболизма в качестве переносчиков электронов и, обладая флюоресценцией, служат основой для анализа метаболических процессов в живых клетках и тканях, без применения дополнительных красителей. Особое внимание уделяется описанию метаболических изменений, сопутствующих канцерогенезу. Многочисленные примеры использования метаболического имиджинга на культурах клеток in vitro, опухолях животных и человека in vivo, а также биопсийных образцах опухолей пациентов демонстрируют его высокую востребованность в биомедицинских исследованиях онкологической направленности.
Особое внимание уделяется описанию метаболических изменений, сопутствующих канцерогенезу. Многочисленные примеры использования метаболического имиджинга на культурах клеток in vitro, опухолях животных и человека in vivo, а также биопсийных образцах опухолей пациентов демонстрируют его высокую востребованность в биомедицинских исследованиях онкологической направленности.
Для поддержания гомеостаза клеткам необходима энергия. Все процессы жизнедеятельности клетки, такие как создание градиентов концентрации, движение цитоскелета, репарация ДНК, транскрипция, трансляция и везикулярный транспорт, являются энергозависимыми. Известно, что энергетический обмен нормальных клеток существенно отличается от метаболизма клеток при тех или иных заболеваниях. Поэтому метаболический статус может служить индикатором диагностики, а также визуализации ответа на лечение патологических процессов. В связи с широкой распространенностью онкологических заболеваний оценка метаболического фенотипа опухолевых клеток особенно актуальна.
Развитие технологий оптической визуализации открыло возможность неинвазивного анализа метаболических кофакторов НАДН и ФАД в живых опухолевых клетках с высоким пространственным разрешением (до нескольких сот нанометров) без применения дополнительных красителей и без существенного влияния на биохимическое и физиологическое состояние клеток. Понятие «метаболический имиджинг» охватывает ряд современных флюоресцентных методов, позволяющих визуализировать НАДН и ФАД по интенсивности и/или времени жизни их флюоресценции.
В представленном обзоре охарактеризованы особенности энергетического метаболизма опухолей, описаны два ключевых подхода к оценке метаболического статуса — анализ отношения интенсивностей флюоресценции кофакторов (редокс-отношение) и времени жизни их флюоресценции. Приведены многочисленные примеры использования метаболического имиджинга в исследовании онкологических процессов на культурах клеток in vitro, опухолях животных и человека in vivo, а также биопсийных образцах опухолей пациентов.
Кофакторы НАДН и ФАД и их роль в энергетическом метаболизме клетки
Важнейшие пути энергетического метаболизма клетки, такие как гликолиз и окислительное фосфорилирование, связаны с процессами клеточного дыхания и синтезом АТФ. В роли доноров и акцепторов электронов в реакциях образования АТФ выступают кофакторы НАДН и ФАД, которые присутствуют в клетке в окисленной (НАД+, ФАД) или восстановленной формах (НАДН, ФАДН2) [1–7].
В процессе гликолиза молекула глюкозы распадается на две молекулы пирувата, при этом две молекулы НАД+ восстанавливаются до двух молекул НАДН и образуются две молекулы АТФ в реакциях субстратного фосфорилирования [8, 9]:
С6H12О6+2АДФ+2H3PO4+2НАД+=2C3H4O3+2НАДН2+2АТФ+2Н2О.
Затем молекула пирувата может быть транспортирована в митохондрии, где она преобразуется в ацетил-коэнзим А в результате реакций дегидрирования и декарбоксилирования. Эти реакции протекают при помощи мультиферментного пируватдегидрогеназного комплекса, состоящего из трех ферментов: пируватдекарбоксилазы, дигидролипоилтрансацетилазы и дигидролипоилдегидрогеназы (LiрDH), а также пяти коферментов: тиаминдифосфата, липоевой кислоты, ФАД, НАД+ и коэнзима А. Впоследствии ацетил-коэнзим А вступает в цикл Кребса. Многочисленные дегидрогеназные комплексы в митохондриях играют важную роль в регулировании соотношения НАД+/НАДН и пула НАДН, который служит донором электронов и протонов для дыхательной цепи митоходрий [10–13].
Окислительное фосфорилирование является самым эффективным способом производства АТФ, НАДН — первичным донором, а ФАД — первичным акцептором электронов и протонов в дыхательной цепи митохондрий. В результате реакций гликолиза и цикла Кребса распад одной молекулы глюкозы может привести к образованию до 10 молекул НАДН. В процессе тканевого дыхания электроны и протоны от НАДН через комплексы дыхательной цепи транспортируются на кислород, при этом НАДН окисляется до НАД+, а протоны поступают из матрикса митохондрий в межмембранное пространство, что приводит к созданию протонного градиента (электрохимического потенциала). Энергия электрохимического потенциала используется для синтеза АТФ при обратном транспорте протонов в матрикс митохондрий с помощью АТФ-синтазы [14–16].
В результате реакций гликолиза и цикла Кребса распад одной молекулы глюкозы может привести к образованию до 10 молекул НАДН. В процессе тканевого дыхания электроны и протоны от НАДН через комплексы дыхательной цепи транспортируются на кислород, при этом НАДН окисляется до НАД+, а протоны поступают из матрикса митохондрий в межмембранное пространство, что приводит к созданию протонного градиента (электрохимического потенциала). Энергия электрохимического потенциала используется для синтеза АТФ при обратном транспорте протонов в матрикс митохондрий с помощью АТФ-синтазы [14–16].
Обобщающая схема участия НАДН и ФАД в реакциях энергетического обмена в клетке выглядит следующим образом (рис. 1) [17].
| Рис. 1. Схема участия метаболических кофакторов НАДН и ФАД в энергетическом обмене клетки [17] |
Коферменты НАДН и ФАД способны флюоресцировать (рис. 2). Спектр возбуждения НАДН лежит в районе 300–400 нм с пиком на длине волны 355 нм, спектр эмиссии — в районе 400–600 нм с максимумом на λ=470 нм. У ФАД спектр возбуждения флюоресценции находится в диапазоне 350–500 нм с двумя максимумами — на 370 и 450 нм, спектр эмиссии — в диапазоне 500–600 нм с максимумом на λ=525 нм [18–21].
2). Спектр возбуждения НАДН лежит в районе 300–400 нм с пиком на длине волны 355 нм, спектр эмиссии — в районе 400–600 нм с максимумом на λ=470 нм. У ФАД спектр возбуждения флюоресценции находится в диапазоне 350–500 нм с двумя максимумами — на 370 и 450 нм, спектр эмиссии — в диапазоне 500–600 нм с максимумом на λ=525 нм [18–21].
| Рис. 2. Спектры поглощения и флюоресценции НАДН (а) и ФАД (б) |
Фосфорилированная форма НАДН (НАДФН) имеет те же спектральные характеристики, что и нефосфорилированная НАДН, однако непосредственно в реакциях энергетического метаболизма не участвует. Основным источником НАДФН в клетке является пентозофосфатный путь (за исключением тканей, в которых активно идет синтез жирных кислот и стероидов, где вклад в производство НАДФН вносят и другие реакции). НАДФН принимает участие в биосинтезе жирных кислот, каротиноидов и стероидов.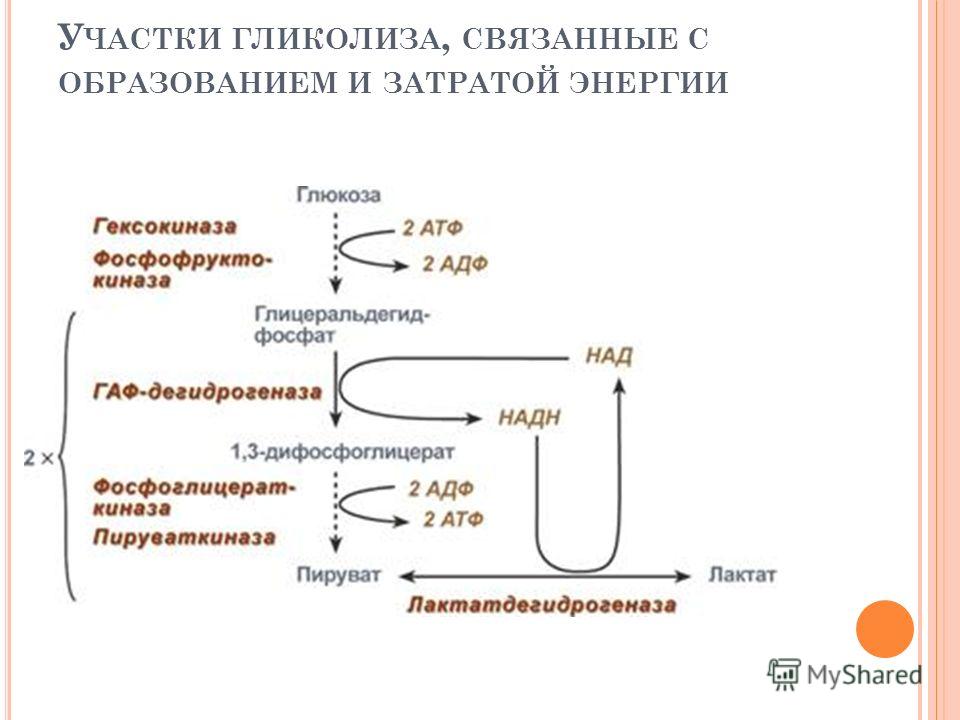 Также НАДФН имеет большое значение для антиоксидантных систем, в частности аскорбат-глутатионового цикла, и регулирует процессы передачи клеточных сигналов. Окисленная форма НАДФ+ поддерживает гомеостаз Ca2+ в клетке [4–7]. По данным ряда работ, концентрация НАДФН в клетке в десятки раз ниже, чем НАДН, а квантовый выход флюоресценции — в 1,25–2,5 раза меньше [21–23]. При анализе энергетического метаболизма вклад НАДФН, как правило, не учитывается.
Также НАДФН имеет большое значение для антиоксидантных систем, в частности аскорбат-глутатионового цикла, и регулирует процессы передачи клеточных сигналов. Окисленная форма НАДФ+ поддерживает гомеостаз Ca2+ в клетке [4–7]. По данным ряда работ, концентрация НАДФН в клетке в десятки раз ниже, чем НАДН, а квантовый выход флюоресценции — в 1,25–2,5 раза меньше [21–23]. При анализе энергетического метаболизма вклад НАДФН, как правило, не учитывается.
НАДН находится в клетке в свободном и связанном с белками состоянии. Свободная форма локализуется в цитозоле и отличается от связанной с белком формы спектром эмиссии (сдвинут в более красную область на 20 нм). Основная флюоресценция в синем диапазоне испускается связанной формой НАДН, локализованной в митохондриях, тогда как вклад свободной формы относительно мал [18]. При этом квантовый выход НАДН увеличивается примерно в четыре раза в связанном с белками состоянии [20].
ФАД в клетке связан с ферментами митохондрий, называемыми флавопротеинами. Флюоресценция ФАД тушится большинством этих ферментов, в том числе сукцинатдегидрогеназой, которая является ключевым ферментом цикла трикарбоновых кислот и вторым комплексом дыхательной цепи митохондрий. Около 50% флюоресценции ФАД испускается LipDH-содержащими ферментативными комплексами, 25% — электронным переносчиком флавопротеином, который служит посредником, принимая электроны и протоны от жирных кислот в процессе β-окисления и транспортируя их к пулу убихинона. Хотя флавопротеины не участвуют непосредственно в метаболизме глюкозы, они могут тушить флюоресценцию ФАД при изменении окислительно-восстановительного статуса клетки [10, 11, 24, 25]. Последние 25% флюоресценции ФАД испускаются дитионитом натрия и не связаны с метаболизмом [10]. Отношение связанной формы ФАД к ФАДН2 увеличивается по мере роста скорости протекания реакций цикла Кребса и уменьшается по мере снижения скорости окисления НАДН в электронно-транспортной цепи митохондрий [26].
Понимание роли НАДН и ФАД в метаболических реакциях клетки имеет большое значение для правильной интерпретации данных, полученных на основе флюоресцентного анализа. Если НАДН локализован в основном в митохондриях и участвует преимущественно в энергетическом обмене клетки, то ФАД содержится как в цитоплазме, так и в митохондриях и задействован помимо окислительного фосфорилирования в различных биохимических процессах (утилизация глутатиона, липогенез, перекисное окисление липидов, антиоксидантные реакции, синтез ацетил-коэнзима А, аскорбат-глутатионовый цикл, пентозофосфатный цикл), что значительно усложняет анализ данных [4, 13, 21, 27].
Метаболические особенности опухолевых клеток
Опухолевые клетки характеризуются активной неконтролируемой пролиферацией, в связи с чем их энергетический метаболизм имеет некоторые особенности по сравнению с нормальными тканями. В отличие от нормальных клеток, у которых основным способом синтеза АТФ является окислительное фосфорилирование, у большинства раковых клеток повышен уровень гликолиза.
В отличие от нормальных клеток, у которых основным способом синтеза АТФ является окислительное фосфорилирование, у большинства раковых клеток повышен уровень гликолиза.
Характерной особенностью многих солидных опухолей является гипоксия, которая возникает в результате дисбаланса между поступлением кислорода и его потреблением в ткани. Считается, что уровень кислорода в гипоксичных опухолях ниже, чем в соответствующих нормальных тканях, и в среднем составляет 1–2% и ниже. Основными факторами развития гипоксии в опухоли являются атипичная структура микрососудов, большие расстояния между кровеносными сосудами и опухолевыми клетками, что ограничивает поступление кислорода путем диффузии, а также пониженный транспорт кислорода кровью в связи с анемией. Многочисленные исследования последних двух десятилетий показали, что гипоксия играет существенную роль в опухолевой прогрессии и является неблагоприятным фактором прогноза лечения [28–30]. Гипоксия индуцирует множество сложных сигнальных путей, включая HIF, PI3K/AKT/mTOR, MARK, NF-kB, вовлеченных в регуляцию пролиферации, апоптоза, воспаления, миграции, выживания и метаболизма. Среди них наибольшая роль в регуляции метаболизма принадлежит HIF1 и mTOR [31–33]. Транскрипционный фактор HIF1 является главным регулятором метаболизма глюкозы в условиях гипоксии. Он может способствовать деградации митохондрий через BNIP3-зависимую аутофагию, а также блокировать биосинтез митохондрий, ингибируя активность фактора транскрипции MYC. Путь mTOR принимает участие в запуске реакций гликолиза, биосинтеза липидов, аминокислот, нуклеотидов и белков. В результате в условиях пониженной оксигенации опухолевые клетки не способны к запуску реакций окислительного фосфорилирования, что вынуждает их переходить на гликолиз [28, 34–36].
Гипоксия индуцирует множество сложных сигнальных путей, включая HIF, PI3K/AKT/mTOR, MARK, NF-kB, вовлеченных в регуляцию пролиферации, апоптоза, воспаления, миграции, выживания и метаболизма. Среди них наибольшая роль в регуляции метаболизма принадлежит HIF1 и mTOR [31–33]. Транскрипционный фактор HIF1 является главным регулятором метаболизма глюкозы в условиях гипоксии. Он может способствовать деградации митохондрий через BNIP3-зависимую аутофагию, а также блокировать биосинтез митохондрий, ингибируя активность фактора транскрипции MYC. Путь mTOR принимает участие в запуске реакций гликолиза, биосинтеза липидов, аминокислот, нуклеотидов и белков. В результате в условиях пониженной оксигенации опухолевые клетки не способны к запуску реакций окислительного фосфорилирования, что вынуждает их переходить на гликолиз [28, 34–36].
Опухолевые клетки в отличие от нормальных используют гликолиз даже при нормальных условиях оксигенации. Данный эффект был открыт в 1920-х гг. немецким физиологом Отто Варбургом и получил название аэробного гликолиза, или эффекта Варбурга [37–39]. Варбург считал, что преобладание гликолиза в присутствии кислорода обусловлено необратимыми нарушениями функций митохондрий. Как было обнаружено позже, в действительности лишь некоторые опухолевые линии имеют митохондриальные дисфункции, такие как пониженная экспрессия белков-переносчиков и ферментов, участвующих в окислительно-восстановительных реакциях, укороченный цикл трикарбоновых кислот, сниженное количество митохондрий, нарушение структуры комплексов дыхательной цепи, повышенное количество ингибиторов митохондриальной АТФ-синтазы и высокая чувствительность мДНК к окислительному стрессу. Показано, что при ингибировании реакций гликолиза многие опухолевые клетки восстанавливают работу митохондрий и переходят на окислительное фосфорилирование [40–44].
немецким физиологом Отто Варбургом и получил название аэробного гликолиза, или эффекта Варбурга [37–39]. Варбург считал, что преобладание гликолиза в присутствии кислорода обусловлено необратимыми нарушениями функций митохондрий. Как было обнаружено позже, в действительности лишь некоторые опухолевые линии имеют митохондриальные дисфункции, такие как пониженная экспрессия белков-переносчиков и ферментов, участвующих в окислительно-восстановительных реакциях, укороченный цикл трикарбоновых кислот, сниженное количество митохондрий, нарушение структуры комплексов дыхательной цепи, повышенное количество ингибиторов митохондриальной АТФ-синтазы и высокая чувствительность мДНК к окислительному стрессу. Показано, что при ингибировании реакций гликолиза многие опухолевые клетки восстанавливают работу митохондрий и переходят на окислительное фосфорилирование [40–44].
Переход опухолевых клеток на гликолитический тип метаболизма вызван рядом причин.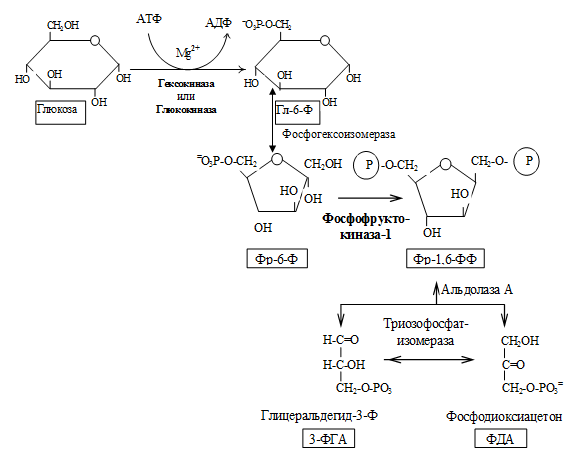 Во-первых, в основе этого лежит высокая потребность опухолевых клеток в синтезе макромолекул для активного роста. Именно в результате гликолиза образуются мономеры, необходимые для синтеза нуклеиновых кислот, белков и липидов. Во-вторых, при гликолизе понижено образование свободных радикалов, что снижает уровень генотоксических повреждений в клетке и способствует уходу от апоптоза [8, 26, 41, 45, 46]. В-третьих, продуктом гликолиза является лактат, который транспортируется в межклеточное пространство. Известно, что кислая среда способствует опухолевой инвазии и метастазированию. Кроме того, высокая концентрация АТФ неблагоприятна для опухолевых клеток, поскольку подавляет гликолиз, ингибируя фосфофруктокиназу-1 и пируваткиназу [40].
Во-первых, в основе этого лежит высокая потребность опухолевых клеток в синтезе макромолекул для активного роста. Именно в результате гликолиза образуются мономеры, необходимые для синтеза нуклеиновых кислот, белков и липидов. Во-вторых, при гликолизе понижено образование свободных радикалов, что снижает уровень генотоксических повреждений в клетке и способствует уходу от апоптоза [8, 26, 41, 45, 46]. В-третьих, продуктом гликолиза является лактат, который транспортируется в межклеточное пространство. Известно, что кислая среда способствует опухолевой инвазии и метастазированию. Кроме того, высокая концентрация АТФ неблагоприятна для опухолевых клеток, поскольку подавляет гликолиз, ингибируя фосфофруктокиназу-1 и пируваткиназу [40].
На сегодняшний день установлено, что энергетический метаболизм опухолевых клеток представляет собой баланс между гликолизом и окислительным фосфорилированием, а теория «чистого гликолиза» в опухоли опровергнута. В опытах со снижением уровня кислорода показано, что ни одна опухолевая клетка не может существовать только посредством гликолиза. Ряд глиом, гепатом и клеточные линии рака молочной железы используют реакции окислительного фосфорилирования в качестве основного источника АТФ (хотя их метаболический фенотип меняется в условиях гипоксии). Считается, что максимальный вклад гликолиза в производство АТФ в опухолевых клетках составляет не более 50–60%, а в некоторых случаях уровень окислительного фосфорилирования в опухолевых клетках даже выше, чем в окружающих стромальных клетках [9, 41, 42, 47]. Кроме того, некоторые опухолевые клетки способны обратимо переключаться между гликолизом и окислительным фосфорилированием в зависимости от наличия глюкозы в среде [9, 42]. Сами опухоли метаболически гетерогенны, и соотношение выработки АТФ путем гликолиза и окислительного фосфорилирования может варьировать в широких пределах между различными клетками одного опухолевого узла [41, 48].
В опытах со снижением уровня кислорода показано, что ни одна опухолевая клетка не может существовать только посредством гликолиза. Ряд глиом, гепатом и клеточные линии рака молочной железы используют реакции окислительного фосфорилирования в качестве основного источника АТФ (хотя их метаболический фенотип меняется в условиях гипоксии). Считается, что максимальный вклад гликолиза в производство АТФ в опухолевых клетках составляет не более 50–60%, а в некоторых случаях уровень окислительного фосфорилирования в опухолевых клетках даже выше, чем в окружающих стромальных клетках [9, 41, 42, 47]. Кроме того, некоторые опухолевые клетки способны обратимо переключаться между гликолизом и окислительным фосфорилированием в зависимости от наличия глюкозы в среде [9, 42]. Сами опухоли метаболически гетерогенны, и соотношение выработки АТФ путем гликолиза и окислительного фосфорилирования может варьировать в широких пределах между различными клетками одного опухолевого узла [41, 48].
Таким образом, метаболическая активность опухолевых клеток представляет собой сложный процесс, который помогает адаптироваться раковым клеткам к различным условиям окружающей среды, а также к их изменениям [42, 49–51].
Редокс-отношение как показатель метаболического статуса
Принцип и методы регистрации редокс-отношения. Так как НАДН и ФАД — единственные переносчики электронов, которые способны к флюоресценции, соотношение интенсивностей их флюоресценции может служить параметром для оценки метаболического статуса клетки и ткани. Отношение окисленных электронных переносчиков к восстановленным называется редокс-отношением (redox ratio). Данный подход был предложен В. Chance и его коллегами [26, 52]. В литературе встречаются различные варианты расчета редокс-отношения:
ФАД/(НАДН+ФАД) [53–56];
ФАД/НАДН [22, 57–60];
НАДН/ФАД [61–63].
Выбор формулы подсчета редокс-отношения часто зависит от соотношения интенсивности флюоресценции кофакторов, вида объекта исследования и метода регистрации [63, 64].
Поскольку основная масса НАДН образуется при гликолизе, а ФАД — при окислительном фосфорилировании, низкое редокс-отношение указывает на высокую метаболическую активность клетки и преобладание гликолитического пути над окислительным фосфорилированием. Помимо увеличения гликолиза в пролиферирующих опухолевых клетках активно протекают реакции цикла Кребса, промежуточные продукты которого могут быть выведены из цикла для синтеза различных соединений. Увеличение гликолиза и/или цикла Кребса по сравнению с окислительным фосфорилированием приводит к аккумуляции НАДН. Если интенсивность флюоресценции НАДН увеличена, значит клетка имеет большой метаболический потенциал для производства АТФ с помощью реакций окислительного фосфорилирования. Увеличение концентрации НАДН является характерной особенностью опухолевых клеток [65, 66].
Снижение интенсивности флюоресценции НАДН и увеличение ФАД (высокое редокс-отношение) свидетельствует о высокой потребности в АТФ и преобладании окислительного фосфорилирования. Для нормальной клетки в стандартных условиях с оптимальным содержанием питательных веществ и кислорода увеличение потребности в АТФ приводит к росту редокс-отношения. Это связано с окислением НАДН до НАД+ в процессе окислительного фосфорилирования. В условиях гипоксии при недостатке кислорода, который служит конечным акцептором электронов в дыхательной цепи митохондрий, протекание реакций окислительного фосфорилирования становится невозможным, при этом увеличивается концентрация НАДН. Чтобы удовлетворить потребность в АТФ, клетка переходит на анаэробный гликолиз, в результате которого НАД+ восстанавливается до НАДН с образованием пирувата и АТФ. Отсутствие окисления НАДН через электронно-транспортную цепь и увеличение концентрации НАДН в результате гликолиза приводит к росту интенсивности флюоресценции НАДН в клетке при гипоксии [26, 52, 67].
Для нормальной клетки в стандартных условиях с оптимальным содержанием питательных веществ и кислорода увеличение потребности в АТФ приводит к росту редокс-отношения. Это связано с окислением НАДН до НАД+ в процессе окислительного фосфорилирования. В условиях гипоксии при недостатке кислорода, который служит конечным акцептором электронов в дыхательной цепи митохондрий, протекание реакций окислительного фосфорилирования становится невозможным, при этом увеличивается концентрация НАДН. Чтобы удовлетворить потребность в АТФ, клетка переходит на анаэробный гликолиз, в результате которого НАД+ восстанавливается до НАДН с образованием пирувата и АТФ. Отсутствие окисления НАДН через электронно-транспортную цепь и увеличение концентрации НАДН в результате гликолиза приводит к росту интенсивности флюоресценции НАДН в клетке при гипоксии [26, 52, 67].
Для регистрации флюоресценции НАДН и ФАД используются методы флюоресцентного имиджинга с одно- и двухфотонным возбуждением [26, 56].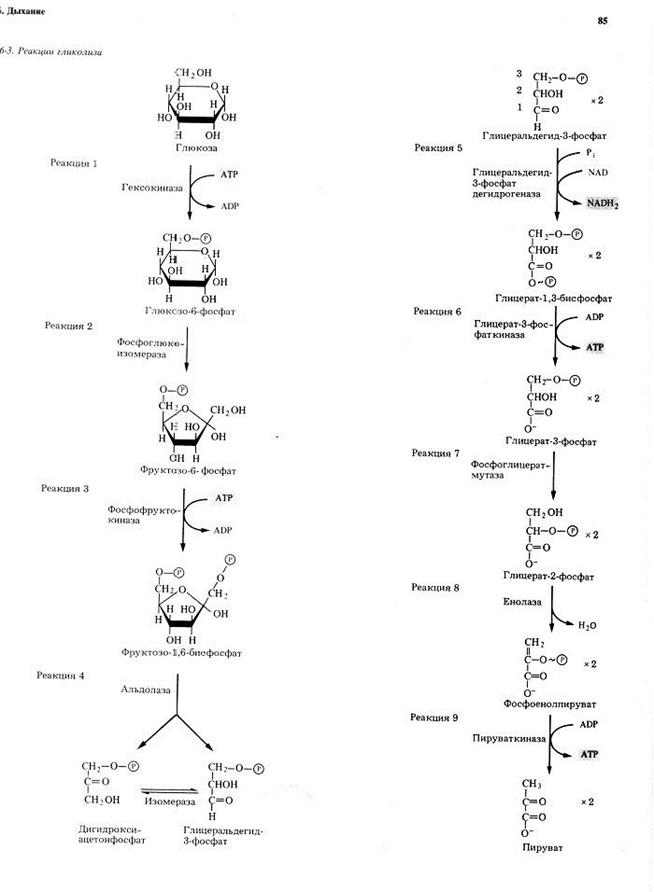
В однофотонном режиме возбуждение НАДН осуществляется на длине волны 350 нм с диапазоном приема 450–470 нм. Флюоресценцию ФАД возбуждают, как правило, при λ=450 нм и регистрируют в диапазоне 500–550 нм [18, 20, 26, 52]. Исследования с применением однофотонного режима ограничены в основном моделями in vitro из-за сильного рассеивания света в толстых образцах ткани [26].
Исследование метаболического статуса с использованием двухфотонной флюоресцентной микроскопии имеет ряд преимуществ по сравнению с однофотонным режимом. При двухфотонном возбуждении молекула флюорофора поглощает два фотона, обладающих низкой энергией, в течение одного квантового события. В результате возбуждать флюоресценцию НАДН и ФАД можно в ИК-области (НАДН — в районе 740 нм и ФАД — в районе 900 нм), а не в УФ- и ближнем УФ-диапазоне [18, 26]. Это особенно важно для исследований in vivo, так как рассеяние света в ткани уменьшается при возбуждении флюоресценции в ИК-области. Кроме того, поскольку одновременное поглощение двух фотонов носит вероятностный характер, эффективное двухфотонное возбуждение происходит только в фокальной плоскости, где плотность фотонов самая высокая. Такое прицельное возбуждение флюоресценции снижает возможность повреждения и фотообесцвечивания образца [26].
Кроме того, поскольку одновременное поглощение двух фотонов носит вероятностный характер, эффективное двухфотонное возбуждение происходит только в фокальной плоскости, где плотность фотонов самая высокая. Такое прицельное возбуждение флюоресценции снижает возможность повреждения и фотообесцвечивания образца [26].
Pедокс-отношение в опухолевых клетках и тканях. На сегодняшний день показатель редокс-отношения используется для оценки метаболического статуса опухолевых клеток in vitro, ткани ex vivo и опухолей in vivo. J.H. Ostrander с соавт. [62] показали на различных клеточных культурах опухоли молочной железы человека, что опухолевые клетки имеют увеличенное редокс-отношение НАДН/ФАД по сравнению с нормальными эпителиальными клетками. Это связано с повышенным потреблением глюкозы и аэробным гликолизом в опухолевых клетках. К тому же субпопуляция клеток рака молочной железы, экспрессирующая рецепторы эстрогена, имела сниженное редокс-отношение. Схожие результаты продемонстрированы и на клеточной линии рака мочевого пузыря человека: редокс-отношение НАДН/ФАД было увеличено по сравнению с нормой [68].
Схожие результаты продемонстрированы и на клеточной линии рака мочевого пузыря человека: редокс-отношение НАДН/ФАД было увеличено по сравнению с нормой [68].
На клеточных линиях рака молочной железы MDA-MB-231, MCF7, SKBr3 и BT474 выявлено снижение редокс-отношения НАДН/ФАД после добавления ингибитора окислительного фосфорилирования FCCP, что свидетельствовало о метаболических изменениях в клетках [69]. Обнаружена прямая корреляция между редокс-отношением ФАД/(НАДН+ФАД) и потреблением кислорода на различных культурах клеток рака молочной железы человека in vitro [70]. Также на культуре клеток рака молочной железы показана взаимосвязь между редокс-отношением НАДН/ФАД и экспрессией гена HER2. Известно, что HER2 играет важную роль в патогенезе и прогрессировании определенных агрессивных типов рака молочной железы. Установлено, что самое высокое редокс-отношение НАДН/ФАД характерно для клеток с гиперэкспрессией гена HER2 [71, 72].
J.M. Levitt и соавт. на 3D-модели эпителия изучали метаболическую активность нормальных и предраковых ВПЧ-иммортализованных клеток. Было обнаружено, что предраковые клетки имеют сниженное редокс-отношение ФАД/(НАДН+ФАД) по сравнению с нормальными клетками вследствие преобладания в них гликолиза [53, 73]. При исследовании изменения редокс-отношения ФАД/НАДН в клетках рака шейки матки человека в условиях кокультивирования с фибробластами [57] показано, что редокс-отношение в опухолевых клетках снижается при кокультивировании с фибробластами. Это снижение вызвано переходом на более гликолитический метаболизм. На клетках рака ротовой полости (SCC25 и SCC61) продемонстрировано in vitro снижение редокс-отношения НАДН/ФАД после лечения клеток Цисплатином [74]. Схожие результаты получены на клеточной линии рака мочевого пузыря (Т24). После воздействия N-4-(гидроксифенил)-ретинамидом авторы наблюдали увеличение редокс-отношения ФАД/(НАДН+ФАД) [75].
In vivo в работе по изучению метаболических изменений эпителия слизистой оболочки защечного мешка хомяка показано снижение редокс-отношения ФАД/НАДН при канцерогенезе [60]. На той же модели в работах [76–78] обнаружено резкое снижение редокс-отношения ФАД/(НАДН+ФАД) в опухолевой ткани по сравнению с контролем, что свидетельствовало о ее повышенной метаболической активности. В работах [60, 78] выявлена разница в редокс-отношении ФАД/(НАДН+ФАД) между метастазирующей клеточной линией рака молочной железы MDA-MB231 и неметастазирующей — MCF7 in vivo. Редокс-отношение у клеток MDA-MB231 было выше, что авторы связывают с более агрессивным фенотипом метастазирующей линии.
Ряд работ посвящен изучению метаболических изменений при противоопухолевой терапии in vivo. Так, A.T. Shah с соавт. наблюдали статистически значимое снижение редокс-отношения НАДН/ФАД в клетках плоскоклеточного рака гортани (FaDu) in vivo на второй день химиотерапии Цисплатином [79]. Z. Zhangc соавт. описали увеличение редокс-отношения ФАД/(НАДН+ФАД) в клетках глиомы крысы in vivo после фотодинамической терапии [56]. В работе [80] ими показано резкое увеличение редокс-отношения ФАД/(НАДН+ФАД) на клетках глиомы крысы ex vivo после фотодинамической терапии, что связывают с запуском окислительного стресса и нарушением структуры митохондрий.
Z. Zhangc соавт. описали увеличение редокс-отношения ФАД/(НАДН+ФАД) в клетках глиомы крысы in vivo после фотодинамической терапии [56]. В работе [80] ими показано резкое увеличение редокс-отношения ФАД/(НАДН+ФАД) на клетках глиомы крысы ex vivo после фотодинамической терапии, что связывают с запуском окислительного стресса и нарушением структуры митохондрий.
Данный метод (использование редокс-отношения для оценки метаболического статуса опухолевых клеток) находит применение и в клинических исследованиях. R. dе А. Natal с соавт. анализировали биопсийный материал от пациентов с опухолью молочной железы [54]. Выявлено, что редокс-отношение ФАД/НАДН снижено в образцах от пациентов с десмопластической реакцией, что указывает на высокую метаболическую активность данных клеток и неблагоприятный прогноз. А.Т. Shah и М.С. Skala продемонстрировали возможность применения редокс-отношения НАДН/ФАД для анализа биопсийного материала от пациентов со злокачественными новообразованиями гортани, языка, эпидермиса и аденокарциномы слюнной железы ex vivo. Полученные ими данные указывают на то, что метаболический статус опухолевых клеток может служить критерием подбора адекватного лечения [81]. На образцах эпителия шейки матки показано, что образцы с дисплазией имеют сниженное редокс-отношение ФАД/(НАДН+ФАД) по сравнению с нормальным эпителием [82]. Схожие результаты получены на опухоли головного мозга крыс ex vivo: редокс-отношение ФАД/(НАДН+ФАД) в опухоли было значительно ниже, чем в нормальной ткани, что свидетельствует о преобладании гликолиза в опухолевых клетках [83]. Предполагается, что разница в значениях редокс-отношения может быть использована для визуализации границы опухоли во время операции [83].
Полученные ими данные указывают на то, что метаболический статус опухолевых клеток может служить критерием подбора адекватного лечения [81]. На образцах эпителия шейки матки показано, что образцы с дисплазией имеют сниженное редокс-отношение ФАД/(НАДН+ФАД) по сравнению с нормальным эпителием [82]. Схожие результаты получены на опухоли головного мозга крыс ex vivo: редокс-отношение ФАД/(НАДН+ФАД) в опухоли было значительно ниже, чем в нормальной ткани, что свидетельствует о преобладании гликолиза в опухолевых клетках [83]. Предполагается, что разница в значениях редокс-отношения может быть использована для визуализации границы опухоли во время операции [83].
Хотя нами не найдено клинических примеров регистрации редокс-отношения, анализ интенсивности флюоресценции метаболических кофакторов имеет большой потенциал для применения в клинике. Ряд работ демонстрируют результаты регистрации флюоресценции НАДН в опухолях пациентов. Показано, что увеличенная интенсивность флюоресценции НАДН свидетельствует о диспластических и онкологических изменениях ткани эпителия шейки матки человека in vivo [84]. В опухолях головы и шеи человека in vivo также была выявлена повышенная интенсивность флюоресценции НАДН по сравнению с нормальным эпителием [85]. Сходные результаты получены и при исследовании базально-клеточной карциномы человека in vivo [3]. Все авторы связывают высокую интенсивность флюоресценции НАДН с активными метаболическими процессами в опухолевых клетках.
Показано, что увеличенная интенсивность флюоресценции НАДН свидетельствует о диспластических и онкологических изменениях ткани эпителия шейки матки человека in vivo [84]. В опухолях головы и шеи человека in vivo также была выявлена повышенная интенсивность флюоресценции НАДН по сравнению с нормальным эпителием [85]. Сходные результаты получены и при исследовании базально-клеточной карциномы человека in vivo [3]. Все авторы связывают высокую интенсивность флюоресценции НАДН с активными метаболическими процессами в опухолевых клетках.
Время жизни флюоресценции НАДН и ФАД в оценке энергетического метаболизма
Флюоресцентный имиджинг с временным разрешением. Исследование метаболизма клеток методом время-разрешенного флюоресцентного имиджинга (fluorescence life time imaging, FLIM) основано на том, что время жизни флюоресценции кофакторов НАДН и ФАД существенно отличается в зависимости от того, в свободном состоянии они находятся или связаны с белками.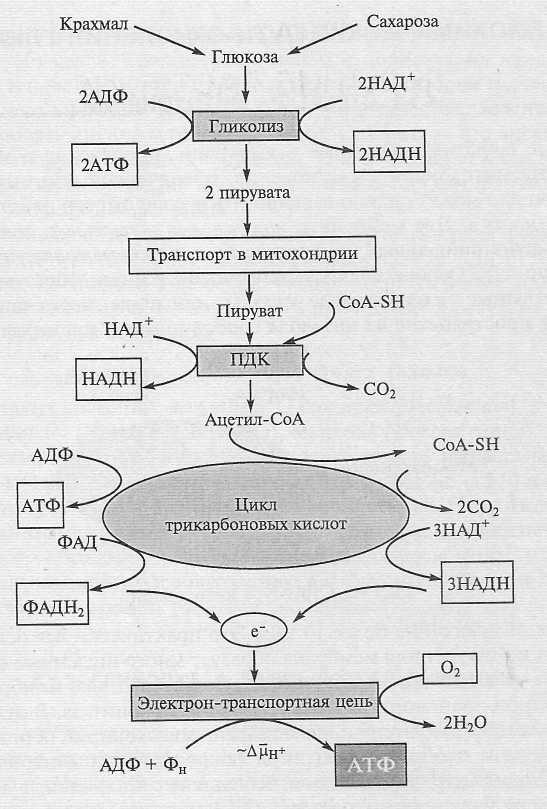 Несмотря на большое количество работ, посвященных исследованию метаболического статуса клетки на основе регистрации редокс-отношения, при таком подходе спектральное разделение свободных и связанных форм кофакторов невозможно, так как их спектры эмиссии отличаются на 10–20 нм при ширине пика в 150 нм [18, 86].
Несмотря на большое количество работ, посвященных исследованию метаболического статуса клетки на основе регистрации редокс-отношения, при таком подходе спектральное разделение свободных и связанных форм кофакторов невозможно, так как их спектры эмиссии отличаются на 10–20 нм при ширине пика в 150 нм [18, 86].
Флюоресцентный имиджинг с временным разрешением дает возможность исследовать метаболические кофакторы в живых клетках путем измерения среднего времени, в течение которого молекула находилась в возбужденном состоянии, а не фактической интенсивности флюоресценции. Время жизни флюоресценции в разумных пределах не зависит от концентрации флюорофора, тогда как микроокружение является наиболее значимым фактором. На время жизни могут оказывать влияние pH, температура, концентрация ионов и кислорода, связь с другими молекулами или конформация хромофора [87, 88].
Технология FLIM для разделения свободного и связанного НАДН была предложена в 1992 г. J.R. Lakowiсz и соавт. [89]. Ими впервые было измерено время жизни НАДН в растворе в свободном состоянии — 0,4 нс и в комплексе с малатдегидрогеназой — 1 нс. Недавно T.S. Blacker с соавт. была разработана методика разделения флюоресценции НАДН и НАДФН в живых клетках и тканях с использованием FLIM [21].
J.R. Lakowiсz и соавт. [89]. Ими впервые было измерено время жизни НАДН в растворе в свободном состоянии — 0,4 нс и в комплексе с малатдегидрогеназой — 1 нс. Недавно T.S. Blacker с соавт. была разработана методика разделения флюоресценции НАДН и НАДФН в живых клетках и тканях с использованием FLIM [21].
В настоящее время основным подходом к регистрации времени жизни флюоресценции является метод время-коррелированного счета фотонов (time-correlated single photon counting, TCSPC). Кинетика затухания флюоресценции измеряется после возбуждения образца коротко-импульсным лазерным излучением (фемто- или пикосекундным). Профиль затухания строится из множественного повтора одного фотонного события. Время прибытия первого фотона на детектор после импульса возбуждения измеряется и сохраняется в памяти, так что гистограмма времен и прихода фотонов представляет собой кривую интенсивности флюоресценции в зависимости от времени [90–92] (рис. 3). Поскольку данные измерения требуют временного разрешения порядка нескольких пикосекунд, FLIM-системы оснащены высокоскоростными и сверхчувствительными детекторами, способными улавливать единичные фотоны [93, 94].
| Рис. 3. Принцип работы метода время-коррелированного счета фотонов [1, 93] |
Характерное время жизни флюоресценции кофакторов в клетке составляет порядка 0,3 и 2,0 нс для НАДН, 0,3 и 2,7 нс — для ФАД. Более короткое время жизни соответствует связанной форме ФАД и свободной — НАДН, более длинное — свободному ФАД и связанному НАДН.
Хотя в случае ФАД различное время жизни обусловлено не связью с белком, а конформацией молекулы кофактора внутри белкового комплекса, применение понятий «свободный» и «связанный» к ФАД скорее традиционно. Известно, что ФАД существует в двух конформациях: закрытой, когда ароматические кольца изоаллоксазина и аденина находятся на предельно близком расстоянии друг от друга, и открытой, при которой два ароматических кольца предельно удалены друг от друга. При этом в открытой конформации эмиссия осуществляется за счет ароматической группы изоаллоксазина и время жизни составляет около 2–3 нс, тогда как время жизни флюоресценции закрытой конформации гораздо короче (100–300 нс), что обусловлено тушением флюоресценции изоаллоксазина аденином [21, 57, 86].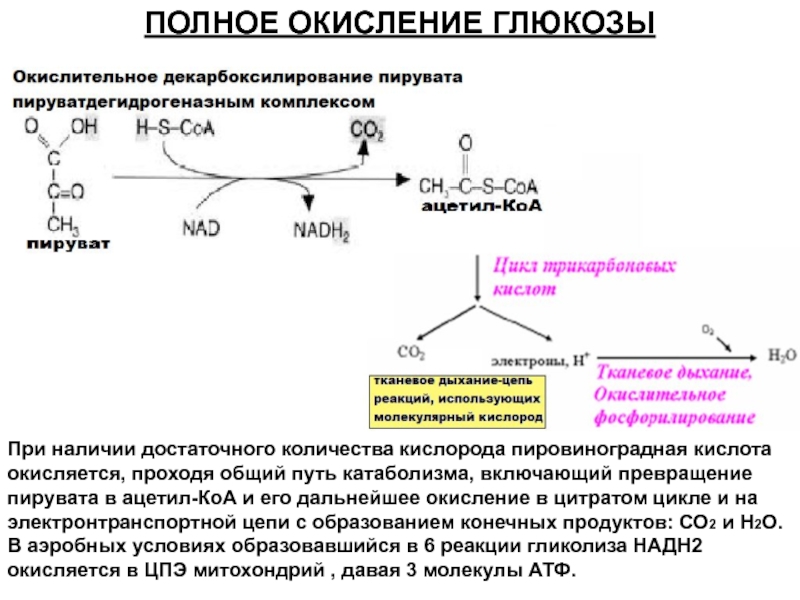
Свободная форма НАДН локализуется в цитозоле и отвечает за процессы гликолиза, тогда как связанная — в митохондриях и участвует в реакциях окислительного фосфорилирования. Время жизни связанного НАДН зависит от того, с каким белком связан кофактор, и варьирует в пределах от 1,7 до 2,9 нс [26, 60, 95].
Существует ряд работ, посвященных анализу изменения времени жизни кофакторов при онкологических процессах, однако основным показателем при изучении энергетического метаболизма методом FLIM является относительный процентный вклад свободной и связанной форм кофакторов [22, 26, 57, 95].
На сегодняшний день флюоресцентный имиджинг с временным разрешением реализован в виде микроскопии на основе двухфотонного возбуждения, спектроскопии и макроимиджинга. Существуют установки для двухфотонной микроскопии и FLIM, одобренные для применения в клинике, например системы MPTflex и DermaInspect производства компании JenLab (Германия) [3, 96, 97].
Изменения времени жизни флюоресценции при онкологических процессах. Ввиду неинвазивности, высокой чувствительности и отсутствия необходимости введения экзогенных красителей метод FLIM стал незаменимым инструментом для визуализации опухолевого метаболизма.
В многочисленных работах с помощью FLIM демонстрируется более гликолитический метаболизм опухолевых клеток по сравнению с нормальными. Например, на культурах клеток рака головы и шеи SCC25 и SCC61 выявлен пониженный процентный вклад связанных форм НАДН и ФАД по сравнению с нормальными эпителиальными клетками [74]. В той же работе продемонстрировано увеличение вклада связанного НАДН и ФАД после лечения химиопрепаратами Цисплатин, Цетуксимаб и BGT226. При исследовании времени жизни НАДН в кератиноцитах и опухолевых клетках полости рта человека in vitro обнаружено, что опухолевые клетки имеют большее время жизни флюоресценции НАДН, а соотношение свободной/связанной форм НАДН в них снижено по сравнению с контролем [98]. Также установлено, что время жизни флюоресценции НАДН в клетках рака молочной железы человека значительно ниже по сравнению с клетками нормального эпителия [86].
Также установлено, что время жизни флюоресценции НАДН в клетках рака молочной железы человека значительно ниже по сравнению с клетками нормального эпителия [86].
V.K. Ramanujan с соавт. измерили характерные времена жизни флюоресценции НАДН для человеческих эмбриональных клеток почек (HEK 293T), гепатоцитов и клеточной линии рака шейки матки человека (HeLa) и показали, что вклад свободной формы НАДН наиболее высок в опухолевых клетках, что свидетельствует о смещении метаболизма клеток к гликолитическому [99]. На культуре клеток базофильной лейкемии крыс проанализировано время жизни флюоресценции НАДН при нормальных условиях и при изменении концентрации глюкозы [100]. Выявлено, что наименьшее значение среднего времени жизни НАДН соотносилось с пониженным содержанием глюкозы и клеточным голоданием. С увеличением концентрации глюкозы в среде среднее время жизни НАДН увеличивалось. На клеточной культуре рака молочной железы человека установлено, что в процессе пролиферации клеток время жизни флюоресценции связанной формы НАДН снижается, а процентный вклад свободной формы увеличивается. Такие же изменения, но с различной динамикой, наблюдали при добавлении к клеткам цианистого калия и при снижении концентрации питательных веществ в культуральной среде [101].
Такие же изменения, но с различной динамикой, наблюдали при добавлении к клеткам цианистого калия и при снижении концентрации питательных веществ в культуральной среде [101].
M.S. Islam с соавт. показали изменение времени жизни флюоресценции ФАД в опухолевых клетках рака шейки матки человека при изменении рН. Время жизни флюоресценции оставалось неизменным при изменении внеклеточного рН, однако при защелачивании внутриклеточного рН оно снижалось [102].
В работе [103] изучено распределение флюоресценции флавинов, их характерное время жизни и вклад в метаболические процессы на опухолевых клетках глиобластомы человека U-87 MG in vitro. Выявлено, что в опухолевых клетках флавины локализуются в основном в митохондриях, а среднее время жизни ФАД составляет 1,4 нс. Данный факт может служить критерием для ранней диагностики онкологических процессов.
In vivo было показано снижение процентных вкладов связанных форм НАДН и ФАД в процессе канцерогенеза клеток эпителия защечного мешка хомяка в результате активации гликолиза [60, 95].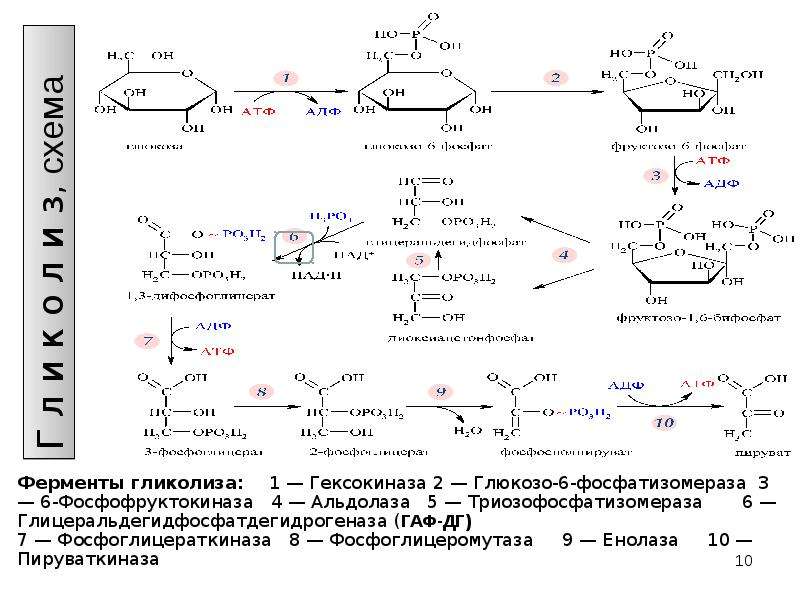 На той же модели индуцированного рака полости рта Н. Fatakdawala с соавт. показали пониженное время жизни флюоресценции НАДН в опухоли по сравнению с нормой [104]. На клетках плоскоклеточного рака гортани (FaDu) in vivo обнаружено снижение времени жизни флюоресценции НАДН и ФАД в результате химиотерапии Цисплатином и Цетуксимабом [79].
На той же модели индуцированного рака полости рта Н. Fatakdawala с соавт. показали пониженное время жизни флюоресценции НАДН в опухоли по сравнению с нормой [104]. На клетках плоскоклеточного рака гортани (FaDu) in vivo обнаружено снижение времени жизни флюоресценции НАДН и ФАД в результате химиотерапии Цисплатином и Цетуксимабом [79].
В последнее время особый интерес вызывает применение метода FLIM в клинической онкологии. Анализ кофакторов в опухолях человека проводится в основном в биопсийных образцах. На образцах опухоли пациентов с раком гортани, языка, эпидермиса и аденокарциномы слюнной железы ex vivo было проанализировано время жизни НАДН и ФАД [81]. Данное исследование показало, что онкологические процессы имеют свои характерные метаболические особенности и отличаются от нормы более гликолитическим типом метаболизма. В работе [54] на образцах опухоли молочной железы человека ex vivo выявлено, что опухолевые клетки с десмопластической реакцией имели более короткое время жизни флюоресценции НАДН и ФАД по сравнению с опухолевыми клетками, у которых данная реакция не наблюдалась.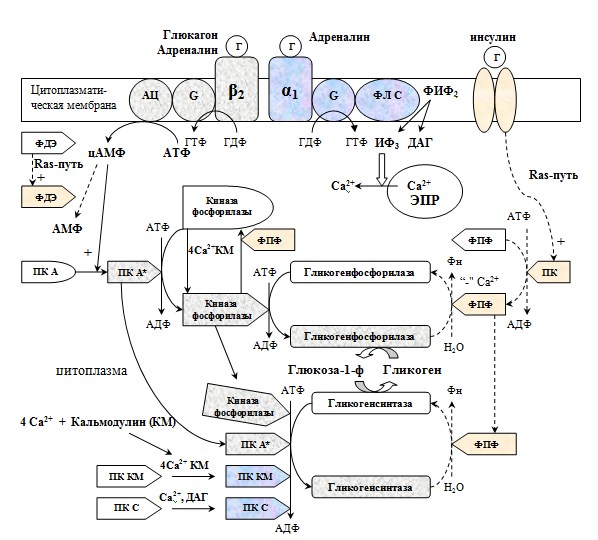 В образцах опухоли яичника человека ex vivo было обнаружено увеличенное время жизни флюоресценции ФАД в сравнении с нормальным эпидермисом [105].
В образцах опухоли яичника человека ex vivo было обнаружено увеличенное время жизни флюоресценции ФАД в сравнении с нормальным эпидермисом [105].
При помощи FLIM-макроимиджинга на биопсийных образцах установлено, что клетки базалиомы имеют более короткое время жизни флюоресценции НАДН по сравнению с нормой [106]. Также на образцах опухолей кишечника, желудка, мочевого пузыря, печени, поджелудочной железы продемонстрировано, что среднее время жизни флюоресценции НАДН значительно длиннее по сравнению с его значением на границе опухоли и нормальной ткани того же образца [107].
В связи с небольшой глубиной зондирования (~300 мкм), работы с использованием FLIM на опухолях человека in vivo ограничены исследованиями новообразований кожи и головного мозга (интраоперационно). Так, было продемонстрировано, что в клетках меланомы время жизни НАДН существенно короче, чем в клетках базалиомы, и это может служить критерием для дифференциальной диагностики [97]. Первая работа на опухоли мозга in vivo показала применимость FLIM для оценки границ резекции в процессе нейрохирурхического вмешательства [96]. У пациентов с опухолями головы и шеиметодом FLIM-спектроскопии обнаружено, что клетки опухолевой ткани имеют более короткое время жизни флюоресценции НАДН по сравнению с окружающей нормальной тканью [108–110], это говорит об их более гликолитическом статусе.
Первая работа на опухоли мозга in vivo показала применимость FLIM для оценки границ резекции в процессе нейрохирурхического вмешательства [96]. У пациентов с опухолями головы и шеиметодом FLIM-спектроскопии обнаружено, что клетки опухолевой ткани имеют более короткое время жизни флюоресценции НАДН по сравнению с окружающей нормальной тканью [108–110], это говорит об их более гликолитическом статусе.
Заключение
Данные о метаболическом статусе клетки важны для оценки ее функционального состояния. Все вышеперечисленные примеры демонстрируют потенциал неинвазивных оптических методов для визуализации метаболического статуса опухолевых клеток по флюоресценции эндогенных флюорофоров НАДН и ФАД. Описанные подходы на основе анализа интенсивности флюоресценции (редокс-отношение) и времени жизни флюоресценции (FLIM) открывают возможности ранней диагностики онкологических заболеваний и мониторинга ответа на терапевтическое воздействие в режиме реального времени. Ожидается, что метаболический имиджинг улучшит понимание динамических биохимических процессов в клетках, а также станет основой для ранней диагностики не только онкологических процессов, но и других патологий, связанных с метаболическими изменениями (сахарный диабет, нейродегенеративные заболевания и др.).
Ожидается, что метаболический имиджинг улучшит понимание динамических биохимических процессов в клетках, а также станет основой для ранней диагностики не только онкологических процессов, но и других патологий, связанных с метаболическими изменениями (сахарный диабет, нейродегенеративные заболевания и др.).
Финансирование исследования. Работа выполнена при финансовой поддержке Российского научного фонда (проект №14-15-00646).
Конфликт интересов. У авторов нет конфликта интересов.
- Chakraborty S., Nian F.-S., Tsai J.-W., Karmenyan A., Chiou A. Quantification of the metabolic state in cell-model of parkinson’s disease by fluorescence lifetime imaging microscopy. Sci Rep 2016; 6: 19145, https://doi.org/10.1038/srep19145.
- Folmes C.D., Dzeja P.P., Nelson T.J., Terzic A. Metabolic plasticity in stem cell homeostasis and differentiation. Cell Stem Cell 2012; 11(5): 596–606, https://doi.
 org/10.1016/j.stem.2012.10.002.
org/10.1016/j.stem.2012.10.002. - Balu M., Zachary C.B., Harris R.M., Krasieva T.B., König K., Tromberg B.J., Kelly K.M. In vivo multiphoton microscopy of basal cell carcinoma. JAMA Dermatol 2015; 151(10): 1068–1074, https://doi.org/10.1001/jamadermatol.2015.0453.
- Corpas F.J., Barroso J.B. NADPH-generating dehydrogenases: their role in the mechanism of protection against nitro-oxidative stress induced by adverse environmental conditions. Front Environ Sci 2014; 2, https://doi.org/10.3389/fenvs.2014.00055.
- Heikal A.A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomark Med 2010; 4(2): 241–263, https://doi.org/10.2217/bmm.10.1.
- Shi F., Li Y., Li Y., Wang X. Molecular properties, functions, and potential applications of NAD kinases. Acta Biochim Biophys Sin (Shanghai) 2009; 41(5): 352–361, https://doi.org/10.1093/abbs/gmp029.
- Xia W., Wang Z., Wang Q., Han J., Zhao C.
 , Hong Y., Zeng L., Tang L., Ying W. Roles of NAD(+)/NADH and NADP(+)/NADPH in cell death. Curr Pharm Des 2009; 15(1): 12–19, https://doi.org/10.2174/138161209787185832.
, Hong Y., Zeng L., Tang L., Ying W. Roles of NAD(+)/NADH and NADP(+)/NADPH in cell death. Curr Pharm Des 2009; 15(1): 12–19, https://doi.org/10.2174/138161209787185832. - Cairns R.A., Harris I.S., Mak T.W. Regulation of cancer cell metabolism. Nat Rev Cancer 2011; 11(2): 85–95, https://doi.org/10.1038/nrc2981.
- Cantor J.R., Sabatini D.M. Cancer cell metabolism: one hallmark, many faces. Cancer Discov 2012; 2(10): 881–898, https://doi.org/10.1158/2159-8290.cd-12-0345.
- Kunz W.S., Kunz W. Contribution of different enzymes to flavoprotein fluorescence of isolated rat liver mitochondria. Biochim Biophys Acta 1985; 841(3): 237–246, https://doi.org/10.1016/0304-4165(85)90064-9.
- Saks V.A., Veksler V.I., Kuznetsov A.V., Kay L., Sikk P., Tiivel T., Tranqui L., Olivares J., Winkler K., Wiedemann F., Kunz W.S. Permeabilized cell and skinned fiber techniques in studies of mitochondrial function in vivo. In: Bioenergetics of the cell: quantitative aspects.
 Springer Science + Business Media; 1998; p. 81–100, https://doi.org/10.10 07/978-1-4615-5653-4_7.
Springer Science + Business Media; 1998; p. 81–100, https://doi.org/10.10 07/978-1-4615-5653-4_7. - Pollak N., Dölle C., Ziegler M. The power to reduce: pyridine nucleotides — small molecules with a multitude of functions. Biochem J 2007; 402(2): 205–218, https://doi.org/10.1042/bj20061638.
- Ying W. NAD+/NADH and NADP+/NADPH in cellular functions and cell death: regulation and biological consequences. Antioxid Redox Signal 2007; 10(2): 179–206, https://doi.org/10.1089/ars.2007.1672.
- Smeitink J., van den Heuvel L., DiMauro S. The genetics and pathology of oxidative phosphorylation. Nat Rev Gene 2001; 2(5): 342–352, https://doi.org/10.1038/35072063.
- Papa S., Martino P.L., Capitanio G., Gaballo A., De Rasmo D., Signorile A., Petruzzella V. The oxidative phosphorylation system in mammalian mitochondria. Adv Exp Med Biol 2012; 942: 3–37, https://doi.org/10.1007/978-94-007-2869-1_1.
- Gautheron D.C. Mitochondrial oxidative phosphorylation and respiratory chain: review.
 J Inherit Metab Dis 1984; 7(Suppl 1): 57–61, https://doi.org/10.1007/bf03047376.
J Inherit Metab Dis 1984; 7(Suppl 1): 57–61, https://doi.org/10.1007/bf03047376. - Nsiah-Sefaa A., McKenzie M. Combined defects in oxidative phosphorylation and fatty acid β-oxidation in mitochondrial disease. Biosci Rep 2016; 36(2): e00313, https://doi.org/10.1042/BSR20150295.
- Chorvat D., Chorvatova A. Multi-wavelength fluorescence lifetime spectroscopy: a new approach to the study of endogenous fluorescence in living cells and tissues. Laser Phys Lett 2009; 6(3): 175–193, https://doi.org/10.1002/lapl.200810132.
- Patterson G.H., Knobel S.M., Arkhammar P., Thastrup O., Piston D.W. Separation of the glucose-stimulated cytoplasmic and mitochondrial NAD(P)H responses in pancreatic islet beta cells. Proc Natl Acad Sci USA 2000; 97(10): 5203–5207, https://doi.org/10.1073/pnas.090098797.
- Richards-Kortum R., Sevick-Muraca E. Quantitative optical spectroscopy for tissue diagnosis. Annu Rev Phys Chem 1996; 47: 555–606, https://doi.org/10.
 1146/annurev.physchem.47.1.555.
1146/annurev.physchem.47.1.555. - Blacker T.S., Mann Z.F., Gale J.E., Ziegler M., Bain A.J., Szabadkai G., Duchen M.R. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat Commun 2014; 5: 3936, https://doi. org/10.1038/ncomms4936.
- Meleshina A.V., Dudenkova V.V., Shirmanova M.V., Shcheslavskiy V.I., Becker W., Bystrova A.S., Cherkasova E.I., Zagaynova E.V. Probing metabolic states of differentiating stem cells using two-photon FLIM. Sci Rep 2016; 6: 21853, https://doi.org/10.1038/srep21853.
- Klaidman L.K., Leung A.C., Adams J.D. Jr. High-performance liquid chromatography analysis of oxidized and reduced pyridine dinucleotides in specific brain regions. Anal Biochem 1995; 228(2): 312–317, https://doi.org/10.1006/abio.1995.1356.
- Huang S., Heikal A.A., Webb W.W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and flavoprotein. Biophys J 2002; 82(5): 2811–2825, https://doi.org/10.1016/s0006-3495(02)75621-x.

- Rocheleau J.V., Head W.S., Piston D.W. Quantitative NAD(P)H/flavoprotein autofluorescence imaging reveals metabolic mechanisms of pancreatic islet pyruvate response. J Biol Chem 2004; 279(30): 31780–31787, https://doi.org/10.1074/jbc.m314005200.
- Georgakoudi I., Quinn K.P. Optical imaging using endogenous contrast to assess metabolic state. Annu Rev Biomed Eng 2012; 14: 351–367, https://doi.org/10.1146/annurev-bioeng-071811-150108.
- Kim H.J., Winge D.R. Emerging concepts in the flavinylation of succinate dehydrogenase. Biochim Biophys Acta 2013; 1827(5): 627–636, https://doi.org/10.1016/j.bbabio.2013.01.012.
- Wouters B.G., Koritzinsky M. Hypoxia signalling through mTOR and the unfolded protein response in cancer. Nat Rev Cancer 2008; 8(11): 851–864, https://doi.org/10.1038/nrc2501.
- Marusyk A., Polyak K. Tumor heterogeneity: causes and consequences. Biochim Biophys Acta 2010; 1805(1): 105–117, https://doi.org/10.
 1016/j.bbcan.2009.11.002.
1016/j.bbcan.2009.11.002. - DeBerardinis R.J., Lum J.J., Hatzivassiliou G., Thompson C.B. The biology of cancer: metabolic reprogramming fuels cell growth and proliferation. Cell Metab 2008; 7(1): 11–20, https://doi.org/10.1016/j.cmet.2007.10.002.
- Edinger A.L., Linardic C.M., Chiang G.G., Thompson C.B., Abraham R.T. Differential effects of rapamycin on mammalian target of rapamycin signaling functions in mammalian cells. Cancer Res 2003; 63(23): 8451–8460.
- Peng T., Golub T.R., Sabatini D.M. The immunosuppressant rapamycin mimics a starvation-like signal distinct from amino acid and glucose deprivation. Mol Cell Biol 2002; 22(15): 5575–5584, https://doi.org/10.1128/mcb.22.15.5575-5584.2002.
- Masson N., Ratcliffe P.J. Hypoxia signaling pathways in cancer metabolism: the importance of co-selecting interconnected physiological pathways. Cancer Metab 2014; 2(1): 3, https://doi.org/10.1186/2049-3002-2-3.
- Solaini G., Baracca A.
 , Lenaz G., Sgarbi G. Hypoxia and mitochondrial oxidative metabolism. Biochim Biophys Acta 2010; 1797(6–7): 1171–1177, https://doi.org/10.1016/j.bbabio.2010.02.011.
, Lenaz G., Sgarbi G. Hypoxia and mitochondrial oxidative metabolism. Biochim Biophys Acta 2010; 1797(6–7): 1171–1177, https://doi.org/10.1016/j.bbabio.2010.02.011. - Zhang H., Bosch-Marce M., Shimoda L.A., Tan Y.S., Baek J.H., Wesley J.B., Gonzalez F.J., Semenza G.L. Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia. J Biol Chem 2008; 283(16): 10892–10903, https://doi.org/10.1074/jbc.M800102200.
- Zhang H., Gao P., Fukuda R., Kumar G., Krishnamachary B., Zeller K.I., Dang C.V., Semenza G.L. HIF-1 inhibits mitochondrial biogenesis and cellular respiration in VHL-deficient renal cell carcinoma by repression of C-MYC activity. Cancer Cell 2007; 11(5): 407–420, https://doi.org/10.1016/j.ccr.2007.04.001.
- Lopez-Lazaro M. The warburg effect: why and how do cancer cells activate glycolysis in the presence of oxygen? Anticancer Agents Med Chem 2008; 8(3): 305–312, https://doi.org/10.2174/187152008783961932.
- Warburg O.
 , Wind F., Negelein E. The metabolism of tumors in the body. J Gen Physiol 1927; 8(6): 519–530, https://doi.org/10.1085/jgp.8.6.519.
, Wind F., Negelein E. The metabolism of tumors in the body. J Gen Physiol 1927; 8(6): 519–530, https://doi.org/10.1085/jgp.8.6.519. - Pelicano H., Martin D.S., Xu R.H., Huang P. Glycolysis inhibition for anticancer treatment. Oncogene 2006; 25(34): 4633–4646, https://doi.org/10.1038/sj.onc.1209597.
- Zheng J. Energy metabolism of cancer: glycolysis versus oxidative phosphorylation (review). Oncol Lett 2012; 4(6): 1151–1157, https://doi.org/10.3892/ol.2012.928.
- Berridge M.V., Herst P.M., Tan A.S. Metabolic flexibility and cell hierarchy in metastatic cancer. Mitochondrion 2010; 10(6): 584–588, https://doi.org/10.1016/j.mito.2010.08.002.
- Diaz-Ruiz R., Rigoulet M., Devin A. The Warburg and Crabtree effects: on the origin of cancer cell energy metabolism and of yeast glucose repression. Biochim Biophys Acta 2011; 1807(6): 568–576, https://doi.org/10.1016/j.bbabio.2010.08.010.
- Fantin V.R., St-Pierre J., Leder P. Attenuation of LDH-A expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance.
 Cancer Cell 2006; 9(6): 425–434, https://doi.org/10.1016/j.ccr.2006.04.023.
Cancer Cell 2006; 9(6): 425–434, https://doi.org/10.1016/j.ccr.2006.04.023. - Moreno-Sánchez R., Rodríguez-Enríquez S., Marín-Hernández A., Saavedra E. Energy metabolism in tumor cells. FEBS J 2007; 274(6): 1393–1418, https://doi.org/10.1111/j.1742-4658.2007.05686.x.
- Brand K.A., Hermfisse U. Aerobic glycolysis by proliferating cells: a protective strategy against reactive oxygen species. Faseb J 1997; 11(5): 388–395.
- Lunt S.Y., Vander Heiden M.G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annu Rev Cell Dev Biol 2011; 27: 441–464, https://doi.org/10.1146/annurev-cellbio-092910-154237.
- Fogal V., Richardson A.D., Karmali P.P., Scheffler I.E., Smith J.W., Ruoslahti E. Mitochondrial p32 protein is a critical regulator of tumor metabolism via maintenance of oxidative phosphorylation. Mol Cell Biol 2010; 30(6): 1303–1318, https://doi.org/10.1128/MCB.01101-09.
- Zu X.L., Guppy M. Cancer metabolism: facts, fantasy, and fiction.
 Biochem Biophys Res Commu 2004; 313(3): 459–465, https://doi.org/10.1016/j.bbrc.2003.11.136.
Biochem Biophys Res Commu 2004; 313(3): 459–465, https://doi.org/10.1016/j.bbrc.2003.11.136. - Robertson-Tessi M., Gillies R.J., Gatenby R.A., Anderson A.R. Impact of metabolic heterogeneity on tumor growth, invasion, and treatment outcomes. Cancer Res 2015; 75(8): 1567–1579, https://doi.org/10.1158/0008-5472.CAN-14-1428.
- Sengupta D., Pratx G. Imaging metabolic heterogeneity in cancer. Mol Cancer 2016; 15: 4, https://doi.org/10.1186/s12943-015-0481-3.
- Xu H.N., Feng M., Moon L., Dolloff N., El-Deiry W., Li L.Z. Redox imaging of the p53-dependent mitochondrial redox state in colon cancer ex vivo. J Innov Opt Health Sci 2013; 6(3): 1350016, https://doi.org/10.1142/s1793545813500168.
- Chance B., Schoener B., Oshino R., Itshak F., Nakase Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. J Biol Chem 1979; 254(11): 4764–4771.
- Levitt J.M., Baldwin A.
 , Papadakis A., Puri S., Xylas J., Munger K., Georgakoudi I. Intrinsic fluorescence and redox changes associated with apoptosis of primary human epithelial cells. J Biomed Opt 2006; 11(6): 064012, https://doi.org/10.1117/1.2401149.
, Papadakis A., Puri S., Xylas J., Munger K., Georgakoudi I. Intrinsic fluorescence and redox changes associated with apoptosis of primary human epithelial cells. J Biomed Opt 2006; 11(6): 064012, https://doi.org/10.1117/1.2401149. - Natal R. de A., Pelegati V.B., Bondarik C., Mendonça G.R., Derchain S.F., Lima C.P., Cesar C.L., Sarian L.O., Vassalloet J. Increased metabolic activity detected by FLIM in human breast cancer cells with desmoplastic reaction: a pilot study. Proc. SPIE 9536, Advanced Microscopy Techniques IV; and Neurophotonics II, 95360L (July 14, 2015), https://doi.org/10.1117/12.2183442.
- Quinn K.P., Sridharan G.V., Hayden R.S., Kaplan D.L., Lee K., Georgakoudi I. Quantitative metabolic imaging using endogenous fluorescence to detect stem cell differentiation. Sci Rep 2013; 3: 3432, https://doi.org/10.1038/srep03432.
- Zhang Z., Blessington D., Li H., Busch T.M., Glickson J., Luo Q., Chance B., Zheng G. Redox ratio of mitochondria as an indicator for the response of photodynamic therapy.
 J Biomed Opt 2004; 9(4): 772–778, https://doi.org/10.1117/1.1760759.
J Biomed Opt 2004; 9(4): 772–778, https://doi.org/10.1117/1.1760759. - Druzhkova I.N., Shirmanova M.V., Lukina M.M., Dudenkova V.V., Mishina N.M., Zagaynova E.V. The metabolic interaction of cancer cells and fibroblasts — coupling between NAD(P)H and FAD, intracellular pH and hydrogen peroxide. Cell Cycle 2016; 15(9): 1257–1266, https://doi.org/10.1080/15384101.2016.1160974.
- Skala M., Ramanujam N. Multiphoton redox ratio imaging for metabolic monitoring in vivo. Methods Mol Biol 2010; 594: 155–162, https://doi.org/10.1007/978-1-60761-411-1_11.
- Skala M.C., Fontanella A., Lan L., Izatt J.A., Dewhirst M.W. Longitudinal optical imaging of tumor metabolism and hemodynamics. J Biomed Opt 2010; 15(1): 011112, https://doi.org/10.1117/1.3285584.
- Skala M.C., Riching K.M., Gendron-Fitzpatrick A., Eickhoff J., Eliceiri K.W., White J.G., Ramanujam N. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia.
 Proc Natl Acad Sci USA 2007; 104(49): 19494–19499, https://doi.org/10.1073/pnas.0708425104.
Proc Natl Acad Sci USA 2007; 104(49): 19494–19499, https://doi.org/10.1073/pnas.0708425104. - Cannon T.M., Shah A.T., Walsh A.J., Skala M.C. High-throughput measurements of the optical redox ratio using a commercial microplate reader. J Biomed Opt 2015; 20(1): 010503, https://doi.org/10.1117/1.jbo.20.1.010503.
- Ostrander J.H., McMahon C.M., Lem S., Millon S.R., Brown J.Q., Seewaldt V.L., Ramanujam N. Optical redox ratio differentiates breast cancer cell lines based on estrogen receptor status. Cancer Res 2010; 70(11): 4759–4766, https://doi.org/10.1158/0008-5472.can-09-2572.
- Staniszewski K., Audi S.H., Sepehr R., Jacobs E.R., Ranji M. Surface fluorescence studies of tissue mitochondrial redox state in isolated perfused rat lungs. Ann Biomed Eng 2013; 41(4): 827–836, https://doi.org/10.1007/s10439-012-0716-z.
- Sepehr R., Staniszewski K., Maleki S., Jacobs E.R., Audi S., Ranji M. Optical imaging of tissue mitochondrial redox state in intact rat lungs in two models of pulmonary oxidative stress.
 J Biomed Opt 2012; 17(4): 046010, https://doi.org/10.1117/1.JBO.17.4.046010.
J Biomed Opt 2012; 17(4): 046010, https://doi.org/10.1117/1.JBO.17.4.046010. - Currie E., Schulze A., Zechner R., Walther T.C., Farese R.V. Jr. Cellular fatty acid metabolism and cancer. Cell Metab 2013; 18(2): 153–161, https://doi.org/10.1016/j.cmet.2013.05.017.
- Fox C.J., Hammerman P.S., Thompson C.B. Fuel feeds function: energy metabolism and the T-cell response. Nat Rev Immunol 2005; 5(11): 844–852, https://doi.org/10.1038/nri1710.
- Chance B. Optical method. Annu Rev Biophys Biophys Chem 1991; 20(1): 1–30, https://doi.org/10.1146/annurev.bb.20.060191.000245.
- Palmer S., Litvinova K., Rafailov E.U., Nabi G. Detection of urinary bladder cancer cells using redox ratio and double excitation wavelengths autofluorescence. Biomed Opt Express 2015; 6(3): 977–986, https://doi.org/10.1364/BOE.6.000977.
- Cannon T.M., Shah A.T., Skala M.C. Validation and characterization of optical redox ratio measurements with a microplate reader in breast cancer cells.
 Proc. SPIE 9303, Photonic Therapeutics and Diagnostics XI, 93032S (February 26, 2015), https://doi.org/10.1117/12.2077941.
Proc. SPIE 9303, Photonic Therapeutics and Diagnostics XI, 93032S (February 26, 2015), https://doi.org/10.1117/12.2077941. - Hou J., Wright H.J., Chan N., Tran R., Razorenova O.V., Potma E.O., Tromberg B.J. Correlating two-photon excited fluorescence imaging of breast cancer cellular redox state with seahorse flux analysis of normalized cellular oxygen consumption. J Biomed Opt 2016; 21(6): 60503, https://doi.org/10.1117/1.JBO.21.6.060503.
- Walsh A., Cook R.S., Rexer B., Arteaga C.L., Skala M.C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomed Opt Express 2012; 3(1): 75–85, https://doi.org/10.1364/boe.3.000075.
- Walsh A.J., Cook R.S., Manning H.C., Hicks D.J., Lafontant A., Arteaga C.L., Skala M.C. Optical metabolic imaging identifies glycolytic levels, sub-types and early treatment response in breast cancer. Cancer Res 2013; 73(20): 6164–6174, https://doi.org/10.1158/0008-5472.can-13-0527.
- Levitt J.
 M., McLaughlin-Drubin M.E., Münger K., Georgakoudi I. Automated biochemical, morphological, and organizational assessment of precancerous changes from endogenous two-photon fluorescence images. PLoS ONE 2011; 6(9): e24765, https://doi.org/10.1371/journal.pone.0024765.
M., McLaughlin-Drubin M.E., Münger K., Georgakoudi I. Automated biochemical, morphological, and organizational assessment of precancerous changes from endogenous two-photon fluorescence images. PLoS ONE 2011; 6(9): e24765, https://doi.org/10.1371/journal.pone.0024765. - Shah A.T., Demory Beckler M., Walsh A.J., Jones W.P., Pohlmann P.R., Skala M.C. Optical metabolic imaging of treatment response in human head and neck squamous cell carcinoma. PLoS ONE 2014; 9(3): e90746, https://doi.org/10.1371/journal.pone.0090746.
- Kirkpatrick N.D., Zou C., Brewer M.A., Brands W.R., Drezek R.A., Utzinger U. Endogenous fluorescence spectroscopy of cell suspensions for chemopreventive drug monitoring. Photochem Photobiol 2005; 81(1): 125–134, https://doi.org/10.1562/2004-08-09-ra-267.1.
- Gurushankar K., Nazeer S.S., Jayasree R.S., Krishnakumar N. Evaluation of antitumor activity of hesperetin-loaded nanoparticles against dmba-induced oral carcinogenesis based on tissue autofluorescence spectroscopy and multivariate analysis.
 J Fluoresc 2015; 25(4): 931–939, https://doi.org/10.1007/s10895-015-1575-4.
J Fluoresc 2015; 25(4): 931–939, https://doi.org/10.1007/s10895-015-1575-4. - Gohulkumar M., Nazeer S.S., Jayasree R.S., Gurushankar K., Krishnakumar N. Monitoring the metabolic response to nanoencapsulated silibinin treatment in DMBA-induced oral carcinogenesis using endogenous fluorescence. Anal Methods 2014; 6(24): 9744–9753, https://doi.org/10.1039/c4ay01877j.
- Xu H.N., Nioka S., Glickson J.D., Chance B., Li L.Z. Quantitative mitochondrial redox imaging of breast cancer metastatic potential. J Biomed Opt 2010; 15(3): 036010, https://doi.org/10.1117/1.3431714.
- Shah A.T., Diggins K.E., Walsh A.J., Irish J.M., Skala M.C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia 2015; 17(12): 862–870, https://doi.org/10.1016/j.neo.2015.11.006.
- Zhang M., Zhang Z., Blessington D., Li H., Busch T.M., Madrak V., Miles J., Chance B., Glickson J.D., Zheng G. Pyropheophorbide 2-deoxyglucosamide: a new photosensitizer targeting glucose transporters.
 Bioconjug Chem 2003; 14(4): 709–714, https://doi.org/10.1021/bc034038n.
Bioconjug Chem 2003; 14(4): 709–714, https://doi.org/10.1021/bc034038n. - Shah A.T., Skala M.C. Ex vivo label-free microscopy of head and neck cancer patient tissues. Proc. SPIE 9329, Multiphoton Microscopy in the Biomedical Sciences XV, 93292B (March 5, 2015), https://doi.org/10.1117/12.2075583.
- Ramanujam N., Richards-Kortum R., Thomsen S., Mahadevan-Jansen A., Follen M., Chance B. Low temperature fluorescence imaging of freeze-trapped human cervical tissues. Opt Express 2001; 8(6): 335–343, https://doi.org/10.1364/oe.8.000335.
- Liu Q., Grant G., Li J., Zhang Y., Hu F., Li S., Wilson C., Chen K., Bigner D., Vo-Dinh T. Compact point-detection fluorescence spectroscopy system for quantifying intrinsic fluorescence redox ratio in brain cancer diagnostics. J Biomed Opt 2011; 16(3): 037004, https://doi.org/10.1117/1.3558840.
- Georgakoudi I., Jacobson B.C., Müller M.G., Sheets E.E., Badizadegan K., Carr-Locke D.L., Crum C.P., Boone C.
 W., Dasari R.R., Van Dam J., Feld M.S. NAD(P)H and collagen as in vivo quantitative fluorescent biomarkers of epithelial precancerous changes. Cancer Res 2002; 62(3): 682–687.
W., Dasari R.R., Van Dam J., Feld M.S. NAD(P)H and collagen as in vivo quantitative fluorescent biomarkers of epithelial precancerous changes. Cancer Res 2002; 62(3): 682–687. - Müller M.G., Valdez T.A., Georgakoudi I., Backman V., Fuentes C., Kabani S., Laver N., Wang Z., Boone C.W., Dasari R.R., Shapshay S.M., Feld M.S. Spectroscopic detection and evaluation of morphologic and biochemical changes in early human oral carcinoma. Cancer 2003; 97(7): 1681–1692, https://doi.org/10.1002/cncr.11255.
- Yu Q., Heikal A.A. Two-photon autofluorescence dynamics imaging reveals sensitivity of intracellular NADH concentration and conformation to cell physiology at the single-cell level. J Photochem Photobiol B 2009; 95(1): 46–57, https://doi.org/10.1016/j.jphotobiol.2008.12.010.
- Tregidgo C., Levitt J.A., Suhling K. Effect of refractive index on the fluorescence lifetime of green fluorescent protein. J Biomed Opt 2008; 13(3): 031218, https://doi.org/10.1117/1.2937212.
- van Manen H.J., Verkuijlen P., Wittendorp P., Subramaniam V., van den Berg T.K., Roos D., Otto C. Refractive index sensing of green fluorescent proteins in living cells using fluorescence lifetime imaging microscopy. Biophys J 2008; 94(8): L67–L69, https://doi.org/10.1529/biophysj.107.127837.
- Lakowicz J.R., Szmacinski H., Nowaczyk K., Johnson M.L. Fluorescence lifetime imaging of free and protein-bound NADH. Proc Natl Acad Sci USA 1992; 89(4): 1271–1275, https://doi.org/10.1073/pnas.89.4.1271.
- Duncan R.R. Fluorescence lifetime imaging microscopy (FLIM) to quantify protein–protein interactions inside cells. Biochem Soc Trans 2006; 34(Pt 5): 679–682, https://doi.org/10.1042/bst0340679.
- Elson D., Webb S., Siegel J., Suhling K., Davis D., Lever J., Phillips D., Wallace A., French P. Biomedical applications of fluorescence lifetime imaging. Opt Photon News 2002; 13(11): 26–32, https://doi.org/10.1364/opn.13.11.000026.
- Campos-Delgado D.U., Navarro O.G., Arce-Santana E.R., Walsh A.J., Skala M.C., Jo J.A. Deconvolution of fluorescence lifetime imaging microscopy by a library of exponentials. Opt Express 2015; 23(18): 23748–23767, https://doi.org/10.1364/oe.23.023748.
- Becker W. Fluorescence lifetime imaging — techniques and applications. J Microsc 2012; 247(2): 119–136, https://doi.org/10.1111/j.1365-2818.2012.03618.x.
- Becker W., Bergmann A., Hink M.A., Konig K., Benndorf K., Biskup C. Fluorescence lifetime imaging by time-correlated single-photon counting. Microsc Res Tech 2004; 63(1): 58–66, https://doi.org/10.1002/jemt.10421.
- Skala M.C., Riching K.M., Bird D.K., Gendron-Fitzpatrick A., Eickhoff J., Eliceiri K.W., Keely P.J., Ramanujam N. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nadh in normal and pre-cancerous epithelia. J Biomed Opt 2007; 12(2): 024014, https://doi.org/10.1117/1.2717503.
- Kantelhardt S.R., Kalasauskas D., Konig K., Kim E., Weinigel M., Uchugonova A., Giese A. In vivo multiphoton tomography and fluorescence lifetime imaging of human brain tumor tissue. J Neurooncol 2016; 127(3): 473–482, https://doi.org/10.1007/s11060-016-2062-8.
- Seidenari S., Arginelli F., Dunsby C., French P.M., Konig K., Magnoni C., Talbot C., Ponti G. Multiphoton laser tomography and fluorescence lifetime imaging of melanoma: morphologic features and quantitative data for sensitive and specific non-invasive diagnostics. PLoS ONE 2013; 8(7): e70682, https://doi.org/10.1371/journal.pone.0070682.
- Ruck A., Hauser C., Mosch S., Kalinina S. Spectrally resolved fluorescence lifetime imaging to investigate cell metabolism in malignant and nonmalignant oral mucosa cells. J Biomed Opt 2014; 19(9): 096005, https://doi.org/10.1117/1.jbo.19.9.096005.
- Ramanujan V.K., Zhang J.H., Biener E., Herman B. Multiphoton fluorescence lifetime contrast in deep tissue imaging: prospects in redox imaging and disease diagnosis. J Biomed Opt 2005; 10(5): 051407, https://doi.org/10.1117/1.2098753.
- Vergen J., Hecht C., Zholudeva L.V., Marquardt M.M., Hallworth R., Nichols M.G. Metabolic imaging using two-photon excited NADH intensity and fluorescence lifetime imaging. Microsc Microanal 2012; 18(4): 761–770, https://doi.org/10.1017/S1431927612000529.
- Bird D.K., Yan L., Vrotsos K.M., Eliceiri K.W., Vaughan E.M., Keely P.J., White J.G., Ramanujam N. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Cancer Res 2005; 65(19): 8766–8773, https://doi.org/10.1158/0008-5472.can-04-3922.
- Islam M.S., Honma M., Nakabayashi T., Kinjo M., Ohta N. pH dependence of the fluorescence lifetime of FAD in solution and in cells. Int J Mol Sci 2013; 14(1): 1952–1963, https://doi.org/10.3390/ijms14011952.
- Horilova J., Cunderlikova B., Marcek Chorvatova A. Time- and spectrally resolved characteristics of flavin fluorescence in U87MG cancer cells in culture. J Biomed Opt 2015; 20(5): 051017, https://doi.org/10.1117/1.jbo.20.5.051017.
- Fatakdawala H., Poti S., Zhou F., Sun Y., Bec J., Liu J., Yankelevich D.R., Tinling S.P., Gandour-Edwards R.F., Farwell D.G., Marcu L. Multimodal in vivo imaging of oral cancer using fluorescence lifetime, photoacoustic and ultrasound techniques. Biomed Opt Express 2013; 4(9): 1724–1741, https://doi.org/10.1364/boe.4.001724.
- Adur J., Pelegati V.B., de Thomaz A.A., Baratti M.O., Almeida D.B., Andrade L.A., Bottcher-Luiz F., Carvalho H.F., Cesar C.L. Optical biomarkers of serous and mucinous human ovarian tumor assessed with nonlinear optics microscopies. PLoS ONE 2012; 7(10): e47007, https://doi.org/10.1371/journal.pone.0047007.
- Galletly N.P., McGinty J., Dunsby C., Teixeira F., Requejo-Isidro J., Munro I., Elson D.S., Neil M.A., Chu A.C., French P.M., Stamp G.W. Fluorescence lifetime imaging distinguishes basal cell carcinoma from surrounding uninvolved skin. Br J Dermatol 2008; 159(1): 152–161, https://doi.org/10.1111/j.1365-2133.2008.08577.x.
- McGinty J., Galletly N.P., Dunsby C., Munro I., Elson D.S., Requejo-Isidro J., Cohen P., Ahmad R., Forsyth A., Thillainayagam A.V., Neil M.A.A., French P.M.W., Stamp G.W. Wide-field fluorescence lifetime imaging of cancer. Biomed Opt Express 2010; 1(2): 627–640, https://doi.org/10.1364/boe.1.000627.
- Sun Y., Hatami N., Yee M., Phipps J., Elson D.S., Gorin F., Schrot R.J., Marcu L. Fluorescence lifetime imaging microscopy for brain tumor image-guided surgery. J Biomed Opt 2010; 15(5): 056022, https://doi.org/10.1117/1.3486612.
- Sun Y., Phipps J.E., Meier J., Hatami N., Poirier B., Elson D.S., Farwell D.G., Marcu L. Endoscopic fluorescence lifetime imaging for in vivo intraoperative diagnosis of oral carcinoma. Microscopy and Microanalysis 2013; 19(4): 791–798, https://doi.org/10.1017/s1431927613001530.
- Butte P.V., Mamelak A.N., Nuno M., Bannykh S.I., Black K.L., Marcu L. Fluorescence lifetime spectroscopy for guided therapy of brain tumors. Neuroimage 2011; 54(Suppl 1): S125–S135, https://doi.org/10.1016/j.neuroimage.2010.11.001.
— энергетический эффект — Биохимия
Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH2 – 2,0.
По современным данным значение коэффициента P/O для НАДH соответствует 2,5, для ФАДH2 – 1,5.
Для расчета количества АТФ, образованной при окислении глюкозы необходимо учитывать:
- Реакции, идущие с затратой или образованием АТФ и ГТФ,
- Реакции, продуцирующие НАДН и ФАДН2 и использующие их,
- Так как глюкоза образует две триозы, то все соединения, образующиеся ниже ГАФ-дегидрогеназной реакции, образуются в двойном (относительно глюкозы) количестве.
Расчет АТФ при анаэробном окислении
На подготовительном этапе на активацию глюкозы затрачивается 2 молекулы АТФ, фосфат каждой из которых оказывается на триозе – глицеральдегидфосфате и диоксиацетонфосфате.
В следующий второй этап входят две молекулы глицеральдегидфосфата, каждая из которых окисляется до пирувата с образованием 2-х молекул АТФ в седьмой и десятой реакциях – реакциях субстратного фосфорилирования. Таким образом, суммируя, получаем, что на пути от глюкозы до пирувата в чистом виде образуется 2 молекулы АТФ.
Однако надо иметь в виду и шестую, глицеральдегидфосфат-дегидрогеназную, реакцию, из которой выходит НАДН. Если условия анаэробные, то он используется в лактатдегидрогеназной реакции, где окисляется для образования лактата и в получении АТФ не участвует.
Расчет энергетического эффекта анаэробного окисления глюкозы
Аэробное окисление
Если в клетке имеется кислород, то НАДН из гликолиза направляется в митохондрию (челночные системы), на процессы окислительного фосфорилирования, и там его окисление приносит дивиденды в виде 2,5 молей АТФ.
Образовавшийся в гликолизе пируват в аэробных условиях превращается в ПВК-дегидрогеназном комплексе в ацетил-S-КоА, при этом образуется 1 молекула НАДН.
Ацетил-SКоА вовлекается в ЦТК и, окисляясь, дает 3 молекулы НАДН, 1 молекулу ФАДН2, 1 молекулу ГТФ. Молекулы НАДН и ФАДН2 движутся в дыхательную цепь, где при их окислении в сумме образуется 9 молекул АТФ. В целом при сгорании одной ацетогруппы в ЦТК образуется 10 молекул АТФ.
Расчет энергетического эффекта аэробного окисления глюкозы
Суммируя результаты окисления «гликолитического» и «пируватдегидрогеназного» НАДН, «гликолитический» АТФ, энергетический выход ЦТК и умножая все на 2, получаем 32 молекулы АТФ.
Гликолиз атф. Анаэробная фаза дыхания (гликолиз): этапы и энергетический выход
Прежде чем изучать клеточное дыхание подробно, полезно ознакомиться с ним в общих чертах. На рисунке указаны пути аэробного и анаэробного дыхания . Отметим, что аэробный путь только один, тогда как анаэробных два. Отметим также, что первый этап у всех этих путей общий. Этот этап — гликолиз.
Гликолиз
Гликолизом называется окисление глюкозы до пировиноградной кислоты. Как это видно из рисунка, из одной молекулы глюкозы (6-углеродного соединения, 6С) образуются две молекулы пировиноградной кислоты бета-углеродного соединения, 3С). Процесс протекает не в митохондриях, а в цитоплазме клетки, и кислород для него не требуется. Процесс может быть подразделен на три этапа:
1. Фосфорилирование сахара . В результате этой реакции сахар «активируется», т. е. его реакционная способность возрастает. При активации потребляется некоторое количество АТФ и, поскольку весь смысл дыхания состоит в том, чтобы поставлять АТФ, его расходование может показаться нецелесообразным. Это следует, однако, рассматривать как своего рода «инвестиции», благодаря которым позже смогут произойти реакции, приводящие к образованию АТФ.
2. Расщепление фосфорилированного 3С-сахара на два 3С-сахарофосфата. С этим связано и происхождение названия «гликолиз» (от греч. lysis — разложение, распад), Два образующихся сахарофосфата — изомеры. Прежде чем подвергнуться дальнейшему превращению, один из них переходит в другой, так что получается два идентичных 3С-сахарофосфата.
3. Окисление путем отщепления водорода .
Каждый 3С-сахарофосфат превращается в пировиноградную кислоту. При этом происходит дегидрирование с образованием одной молекулы восстановленного НАД и двух молекул АТФ. Общий выход (от двух молекул 3С-сахарофосфата) составляет: две молекулы восстановленного НАД и четыре молекулы АТФ.
Итак, на первом этапе гликолиза в реакциях фосфорилирования потребляются, две молекулы АТФ, а на третьем — образуются четыре молекулы. Таким образом, чистый выход АТФ при гликолизе равен двум молекулам. Кроме того, при гликолизе отщепляются и передаются НАД четыре атома водорода. Их судьбу мы рассмотрим позднее. Суммарную реакцию гликолиза можно записать так:
Потребление и выход различных веществ в процессе гликолиза указаны в таблице.
При использовании в процессе дыхания липидов глицерол легко превращается в 3С-сахарофосфат, который и вступает на путь гликолиза. При этом расходуется одна молекула АТФ и три молекулы образуются.
Конечная судьба пировиноградной кислоты зависит от присутствия кислорода в клетке. Если кислород имеется, то пировиноградная кислота переходит в митохондрии для полного окисления до СО2 и воды (аэробное дыхание). Если же кислорода нет, то она превращается либо в этанол, либо в молочную кислоту (анаэробное дыхание).
Глюкоза + 2 АДФ + 2 НАД + + 2 H 3 PO 4 2 Пируват + 2АТФ + 2 НАДН + 2 Н +
Челночные механизмы.
Перенос водорода с цитозольного НАДН в митохондрии происходит при участии специальных механизмов, называющихся челночными. Суть этих механизмов сводится к тому, что НАДН в цитозоле восстанавливает некоторое соединение, способное проникать в митохондрию; в митохондрии это соединение окисляется, восстанавливая внутримитохондриальный НАД + , и вновь переходит в цитозоль. Самая активная малат-аспартатная система, действующая в митохондриях печени, почек и сердца. На каждую пару электронов цитозольной НАДН, переданную на кислород по этой системе, образуется 3 молекулы АТФ.
В скелетных мышцах и мозге перенос восстановительных эквивалентов от цитозольной НАДН осуществляет глицеролфосфатная система. При этом восстановительные эквиваленты передаются в цепь переноса электронов через комплекс II, и поэтому синтезируется только 2 молекулы АТФ.
Выход атф при аэробном гликолизе.
Основное физиологическое значение аэробного распада глюкозы заключается в использовании ее энергии для синтеза АТФ.
В наибольшей зависимости от аэробного гликолиза находится мозг. Он расходует 100 г глюкозы в сутки. В состоянии основного обмена около 20% кислорода потребляется мозгом. Поэтому недостаток глюкозы или кислорода проявляется, прежде всего, симптомами со стороны центральной нервной системы — головокружением, потерей сознания, судорогами.
Анаэробный гликолиз.
При аэробных условиях продуктом гликолиза в тканях является пируват, а НАДН, образовавшийся в ходе окисления, реокисляется за счет молекулярного кислорода. В анаэробных условиях, т. е. при недостатке кислорода в тканях, например в напряженно работающих скелетных мышцах, образовавшийся НАДН реокисляется не за счет кислорода, а за счет пирувата, восстанавливающегося при этом в лактат (молочную кислоту). Восстановление пирувата до лактата катализирует изофермент лактатдегидрогеназа .
Лактатдегидрогеназа представляет собой тетрамер, содержащий протомеры двух типов — М (muscle) и Н (heart). Известно 5 изоферментов, различающихся набором протомеров.
Изомерные формы ЛДГ 1 и ЛДГ 2 обнаруживаются в мозге, сердце, корковом веществе почек, т.е. в тканях с интенсивным снабжением кислородом. Форма ЛДГ 3 — в поджелудочной железе, ЛДГ 4 и ЛДГ 5 в скелетных мышцах, печени, мозговом веществе почек, т.е. в тканях с менее интенсивным снабжением кислородом. Все эти формы ферментов значительно различаются максимальной скоростью реакции и константами Михаэлиса для лактата и пирувата. ЛДГ 5 быстро катализирует восстановление пирувата в лактат при низких концентрациях лактата. ЛДГ 1 катализирует быстрое окисление лактата в пируват в сердечной мышце.
В этой статье мы подробно рассмотрим аэробный гликолиз, его процессы, разберем стадии и этапы. Ознакомимся с анаэробным узнаем об эволюционных видоизменениях данного процесса и определим его биологическое значение.
Что такое гликолиз
Гликолиз — это одна из трех форм окисления глюкозы, при котором сам процесс окисления сопровождается выделением энергии, которая запасается в НАДН и АТФ. В процессе гликолиза из молекулы две молекулы кислоты пировиноградной.
Гликолиз — это процесс, происходящий под воздействием различных биологических катализаторов — ферментов. Главным окислителем служит кислород — О 2 , однако процессы гликолиза могут протекать и в его отсутствие. Такой вид гликолиза называют — анаэробный гликолиз.
Процесс гликолиза при отсутствии кислорода
Анаэробный гликолиз — ступенчатый процесс окисления глюкозы, при котором глюкоза окисляется не полностью. Образуется одна молекула пировиноградной кислоты. А с энергетической точки зрения, гликолиз без участия кислорода (анаэробный) является менее выгодным. Однако при поступлении кислорода в клетку анаэробный процесс окисления может превращаться в аэробный и протекать в полноценной форме.
Механизмы гликолиза
Процесс гликолиза — это разложение шестиуглеродной глюкозы на пируват трехуглеродный в виде двух молекул. Сам процесс разделяется на 5 этапов подготовки и 5 этапов, при которых запасается энергия в АТФ.
Процесс гликолиза из 2 стадий и 10 этапов выглядят следующим образом:
- 1 стадия, этап 1 — фосфорилирование глюкозы. По шестому атому углерода в глюкозе, сам сахарид активируют через фосфорилирование.
- Этап 2 — изомеризация глюкозы-6-фосфата. На этом этапе фосфоглюкозоимераза каталитический обращает глюкозу во фруктозу-6-фосфат.
- Этап 3 — Фруктоза-6-фосфат и её фосфорилирование. Этот этап заключается в образовании фруктозо-1,6-дифосфата (альдолаза) путем воздействия фосфофруктокиназы-1, которая сопровождает фосфорильную группу от аденозинтрифосфорной кислоты к молекуле фруктозы.
- Этап 4 — это процесс расщепления альдолазы с образованием двух молекул триозофосфата, а именно эльдозы и кетозы.
- Этап 5 — триозофосфаты и их изомеризация. На этом этапе глицеральдегид-3-фосфат отправляется на последующие этапы расщепления глюкозы, а дигидроксиацетонфосфат переходит в форму глицеральдегид-3-фосфата под воздействием фермента.
- 2 стадия, этап 6 (1) — Глицеральдегид-3-фосфат и его окисление — этап в котором данная молекула окисляется и фосфорилируется до дифосфоглицерата-1,3.
- Этап 7 (2) — направлен на перенос группы фосфатов на АДФ с 1,3-дифосфоглицерата. Конечными продуктами данного этапа являются образование 3-фосфоглицерата и АТФ.
- Этап 8 (3) — переход от 3-фосфоглицерата в 2-фосфоглицерат. Этот процесс происходит под воздействием фермента фосфоглицератмутаза. Обязательным условием протекания химической реакции является наличие магния (Mg).
- Этап 9 (4) — 2 фосфоглицерта дегидратируется.
- Этап 10 (5) — в АДФ и ФЕП переносятся фосфаты, полученные в результате прохождения предыдущих этапов. Энергия с фосфоэнулпировата переносится на АДФ. Для протекания реакции необходимо наличие ионов калия (K) и магния (Mg).
Видоизмененные формы гликолиза
Процесс гликолиза способен сопровождаться дополнительной выработкой 1,3 и 2,3-бифосфоглицератов. 2,3-фосфоглицерат под влиянием биологических катализаторов способен возвращаться в гликолиз и переходить в форму 3-фосфоглицерата. Роль данных ферментов разнообразная, например, 2,3-бифосфоглицерат, находясь в гемоглобине, заставляет кислород переходить в ткани, способствуя диссоциации и понижая сродство О 2 и эритроцитов.
Многие бактерии изменяют формы гликолиза на различных этапах, сокращая их общее количество или видоизменяя их под воздействием разных ферментов. Небольшая часть анаэробов имеет другие методы углеводного разложения. Многие термофилы вовсе имеют лишь 2 фермента гликолиза, это енолаза и пируваткиназа.
Гликоген и крахмал, дисахариды и другие виды моносахаридов
Аэробный гликолиз — это процесс, свойственный и другим видам углеводов, а конкретно он присущ крахмалу, гликогену, большинству дисахаридов (маноза, галактоза, фруктоза, сахароза и другие). Функции всех видов углеводов в целом направлены на получение энергии, но могут различаться спецификой своего назначения, использования и т. д. Например, гликоген поддается гликогенезу, что по сути, является фосфолитическим механизмом, нацеленным на получение энергии при расщеплении гликогена. Сам же гликоген может запасаться в организме как резервный источник энергии. Так, например, глюкоза, получаемая во время приёма пищи, но не усвоившаяся мозгом, накапливается в печени и будет использована при недостатке глюкозы в организме с целью защитить индивид от серьезных сбоев гомеостаза.
Значение гликолиза
Гликолиз — это уникальный, однако не единственный вид окисления глюкозы в организме, клетке как прокариотов, так и эукариотов. Ферменты гликолиза являются водорастворимыми. Реакция гликолиза в некоторых тканях и клетках может происходить только таким образом, например, в мозгу и клетках нефронов печени. Другие способы окисления глюкозы в этих органах не используются. Однако не везде функции гликолиза одинаковы. Например, жировые ткани и печени в процессе пищеварения добывают необходимые субстраты из глюкозы для синтеза жиров. Многие растения используют гликолиз как способ добычи основной части энергии.
Последующие этапы переваривания нерасщеплённого или частично расщеплённого крахмала, а также других углеводов пищи происходит в тонком кишечнике в разных его отделах под действием гадролитических ферментов — гликозидаз.
Панкреатическая α-амилаза
В двенадцатиперстной кишке рН среды желудочного содержимого нейтрализуется, так как секрет поджелудочной железы имеет рН 7,5-8,0 и содержит бикарбонаты (НСО 3 -). С секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-1,4-гликозидные связи в крахмале и декстринах.
Продукты переваривания крахмала на этом этапе — дисахарид мальтоза, содержащая 2 остатка глюкозы, связанные α-1,4-связью. Из тех остатков глюкозы, которые в молекуле крахмала находятся в местах разветвления и соединены α-1,6-гликозидной связью, образуется дисахарид изомальтоза. Кроме того, образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанные α-1,4- и α-1,6-связями.
α-Амилаза поджелудочной железы, так же, как α-амилаза слюны, действует как эндогликозидаза. Панкреатическая α-амилаза не расщепляет α-1,6-гликозидные связи в крахмале. Этот фермент также не гидролизует (3-1,4-гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы. Целлюлоза, таким образом, проходит через кишечник неизменённой. Тем не менее непереваренная целлюлоза выполняет важную функцию балластного вещества, придавая пище дополнительный объём и положительно влияя на процесс переваривания. Кроме того, в толстом кишечнике целлюлоза может подвергаться действию бактериальных ферментов и частично расщепляться с образованием спиртов, органических кислот и СО 2 . Продукты бактериального расщепления целлюлозы важны как стимуляторы перистальтики кишечника.
Мальтоза, изомальтоза и триозосахариды, образующиеся в верхних отделах кишечника из крахмала, — промежуточные продукты. Дальнейшее их переваривание происходит под действием специфических ферментов в тонком кишечнике. Дисахариды пищи сахароза и лактоза также гидролизуются специфическими дисахаридазами в тонком кишечнике.
Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника.
Тонкий кишечник изнутри имеет форму пальцеобразных выростов — ворсинок, покрытых эпителиальными клетками. Эпителиальные клетки, в свою очередь, покрыты микроворсинками, обращёнными в просвет кишечника. Эти клетки вместе с ворсинками образуют щёточную каёмку, благодаря которой увеличивается поверхность контакта гидролитических ферментов и их субстратов в содержимом кишечника. На 1 мм 2 поверхности тонкой кишки у человека приходится 80-140 млн ворсинок.
Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов.
Сахаразо-изомальтазный комплекс
Этот ферментативный комплекс состоит из двух полипептидных цепей и имеет доменное строение. Сахаразо-изомальтазный комплекс прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного (трансмембранного) домена, образованного N-концевой частью полипептида. Каталитический центр выступает в просвет кишечника.
Сахаразо-изомальтазный комплекс. 1 — сахараза; 2 — изомальтаза;
3 — связывающий домен; 4 — трансмембранный домен; 5 — цитоплазматический домен.
Связь этого пищеварительного фермента с мембраной способствует эффективному поглощению продуктов гидролиза клеткой.
Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу, расщепляя α-1,2- и α-1,6-гликозидные связи. Кроме того, оба ферментных домена имеют мальтазную и мальтотриазную активности, гидролизуя α-1,4-гликозидные связи в мальтозе и мальтотриозе (трисахарид, образующийся из крахмала). На долю сахаразо-изомальтазного комплекса приходится 80% от всей мальтазной активности кишечника. Но несмотря на присущую ему высокую мальтазную активность, этот ферментативный комплекс назван в соответствии с основной специфичностью. К тому же сахаразная субъединица — единственный фермент в кишечнике, гадролизующий сахарозу. Изомальтазная субъединица с большей скоростью гидролизует гликозидные связи в изомальтозе, чем в мальтозе и мальтотриозе.
Действие сахаразо-изомальтазного комплекса на мальтозу и мальтотриозу.
Действие сахаразо-изомальтазного комплекса на изомальтозу и олигосахарид.
В тощей кишке содержание сахаразо-изомальтазного ферментативного комплекса достаточно высокое, но оно снижается в проксимальной и дистальной частях кишечника.
Гликоамилазный комплекс
Этот ферментативный комплекс катализирует гидролиз α-1,4-связи между глюкозными остатками в олигосахаридах, действуя с восстанавливающего конца. По механизму действия этот фермент относят к экзогликозидазам. Комплекс расщепляет также связи в мальтозе, действуя как мальтаза. В гликоамилазный комплекс входят две разные каталитические субъединицы, имекдцие небольшие различия в субстратной специфичности. Гликоамилазная активность комплекса наибольшая в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза)
Лактаза расщепляет
β-1,4-гликозидные связи между галактозой
и глюкозой в лактозе.
Этот ферментативный комплекс по химической природе является гликопротеином. Лактоза, как и другие гликозидазные комплексы, связана с щёточной каемкой и распределена неравномерно по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста. Так, активность лактазы у плода особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность фермента снижается, составляя у взрослых 10% от уровня активности, характерного для детей.
Трегалаза — также гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе — дисахариде, содержащемся в грибах. Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода.
Совместное действие всех перечисленных ферментов завершает переваривание пищевых олиго- и полисахаридов с образованием моносахаридов, основной из которых — глюкоза. Кроме глюкозы, из углеводов пищи также образуются фруктоза и галактоза, в меньшем количестве — манноза, ксилоза, арабиноза.
МЕХАНИЗМ ТРАНСМЕМБРАННОГО ПЕРЕНОСА ГЛЮКОЗЫ И ДРУГИХ МОНОСАХАРИДОВ В КЛЕТКИ
Моносахариды, образовавшиеся в результате переваривания, всасываются эпителиальными клетками кишечника с помощью специальных механизмов транспорта через мембраны этих клеток.
Всасывание моносахаридов в кишечнике
Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться разными способами: путём облегчённой диффузии по градиенту концентрации и активного транспорта по механизму симпорта за счет градиента концентрации ионов Na + . Na + поступает в клетку по градиенту концентрации, и одновременно глюкоза транспортируется против градиента концентрации (вторично-активный транспорт). Следовательно, чем больше градиент Na + , тем больше поступление глюкозы в энтероциты. Если концентрация Na + во внеклеточной жидкости уменьшается, транспорт глюкозы снижается. Градиент концентрации Na + , являющийся движущей силой активного симпорта, создаётся работой Nа + , К + -АТФ-азы, которая работает как насос, откачивая из клетки Na + в обмен на К + . В отличие от глюкозы, фруктоза транспортируется системой, не зависящей от градиента натрия.
Перенос в клетки слизистой оболочки кишечника по механизму вторично-активного транспорта характерен также для галактозы.
При разной концентрации глюкозы в просвете кишечника «работают» различные механизмы транспорта. Благодаря активному транспорту эпителиальные клетки кишечника могут поглощать глюкозу при её очень низкой концентрации в просвете кишечника. Если же концентрация глюкозы в просвете кишечника велика, то она может транспортироваться в клетку путём облегчённой диффузии. Таким же способом может всасываться и фруктоза. Следует отметить, что скорость всасывания глюкозы и галактозы гораздо выше, чем других моносахаридов.
После всасывания моносахариды (главным образом, глюкоза) покидают клетки слизистой оболочки кишечника через мембрану с помощью облегчённой диффузии в кровеносную систему.
В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват.
Многие клетки организма способны к анаэробному окислению глюкозы. Для эритроцитов он является единственным источником энергии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта. Вне физических нагрузок бескислородное окисление глюкозы в клетках усиливается при гипоксии – при различного рода анемиях , при нарушении кровообращения в тканях независимо от причины.
Гликолиз
Анаэробное превращение глюкозы локализуется в цитозоле и включает два этапа из 11 ферментативных реакций.
Первый этап гликолиза
Первый этап гликолиза – подготовительный , здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов .
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой .
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент глюкозофосфат-изомераза ). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат- альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы . Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
- при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза,
- при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
Второй этап гликолиза
Второй этап гликолиза – это освобождение энергии , содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ .
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа ) – окисление глицеральдегидфосфата и присоединение к нему фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа ) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название – , что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (использование энергии электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ и образовании пировиноградной кислоты.
Последняя реакция бескислородного окисления глюкозы, одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы . Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях.
Сколько молекул атф образуется при полном окислении. Полное окисление глюкозы. Реакция окисления глюкозы. Расчет АТФ при анаэробном окислении
Определим теперь выход химической энергии в форме АТР при окислении глюкозы в животных клетках до и .
Гликолитическое расщепление одной молекулы глюкозы в аэробных условиях дает две молекулы пирувата, две молекулы NADH и две молекулы АТР (весь этот пропесс протекает в цитозоле):
Затем две пары электронов от двух молекул цитозольного NADH, образовавшихся в процессе гликолиза под действием глицеральдегидфосфатдегидрогеназы (разд. 15.7), переносятся в митохондрии при помощи малат-аспартатной челночной системы. Здесь они поступают в цепь переноса электронов и направляются через ряд последовательных переносчиков на кислород. Этот процесс дает поскольку окисление двух молекул NADH описывается следующим уравнением:
(Конечно, если вместо малат-аспартатной челночной системы действует глицеролфосфатная, то на каждую молекулу NADH образуются не три, а только две молекулы АТР.)
Теперь мы можем написать полное уравнение окисления двух молекул пирувата с образованием двух молекул ацетил-СоА и двух молекул в митохондриях. В результате этого окисления образуются две молекулы NADH. которые передают затем два своих электрона через дыхательную цепь на кислород, что сопровождается синтезом трех молекул АТР на каждую пару перенесенных электронов:
Напишем также уравнение для окисления двух молекул ацетил-СоА до через цикл лимонной кислоты и для окислительного фосфорилирования, сопряженного с переносом на кислород электронов, отщепляемых от изоцитрата, -кетоглутарата и малата: при этом на каждую пару перенесенных электронов образуются по три молекулы АТР. Добавим к этому две молекулы АТР, образующиеся при окислении сукцината, и еще две, которые образуются из сукцинил-СоА через GTP (разд. 16.5,д):
Если теперь просуммировать эти четыре уравнения и сократить общие члены, то мы получим суммарное уравнение для гликолиза и дыхания:
Итак, на каждую молекулу глюкозы, претерпевающую полное окисление до в печени, почках или миокарде, т. е. там, где функционирует малат-аспартатная челночная система, образуется максимум 38 молекул АТР. (Если вместо малат-аспартатной системы действует глицеролфосфатная, то на каждую полностью окисленную молекулу глюкозы образуется 36 молекул АТР.) Теоретический выход свободной энергии при полном окислении глюкозы равен, таким образом, в стандартных условиях (1,0 М). В интактных же клетках эффективность этого превращения, вероятно, превышает 70%, поскольку внутриклеточные концентрации глюкозы, и АТР не одинаковы и значительно ниже 1,0 М, т.е. той концентрации, из которой принято исходить при расчетах стандартной свободной энергии (см. дополнение 14-2).
В данной статье рассмотрим, как происходит окисление глюкозы. Углеводы представляют собой соединения полигидроксикарбонильного типа, а также их производные. Характерные признаки — наличие альдегидных или кетонной групп и не меньше двух групп гидроксильных.
По своей структуре углеводы подразделяются на моносахариды, полисахариды, олигосахариды.
Моносахариды
Моносахариды являются наиболее простыми углеводами, которые не могут быть подвергнуты гидролизу. В зависимости от того, какая группа присутствует в составе — альдегидная или кетонная, выделяют альдозы (к ним относятся галактоза, глюкоза, рибоза) и кетозы (рибулоза, фруктоза).
Олигосахариды
Олигосахариды представляют собой углеводы, которые имеют в своем составе от двух до десяти остатков моносахаридного происхождения, соединенных посредством гликозидных связей. В зависимости от количества остатков моносахаридов различают дисахариды, трисахариды и так далее. Что при окислении глюкозы образуется? Об этом будет рассказано позднее.
Полисахариды
Полисахариды представляют собой углеводы, которые содержат более чем десять моносахаридных остатков, соединенных между собой гликозидными связями. Если в составе полисахарида содержатся одинаковые моносахаридные остатки, то он называется гомополисахаридом (к примеру, крахмал). Если же такие остатки разные — то гетерополисахаридом (к примеру, гепарин).
Какое значение имеет окисление глюкозы?
Функции углеводов в организме человека
Углеводы выполняют следующие основные функции:
- Энергетическая. Самая главная функция углеводов, так как они служат основным источником энергии в организме. В результате их окисления удовлетворяется более половины энергетической потребности человека. В результате окисления одного грамма углеводов высвобождается 16,9 кДж.
- Резервная. Гликоген и крахмал являются формой накопления питательных веществ.
- Структурная. Целлюлоза и некоторые другие полисахаридные соединения образуют в растениях прочный остов. Также они, в комплексе с липидами и белками, являются составляющей всех клеточных биомембран.
- Защитная. Для кислых гетерополисахаридов отведена роль биологического смазочного материала. Они выстилают поверхности суставов, которые соприкасаются и трутся друг об друга, слизистые носа, пищеварительных путей.
- Антигоагулянтная. Такой углевод, как гепарин, имеет важное биологическое свойство, а именно — препятствует свертыванию крови.
- Углеводы представляют собой источник углерода, необходимый для синтеза белков, липидов и нуклеиновых кислот.
В процессе подсчета гликолитической реакции необходимо учитывать, что каждая ступень второй стадии повторяется два раза. Из этого можно сделать вывод о том, что на первой стадии тратится две АТФ-молекулы, а при протекании второй стадии образуется 4 АТФ-молекулы путем фосфорилирования субстратного типа. Это значит, что в результате окисления каждой молекулы глюкозы клетка накапливает две АТФ-молекулы.
Мы рассмотрели окисление глюкозы кислородом.
Анаэробный путь глюкозного окисления
Аэробным окислением называют процесс окисления, при котором происходит выделение энергии и который протекает в присутствии кислорода, выступающего конечным акцептором водорода в цепи дыхания. Донором выступает восстановленная форма коферментов (ФАДН2, НАДН, НАДФН), которые образуются при промежуточной реакции субстратного окисления.
Процесс окисления глюкозы аэробного дихотомического типа представляет собой основной путь катаболизма глюкозы в человеческом организме. Такой тип гликолиза может осуществляться во всех тканях и органах человеческого организма. Результатом этой реакции является расщепление молекулы глюкозы до воды и углекислого газа. Выделенная энергия при этом будет аккумулирована в АТФ. Этот процесс можно условно разделить на три этапа:
- Процесс превращения молекулы глюкозы в пару молекул пировиноградной кислоты. Реакция происходит в клеточной цитоплазме и представляет собой специфический путь глюкозного распада.
- Процесс образования ацетил-КоА в результате окислительного декарбоксилирования пировиноградной кислоты. Данная реакция протекает в клеточных митохондриях.
- Процесс окисления ацетил-КоА в цикле Кребса. Реакция протекает в клеточных митохондриях.
На каждой стадии данного процесса образуются восстановленные формы коферментов, окисляющихся посредством ферментных комплексов дыхательной цепи. В результате образуется АТФ при окислении глюкозы.
Образование коферментов
Коферменты, которые образуются на втором и третьем этапе аэробного гликолиза, будут окисляться непосредственно в митохондриях клеток. Параллельно с этим НАДН, которой образовался в клеточной цитоплазме при протекании реакции первого этапа аэробного гликолиза, не имеет способности к проникновению сквозь мембраны митохондрий. Водород переносится с цитоплазматического НАДН в клеточные митохондрии посредством челночных циклов. Среди таких циклов можно выделить основной — малат-аспартатный.
Затем при помощи цитоплазматического НАДН происходит восстановление оксалоацетата в малат, который, в свою очередь, проникает в клеточную митохондрию и затем окисляется с восстановлением митохондриальной НАД. Оксалоацетат возвращается в цитоплазму клетки в виде аспартата.
Видоизмененные формы гликолиза
Протекание гликолиза дополнительно может сопровождаться выделением 1,3 и 2,3-бифосфоглицератов. При этом 2,3-бифосфоглицерат под воздействием биологических катализаторов может возвращаться в процесс гликолиза, а затем изменять свою форму на 3-фосфоглицерат. Данные ферменты играют разнообразные роли. К примеру, 2,3-бифосфоглицерат, находящийся в гемоглобине, способствует переходу кислорода в ткани, способствуя при этом диссоциации и понижению сродства кислорода и эритроцитов.
Заключение
Многие бактерии могут изменять формы протекания гликолиза на его различных этапах. При этом возможно сокращение их общего количества или видоизменение этих этапов в результате воздействия различных ферментных соединений. Некоторые из анаэробов имеют способность к другим способам разложения углеводов. Большая часть термофилов имеет всего два гликолизных фермента, в частности енолазу и пируваткиназу.
Мы рассмотрели, как протекает окисление глюкозы в организме.
Мы можем определить общее количество молекул АТФ , которое образуется при расщеплении 1 молекулы глюкозы при оптимальных условиях.
1. Во время гликолиза образуются 4 молекулы АТФ: 2 молекулы АТФ расходуются на первом этапе фосфорилирования глюкозы, необходимого для хода процесса гликолиза, чистый выход АТФ при гликолизе равен 2 молекулам АТФ.
2. В итоге цикла лимонной кислоты образуется 1 молекула АТФ. Однако в связи с тем, что 1 молекула глюкозы расщепляется на 2 молекулы пировиноградной кислоты, каждая из которых проходит оборот в цикле Кребса, получается чистый выход АТФ на 1 молекулу глюкозы, равный 2 молекулам АТФ.
3. При полном окислении глюкозы суммарно образуются 24 атома водорода в связи с процессом гликолиза и циклом лимонной кислоты, 20 из них окисляются в соответствии с хемо-осмотическим механизмом с выделением 3 молекул АТФ на каждые 2 атома водорода. В итоге получается еще 30 молекул АТФ.
4. Четыре оставшихся атома водорода выделяются под влиянием дегидрогеназ и включаются в цикл хемоосмотического окисления в митохондриях помимо первой стадии. Окисление 2 атомов водорода сопровождается получением 2 молекул АТФ, в итоге получается еще 4 молекулы АТФ.
Сложив все полученные молекулы , получим 38 молекул АТФ как максимально возможное количество при окислении 1 молекулы глюкозы до углекислого газа и воды. Следовательно, 456000 калорий могут сохраняться в виде АТФ из 686000 калорий, получаемых при полном окислении 1 грамм-молекулы глюкозы. Эффективность преобразования энергии, обеспечиваемая этим механизмом, составляет около 66%. Остальные 34% энергии преобразуются в тепловую и не могут быть использованы клетками для выполнения специфических функций.
Выделение энергии из гликогена
Продолжительное высвобождение энергии из глюкозы , когда клетки не нуждаются в энергии, было бы слишком расточительным процессом. Гликолиз и последующее окисление атомов водорода постоянно контролируются в соответствии с потребностями клеток в АТФ. Этот контроль осуществляется многочисленными вариантами управляющих механизмов обратной связи в ходе химических реакций. К числу наиболее важных влияний такого рода можно отнести концентрацию АДФ и АТФ, контролирующую скорость химических реакций в ходе процессов обмена энергии.
Одним из важных путей , позволяющих АТФ управлять обменом энергии, является ингибирование фермента фосфофруктокиназы. Этот фермент обеспечивает образование фруктозо-1,6-дифосфата — одной из начальных стадий гликолиза, поэтому результирующим влиянием избытка АТФ в клетке будет торможение или даже остановка гликолиза, что, в свою очередь, приведет к торможению обмена углеводов. АДФ (равно как и АМФ) оказывает противоположное влияние на фосфофруктокиназу, существенно повышая ее активность. Когда АТФ используется тканями для энергообеспечения большинства химических реакций в клетках, это уменьшает ингибирование фермента фосфофруктокиназы, более того, его активность повышается параллельно увеличению концентрации АДФ. В результате запускаются процессы гликолиза, приводящие к восстановлению запасов АТФ в клетках.
Другой способ управления опосредован цитратами , образующимися в цикле лимонной кислоты. Избыток этих ионов существенно снижает активность фосфофруктокиназы, что не дает гликолизу опережать скорость использования пировиноградной кислоты, образующейся в результате гликолиза в цикле лимонной кислоты.
Третий способ, с помощью которого система АТФ-АДФ-АМФ может контролировать обмен углеводов и управлять выделением энергии из жиров и белков, заключается в следующем. Возвращаясь к различным химическим реакциям, служащим способом выделения энергии, мы можем заметить, что если весь имеющийся в наличии АМФ уже превращен в АТФ, дальнейшее образование АТФ становится невозможным. В результате прекращаются все процессы использования питательных веществ (глюкозы, белков и жиров) для получения энергии в виде АТФ. Лишь после использования образовавшегося АТФ в качестве источника энергии в клетках для обеспечения разнообразных физиологических функций вновь появляющиеся АДФ и АМФ запустят процессы получения энергии, в ходе которых АДФ и АМФ преобразуются в АТФ. Этот путь автоматически поддерживает сохранение определенных запасов АТФ, кроме случаев экстремальной активности клеток, например при тяжелых физических нагрузках.
1. Ферментами гликогенолиза являются
+ фосфорилаза
+ фосфофруктокиназа
– глюкокиназа
+ пируваткиназа
2. Какими ферментными системами отличается глюконеогенез от гликолиза?
+ пируваткарбоксилазой, фосфоенолпируваткарбоксикиназой,
+ фосфоенолпируваткарбоксикиназой, фруктозодифосфатазой,
– пируваткарбоксилазой, фруктозоди-фосфатазой, глюкозо-6-фосфатазой, альдолазой
+ пируваткарбоксилазой, фосфоенолпируват-карбоксикиназой, фруктозодифосфатазой и глюкозо-6-фосфатазой
– гексокиназой, глюкозо-6-фосфатазой, глицераткиназой и триозофосфатизомеразой
3. При участии каких витаминов осуществляется окислительное декарбоксилирование пировиноградной кислоты?
+ В1;
+ В2;
+ В3;
+ В5;
– В6.
4. При участии каких ферментов глюкозо-6-фосфат превращается в рибулозо-5-фосфат?
– глюкозофосфатизомеразы
+ глюконолактоназы
+ глюкозо-6-фосфатдегидрогеназы
+ фосфоглюконатдегидрогеназы
– трансальдолаза
5. Какие функции выполняет гликоген?
+ энергетическую
+ регуляторную
+ резервную
– транспортную
– структурную
6. Для оптимальной активности фосфофруктокиназы необходимо наличие
– АТФ, цитрата
– НАД(восстановленная), Н2О2
+ НАД, АМФ
– АМФ, НАДФ(восстановленная) и фосфорная кислота
+ НАД, ионы магния
7. Исследование каких показателей крови и мочи следует провести для оценки состояния углеводного обмена?
+ галактоза
– мочевина
+ рН
+ удельный вес мочи
+ тест толерантности к глюкозе
8. Какие соединения являются субстратом, продуктом реакции и ингибитором ЛДГ1,2
+ молочная кислота
– яблочная кислота
+ пировиноградная кислота
– лимонная кислота
+ НАДН2
9. Сколько молекул НАДН2 и углекислого газа может образоваться при полном окислении 1 молекулы ПВК
– 3 НАДН2
+ 3 СО2
+ 4 НАДН2
– 4 СО2
– 2 НАДН2
10. Какие симптомы характерны для клинической картины аденомы островков Лангерганса?
+ гипогликемия
– гипергликемия
– глюкозурия
+ потеря сознания
+ судороги
11. Какие ферменты принимают участие в гликолизе
+ альдолаза
– фосфорилаза
+ енолаза
+ пируваткиназа
+ фосфофруктокиназа
– пируваткарбоксилаза
6. В реакциях превращения лактата в ацетил-КоА участвуют ферменты
+ ЛДГ1
– ЛДГ5
– пируваткарбоксилаза
+ пируватдегидрогеназа
– сукцинатдегидрогеназа
7. Биосинтезом какого количества макроэргических связей сопровождается полное окисление молекулы глюкозы по дихотомическому пути при участии цикла Кребса
– 12
– 30
– 35
+ 36
+ 38
8. Реакции дегидрирования в пентозном цикле идут с участием
– НАД
– ФАД
+ НАДФ
– ФМН
– тетрагидрофолиевой кислоты
9. В каких органах и тканях создается резерв гликогена для всего организма?
– скелетные мышцы
– миокард
– мозг
+ печень
– селезенка
10. Фосфофруктокиназа ингибируется
– АМФ
+ НАДН2
+ АТФ
– НАД
+ цитратом
11. Исследование каких биохимических показателей мочи следует провести для выявления нарушений углеводного обмена?
+ сахар
+ кетоновые тела
+ удельный вес мочи
– белок
+ рН
– индикан
12. Что является причиной повышенной хрупкости эритроцитов при наследственном заболевании гемолитическая лекарственная анемия
+ недостаточность глюкозо-6-фосфатдегидрогеназы в эритроцитах
+ недостаточность витамина в5
+ недостаточность инсулина
– гиперпродукция инсулина
+ нарушение восстановления глутатиона
13. Сколько моль АТФ образуется при полном окислении 1 молекулы фруктозо-1,6-дифосфата
– 36
+ 38
+ 40
– 15
– 30
14. Какие ферменты принимают участие в превращении аспартата в фосфоенолпируват
+ аспартатаминотрансфераза
– пируватдекарбоксилаза
– лактатдегидрогеназа
– пируваткарбоксилаза
15. Для превращения фруктозо-6-фосфата во фруктозо-1,6-дифосфат, кроме соответствующего фермента, необходим
– АДФ
– НАДФ
+ ионы магния
+ АТФ
– фруктозо-1-фосфат
16. Глюконеогенез в организме человека возможен из следующих предшественников
– жирных кислот, кетогенных аминокислот
+ пирувата, глицерина
– уксусной кислоты, этилового спирта
+ лактата, щук
+ гликогенных аминокислот и диоксиацетонфосфата
17. Какой конечный продукт образуется при окислительном декарбоксилировании пировиноградной кислоты в аэробных условиях?
– лактат
+ ацетил-КоА
+ углекислый газ
– оксалоацетат
+ НАДН2
18. С помощью какого фермента осуществляется декарбоксилирование в пентозном цикле?
– глюконолактоназа
– глюкозофосфатизомераза
+ фосфоглюконатдегидрогеназа
– транскетолаза
19. Укажите ферменты, участвующие в мобилизации гликогена до глюкозо-6-фосфата
– фосфатаза
+ фосфорилаза
+ амило-1,6-гликозидаза
+ фосфоглюкомутаза
– гексокиназа
20. Какие гормоны активируют глюконеогенез?
– глюкагон
+ актг
+ глюкокортикоиды
– инсулин
– адреналин
21. К гипергликемии могут привести
– большая физическая нагрузка
+ стрессовые ситуации
+ избыточное употребление углеводов с пищей
+ болезнь иценко-кушинга
+ гипертиреоз
22. Какие ферменты и витамины принимают участие в окислительном декарбоксилирование альфа-кетоглютарата
+ альфа-кетоглютаратдегидрогеназа
+ дигидролипоатдегидрогеназа
– сукцинил-КоА-тиокиназа
+ В1 и В2
– В3 и В6
+ В5 и липоевая кислота
23. Какие продукты образуются при участии алкогольдегидрогеназы
– углекислый газ
+ этиловый спирт
– уксусная кислота
+ НАДН2
+ НАД
+ уксусный альдегид
24. Какие из указанных ниже симптомов характерны для клинической картины болезни Гирке
+ гипогликемия, гиперурикемия
+ гиперлипидемия, кетонемия
+ гипергликемия, кетонемия
+ гиперлактатемия, гиперпируватемия
– гиперпротеинемия, азотурия
25. Глицероальдегидфосфатдегидрогеназа содержит в связанном с белком состоянии
+ НАД
– НАДФ
– АТФ
– ионы меди (п)
+ Sн-группы
26. Глюконеогенез интенсивно протекает
– скелетных мышцах
– миокарде и мозге
+ в печени
– селезенке
+ корковый слой почек
27. С превращением какого субстрата в ЦТК связан синтез ГТФ?
– альфа-кетоглутарата
– фумарата
– сукцината
+ сукцинил-КоА
– изоцитрата
28. Какие из перечисленных ниже ферментов участвует в прямом окислении глюкозы?
– пируваткарбоксилаза
+ глюкозо-6-фосфатдегидрогеназа
– лактатдегидрогеназа
– альдолаза
+ 6-фосфоглюконатдегидрогеназа
+ трансальдолаза
29. Какой нуклеозидтрифосфат необходим для синтеза гликогена из глюкозы?
+ УТФ
– ГТФ
+ АТФ
– ЦТФ
– ТТФ
30. Какие гормоны блокируют глюконеогенез?
– глюкагон
– адреналин
– кортизол
+ инсулин
– СТГ
31. Какое из предлагаемых исследований необходимо в первую очередь провести для подтверждения сахарного диабета?
+ определить уровень кетоновых тел крови
+ определить уровень глюкозы крови натощак
– определить содержание холестерина и липидов в крови
+ определить рН крови и мочи
+ определить толерантность к глюкозе
32. Назовите субстраты окисления в ЦТК
– щук
+ изоцитрат
+ альфа-кетаглютарат
– фумарат
+ малат
+ сукцинат
33. Какие из указанных ниже симптомов характерны для клинической картины болезни Тэрье
– гиперлактатемия
– гиперпируватемия
– гипогликемия
+ болезненные мышечные судороги при интенсивных физических упражнениях
+ миоглобинурия
34. Какие продукты образуются из ПВК при действии пируватдекарбоксилазы
– уксусная кислота
+ уксусный альдегид
+ углекислый газ
– этанол
– лактат
35. Превращение глюкозо-6-фосфата во фруктозо-1,6-дифосфат осуществляется в присутствии
– фосфоглюкомутазы
– альдолазы
+ глюкозофосфатизомеразы
– глюкозофосфатизомеразы и альдолазы
+ фосфофруктокиназы
36. Какой фермент глюконеогенеза является регуляторным?
– енолаза
– альдолаза
– глюкозо-6-фосфатаза
+ фруктозо-1,6-дифосфатаза
+ пируваткарбоксилаза
37. Какие метоболиты ЦТК окисляются с участием НАД-зависимых дегидрогеназ
+ альфа-кетоглютарат
– уксусная кислота
– янтарная кислота
+ изолимонная кислота
+ яблочная кислота
38. Коферментом каких энзимов является тиаминпирофосфат?
– трансальдолаза
+ транскетолаза
+ пироватдегидрогеназа
+ пируватдекарбоксилаза
39. Какое ферментативные системы отличают гликолиз и гликогенолиз?
+ фосфорилаза
– глюкозо-6-фосфатдегидрогеназа
+ фосфоглюкомутаза
– фруктозо-1,6-бисфосфатаза
+ глюкокиназа
40. Какие из гормонов повышают уровень сахара в крови?
– инсулин
+ адреналин
+ тироксин
– окситоцин
+ глюкагон
41. При каком заболевании наблюдается увеличение печени, недостаточность роста, тяжелая гипогликемия, кетоз, гиперлипидемия, гиперурикемия?
– болезнь Кори
– болезнь Мак-Ардля
+ болезнь Гирке
– болезнь Андерсена
– болезнь Вильсона
42. Какие витамины входят в состав ферментов ПФЦ
+ В1
– В3
+ В5
– В6
– В2
43. Какие из указанных ниже симптомов характерны для клинической картины агликогенозов
+ резкая гипогликемия натощак
+ рвота
+ судороги
+ умственная отсталость
– гипергликемия
+ потеря сознания
44. Какие ферменты гликолиза участвуют в субстратном фосфорилировании
– фосфофруктокиназа
+ фосфоглицераткиназа
– гексокиназа
– фосфоенолпируваткарбоксикиназа
+ пируваткиназа
45. Какие ферменты осуществляют превращение фруктозо-1,6-дифосфата в фосфотриозы и фруктозо-6-фосфат
– енолаза
+ альдолаза
– триозофосфатизомераза
+ фруктозодифосфатаза
– глюкозофосфатизомераза
46. Какие из перечисленных соединений являются исходными субстратами глюконеогенеза
+ яблочная кислота
– уксусная кислота
+ глицеролфосфат
– жирные кислоты
+ молочная кислота
47. Какой метаболит образуется при конденсации ацетил-КоА со ЩУК
+ цитрил-КоА
+ лимонная кислота
– янтарная кислота
– молочная кислота
– альфа-кетоглутаровая кислота
48. Какое количество НАДФН2 образуется при полном окислении 1 молекулы глюкозы по прямому пути распада?
– 6 молекул
– 36 молекул
+ 12 молекул
– 24 молекулы
– 26 молекул
49. Где локализуются ферменты, отвечающие за мобилизацию и синтез гликогена?
+ цитоплазма
– ядро
– рибосомы
– митохондрии
– лизосомы
50. Какие из гормонов понижают уровень сахара в крови?
– тироксин
– АКТГ
+ инсулин
– глюкагон
– гормон роста
51. У обследуемого наблюдается гипогликемия, дрожь, слабость, утомляемость, потливость, постоянное чувство голода, возможны нарушения мозговой деятельности, что является причиной этих симптомов?
– гиперфункция щитовидной железы
+ гиперфункция бета-клеток островков Лангерганса поджелудочной железы
+ гиперфункция альфа-клеток островков Лангерганса поджелудочной железы
– аденома островков Лангерганса поджелудочной железы
52. Какие витамины входят в состав ферментных систем,катализирующих превращение сукцинил-КоА в фумаровую кислоту
– В1
+ В2
+ В3
– В5
– Н
53. Дефект какого фермента наблюдается при болезни Мак-Ардля
– фосфорилазы печени
– гликогенсинтетазы миокарда
+ фосфорилазы мышечной ткани
– фосфофруктокиназы мышц
– фермента печени
54. Какие продукты образуются при субстратном фосфорилировании в цЦТК
– малат
+ сукцинат
– фумарат
+ ГТФ
+ НSКоА
– НАДН2
– гиперфункция альфа-клеток островков Лангерганса поджелудочной железы
– гиперфункция коркового слоя надпочечников
55. Что является активной формой глюкозы в синтезе гликогена
+ глюкозо-6-фосфат
+ глюкозо-1-фосфат
– УДФ-глюкуронат
+ УДФ-глюкоза
– УДФ-галактоза
56. Какая из реакций не протекает в ЦТК
– дегидратация лимонной кислоты с образованием цис-аконитовой кислоты
– окислительное декарбоксилирование альфа-кетоглутарата с образованием сукцинил-КоА
– гидратация фумаровой кислоты с образованием яблочной кислоты
+ декарбоксилирование лимонной кислоты с образованием оксалосукцината
– дегидрирование янтарной кислоты с образованием фумаровой кислоты
+ окислительное декарбоксилирование ЩУК с участием НАДФ-зависимой малатдегидрогеназы
57. Из какого метаболита синтез глюкозы по пути глюконеогенеза идет с минимальной затратой АТФ
– пирувата
+ глицерина
– малата
– лактата
– изоцитрат
58. Сколько молекул углекислого газа образуется при окислении глюкозы апотомическим путем?
– 2
– 4
+ 6
– 1
– 3
59. Какой фермент участвует в образовании альфа-1,6-гликозидной связи гликогена?
– фосфорилаза
– гликогенсинтетаза
+ ветвящий фермент
– амило-1,6- гликозидаза
+ (4=6) – глико-зилтрансфераза
60. Какие из гормонов стимулируют распад гликогена в печени?
– глюкокортико-иды
– вазопрессин
– инсулин
+ адреналин
+ глюкагон
61. При каких физиологических состояниях происходит накопление молочной кислоты в крови?
– передача нервных импульсов
– стрессовые ситуации
+ усиленная физическая нагрузка
– деление клеток
+ гипоксия
62. Какие исходные субстраты необходимы для действия фермента цитратсинтазы
– сукцинат
+ ацетил-КоА
– малат
– ацил-КоА
+ ЩУК
63. Дефект какого фермента наблюдается при болезни Андерсена?
– гликогенсинте-тазы печени
+ ветвящего фермента печени
– альдолазы
+ ветвящего фермента селезенки
– фосфорилазы печени
64. Активность каких цитоплазматических дегидрогеназ будет повышена в печени в аэробных условиях (эффект Пастера)
+ ЛДГ 1,2
– ЛДГ 4,5
+ глицеролфос-фатдегидрогеназы
– глицероальде-гидфосфатдегидрогеназы
+ малатдегидро-геназы
65. Необратимые реакции гликолиза катализируют ферменты
+ гексокиназа
+ фосфофрукто-киназа
+ пируваткиназа
– альдолаза
– триозофосфа-тизомераза
66. Сколько молекул ГТФ потребуется для синтеза 1 молекулы глюкозы из пирувата?
+ 2
– 4
– 6
– 8
– 1
67. Каков энергетический эффект окислительного декарбоксилирования ПВК
+ 3 молекулы АТФ
– 36 молекул АТФ
– 12 молекул АТФ
– 10 молекул АТФ
– 2 молекулы АТФ
68. Какова судьба НАДФН2, образованного в пентозном цикле?
+ реакции детоксикации лекарств и ядов
+ восстановление глютатиона
– синтез гликогена
+ реакции гидроксилирования
+ синтез желчных кислот
69. Почему гликоген скелетных мышц может использоваться только локально?
– отсутствие лактатдегидрогеназы I
– отсутствие амилазы
– отсутствие глюкокиназы
– отсутствие фосфоглюкомутазы
70. Какие гормоны являются активаторами глюкокиназы печени?
– норадреналин
– глюкагон
+ инсулин
– глюкокортикоиды
– АКТГ
71. При каких патологических состояниях происходит накопление молочной кислоты в крови?
+ гипоксия
– сахарный диабет
+ болезнь Гирке
– нефриты
+ эпилепсия
72. Сколько молекул АТФ образуется при полном окислении 1 молекулы молочной кислоты?
– 15
+ 17
+ 18
– 20
– 21
73. Что является причиной развития диспепсических расстройств при кормлении ребенка молоком
+ недостаточность лактазы
– недостаточность фосфофруктокиназы
+ недостаточность галактозо-1-фосфатуридилтрансферазы
– недостаточность фруктокиназы
74. Какие ферменты участвуют в превращении пирувата в ФЕПВК
– пируваткиназа
+ пируваткарбоксилаза
– фосфоглицераткиназа
+ фосфоенолпируваткарбоксикиназа
– пируватдегидрогеназа
75. Реакцию образованию глюкозо-6-фосфата из гликогена ускоряют ферменты
+ глюкокиназа
+ фосфоглюкомутаза
+ фосфорилаза
– фосфатаза
– глюкозофосфатизомераза
+ амило-1,6- гликозидаза
76. Сколько молекул АТФ потребуется для синтеза 1 молекулы глюкозы из малата?
– 2
+ 4
– 6
– 8
– 3
77. Каков энергетический эффект окисления ПВК до конечных продуктов обмена углекислого газа и воды?
– 38 молекул АТФ
+ 15 молекул АТФ
– 3 молекулы АТФ
– 10 молекул АТФ
– 2 молекулы АТФ
78. Какова судьба рибулозо-5-фосфата, образовавшегося в пентозном цикле?
+ синтез пролина
+ синтез нуклеиновых кислот
+ синтез ц3,5АМФ
+ синтез АТФ
– синтез карнитина
79. Почему гликоген печени является резервом глюкозы для всего организма?
– наличие глюкокиназы
+ наличие глюкозо-6-фосфатазы
– наличие фруктозо-1,6-бисфосфатазы
– наличие альдолазы
– наличие фосфоглюкомутазы
80. Активаторами синтеза гликогена печени являются
+ глюкокортикоиды
– глюкагон
+ инсулин
– тироксин и норадреналин
– адреналин
81. У обследуемого наблюдается увеличении печени, недостаточность роста, тяжелая гипогликемия, кетоз, гиперлипидемия, что является причиной возникновения указанных симптомов?
+ отсутствие глюкозо-6-фосфатазы
– отсутствие глюкокиназы
– отсутствие галактозо- 1-фосфатуридилтрансферазы
– отсутствие альдолазы
– отсутствие гликогенфосфорилазы
82. При участии каких ферментов происходит потребление АТФ в процессе глюконеогенеза из пирувата?
+ пируваткарбоксилаза
– фосфоенолпируваткарбоксикиназа
+ фосфоглицераткиназа
– фруктозо-1,6- бисфосфатаза
– глюкозо- 6-фосфатаза
83. Сколько молекул АТФ образуется при окислении лактата до ацетил-КоА
– 2
– 3
+ 5
+ 6
– 7
– 8
84. Что является причиной сахарного диабета
+ дефицит инсулина
– избыток инсулина
+ нарушение активации инсулина
+ высокая активность инсулиназы
+ нарушение синтеза рецепторов к инсулину в клетках-мишенях
85. Какие ферменты участвуют в превращении 3- фосфоглицериновой кислоты в 2- фосфоенолпировиноградную кислоту
– триозофосфа-тизомеразой
+ енолазой
– альдолазой
– пируваткиназой
+ фосфоглицератмутаза
86. Глюконеогенез ингибируется следующими лигандами
+ АМФ
– АТФ
+ АДФ
– ионы магния
– ГТФ
87. Образованием каких конечных продуктов заканчивается окислительное декарбоксилирование альфа-кетоглутарата
– ацетил-КоА
– лимонная кислота
+ сукцинил-КоА
+ углекислый газ
– фумарат
88. Через какие промежуточные метаболиты пентозный цикл связан с гликолизом
+ 3- фосфоглицериновой альдегид
– ксилулозо- 5-фосфат
+ фруктозо- 6-фосфат
– 6- фосфоглюконат
– рибоза 5-фосфат
89. Какие лиганды являются активаторами распада гликогена?
+ цАМФ
+ АДФ
– цитрат
– цГМФ
– ионы железа
90. Какие соединения являются активаторами пируват-карбоксилазы?
+ ацетил-КоА
– АМФ
+ АТФ
– цитрат
+ биотин
+ углекислый газ
91. При каком заболевании у больного наблюдаются следующие симптомы гипогликемия, дрожь, слабость, утомляемость, потливость, постоянное чувство голода, возможны нарушения мозговой деятельности?
– болезнь Вильсона
– болезнь Мак-Ардля
– сахарный диабет
+ аденома бета-клеток островков Лангерганса поджелудочной железы
+ гиперинсулинизм
92. Какие ферменты принимают участие в превращении глюкозо-6-фосфата в УДФ-глюкозу?
– гексокиназа
+ фосфоглюкомутаза
– фосфоглицеромутаза
+ глюкозо- 1-фосфатуридилилтрансфераза
– ветвящий фермент
93. Что является причиной снижения липогенеза у больных сахарным диабетом?
+ низкая активность глюкозо- 6-фосфатдегидрогеназы
– нарушение синтеза гликогена
+ снижение активности гликолитических ферментов
+ низкая активность глюкокиназы
– повышение активности гликолитических ферментов
94. Сколько молекул АТФ образуется при полном окислении 1 молекулы 3-фосфоглицериновой кислоты
– 12
– 15
+ 16
– 17
– 20
95. Перенос фосфатной группы от фосфоенолпирувата на АДФ катализируется ферментов и при этом образуется
– киназой фосфорилазы
– карбаматкиназой
+ пируват
+ пируваткиназой
+ АТФ
96. Активатором глюконеогенеза является
+ ацетил-КоА
– АДФ
+ АТФ
– АМФ
+ ацил-КоА
97. Окислительное декарбоксилирование альфа-кетоглутарата осуществляется при участии
+ тиамина
+ пантотеновой кислоты
– пиридоксина
+ липоевой кислоты
+ рибофлавина
+ ниацина
98. В каких органоидах клетки интенсивно протекает пентозный цикл?
– митохондрии
+ цитоплазма
– рибосомы
– ядро
– лизосомы
99. Какой из перечисленных ниже ферментов является аллостерическим в синтезе гликогена
+ гликогенсинтетаза
– фосфорилаза
– ветвящий фермент 4-глюкозо-1-фосфатуридилилтрансфераза
– амило-1,6-гликозидаза
100. Какой фермент гликолиза ингибируется глюкагоном?
– енолаза
+ пируваткиназа
– гексокиназа
– лактатдегидрогеназа
101. При каком заболевании у ребенка наблюдается повышенное содержание сахара в крови, увеличение содержания галактозы, отмечается наличие галактозы в моче?
– фруктоземия
+ галактоземия
– болезнь Гирке
– гиперинсулинизм
– сахарный диабет
102. Какие метаболиты накапливаются в крови и активность каких ферментов крови повышается при гипоксии (инфаркте миокарда) ?
– ацетоуксусная кислота
+ молочная кислота
+ ЛДГ 1,2
– ЛДГ 4,5
+ АСАТ
103. Сколько молекул ФАДН2 образуется при полном окислении молекулы ДОАФ?
+ 1
– 2
– 3
– 4
– 5
104. В состав каких ферментативных систем углеводного обмена входит витамин В2
– дигидролипоатацетилтрансфераза
+ дигидролипоилдегидрогеназа
+ альфа-кетоглютаратоксидаза
– сукцинил-КоА-тиокиназа
+ сукцинатдегидрогеназа
105. Какие ферменты осуществляют превращение фруктозо-6-фосфата в фосфотриозы
– гексокиназой
– енолазой
– фосфоглюкомутазой
+ альдолаза
– фосфорилазой
+ фосфофруктокиназа
106. Какое количество молекул глицерина потребуется для синтеза 2-х молекул глюкозы по пути глюконеогенеза
– 2
+ 4
– 6
– 8
– 3
107. С участием каких ферментных систем осуществляется превращение молочной кислоты в ЩУК
– альфа-кетоглутаратдегидрогеназы
– пируватдегидрогеназы
+ лактатдегидрогеназы
– пируватдегидрогеназы
+ пируваткарбоксилаза
108. В каких органоидах и тканях проявляют наибольшую активность ферменты пентозного цикла
+ надпочечники
+ печени
+ жировая ткань
– легкие
– мозг
109. Какой из ферментов является аллостерическим в распаде гликогена?
+ фосфорилаза
– фосфатаза
– амило-1,6- гликозидаза
– триозофосфатизомераза
– альдолаза
110. Какой из ферментов цикла Кребса ингибируется малоновой кислотой?
+ сукцинатдегидрогеназа
– изоцитратдегидрогеназы
– цисаконитаза
– цитратсинтетаза
– альфа-кетоглютаратдегидрогеназа
111. У ребенка отмечается повышение общего сахара крови, увеличение содержания галактозы в крови, появление ее в моче, что является причиной этих нарушений?
+ недостаточность галактозо- 1-фосфатуридилтрансферазы
+ недостаточность галактокиназы
– недостаточность глюкокиназы
112. Сколько молекул НАДН2 образуется при полном окислении 1 молекулы глюкозы до углекислого газа и воды?
– 5
+ 10
– 12
– 15
– 36
113. Дефект каких ферментов может привести к развитию агликогенозов
– гликогенфосфорилазы
+ гликогенсинтетазы
+ ветвящего фермента
+ фосфоглюкомутазы
– глюкозо-6-фосфатазы
114. Какие соединения могут быть предшествениками ЩУК, необходимой для стимуляции ЦТК и процесса глюконеогенеза
– ацетил-КоА
+ пируват
+ углекислый газ
+ аспартат
+ пиридоксальфосфат
– этиловый спирт
115. Для превращения диоксиацетонфосфата в 1,3- дифосфоглицериновую кислоту необходимо действие ферментов
– альдолазы
– гексокиназы
– глюкозофосфатизомеразы
+ триозофосфатизомеразы
– глицераткиназы
+ глицероальдегидфосфатдегидрогеназа
116. Какое количество молей НАДН2 потребуется для синтеза 1-ой молекулы глюкозы из малата?
– 8
– 6
– 4
– 2
+ 0
117. Какие субстраты ЦТК вступают в реакции гидратации?
+ изоцитрил-КоА
+ фумарат
+ аконитат
– оксалоацетат
– сукцинат
118. Сколько молекул воды необходимо для прямого окисления глюкозы?
– 3
– 2
+ 7
– 4
– 6
119. Какие конечные продукты образуются в процессе гликогенолиза?
+ пируват
– фруктозо- 6-фосфат
– глюкозо- 6-фосфат
+ лактат
+ глюкоза
120. От каких факторов зависит скорость окисления ацетил-КоА в ЦТК?
– лактат
+ малоновая кислота
+ щавелевоуксусная кислота
+ пируват
+ энергетический заряд клетки
+ аэробные условия
121. Какие биохимические исследования необходимо провести для дифференциальной
диагностики сахарного и несахарного диабета?
– определить СОЭ
+ определить удельный вес мочи
– определить белок в моче
– определить белковые фракции крови
+ определить сахар мочи и крови
+ определить рН мочи
122. Концентрация каких метаболитов углеводного обмена будет повышаться в крови при стрессах?
+ лактат
– гликоген
+ глюкоза
– глицерин
– аланин
123. Сколько молекул УТФ потребуется для активации 100 гликозильных остатков в процессе гликогенеза
– 50
+ 100
– 150
– 200
– 300
124. Какие ферменты принимают участие в превращении ДОАФ во фруктозо-6-фосфат
+ альдолаза
+ триозофосфатизомераза
– фосфофруктокиназа
+ фруктозо-1,6- дифосфатаза
– фосфоглюко-мутаза
125. В реакциях превращения пирувата до углекислого газа и этилового спирта участвуют следующие ферменты
+ пируватдекарбоксилаза
– лактатдегидрогеназа
+ этанолдегидрогеназа
+ алкогольдегидрогеназа
– фосфоглицераткиназа
126. Сколько молекул воды потребуется для синтеза 10 молекул глюкозы из пирувата?
+ 6
– 2
– 8
– 7
– 10
127. Какие субстраты ЦТК окисляются при участии ФАД-зависимых дегидрогеназ
+ альфа-кетоглутарат
– малат
– изоцитрат
+ сукцинат
– оксалосукцинат
128. Какие из перечисленных ниже металлов являются активаторами пентозного цикла
– кобальт
+ магний
+ марганец
– железо
– медь
129. Какие ферменты гликогенолиза требуют наличия неорганического фосфата
– пируваткиназа
+ гликогенфосфорилаза
– фосфоглюкомутаза
+ глицероальдегиддегидрогеназа
– фосфоглицераткиназа
130. Какие из ферментов гликолиза стимулируется АМФ?
– енолаза
+ пируваткиназа
+ фосфофрукто-киназа
– фруктозо-1,6- бисфосфатаза
131. Что является основной причиной ювенильной формы сахарного диабета
– гиперфункция коркового слоя надпочечников
+ абсолютная недостаточность инсулина
– относительная недостаточность инсулина
– гиперфункция мозгового слоя надпочечников
– недостаточность глюкагона
132. В какой активной форме витамин В1 учавствует в окислительном декарбоксилировании альфа-кетокислот
+ кокарбоксилаза
– тиамина хлорид
– тиаминмонофосфат
+ тиаминпирофосфат
– тиаминтрифосфат
133. Сколько молекул фосфоглицеринового альдегида образуется при окислении 3 молекул глюкозы в пентозном цикле?
+ 1
– 2
– 3
– 4
– 5
134. Дефицит каких ферментов приводит к нарушению обмена фруктозы
– гексокиназа
+ фруктокиназа
+ кетозо-1-фосфатальдолаза
– фосфофрукто-киназа
– триозофосфа-тизомераза
135. Пируват превращается в молочную кислоту при действии фермента
+ ЛДГ 4,5
– фосфорилазы
– этанолдегид-рогеназы
– ЛДГ 1,2
– глицероальде-гидфосфатдегидрогеназа
136. В каких органах и тканях активно работает фермент глюкозо-6-фосфатаза
+ печени
+ слизистых почечных канальцев
+ слизистой кишечника
– миокарде
– селезенке
137. Какие субстраты подвергаются декарбоксилированию в ЦТК
+ оксалосукцинат
– цисаконитат
– сукцинат
+ альфа-кетоглутарат
– оксалоацетат
138. Какова биологическая роль пентозного цикла?
+ катаболическая
+ энергетическая
– транспортная
+ анаболическая
+ защитная
139. Какие продукты образуются при действии на гликоген фосфорилазы и амило-1,6-
гликозидазы
– глюкозо-6-фосфат
+ глюкоза
– мальтоза
+ глюкозо- 1-фосфат
+ декстрины
– амилоза
140. Какой из ферментов активируется цитратом
– лактатдегидрогеназа
– фосфофруктокиназа
– глюкокиназа
– фосфорилаза
+ фруктозо-1,6-дифосфатаза
141. При диспансерном обследовании у пациента обнаружена гипергликемия (8 ммоль/л) ,
после приема 100 г глюкозы концентрация ее в крови повысилась до 16 ммоль/л и
удерживалась в течение 4 часов, при каком заболевании возможны указанные
изменения?
– цирроз печени
+ сахарный диабет
– нефрит
– гипофизарный диабет
– стероидный диабет
142. Какие ферменты принимают участие в превращении фруктозы в 3ФГА в мышечной
и жировой тканях и почках?
+ гексокиназа
– глюкокиназа
– фруктокиназа
+ фосфофруктокиназа
+ альдолаза
143. Сколько молекул кислорода используется при окислении 1 молекулы 3ФГА?
– 1
– 2
+ 3
– 5
– 6
– 8
144. Нижеследующих утверждений правильные
+ гликолиз в эритроцитах является основным поставщиком энергии, необходимой
для их функционирования
– окислительное фосфорилирование – основной путь синтеза АТФ в эритроцитах
+ повышение концентрации 2,3ФДГ и лактата в эритроцитах снижает сродство
гемоглобина A1 к кислороду
+ повышение концентрации 2,3ФДГ и лактата в эритроцитах повышает отдачу
гемоглобином кислорода
+ субстратное фосфорилирование – основной путь синтеза АТФ в эритроцитах
145. Какова энергетическая эффективность гликогенолиза в анаэробных условиях?
– 2 молекулы АТФ
+ 3 молекулы АТФ
– 15 молекул АТФ
– 4 молекулы АТФ
– 1 молекула АТФ
146. Какое количество молекул углекислого газа необходимо для активации синтеза глюкозы из пирувата?
+ 2
– 4
– 6
– 8
– 3
147. Какое соединение является конечным продуктом аэробного гликолиза?
+ пируват
– лактат
– фосфоенолпируват
– щавелевоуксусная кислота
+ НАДН2
148. Какие из перечисленных ниже соединений являются промежуточными метаболитами пентозного цикла?
+ глюкозо- 6-фосфат
– 1,3- дифосфоглицериновая кислота
+ 6- фосфоглюконат
+ ксилулозо- 5-фосфат
+ эритрозо- 4-фосфат
149. Какое количество АТФ необходимо для активации фосфорилазы B
– 2
– 6
+ 4
– 8
– 3
150. Какой метаболит регулирует перенос восстанавливающих эквивалентов из цитозоля через внутренние мембраны митохондрии и обратно
+ глицерол- 3-фосфат
+ малат
– глутамат
+ оксалоацетат
+ диоксиацетонфосфат
151. Что является причиной гипогликемии и недостатка гликогена в печени
– недостаточность глюкозо-6-фосфатазы
+ недостаточность ветвящего фермента
– недостаточность гликогенфосфорилазы
+ недостаточность фосфоглюкомутазы
+ недостаточность гликогенсинтетазы
152. Сколько молекул кислорода требуется для полного окисления 1 молекулы ацетил-КоА?
– 1
+ 2
– 1/2
– 3
– 5
153. Какие ферменты принимают участие в превращении фруктозы в 3фга в гепатоцитах
+ фруктокиназа
– глюкокиназа
– фосфофрукто-киназа
+ кетозо- 1-фосфатальдолаза
– альдолаза
– фруктозо-1,6- бисфосфатаза
154. Какие заболевания сопровождаются глюкозурией?
+ сахарный диабет
– аденома поджелудочной железы
+ болезнь Иценко-Кушинга
+ нефриты
+ гипофизарный диабет
– несахарный диабет
155. Какое количество АТФ может синтезироваться при окислении глюкозы до пирувата в аэробных условиях
– 2
– 4
+ 6
+ 8
– 10
156. В каких органоидах печени обнаружен фермент пируват-карбоксилаза
+ цитоплазме
+ митохондриях
– ядре
– рибосомах
– ядрышко
157. Какой метаболит ЦТК подвергается дегидрированию при участии оксидазы
зависимых дегидрогеназ?
– альфа-кетоглутарат
– цитрат
– фумарат
+ сукцинат
– малат
158. Какой из перечисленных ниже субстратов пентозного цикла может пойти на удовлетворение энергетических потребностей организма
– 6- фосфоглюконат
– рибулозо- 5-фосфат
– рибозо- 5-фосфат
+ 3- фосфоглицериновый альдегид
+ фруктозо- 6-фосфат
159. Где наиболее интенсивно идет биосинтез гликогена?
– мозг
+ печень
– поджелудочная железа
– миокард
+ скелетные мышцы
160. Недостаточность каких витаминов приводит к нарушению функционирования челночных механизмов
– В1
+ В2
– В3
+ В5
+ В6
– С
161. При каких патологических состояниях наблюдается повышение уровня ПВК в крови свыше 0,5 ммоль/л?
– сахарный диабет
+ полиневрит
– нефрозы
– галактоземия
+ Бери-бери
162. Какие ферменты принимают участие в превращении галактозы в глюкозу в печени
+ галактокиназа
+ галактозо- 1-фосфатуридилилтрансфераза
+ эпимераза
+ глюкозо- 6-фосфатаза
+ фосфоглюкомутаза
– фруктозо- 1-фосфатальдолаза
163. Сколько молекул АТФ образуется при полном окислении 3 молекул рибозо-5-фосфата
– 30
– 52
+ 93
+ 98
– 102
164. При каких заболеваниях наблюдаются следующие симптомы: тяжелая гипогликемия
натощак, тошнота, рвота, судороги, потеря сознания, умственная отсталость?
+ болезнь Гирке
+ болезнь Херса
+ агликогенозы
+ гиперинсулинизм
– гипертиреоз
165. Сколько молекул АТФ образуется при полном окислении 1 молекулы ДОАФ
– 5
– 6
+ 19
+ 20
– 36
– 38
166. Сколько молекул АТФ потребуется для синтеза глюкозы из глицерина?
– 1
+ 2
– 4
– 6
– 8
167. Какие ферменты и витамины участвуют в превращении лактата в ацетил-КоА
+ ЛДГ 1,2
– ЛДГ 4,5
+ пируватоксидаза
+ В2 и В5
+ В3 и В1
– В6 и липоевая кислота
168. Какие из перечисленных ниже лигандов повышают скорость прямого окисления глюкозы
– АМФ
– неорганический фосфат
+ АТФ
+ НАДФ
– цАМФ
169. С помощью каких ферментов происходит образование глюкозо-1-фосфат из глюкозы
+ глюкокиназа
+ фосфоглюкомутаза
– гликогенфосфорилаза
+ гексокиназа
– фосфоглицеромутаза
170. Какой фермент углеводного обмена в гепатоцитах стимулируется инсулином?
– енолаза
– гексокиназа
+ глюкокиназа
+ гликогенсинтетаза
– фосфорилаза
171. При каких патологических состояниях наблюдается повышение активности
альфа-амилазы в крови и моче?
+ острый панкреатит
– вирусный гепатит
+ пиелонефрит
– инфаркт миокарда
– болезнь Вильсона
172. Для какого заболевания характерна следующая клиническая картина: ограниченная
способность выполнять интенсивные упражнения из-за мышечных судорог?
– болезнь Херса
– болезнь Гирке
+ болезнь Тэрье
+ болезнь Мак-Ардля
– болезнь Андерсена
7.2D: Результаты гликолиза — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
- Результаты гликолиза
Одна молекула глюкозы производит четыре молекулы АТФ, две молекулы НАДН и две молекулы пирувата во время гликолиза.
Задачи обучения
- Опишите энергию, полученную от одной молекулы глюкозы, проходящей гликолиз
Ключевые моменты
- Хотя четыре молекулы АТФ производятся во второй половине, чистый выигрыш от гликолиза составляет только две АТФ, потому что две молекулы АТФ используются в первой половине гликолиза.
- Ферменты, которые катализируют реакции, которые производят АТФ, являются этапами гликолиза, ограничивающими скорость, и должны присутствовать в достаточных количествах для гликолиза, чтобы завершить производство четырех молекул АТФ, двух НАДН и двух молекул пирувата для каждой молекулы глюкозы, которая вступает в этот путь.
- Эритроцитам для выживания необходим гликолиз в качестве единственного источника АТФ, поскольку у них нет митохондрий.
- Раковые клетки и стволовые клетки также используют гликолиз в качестве основного источника АТФ (процесс, известный как аэробный гликолиз или эффект Варбурга).
Ключевые термины
- пируват : любая соль или сложный эфир пировиноградной кислоты; конечный продукт гликолиза перед входом в цикл TCA
Результаты гликолиза
Гликолиз начинается с одной молекулы глюкозы и заканчивается двумя молекулами пирувата (пировиноградной кислоты), всего четырьмя молекулами АТФ и двумя молекулами НАДН.Две молекулы АТФ были использованы в первой половине пути для подготовки шестикарбонатного кольца к расщеплению, поэтому клетка имеет чистый прирост в две молекулы АТФ и 2 молекулы НАДН для его использования. Если клетка не может катаболизировать молекулы пирувата в дальнейшем (через цикл лимонной кислоты или цикл Кребса), она будет собирать только две молекулы АТФ из одной молекулы глюкозы.
Рисунок \ (\ PageIndex {1} \): Гликолиз производит 2 молекулы АТФ, 2 НАДН и 2 молекулы пирувата. : Гликолиз, или аэробный катаболический распад глюкозы, производит энергию в форме АТФ, НАДН и пирувата, который сам входит в цикл лимонной кислоты, чтобы производить больше энергии.Зрелые эритроциты млекопитающих не имеют митохондрий и не способны к аэробному дыханию — процессу, при котором организмы преобразуют энергию в присутствии кислорода. Вместо этого гликолиз является их единственным источником АТФ. Следовательно, если гликолиз прерывается, красные кровяные тельца теряют способность поддерживать свои натриево-калиевые насосы, которым для работы необходим АТФ, и в конечном итоге они умирают. Например, поскольку вторая половина гликолиза (который производит молекулы энергии) замедляется или останавливается в отсутствие НАД +, когда НАД + недоступен, красные кровяные тельца не могут производить достаточное количество АТФ, чтобы выжить.
Кроме того, последняя стадия гликолиза не произойдет, если пируваткиназа, фермент, катализирующий образование пирувата, недоступен в достаточных количествах. В этой ситуации весь путь гликолиза будет продолжаться, но только две молекулы АТФ будут образованы во второй половине (вместо обычных четырех молекул АТФ). Таким образом, пируваткиназа является ферментом, ограничивающим скорость гликолиза.
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
- Курирование и проверка. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
- Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest…ol11448/latest . Лицензия : CC BY: Attribution
- гетеротроф. Источник : Викисловарь. Находится по адресу : en.wiktionary.org/wiki/heterotroph . Лицензия : CC BY-SA: Attribution-ShareAlike
- гликолиз. Источник : Викисловарь. Адрес: : en.wiktionary.org/wiki/glycolysis . Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Углеводный метаболизм.10 ноября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m46451/latest/ . Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest…ol11448/latest . Лицензия : CC BY: Attribution
- глюкоза. Источник : Викисловарь. Находится по адресу : en.wiktionary.org/wiki/gluosis . Лицензия : CC BY-SA: Attribution-ShareAlike
- аденозинтрифосфат. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/adenosine%20triphosphate . Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Углеводный метаболизм.10 ноября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m46451/latest/ . Лицензия : CC BY: Attribution
- Колледж OpenStax, Гликолиз. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest…e_07_02_01.jpg . Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология.16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest/?collection=col11448/latest . Лицензия : CC BY: Attribution
- NADH. Источник : Викисловарь. Находится по адресу : en.wiktionary.org/wiki/NADH . Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Углеводный метаболизм.10 ноября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m46451/latest/ . Лицензия : CC BY: Attribution
- Колледж OpenStax, Гликолиз. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest…e_07_02_01.jpg . Лицензия : CC BY: Attribution
- Колледж OpenStax, Гликолиз.16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest…e_07_02_02.jpg . Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest/?collection=col11448/latest . Лицензия : CC BY: Attribution
- пируват. Источник : Викисловарь. Находится по адресу : en.wiktionary.org/wiki/pyruvate . Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Углеводный метаболизм. 10 ноября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m46451/latest/ . Лицензия : CC BY: Attribution
- Колледж OpenStax, Гликолиз.16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest…e_07_02_01.jpg . Лицензия : CC BY: Attribution
- Колледж OpenStax, Гликолиз. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44432/latest…e_07_02_02.jpg . Лицензия : CC BY: Attribution
- Гликолиз. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Glycolysis.svg . Лицензия : CC BY-SA: Attribution-ShareAlike
Что дает гликолиз? | Sciencing
Все живые существа, состоящие из одной или нескольких индивидуальных клеток, можно разделить на прокариот и эукариот.
Практически все клетки полагаются на глюкозу для своих метаболических потребностей, и первым шагом в распаде этой молекулы является серия реакций, называемых гликолиз (буквально «расщепление глюкозы»).При гликолизе отдельная молекула глюкозы претерпевает серию реакций с образованием пары молекул пирувата и небольшого количества энергии в форме аденозинтрифосфата (АТФ).
Конечное обращение с этими продуктами, однако, варьируется от типа ячейки к типу ячейки. Прокариотические организмы не участвуют в аэробном дыхании . Это означает, что прокариоты не могут использовать молекулярный кислород (O 2 ). Вместо этого пируват подвергается ферментации (анаэробное дыхание).
Некоторые источники включают гликолиз в процессе «клеточного дыхания» у эукариот, потому что он непосредственно предшествует аэробному дыханию (т. Е. Циклу Кребса и окислительному фосфорилированию в цепи переноса электронов). Более строго, гликолиз сам по себе не является аэробным процессом просто потому, что он не зависит от кислорода и происходит независимо от того, присутствует ли O 2 .
Однако, поскольку гликолиз является предварительным условием аэробного дыхания, поскольку он поставляет пируват для его реакций, естественно изучить обе концепции сразу.
Что такое глюкоза?
Глюкоза — это шестиуглеродный сахар, который является наиболее важным углеводом в биохимии человека. Углеводы содержат углерод (C) и водород (H) в дополнение к кислороду, и отношение C к H в этих соединениях неизменно составляет 1: 2.
Сахар меньше других углеводов, включая крахмал и целлюлозу. Фактически, глюкоза часто является повторяющейся субъединицей или мономером в этих более сложных молекулах. Сама глюкоза не состоит из мономеров и как таковая считается моносахаридом («один сахар»).
Формула глюкозы: C 6 H 12 O 6 . Основная часть молекулы состоит из гексагонального кольца, содержащего пять атомов C и один атом O. Шестой и последний атом C существует в боковой цепи с гидроксилсодержащей метильной группой (-CH 2 OH).
Путь гликолиза
Процесс гликолиза, происходящий в цитоплазме клетки, состоит из 10 отдельных реакций.
Обычно нет необходимости запоминать названия всех промежуточных продуктов и ферментов.Но иметь четкое представление об общей картине полезно. Это связано не только с тем, что гликолиз, возможно, является единственной наиболее актуальной реакцией в истории жизни на Земле, но и потому, что этапы хорошо иллюстрируют ряд общих событий в клетках, включая действие ферментов во время экзотермических (энергетически благоприятных) реакций.
Когда глюкоза попадает в клетку, она подвергается воздействию фермента гексокиназы и фосфорилируется (то есть к ней присоединяется фосфатная группа, часто обозначаемая буквой Pi).Это удерживает молекулу внутри клетки, наделяя ее отрицательным электростатическим зарядом.
Эта молекула перестраивается в фосфорилированную форму фруктозы, которая затем проходит еще одну стадию фосфорилирования и становится фруктозо-1,6-бисфосфатом. Затем эта молекула разделяется на две похожие трехуглеродные молекулы, одна из которых быстро превращается в другую с образованием двух молекул глицеральдегид-3-фосфата.
Это вещество перестраивается в другую дважды фосфорилированную молекулу до того, как раннее добавление фосфатных групп отменяется в непоследовательных стадиях.На каждом из этих этапов молекула аденозиндифосфата (АДФ) образуется комплексом фермент-субстрат (название структуры, образованной любой молекулой, вступающей в реакцию, и ферментом, который способствует завершению реакции).
Этот АДФ принимает фосфат от каждой из трех присутствующих молекул углерода. В конце концов, две молекулы пирувата оказываются в цитоплазме, готовые к развертыванию на любом пути, по которому клетка должна войти или способна к хостингу.
Краткое описание гликолиза: входы и выходы
Единственный истинный реагент гликолиза — это молекула глюкозы.Две молекулы АТФ и НАД + (никотинамидадениндинуклеотид, переносчик электронов) вводятся во время серии реакций.
Вы часто будете видеть полный процесс клеточного дыхания, в котором глюкоза и кислород являются реагентами, а углекислый газ и вода — продуктами, а также 36 (или 38) АТФ. Но гликолиз — это только первая серия реакций, которая в конечном итоге приводит к аэробному извлечению такого количества энергии из глюкозы.
Всего четыре молекулы АТФ образуются в реакциях с участием трехуглеродных компонентов гликолиза — две во время превращения пары молекул 1,3-бисфосфоглицерата в две молекулы 3-фосфоглицерата и две во время превращение пары молекул фосфоенолпирувата в две молекулы пирувата, представляющих собой конец гликолиза.Все они синтезируются посредством фосфорилирования на уровне субстрата, что означает, что АТФ возникает в результате прямого присоединения неорганического фосфата (Pi) к АДФ, а не образуется в результате какого-либо другого процесса.
Два АТФ необходимы на ранней стадии гликолиза, сначала, когда глюкоза фосфорилируется до глюкозо-6-фосфата, а затем двумя стадиями позже, когда фруктозо-6-фосфат фосфорилируется до фруктозо-1,6-бисфосфата. Таким образом, чистый прирост АТФ при гликолизе в результате того, что одна молекула глюкозы подвергается процессу, составляет две молекулы, что легко запомнить, если связать это с количеством образованных молекул пирувата.
Кроме того, во время превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат две молекулы НАД + восстанавливаются до двух молекул НАДН, причем последняя служит косвенным источником энергии, поскольку они участвуют в реакциях в том числе аэробное дыхание.
Таким образом, чистый выход гликолиза составляет 2 АТФ, 2 пирувата и 2 НАДН . Это едва ли одна двадцатая от количества АТФ, производимого при аэробном дыхании, но поскольку прокариоты, как правило, намного меньше и менее сложны, чем эукариоты, с меньшими метаболическими потребностями, чтобы соответствовать, они могут справиться, несмотря на это меньше, чем -идеальная схема.
(Другой способ взглянуть на это, конечно, заключается в том, что отсутствие аэробного дыхания у бактерий не дает им развиться в более крупных и разнообразных существ, что это важно.)
Судьба продуктов гликолиза
У прокариот, когда путь гликолиза завершен, организм разыграл почти все имеющиеся у него метаболические карты. Пируват может далее метаболизироваться до лактата посредством ферментации или анаэробного дыхания. Целью ферментации является не производство лактата, а регенерация NAD + из NADH, чтобы его можно было использовать в гликолизе.
(Обратите внимание, что это отличается от спиртовой ферментации, при которой этанол образуется из пирувата под действием дрожжей.)
У эукариот большая часть пирувата входит в первый набор этапов аэробного дыхания: цикл Кребса, также называется циклом трикарбоновой кислоты (ТСА) или циклом лимонной кислоты. Это происходит в митохондриях, где пируват превращается в двухуглеродное соединение ацетил-кофермент A (CoA) и диоксид углерода (CO 2 ).
Роль этого восьмиступенчатого цикла состоит в том, чтобы производить больше носителей электронов высокой энергии для последующих реакций — 3 НАДН, один ФАДН 2 (восстановленный динуклеотид флавинаденин) и один ГТФ (гуанозинтрифосфат).
Когда они входят в цепь переноса электронов на митохондриальной мембране, процесс, называемый окислительным фосфорилированием, сдвигает электроны с этих высокоэнергетических носителей на молекулы кислорода, в результате чего получается 36 (или, возможно, 38) молекул АТФ на глюкозу. молекула «вверх по течению».
Гораздо более высокая эффективность и результативность аэробного метаболизма объясняют, по существу, все основные различия, существующие сегодня между прокариотами и эукариотами, причем первые предшествуют вторым и, как считается, породили их.
BSC 1005 Примечания к главе 4
Глобальное потепление — это постепенное повышение температуры Земли. Солнце достигает Земли, а часть излучается обратно в космос. Парниковые газы, особенно углекислый газ , улавливают это тепло как одеяло, поэтому земля медленно нагревается. Ожидается, что к 2050 году во всем мире глобальная температура повысится на 1,5 — 3 o C (до 6 o F). Углекислый газ вырабатывается естественными процессами, включая животных и вулканы.Он поглощается растениями, океанами и почвой. Ископаемое топливо (уголь, нефть и природный газ) — это остатки растений, оставшиеся миллионы лет назад. При сжигании ископаемого топлива (в автомобилях, заводах, электростанциях) в воздух выделяется дополнительный углекислый газ. Уровень углекислого газа в воздухе неуклонно растет.
ледяных кернов из Антарктиды, содержащих захваченные пузырьки воздуха, подтверждают, что уровни парниковых газов сейчас выше, чем когда-либо за последние 600 000 слез.
По мере повышения температуры ледники тают и уровень моря повышается.Исследование, проведенное в 2014 году, показало, что ледники в Антарктиде тают с возрастающей скоростью, что в конечном итоге приведет к повышению уровня моря более чем на 10–12 футов. Исследование 2014 г.
Когда клетке нужна энергия, она расщепляет АТФ (аденозинтрифосфат) до АДФ (аденозиндифосфат). Дыхание используется для регенерации АТФ.
Аэробное дыхание: использует кислород.
Анаэробное дыхание : не использует кислород.
Аэробное дыхание
Глюкоза + кислород производит углекислый газ + вода + энергия
C 6 H 12 O 6 + 6 O 2 производит 6 CO 2 + 6 H 2 O.
Энергия хранится в клетке в виде АТФ или НАДН.
Аэробное дыхание делится на три основных этапа:
Гликолиз, цикл Кребса и электронная транспортная цепь.
Гликолиз:
Глюкоза (6 атомов углерода) расщепляется на 2 молекулы пировиноградной кислоты (по 3 атома углерода в каждой).
Это производит 2 АТФ и 2 НАДН.
В цитоплазме происходит гликолиз.
Цикл Кребса (или цикл лимонной кислоты)
Это расщепляет пировиноградную кислоту до диоксида углерода.
Это производит 2 АТФ и 6 НАДН на каждую молекулу глюкозы, вступающую в гликолиз.
Цикл Кребса происходит внутри митохондрий.
Цикл Кребса производит выдыхаемый вами CO 2 .
Цепь транспортировки электронов
На этом этапе производится большая часть энергии (34 молекулы АТФ по сравнению с 2 АТФ для гликолиза и 2 АТФ для цикла Кребса). Цепь переноса электронов происходит в митохондриях. На этом этапе НАДН превращается в АТФ.
Цепь переноса электронов работает как протонный насос : он качает ионы водорода (протоны) через мембрану и пропускает их обратно только через белок (АТФ-синтаза), который производит АТФ.
Цепь переноса электронов использует кислород для приема электронов в конце цепи (электроны соединяются с ионами водорода и кислородом, образуя молекулы воды).
Анаэробное дыхание (или ферментация)
При анаэробном дыхании кислород не используется.Возможен только гликолиз.
Одноклеточные организмы, например бактерии и дрожжи, могут выжить анаэробно.
У крупных животных (например, людей) в анаэробной среде накапливается кислородный дефицит.
Во время анаэробного дыхания пируват накапливается и превращается в: молочную кислоту у животных и этанол (спирт) у растений.
« Пиво — доказательство того, что Бог любит нас и хочет, чтобы мы были счастливы ». — Бенджамин ФранклинФотосинтез Растения и другие фотосинтезирующие организмы удаляют углекислый газ из воздуха в реакциях фотосинтеза.Буквально «фото» означает «свет», а «синтез» означает «строительство».
Фотосинтез — это серия реакций, в результате которых образуется глюкоза и другие углеводы.
6 CO 2 + 12 H 2 O ———-> C 6 H 12 O 6 + 6 H 2 O + 6 O 2
Есть двух стадий фотосинтеза:
1) Световые реакции : использование световой энергии для образования химической энергии (АТФ и НАДФН).
2) Цикл Кальвина : использует НАДФН и АТФ для образования углеводов из диоксида углерода.
Хлорофилл отражает (не использует) зеленый свет; он поглощает (использует) красный и синий свет. Одна из идей по поиску жизни на других планетах — это поиск характерных длин волн, которые отражают фотосинтезирующие организмы.
Световые реакции
Световые реакции происходят в гранах хлоропласта.Световые реакции производят АТФ и НАДФН, а также расщепляют молекулы воды с образованием кислорода.
Цикл Кальвина
Это происходит в строме хлоропласта. Он поглощает CO 2 и производит углевод (глицеральдегидфосфат или G3P). Цикл Кальвина использует АТФ и НАДФН, которые были произведены в световых реакциях. Фотосинтез поглощает углекислый газ из воздуха. Таким образом, один из способов уменьшить глобальное потепление — это посадить больше деревьев (или прекратить вырубать деревья).
Искусственный фотосинтез может производить водород, который можно использовать в качестве топлива в автомобилях и генераторах. Водород также можно получать непосредственно из растений.
Три разных типа растений:
1) C3-растения : типичные растения, которые открывают устьица днем и закрывают их ночью.
Обычные растения в прохладных местах, например, в Канаде.
2) Растения C4 : устьица открываются лишь ненадолго в течение дня.Они хранят CO 2 в виде 4-х углеродного сахара.
В основном тропические растения, например сахарный тростник.
3) CAM-растения : устьица открываются только ночью. Это пустынные растения вроде кактусов. Уменьшение последствий глобального потепления
В США проживает 4% населения мира, но они производят 25% всех парниковых газов.
В 2005 году вступил в силу Киотский договор. Это было подписано более 160 странами и требует от них сокращения выбросов углекислого газа и других парниковых газов.США и Канада — единственные крупные страны, не ратифицировавшие договор.
В 2006 году Калифорния была первым штатом, обязавшимся сократить выбросы парниковых газов на 25% к 2020 году. Другие штаты, включая Флориду, последовали этому примеру в течение следующих двух лет. Альтернативная энергия
В настоящее время большая часть нашей энергии поступает из ископаемого топлива. Диаграмма.
Существует несколько альтернатив использованию ископаемого топлива для получения энергии:
1) Производство электроэнергии
- Атомная энергия. Франция получает 78% электроэнергии от ядерной энергетики (США — 9%).
- Гидроэнергетика. Норвегия получает 99% электроэнергии от гидроэнергетики (США получают 3%).
- Ветровые турбины. Дания планирует получать 50% электроэнергии за счет энергии ветра. Ветровые турбины составляют большую часть из новых мощностей , добавленных в США, но пока они составляют лишь 7% от общей мощности.
- Солнечная энергия. Крупные солнечные электростанции начинают строиться по всему миру.Солнечные панели становятся дешевле и все чаще используются в домах.
- Биомасса. Такие растения, как травы, можно сжигать для выработки электроэнергии. Европа
- Турбины Ocean. Во Флориде только начинаются испытания подводных океанских турбин, которые могут вырабатывать электроэнергию из потока Персидского залива.
- Этанол: Большинство автомобилей в Бразилии работают на этаноле (спирте), изготовленном из сахарного тростника.
- Электричество: Моторы Tesla произвели первый в США полностью электрический спортивный автомобиль. В 2010 году впервые были проданы полностью электрический Nissan Leaf и подключаемый / гибридный Chevy Volt.
- Водород: В автомобилях будущего можно будет использовать водородный топливный элемент. При этом в качестве топлива используется водород, а отходы — просто вода.
- Биодизель: В большинстве дизельных двигателей можно использовать растительные или животные масла или масло из водорослей.
Способы сокращения выбросов парниковых газов:
- Купить энергоэффективную технику
- Сажать деревья
- Переработка металла, стекла и бумаги
- Перейти на более экономичный автомобиль
- Замените обычные лампочки на энергоэффективные компактные люминесцентные или светодиодные.
- Покупайте продукты местного производства
- Установите солнечные батареи или солнечный водонагреватель.
Анаэробный гликолиз — обзор
Хотя анаэробный гликолиз производит только около 5% АТФ, выделяемого во время катаболизма глюкозы, существует ряд причин, по которым он необходим:
Есть несколько случаев, когда животные нужно быстрой энергии. При переходе от состояния покоя к полному полету, например, аэробное окисление потребовало бы быстрого увеличения поступления O 2 , чего можно было достичь только путем увеличения кровоснабжения (что обычно занимает несколько секунд).Таким образом, животное, которое начинает спринт из положения покоя, сильно зависит от анаэробного гликолиза.
Для быстрого увеличения поступления O 2 в ткани требуется хорошо развитая сосудистая сеть. В некоторых случаях может оказаться неэффективным обеспечение большой массы тела (то есть больших мышц) с хорошо развитым кровоснабжением. Это, безусловно, относится к грудным мышцам промысловых птиц (например, фазанов), которые часто используются для побега.В других случаях кровоснабжение может быть ограничено из-за патологии (например, опухоли) или физиологии (мозговое вещество почки). В этих примерах анаэробный гликолиз может быть основным или единственным источником энергии.
Две основные группы волокон скелетных мышц: красные , медленно сокращающиеся окислительные волокна (тип I) и белые , быстро сокращающиеся гликолитические волокна (тип IIB) ( см. главу 80). Волокна типа I обладают высокой аэробной способностью и, следовательно, достаточно устойчивы к усталости; тогда как волокна типа IIB в значительной степени анаэробны.Многие рыбы обладают в основном волокнами типа IIB, при этом только тонкое сечение вдоль боковой линии относится к типу I. Волокна боковой линии используются во время обычных периодов плавания, тогда как большая белая мышечная масса используется для коротких всплесков быстрой активности. Однако голубая рыба содержит много волокон типа I, которые обеспечивают им гораздо большую аэробную способность.
При сравнении скелетных мышц в состоянии покоя с более перфузируемыми кислородозависимыми областями тела (например, печень , почки , мозг и сердце ), ключевое различие становится очевидным: печень, почки, мозг и сердце обычно составляют только около 7%, массы тела, но получают почти 70% сердечного выброса (СО) и потребляют 58% O 2 , используемых в состояние покоя ( Таблица 24-1 ). Скелетная мышца составляет почти 50% нормальной массы тела, но получает только 16% CO в состоянии покоя и потребляет только 20% O 2 , используемых в состоянии покоя. Неудивительно, что анаэробный гликолиз так важен для скелетных мышц, поскольку O 2 утилизируется более «жизненно важными» органами в состоянии покоя, даже если эти органы занимают довольно небольшую долю от общей массы тела. Если бы упражнения начинались быстро из состояния покоя, анаэробный гликолиз был бы обязательным.
Таблица 24-1. Регионарная перфузия крови и потребление кислорода в состоянии покоя.
| Масса тела | Сердечный выброс | O 2 Потребление | |||
|---|---|---|---|---|---|
| Область | (% всего) | (% всего) | 10 (% всего) Печень4,1 | 27,8 | 20,4 |
| Почки | 0,48 | 23.3 | 7,2 | ||
| Мозг | 2,2 | 13,9 | 18,4 | ||
| Heart M. | 0,48 | 4,7 | 11,6 |
| 11,6 | |||
| 9007 | 57,6 | ||
| Кожа | 5,7 | 8,6 | 4,8 |
| Скелетная М. | 49,0 | 15,6 | 20.0 |
| Остаток | 37,8 | 6,2 | 17,6 |
| Все тело | 100,0 | 100,0 | 10010 99025 9 9 Аэробное окисление углеводов, жиров и аминокислот осуществляется в митохондриях, довольно объемных органеллах клетки. В некоторых случаях может быть желательно уменьшить количество митохондрий (из-за их объема), и в этих случаях клетка будет больше зависеть от анаэробного гликолиза.Например, глаз (а именно роговица и хрусталик) должен передавать световые сигналы с высокой эффективностью. Оптически плотные структуры, такие как митохондрии и капилляры, снизили бы эту эффективность (и, если бы они присутствовали в больших количествах, животные могли бы буквально «видеть» эти дополнительные митохондрии, а также кровь, текущую по капиллярам). Следовательно, большая часть глюкозы (более 80%), используемой роговицей и хрусталиком, обычно метаболизируется анаэробно. Доходность ATP | Протокол8.12: Выход ATPКлеточное дыхание производит 30-32 молекулы АТФ на молекулу глюкозы. Хотя большая часть АТФ возникает в результате окислительного фосфорилирования и цепи переноса электронов (ETC), 4 АТФ получают заранее (2 из гликолиза и 2 из цикла лимонной кислоты). ETC встроен во внутреннюю мембрану митохондрий и состоит из четырех основных белковых комплексов и АТФ-синтазы. NADH и FADh3 передают электроны этим комплексам, которые, в свою очередь, перекачивают протоны в межмембранное пространство.Такое распределение протонов создает градиент концентрации через мембрану. Градиент управляет производством АТФ, когда протоны возвращаются обратно в митохондриальный матрикс через АТФ-синтазу. На каждые 2 входных электрона, которые НАДН переходит в комплекс I, комплексы I и III перекачивают 4 протона, а комплекс IV перекачивает 2 протона, всего 10 протонов. Комплекс II не участвует в электронной цепи, инициированной НАДН. FADH 2 , однако, передает 2 электрона в комплекс II, так что всего накачивается 6 протонов на FADH 2 ; 4 протона через комплекс III и 2 через комплекс IV. Четыре протона необходимы для синтеза 1 АТФ. Поскольку на каждый НАДН накачивается 10 протонов, 1 НАДН дает 2,5 (10/4) АТФ. На каждый FADH 2 накачивается шесть протонов, поэтому 1 FADH 2 дает 1,5 (6/4) АТФ. Клеточное дыхание производит максимум 10 НАДН и 2 ФАДН 2 на молекулу глюкозы. Поскольку один НАДН производит 2,5 АТФ, а один ФАДН 2 производит 1,5 АТФ, отсюда следует, что 25 АТФ + 3 АТФ производятся путем окислительного фосфорилирования.Четыре АТФ продуцируются перед окислительным фосфорилированием, что дает максимум 32 АТФ на молекулу глюкозы. Важно отметить, что гликолиз происходит в цитозоле, а ETC находится в митохондриях (у эукариот). Митохондриальная мембрана не проницаема для НАДН, следовательно, электроны 2 НАДН, образующиеся при гликолизе, должны перемещаться в митохондрии. Попав внутрь митохондрии, электроны могут переходить к NAD + или FAD. Учитывая различный выход АТФ в зависимости от переносчика электронов, общий выход клеточного дыхания составляет от 30 до 32 АТФ на молекулу глюкозы. Рекомендуемая литература Да Пойан, А. Т., Эль-Баха, Т. и Луз, М. Р. М. П. (2010) Использование питательных веществ в организме человека: пути метаболизма. Природное образование 3 (9): 11. [Источник] Lane, N. (2010) Почему клетки питаются протонными градиентами? Природное образование 3 (9): 18. [Источник] клеток дыхания | Ресурсы WyzantТочно так же, как нам нужна энергия, чтобы прожить день, отдельные клетки нуждаются в энергии для выживания.Клеточное дыхание — это процесс, при котором клетки получают энергию в виде АТФ. Существует два типа клеточного дыхания: аэробный и анаэробный. Аэробное дыхание более эффективно и может использоваться в присутствии кислорода, в то время как анаэробное дыхание не требует кислорода. Многие организмы (или клетки) будут в первую очередь использовать аэробное дыхание, однако, если поступление кислорода ограничено, они могут использовать анаэробное дыхание для выживания. Хотя есть некоторые организмы (или клетки), которые всегда требуют анаэробного дыхания, а другие всегда требуют аэробного дыхания.У анаэробного дыхания меньше шагов, так что начнем с этого. Анаэробное дыханиеПервый этап анаэробного и аэробного дыхания называется гликолизом. Это процесс расщепления одной молекулы глюкозы (сахара) на пируват и энергию (2 АТФ). Мы подробно обсудим это во время аэробного дыхания. Второй этап анаэробного дыхания называется ферментация . Ферментация начинается с пирувата (конечный продукт гликолиза).В зависимости от организма пируват может ферментироваться до этанола (причудливое название алкоголя) или лактата (молочная кислота). Ферментация выделяет CO 2 , но не производит никакого АТФ — весь АТФ во время анаэробного дыхания вырабатывается во время гликолиза. Поскольку гликолиз производит 2 АТФ, анаэробное дыхание дает 2 АТФ на каждую молекулу глюкозы . И гликолиз, и ферментация происходят в цитозоле / цитоплазме клетки. Фактически, весь процесс анаэробного дыхания происходит в цитозоле. Ферментация — это процесс, с помощью которого мы производим вино и другие виды алкоголя. В результате анаэробного процесса дрожжи расщепляют глюкозу в виноградном соке и превращают ее в пируват. Затем пируват ферментируют до смеси этанол / спирт. Во время анаэробного дыхания также выделяется CO 2 , поэтому в вине и шампанском появляются пузыри (выделение CO 2 во время анаэробного дыхания также является причиной подъема хлеба из-за дрожжей). Конечно, другие организмы и бактерии также могут использовать этот метод дыхания, но дрожжи — лучший организм для приготовления вина. Другие клетки и организмы ферментируют пируват в лактат, также известный как молочная кислота. Я уверен, что вам всем говорили, что ваши мышцы болят во время и после упражнений, потому что в ваших мышцах накоплен избыток молочной кислоты. Это из-за анаэробного дыхания. Во время упражнений поступление кислорода к нашим мышечным клеткам ограничено. Когда кислорода мало, наши мышечные клетки используют анаэробное дыхание и ферментируют пируват в молочную кислоту. С отдыхом и временем наше тело выводит молочную кислоту, и наши мышцы больше не болят.Когда мы не тренируемся, наши мышечные клетки в основном используют аэробное дыхание, потому что кислорода много. Вот что вам нужно знать: Теперь поговорим об аэробном дыхании. Это более эффективно, потому что оно производит больше энергии (или АТФ) для каждой молекулы глюкозы. Однако аэробное дыхание можно использовать только при наличии достаточного количества кислорода. Уравнение клеточного дыханияЧтобы понять клеточное дыхание, нам сначала нужно понять основное химическое уравнение.Подумайте, что вы делаете, когда устали и вам нужно больше энергии, чтобы бодрствовать. Вы зеваете, что требует много кислорода, или O 2 , и пьете что-нибудь с большим количеством сахара, например Mountain Dew. Научный термин для сахара — глюкоза, а химическая формула глюкозы — C 6 H 12 O 6 . Нам нужно O 2 + C 6 H 12 O 6 для энергии, чтобы бодрствовать, точно так же, как нам нужно O 2 + C 6 H 12 O 6 для сотовой связи дыхание должно иметь место. А теперь давайте подумаем, что происходит с кислородом, который мы вдыхаем после большого зевота. Он попадает в наши легкие, чтобы его использовать, и мы выдыхаем углекислый газ, или CO 2 . С углекислым газом смешиваются капли воды, или H 2 O. Вот почему наше дыхание затуманивает стекло, когда мы выдыхаем в окно автомобиля. Собирая всю эту информацию вместе, мы получаем глюкозу плюс сахар, образуем углекислый газ, воду и энергию. Это уравнение клеточного дыхания: C 6 H 12 O 6 + 6O 2 -> 6CO 2 + 6H 2 O + ATP В этом уравнении 6 — магическое число.Есть 6 молекул кислорода, 6 углекислого газа и 6 молекул воды. В нашей формуле глюкозы также есть пара шестерок. Запомните цифру 6 при написании этого уравнения. В конце концов, нам нужно перерабатывать CO 2 и H 2 O, чтобы было больше глюкозы и кислорода для будущего клеточного дыхания и производства энергии. Вот тут-то и появляются растения с фотосинтезом. Уравнение фотосинтеза почти прямо противоположно уравнению клеточного дыхания: 6CO 2 + 6H 2 O + светлый -> C 6 H 12 O 6 + 6O 2 Сохраним обсуждение фотосинтеза для будущего урока. Продолжаем … ГликолизПервым этапом клеточного дыхания является гликолиз или расщепление глюкозы. Название этого процесса на самом деле очень логично. Гликолиз буквально означает распад глюкозы. Если мы знаем, что «глюкоза» — это более старый термин для «глюкозы», и если мы помним «лизис» означает разрушение, то мы можем понять, что гликолиз = глюкоза + лизис, или разрушение глюкозы. Гликолиз — это первый этап клеточного дыхания как для анаэробных, так и для аэробных процессов. Гликолиз происходит в цитозоле клетки. В цитозоле мы превращаем 1 молекулу глюкозы в 2 молекулы пирувата. Конечно, глюкозу невозможно превратить в пируват без небольшой помощи. Это преобразование требует 2 НАД + и немного энергии в виде 2 АТФ. После завершения гликолиза в качестве продуктов остаются 2 пирувата, 2 НАДН и 4 АТФ. Поскольку гликолиз дает 4 АТФ, но нам пришлось использовать 2 АТФ в начале процесса, общий чистый прирост энергии составляет 2 АТФ.Клетка будет использовать 2 АТФ для получения энергии. НАДН будет переработан обратно в НАД + в будущем процессе, чтобы его можно было снова использовать в гликолизе. Две молекулы пирувата будут использоваться на втором этапе клеточного дыхания. Цикл Кребса / Цикл лимонной кислоты / Цикл TCAНе путайте. Цикл Кребса можно назвать несколькими разными именами. Цикл Кребса, цикл лимонной кислоты и цикл TCA (трикарбоновой кислоты) могут использоваться взаимозаменяемо.С этого момента я буду называть этот шаг циклом Кребса. Цикл Кребса является вторым этапом аэробного дыхания и происходит в матриксе митохондрий (середина митохондрий). Это многоступенчатый процесс, но не беспокойтесь, нам не нужно запоминать все соединения или каждый задействованный фермент. Здесь мы сосредоточимся только на ключевых игроках. Начнем с одной из двух молекул пирувата, которые образовались в цитозоле клетки во время гликолиза.Молекула пирувата попадает в матрицу митохондрий, где превращается в ацетил-КоА. Ацетил-КоА отвечает за запуск циклической серии реакций. Ацетил-КоА создает первое соединение в цикле Кребса (цитрат) путем ферментативного преобразования самого последнего продукта, образовавшегося в цикле Кребса, оксалоацетата, в цитрат. Названия этих конкретных соединений не важны, однако важно понимать, почему это называется циклом. Каждый раз в течение цикла Кребса создается 1 молекула АТФ и выделяются 3 молекулы диоксида углерода, CO 2 .Поскольку для прохождения цикла Кребса необходим только 1 пируват, а во время гликолиза образовались 2 молекулы пирувата, цикл Кребса повторяется. Это означает, что во время клеточного дыхания выделяются шесть молекул углекислого газа, а цикл Кребса образует 2 дополнительных АТФ. На первых двух этапах клеточного дыхания происходит чистый прирост 4 АТФ. Хотя цикл Кребса не дает много энергии, он дает несколько молекул НАДН и ФАДН 2 . Эти две молекулы будут ключом к производству гораздо большего количества АТФ на третьей стадии клеточного дыхания, цепи переноса электронов. Электронная транспортная цепь / окислительное фосфорилированиеТретий и последний этап клеточного дыхания происходит во внутреннем митохондриальном члене и называется цепью переноса электронов (ETC). Помните, что митохондрии — это органеллы, которые имеют две фосфолипидные двухслойные мембраны. ETC происходит внутри самой внутренней мембраны. Часто термин окислительное фосфорилирование используется как синоним цепи переноса электронов; однако окислительное фосфорилирование — это серия реакций, происходящих во время ETC. Возможно, вы заметили, что мы обсуждаем аэробное дыхание и еще не обсуждали роль кислорода, но мы знаем, что кислород используется. Кислород вступает в игру во время этого третьего процесса. Это также этап, на котором вырабатывается больше всего энергии. Поскольку на этом третьем этапе вырабатывается большая часть АТФ, и он происходит в митохондриях, мы называем мощные митохондрии «электростанцией клетки», потому что она обеспечивает большую часть энергии клетки. НАДН и ФАДН 2 , которые образуются во время цикла Кребса, инициируют цепь переноса электронов.И НАДН, и ФАДН 2 переносят электроны вниз по цепочке реакций. НАДН или ФАДН 2 , в зависимости от того, какой из них присутствует в данный момент, будет работать с электронами и кислородом для преобразования АДФ в АТФ. В процессе НАДН теряет водород и создает градиент концентрации водорода на внутренней мембране митохондрий. Этот градиент концентрации водорода стимулирует производство большего количества АТФ. Поскольку НАДН потерял водород, теперь он составляет НАД + . Вы помните, почему это важно? Этот процесс перерабатывает НАДН в НАД + , так что НАД + можно повторно использовать в гликолизе. В конце ETC производится вода (H 2 O) и АТФ. В зависимости от того, сколько молекул НАДН доступно, электронная транспортная цепь составляет в общей сложности 32 или 34 АТФ. Эти 32-34 АТФ в сочетании с 2 АТФ из гликолиза и 2 АТФ из цикла Кребса означает, что одна молекула глюкозы (сахара) может образовать в общей сложности 36-38 АТФ. Сводка клеточного дыханияКлеточное дыхание может быть анаэробным или аэробным, в зависимости от того, присутствует кислород или нет.Анаэробное дыхание составляет всего 2 АТФ. Аэробное дыхание намного эффективнее и может производить до 38 АТФ с одной молекулой глюкозы. Анаэробное дыхание состоит из двух этапов. Аэробное дыхание состоит из трех этапов. Аэробное клеточное дыхание можно описать уравнением: C 6 H 12 O 6 + 6O 2 -> 6CO 2 + 6H 2 O + ATP Обзор цикла КребсаЦикл Кребса назван в честь его первооткрывателя Ганса Кребса.Он также известен как цикл лимонной кислоты или цикл трикарбоновых кислот. Это серия химических реакций, необходимых для клеточного дыхания; он включает окислительно-восстановительные реакции, дегидратацию, гидратацию и декарбоксилирование, которые производят АТФ (аденозинтрифосфат), коферментный энергоноситель для клеток. Также производятся отходы в виде диоксида углерода, а также дополнительные наборы реагентов, используемых для регенерации исходной реакции. Гликолиз, окисление пирувата и цикл КребсаГликолиз, процесс расщепления шестиуглеродной молекулы глюкозы на две трехуглеродные молекулы пирувата, связан с циклом Кребса.Для каждой вдыхаемой молекулы глюкозы циклические реакции происходят дважды, поскольку образуются две молекулы пировиноградной кислоты. Гликолиз — это анаэробная реакция, протекающая в цитоплазме клетки. Остальные реакции клеточного дыхания являются аэробными, поэтому требуют кислорода и происходят в митохондриях клетки. Трехуглеродные молекулы пировиноградной кислоты превращаются в двухуглеродную молекулу, присоединенную к коферменту А, называемую ацетил-КоА, в процессе окисления пирувата. Это продукт, ацетил-КоА, который входит в цикл Кребса. Химическая схема цикла Кребса — цикл трикарбоновой кислоты (лимонной), 2-я иллюстрация. Кредит изображения: Chromatos / Shutterstock Шаги цикла КребсаЦикл Кребса представляет собой замкнутый набор реакций из восьми шагов:
Остальные стадии цикла Кребса регенерируют щавелевоуксусную кислоту из сукцината:
Продукты и функции цикла КребсаЗа один цикл продуцируются две молекулы углерода, три молекулы NADH, одна молекула FADh3 и одна молекула ATP или GTP.Каждая молекула глюкозы производит две молекулы ацетил-КоА, которых достаточно для двух циклов. Эти продукты можно умножить на два, чтобы получить выход на глюкозу. Хотя непосредственно за цикл вырабатывается только один АТФ (или ГТФ), продукты НАДН и ФАДх3 могут продуцировать АТФ (или ГТФ) в дальнейшем процессе клеточного дыхания, называемом окислительным фосфорилированием.
Основная функция цикла Кребса — производство энергии, хранимой и транспортируемой в виде АТФ или ГТФ. Цикл также играет центральную роль в других биосинтетических реакциях, где продуцируемые промежуточные соединения необходимы для образования других молекул, таких как аминокислоты, нуклеотидные основания и холестерин.Цикл Кребса присутствует во всех клетках, которые используют кислород. В сочетании с процессом окислительного фосфорилирования цикл Кребса производит большую часть энергии, используемой аэробными клетками, при этом процент энергии, обеспечиваемой людям, превышает 95%. Терминология
Источники: |

 org/10.1016/j.stem.2012.10.002.
org/10.1016/j.stem.2012.10.002. , Hong Y., Zeng L., Tang L., Ying W. Roles of NAD(+)/NADH and NADP(+)/NADPH in cell death. Curr Pharm Des 2009; 15(1): 12–19, https://doi.org/10.2174/138161209787185832.
, Hong Y., Zeng L., Tang L., Ying W. Roles of NAD(+)/NADH and NADP(+)/NADPH in cell death. Curr Pharm Des 2009; 15(1): 12–19, https://doi.org/10.2174/138161209787185832. Springer Science + Business Media; 1998; p. 81–100, https://doi.org/10.10 07/978-1-4615-5653-4_7.
Springer Science + Business Media; 1998; p. 81–100, https://doi.org/10.10 07/978-1-4615-5653-4_7. J Inherit Metab Dis 1984; 7(Suppl 1): 57–61, https://doi.org/10.1007/bf03047376.
J Inherit Metab Dis 1984; 7(Suppl 1): 57–61, https://doi.org/10.1007/bf03047376. 1146/annurev.physchem.47.1.555.
1146/annurev.physchem.47.1.555.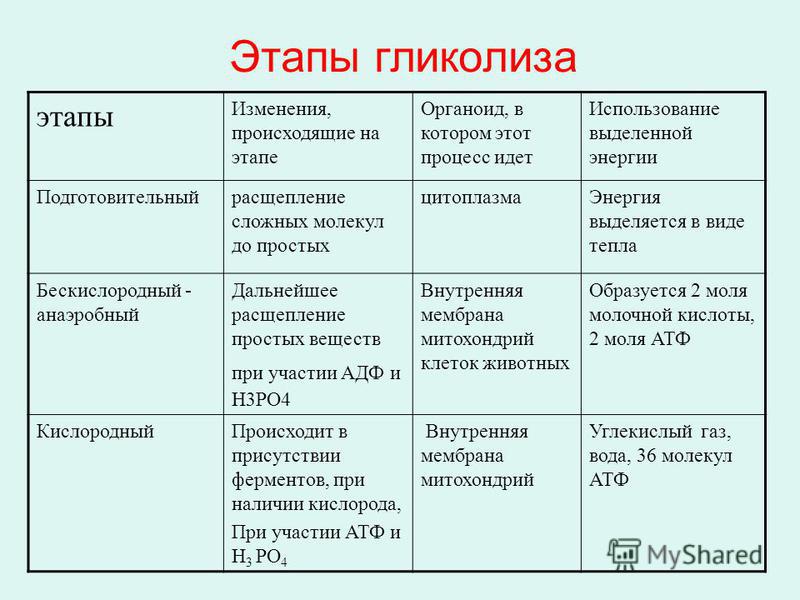
 1016/j.bbcan.2009.11.002.
1016/j.bbcan.2009.11.002.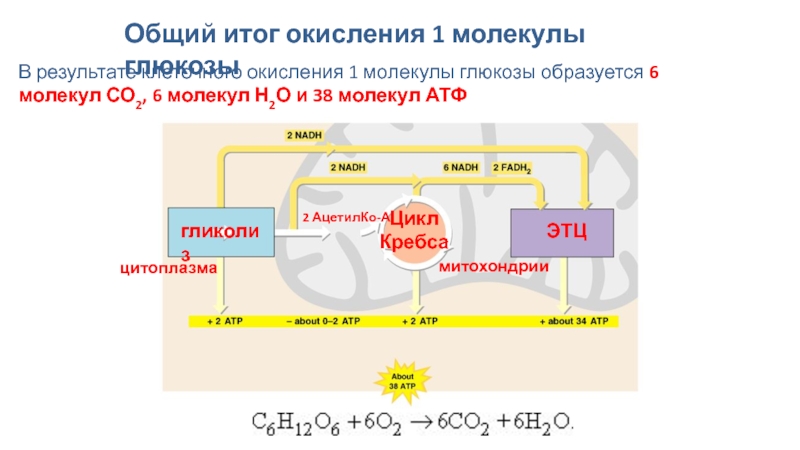 , Lenaz G., Sgarbi G. Hypoxia and mitochondrial oxidative metabolism. Biochim Biophys Acta 2010; 1797(6–7): 1171–1177, https://doi.org/10.1016/j.bbabio.2010.02.011.
, Lenaz G., Sgarbi G. Hypoxia and mitochondrial oxidative metabolism. Biochim Biophys Acta 2010; 1797(6–7): 1171–1177, https://doi.org/10.1016/j.bbabio.2010.02.011. , Wind F., Negelein E. The metabolism of tumors in the body. J Gen Physiol 1927; 8(6): 519–530, https://doi.org/10.1085/jgp.8.6.519.
, Wind F., Negelein E. The metabolism of tumors in the body. J Gen Physiol 1927; 8(6): 519–530, https://doi.org/10.1085/jgp.8.6.519. Cancer Cell 2006; 9(6): 425–434, https://doi.org/10.1016/j.ccr.2006.04.023.
Cancer Cell 2006; 9(6): 425–434, https://doi.org/10.1016/j.ccr.2006.04.023.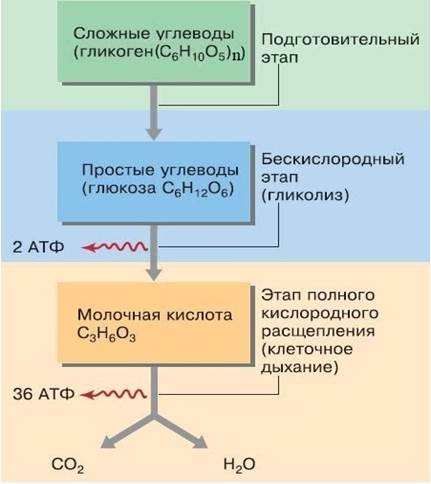 Biochem Biophys Res Commu 2004; 313(3): 459–465, https://doi.org/10.1016/j.bbrc.2003.11.136.
Biochem Biophys Res Commu 2004; 313(3): 459–465, https://doi.org/10.1016/j.bbrc.2003.11.136. , Papadakis A., Puri S., Xylas J., Munger K., Georgakoudi I. Intrinsic fluorescence and redox changes associated with apoptosis of primary human epithelial cells. J Biomed Opt 2006; 11(6): 064012, https://doi.org/10.1117/1.2401149.
, Papadakis A., Puri S., Xylas J., Munger K., Georgakoudi I. Intrinsic fluorescence and redox changes associated with apoptosis of primary human epithelial cells. J Biomed Opt 2006; 11(6): 064012, https://doi.org/10.1117/1.2401149.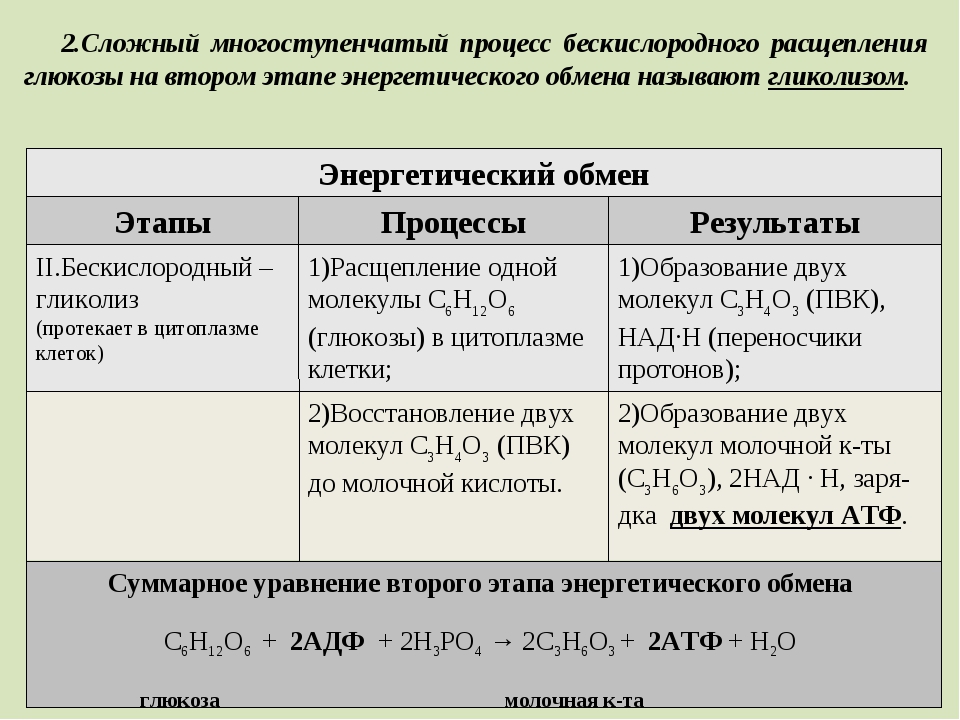 J Biomed Opt 2004; 9(4): 772–778, https://doi.org/10.1117/1.1760759.
J Biomed Opt 2004; 9(4): 772–778, https://doi.org/10.1117/1.1760759. Proc Natl Acad Sci USA 2007; 104(49): 19494–19499, https://doi.org/10.1073/pnas.0708425104.
Proc Natl Acad Sci USA 2007; 104(49): 19494–19499, https://doi.org/10.1073/pnas.0708425104. J Biomed Opt 2012; 17(4): 046010, https://doi.org/10.1117/1.JBO.17.4.046010.
J Biomed Opt 2012; 17(4): 046010, https://doi.org/10.1117/1.JBO.17.4.046010. Proc. SPIE 9303, Photonic Therapeutics and Diagnostics XI, 93032S (February 26, 2015), https://doi.org/10.1117/12.2077941.
Proc. SPIE 9303, Photonic Therapeutics and Diagnostics XI, 93032S (February 26, 2015), https://doi.org/10.1117/12.2077941.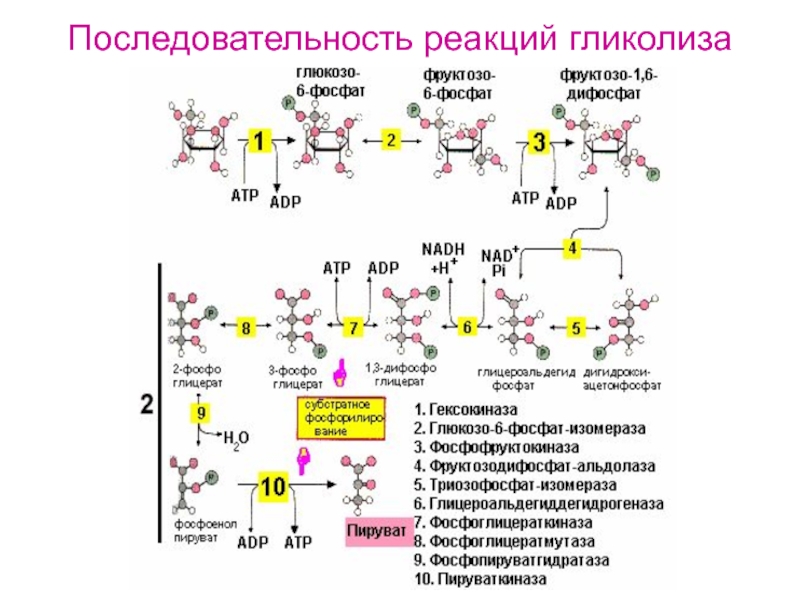 M., McLaughlin-Drubin M.E., Münger K., Georgakoudi I. Automated biochemical, morphological, and organizational assessment of precancerous changes from endogenous two-photon fluorescence images. PLoS ONE 2011; 6(9): e24765, https://doi.org/10.1371/journal.pone.0024765.
M., McLaughlin-Drubin M.E., Münger K., Georgakoudi I. Automated biochemical, morphological, and organizational assessment of precancerous changes from endogenous two-photon fluorescence images. PLoS ONE 2011; 6(9): e24765, https://doi.org/10.1371/journal.pone.0024765. J Fluoresc 2015; 25(4): 931–939, https://doi.org/10.1007/s10895-015-1575-4.
J Fluoresc 2015; 25(4): 931–939, https://doi.org/10.1007/s10895-015-1575-4. Bioconjug Chem 2003; 14(4): 709–714, https://doi.org/10.1021/bc034038n.
Bioconjug Chem 2003; 14(4): 709–714, https://doi.org/10.1021/bc034038n. W., Dasari R.R., Van Dam J., Feld M.S. NAD(P)H and collagen as in vivo quantitative fluorescent biomarkers of epithelial precancerous changes. Cancer Res 2002; 62(3): 682–687.
W., Dasari R.R., Van Dam J., Feld M.S. NAD(P)H and collagen as in vivo quantitative fluorescent biomarkers of epithelial precancerous changes. Cancer Res 2002; 62(3): 682–687.
Leave A Comment