Индикаторы. Кислотно-основные индикаторы. Изменение окраски в зависимости от рН (кислотности среды)
Изменение окраски индикаторов в зависимости от pH
Кислотно-основные индикаторы — это соединения, окраска которых меняется в зависимости от кислотности среды.
Например, лакмус в кислой среде окрашен в красный цвет, а в щелочной — в синий. Это свойство можно использовать для быстрой оценки pH растворов.
Кислотно-основные индикаторы находят широкое применение в химии. Известно, например, что многие реакции по-разному протекают в кислой и щелочной средах. Регулируя pH, можно изменить направление реакции. Индикаторы можно использовать не только для качественной, но и для количественной оценки содержания кислоты в растворе (метод кислотно-основного титрования).
Применение индикаторов не ограничивается «чистой» химией. Кислотность среды необходимо контролировать во многих производственных процессах, при оценке качества пищевых продуктов, в медицине и т. д.
В таблице 1 указаны наиболее «популярные» индикаторы и отмечена их окраска в нейтральной, кислой и щелочной средах.
Таблица 1
| Кислая среда | Нейтральная среда | Щелочная среда | |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Лакмус
Метилоранж
Фенолфталеин
В действительности, каждый индикатор характеризуется своим интервалом рН, в котором происходит изменение цвета (интервал перехода). Изменение окраски происходит из-за превращения одной формы индикатора (молекулярной) в другую (ионную). По мере понижения кислотности среды (с ростом рН) концентрация ионной формы повышается, а молекулярной — падает. В таблице 2 перечислены некоторые кислотно-основные индикаторы и соответствующие интервалы перехода.
| Название индикатора | Цвет в кислой среде | Интервал перехода (pH) | Цвет в щелочной среде |
| Метиловый оранжевый | Красный | 3 — 5 | Желтый |
| Метиловый красный | Красный | 4-6 | Желтый |
| Бромкрезоловый пурпурный | Желтый | 5,5 — 7,5 | Фиолетовый |
| Феноловый красный | Желтый | 7-9 | Красный |
| Фенолфталеин | Бесцветный | 8-10 | Малиновый |
Возможно, вам будут интересны следующие материалы:
Cреда водных растворов веществ. Индикаторы
Определение характера среды водных растворов веществ. Индикаторы.
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н+ и ОН—. Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н+ равно количеству гидроксид-ионов ОН–.
[Н+] = [ОН–]
Если количество ионов водорода Н+ больше количества гидроксид-ионов ОН
[Н+] > [ОН–]
Если количество ионов водорода Н+ меньше количества гидроксид-ионов ОН–, то среда раствора щелочная:
[Н+] < [ОН–]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н+] > [ОН–] | [Н+] = [ОН–] | [Н+] < [ОН–] |
| pH < 7 | pH = 7 | pH > 7 |
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H
HA = H+ + A–
При этом в растворе возникает избыток катионов водорода Н+, поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН–:
МеОH = Ме+ + ОН–
При этом в растворе возникает избыток катионов гидроксид-анионов ОН–, поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН–. Среда водного раствора аммиака слабо щелочная.
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей.
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4+) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН–, при этом в воде образуются избыточные катионы водорода Н+. Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например, катионы
Fe3+ + HOH ↔ FeOH2+ + H+
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н+, при этом в воде остаются гидроксид-анионы ОН–. Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например, ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO— + HOH ↔ CH3COOH + OH—
Типы гидролиза солей в водных растворах:
| Катион/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катион/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочная | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катион/анион | Na+ | NH4+ |
| Cl– | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO32– | Na2CO3, гидролиз по аниону, среда щелочная | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
:
| Катион/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катион/анион | Na+ | NH4+ |
| Cl– | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO32– | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Инструктивная карта. Лабораторная работа в 8кл. по теме «Изменение окраски индикаторов в кислой среде»
Инструктивная карта. Лабораторная работа в 8кл. по теме «Изменение окраски индикаторов в кислой среде»
Цель: Изучить действие индикаторов в кислой среде.
Оборудование и реактивы:
Индикаторы: лакмус, метиловый оранжевый, фенолфталеин;
Реактивы: раствор HCl, Н2О дистиллированная;
Чистые пробирки – 6 шт.
Ход работы.
Текущий инструктаж: работа с кислотами.
Проведение опыта и оформление результатов.
Задание 1.
В 3 чистые пробирки прилить по 1 мл дистиллированной воды.
В 1-ю пробирку добавить 2-3 капли лакмуса, отметить цвет полученного раствора, результат записать в таблице или зарисовать.
Во 2-ю пробирку добавить 2-3 капли метилоранж, отметить цвет полученного раствора, результат записать в таблице или зарисовать.
В 3-ю пробирку добавить 2-3 капли фенолфталеина, отметить цвет полученного раствора, результат записать в таблице или зарисовать.
Задание 2.
В 3 чистые пробирки прилить по 1 мл HCl.
В 1-ю пробирку добавить 2-3 капли лакмуса, отметить цвет полученного раствора, результат записать в таблице или зарисовать.
Во 2-ю пробирку добавить 2-3 капли метилоранж, отметить цвет полученного раствора, результат записать в таблице или зарисовать.
В 3-ю пробирку добавить 2-3 капли фенолфталеина, отметить цвет полученного раствора, результат записать в таблице или зарисовать.
Задание 3.
Как можно определить раствор кислоты среди других веществ?
Какие индикаторы изменили свой цвет в кислоте?
Задание 4.
Оформить отчет о проделанной работе.
Сделать вывод.
Результаты изменения цвета индикаторов.
- Среда
Индикатор
нейтральная
кислая
Лакмус
Метилоранж
Фенолфталеин
рН-водородный показатель
«Изменение окраски индикаторов в кислой среде»
Лакмус Метилоранж Фенолфталеин Н2О дистил. раствор HCl





Лакмус Метилоранж Фенолфталеин Н2О дистил.







Лакмус Метилоранж Фенолфталеин раствор HCl







Больше всего распространены индикаторы лакмус, фенолфталеин и метилоранж.
Самым первым появился кислотно-основный индикатор лакмус. Фактически природный лакмус представляет собой сложную смесь.Это порошок черного цвета, растворим в воде, 95 % спирте, ацетоне, ледяной уксусной кислоте. Его основными компонентами являются: азолитмин (C9H10NO5) и эритролитмин (С13H22O6).
Окраска лакмуса в различных средах изменяется следующим образом:
Щёлочь
Нейтральная
среда
красный
синий
фиолетовый
Фенолфталеин С20Н14О4 (продается в аптеке под названием «пурген») — белый мелкокристаллический порошок, растворим в 95% спирте, но практически не растворим в воде. Применяется в виде спиртового раствора, приобретает в щелочной среде малиновый цвет, а в нейтральной и кислой он бесцветен.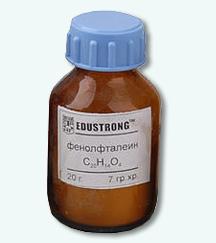
Щёлочь
Нейтральная
среда
бесцветный
малиновый
бесцветный
Метиловый оранжевый, C14H14N3O3SNa, — кристаллический порошок оранжевого цвета, умеренно растворим в воде, нерастворим в органических растворителях. Метилоранж действительно оранжевый в нейтральной среде. В кислотах его окраска становится розово-малиновой, а в щелочах – желтой.
Щёлочь
Нейтральная
среда
розовый
жёлтый
оранжевый
В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зеленый (его спиртовой раствор используется как дезинфицирующее средство – зеленка). В сильнокислой среде его окраска желтая, а в сильнощелочной среде раствор обесцвечивается.
Помимо кислотно-основных известны и другие типы индикаторов:адсорбционные, комплексонометрические, флуоресцентные, изотопные, окислительно-восстановительные и прочие.
В настоящее время химики часто пользуются универсальной индикаторной бумагой. В основе — смеси индикаторов, позволяющие определить значение рН растворов в большом диапазоне концентраций (1-10; 0-12). Растворами таких смесей — «универсальных индикаторов» обычно пропитывают полоски «индикаторной бумаги», с помощью которых можно быстро (с точностью до десятых долей рН) определить кислотность исследуемых водных растворов. Для более точного определения полученный при нанесении капли раствора цвет индикаторной бумаги немедленно сравнивают с эталонной цветовой шкалой.
КИСЛОТЫ И ОСНОВАНИЯ; ИНДИКАТОРЫ | НООС Руководителю
В химии есть целый ряд веществ, обладающих способностью менять свою окраску в присутствии кислот и щелочей (щелочь — хорошо растворимое в воде основание). Эти вещества называются индикаторами и применяются для определения реакционной среды. Среда может быть кислой, щелочной и нейтральной.
Этими веществами пропитывают бумагу.
Существует много видов различных индикаторных бумаг.
В нашем наборе имеются следующие: лакмусовая нейтральная (окрашена в сиреневый цвет), лакмусовая синяя и лакмусовая красная, фенолфталеиновая, метиловая оранжевая, конго.
ОПРЕДЕЛЕНИЕ КИСЛОТ
Поставим в штатив две пробирки. Нальем в одну из них немного 10% раствора соляной кислоты, а в другую — такое же количество уксусной. (Для этого используйте имеющийся в домашнем хозяйстве столовый уксус, который представляет 9% раствор уксусной кислоты).
В каждую пробирку опустим по половине нейтральной лакмусовой бумажки (она имеет фиолетовый цвет). В пробирке с соляной кислотой бумажка изменила свой цвет на красный, а с уксусной на розовый.
Существуют другие кислоты, в которых фиолетовая бумажка меняет свой цвет на красный. Это серная кислота, азотная и др. Эти кислоты называются сильными кислотами. А такие кислоты, как уксусная, лимонная, винная и др., относящиеся, главным образом, к большому классу химических веществ — органических, называются слабыми.
Следовательно, с помощью индикаторной бумажки (не только лакмусовой) можно определить сильную и слабую кислоту, если они имеют раствор примерно одинаковой концентрации.
ОПРЕДЕЛЕНИЕ ОСНОВАНИЙ
В нашем наборе есть кристаллический едкий натр (гидроокись натрия) — это очень ценное основание, широко использующееся и в лабораториях и в промышленности.
Прежде всего, приготовим раствор этого основания. К кристаллам едкого натра прильем воды (полный флакон), закроем его пробкой и тщательно взболтаем. Мы видим, что едкий натр очень хорошо растворим в воде. Все основания называются гидроксадами. Они могут быть растворимы в воде и не растворимы.
Растворимые в воде основания, как уже вам известно, называются щелочами. К щелочам относится известковая вода и нашатырный спирт, который неправильно назван «спиртом». Это его бытовое название. Правильно это вещество называется раствор аммиака (гидроксид аммония).
Испытаем нейтральной лакмусовой бумажкой растворы перечисленных выше веществ: гидроксид натрия, гидроксид кальция (известковой воды), гидроксида аммония, налив растворы этих веществ в пробирки и опустив в них по полоске фиолетовой лакмусовой бумажки.
Во всех пробирках фиолетовая бумажка изменила свой цвет на синий.
Следовательно, нейтральный лакмус в щелочной среде становится синим. При работе со щелочами соблюдайте осторожность.
Не случайно они названы едкими (едкий натр, едкий калий).
Не забывайте, от щелочей надо оберегать глаза и руки, они оставляют на столе несмываемые пятна, портят краску.
ИССЛЕДУЕМ ДРУГИЕ ИНДИКАТОРЫ
Кроме нейтральной лакмусовой бумаги есть синяя и красная. При действии кислот па синюю бумагу она резко изменяет свой цвет на красный, еще отчетливее, чем нейтральная бумага.
Изменения в окраске других индикаторов приведены в таблице.
ЕЩЕ ОДИН ПОМОЩНИК, КОТОРЫЙ СПОСОБЕН ОПРЕДЕЛИТЬ КИСЛОТУ И ЩЕЛОЧЬ (растворимое основание)
Он содержится в листьях красной капусты. Красящее вещество называют антоциан. Опустим листья красной капусты в кипящую воду, и вода окрасится в красно-фиолетовый цвет. Этот раствор поможет нам в определении кислот.
Индикаторные бумаги | в нейтральной среде | в кислой среде | в щелочной среде |
лакмусовая нейтральная | фиолетовая | красная | синяя |
лакмусовая синяя | синяя | красная | синяя |
лакмусовая красная | красная | красная | синяя |
фенолфталеиновая | белая | белая | малиновая |
метилоранжевая | оранжевая | красная | желтая |
конго | красная | сине-фиолетовая | красная |
ЛАКМУС — Большой энциклопедический словарь
ЛАКМУС (от нидер. lakmoes) — красящее вещество, добываемое из некоторых лишайников. Водный раствор применяют как индикатор при кислотно-основном титровании (в кислой среде окрашен в красный, в щелочной — в синий цвет).
Источник: Большой энциклопедический словарь на Gufo.me
Значения в других словарях
- лакмус — Лакмуса, м. [от латин. lacca musci – нарост на мхе] (хим.). Сине-лиловая краска, служащая для изготовления лакмусовой бумаги. || То же, что лакмусовая бумага. Большой словарь иностранных слов
- лакмус — ЛАКМУС м. добываемая из ягеля Liche rocella лиловая краска, краснеющая от кислот, и потому служащая для химических разведок. Лакмусовый к лакмусу относящ. Толковый словарь Даля
- лакмус — Лакмус, лакмусы, лакмуса, лакмусов, лакмусу, лакмусам, лакмус, лакмусы, лакмусом, лакмусами, лакмусе, лакмусах Грамматический словарь Зализняка
- лакмус — орф. лакмус, -а Орфографический словарь Лопатина
- Лакмус — (от голл. lakmoes) красящее вещество, добываемое из некоторых видов лишайников (например, Roccella tinctoria). Состав Л. сложен и окончательно не установлен. Красящий компонент Л. — слабая кислота азолитмин, соли которой имеют синий цвет. Большая советская энциклопедия
- лакмус — ла́кмус «вид красителя». Из нем. Lackmus или голл. lаkmоеs – то же (Клюге-Гётце 340). Этимологический словарь Макса Фасмера
- Лакмус — Добывается из лишаев Rocella tinctoria, Lecanora tartarea и пр., из которых готовится также орсин и орсеин. Под влиянием кислорода воздуха и аммиака красящее вещество этих растений дает орсеин… Энциклопедический словарь Брокгауза и Ефрона
- лакмус — ЛАКМУС, а, м. Красящее растительное вещество, раствор к-рого в щелочной среде окрашивается в синий цвет, а в кислой среде в красный. | прил. лакмусовый, ая, ое. Толковый словарь Ожегова
- лакмус — Ла́кмус/. Морфемно-орфографический словарь
- ЛАКМУС — ЛАКМУС, краска, в нейтральных водных растворах имеющая фиолетовый оттенок; используется для определения кислотности (становится красной) или щелочности (становится синей). Научно-технический словарь
- лакмус — Это слово, имеющее значение «красящее вещество, способное менять цвет», было заимствовано из голландского, где lakmoes – образовано сложением lak (от глагола leken – «течь») и moes – «краска»: краска, пропитывающая бумагу. Этимологический словарь Крылова
- Лакмус — Турниса. (Термины российского архитектурного наследия. Плужников В.И., 1995) Архитектурный словарь
- лакмус — лакмус м. 1. Красящее вещество, добываемое из некоторых лишайников и окрашивающееся под действием кислот — в красный цвет, а под действием щелочей — в синий. 2. разг. Лакмусовая бумага. Толковый словарь Ефремовой
- лакмус — Л’АКМУС, лакмуса, ·муж. (от ·лат. lacca musci) — нарост на мхе) (·хим. ). Сине-лиловая краска, служащая для изготовления лакмусовой бумаги. | То же, что лакмусовая бумага. Толковый словарь Ушакова
- лакмус — Заимств. в XIX в. из голл. яз., в котором lak moes — сращение lak (от lëken «течь») и moes «растительная краска». Этимологический словарь Шанского
- лакмус — -а, м. 1. Красящее вещество, добываемое из морских лишайников, меняющее цвет пропитанной им бумаги под действием кислот на красный, под действием щелочей — на синий. 2. То же, что лакмусовая бумага (см. лакмусовый). [голл. lakmoes] Малый академический словарь
- лакмус — ЛАКМУС -а; м. [голл. lakmoes] 1. Красящее вещество, добываемое из морских лишайников, меняющее цвет под действием кислот на красный, под действием щелочей — на синий. Толковый словарь Кузнецова
- Лакмус — (нем. Lackmus, от лат. lacca Musci сок лишайника) растительный пигмент, получаемый из некоторых видов лишайника, имеющий красный цвет в кислой и синий в щелочной среде; применяется в качестве нейтрального индикатора для качественного определения активной реакции среды. Медицинская энциклопедия
Нормальные значения и что они означают
Моча содержит воду, соли и продукты жизнедеятельности почек. Баланс этих соединений может влиять на уровень кислотности мочи, который специалисты измеряют с помощью pH.
pH — это показатель того, насколько кислая или щелочная моча человека. Врачи часто проверяют pH мочи и могут проводить другие диагностические тесты, когда у человека есть симптомы, которые могут быть связаны с проблемой в мочевыводящих путях.
По данным Американской ассоциации клинической химии, среднее значение pH мочи составляет 6.0, но может варьироваться от 4,5 до 8,0. Моча ниже 5,0 кислая, а моча выше 8,0 щелочная или щелочная.
В разных лабораториях могут быть разные диапазоны «нормальных» уровней pH. Отчет лаборатории объяснит нормальные и аномальные уровни для конкретной лаборатории. Врач обычно объясняет человеку эти результаты.
Одним из основных факторов, влияющих на pH мочи, является пища, которую ест человек. Врач, скорее всего, спросит человека о продуктах, которые он обычно ест, прежде чем оценивать уровень pH мочи.
К кислым продуктам относятся:
- зерна
- рыба
- газированные напитки
- продукты с высоким содержанием белка
- сладкие продукты
Щелочные продукты включают:
- орехи
- овощи
- большинство фруктов
Если человек имеет высокий pH мочи, что означает, что она более щелочная, это может указывать на состояние здоровья, например:
У человека также может быть более высокий pH мочи из-за продолжительной рвоты. Это избавляет организм от кислоты из желудка, которая может сделать жидкости тела более щелочными.
Кислая моча также может создавать среду, в которой могут образовываться камни в почках.
Если у человека низкий уровень pH мочи, что означает, что она более кислая, это может указывать на такое заболевание, как:
Прием определенных лекарств также может сделать pH мочи человека более щелочным или кислым.
Человек должен спросить своего врача, следует ли ему прекратить прием определенных лекарств ночью или утром перед анализом мочи. Однако иногда врач хочет, чтобы человек продолжал принимать эти лекарства, чтобы определить pH мочи человека, пока он их принимает.
Поскольку на pH мочи влияют многие факторы и он может сильно различаться, врач не может диагностировать заболевание, основываясь только на pH. Например, pH более 7 может сигнализировать об ИМП или другом виде инфекции.
Врач может рассмотреть pH мочи наряду с другими симптомами, чтобы поставить диагноз. Они также могут заказать анализ pH мочи, чтобы изучить эффективность лечения камней в почках.
Лекарства, такие как ингибиторы карбоангидразы (ацетазоламид), стремятся сделать мочу более щелочной, поэтому врач может взять более одного образца, чтобы увидеть, меняется ли pH.
Иногда врач может попросить образец мочи для «чистого улова», чтобы предотвратить попадание бактерий в образец. Это означает, что человек очистит область своих гениталий, выделит небольшое количество мочи и соберет 1–2 унции мочи для проверки pH.
Анализ мочи состоит из трех основных компонентов:
- Визуальный осмотр: Когда врач или лаборант исследует мочу, они будут проверять ее цвет, наличие в моче посторонних веществ, таких как кровь, и наличие в моче мочи. кажется пенистым.
- Тест с помощью щупа: Тест с помощью щупа заключается в удержании кусочка специально обработанной бумаги или лакмусовой бумаги в образце мочи. Щуп изменит цвет, чтобы показать, насколько кислая или щелочная моча. Он также может изменить цвет, если в моче присутствуют другие вещества, такие как глюкоза, лейкоциты, билирубин или белки.
- Исследование под микроскопом: Лаборант исследует небольшое количество мочи под микроскопом, чтобы найти частицы, такие как красные кровяные тельца, кристаллы или белые кровяные тельца.Обычно они не присутствуют в моче и могут указывать на основное заболевание.
Анализ pH мочи не вызывает побочных эффектов. Человек будет мочиться, как обычно, чтобы сдать образец.
Кислотность или щелочность мочи может помочь врачу диагностировать заболевания. Врачи могут проверить pH мочи с помощью лакмусовой бумажки.
Врач может выполнить анализ pH мочи как часть более крупного анализа мочи, или он может специально проверить pH мочи.
Высокий и низкий уровень pH может указывать на проблемы с почками человека, например на среду, которая может способствовать развитию камней в почках.
.Примечания к индикаторам | Дополнительные ссылки> Наука> Кислота, щелочь и соль
Индикаторы — это химические вещества, которые используются для определения того, является ли данное вещество кислотным или основным. Индикаторы не могут участвовать в химической реакции и не влияют на химическую реакцию, но показывают окончание химической реакции.
Лакмус, фенолфталеин и метиловый оранжевый — общие индикаторы, которые определяют кислотную и основную природу вещества по характерному изменению их цвета.Обычные индикаторы не дают информации о силе кислотных или основных веществ. Они показывают следующее изменение цвета в кислых, щелочных и нейтральных растворах:
| Общие индикаторы | Кислотный раствор | Щелочной раствор | Солевой раствор |
| Красная лакмусовая бумага | Без изменения цвета | Меняется на синий | Без изменения цвета |
| Синий лакмус | Меняется на красный | Без изменения цвета | Без изменения цвета |
| Метиловый оранжевый | Меняется на красный | Меняется на желтый | Слабый оранжевый цвет |
| Фенолфталеин | Без изменения цвета | Меняется на розовый | Без изменения цвета |
| Сок краснокочанной капусты | Меняется на красный | Меняется на зеленый | Меняется на бледно-фиолетовый |
Универсальный индикатор представляет собой смесь простых индикаторов.Он используется для определения кислотных и основных характеристик веществ, а также указывает на силу кислотных и основных характеристик веществ. Он готовится из комбинации общих индикаторов, содержащихся в зеленом синем растворе или желтой лакмусовой бумаге. В универсальном индикаторе красный или интенсивный красный цвет указывает на кислотную природу, а голубой или интенсивный синий цвет указывает на щелочную природу.
Отличия обычного индикатора от универсального
| Индикатор обыкновенный | Универсальный индикатор |
| Это слабое органическое вещество, состоящее из лишайников. | Это смесь обычных индикаторов. |
| Не указывает на концентрацию кислоты и основания. Пример: лакмусовая бумага. | Указывает на силу кислоты и основания. Пример: бумага PH |
CBSE Class 10 Science, глава 2: Примерное решение NCERT (Часть II)
Здесь вы получаете научную главу 2 класса 10 CBSE, Кислоты, основания и соли: типовые проблемы и решения NCERT (Часть II). Эта часть главы включает решения вопросов № 26–42 из раздела «Образцы задач NCERT для класса 10 по науке»: «Кислоты, основания и соли». Эти вопросы включают только вопросы типа краткого ответа, основанные на различных важных темах главы. Каждый вопрос снабжен подробным объяснением.
Примерное решение NCERT для науки CBSE Class 10 Глава 2: Кислоты, основания и соли (Часть-I)
NCERT Примеры задач — очень хороший ресурс для подготовки критических вопросов, таких как вопросы по навыкам мышления высшего порядка (HOTS). Все эти вопросы очень важны для подготовки к экзамену CBSE Class 10 Science Board 2017-2018, а также к другим конкурсным экзаменам.
Найдите ниже примеры проблем NCERT и их решения для главы 10 по науке, кислоты, основания и соли:
Тип короткого ответа Вопросы:
Вопрос.26 Смешивают равные объемы растворов соляной кислоты и гидроксида натрия одинаковой концентрации и проверяют pH полученного раствора с помощью pH-индикатора. Какой бы цвет получился? (Вы можете использовать цветовую шкалу на рисунке ниже).
(а) Красный
(б) Желтый
(c) Желтовато-зеленый
(d) Синий
Ответ. (в)
Пояснение : Соляная кислота и гидроксид натрия — сильные кислоты и основания соответственно.Таким образом, при смешивании сильной кислоты и сильного основания образуется нейтральная соль и вода с показателем pH 7,
.Вопрос. 27 Что из следующего верно / верно, когда HCl (г) пропускается через воду?
(i) Он не ионизируется в растворе, так как является ковалентным соединением.
(ii) Он ионизируется в растворе.
(iii) Он дает как водород, так и гидроксил-ион в растворе.
(iv) Он образует ион гидроксония в растворе за счет комбинации иона водорода с молекулой воды.
(a) Только (i)
(b) Только (iii)
(c) (ii) и (iv)
(d) (iii) и (iv)
Ответ. (в)
Программа CBSE по науке, класс 10, 2017-2018 гг.
Объяснение : HCl — полярное ковалентное соединение, которое может легко ионизироваться в воде с образованием ионов гидроксония (H 3 O + ) и ионов хлора (Cl —).
Вопрос. 28 Какое из следующих утверждений верно для кислот?
(a) Горький и замена красной лакмусовой бумаги на синюю
(b) Прокиснуть и заменить красную лакмусовую бумажку на синюю
(c) Кислый и замена синей лакмусовой бумаги на красную
(d) Горький и изменение синей лакмусовой бумаги на красную
Ответ. (в)
Пояснение : Кислоты имеют кислый вкус и могут превратить синий лакмусовый раствор в красный.
Вопрос.29 Что из перечисленного присутствует в разбавленном водном растворе соляной кислоты?
(а) H 3 O + + Cl —
(б) H 3 O + + OH —
(в) Класс — + OH —
(d) Объединенный HCl
Ответ. (а)
Объяснение : Сильная кислота, такая как HCl, полностью диссоциирует в своем водном растворе и образует ионы гидроксония с соответствующим анионом.
HCl + H 2 O → H + + Cl — + H 2 O
H 2 O + H + → H 3 O + (ион гидроксония)
Вопрос. 30 Определите правильное представление реакции, происходящей во время процесса хлористой щелочи.
(а) 2NaCl (л) + 2H 2 O (л) → 2NaOH (л) + Cl 2 (г) + H 2 (г)
(б) 2NaCl (л) + 2H 2 O (водн.) → 2NaOH (водн.) + Cl 2 (г) + H 2 (водн.)
(в) 2NaCl (водн.) + 2H 2 O (л) → 2NaOH (водн.) + Cl 2 (водн.) + H 2 (водн.)
(г) 2NaCl (водн.) + 2H 2 O (л) → 2NaOH (водн.) + Cl 2 (г) + H 2 (г)
Ответ.(г)
Пояснение : Хлорно-щелочной процесс — это промышленный процесс, который используется для образования гидроксида натрия путем электролиза водного раствора хлорида натрия. Он образует гидроксид натрия с водородом и газообразным хлором в качестве побочных продуктов.
Вопросы типа краткого ответа
Вопрос. 31 Сопоставьте кислоты, указанные в столбце I, с их правильным источником, указанным в столбце II
Столбец I | Колонна II |
А.Молочная кислота | 1. Помидор |
B. Уксусная кислота | 2. Лимонный |
C. Лимонная кислота | 3. Уксус |
D. Щавелевая кислота | 4. Творог |
Ответ.
Столбец I | Колонна II |
А.Молочная кислота | 4. Творог |
B. Уксусная кислота | 3. Уксус |
C. Лимонная кислота | 2. Лимонный |
D. Щавелевая кислота | 1. Помидор |
Вопрос. 32 Сопоставьте важные химические вещества, указанные в столбце I, с химическими формулами, приведенными в столбце II.
Столбец I | Колонна II |
А. Штукатурка Парижская | 1. Ca (OH) 2 |
Б. Гипс | 2. CaSO 4 .1 / 2H 2 O |
C. Обесцвечивающий порошок | 3.CaSO 4 .2H 2 O |
D. Известь гашеная | 4. CaOCl 2 |
Ответ.
Столбец I | Колонна II |
А. Штукатурка Парижская | 2. CaSO 4 .1 / 2H 2 O |
Б. Гипс | 3. CaSO 4 .2H 2 O |
C. Обесцвечивающий порошок | 4. CaOCl 2 |
D. Известь гашеная | 1. Ca (OH) 2 |
Вопрос. 33 Как будут действовать следующие вещества на лакмусовой бумаге?
Сухой газ HCl, увлажненный газ NH 3 , лимонный сок, газированный безалкогольный напиток, творог, мыльный раствор
Ответ.
- Сухой газ HCl: Не окажет никакого воздействия на лакмусовую бумагу, так как в газообразном состоянии ионизация не происходит.
- Увлажненный газ NH 3 : Он щелочной по природе, поэтому красная лакмусовая бумажка станет синей.
- Лимонный сок — он содержит лимонную кислоту, поэтому он превращает лакмусовую бумажку с синего в красный.
- Газированные безалкогольные напитки : Они содержат углекислоту, которая является слабой кислотой и может превращать синюю лакмусовую бумажку в красную.
- Творог : Он содержит молочную кислоту, поэтому синий лакмус станет красным.
- Мыльный раствор: Они имеют щелочную природу и могут превращать красную лакмусовую бумажку в синюю.
Вопрос. 34 Назовите кислоту, содержащуюся в укусе муравья, и назовите ее химическую формулу. Также дайте общий способ избавиться от дискомфорта, вызванного укусом муравья.
Отв. Кислота, содержащаяся в укусе муравья, представляет собой муравьиную кислоту, которую также называют метановой кислотой.
Химическая формула муравьиной кислоты — HCOOH.
По своей природе он кислый, поэтому можно использовать щелочное соединение, такое как влажная пищевая сода, для нейтрализации его действия и облегчения дискомфорта.
Вопрос. 35 Что происходит при добавлении азотной кислоты в скорлупу яйца?
Ответ.
Карбонат кальция является основным компонентом яичной скорлупы, поэтому, когда мы добавляем азотную кислоту в яичную скорлупу, она вступает в реакцию с карбонатом кальция с образованием растворимого нитрата кальция и воды с бурным выделением углекислого газа.
CaCO 3 (т) + 2HNO 3 (водн.) → Ca (NO 3 ) 2 (водн.) + CO 2 (г) + H 2 O (л)
Вопрос. 36 Студент приготовил растворы (i) кислоты и (ii) основания в двух отдельных стаканах. Она забыла промаркировать растворы, а лакмусовой бумаги в лаборатории нет. Поскольку оба раствора бесцветные, как она будет различать их?
Ответ.
Помимо лакмусовой бумаги, индикаторы pH также могут использоваться для различения кислого и щелочного раствора. Некоторые распространенные индикаторы pH — это метиловый апельсин, фенолфталеин. Они показывают характерное изменение цвета в кислой и щелочной среде. Некоторые природные индикаторы, такие как куркума, сок красной капусты, также могут использоваться для определения кислотного и щелочного поведения растворов.
Индикатор pH | Цвет в кислой среде | Цвет в основном средний |
Фенол красный | Желтый | Красный |
Фенолфталеин | Бесцветный | Розовый |
Метиловый оранжевый | Красный / Розовый | Желтый |
Куркума | Желтый | Красновато-коричневый |
Сок краснокочанной капусты | Красный | Желтый |
Вопрос.37 Как бы вы различили разрыхлитель и стиральную соду при нагревании?
Ответ.
Пищевая сода — это гидрокарбонат натрия (NaHCO 3 ), который при нагревании образует карбонат натрия (Na 2 CO 3 ), воду и углекислый газ.
2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2 ↑
Наличие CO 2 может быть обнаружено с помощью известковой воды, которая становится молочной после реакции с газообразным диоксидом углерода
Сода стиральная — декагидрат карбоната натрия (Na 2 CO 3 .10H 2 O), что означает наличие 10 молекул воды с кристаллами, следовательно, названную водой кристаллизации.
При нагревании стиральной соды она становится безводной, и присутствие кристаллизационной воды можно определить с помощью безводного CuSO 4 , который показывает изменение цвета с белого на синий в зависимости от влажности.
Na 2 CO 3 .10H 2 O → Na 2 CO 3 + 10 H 2 O
Вопрос.38 Соль A, обычно используемая в хлебобулочных изделиях при нагревании, превращается в другую соль B, которая сама используется для уменьшения жесткости воды, и выделяется газ C. Газ C при прохождении через известковую воду делает ее молочной. Найдите A, B и C.
Ответ.
Соль, которая используется в хлебобулочных изделиях, — это пищевая сода или гидрокарбонат натрия. При нагревании пищевой соды образуется карбонат натрия с выделением газообразного диоксида углерода.
2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2 ↑
Карбонат натрия используется для уменьшения жесткости воды.Другой продукт — это углекислый газ, который дает тест на известь, при котором известковая вода становится молочной.
Таким образом, A = NaHCO 3 ; B = Na 2 CO 3 и C = CO 2 .
Вопрос. 39 В одном из промышленных процессов производства гидроксида натрия в качестве побочного продукта образуется газ X. Газ X реагирует с известковой водой с образованием соединения Y, которое используется в качестве отбеливающего агента в химической промышленности. Определите X и Y, чтобы получить химическое уравнение участвующих реакций.
Ответ.
Гидроксид натрия получают электролизом водного раствора хлорида натрия, который образует водород и газообразный хлор в качестве побочных продуктов. Реакция газообразного хлора с известковой водой дает обесцвечивающий порошок (CaOCl 2 ). Таким образом, X = Cl 2 газ и Y = оксихлорид кальция (CaOCl 2 )
.Уравнение для получения гидроксида натрия (NaOH) и обесцвечивающего порошка (CaOCl 2 ) приведено ниже:
(i) 2NaCl (водн.) + 2H 2 O (l) → 2NaOH (водн.) + Cl 2 (г) + H 2 (г)
(ii) Cl 2 (г) + Ca (OH) 2 → CaOCl 2 + H 2 O
Вопрос.40 Заполните недостающие данные в данной таблице.
Название соли | Формула | Соль, полученная из | |
База | Кислота | ||
Хлорид аммония | NH 4 Класс | NH 4 OH | – |
Сульфат меди | – | – | H 2 SO 4 |
Хлорид натрия | NaCl | NaOH | – |
Нитрат магния | мг (НЕТ 3 ) 2 | – | HNO 3 |
Сульфат калия | К 2 SO 4 | – | – |
Нитрат кальция | Ca (НЕТ 3 ) 2 | Са (ОН) 2 | – |
Ответ.
Название соли | Формула | Соль, полученная из | |
База | Кислота | ||
Хлорид аммония | NH 4 Класс | NH 4 OH | HCl |
Сульфат меди | CuSO 4 | Cu (OH) 2 | H 2 SO 4 |
Хлорид натрия | NaCl | NaOH | HCl |
Нитрат магния | мг (нет 3 ) 2 | мг (OH) 2 | HNO 3 |
Сульфат калия | К 2 SO 4 | КОН | H 2 SO 4 |
Нитрат кальция | Ca (НЕТ 3 ) 2 | Са (ОН) 2 | HNO 3 |
Вопрос.41 Какие бывают сильные и слабые кислоты? В следующем списке кислот отделите сильные кислоты от слабых.
- Кислота соляная
- Лимонная кислота
- Уксусная кислота
- Азотная кислота
- Муравьиная кислота
- Серная кислота
Ответ.
Сильные кислоты полностью ионизируются в водном растворе, поэтому такие кислоты содержат в своих растворах высокую концентрацию ионов гидроксония.Азотная кислота, серная кислота — хорошие примеры сильных кислот.
В отличие от сильных кислот, слабые кислоты не могут полностью ионизироваться, поэтому раствор слабой кислоты содержит несколько неионизированных молекул с ее ионами. Органические кислоты, такие как лимонная кислота, уксусная кислота, являются слабыми кислотами.
В данных кислотах;
- Соляная кислота — сильная кислота
- Лимонная кислота — слабая кислота
- Уксусная кислота-слабая кислота
- Азотная кислота — сильная кислота
- Муравьиная кислота — слабая кислота
- Серная кислота — сильная кислота
Вопрос.42 Когда металлический цинк обрабатывают разбавленным раствором сильной кислоты, выделяется газ, который используется при гидрировании нефти. Назовите выделившийся газ. Напишите химическое уравнение вовлеченной реакции, а также напишите тест для обнаружения образовавшегося газа.
Ответ.
Цинк — это металлический элемент. Металлы реагируют с разбавленными растворами сильных кислот с образованием соответствующих солей и газообразного водорода.
При реакции цинка с разбавленным раствором сильной кислоты, такой как HCl, образуется хлорид цинка (ZnCl 2 ) и выделяется газообразный водород.
Zn + 2HCl → ZnCl 2 + H 2 ↑
Водородный газ используется при гидрировании растительного масла. Это можно проверить с помощью горящей занозы, поскольку она горит с треском.
Решения NCERT для науки CBSE Class 10
CBSE Class 10 NCERT Учебники и решения NCERT
Решения NCERT для математики класса 10 CBSE
.Кислотно-основной эксперимент с изменением цвета
Каждый ребенок должен иметь возможность хотя бы раз в детстве сыграть в сумасшедшего ученого . Chemistry с его смешиванием зелий и неожиданными результатами — идеальный способ познакомить детей science с наукой. Этот эксперимент особенно привлекателен, потому что дети могут смешивать вещества и растворы вместе и, вероятно, будут удивлены изменениями цвета , которые вызывает это смешивание.
Научные эксперименты
Кислотный / основной фон
По своей природе почти каждая жидкость имеет либо кислотную , либо основную . Кислоты — это молекулы, которые выделяют ионов водорода (H +) при растворении в воде. Основания выделяют гидроксид-иона (ОН-) . Шкала pH — это способ измерения и точного определения того, насколько кислотный или основной раствор. Жидкости с pH от 0 до 7 считаются кислыми, а жидкости с pH от 7 до 14 считаются основными.
Жидкости, такие как дистиллированная вода, с pH 7, считаются нейтральными . Они не являются ни кислотными, ни основными, поскольку содержат равную концентрацию ионов водорода и гидроксид-ионов. Если у жидкости pH около 7, она считается либо слабой кислотой , либо слабым основанием , в зависимости от того, на какую сторону шкалы она падает. Напротив, кислота с pH около 0 очень сильно кислая, а основание с pH около 14 — очень сильно щелочное. Эти вещества опасны и могут вызвать коррозию и ожоги.
Итак, как ученые узнают, является ли вещество кислотой или основанием ? Один из способов — использовать индикатор , который меняет цвет в зависимости от pH вещества, с которым он контактирует. Наиболее широко известен индикатор лакмусовой бумаги , который окрашивается в красный цвет в кислых растворах и в синий в щелочных. Однако легко сделать самому . Один из часто используемых естественных индикаторов — сок красной капусты . Другой — куркума , специя, содержащаяся в индийской пище, карри.


Чтобы быстро и легко провести этот эксперимент, я использовал индикатор куркумы и медицинский спирт. Этот раствор меняет цвет от желто-оранжевого до темно-красного при контакте с основаниями. Хотя ребенок не сможет отличить кислоты от нейтральных веществ, если он добавит какое-либо вещество к индикатору куркумы, и он станет красным, он будет знать, что это вещество определенно является основой.


Кислотно-основные экспериментальные материалы по изменению цвета:
- куркума (мы использовали 1 чайную ложку)
- изопропиловый (медицинский) спирт (мы использовали 1 стакан)
- мерный стакан или стакан
- 1/2 или 1 чайная ложка ложка
- ложка для перемешивания
- пустые стаканы или прозрачные пластиковые контейнеры для наблюдения за реакциями
- малярная лента и маркер для маркировки контейнеров


Вам также понадобятся вещества для тестирования.Мы использовали:
- дистиллированная вода
- мыло
- стиральный порошок
- пищевая сода
- уксус
- лимонад
- бура
- кислородный отбеливатель
Однако возможности бесконечны. Вот еще несколько предложений:
- апельсиновый сок
- томатный сок
- газировка
- молоко
- шампунь
- кондиционер
- гель для душа
- мыло для мытья посуды
- кусковое мыло
- соленая вода
- хлорсодержащий отбеливатель
- пузырьки
Инструкции по эксперименту с изменением цвета кислотно-щелочного раствора
Во-первых, вам необходимо приготовить индикаторный раствор.Смешайте 1 стакан медицинского спирта с 1 чайной ложкой куркумы. (Вы можете вдвое или в два раза больше ингредиентов, если хотите получить более или менее индикатор.)


Затем промаркируйте стеклянные или пластиковые контейнеры каждым из растворов, которые вы хотите протестировать.
Разложите индикаторный раствор между тестовыми чашками. Поскольку у нас было 8 стаканов, мы налили примерно 1 унцию раствора в каждую из наших чашек. (Точное количество не имеет значения.)


Наконец, позвольте вашему ребенку налить небольшое количество каждого тестируемого вещества в соответствующий контейнер с этикеткой.Если индикаторный раствор начинает становиться темно-красным, ребенок будет знать, что тестируемое вещество является основой. Если раствор ничего не делает, они будут знать, что это кислота или нейтрален.


Для дополнительного удовольствия ваши дети могут добавить немного кислоты (например, уксуса) в растворы, которые, по их мнению, являются основными. Как по волшебству, они вернутся к своему первоначальному цвету!


Когда все будет готово, у некоторых детей возникнет непреодолимое желание смешать все свои «зелья».Я говорю: пусть! Что может быть лучше для развития научного любопытства?


(Если они у вас есть, пипетки — отличный способ гарантировать, что последующая «наука» не попадет на столешницы и другие поверхности. С моими детьми наливание часто бывает беспорядочным. Научиться пользоваться пипеткой — это отличная активность по контролю мелкой моторики.) Развлекайтесь, поощряя вашего юного химика!

 .
.
Leave A Comment