Степень окисления азота (N), формула и примеры
Общие сведения о степени окисления азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Степень окисления азота в соединениях
Азот образует двухатомные молекулы состава N2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Для азота характерен целый спектр степеней окисления, среди которых есть как положительные, так и отрицательные.
Степень окисления (-3) азот проявляет в соединениях под названием нитриды (Mg+23N-32, B+3N-3), самым известным из которых является аммиак (N-3H+13).
Степень окисления (-2) азот проявляет в соединениях перикисного типа – пернитридах, простейшим представителем которых является гидразин (диамид/ пернитрид водорода) – N-22H2.
В соединении под названием гидроксиламин – N-1H2OH–азот проявляет степень окисления (-1).
Наиболее устойчивые положительные степени окисления азота – это (+3) и (+5). Первую из них он проявляет во фториде (N
Азот также проявляет степени окисления (+1) – N+12O, (+2) – N+2
Примеры решения задач
Степень окисления азота — учимся разбираться
Азот – едва ли не самый распространенный химический элемент во всей Солнечной Системе. Если быть конкретнее, то азот занимает 4 место по распространенности. Азот в природе – инертный газ.

Этот газ не имеет ни цвета, ни запаха, его очень трудно растворить в воде. Однако соли-нитраты имеют свойство очень хорошо реагировать с водой. Азот имеет малую плотность.
Азот – удивительный элемент. Есть предположение, что свое название он получил из древнегреческого языка, что в переводе с него значит «безжизненный, испорченный». Отчего же такое негативное отношение к азоту? Ведь нам известно, что он входит в состав белков, а дыхание без него практически невозможно. Азот играет важную роль в природе. Но в атмосфере этот газ инертен. Если его взять таким, какой он есть в первозданном виде, то возможно множество побочных эффектов. Пострадавший может даже умереть от удушья. Ведь азот оттого и называется безжизненным, что не поддерживает ни горения, ни дыхания.

При обычных условиях такой газ реагирует только с литием, образовывая такое соединение, как нитрид лития Li3N. Как мы видим, степень окисления азота в таком соединении равна -3. С остальными металлами и веществами азот, конечно же, реагирует тоже, однако лишь при нагревании или при использовании различных катализаторов. К слову говоря, -3 – низшая степень окисления азота, так как только 3 электрона нужны для полного заполнения внешнего энергетического уровня.
Этот показатель имеет разнообразные значения. Каждая степень окисления азота имеет свое соединение. Такие соединения лучше просто запомнить.
Итак, степень окисления -3 может быть у нитридов. Степень окисления азота в аммиаке также равна -3, как бы это ни звучало парадоксально. Аммиак представляет собой бесцветный газ с очень резким запахом. Вспомните нашатырный спирт. В его состав также входит аммиак Nh4. Выпускают даже лекарственные препараты с содержанием аммиака. В основном они показаны при обмороках, головокружениях, сильных алкогольных опьянениях. Резкий запах быстро приводит в чувства в пострадавшего. Еще бы, ведь он готов сделать что угодно, лишь бы от него убрали эту «вонючку».

Редко встречаются такие степени окисления азота, как -1 и -2. Первая встречается в так называемых пернитридах, среди которых особенно стоит отметить N2h3. Последняя степень окисления встречается в соединении Nh3OH. Такое сложное вещество представляет собой очень слабое неустойчивое основание. Применяется в основном в органическом синтезе.
Перейдем к высшим степеням окисления азота, коих тоже очень даже немало. Степень окисления азота +1 встречается в таком соединении, как веселящий газ (N2O). При малом количестве такого газа практически не наблюдается никаких побочных воздействий. Нередко он используется в малых дозах для наркоза. Однако если время вдыхания этого газа является достаточно длительным, то возможна смерть от удушения.
Степень окисления +2 встречается в соединении NO. Степень окисления +3 – в оксиде N2O3. Степень окисления +4 – в оксиде NO2. Такой газ имеет красно-бурый оттенок и острый запах. Является кислотным оксидом.
+5 – высшая степень окисления у азота. Встречается в азотной кислоте и во всех солях-нитратах.
Степени окисления азота в аммонии :: SYL.ru
Существуют химические элементы, проявляющие разные степени окисления, что позволяет образовывать в ходе химических реакций большое количество соединений с определенными свойствами. Зная электронное строение атома, можно предположить, какие вещества будут образовываться.
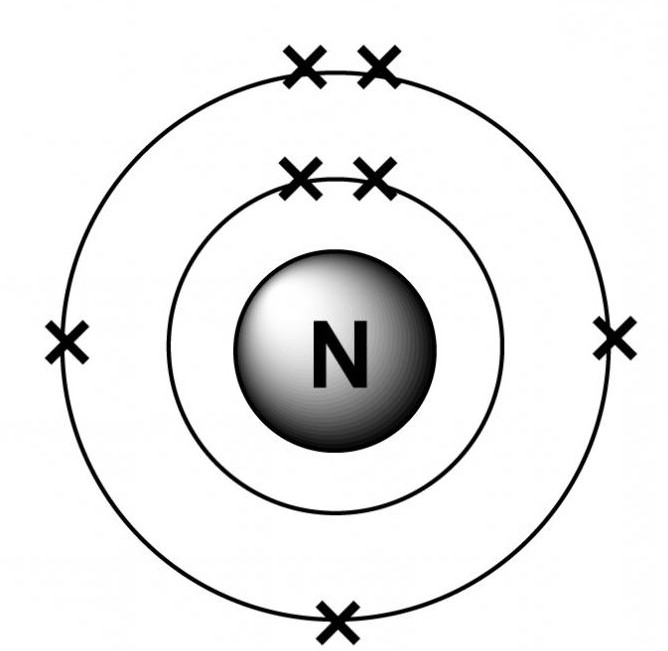
Степени окисления азота могут варьировать от -3 до +5, что указывает на многообразие соединений на его основе.
Характеристика элемента
Азот относится к химическим элементам, расположенным в 15 группе, во втором периоде в периодической системе Менделеева Д. И. Ему присвоены порядковый номер 7 и сокращенное буквенное обозначение N. В нормальных условиях сравнительно инертный элемент, для проведения реакций необходимы специальные условия.
В природе встречается в виде двухатомного бесцветного газа атмосферного воздуха с объемной долей более 75%. Содержится в составе белковых молекул, кислот нуклеиновых и азотсодержащих веществ неорганического происхождения.
Структура атома
Чтобы определить степень окисления азота в соединениях, необходимо знать его ядерную структуру и изучить электронные оболочки.
Природный элемент представлен двумя устойчивыми изотопами, с числом их массы 14 или 15. В первом ядре содержится 7 нейтроновых и 7 протоновых частиц, а во втором − на 1 нейтроновую частицу больше.
Существуют искусственные разновидности его атома с массой 12-13 и 16-17, обладающие нестабильными ядрами.
При изучении электронной структуры атомарного азота видно, что имеется две электронные оболочки (внутренняя и внешняя). На 1s-орбитали содержится одна пара электронов.
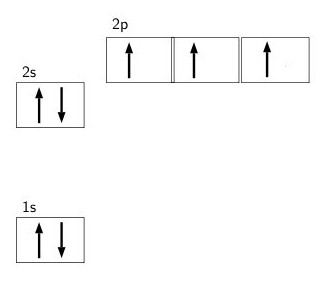
На второй внешней оболочке присутствует всего пять отрицательно заряженных частиц: две на 2s-подуровне и три на 2p-орбитале. Валентный энергетический уровень не имеет свободных ячеек, что указывает на невозможность разделения его электронной пары. Орбиталь 2р считается заполненной электронами только наполовину, что позволяет присоединить 3 отрицательно заряженные частицы. В таком случае степень окисления азота равна -3.
Учитывая строение орбиталей, можно сделать вывод, что данный элемент с координационным числом 4 максимально связывается только с четырьмя другими атомами. Для образования трех связей используется обменный механизм, еще одна формируется донорно-акцепторным способом.
Степени окисления азота в разных соединениях
Максимальное количество отрицательных частиц, которое способен присоединить его атом, равняется 3. В таком случае проявляется степень его окисления равная -3, присущая соединениям типа NH3 или аммиаку, NH4+ или аммонию и нитридам Me3N2. Последние вещества формируются при повышении температуры путем взаимодействия азота с атомами металлов.
Наибольшее количество отрицательно заряженных частиц, которое способен отдать элемент, приравнивается к 5.
Два атома азота способны соединяться между собой с образованием устойчивых соединений со степенью окисления -2. Такая связь наблюдается в N2H4 или гидразинах, в азидах различных металлов или MeN3. Атом азота присоединяет на свободные орбитали 2 электрона.
Существует степень окисления -1, когда данный элемент получает только 1 отрицательную частицу. Например, в NH2OH или гидроксиламине он заряжен отрицательно.
Бывают положительного знака степени окисления азота, когда с внешнего энергетического слоя забираются электронные частицы. Варьируют они от +1 до +5.
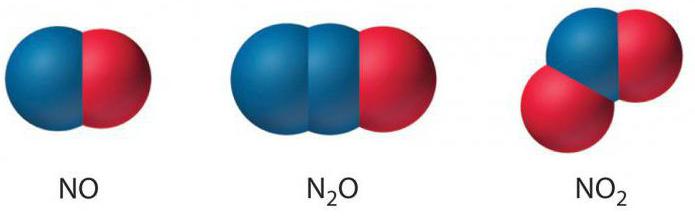
Заряд 1+ имеется у азота в N2O (одновалентном оксиде) и в гипонитрите натрия с формулой Na2N2O2.
В NO (двухвалентном оксиде) элемент отдает два электрона и заряжается положительно (+2).
Существует степень окисления азота 3 (в соединении NaNO2 или нитриде и еще в трехвалентном оксиде). В таком случае отщепляется 3 электрона.
Заряд +4 бывает в оксиде с валентностью IV или его димере (N2O4).
Положительный знак степени окисления (+5) проявляется в N2O5 или в пятивалентном оксиде, в азотной кислоте и ее производных солях.
Соединения из азота с водородом
Природные вещества на основе двух вышеуказанных элементов напоминают органические углеводороды. Только азотоводороды теряют свою устойчивость при увеличении количества атомарного азота.
К наиболее значимым водородным соединениям относят молекулы аммиака, гидразина и азотистоводородной кислоты. Их получают путем взаимодействия водорода с азотом, а в последнем веществе присутствует еще кислород.
Что такое аммиак
Его еще называют нитридом водорода, а его химическая формула обозначается как NH3 с массой 17. В условиях с нормальной температурой и давлением аммиак имеет форму бесцветного газа с резким нашатырным запахом. По плотности он в 2 раза реже воздуха, легко растворяется в водной среде за счет полярного строения его молекулы. Относится к малоопасным веществам.
В промышленных объемах аммиак получают с помощью каталитического синтеза из водородных и азотных молекул. Существуют лабораторные методы получения из аммонийных солей и натрия нитрита.
Строение аммиака
В составе молекулы пирамидальной присутствует один азот и 3 атома водорода. Расположены они по отношению друг к другу под углом 107 градусов. В молекуле, имеющей форму тетраэдра, азот расположен по центру. За счет трех неспаренных p-электронов он соединяется полярными связями ковалентной природы с 3 атомарными водородами, у которых имеются по 1 s-электрону. Так образуется аммиачная молекула. В данном случае азот проявляет степень окисления -3.
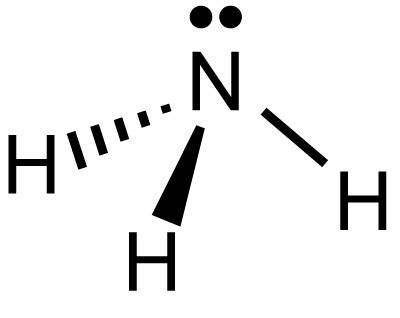
У данного элемента находится еще неподеленная пара электронов на внешнем уровне, которая создает связь ковалентную с ионом водорода, имеющим положительный заряд. Один элемент является донором отрицательно заряженных частиц, а другой акцептором. Так образуется аммонийный ион NH4+.
Что такое аммоний
Его относят к положительно заряженным полиатомным ионам или катионам. Аммоний еще причисляют к химическим веществам, которые не могут существовать в форме молекулы. Он состоит из аммиака и водорода.
Аммоний с положительным зарядом в присутствии различных анионов с отрицательным знаком способен образовывать аммонийные соли, в которых ведет себя подобно металлам с валентностью I. Также при его участии синтезируются аммониевые соединения.
Многие соли аммония существуют в виде кристаллических бесцветных веществ, которые хорошо растворяются водой. Если соединения иона NH4+ образованы летучими кислотами, то в условиях нагревания происходит их разложение с выделением газообразных веществ. Последующее их охлаждение приводит к обратимому процессу.
Стабильность таких солей зависит от силы кислот, из которых они образованы. Устойчивые соединения аммония соответствуют сильному кислотному остатку. Например, стабильный аммония хлорид производится из соляной кислоты. При температуре до 25 градусов такая соль не разлагается, что нельзя сказать о карбонате аммония. Последнее соединение часто используется в кулинарии для подъема теста, заменяя пищевую соду.
Кондитеры карбонат аммония называют просто аммонием. Такую соль применяют пивовары для улучшения брожения пивных дрожжей.
Качественной реакцией для обнаружения ионов аммония является действие гидроксидов щелочных металлов на его соединения. В присутствие NH4+ происходит высвобождение аммиака.
Химическая структура аммония
Конфигурация его иона напоминает правильный тетраэдр, по центру которого находится азот. Атомы водорода расположены по вершинам фигуры. Чтобы рассчитать степень окисления азота в аммонии, нужно помнить, что общий заряд катиона равен +1, а у каждого иона водорода отсутствует по одному электрону, а их всего 4. Суммарный водородный потенциал составляет +4. Если из заряда катиона вычесть заряд всех ионов водорода, то получим: +1 — (+4) = -3. Значит, азот имеет степень окисления -3. В данном случае он присоединяет три электрона.
Что такое нитриды
Азот способен соединяться с более электроположительными атомами металлической и неметаллической природы. В результате образуются соединения схожие с гидридами и карбидами. Такие вещества азотсодержащие называют нитриды. Между металлом и азотным атомом в соединениях выделяют ковалентную, ионную и промежуточную связи. Именно такая характеристика лежит в основе их классификации.
К нитридам ковалентным относят соединения, в химической связи которых электроны не переходят от атомарного азота, а образуют вместе с заряженными отрицательно частицами других атомов общее электронное облако.
Примером таких веществ являются водородные нитриды, типа аммиачных и гидразиновых молекул, а также азотные галогениды, к которым относят трихлориды, трибромиды и трифториды. У них общая электронная пара одинаково принадлежит двум атомам.
К нитридам ионным относят соединения с химической связью, образованной переходом электронов от элемента металла на свободные уровни у азота. В молекулах таких веществ наблюдается полярность. Нитриды имеют степень окисления азота 3-. Соответственно, общий заряд металла будет 3+.
К таким соединениям относят нитриды магния, лития, цинка или меди, за исключением щелочных металлов. Они обладают высокой температурой плавления.
К нитридам с промежуточной связью относятся вещества, у которых распределены равномерно атомы металлов и азота и отсутствует четкое смещение электронного облака. К таким инертным соединениям принадлежат нитриды железа, молибдена, марганца и вольфрама .
Описание оксида трехвалентного азота
Его еще называют ангидридом, полученным из кислоты азотистой, имеющей формулу HNO2. Учитывая степени окисления азота (3+) и кислорода (2-) в триоксиде, получается соотношение атомов элементов 2 к 3 или N2O3.
Жидкая и газообразная форма ангидрида — это весьма неустойчивые соединения, они легко распадаются на 2 разных оксида с валентностью IV и II.
ЕГЭ. Правила составления окислительно-восстановительных реакций (азот)
3. Химические свойства соединений азота с точки зрения изменения степеней окисления
Правило 3.1. Аммиак в реакциях, как правило, окисляется до азота:
4NH3 + 3O2 → 2N2 + 6H2O (t)
8NH3 + 3Cl2 → N2 + 6NH4Cl (в атмосфере хлора)
2NH3 + 3CuO → 3Cu + N2 + 6H2O
2NH4Cl + 4CuO → 3Cu + N2 + CuCl2 + 4H2O
2NH3 + 3H2O2
2NH3 + 2K2FeO4 + 5H2SO4 → Fe2(SO4)3 + N2 + 2K2SO4 + 8H2O
8NH3 + 3KBrO4 → 3KBr + 4N2 + 12H2O
2NH3 + 3KClO → 3KCl + N2 + 3H2O
4NH3 + 3Ca(ClO)2 → 3CaCl2 + 2N2 + 6H2O
2NH3 + 2NaMnO4 → 2MnO2 + N2 + 2NaOH + 2H2
2NH3 + 6NaMnO4 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
2NH3×H2O + 2KMnO4 → 2MnO2 + N2 + 2KOH + 4H2O
Исключения:
Чтобы легко запомнить следующие реакции, нужно помнить, что нитрат аммония разлагается при нагревании на оксид азота (I) и воду
(NH4NO3 → N2O + 2H2O):
NH4Cl + KNO3 → N2O + KCl + H2O
А также нужно помнить термическое разложение нитрита аммония на азот и воду (NH
NH4Cl + NaNO2 → N2 + NaCl + 2H2O
Реакции термического разложения нитрата и нитрита аммония также часто встречаются на экзамене.
В присутствии катализатора аммиак окисляется кислородом до оксида азота (II), а не простого вещества:
4NH3 + 5O2 → 2NO + 6H2O (t, Pt)
Правило 3.2. Нитриды (и для аналогии фосфиды) активных металлов легко реагируют с водой и растворами кислот:
1. Реакции с водой:
Mg3N2 + H2O → 3Mg(OH)
Na3N + H2O → NaOH + NH3
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3
2. В реакциях с кислотами образуются соли (в случае нитридов) или фосфин (в случае фосфидов):
Ca3N2 + HCl → 3CaCl2 + 2NH4Cl
Zn3P2 + 6HCl → 3ZnCl2 + 2PH3
Азотная кислота
Правило 3.3. Чем более разбавленной является кислота, тем более сильным окислителем она является.
Изменение степени окисления азота в реакциях с сильным восстановителем:
N+5 + 5e → N0 (N2) разбавленная HNO3
N+5 + 4e → N+1 (N2O) разбавленная HNO3, концентрированная
Изменение степени окисления азота в реакциях со слабым восстановителем:
N+5 + 3e → N+2 (NO) разбавленная HNO3
N+5 + 1e → N
Восстановители:
Сильные:
- Металлы от Li до Al
Слабые:
- Металлы, начиная с Fe
- Неметаллы
- Соли (если можем окислить)
- Оксиды (если можем окислить)
- HI и йодиды, H2S и сульфиды
10HNO3(оч. разб.) + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3(разб.) + 4Mg → 4Mg(NO3)2 +
8HNO3(разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
4HNO3(конц.) + 3Cu → 3Cu(NO3)2 + 2NO2 + 2H2O
С неметаллами образуются соответствующие кислоты:
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t) (из галогенов реакция идет только с йодом)
4HNO3(конц.) + C → CO2 + 4NO2 + 2H2O
5HNO3(конц.) + P → H
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
Возможные степени окисления элементовПеред тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ. Элементы с постоянными степенями окисления в сложных соединениях:
Элементы с переменными степенями окисления:1. Водород
2. Кислород
3. Сера
|
Электроотрицательность. Степень окисления и валентность.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:

График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО | Значение постоянной СО этого элемента |
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода —  |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент | Номер группы | Высшая степень окисления |
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:

Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:

Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:

Т.е. мы получаем два независимых уравнения:

Решая которые, находим x и y:

Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов 
2) неподеленных электронных пар на орбиталях валентных уровней 
3) пустых электронных орбиталей валентного уровня 
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:

Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:

Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:

Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных (  ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:

Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:

Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор(  ) предоставляет ее другому атому с вакантной (
) предоставляет ее другому атому с вакантной (  ) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:

Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:

Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:

Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:

Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:

Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:

У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:

В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:

В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
NO2, степень окисления азота и кислорода в нем
Общие сведения об оксиде азота (IV) и степени окисления в NO2
Плотность – 2,0527 г/л (н.у.). Брутто-формула – NO2. Молярная масса – 46,01 г/моль. Электронное и пространственное строение молекулы диоксида азота представлено на рис. 1.
Хорошо растворяется в холодной воде (насыщенный раствор ярко-зеленого цвета), полностью реагируя с ней.
Рис. 1. Строение молекулы оксида азота (IV): а) пространственное с указанием валентного угла и длины связи; б) электронное.
В ОВР проявляет свойства очень сильного окислителя. Вызывает коррозию металлов.
NO2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав диоксида азота, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2×(-2) = 0;
x — 4 = 0;
x = +4.
Значит степень окисления азота в оксиде азота (IV) равна (+4):
N+4O-22.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Степени окисления азота — Chemistry LibreTexts
Сравнивая химию аминов со спиртами и простыми эфирами, мы обнаруживаем много классов родственных соединений, в которых азот принимает более высокие степени окисления, в отличие от ограниченных степеней окисления кислорода.
В этом контексте имейте в виду, что степень окисления элементарного кислорода (O 2 ) и азота (N 2 ) определяется как ноль. Наиболее распространенное состояние ковалентно связанного кислорода — -2.Это касается воды, спиртов, простых эфиров и карбонильных соединений. Единственная общая более высокая степень окисления (-1) находится в пероксидах, R – O – O – R, где R = водород, алкил, арил или ацил. Из-за низкой энергии ковалентной связи пероксидной связи ( около 35 ккал / моль) эти соединения широко используются в качестве инициаторов свободных радикалов, а иногда и опасно взрывоопасны по своей реакционной способности (например, трипероксид триацетона, используемый террористами-бомбардировщиками). С другой стороны, соединения азота имеют степень окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.В следующей таблице перечислены некоторые из известных органических соединений азота, имеющих разные степени окисления этого элемента. Были описаны некоторые из этих классов соединений; другие будут обсуждаться позже.
Состояние окисления | _ 3 | _ 2 | _ 1 | 0 | +1 | |
|---|---|---|---|---|---|---|
| Формулы (названия) | R 3 N (амины) (аммоний) (имины ) (нитрилы) | R 2 N – NR 2 (гидразины) (гидразоны) | RN = (азо цпд.) (гидроксиламин) (оксид амина) | N 2 (азот) (диазоний) | R – N = O (нитрозо) | R-NO 2 (нитро) (сложный эфир нитрита) |
Оксиды аминов и Cope Elimination
Оксиды аминов получают окислением 3º-аминов или пиридинов перекисью водорода или надкислотами (например.{(-)} + ZOH \]
Оксиды аминов являются относительно слабыми основаниями, pK a ок. 4,5 по сравнению с исходным амином. Координатная ковалентная функция N – O полярна, кислород является мощным акцептором водородных связей. Если один из алкильных заместителей состоит из длинной цепи, такой как C 12 H 25 , образующийся оксид амина является амфотерным поверхностно-активным веществом и находит применение в шампунях и других мягких чистящих средствах.
Реакция элиминирования, дополняющая элиминирование по Хофманну, происходит при нагревании оксидов 3º-амина при температуре от 150 до 200ºC.Эта реакция известна как Устранение Копа. Обычно это осуществляется путем добавления по каплям раствора оксида амина в нагретую трубку, заполненную маленькими стеклянными шариками. Поток газообразного азота, протекающий через колонну, переносит летучие алкеновые продукты в охлаждаемый ресивер. Азотсодержащий продукт представляет собой гидроксиламин. В отличие от отщепления Хофмана, эта реакция протекает путем согласованной циклической реорганизации, как показано на следующей диаграмме. Для такого механизма фрагменты бета-водорода и оксида амина обязательно имеют син-отношение.
Удаление диастереомерных аминооксидов, как показано в примерах № 2 и 3 выше, обеспечивает доказательство син-взаимосвязи бета-водородных и аминоксидных групп. Эти примеры также демонстрируют сильную региоселективность в пользу более стабильной двойной связи.
Пиролитическое син-отщепление
Оксиды аминов — не единственные функции, которые подвергаются мономолекулярному син-отщеплению при нагревании. Чтобы увидеть примеры других случаев, щелкните здесь
Нитроксидные радикалы
2º-амины, не содержащие α-атомы водорода, окисляются пероксидами (ZOOH) до нитроксильных радикалов удивительной стабильности.В примере, показанном в верхней части следующей диаграммы, следует отметить, что резонансная делокализация неспаренного электрона способствует образованию полярной связи N – O. Соединение R = H, известное под аббревиатурой TEMPO, представляет собой относительно стабильное твердое вещество красного цвета. Было приготовлено много других нитроксидов, три из которых показаны в правом нижнем углу. Если один или несколько атомов водорода присутствуют на соседнем углероде, нитроксид разлагается на смеси, включающие оксиды амина и нитроны, как показано в нижнем левом углу. Нитроксиды окисляются галогенами до нестабильных катионов оксаммония.
Спин неспаренного электрона нитроксила может быть изучен с помощью метода, называемого электронным парамагнитным резонансом (epr или esr). Эксперименты такого рода показали, что спектры эпр чувствительны к заместителям радикала, а также к его ближайшему окружению. Это привело к стратегии спинового мечения для исследования конформационных структур макромолекул, подобных белкам. Таким образом, сайт-направленное спиновое мечение (SDSL) стало ценным методом для картирования элементов вторичной структуры на уровне основной цепи в широком спектре белков, включая те, которые не поддаются структурной характеристике с использованием классических структурных методов. такие как ядерный магнитный резонанс и рентгеновская кристаллография.
Фосфорные аналоги аминов
Фосфор находится ниже азота в периодической таблице. Чтобы увидеть примеры фосфорорганических соединений и их химический состав, щелкните здесь
.степеней окисления азота — Скачать PDF бесплатно
Номенклатура ионных соединений
 Номенклатура ионных соединений Ионные соединения состоят из ионов. Ион — это атом или молекула с электрическим зарядом. Одноатомные ионы образуются из отдельных атомов, которые получили или потеряли электроны.
Номенклатура ионных соединений Ионные соединения состоят из ионов. Ион — это атом или молекула с электрическим зарядом. Одноатомные ионы образуются из отдельных атомов, которые получили или потеряли электроны.
Название ионных соединений
 Обозначение ионных соединений I. Обозначение ионов A. Катионы (+ ионы) 1. Название элемента, за которым следует «ион» (когда в Группе IA, IIA, Al 3+, Ga 3+, Zn 2+, Cd 2+, Ag +, Ni 2+).Ион натрия Na +, ион калия K +, алюминий Al 3+
Обозначение ионных соединений I. Обозначение ионов A. Катионы (+ ионы) 1. Название элемента, за которым следует «ион» (когда в Группе IA, IIA, Al 3+, Ga 3+, Zn 2+, Cd 2+, Ag +, Ni 2+).Ион натрия Na +, ион калия K +, алюминий Al 3+
ХИМИЧЕСКИЕ НАЗВАНИЯ И ФОРМУЛЫ
 9 ХИМИЧЕСКИЕ НАЗВАНИЯ И ФОРМУЛЫ РАЗДЕЛ 9.1 НАЗВАНИЕ ИОНОВ (страницы 253 258) В этом разделе объясняется использование периодической таблицы для определения заряда иона. Он также определяет многоатомный ион и дает
9 ХИМИЧЕСКИЕ НАЗВАНИЯ И ФОРМУЛЫ РАЗДЕЛ 9.1 НАЗВАНИЕ ИОНОВ (страницы 253 258) В этом разделе объясняется использование периодической таблицы для определения заряда иона. Он также определяет многоатомный ион и дает
ГЛАВА 5: МОЛЕКУЛЫ И СОЕДИНЕНИЯ
 ГЛАВА 5: МОЛЕКУЛЫ И СОЕДИНЕНИЯ Проблемы: 1-6, 9-13, 16, 20, 31-40, 43-64, 65 (a, b, c, e), 66 (ad, f), 69 (ad, е), 70 (к.э.), 71-78, 81-82, 87-96 Соединение будет проявлять те же свойства (например,грамм. плавка
ГЛАВА 5: МОЛЕКУЛЫ И СОЕДИНЕНИЯ Проблемы: 1-6, 9-13, 16, 20, 31-40, 43-64, 65 (a, b, c, e), 66 (ad, f), 69 (ad, е), 70 (к.э.), 71-78, 81-82, 87-96 Соединение будет проявлять те же свойства (например,грамм. плавка
ХИМИЧЕСКАЯ НОМЕНКЛАТУРА
 ХИМИЧЕСКАЯ НОМЕНКЛАТУРА Химическая номенклатура Процесс присвоения однозначных химических формул или химических названий элементам и соединениям Введение Химия — это исследование материи (элементов и соединений)
ХИМИЧЕСКАЯ НОМЕНКЛАТУРА Химическая номенклатура Процесс присвоения однозначных химических формул или химических названий элементам и соединениям Введение Химия — это исследование материи (элементов и соединений)
Глава 3 Химические соединения
 Глава 3 Химические соединения 3.1 (а) формульная единица; (б) сильный электролит; (c) молекулярное соединение; (d) кислота; (д) неэлектролит; (е) оксоанион 3.2 (а) молекулярная формула; (б) слабый электролит; (в) ионный
Глава 3 Химические соединения 3.1 (а) формульная единица; (б) сильный электролит; (c) молекулярное соединение; (d) кислота; (д) неэлектролит; (е) оксоанион 3.2 (а) молекулярная формула; (б) слабый электролит; (в) ионный
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ
 ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ Периодическая таблица: расположение элементов в горизонтальных рядах (периоды) и вертикальных столбцах (группах) демонстрирует периодическое повторение свойств Первая периодическая таблица: обнаружено
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ Периодическая таблица: расположение элементов в горизонтальных рядах (периоды) и вертикальных столбцах (группах) демонстрирует периодическое повторение свойств Первая периодическая таблица: обнаружено
Глава 4 Соединения и их связи
 Глава 4 Соединения и их связи 4.Правило 1 октета и правило октета ионов Октет состоит из 8 валентных электронов. связано со стабильностью благородных газов. Он стабилен с 2 валентными электронами (дуэт).
Глава 4 Соединения и их связи 4.Правило 1 октета и правило октета ионов Октет состоит из 8 валентных электронов. связано со стабильностью благородных газов. Он стабилен с 2 валентными электронами (дуэт).
Водные ионы и реакции
 Водные ионы и реакции (ионы, кислоты и основания) Demo NaCl (водн.) + AgNO 3 (водн.) AgCl (s) Два прозрачных и бесцветных раствора превращаются в мутно-белые при смешивании Demo Special Light lamp в воде, можно проверить на
Водные ионы и реакции (ионы, кислоты и основания) Demo NaCl (водн.) + AgNO 3 (водн.) AgCl (s) Два прозрачных и бесцветных раствора превращаются в мутно-белые при смешивании Demo Special Light lamp в воде, можно проверить на
Обозначение соединений Раздаточный ключ
 Обозначение соединений с раздаточным материалом с.2 Назовите каждый из следующих одноатомных катионов: Li + = ион лития Ag + = ион серебра Cd +2 = ион кадмия Cu +2 = ион меди (II) Al +3 = ион алюминия Mg +2 = ион магния
Обозначение соединений с раздаточным материалом с.2 Назовите каждый из следующих одноатомных катионов: Li + = ион лития Ag + = ион серебра Cd +2 = ион кадмия Cu +2 = ион меди (II) Al +3 = ион алюминия Mg +2 = ион магния
БЛОК (6) КИСЛОТЫ И ОСНОВАНИЯ
 РАЗДЕЛ (6) КИСЛОТЫ И ОСНОВАНИЯ 6.1 Определение кислот и оснований по Аррениусу Определения кислот и оснований были предложены шведским химиком Саванте Аррениусом в 1884 году. Кислоты были определены как соединения, которые
РАЗДЕЛ (6) КИСЛОТЫ И ОСНОВАНИЯ 6.1 Определение кислот и оснований по Аррениусу Определения кислот и оснований были предложены шведским химиком Саванте Аррениусом в 1884 году. Кислоты были определены как соединения, которые
Глава 16 Кислотно-основное равновесие
 Глава 16 Кислотно-основное равновесие Цели обучения и ключевые навыки: Понять природу гидратированного протона, представленного как H + (водн.) Или H 3 O + (водн.). Определить и идентифицировать кислоты и основания Арренюиса.
Глава 16 Кислотно-основное равновесие Цели обучения и ключевые навыки: Понять природу гидратированного протона, представленного как H + (водн.) Или H 3 O + (водн.). Определить и идентифицировать кислоты и основания Арренюиса.
НАПИСАНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ
 НАПИСАНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ Для ионных соединений должна быть разработана химическая формула. У вас больше не будет списка ионов на экзамене (как на GCSE). Вместо этого вы должны выучить одни и отработать другие.
НАПИСАНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ Для ионных соединений должна быть разработана химическая формула. У вас больше не будет списка ионов на экзамене (как на GCSE). Вместо этого вы должны выучить одни и отработать другие.
ХИМИЧЕСКИЕ НАЗВАНИЯ И ФОРМУЛЫ
 6 СЕМИЧЕСКИЕ НАЗВАНИЯ И ФОРМУЛЫ РАЗДЕЛ 6.1 ВВЕДЕНИЕ В КЕМИЧЕСКИЕ СВЯЗИ (страницы 133 137) В этом разделе объясняется, как различать ионные и молекулярные соединения. Он также определяет катион и анион
6 СЕМИЧЕСКИЕ НАЗВАНИЯ И ФОРМУЛЫ РАЗДЕЛ 6.1 ВВЕДЕНИЕ В КЕМИЧЕСКИЕ СВЯЗИ (страницы 133 137) В этом разделе объясняется, как различать ионные и молекулярные соединения. Он также определяет катион и анион
Обзор стехиометрии
 Обзор стехиометрии В этом обзоре 20 задач. Ответы, включая постановку задачи, можно найти во второй половине этого документа. 1. N 2 (г) + 3H 2 (г) ———> 2NH 3 (г) а.азот
Обзор стехиометрии В этом обзоре 20 задач. Ответы, включая постановку задачи, можно найти во второй половине этого документа. 1. N 2 (г) + 3H 2 (г) ———> 2NH 3 (г) а.азот
Разложение. Сочинение
 Разложение 1. Твердый карбонат аммония нагревают. 2. Твердый карбонат кальция нагревают. 3. Твердый сульфит кальция нагревают в вакууме. Состав 1. Оксид бария добавлен в дистиллированную воду. 2. Фосфор
Разложение 1. Твердый карбонат аммония нагревают. 2. Твердый карбонат кальция нагревают. 3. Твердый сульфит кальция нагревают в вакууме. Состав 1. Оксид бария добавлен в дистиллированную воду. 2. Фосфор
6 Реакции в водных растворах
 6 Реакции в водных растворах. Вода — самая распространенная среда, в которой естественным образом протекают химические реакции.В этом нетрудно убедиться: 70% массы нашего тела состоит из воды и около 70% поверхности
6 Реакции в водных растворах. Вода — самая распространенная среда, в которой естественным образом протекают химические реакции.В этом нетрудно убедиться: 70% массы нашего тела состоит из воды и около 70% поверхности
(б) Образование хлорида кальция:
 Глава 2: Химические соединения и связи Раздел 2.1: Ионные соединения, страницы 22 23 1. Ионное соединение объединяет металл и неметалл, соединенные ионной связью. 2. Электростатическая сила удерживает
Глава 2: Химические соединения и связи Раздел 2.1: Ионные соединения, страницы 22 23 1. Ионное соединение объединяет металл и неметалл, соединенные ионной связью. 2. Электростатическая сила удерживает
Глава 6 Примечания Наука 10 Название:
 6.1 Типы химических реакций a) Синтез (A + B AB) Реакции синтеза также известны как реакции. Когда это происходит, два или более реагента (обычно элементы) соединяются с образованием a. A + B AB, где A и
6.1 Типы химических реакций a) Синтез (A + B AB) Реакции синтеза также известны как реакции. Когда это происходит, два или более реагента (обычно элементы) соединяются с образованием a. A + B AB, где A и
Имя: Класс: Дата: 2 4 (водн.)
 Имя: Класс: Дата: Раздел 4 Практический тест Множественный выбор Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос. 1) Сбалансированное молекулярное уравнение для полной нейтрализации
Имя: Класс: Дата: Раздел 4 Практический тест Множественный выбор Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос. 1) Сбалансированное молекулярное уравнение для полной нейтрализации
НАПИСАНИЕ УРАВНЕНИЙ
 НАПИСАНИЕ УРАВНЕНИЙ AP Наборы уравнений AP находятся в разделе «Свободный ответ» теста AP.Это вопрос из 15 баллов, и вы можете практиковать его круглый год! Вам даны три уравнения, и вы должны
НАПИСАНИЕ УРАВНЕНИЙ AP Наборы уравнений AP находятся в разделе «Свободный ответ» теста AP.Это вопрос из 15 баллов, и вы можете практиковать его круглый год! Вам даны три уравнения, и вы должны
Вопросы о реакции AP Chemistry
 AP Chemistry Reaction Questions Направления: дайте формулы, чтобы показать реагенты и продукты для следующих химических реакций. Каждая из реакций протекает в водном растворе, если не указано иное
AP Chemistry Reaction Questions Направления: дайте формулы, чтобы показать реагенты и продукты для следующих химических реакций. Каждая из реакций протекает в водном растворе, если не указано иное
Название периода Единица 3 Рабочий лист
 Период имени Рабочий лист блока 3 Прочтите главы 8, 2.52.7 1. Объясните разницу между металлической, ионной и ковалентной связью Катионы металлов разделяют море электронов Ионные атомы отдают и забирают электроны
Период имени Рабочий лист блока 3 Прочтите главы 8, 2.52.7 1. Объясните разницу между металлической, ионной и ковалентной связью Катионы металлов разделяют море электронов Ионные атомы отдают и забирают электроны
Кислотно-основное равновесие
 Раздел 9 Соединения Молекулы ВВЕДЕНИЕ Соединения — это результат сочетания элементов.Эти новые вещества обладают уникальными свойствами по сравнению с элементами, из которых они состоят. Соединений на сегодняшний день
Раздел 9 Соединения Молекулы ВВЕДЕНИЕ Соединения — это результат сочетания элементов.Эти новые вещества обладают уникальными свойствами по сравнению с элементами, из которых они состоят. Соединений на сегодняшний день
Молярность ионов в растворе.
 ПРИЛОЖЕНИЕ А. Молярность ионов в растворе. Часто необходимо рассчитать не только концентрацию (в молярности) соединения в водном растворе, но также и концентрацию каждого иона в водном растворе.
ПРИЛОЖЕНИЕ А. Молярность ионов в растворе. Часто необходимо рассчитать не только концентрацию (в молярности) соединения в водном растворе, но также и концентрацию каждого иона в водном растворе.
Блок 10A Примечания по стехиометрии
 Блок 10А. Примечания к стехиометрии. Стехиометрия — это громкое слово для процесса, который химики используют для расчета количеств в реакциях.Он использует коэффициент, установленный уравнениями сбалансированной реакции
Блок 10А. Примечания к стехиометрии. Стехиометрия — это громкое слово для процесса, который химики используют для расчета количеств в реакциях.Он использует коэффициент, установленный уравнениями сбалансированной реакции
W1 МАСТЕРСКАЯ ПО СТОХИОМЕТРИИ
 ВВЕДЕНИЕ W1 СЕМИНАР ПО СТОХИОМЕТРИИ Эти заметки и упражнения разработаны, чтобы познакомить вас с основными концепциями, необходимыми для понимания химической формулы или уравнения. Относительные атомные массы
ВВЕДЕНИЕ W1 СЕМИНАР ПО СТОХИОМЕТРИИ Эти заметки и упражнения разработаны, чтобы познакомить вас с основными концепциями, необходимыми для понимания химической формулы или уравнения. Относительные атомные массы
РАСЧЕТ МОЛЕЙ И МОЛЕЙ
 35 МОЛЕЙ И МОЛЕЙ КУКУЛЯЦИИ ВВЕДЕНИЕ Цель этого раздела — представить некоторые методы расчета количества каждого реагента, используемого в химической реакции, и количества каждого продукта
35 МОЛЕЙ И МОЛЕЙ КУКУЛЯЦИИ ВВЕДЕНИЕ Цель этого раздела — представить некоторые методы расчета количества каждого реагента, используемого в химической реакции, и количества каждого продукта
Химический блок оценки AS 1
 Центр № 71 Номер кандидата ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ (AS) Общий аттестат об образовании Январь 2011 г. Группа оценки химии AS 1, оценивающая основные понятия физической и неорганической химии [AC111]
Центр № 71 Номер кандидата ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ (AS) Общий аттестат об образовании Январь 2011 г. Группа оценки химии AS 1, оценивающая основные понятия физической и неорганической химии [AC111]
Глава 13 и 14 Практический экзамен
 Имя: Класс: Дата: Глава 13 и 14 Практический экзамен Множественный выбор Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос.1. Кислоты обычно выделяют газообразный H 2, когда они реагируют с a.
Имя: Класс: Дата: Глава 13 и 14 Практический экзамен Множественный выбор Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос.1. Кислоты обычно выделяют газообразный H 2, когда они реагируют с a.
Глава 4 Химические реакции
 Глава 4 Химические реакции I) Ионы в водном растворе. Многие реакции протекают в воде, образуют ионы в растворе водный раствор = растворенное вещество + растворенное вещество: вещество, растворенное и присутствует в меньшем количестве
Глава 4 Химические реакции I) Ионы в водном растворе. Многие реакции протекают в воде, образуют ионы в растворе водный раствор = растворенное вещество + растворенное вещество: вещество, растворенное и присутствует в меньшем количестве
Рабочий лист химии после зачисления
 Название: Рабочий лист химии после зачисления Цель этого рабочего листа — помочь вам обобщить некоторые из фундаментальных концепций, которые вы изучали на GCSE, и представить некоторые из концепций, которые будут частью
Название: Рабочий лист химии после зачисления Цель этого рабочего листа — помочь вам обобщить некоторые из фундаментальных концепций, которые вы изучали на GCSE, и представить некоторые из концепций, которые будут частью
19.2 Химические формулы
 В предыдущем разделе вы узнали, как и почему атомы образуют химические связи друг с другом. Вы также знаете, что атомы соединяются в определенных соотношениях с другими атомами. Эти соотношения определяют химическую формулу
В предыдущем разделе вы узнали, как и почему атомы образуют химические связи друг с другом. Вы также знаете, что атомы соединяются в определенных соотношениях с другими атомами. Эти соотношения определяют химическую формулу
Периодическая таблица, валентность и формула
 Периодическая таблица, валентность и формула Происхождение периодической таблицы Мендельев в 1869 году предположил, что существует связь между химическими свойствами элементов и их атомными массами.Он заметил
Периодическая таблица, валентность и формула Происхождение периодической таблицы Мендельев в 1869 году предположил, что существует связь между химическими свойствами элементов и их атомными массами.Он заметил
ГЛАВА 18 КИСЛОТО-ОСНОВНОЕ РАВНОВЕСИЕ
 ГЛАВА 18 РАВНОВЕСИЕ КИСЛОТНЫХ ОСНОВАНИЙ 18.1 В определении Аррениуса вещества классифицируются как кислоты или основания по их поведению в растворяющей воде. 18. Все кислоты Аррениуса содержат водород и дают
ГЛАВА 18 РАВНОВЕСИЕ КИСЛОТНЫХ ОСНОВАНИЙ 18.1 В определении Аррениуса вещества классифицируются как кислоты или основания по их поведению в растворяющей воде. 18. Все кислоты Аррениуса содержат водород и дают
Присвоение имен ионным соединениям.
 Обозначение ионных соединений Ключ ответа Дайте названия следующих ионных соединений: Название 1) Na 2 CO 3 карбонат натрия 2) гидроксид натрия NaOH 3) бромид магния MgBr 2 4) хлорид калия KCl 5) FeCl
Обозначение ионных соединений Ключ ответа Дайте названия следующих ионных соединений: Название 1) Na 2 CO 3 карбонат натрия 2) гидроксид натрия NaOH 3) бромид магния MgBr 2 4) хлорид калия KCl 5) FeCl
нейтроны присутствуют?
 Рабочий лист AP Chem Summer Assignment №1 Атомная структура 1.а) Для иона 39 K + укажите, сколько электронов, сколько протонов и сколько 19 нейтронов присутствует? б) Какая из этих частиц имеет наименьшее
Рабочий лист AP Chem Summer Assignment №1 Атомная структура 1.а) Для иона 39 K + укажите, сколько электронов, сколько протонов и сколько 19 нейтронов присутствует? б) Какая из этих частиц имеет наименьшее
11.16: Число окисления и окислительно-восстановительные реакции
11.16: Число окисления и окислительно-восстановительные реакции — Chemistry LibreTexts Перейти к основному содержанию- Последнее обновление
- Сохранить как PDF
- Определение состояний окисления Подсчет количества перенесенных электронов — неэффективный и трудоемкий способ определения степени окисления.Эти правила предоставляют более простой метод: Степень окисления несоединенного элемента равна нулю. Это применимо независимо от структуры элемента: Xe, Cl2, S8 и большие структуры углерода или кремния имеют нулевую степень окисления. Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна нулю. Сумма степеней окисления всех атомов в ионе равна заряду иона. Более электроотрицательному элементу в веществе присваивается отрицательная степень окисления.Менее электроотрицательный элемент получает положительную степень окисления. Помните, что электроотрицательность максимальна в верхнем правом углу таблицы Менделеева и уменьшается в нижнем левом углу. Некоторые элементы почти всегда имеют одинаковую степень окисления в своих соединениях: Элемент Обычная степень окисления Исключения Металлы 1 группы Всегда +1 Металлы 2 группы Всегда +2 Кислород Обычно -2 Пероксиды и F2O (см. Ниже) Водород Обычно +1 Гидриды металлов (-1) (см. Ниже) Фтор Всегда -1 Хлор обычно -1 Соединения с O или F (см. Ниже) Исключения: Водород в гидридах металлов. Гидриды металлов включают такие соединения, как гидрид натрия, NaH.Здесь водород существует в виде гидрид-иона H-. Степень окисления простого ионоподобного гидрида равна заряду иона — в данном случае -1. В качестве альтернативы сумма степеней окисления нейтрального соединения равна нулю. Поскольку металлы группы 1 всегда имеют степень окисления +1 в своих соединениях, отсюда следует, что водород должен иметь степень окисления -1 (+1 -1 = 0). Кислород в пероксидах: пероксиды включают пероксид водорода h3O2. Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю.Поскольку каждый водород имеет степень окисления +1, каждый кислород должен иметь степень окисления -1, чтобы сбалансировать его. Кислород в F2O: отклонение здесь связано с тем, что кислород менее электроотрицателен, чем фтор; фтор имеет приоритет со степенью окисления -1. Поскольку соединение нейтрально, кислород имеет степень окисления +2. Хлор в соединениях с фтором или кислородом: поскольку хлор принимает такое большое разнообразие степеней окисления в этих соединениях, безопаснее просто помнить, что его степень окисления не равна -1, и определять правильное состояние, используя фтор или кислород в качестве эталона. .{-} + S} \) Решение: а) Соответствующие степени окисления Единственные изменяющиеся атомы — это Mn, от +7 до +2, восстановление, и S, от +4 до +6, окисление. Реакция представляет собой окислительно-восстановительный процесс. SO2 был окислен MnO4–, поэтому MnO4– является окислителем. MnO4– имеет
Как определить степень окисления азота в нитрат-ионе?
Наука
- Анатомия и физиология
- Астрономия
- Астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде

Leave A Comment