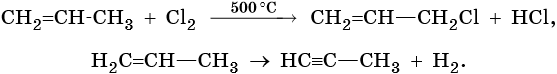
Дивинил, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Диены или Алкадиены — это… Что такое Диены или Алкадиены?
- Диены или Алкадиены
Дие́ны (диеновые углеводороды) — ненасыщенные углеводороды с открытой цепью, содержащие в молекуле две двойные связи и образующие гомологический ряд общей формулы CnH2n−2. Диены являются структурными изомерами алкинов.
Классификация
Диеновые углеводороды различаются расположением двойных связей, такое расположение вследствие эффектов сопряжения связей сказывается на их реакционной способности. Существуют три класса диенов:
- Аллены — диены с кумулированными связями, замещённые производные пропадиена-1,2 H2C=C=CH2
- Сопряжённые диены или 1,3-диены — замещённые производные бутадиена-1,3 CH2=CH–CH=CH2
- Изолированные диены, в которых двойные связи располагаются через две и более простых связи С–С
Наибольшее значение имеют диеновые углеводороды с сопряжёнными двойными связями, в их молекулах двойные связи разделены одной одинарной связью. Например, дивинил СН2=СН–СН=СН2, изопрен СН2=С(СН3)–СН=СН2 и др.
Реакции
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука.
Wikimedia Foundation. 2010.
- Диего Симеоне
- Диего Родригес Веласкес
Смотреть что такое «Диены или Алкадиены» в других словарях:
Диены — бутадиен 1,3. Алкадиены класс углеводородов, содержащих две двойных связи углерод углерод. Содержание … Википедия
Органические соединения — Органические вещества класс соединений, в состав которых входит углерод (за исключением карбидов, карбонатов, оксидов углерода и цианидов). Название «органические соединения» появилось на ранней стадии развития химии и говорит само за себя ученые … Википедия
Органическое вещество — Органические вещества класс соединений, в состав которых входит углерод (за исключением карбидов, карбонатов, оксидов углерода и цианидов). Название «органические соединения» появилось на ранней стадии развития химии и говорит само за себя ученые … Википедия
Органическое соединение — Органические вещества класс соединений, в состав которых входит углерод (за исключением карбидов, карбонатов, оксидов углерода и цианидов). Название «органические соединения» появилось на ранней стадии развития химии и говорит само за себя ученые … Википедия
Органические вещества — Органические соединения, органические вещества класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[1] Содержание 1 История 2 Класси … Википедия
Алкены — У этого термина существуют и другие значения, см. Алкен (значения). Пространственная структура этилена. Алкены (олефины, этиленовые углеводороды) ациклические непредельные углеводороды … Википедия
Систематическая номенклатура полиненасыщенных углеводородов — Наличие двух или более двойных связей обозначают суффиксами диен, триен и т. д., все двойные связи должны входить в главную цепь. Общие родовые названия углеводородов с двумя, тремя двойными связями и т. д. алкадиены,… … Википедия
Химические свойства алкадиенов | CHEMEGE.RU
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n+2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
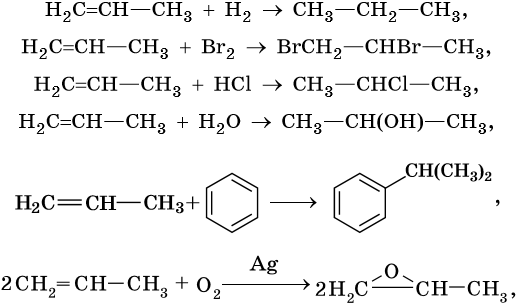
1. Реакции присоединения
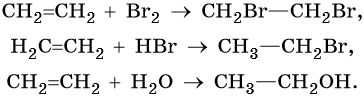
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
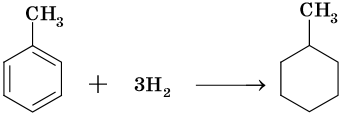
1.1. Гидрирование
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):

Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:

1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |

Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:

При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:

1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
. 
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:

При полимеризации изопрена образуется природный (натуральный) каучук:

2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.

| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:

2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
| Например, уравнение сгорания бутадиена: |
2C4H6 + 11O2 → 8CO2 + 6H2O
Бутадиен-1,2, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Задания на классификацию и номенклатуру органических веществ.
Задание №1
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) метилбензол Б) анилин В) 3-метилбутаналь | 1) альдегиды 2) амины 3) аминокислоты 4) углеводороды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеОтвет: 421
Пояснение:
A) Метилбензол он же толуол, имеет структурную формулу:

Как можно видеть, молекулы данного вещества состоят только из углерода и водорода, поэтому метилбензол (толуол) относится к углеводородам
Б) Структурная формула анилина (аминобензола) следующая:

Как можно видеть из структурной формулы молекула анилина состоит из ароматического углеводородного радикала (C6H5-) и аминогруппы (-NH2) , таким образом, анилин относится к ароматическим аминам, т.е. верный ответ 2.
В) 3-метилбутаналь. Окончание «аль» говорит о том, что вещество относится к альдегидам. Структурная формула данного вещества:

Задание №2
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) метилпропионат Б) глицерин В) стирол | 1) сложные эфиры 2) углеводороды 3) спирты 4) простые эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №3
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) деканол-1 Б) этилацетат В) декан | 1) простые эфиры 2) углеводороды 3) спирты 4) сложные эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №4
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) аланин Б) бутин В) изопрен | 1) альдегиды 2) аминокислоты 3) алкины 4) диены |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №5
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) этанол Б) глицерин В) бензол | 1) арены 2) альдегиды 3) спирты 4) кетоны |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №6
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) толуол Б) аланин В) глицерин | 1) амины 2) спирты 3) углеводороды 4) аминокислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №7
Установите соответствие между молекулярной формулой соединения и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЕДИНЕНИЯ | КЛАСС/ГРУППА |
А) C3H6O Б) C6H6O В) C3H6O2 | 1) фенолы 2) спирты 3) альдегиды 4) сложные эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №8
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) ацетон Б) 3-метилбутаналь В) 2-метилбутен-2 | 1) углеводороды 2) кетоны 3) альдегиды 4) одноатомные спирты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №9
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) этандиол Б) винилацетилен В) нитроглицерин | 1) одноатомные спирты 2) многоатомные спирты 3) сложные эфиры 4) углеводороды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №10
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) HCOOC6H5 Б) CH3OCH3 В) HCOOH | 1) карбоновые кислоты 2) альдегиды 3) простые эфиры 4) сложные эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №11
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) HCHO Б) CH3NH2 В) C4H10 | 1) нитросоединения 2) амины 3) альдегиды 4) углеводороды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №12
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) C6H12O6 Б) HCOOCH3 В) CH3OCH3 | 1) простые эфиры 2) сложные эфиры 3) углеводороды 4) углеводы |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №13
Установите соответствие между классом соединений и тривиальным названием вещества, которое является его представителем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| КЛАСС СОЕДИНЕНИЙ | ТРИВИАЛЬНОЕ НАЗВАНИЕ ВЕЩЕСТВА |
А) спирты Б) углеводы В) углеводороды | 1) толуол 2) крахмал 3) этиленгликоль 4) анилин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №14
Установите соответствие между названием вещества и его формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ФОРМУЛА ВЕЩЕСТВА |
А) пропиламин Б) триметиламин В) дивинил | 1) (CH3)3N 2) C3H7NH2 3) C4H8 4) C4H6 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №15
Установите соответствие между молекулярной формулой вещества и его названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| МОЛЕКУЛЯРНАЯ ФОРМУЛА | НАЗВАНИЕ СОЕДИНЕНИЯ |
А) CH4O Б) CH2O В) C2H3Cl | 1) хлорэтан 2) метаналь 3) метанол 4) хлорэтен |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №16
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) децен Б) метилпальмитат В) глицилаланин | 1) пептиды 2) углеводороды 3) эфиры 4) амины |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №17
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) C6H6 Б) C4H10 В) C2H3OC2H5 | 1) арены 2) алканы 3) простые эфиры 4) сложные эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №18
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
А) толуол Б) 2-метил-1-бутанол В) изопропилэтаноат | 1) альдегиды 2) сложные эфиры 3) углеводороды 4) спирты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №19
Установите соответствие между общей формулой гомологического ряда и названием вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБЩАЯ ФОРМУЛА | НАЗВАНИЕ ВЕЩЕСТВА |
А) CnH2n+2O Б) CnH2n+2O2 В) CnH2nO2 | 1) бутанол-2 2) этиленгликоль 3) глицерин 4) метилформиат |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №20
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| МОЛЕКУЛЯРНАЯ ФОРМУЛА | КЛАСС/ГРУППА |
А) C4H8O2 Б) C7H8 В) C5H10O5 | 1) углеводы 2) арены 3) сложные эфиры 4) альдегиды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №21
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| МОЛЕКУЛЯРНАЯ ФОРМУЛА | КЛАСС/ГРУППА |
А) фруктоза Б) рибоза В) крахмал | 1) C5H10O5 2) C6H12O6 3) C12H22O11 4) (C6H10O5)n |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №22
Установите соответствие между названием вещества и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЩАЯ ФОРМУЛА |
А) стеариновая кислота Б) бутанон В) пропаналь | 1) CnH2nO2 2) CnH2nO 3) CnH2n+2O 4) CnH2n–6O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №23
Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
А) HCOOCH3 Б) С6Н5СНО В) C6H5ОС6Н5 | 1) простые эфиры 2) кетоны 3) cложные эфиры 4) альдегиды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №24
Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
А) HCOOH Б) C2H5ОН В) C6H5ОН | 1) фенолы 2) алкадиены 3) спирты 4) карбоновые кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №25
Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
А) этаналь Б) пропин В) этилацетат | 1) сложные эфиры 2) алкины 3) спирты 4) альдегиды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №26
Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
А) этиленгликоль Б) метилацетат В) стирол | 1) сложные эфиры 2) углеводороды 3) спирты 4) карбоновые кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №27
Установите соответствие между общей формулой гомологического ряда и названием вещества, принадлежащего к этому ряду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБЩАЯ ФОРМУЛА | НАЗВАНИЕ ВЕЩЕСТВА |
А) CnH2n+2O2 Б) CnH2nO2 В) CnH2n+2O | 1) глицерин 2) пропанол 3) этиленгликоль 4) муравьиная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеУглеводороды – HIMI4KA

Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Для алканов характерна изомерия углеродного скелета.
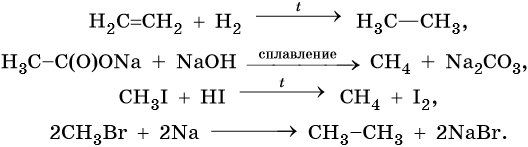
Способы получения алканов. Как правило, алканы получают из природного сырья, однако известно большое число синтетических методов их получения. Это реакции гидрирования алкенов и алкинов, декарбоксилирование натриевых или калиевых солей карбоновых кислот, восстановление йодалканов йодоводородом, реакция Вюрца:

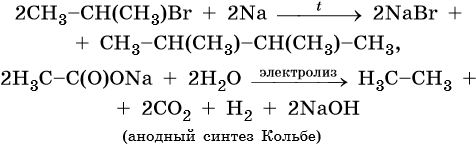
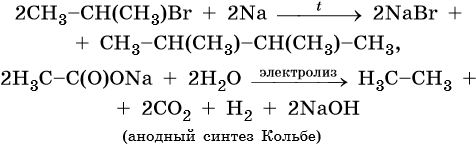
Для алканов характерны реакции замещения, которые идут при нагревании или УФ-облучении. При этом происходит разрыв связи C—H с последующей заменой атома водорода на другой атом или группу атомов или же разрыв молекулы по связи C—С.
Большинство реакций алканов протекают по механизму радикального замещения SR. В этих реакциях реакционная способность атомов водорода убывает в ряду: третичные > вторичные > первичные.
Ниже приведены уравнения химических реакций, характерных для алканов.
1. Галогенирование:
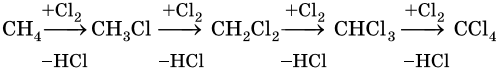
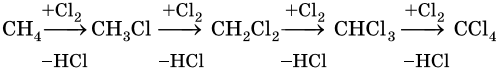
Реакция идет на свету или при температуре 250— 400 °С.
Реакционная способность галогенов в этой реакции уменьшается в ряду F2 > Cl2 > Br2 > I2.
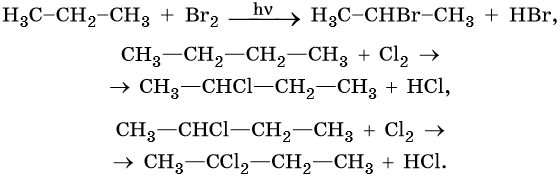
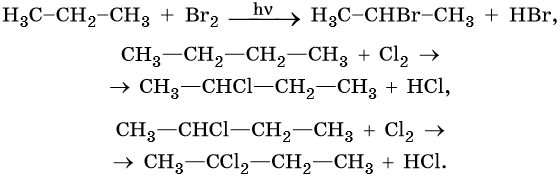
Реакции замещения в алканах протекают по радикальному механизму. При этом легче всего происходит замещение атома водорода, связанного с третичным углеродным атомом, затем — со вторичным и наконец — с первичным. Это объясняют значением энергии связей C–H, имеющих величину для первичной около 419 кДж/моль, вторичной — 393,6 кДж/моль и третичной — 372,6 кДж/ моль.
Наиболее широко известны реакции галогенирования алканов. Эти реакции идут на свету или при нагревании в присутствии инициаторов радикальных реакций. Рассмотрим механизм реакции на примере хлорирования метана.
На первой стадии этой реакции происходит распад молекулы хлора на два свободных радикала:
Cl:Cl → 2Cl• — зарождение, или инициирование цепи. Затем начинается рост цепи, связанный с взаимодействием свободного радикала с молекулой метана, что приводит к образованию новых радикалов:
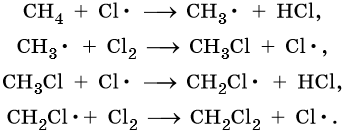
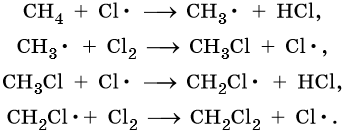
Реакция заканчивается обрывом цепи, который наступает в результате взаимодействия между собой свободных радикалов:
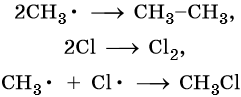
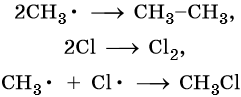
Механизм реакции галогенирования был установлен академиком Н.Н. Семеновым.
2. Нитрование:
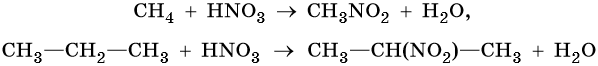
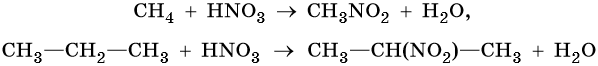
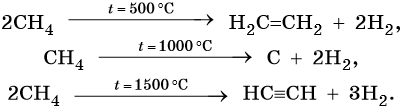
3. Термические превращения:

4. Окисление:
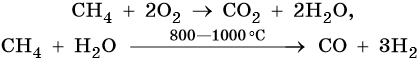
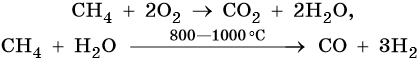
Каталитическое окисление бутана приводит к уксусной кислоте, а горение в кислороде — к углекислому газу и воде:
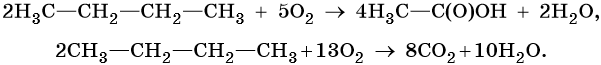
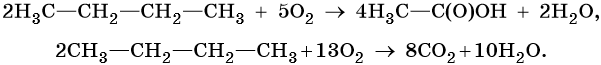
5. Дегидрирование:
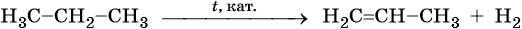
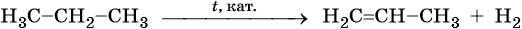
Реакции дегидрирования (отщепления водорода) протекают по разным направлениям:
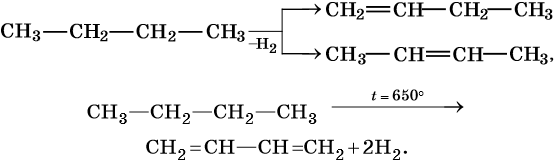

Изомеризация:
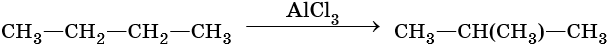
Крекинг:
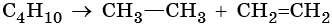
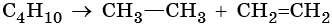
Реакции циклизации и ароматизации:
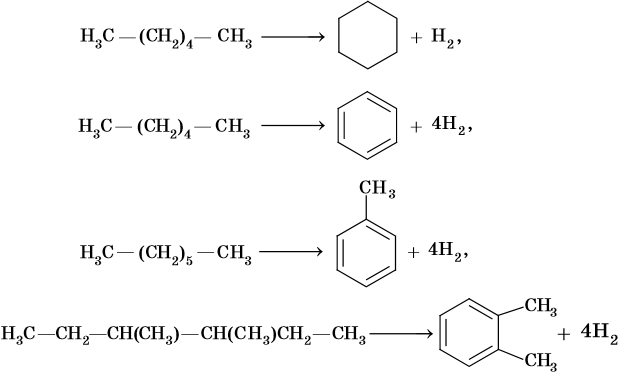

Последние две реакции идут при температурах 450–500 °С с использованием в качестве катализаторов оксидов хрома или алюминия.
Алициклическими называют углеводороды, которые содержат один или несколько циклов неароматического характера. По своим свойствам они схожи с соответствующими соединениями алифатического ряда. Термин «алициклические» означает «алифатические циклические» углеводороды. Несмотря на большое сходство между алифатическими и алициклическими соединениями, у последних имеются некоторые специфические свойства, обусловленные их циклической структурой. Общая формула гомологического ряда циклоалканов CnH2n.
Иногда циклоалканы называют нафтенами, т. к. производные циклопентана и циклогексана содержатся в некоторых сортах нефти.
Для гомологов и производных циклоалканов возможны следующие виды изомерии: изомерия, связанная с размером цикла, например, циклобутан является изомером метилциклопропана; изомерия положений заместителей в цикле; изомерия боковых цепей.
Циклопентан, циклогексан и их производные широко распространены в природе и составляют основную часть некоторых сортов нефти.
Низшие циклы синтезируют циклизацией дигалоидпроизводных, например:
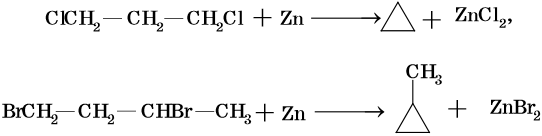
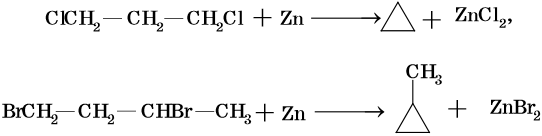
Циклобутан и циклопентан получают циклизацией 1,4-дибромбутана и 1,5-дибромпентана под действием амальгамы лития. Циклогексан и его производные получают из нефти или гидрированием бензола и его производных.

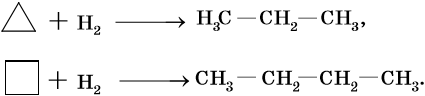
Химические свойства циклоалканов во многом определяются размерами цикла. Наибольшей химической стойкостью обладают пяти- и шестичленные циклы. Циклопропан склонен к многочисленным реакциям раскрытия цикла.
Гидрирование циклопропана и циклобутана идет над никелевым катализатором при температуре 80 и 120 °С соответственно. При этом образуются пропан и бутан.

Циклопропановый цикл легко раскрывают при бромировании или гидробромировании, например:
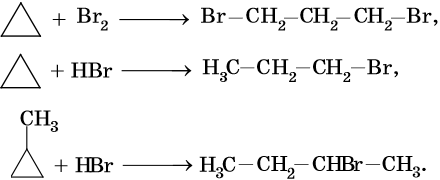

В аналогичных условиях углеводороды от циклобутана до циклогексана вступают в реакции замещения:

Циклопропан используют в качестве анестезирующего средства. Циклогексан используют как растворитель. Окислением циклогексана получают циклогексанол C6H11OH, циклогексанон C6H10O и адиптиновую кислоту HOOC(CH2)4COOH. Циклогексанон является промежуточным продуктом при получении полиамидного волокна — капрона.
Алкенами, или олефинами, называют алифатические непредельные углеводороды, молекулы которых отвечают общей формуле CnH2n и имеют в своем составе одну двойную связь C=C. Родоначальником этого класса органических соединений является этилен CH2=CH2. Для алкенов характерна изомерия углеродного скелета, изомерия положения кратной связи, геометрическая изомерия, а также межклассовая изомерия с циклоалканами.
Способы получения алкенов. Этилен, пропилен и бутилены выделяют из газов нефтепереработки, образующихся при термическом крекинге. Алкены также образуются в большом количестве при пиролизе нефти.
Промышленным способом получения алкенов является дегидрирование алканов на катализаторе (K2O—Cr2O3—Al2O3), при температуре 560—620 °C из н-бутана образуются изомерные бутены. Еще легче этот процесс идет в случае изобутана:


Алкены получают дегидратацией спиртов при катализе серной или фосфорной кислотами, оксидом алюминия или хлоридом цинка:
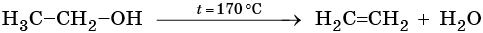
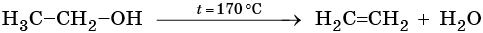
При дегидратации спиртов атом водорода наиболее легко отщепляется от наименее гидрогенизированного атома углерода (правило Зайцева):
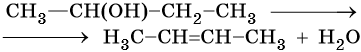
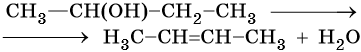
Алкены образуются при действии на галоидные алкилы спиртовой или измельченной твердой щелочи. Эта реакция дегидрогалогенирования также идет по правилу Зайцева:
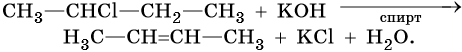
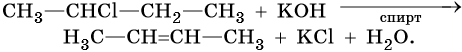
Алкены можно получить обработкой цинковым или магниевым порошком вицинальных дигалоидалканов:
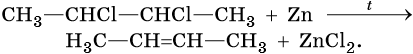
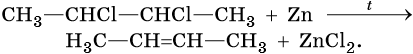
Алкены вступают в реакции соединения по двойной связи. Они протекают по механизму электрофильного присоединения, или AE. Присоединение галогеноводородов и воды к несимметричным алкенам идет по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному, т. е. связанному с наибольшим числом водородных атомов, атому углерода. По легкости присоединения к алкенам галогеноводороды можно расположить в ряд: HI > HBr > HCl > HF.
Ниже приведены реакции алкенов на примере этена и пропена:
Этен:
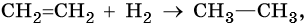
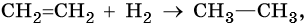

Реакция гидратации катализируется кислотами.
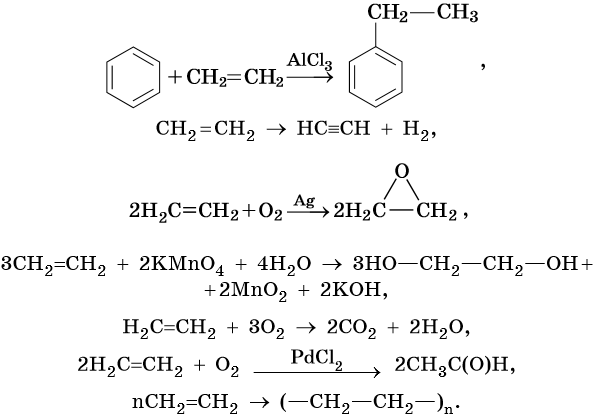

Пропен:

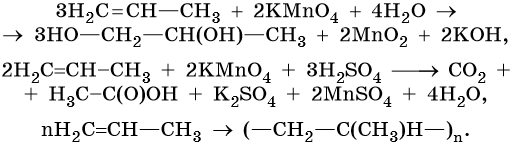
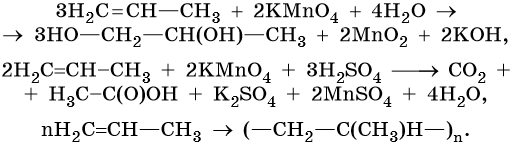
Реакция алкилирования протекает между алканами и алкенами в присутствии катализаторов:
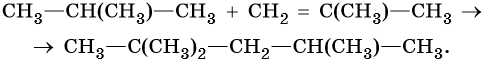
Кроме реакций соединения для алкенов возможны отдельные реакции замещения, которые протекают по радикальному механизму, а также реакции разложения:

C позиции электронной теории правило Марковникова объясняют так: под действием метильного радикала в молекуле пропилена происходит перераспределение электронной плотности электронного облака π-связи в сторону крайнего ненасыщенного атома углерода, в результате чего на атомах углерода, связанных двойной связью, возникают частичные заряды:
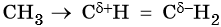
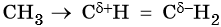
При взаимодействии такой молекулы с галогенводородом присоединение положительно заряженного иона водорода идет по атому углерода с частичным отрицательным зарядом, а отрицательно заряженного галогенидиона — по атому углерода с частичным положительным зарядом.
Другое объяснение правила Марковникова следующее. В результате электрофильного присоединения возможно образование двух различных карбокатионов: из-за положительного индуктивного эффекта двух метильных групп карбокатион 1 более стабилен, чем карбокатион 2.
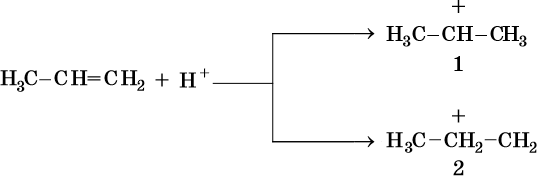

Таким образом, реакции электрофильного присоединения по двойной связи идут в направлении образования наиболее устойчивого промежуточного карбокатиона.
Существуют исключения из правила Марковникова. Это присоединение бромоводорода к алкенам в присутствии органических пероксидов или кислорода. В этом случае из пропена и бромоводорода образуется 1-бромпропан (перекисный эффект Хараша). Подчеркнем особо: перекисный эффект имеет место только в случае реакции алкенов с бромоводородом. При присоединении к алкенам HCl, H2O, HI пероксиды не влияют на направление реакции, и она идет по правилу Марковникова.
Диеновыми углеводородами называют класс химических соединений, молекулы которых отвечают общей формуле CnH2n–2 и содержат в своем составе две двойные углерод-углеродные связи. Для диенов характерна изомерия углеродного скелета, изомерия положения кратных связей, геометрическая изомерия, а также межклассовая изомерия с ацетиленовыми углеводородами.
Способы получения диенов. Дивинил и изопрен выделяют из продуктов пиролиза нефти. Основным промышленным способом получения бутадиена-1,3 является дегидрирование бутан-бутеновой смеси над катализатором, состоящим из окиси хрома, нанесенной на окись алюминия.
Метод получения дивинила по С.В. Лебедеву заключается в дегидрировании-дегидратации этилового спирта над катализатором MoO — ZnO при 450 °С.
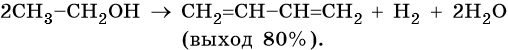
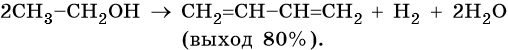
Диены, у которых двойные связи разделены более чем одной одинарной связью, в химическом отношении ведут себя подобно алкенам.
Диены, у которых двойные связи разделены одной простой связью, называют конъюгированными или сопряженными диенами. Эти соединения обладают специфическими химическими свойствами и имеют важное практическое значение.
Своеобразные химические свойства диенов проявляются в реакциях присоединения, которые идут не только по одной или двум отдельным двойным связям (1,2-присоединение), но и по противоположным концам молекулы (1,4-присоединение). Выход продуктов 1,2- или 1,4-присоединения определяется характером реагента и условиями реакции.
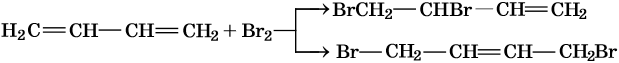

При низких температурах преобладают продукты 1,2-присоединения, при повышенных — 1,4-присоединения.
Полное бромирование бутадиена-1,3 приведет к 1,2,3,4-тетрабромбутану:
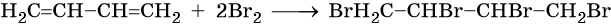
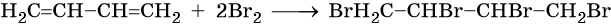
Неполное гидрирование диенов приводит к смеси алкенов, а при полном образуются алканы:
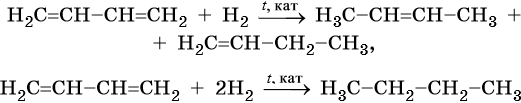
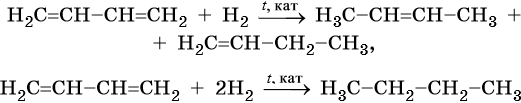
Окисление сопряженных диенов, в зависимости от используемого окислителя и условий проведения реакции, может протекать с образованием различных кислородсодержащих соединений. При частичном окислении в нейтральной среде образуется щавелевая кислота, а действие перманганата калия в кислой среде при нагревании приведет к полному окислению диена до углекислого газа и воды.
Полимеризация диенов:
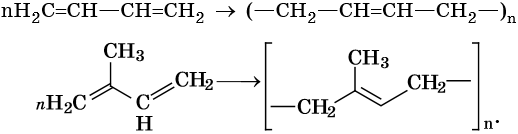

Ацетиленовыми углеводородами, или алкинами, называют класс органических соединений, которые соответствуют общей формуле CnH2n–2 и содержат в молекуле одну тройную связь. Родоначальником этого класса соединений является ацетилен, или этин, — HC≡CH. Для ацетиленовых углеводородов характерна изомерия углеродной цепи, изомерия положения кратной связи и межклассовая изомерия с диеновыми углеводородами.
Общим методом получения алкинов является реакция спиртовых растворов щелочи с дигалоидалканами, содержащими два атома галогена при одном атоме углерода или двух соседних атомах углерода:
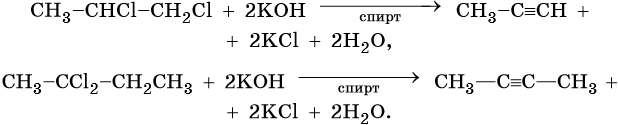
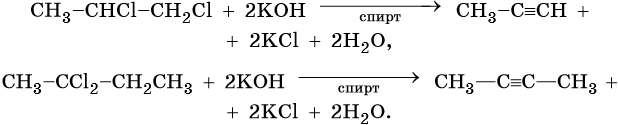
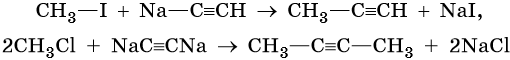
Производные ацетилена можно получить, действуя на его металлические производные галоидными алкилами:

Ацетилен получают действием воды на карбид кальция:
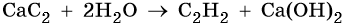
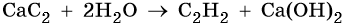
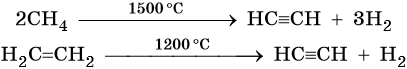
Кроме того, ацетилен получают термолизом метана и дегидрированием этилена:

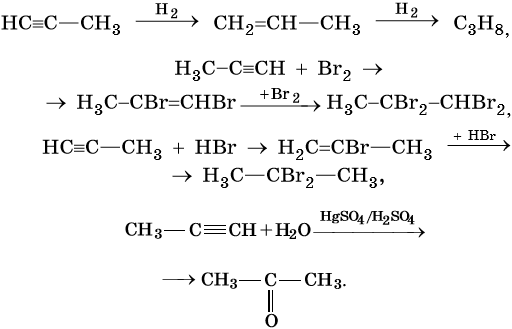
Для алкинов характерны реакции соединения и некоторые реакции замещения, которые приведены ниже на примере ацетилена и пропина. Катализаторами для реакций гидрирования алкинов являются Pd или PbO. Следует отметить, что реакции галогенирования и гидрогалогенирования алкинов идут медленнее, чем с алкенами.
Ацетилен:
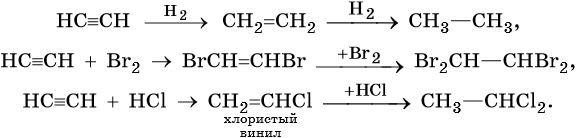
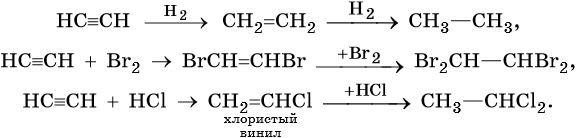
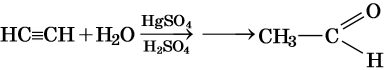
Реакция Кучерова:

Реакции винилирования:
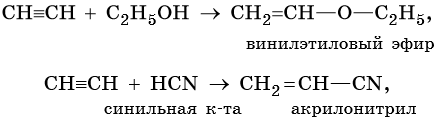
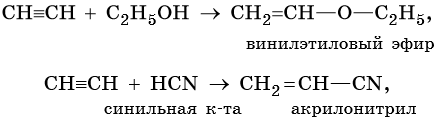
Реакции ди- и тримеризации:
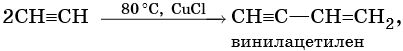

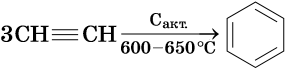
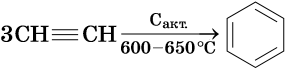
Реакции замещения:
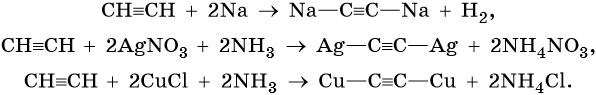
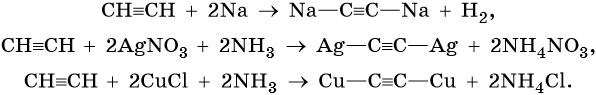
Реакции окисления:
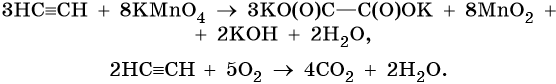
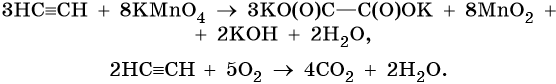
Пропин:

Тримеризация:
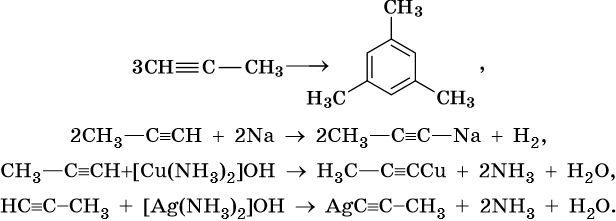

Ароматическими углеводородами, или аренами, называют класс химических соединений, который отвечает общей формуле CnH2n–6 и имеет в своем составе устойчивую циклическую группировку (бензольное кольцо), обладающую особыми химическими свойствами.
Получение ароматических углеводородов. Основным природным источником ароматических углеводородов является нефть. Для получения гомологов бензола разработаны многочисленные синтетические методы.
Некоторые сорта нефти содержат достаточное количество ароматических углеводородов, которые выделяют простой перегонкой, пиролизом или каталитическим крекингом.
Синтетические методы — это ароматизация алканов, алкилирование бензола и т.д.
Так, например, бензол можно получить реакцией декарбоксилирования бензоата натрия или калия:
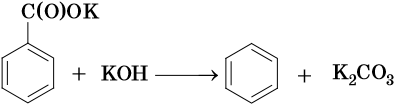

Для ароматических углеводородов наиболее характерны реакции замещения и некоторые реакции присоединения.
Как правило, все реакции замещения в ароматических соединениях протекают по электрофильному механизму SE. К таким реакциям относятся реакции алкилирования, галогенирования, нитрования, сульфирования, ацилирования и другие. Характерные химические свойства бензола:
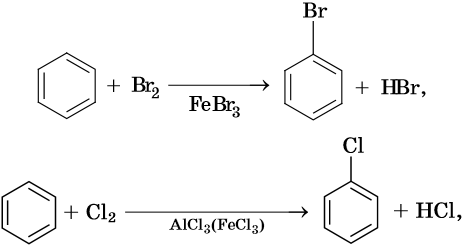

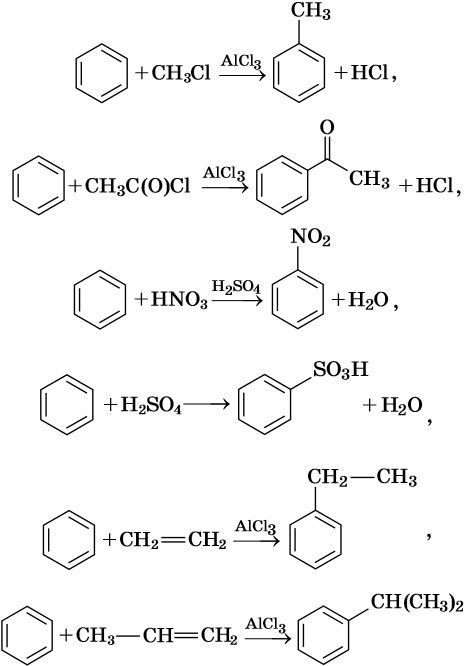

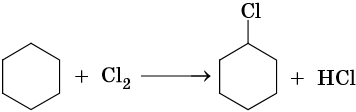
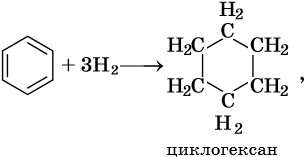
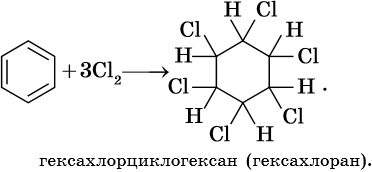
Гидрирование бензола до циклогексана идет при повышенной температуре, в присутствие катализатора (никель, платина), а хлорирование до гексахлорциклогексана — в газовой фазе под ультрафиолетовым излучением.


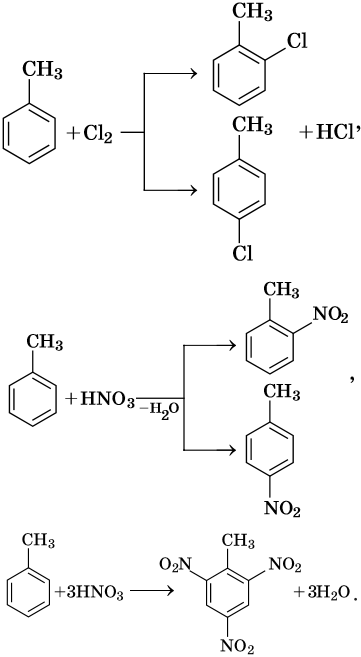
В молекуле толуола проявляется взаимное влияние метильного радикала на ароматическое ядро и ароматического ядра на метильный радикал. Толуол вступает в реакции замещения легче, чем бензол. При этом метильная группа ориентирует вхождение заместителей в орто— и пара-положения:

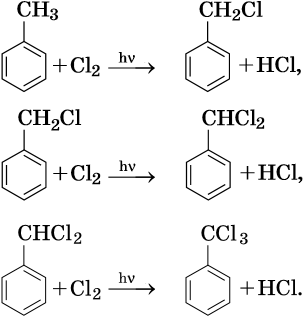
Галогенирование атомов водорода боковой цепи:

Окисление метильного радикала сильными окислителями, в зависимости от среды реакции, идет по разным направлениям:
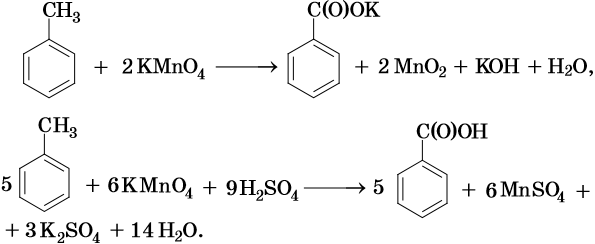

В ходе реакций окисления алкилбензолов происходит окисление боковой цепи, а бензольное кольцо изменений не претерпевает:
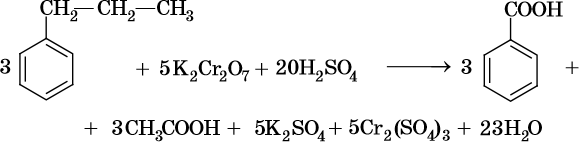
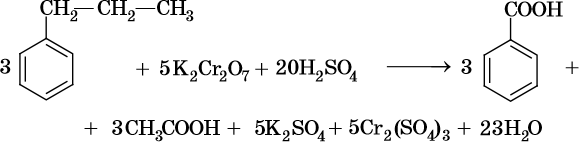
Исключением являются третбутильные группы, связанные с бензольным кольцом — бензольное кольцо окисляется легче, чем эти группы.
При окислении жирноароматических соединений, содержащих ненасыщенные радикалы, соблюдаются общие закономерности, например:
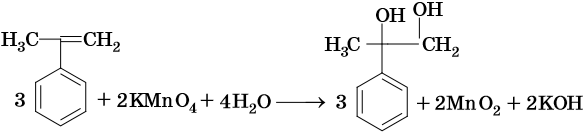
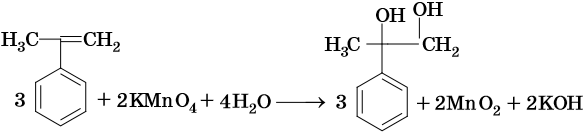
Этилбензол вступает в реакцию дегидрирования с образованием стирола:

Реакция протекает с высоким (92%) выходом при катализе оксидом цинка при температуре 600–650 °С.
Стирол легко вступает в реакции по двойной связи и в реакции полимеризации и сополимеризации:
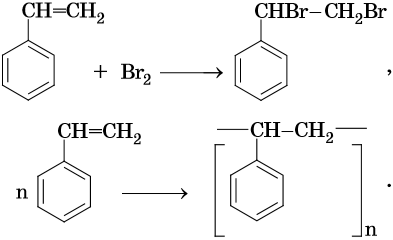

Свойства бутадиен-стирольных каучуков зависят от их состава. На их основе изготавливают шины и другие резинотехнические изделия.
Номенклатура органических соединений | CHEMEGE.RU
Номенклатура органических веществ – это система правил, которые позволяют дать уникальное название каждому химическому соединению.
Перед изучением номенклатуры органических веществ обязательно рекомендую познакомиться с темой Классификация органических соединений.
| Номенклатура органических соединений | ||
| Тривиальная | Систематическая | Рациональная |
В настоящее время используется номенклатура ИЮПАК (IUPAC) — Международный союз теоретической и прикладной химии (International Union of Pure and Applied Chemistry).
Основа названия органических соединений в зависимости от числа атомов углерода:
| Количество атомов С в цепи | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Корень | Мет- | Эт- | Проп- | Бут- | Пент- | Гекс- | Гепт- | Окт- | Нон- |
Наличие двойных или тройных связей в молекулах органических соединений обозначают, добавляя в конце слова суффикс -ен или -ин:
| Тип связей | Одинарная связь (С–С) | Двойная связь (С=С) | Тройная связь (СΞС) |
| Суффикс | -ан | -ен | -ин |
Наличие функциональных групп в органической молекуле обозначают добавлением в название приставки или суффикса:
| Функциональная группа | Приставка | Суффикс |
| –СООН | -карбокси | |
| –СООН | — овая кислота | |
| –SO3H | Сульфо- | -сульфокислота |
| –(С)Н=O | Оксо- | -аль |
| –ОН | Гидрокси- | -ол |
| –SН | Мерканто- | -тиол |
| –NH2 | Амино- | -амин |
| –NО2 | Нитро- | |
| –OR | Алкокси- | |
| –F, –Cl, –Br, –I, –Hal | Фтор-, хлор-, бром-, йод- (галоген-) |
Для обозначения числа кратных связей и числа функциональных групп используют следующие числительные:
| Количество кратных связей и функциональных групп | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Числительное | Ди | Три | Тетра | Пента | Гекса | Гепта | Окта |
Название углеводородных радикалов:
| Название | Углеводородный радикал |
| Метил- | –CH3 |
| Этил- | –CH2CH3 |
| Пропил- | –CH2CH2CH3 |
| Изопропил- | –CH(CH3)CH3 |
| Бутил- | – CH2CH2CH2CH3
|
| Изобутил- | – CH2CH(CH3)CH3 |
| Втор-бутил | – CH(CH3)CH2CH3 |
| Трет-бутил | – C(CH3)3 |
Правила составления названий алканов
1. Выбирают главную углеродную цепь
Главная цепь — это самая длинная и самая разветвленная непрерывная последовательность углеродных атомов. При этом неважно, как нарисованы на схеме углеродные атомы (вверх, вниз, влево, вправо). При этом углеводородные радикалы, которые не входят в главную цепь, являются в ней заместителями. Главная цепь должна быть самой длинной.
| Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а |

2. Главная цепь должна быть самой разветвленной.
| Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от главной цепи на рисунке б – один: |

3. Нумеруют атомы углерода в главной цепи.
Нумерацию следует начинать с более близкого к старшей группе конца цепи.
При наличии двух и более заместителей цепь стараются пронумеровать так, чтобы заместителям принадлежали минимальные номера.
| Например, правильная нумерация в главной углеродной цепи |

Тривиальная номенклатура сложилась исторически по мере зарождения и развития исторической химии, до появления единой системы наименования органических веществ.
Многие тривиальные названия используются и сейчас. В таблице ниже приведены тривиальные названия основных органических веществ, а также их названия по систематической номенклатуре.
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
Углеводороды и галогенпроизводные | ||
| Изобутан | 2-метилпропан | CH3-CH(CH3)-CH3 |
| Этилен | Этен | |
| Пропилен | Пропен | CH2=CH-CH3 |
| Дивинил | Бутадиен-1,3 | CH2=CH-CH=CH2 |
| Изопрен | 2-Метилбутадиен-1,3 | CH2=C(СH3)-CH=CH2 |
| Винилацетилен | Бутен-1-ин-3 | CH≡C-CH=CH2 |
| Толуол | Метилбензол |  |
| Кумол | Изопропилбензол |  |
| орто-Ксилол, мета-ксилол, пара-ксилол | 1,2-Диметилбензол, 1,3-Диметилбензол, 1,4-Диметилбензол |    |
| Стирол | Винилбензол |  |
| Хлороформ | Трихлорметан | СHCl3 |
| Хлоропрен | 2-хлорбутадиен-1,3 | CH2=C(Cl)-CH=CH2 |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
Кислородсодержащие и азотсодержащие вещества | ||
| Бензиловый спирт | Фенилметанол |  |
| Этиленгликоль | Этандиол-1,2 | CH2OH-CH2OH |
| Глицерин | Пропантриол-1,2,3 | CH2OH-CHOH-CH2OH |
| орто-Крезол, мета-крезол, пара-крезол | 2-Метилфенол, 3-метилфенол, 4-метилфенол |   |
| Формальдегид | Метаналь | CH2=O |
| Ацетальдегид | Этаналь | CH3-CH=O |
| Анилин | Фениламин |  |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
Карбоновые кислоты | ||
| Муравьиная кислота | Метановая кислота | HCOOH |
| Уксусная кислота | Этановая кислота | CH3COOH |
| Пропионовая кислота | Пропановая кислота | CH3CH2COOH |
| Масляная кислота | Бутановая кислота | CH3CH2CH2COOH |
| Щавелевая кислота | Этандиовая кислота | HOOC-COOH |
| Бензойная кислота | Фенилмуравьиная кислота | C6H5COOH |
связанных слов (существительное / глагол / прилагательное / наречие, положительный / отрицательный, общий / редкий). Описание слов для ‘divinyl’: NiftyWord
стирол
- сущ. Бесцветная маслянистая жидкость; мономер для полистирола
фенилэтилен; винилбензол; cinnamene .
Больше «стирол» Значение
сульфон
(Хим.) Любое одно из ряда соединений, аналогичных кетонам и состоящих из сульфурильной группы, объединенной с двумя углеводородными радикалами; как диметилсульфон, (CH) .SO.Значение слова «сульфон»
полистирол
- существительное полимер стирола; жесткий прозрачный термопласт
- пенополистирол выглядит как жесткий белый пенопласт и используется в качестве упаковки или изоляции
Больше значения слова «полистирол»
бензол
- существительное жидкий бесцветный углеводород; легко воспламеняется; канцерогенный; простейшее из ароматических соединений
бензол; бензин .
Больше значения слова «бензол»
гликоль
- существительное сладкая, но ядовитая сиропообразная жидкость, используемая в качестве антифриза и растворителя
этандиол; этиленгликоль . - существительное любой из класса спиртов, имеющих 2 гидроксильные группы в каждой молекуле
диол; двухатомный спирт .
Больше «гликоль» Значение
эфир
- существительное пятый и высший элемент после воздуха, земли, огня и воды; считалось веществом, составляющим все небесные тела
квинтэссенция . - существительное любое из класса органических соединений, которые имеют две углеводородные группы, связанные атомом кислорода
Больше значения слова «эфир»
ангидрид
- существительное соединение, образованное из одного или нескольких других соединений в результате реакции, приводящей к удалению воды
Больше «ангидрид» Значение
эфир
- существительное пятый и высший элемент после воздуха, земли, огня и воды; считалось веществом, составляющим все небесные тела
квинтэссенция . - существительное любое из класса органических соединений, которые имеют две углеводородные группы, связанные атомом кислорода
Больше значения слова «эфир»
содержат
- глагол включать или содержать; иметь в качестве компонента
включить; составляют .- В этом документе содержится совершенно новая идея.
- Пластинка содержит много старых песен 1930-х годов.
- глагол содержать или удерживать; иметь в пределах
переноски; держать; медведь .- Кувшин для вина
- Столовая для пресной воды
- Канистра для воды
Больше «содержать» Значение
с использованием
- существительное действие, которое эксплуатирует кого-либо или ставит его в жертву (обращается с ним несправедливо)
эксплуатация; виктимизация; виктимизация .- капиталистическая эксплуатация рабочего класса
- платить черным меньше, а брать больше — это форма виктимизации
- глагол введен в действие; выполнять работу или нанимать для определенной цели или для ее естественной или естественной цели
нанять; подать заявление; использование; использовать; использовать .- используй свою голову!
- мы используем только испанский язык дома
- Я не могу использовать этот инструмент
- Приложите здесь магнитное поле
- Это мышление было применено ко многим проектам
- Как вы используете этот инструмент?
- Я применяю это правило для получения хороших результатов
- Используйте пластиковые пакеты для хранения продуктов
- Он не знает, как пользоваться компьютером
Больше «использование» Значение
хлорофилл
- существительное любой из группы зеленых пигментов, обнаруженных в фотосинтезирующих организмах; существует четыре встречающиеся в природе формы
хлорофил .
Больше значения «хлорофилл»
центов
- существительное дробная денежная единица нескольких стран
- существительное монета стоимостью одну сотую стоимости основной единицы
сантим; копейка .
Больше «цент» Значение
ацетилен
- существительное бесцветный горючий газ, используемый в основном при сварке и в органическом синтезе
этин; алкин .
Больше «ацетилен» Значение
звоните
- сущ телефонное соединение
телефонный звонок; телефонный звонок .- она сообщила о нескольких анонимных звонках
- он позвонил в Лондон
- он слышал телефонный звонок, но не хотел отвечать на звонок
- существительное особое расположение (как будто от божественного источника) к следовать определенному курсу
- он был разочарован тем, что не услышал звонок
Больше «звонок» Значение
кетон
- существительное любое из класса органических соединений, имеющих карбонильную группу, связанную с атомом углерода в каждом из двух углеводородных радикалов
Больше значения «кетон»
см.
- существительное место в епископской епархии, где расположен его собор
- глагол воспринимать зрением или обладать способностью воспринимать зрение
- Вы должны быть хорошим наблюдателем, чтобы видеть все детали
- Можете ли вы видеть птица на том дереве?
- Он слепой — не видит
Подробнее см. Значение
сульфид
- существительное соединение серы и некоторых других элементов, которые являются более электроположительными
сульфид .
Больше «сульфид» Значение
соединение
- существительное целое, образованное объединением двух или более элементов или частей
- существительное (химия) вещество, образованное химическим объединением двух или более элементов или ингредиентов в определенной весовой пропорции
химическое соединение .
Более сложное значение
соединение
- существительное целое, образованное объединением двух или более элементов или частей
- существительное (химия) вещество, образованное химическим объединением двух или более элементов или ингредиентов в определенной весовой пропорции
химическое соединение .
Более сложное значение
Как мы можем улучшить для вас подбор слов?
Спасибо. Мы получили ваш отзыв.
Слова выразительны, эмоциональны, тонки, тонки, эрудированы и проницательны!
К сожалению, слова иногда бывают неуловимыми, обманчивыми, мимолетными в памяти.
Через несколько месяцев горько-сладкого труда мы наконец-то собрали слова вместе по контексту. Новый способ поиска новых и неуловимых слов. Надеюсь, они вам помогут!
Мы в правильном направлении? Ваши потребности выполнены? Если да, то как? Что мы можем сделать или сделать лучше? Сообщите нам об этом через форму обратной связи!Словосочетания для «дивинила» — это слова, относящиеся к «дивинилу», поскольку они встречаются либо до (префиксные слова), либо после «дивинил» (суффиксные слова) в общепринятом языковом использовании на различных носителях.Слова, собранные выше, могут быть отфильтрованы по частям речи (т. Е.) Существительным, глаголам, описывающим прилагательные и наречия, или по их положительным или отрицательным вибрациям, частоте использования, являются ли они префиксными или суффиксными словами для слова «дивинил» или количество слогов в каждом слове.
.
1,2-Дивинилбензол | C10h20 | ChemSpider
Прогнозируемые данные генерируются с использованием EPISuite ™ Агентства по охране окружающей среды США.
Логарифмический коэффициент разделения октанол-вода (SRC):
Log Kow (оценка KOWWIN v1.67) = 3,80
Boiling Pt, Melting Pt, оценка давления пара (MPBPWIN v1.42):
Температура кипения (° C): 187,71 (адаптированный метод Штейна и Брауна)
Температура плавления (° C): -19.67 (Среднее или взвешенное MP)
VP (мм рт. Ст., 25 ° C): 0,663 (среднее VP методов Антуана и Грейна)
Оценка растворимости в воде из Log Kow (WSKOW v1.41):
Растворимость в воде при 25 ° C (мг / л): 52,5
log Kow: 3,80 (оценка)
Использовано уравнение неплавления pt
Оценка водного соля по фрагментам:
Ват Соль (v1.01 оценка) = 17,926 мг / л
Программа класса ECOSAR (ECOSAR v0.99h):
Найдены классы:
Нейтральная органика
Константа закона Генри (25 ° C) [HENRYWIN v3.10]:
Связующий метод: 1.42E-003 атм-м3 / моль
Групповой метод: 1.47E-003 атм-м3 / моль
Henrys LC [оценка VP / WSol с использованием значений EPI]: 2,163E-003 атм-м3 / моль
Логарифмический коэффициент разделения октанол-воздух (25 ° C) [KOAWIN v1.10]:
Используемый лог-ков: 3,80 (оценка KowWin)
Log Kaw используется: -1,236 (HenryWin est)
Log Koa (оценка KOAWIN v1.10): 5.036
Лог Коа (экспериментальная база данных): Нет
Вероятность быстрого биоразложения (BIOWIN v4.10):
Biowin1 (линейная модель): 0,6856
Biowin2 (нелинейная модель): 0.7613
Результаты экспертного исследования по биоразложению:
Biowin3 (Ultimate Survey Model): 2,9115 (недель)
Biowin4 (модель первичного обследования): 3,6599 (дни-недели)
Вероятность биоразложения MITI:
Biowin5 (линейная модель MITI): 0,3948
Biowin6 (нелинейная модель MITI): 0,3587
Вероятность анаэробного биоразложения:
Biowin7 (анаэробная линейная модель): 0,0132
Готовый прогноз биоразлагаемости: НЕТ
Биодеградация углеводородов (BioHCwin v1.01):
LOG BioHC Half-Life (дни): 0,5340
Период полураспада BioHC (дни): 3.4194
Сорбция аэрозолями (25 дек C) [AEROWIN v1.00]:
Давление пара (жидкость / переохлажденный): 80,4 Па (0,603 мм рт. Ст.)
Лог Коа (Koawin est): 5.036
Kp (коэффициент распределения частицы / газа (м3 / мкг)):
Модель Mackay: 3.73E-008
Октанол / воздух (Koa) модель: 2.67E-008
Фракция, сорбированная взвешенными в воздухе твердыми частицами (фи):
Модель Юнге-Панкова: 1.35E-006
Модель Mackay: 2.99E-006
Октанол / воздух (Koa) модель: 2.13E-006
Атмосферное окисление (25 ° C) [AopWin v1.92]:
Реакция гидроксильных радикалов:
ОБЩАЯ Константа скорости OH = 54,3235 E-12 см3 / молекула-сек.
Период полураспада = 0,197 дня (12-часовой день; 1,5E6 OH / см3)
Период полураспада = 2.363 часа
Озоновая реакция:
ОБЩАЯ константа скорости озона = 4.200000 Е-17 см3 / молекула-сек.
Период полураспада = 0,273 дня (при 7E11 моль / см3)
Период полураспада = 6.549 часов
Фракция, сорбированная взвешенными в воздухе твердыми частицами (phi): 2.17E-006 (Junge, Mackay)
Примечание: сорбированная фракция может быть стойкой к атмосферному окислению.
Коэффициент адсорбции почвы (PCKOCWIN v1.66):
Koc: 1654
Лог Koc: 3,219
Водное основание / гидролиз, катализируемый кислотой (25 ° C) [HYDROWIN v1.67]:
Константы скорости НЕ могут быть оценены для этой структуры!
Оценки биоаккумуляции по Log Kow (BCFWIN v2.17):
Логарифм BCF из регрессионного метода = 2,224 (BCF = 167,4)
log Kow: 3,80 (оценка)
Улетучивание из воды:
Генри LC: 0,00147 атм-м3 / моль (оценено методом группового SAR)
Период полураспада из Модельной реки: 1,619 часа
Период полураспада из Модельного озера: 113.3 часа (4,722 дня)
Удаление при очистке сточных вод:
Полное удаление: 48,69%
Общее биоразложение: 0,18 процента
Общая адсорбция ила: 18,28%
Всего в воздух: 30,23%
(с использованием 10000 часов Bio P, A, S)
Модель Fugacity уровня III:
Массовое количество выбросов с периодом полураспада
(процент) (час) (кг / час)
Воздух 0,497 2,75 1000
Вода 17 360 1000
Почва 81.1 720 1000
Осадок 1.41 3.24e + 003 0
Время настойчивости: 387 часов
.ХИМИЧЕСКАЯ ИДЕНТИФИКАЦИЯ
ДАННЫЕ ОБ ОПАСНОСТИ ДЛЯ ЗДОРОВЬЯДАННЫЕ О ОСТРОЙ ТОКСИЧНОСТИ
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Тег: Дивинилсульфон (77-77-0) Связанная информация о продукте | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 3,4-дибром-2,5-диметилтиофен-1,1-диоксид 2- (4-МЕТИЛФЕНИЛ) -6-ФЕНИЛ-4H-ТИОПИРАН-4-ИЛИДЕН-ПРОПАНДИНИТРИЛ-1,1-ДИОКСИД 1,1-диоксид 3,4-дихлоротиофена 4,6-ДИФЕНИЛТИЕНО [3,4-D] -1,3-ДИОКСОЛ-2-ОН 5,5-ДИОКСИД 2,3,4,5-ТЕТРАХЛОРОТИОФЕН 1,1-ДИОКСИД 2- (4-ХЛОРОФЕНИЛ) -2 — [(4-ХЛОРОСТИРИЛ) СУЛЬФОНИЛ] -N, N-ДИМЕТИЛ-1-ЭТИЛЕНАМИН ВИНИЛПРОПИОНАТ Фенилвинилсульфон Смола сложного винилового эфира Винилацетат Диметилсульфоксид 3-СУЛЬФОЛЕН Ацетилкетен Виниловый эфир Диметилсульфон N-винил-2-пирролидон 2-хлорэтилвиниловый эфир ВИНИЛОВАЯ ЭФИРНАЯ СМОЛА | |||||||||||||||||||||||||||||||||||||||||||||||||||


Leave A Comment