Задание 4 ЕГЭ по химии 2023: теория и практика
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 60%
Ответом к заданию 4 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
Из предложенного перечня выберите два соединения, которые имеют немолекулярное строение.
- $Na_2S$
- $Na_2Se$
- $H_2S$
- $H_2Se$
- $H_2O$
Запишите в поле ответа номера выбранных соединений.
Решение
Немолекулярным строением обладают вещества, имеющие в своём составе ионы или отдельные атомы. Из предложенных веществ ионное строение имеют две соли – сульфид натрия $({Na_2S$) и селенид натрия ($Na_2Se$).
Ответ: 12
Показать решение
Бесплатный интенсив
Задача 2
Из предложенного перечня выберите два соединения, в которых присутствует донорно-акцепторная связь.
- $K_2HPO_4$
- $(NH_4)_2HPO_4$
- $Na_3PO_4$
- $PH_3$
- $K_2[Zn(OH)_4]$
Запишите в поле ответа номера выбранных соединений.
Решение
Донорно-акцепторные связи образовывает азот в катионе аммония, выбираем 2 вариант, а также комплексы образуются с помощью донорно-акцепторных связей, выбираем 5.
Ответ: 25
Показать решение
Бесплатный интенсив
Задача 3
Из предложенного перечня выберите два вещества, имеющих немолекулярное строение, в которых присутствует ионная связь.
- $H_3NCH_2COO$
- $SiO_2$
- $H_2O$
- $Ca(HCO_3)_2$
- HBr
Запишите в поле ответа номера выбранных веществ.
Решение
Немолекулярное строение имеют вещества с атомной, ионной или металлической решеткой. Молекулярное строение — с молекулярной решеткой (это номера 3 и 5, сразу их выкидываем).
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 4
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная связь.
- $H_2O$
- NaBr
- $Na_2O_2$
- HF
- $P_4$
Запишите в поле ответа номера выбранных соединений.
Решение
Ковалентная неполярная связь возникает между двумя одинаковыми атомами, они есть только в молекулах $P_4$ и $Na_2O_2$, поскольку в перекисях есть кислородная группировка -O-O-.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 5
Из предложенного перечня выберите два соединения, в которых присутствуют только ковалентные полярные связи.
- $CH_3COONH_4$
- $HClO_3$
- $CuSO_4$
- $NO_2$
- $NH_4Cl$
Запишите в поле ответа номера выбранных соединений.
Решение
Ковалентные полярные связи присутствуют в соединениях между неметаллами с разными значениями электроотрицательности, но следует помнить, что соединения аммония являются солями, то есть имеют ионное строение. Вещества, состоящие из различных неметаллов представлены под номерами 2 ($HClO_3$) и 4 ($NO_2$). Все атомы кислорода в этих соединениях связаны с атомами других элементов.
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 6
1) N 2) Be 3) B 4) Al 5) P
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях с донорно-акцепторной связью могут проявлять степень окисления –3. Запишите в поле ответа номера выбранных элементов.
Решение
Из указанных элементов только три могут проявлять отрицательные степени окисления, так как остальные – металлы.
Ответ: 15
Показать решение
Бесплатный интенсив
Задача 7
Из предложенного перечня выберите два вещества, которые имеют молекулярное строение.
- $HCOONH_4$
- $Mg_3(PO_4)_2$
- $CH_4$
- $FeBr_3$
- $CH_3CONH_2$
Запишите в поле ответа номера выбранных веществ.
Решение
Почти все органические вещества имеют молекулярное строение. Соли, даже органические, имеют немолекулярное строение, так как в них ионы. Молекулярные также почти все соединения неметаллов.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 8
Из предложенного перечня выберите два соединения, в которых присутствует ионная связь.
- $C_6H_5OH$
- $NH_4H_2PO_4$
- $P_2O_5$
- $CH_3CONH_2$
- $C_2H_5COONa$
Запишите в поле ответа номера выбранных соединений.
Решение
Для ионных связей надо сначала искать соли, потому что в них есть катионы и анионы, так что мы сразу можем выбрать дигидрофосфат аммония и пропионат натрия.
Ответ: 25
Показать решение
Бесплатный интенсив
Задача 9
Из приведённого списка выберите два ряда веществ, в которых каждое вещество имеет немолекулярное строение.
- W и Ni
- $С_2H_5ONa$ и $C_{17}Н_{33}COOH$
- SiC и C (алмаз)
- $Li_2CО_3$ и $HIO_3$
- HCl и $К_2SO_4$
Запишите в поле ответа номера выбранных рядов веществ.
Решение
Немолекулярными веществами являются вещества с атомной, ионной или металлической кристаллическими решетками. Сразу выделяем алмаз и SiC — это атомные решетки, а также никель и вольфрам с металлической решеткой.
Ответ: 13
Показать решение
Бесплатный интенсив
Задача 10
Из предложенного перечня выберите два вещества, имеющих немолекулярное строение, в которых присутствует несколько типов химической связи.
- $SiO_2$
- $N_2O_4$
- LiOH
- KCl
- $CH_3ONa$
Запишите в поле ответа номера выбранных веществ.
Решение
Немолекулярными веществами являются вещества, имеющие ионные связи или атомное строение (а так же металлы). Таких здесь 3, но $SiO_2$ имеет лишь один тип связи, что не удовлетворяет всем требованиям задания.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 11
Из предложенного перечня выберите два вещества, в которых отсутствует ионная связь.
- $NaHCO_3$
- $NH_4H_2PO_4$
- $NH_3$
- $H_2N–CH_2–COOH$
- $PCl_5$
Запишите в поле ответа номера выбранных соединений.
Решение
Ионная связь присутствует в солях, кислотах и гидроксидах, но в строчке 3 и 5 находятся вещества, которые не относятся к данным соединениям.
Ответ: 35
Показать решение
Задача 12
Из предложенного перечня выберите два соединения, имеющих немолекулярное строение, в которых присутствует ионная связь.
- CaH2
- C (алмаз)
- HClO4
- PH4Cl
- NH3
Запишите в поле ответа номера выбранных соединений.
Решение
Под строением вещества (молекулярным или немолекулярным) понимают, из каких частиц (либо из молекул, либо из атомов, либо из ионов) построена кристаллическая решётка этого вещества. Немолекулярное строение имеют все вещества с ионными или металлическими связями, а также вещества с ковалентными связями и высокой температурой плавления (кипения). –$ в хлориде фосфония — ионная. Вещество имеет немолекулярное строение.
–$ в хлориде фосфония — ионная. Вещество имеет немолекулярное строение.
Вывод: ответ правильный. Оставшийся вариант рассматривать не будем.
Ответ: 14
Показать решение
Задача 13
Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная химическая связь.
- CaCl2
- NCl3
- ICl3
- KCl
- CuCl2
Запишите в поле ответа номера выбранных соединений.
Решение
Ковалентные связи образуются между атомами неметаллов (H–Cl, N–H, P–O…).
Хлор — неметалл, и он будет образовывать ковалентные связи с другими неметаллами. К неметаллам относятся азот (ответ — 2) и йод (ответ — 3).
Ответ: 23
Показать решение
Бесплатный интенсив
Задача 14
Из предложенного перечня выберите два вещества, которые имеют молекулярное строение.
- Ba(OH)2
- Mg(NO3)2
- C3H7OH
- Na2CO3
- NH3
Запишите в поле ответа номера выбранных веществ.
Решение
1) Барий (Ba) — металл, кислород (O) — неметалл, водород (H) — неметалл; связь O–H — ковалентная полярная, связь между катионами бария и гидроксид-ионами — ионная. $Ba(OH)_2$ является осно вным гидроксидом металла. Осно вные и амфотерные гидроксиды всех металлов имеют ионное, т. е. немолекулярное, строение.
Вывод: $Ba(OH)_2$ имеет немолекулярное строение.
2) Магний (Mg) — металл, азот (N) — неметалл, кислород (O) — неметалл; связь N–O — ковалентная полярная, связь между катионами магния и группами –$NO_3$ (Mg–O) — ионная. $Mg(NO_3)_2$ относится к классу солей. Все соли имеют ионное, т. е. немолекулярное, строение.
Вывод: $Mg(NO_3)_2$ имеет немолекулярное строение.
3) Углерод (C) — неметалл, водород (H) — неметалл, кислород (O) — неметалл; связь С–H — ковалентная полярная, связь C–O — ковалентная полярная, связь O–H — ковалентная полярная.
Вывод: $C_3H_7OH$ имеет молекулярное строение.
4) Натрий (Na) — металл, углерод (С) — неметалл, кислород (O) — неметалл; связь С–O — ковалентная полярная, связь между катионами натрия и группами –$СO_3$ (Na–O) — ионная. $Na_2CO_3$ относится к классу солей. Все соли имеют ионное, т. е. немолекулярное, строение.
Вывод: $Na_2CO_3$ имеет немолекулярное строение.
5) Азот (N) — неметалл, водород (H) — неметалл; связь N–H — ковалентная полярная. Аммиак при обычных условиях — газ, т. е. имеет низкую температуру кипения и, следовательно, имеет молекулярное строение.
Вывод: $NH_3$ имеет молекулярное строение.
Ответ: 35
Показать решение
Бесплатный интенсив
Задание №2 ЕГЭ по Химии • СПАДИЛО
[su_box title=”Описание задания” style=”soft” box_color=”#c1e8cc” title_color=”#0c0a0a”]
В Задании №2 нужно расположить элементы в порядке возрастания или убывания каких-либо свойств – металлических или неметаллических, электроотрицательности, радиусов атомов.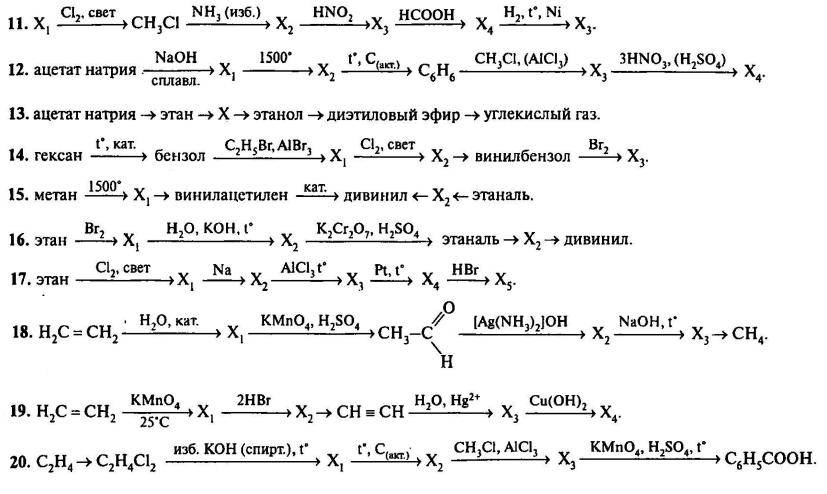
Тематика заданий: закономерности в таблице Менделеева
Вариант 2ЕХ1
[su_note note_color=”#defae6″]
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
- Sr
- F
- C
- I
- Sb
[/su_note]
Самое типичное задание – выявив элементы одного периода, расставить их в порядке возрастания или уменьшения металлических (или неметаллических) свойств. Напомню закономерности в таблице Менделеева, о которых мы писали в разборе к ОГЭ:
В периоде слева направо ⇒
| Увеличивается | Уменьшается |
|
|
Основные свойства соединений (оксидов, гидроксидов) уменьшаются, сменяются амфотерными, кислотные свойства (оксидов, кислородных кислот) увеличиваются.
В группе сверху вниз ⇓
| Увеличивается | Уменьшается |
|
|
Основные свойства соединений (оксидов, гидроксидов) увеличиваются, кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются;
Не меняется число валентных электронов и степень окисления химических элементов в одной группе.
После прочитанного выше легко найти ответ, просто найдем элементы одного периода:
Определяем, что это стронций, сурьма и йод. Далее нам нужно расставить их в порядке возрастания металлических свойств, значит справа налево – йод – сурьма – стронций!
Далее нам нужно расставить их в порядке возрастания металлических свойств, значит справа налево – йод – сурьма – стронций!
Ответ: 415
Вариант 2ЕХ2
[su_note note_color=”#defae6″]
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения радиуса атома.
- Br
- O
- Se
- F
- Li
[/su_note] Находим элементы одного периода: А далее вспоминаем закономерность о радиусах – радиус в периоде увеличиваетсясправа налево: Значит, наш ответ – фтор – кислород – литий. Ответ: 425
Вариант 2ЕХ3
[su_note note_color=”#defae6″]
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения основных и увеличения кислотных свойств высшего гидроксида.
- C
- Be
- Mg
- S
- P
[/su_note]
В данном варианте вспоминаем свойства гидроксидов – типичные основания у нас в начале периода – а типичные кислоты – в конце, поэтому…
Строго говоря, говорить о гидроксидах фосфора и серы как о гидроксидах нельзя, так как они их просто не образуют, но в данных заданиях под гидроксидами подразумеваются соединения-продукты взаимодействия высших оксидов с водой, поэтому, конечно, в начале периода идут типичные основные гидроксиды, а в конце – кислотные. Магний – фосфор – сера.
Ответ: 354
Мы разобрали хоть и всего три примера, но они покрывают необходимые знания, главное – запомните, пожалуйста, теорию к данному заданию! 😉
Даниил Романович | Просмотров: 8.4k
Химия с отличием | Класс химии мистера Круга
Неделя 17 Задания – 1–5 мая 2023 г.- Задание 1.
 В понедельник мы рассмотрим учебное пособие, которое вы выполнили на занятии в пятницу. Мы ответим на несколько практических вопросов, чтобы подготовить вас к тесту по химии растворов. Если вы не на занятиях в понедельник, вы можете поработать над этими практическими вопросами здесь. (Игровой PIN-код: 07993001 )
В понедельник мы рассмотрим учебное пособие, которое вы выполнили на занятии в пятницу. Мы ответим на несколько практических вопросов, чтобы подготовить вас к тесту по химии растворов. Если вы не на занятиях в понедельник, вы можете поработать над этими практическими вопросами здесь. (Игровой PIN-код: 07993001 ) - Задание 2. Во вторник учащиеся сдают Тест 14 по химии растворов.
- Задание 3. В среду учащиеся начнут использовать местные климатические данные Национальной метеорологической службы для анализа климатических закономерностей за последнее столетие.
- Задание 4. В четверг учащиеся продолжат проект по исследованию климата, который они начали раньше, и придут к некоторым выводам о местном климате.
- Задание 5 – Пятница будет использоваться в качестве рабочего дня. Учащиеся, которым необходимо составить тесты, викторины или другие задания из текущей оценочной четверти, ДОЛЖНЫ выполнить их не позднее сегодняшнего дня.

- Задача 1 — понедельник , учащиеся сдадут свою завершенную лабораторию Эксперимента 8. отчет. Затем загрузите пакет пошаговых заметок для курса «Химия растворов — модуль 14». После этого вам нужно посмотреть это 12-минутное видео на YouTube, посвященное словарю химии растворов и различным типам растворов.
- Задание 2. В вторник найдите время, чтобы просмотреть, как рассчитать молярность. Затем загрузите Solution Chemistry — Problem Set 1 и завершите ее. Это будет в начале урока в среду.
- Задание 3. В среду посмотрите этот 19-минутный видеоурок о правилах растворимости и важных применениях растворимости. Делайте заметки во время просмотра.
- Задача 4. В четверг выполните это практическое онлайн-задание, которое поможет вам изучить правила растворимости.
 Вы можете использовать свои записи, чтобы помочь вам. Если вы недовольны своей оценкой онлайн-задания, попробуйте еще раз. Когда вы закончите свое онлайн-задание, вы выполните практическое задание по правилам растворимости на бумаге (вы должны получить бумажное задание от г-на Круга).
Вы можете использовать свои записи, чтобы помочь вам. Если вы недовольны своей оценкой онлайн-задания, попробуйте еще раз. Когда вы закончите свое онлайн-задание, вы выполните практическое задание по правилам растворимости на бумаге (вы должны получить бумажное задание от г-на Круга). - Задание 5. В Friday посмотрите вторую половину этого видео, в котором обсуждается важность правил растворимости, а также три отдельных способа изменения растворимости твердых веществ или газов в растворителе. После просмотра скачайте Solution Chemistry — Problem Set 2 и выполните задание.
- Задание 1 – В понедельник мы исправим Химию решений – набор задач 2 в классе. Затем посмотрите это 12-минутное видео об основах кислот и оснований.
- Задание 2. В вторник посмотрите это 8-минутное видео о шкале pH и о том, как определить pH раствора.
 Когда вы закончите просмотр видео, загрузите Solution Chemistry – Problem Set 3 и выполните задание. Для выполнения задания вам понадобится научный калькулятор.
Когда вы закончите просмотр видео, загрузите Solution Chemistry – Problem Set 3 и выполните задание. Для выполнения задания вам понадобится научный калькулятор. - Задание 3. В среду мы исправим набор задач 3 в классе. Затем пройдите этот открытый тест на заметки по концепции pH. Для выполнения задания вам понадобится научный калькулятор.
- Задание 4 – В Четверг мы посмотрим это видео о применении химии растворов.
- Задание 5. В пятницу загрузите учебное пособие по тесту 14, которое поможет вам подготовиться к следующему тесту по химии растворов. Ваш тест будет во вторник на следующей неделе.
Если вам нужен студенческий договор о безопасности, воспользуйтесь этой ссылкой!
Если вам нужна ионная карта, воспользуйтесь этой ссылкой!
Ресурсы для студентов-химиков с отличием
- Контракт о безопасности учащихся – будет использоваться для всех экспериментов
- Глава 1.
 Химия как центральная наука
Химия как центральная наука - Глава 2 – Измерение в химии
- Глава 3 – Атомы и периодическая таблица
- Глава 4 – Электроны
- Глава 5 – Кинетическая теория и крот
- Глава 6 – Склеивание и химические соединения
- Глава 7 – Ядерная химия
- Глава 8 – Молекулярная форма
- Глава 9– Свойства газов
- Глава 10 – Состояние вещества
- Глава 11 – Химические реакции
- Глава 12 – Математика сбалансированных уравнений
- Глава 13 – Энергия реакций
- Глава 14 – Химия растворов
- Глава 15 – Заключительный экзамен
Используйте эти карточки Quizlet для подготовки ко ВТОРОМУ тесту по элементам и символам (элементы 21–40)
Используйте эти карточки Quizlet для подготовки к первому тесту по элементам и символам (элементы 1–20)
Вот несколько карточек для практики перед первой викториной «Полиатом».
Подумайте о выборе курса естествознания на следующий год. Откройте эту ссылку, чтобы получить дополнительные рекомендации по выбору классов на следующий год. Если у вас есть A, B или C по химии с отличием, вам, вероятно, нужно сдать либо физику с отличием, либо AP Physics в следующем году. Если у вас D или F по химии, вам, вероятно, следует вместо этого сдавать Integrated Science II.
Откройте эту ссылку, чтобы получить дополнительные рекомендации по выбору классов на следующий год. Если у вас есть A, B или C по химии с отличием, вам, вероятно, нужно сдать либо физику с отличием, либо AP Physics в следующем году. Если у вас D или F по химии, вам, вероятно, следует вместо этого сдавать Integrated Science II.
- Вам нравится химия?
- Вы набрали хотя бы пятерку или четверку по химии с отличием?
- Планируете ли вы заняться какой-либо наукой или областью, связанной со здоровьем? (сестринское дело, доврачебное дело, аптека, физиотерапия и т. д.)
Если вы ответили утвердительно хотя бы на два из вышеперечисленных вопросов, вам необходимо сдавать курс AP Chemistry в следующем году. AP Chem является эквивалентом первых двух семестров университетского курса химии и является обязательным для всех, кто занимается наукой или медициной. Не позволяйте себе отставать от своих сверстников в колледже; возьми АП Хим!
Нравится:
Нравится Загрузка. ..
..
Чем занимается химик?
Химики исследуют свойства материи на уровне атомов и молекул. Они измеряют пропорции и скорость реакции, чтобы понять незнакомые вещества и их поведение или создать новые соединения для использования в различных практических приложениях. Для этого они используют широкий спектр аналитических методов и приборов, включая хроматографию и спектроскопию.
На чем специализируются химики?
Химики обычно специализируются на биохимии, нейрохимии, ядерной химии или теоретической химии. В фармацевтической промышленности химики разрабатывают лекарства и изучают их свойства, чтобы определить качество и стабильность лекарств. Некоторые химики даже работают в криминалистике, чтобы установить доказательства в уголовных расследованиях. Опытные химики также участвуют в подготовке документации для лицензий на продукцию.
Какая квалификация мне нужна?
Для работы химиком требуется степень бакалавра и, как правило, степень доктора философии. Химикам необходимы всесторонние знания в области математики и физики, а также биологии, потому что они часто работают совместно в межфункциональных командах, и существует много совпадений с другими научными областями, такими как медицина, радиология и инженерные дисциплины. Химики должны обладать высокой технической квалификацией и строго соблюдать процедуры, а также требования по охране труда и технике безопасности. Они также должны иметь возможность интерпретировать данные, а также отличные навыки письма, чтобы сообщать о научных результатах и представлять свои выводы для экспертной оценки.
Химикам необходимы всесторонние знания в области математики и физики, а также биологии, потому что они часто работают совместно в межфункциональных командах, и существует много совпадений с другими научными областями, такими как медицина, радиология и инженерные дисциплины. Химики должны обладать высокой технической квалификацией и строго соблюдать процедуры, а также требования по охране труда и технике безопасности. Они также должны иметь возможность интерпретировать данные, а также отличные навыки письма, чтобы сообщать о научных результатах и представлять свои выводы для экспертной оценки.
Все химики работают с простыми формами материи, чтобы лучше понять само химическое вещество, раскрыть элементы незнакомых веществ или создать совершенно новые химические соединения для использования в различных областях.
Химики обычно специализируются на одной из поддисциплин химии, наиболее известными из которых являются биохимия, нейрохимия, ядерная химия и теоретическая химия.

 В понедельник мы рассмотрим учебное пособие, которое вы выполнили на занятии в пятницу. Мы ответим на несколько практических вопросов, чтобы подготовить вас к тесту по химии растворов. Если вы не на занятиях в понедельник, вы можете поработать над этими практическими вопросами здесь. (Игровой PIN-код: 07993001 )
В понедельник мы рассмотрим учебное пособие, которое вы выполнили на занятии в пятницу. Мы ответим на несколько практических вопросов, чтобы подготовить вас к тесту по химии растворов. Если вы не на занятиях в понедельник, вы можете поработать над этими практическими вопросами здесь. (Игровой PIN-код: 07993001 )
 Вы можете использовать свои записи, чтобы помочь вам. Если вы недовольны своей оценкой онлайн-задания, попробуйте еще раз. Когда вы закончите свое онлайн-задание, вы выполните практическое задание по правилам растворимости на бумаге (вы должны получить бумажное задание от г-на Круга).
Вы можете использовать свои записи, чтобы помочь вам. Если вы недовольны своей оценкой онлайн-задания, попробуйте еще раз. Когда вы закончите свое онлайн-задание, вы выполните практическое задание по правилам растворимости на бумаге (вы должны получить бумажное задание от г-на Круга).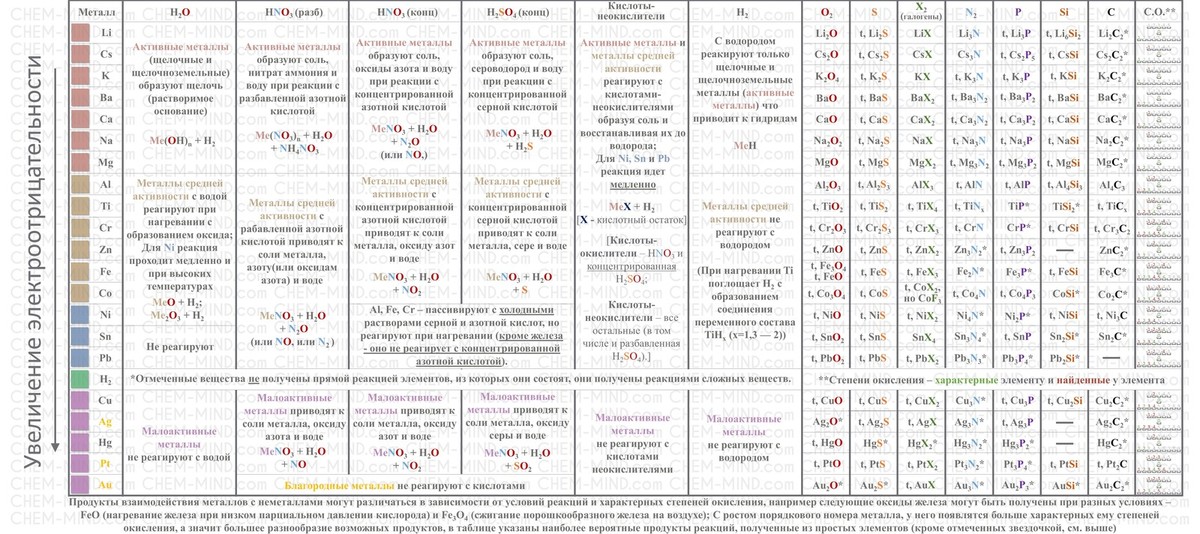 Когда вы закончите просмотр видео, загрузите Solution Chemistry – Problem Set 3 и выполните задание. Для выполнения задания вам понадобится научный калькулятор.
Когда вы закончите просмотр видео, загрузите Solution Chemistry – Problem Set 3 и выполните задание. Для выполнения задания вам понадобится научный калькулятор. Химия как центральная наука
Химия как центральная наука
Leave A Comment