Твердый оксид — углерод — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Твердый оксид углерода ( IV) называют сухим льдом. [1]
Различие в строении решеток твердого оксида углерода ( IV) и оксида кремния ( IV) и обусловливает различие их свойств. Решетка твердого СО2 — молекулярная, слагается из слабосвязанных молекул. Атомные решетки, состоящие из атомов кремния, связанных друг с другом через кислород, отличаются значительной прочностью, что и обусловливает его нелетучесть и, как следствие — большое распространение кремнезема в земной коре. На долю свободного SiO2 приходится 12 % от всей массы земной коры. На долю же кремния и кислорода ( в виде силикатов) в горных породах приходится около 43 % от массы земной коры. [2]
| Кристаллическая решетка иода.| Схематическое изображение металлической решетки. [3] |
Примерами веществ с молекулярной решеткой в неорганической химии являются лед,  Большинство кристаллических органических соединений имеют молекулярную решетку.
[4]
Большинство кристаллических органических соединений имеют молекулярную решетку.
[4]
Переход вещества из твердого состояния в газообразное ( минуя жидкое) называется сублимацией ( от латинского слова суб-лимо — возношу) или возгонкой, обратный процесс называется десублимацией. Сразу в газообразное состояние ( минуя жидкое) переходит и так называемый сухой лед ( твердый оксид углерода ССЬ), который можно увидеть в контейнерах для хранения и транспортировки мороженого. Все запахи, которыми обладают твердые тела ( например, нафталин), также обусловлены возгонкой: вылетая из твердого тела, молекулы образуют над ним газ ( или пар), который и вызывает ощущение запаха. [5]
| Прохождение луча через истинный и коллоидный растворы. [6] |
В больших масштабах осуществляется гидролиз древесины. Растущая быстрыми темпами гидролизная промышленность вырабатывает из непищевого сырья ( древесины, хлопковой шелухи, подсолнечной лузги, соломы, кукурузной кочерыжки) ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкозу,  [7]
[7]
В больших масштабах осуществляется гидролиз древесины. Растущая быстрыми темпами гидролизная промышленность вырабатывает из непищевого сырья ( древесины, хлопковой шелухи, подсолнечной лузги, соломы, кукурузной кочерыжки) ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкозу, твердый оксид углерода ( IV), фурфурол, метиловый спирт, лигнин и многие другие. [8]
В жидком состоянии хранится и транспортируется в стальных баллонах. При открывании вентиля баллона жидкий оксид углерода ( IV) испаряется, в результате чего происходит сильное охлаждение и часть газа переходит в снегообразную массу.
В жидком состоянии хранится и транспортируется в стальных баллонах. При открывании вентиля баллона жидкий оксид углерода ( IV) испаряется, в результате чего происходит сильное охлаждение и часть газа переходит в снегообразную массу. Твердый оксид углерода ( IV) называют сухим льдом.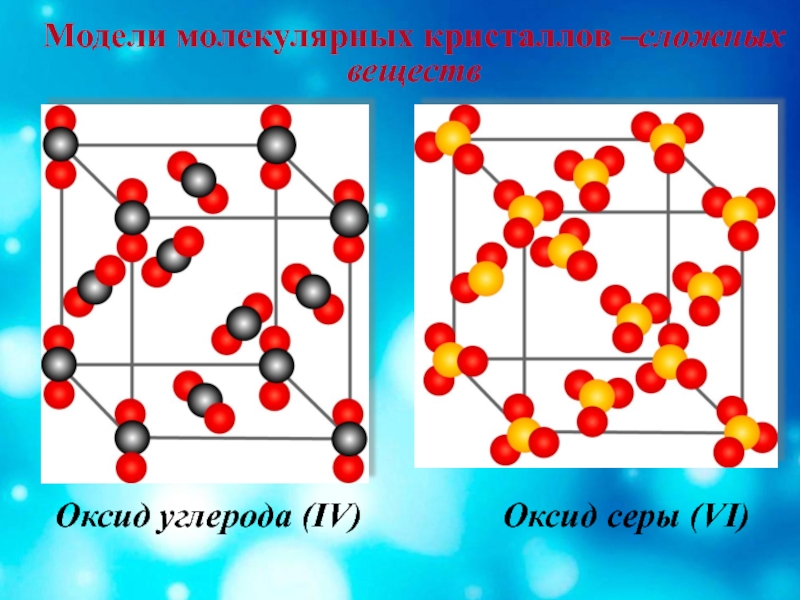
Жидкий угольный ангидрид ( плотность 774 кг / м3) хранят и перевозят в стальных баллонах. Твердый оксид углерода ( IV) способен сублимироваться ( превращаться в пар, минуя жидкое состояние), он образует сухой лед, который применяют, например, при перевозке скоропортящихся продуктов. [11]
В жидком состоянии хранится и транспортируется в стальных баллонах. При открывании вентиля баллона жидкий оксид углерода ( IV) испаряется, в результате чего происходит сильное охлаждение и часть газа переходит в снегообразную массу. Твердый оксид углерода ( IV) называют сухим льдом. [12]
Согласно современным представлениям, из молекул состоят вещества в газообразном и парообразном состояниях. В жидком состоянии из молекул состоят только те вещества, которые находятся не в ассоциированном состоянии; в твердом же состоянии из молекул состоят лишь те вещества, которые имеют молекулярную структуру. К ним относятся органические соединения и небольшое количество неорганических веществ ( например: кристаллический йод,  .. К ним относятся: металлы, оксиды, сульфиды, карбиды и многие другие соединения.
[13]
.. К ним относятся: металлы, оксиды, сульфиды, карбиды и многие другие соединения.
[13]
Он известен также под названием углекислый газ. При пониженной температуре или повышенном давлении СО2 легко переходит в жидкое и твердое состояние.
Кристаллические решетки, состоящие из молекул ( полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число веществ с молекулярной решеткой в неорганической химии невелико. Примерами их являются лед,  Молекулярная кристаллическая решетка иода представлена на рис. 1.22. Большинство кристаллических органических соединений имеют молекулярную решетку.
[15]
Молекулярная кристаллическая решетка иода представлена на рис. 1.22. Большинство кристаллических органических соединений имеют молекулярную решетку.
[15]
Страницы: 1 2
Алмаз. Графит. Оксиды углерода. Угольная кислота и ее соли
Билет № 18
1. Углерод: положение этого химического элемента в периодической системе, строение его атома. Алмаз. Графит. Оксиды углерода, их принадлежность к подклассам оксидов. Угольная кислота и ее соли
Положение в периодической системе: углерод находится во 2 периоде, IV группе, главной (А) подгруппе.
Атомный номер углерода 6, следовательно, заряд ядра атома равен +6, число электронов 6. Два электронных уровня (равно периоду), на внешнем уровне 4 электрона (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
6C ) )
2 4
Ядро атома углерода 12C содержит 6 протонов (равно заряду ядра) и 6 нейтронов (атомная масса минус число протонов: 12 − 6 = 6).
Углерод как простое вещество образует две аллотропные модификации: графит и алмаз.
Алмаз — прозрачные бесцветные кристаллы. У алмаза атомная кристаллическая решетка. Каждый атом в кристаллической решетке алмаза соединен ковалентными связями с четырьмя соседними атомами, так что кристалл алмаза поэтому сравнивают с единой молекулой. Атомные кристаллические решетки обладают большой прочностью: алмаз — самое твердое из природных веществ. Мелкие алмазы используют для бурения горных пород, в стеклорезах. Алмазный порошок используется для шлифовки драгоценных камней. Огранённые алмазы называются бриллиантами.
Графит — темно-серое вещество со слабым металлическим блеском. Кристалл графита состоит из слоев, в которых атомы связаны ковалентными связями. Связь между слоями обладает свойствами металлической связи (т. е. электроны принадлежат всем атомам). Поэтому графит проводит электрический ток. Слои графита слабо связаны: расслаиваются и скользят относительно друг друга, поэтому графит применяется в простых карандашах и в графитовой смазке.
Сажу, древесный уголь, кокс рассматривают как аморфную (состоящую из мелких частиц) разновидность графита.
Сажа используется как наполнитель для черной резины, получения черной краски. Древесный уголь в виде порошка применяется в противогазах, таблетках и фильтрах для воды, т. к. поглощает, адсорбирует на своей поверхности различные примеси, вредные вещества. Кокс в металлургии применяется для выплавки чугуна. Угольные (графитовые) стержни применяются в качестве электродов.
Углеродом образованы также графен, лонсдейлит, карбин, фуллерит.
Графит сгорает в кислороде с образованием оксида углерода (IV), или углекислого газа:
C + O2 = CO2
При высокой температуре этот оксид реагирует с раскаленным углем, получается оксид углерода (II) — угарный газ:
CO2 + C = 2CO
Угарный газ горит голубоватым пламенем:
2CO + O2 = 2CO2
Угарный газ чрезвычайно ядовит, так как соединяется с гемоглобином крови, делая невозможным перенос кровью кислорода.
Углекислый газ необходим растениям для фотосинтеза. Считается одним из «главных виновников» парникового эффекта, способствующего потеплению климата. Замороженный углекислый газ — сухой лёд — при нагревании испаряется, минуя жидкую фазу и поглощая много тепла, поэтому используется в тележках с мороженым и т. п. для сохранения низкой температуры.
Оба этих оксида являются кислотными, т. е. реагируют со щелочами с образованием солей. Углекислый газ реагирует с известью, получается карбонат кальция:
CO2 + Ca(OH)2 = CaCO3 + H2O
Оксид углерода (II) иногда относят к несолеобразующим оксидам, но он реагирует при нагревании с гидроксидом натрия с образованием соли — формиата натрия:
CO + NaOH = HCOONa (эти реакции не для запоминания! Изучаются в 10–11 классах)
Ему соответствует муравьиная кислота HCOOH, и он может быть получен из нее при нагревании с концентрированной серной кислотой (отнимает воду):
HCOOH = CO↑ + H2O
Углекислому газу соответствует угольная кислота H2CO3 — слабая, существует только в растворе.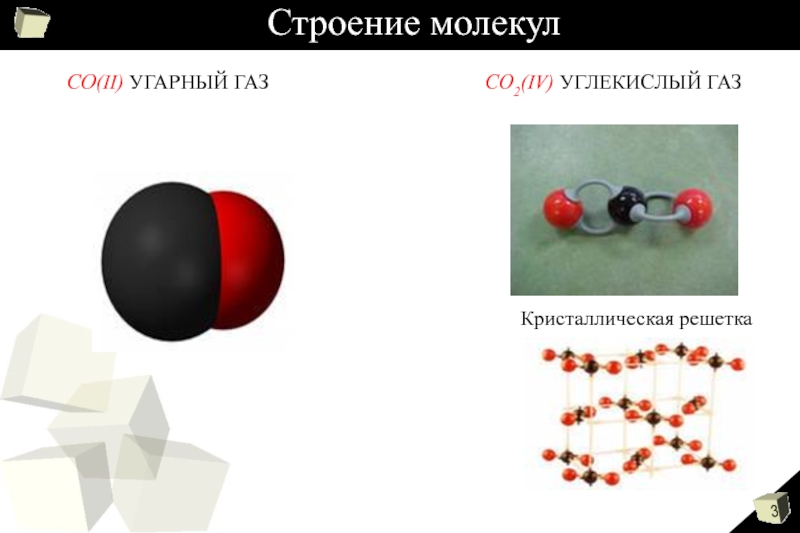 Ее соли — карбонаты. Карбонат кальция широко встречается в природе в виде мела, известняка, мрамора. Применяется в строительстве: известняк в виде щебня и для кладки стен, мел как наполнитель, мрамор для облицовки зданий, станций метрополитена. Обжигом мела и известняка получают жженую известь CaO:
Ее соли — карбонаты. Карбонат кальция широко встречается в природе в виде мела, известняка, мрамора. Применяется в строительстве: известняк в виде щебня и для кладки стен, мел как наполнитель, мрамор для облицовки зданий, станций метрополитена. Обжигом мела и известняка получают жженую известь CaO:
CaCO3 = CaO + CO2↑
Карбонат натрия Na2CO3 — сода — обладает щелочной реакцией раствора. Применяется для стирки, смягчения жёсткой воды. Гидрокарбонат натрия NaHCO3 — питьевая сода — для мытья посуды, нейтрализации кислоты, попавшей на кожу. В составе теста в качестве разрыхлителя.
Питьевая сода разлагается при нагревании с выделением углекислого газа, но лучше добавлять к соде лимонную кислоту:
NaHCO3 + H+ = Na+ + H2O + CO2↑
2. Опыт. Распознавание раствора соли соляной (хлороводородной) кислоты среди трех предложенных растворов
Качественная реакция на хлорид-ион — при сливании с раствором соли серебра, образуется белый творожистый осадок, нерастворимый в концентрированной азотной кислоте.
Добавляем во все три пробирки немного нитрата серебра. В которой выпадет белый творожистый осадок — находится соль соляной кислоты (хлорид):
AgNO3 + NaCl = NaNO3 + AgCl↓
или в ионном виде:
Ag+ + Cl− = AgCl↓
Если в одной из пробирок к тому же имеется соляная кислота (даст такой же осадок), сначала
- Делим каждый раствор на две пробирки (получаем два набора по три)
- Капаем по очереди в первые три — индикатор метилоранж или лакмус. Где покраснеет индикатор, там кислота — отмечаем эту пробирку.
- В оставшиеся две пробирки капаем нитрат серебра.
Ион серебра дает осадок со многими солями (смотрите таблицу растворимости). Чтобы творожистый характер осадка был лучше виден, не следует трясти пробирку, перемешивать растворы. При наличии хлорида осадок выпадает сразу очень заметный, похожий на простоквашу.
Если возникают сомнения, можно было бы попробовать растворить осадок в концентрированной азотной кислоте, но учащимся работать с концентрированными кислотами ЗАПРЕЩЕНО.
автор: Владимир Соколов
Кристаллическая структура тройного комплекса монооксид углерода-субстрат-цитохром P-450CAM
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронная почта: (изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Сравнительное исследование
. 1989 г., 19 сентября; 28 (19): 7586-92.
doi: 10.1021/bi00445a013.
Р Рааг 1 , TL Poulos
принадлежность
- 1 Центр передовых исследований в области биотехнологии Мэрилендского института биотехнологии, Мэрилендский университет, Роквилл 20850.
- PMID: 2611203
- DOI:
10.
 1021/bi00445a013
1021/bi00445a013
Сравнительное исследование
R Raag et al. Биохимия. .
. 1989 г., 19 сентября; 28 (19): 7586-92.
doi: 10.1021/bi00445a013.
Авторы
Р Рааг 1 , Т. Л. Пулос
принадлежность
- 1 Центр перспективных исследований в области биотехнологии Мэрилендского института биотехнологии, Мэрилендский университет, Роквилл 20850.
- PMID: 2611203
- DOI:
10.
 1021/bi00445a013
1021/bi00445a013
Абстрактный
Кристаллическая структура тройного комплекса, образованного монооксидом углерода (CO), камфорой и цитохромом железа P-450CAM, была уточнена до значения R 17,9% при разрешении 1,9-A. Чтобы разместить молекулу CO, субстрат, камфора, перемещается примерно на 0,8 А, в то же время оставаясь в несвязанном контакте с CO. Средний температурный фактор атомов камфоры примерно на 50% выше в комплексе CO, что позволяет предположить, что камфора более слабо связаны в этом тройном комплексе. Угол Fe-CO составляет около 166 градусов, и, таким образом, CO кажется отклоненным от нормали гема, как и в различных комплексах CO-глобин, из-за стерических взаимодействий с группами активных центров. Атом кислорода молекулы CO расположен в канавке, образованной необычной спиральной водородной связью в дистальной спирали между высококонсервативными остатками Thr 252 и Gly 248. При переходе от бинарного комплекса трехвалентного железа, связанного с камфорой, к тройному комплексу двухвалентного железа, связанного с камфорой, атом железа гема перемещается в плоскость, определяемую атомами азота пиррола, примерно на 0,41 Å. Хотя аксиальный лиганд Cys также перемещается в сторону гема , связь S-Fe растягивается примерно от 2,20 А в отсутствие СО до примерно 2,41 А после связывания СО.
При переходе от бинарного комплекса трехвалентного железа, связанного с камфорой, к тройному комплексу двухвалентного железа, связанного с камфорой, атом железа гема перемещается в плоскость, определяемую атомами азота пиррола, примерно на 0,41 Å. Хотя аксиальный лиганд Cys также перемещается в сторону гема , связь S-Fe растягивается примерно от 2,20 А в отсутствие СО до примерно 2,41 А после связывания СО.
Похожие статьи
Структурная основа субстрат-индуцированных изменений окислительно-восстановительного потенциала и спинового равновесия цитохрома Р-450САМ.
Рааг Р., Поулос Т.Л. Рааг Р. и др. Биохимия. 1989 г., 24 января; 28 (2): 917-22. doi: 10.1021/bi00428a077. Биохимия. 1989. PMID: 2713354
Структурные изменения цитохрома Р-450кам осуществляются за счет связывания энантиомеров (1R)-камфоры и (1S)-камфоры.

Шульце Х., Хоа Г.Х., Хелмс В., Уэйд Р.С., Юнг К. Шульце Х. и др. Биохимия. 1996 12 ноября; 35 (45): 14127-38. дои: 10.1021/bi9527303. Биохимия. 1996. PMID: 8916898
Инфракрасные исследования с преобразованием Фурье с временным разрешением комплекса монооксида углерода цитохрома P-450cam, связанного с (1R)-камфорой и (1S)-камфорным субстратом.
Концен Дж., Ристау О., Юнг С. Концен Дж. и соавт. ФЭБС лат. 1996 25 марта; 383 (1-2): 13-7. doi: 10.1016/0014-5793(96)00103-2. ФЭБС лат. 1996. PMID: 8612780
Дифференциальное поведение подсайтов активного центра цитохрома 450 при связывании субстратов и продуктов (последствия для связывания/разъединения).
Нарасимхулу С.
 Нарасимхулу С.
Биохим Биофиз Акта. 2007 март; 1770 (3): 360-75. doi: 10.1016/j.bbagen.2006.090,018. Epub 2006 5 октября.
Биохим Биофиз Акта. 2007.
PMID: 17134838
Обзор.
Нарасимхулу С.
Биохим Биофиз Акта. 2007 март; 1770 (3): 360-75. doi: 10.1016/j.bbagen.2006.090,018. Epub 2006 5 октября.
Биохим Биофиз Акта. 2007.
PMID: 17134838
Обзор.Биоорганическая химия и цитохром Р-450-зависимый катализ.
Слигар С.Г., Гелб М.Х., Хеймбрук, округ Колумбия. Слигар С.Г. и соавт. Ксенобиотика. 1984 янв-февраль;14(1-2):63-86. дои: 10.3109/00498258409151399. Ксенобиотика. 1984. PMID: 6372267 Обзор.
Посмотреть все похожие статьи
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- GM33688/GM/NIGMS NIH HHS/США
Процитируйте
Формат: ААД АПА МДА НЛМ
Отправить по номеру
В кристаллической структуре дегидрогеназы моноксида углерода обнаружен кластер [Ni-4Fe-5S]
. 2001 17 августа; 293 (5533): 1281-5.
2001 17 августа; 293 (5533): 1281-5.
doi: 10.1126/наука.1061500.
Х Доббек 1 , Светличный В., Гремер Л., Хубер Р., Мейер О.
Принадлежности
принадлежность
- 1 Макс-Планк-Институт биохимии, Abteilung Strukturforschung, Am Klopferspitz 18a, D-82152 Martinsried, Германия. [email protected]
- PMID: 11509720
- DOI: 10.1126/науч.1061500
H Доббек и соавт.
Наука. .
. 2001 17 августа; 293 (5533): 1281-5.
doi: 10.1126/наука.1061500.
Авторы
Х Доббек 1 , В. Светличный, Л. Гремер, Р. Хубер, О. Мейер
принадлежность
- 1 Макс-Планк-Институт биохимии, Abteilung Strukturforschung, Am Klopferspitz 18a, D-82152 Martinsried, Германия. [email protected]
- PMID: 11509720
- DOI: 10.1126/науч.1061500
Абстрактный
Окисление СО до СО2 катализирует гомодимерная никельсодержащая СО-дегидрогеназа анаэробной бактерии Carboxydothermus hydroformans. Кристаллическая структура восстановленного фермента была решена с разрешением 1,6 ангстрем. Эта структура представляет собой прототип Ni-содержащих СО-дегидрогеназ анаэробных бактерий и архей. Он содержит пять металлических кластеров, из которых кластеры B, B’ и субъединичный мостиковый кластер D, открытый на поверхности, представляют собой кластеры [4Fe-4S] кубанового типа. Кластеры активных центров C и C’ представляют собой новые асимметричные кластеры [Ni-4Fe-5S]. Их интегральный ион Ni, который является вероятным местом окисления CO, координируется четырьмя лигандами серы с плоскоквадратной геометрией.
Кристаллическая структура восстановленного фермента была решена с разрешением 1,6 ангстрем. Эта структура представляет собой прототип Ni-содержащих СО-дегидрогеназ анаэробных бактерий и архей. Он содержит пять металлических кластеров, из которых кластеры B, B’ и субъединичный мостиковый кластер D, открытый на поверхности, представляют собой кластеры [4Fe-4S] кубанового типа. Кластеры активных центров C и C’ представляют собой новые асимметричные кластеры [Ni-4Fe-5S]. Их интегральный ион Ni, который является вероятным местом окисления CO, координируется четырьмя лигандами серы с плоскоквадратной геометрией.
Похожие статьи
Монооксид углерода индуцировал разложение кластера активного центра [Ni-4Fe-5S] СО-дегидрогеназы.
Доббек Х., Светличный В., Лисс Дж., Мейер О. Доббек Х. и др. J Am Chem Soc.
 2004 г., 5 мая; 126 (17): 5382-7. дои: 10.1021/ja037776v.
J Am Chem Soc. 2004.
PMID: 15113209
2004 г., 5 мая; 126 (17): 5382-7. дои: 10.1021/ja037776v.
J Am Chem Soc. 2004.
PMID: 15113209Активация углекислого газа в Ni, Fe-кластере анаэробной дегидрогеназы моноксида углерода.
Чон Дж. Х., Доббек Х. Чон Дж. Х. и соавт. Наука. 2007 30 ноября; 318 (5855): 1461-4. doi: 10.1126/наука.1148481. Наука. 2007. PMID: 18048691
Энзимология. Никель на первый план.
Тауэр РК. Тауэр РК. Наука. 2001 17 августа; 293(5533):1264-5. doi: 10.1126/science.1064049. Наука. 2001. PMID: 11509713 Аннотация недоступна.
Дегидрогеназы монооксида углерода.


 1021/bi00445a013
1021/bi00445a013 1021/bi00445a013
1021/bi00445a013
 Нарасимхулу С.
Биохим Биофиз Акта. 2007 март; 1770 (3): 360-75. doi: 10.1016/j.bbagen.2006.090,018. Epub 2006 5 октября.
Биохим Биофиз Акта. 2007.
PMID: 17134838
Обзор.
Нарасимхулу С.
Биохим Биофиз Акта. 2007 март; 1770 (3): 360-75. doi: 10.1016/j.bbagen.2006.090,018. Epub 2006 5 октября.
Биохим Биофиз Акта. 2007.
PMID: 17134838
Обзор. 2004 г., 5 мая; 126 (17): 5382-7. дои: 10.1021/ja037776v.
J Am Chem Soc. 2004.
PMID: 15113209
2004 г., 5 мая; 126 (17): 5382-7. дои: 10.1021/ja037776v.
J Am Chem Soc. 2004.
PMID: 15113209
Leave A Comment