Анилин, C6H5Nh3, химические свойства, получение, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Анилин кислот
Анилин, перегнанный; уксусная кислота, ледяная.[ …]
Анилин получают восстановлением нитробензола металлическим железом в водной среде, в Присутствии небольшого количества соляной кислоты. Процесс протекает при температуре кипения. Соляная кислота или, вернее, хлористое железо, образующееся в результате воздействия соляной кислоты на железо, че принимает непосредственного участия в процессе, а только ускоряет окисление металлического железа.[ …]
Анилин, перегнанный, ч.; уксусная кислота, ледяная; едкий натр, х. ч., 20% раствор.[ …]
Черный анилин — продукт окисления анилина — применяют под названием пигмент глубоко черный. Получают его растворением анилина в соляной кислоте и окислением раствора при низкой температуре (25—50°) хромпиком в присутствии серной кислоты и медного купороса в качестве катализатора.[ …]
Чистый анилин — бесцветная маслянистая жидкость с характерным запахом. Плотность 1,022 при 20°. Температура кипения 184.4°, температура плавления—6,15°. На свету и на врздухе быстро окисляется и приобретает бурую окраску. Упругость пара 0,36 мм рт. ст. при 20°. Пары анилина в 3,2 раза тяжелее воздуха, они хорошо сорбируются всеми окружающими предметами. Анилин хорошо растворим в спирте, эфире, сероуглероде, ацетоне, бензоле, хлороформе и других органических растворителях. В 100 мл воды при 20° растворяется 3,4 г анилина. Анилин и его водные растворы обладают слабыми основными свойствами. С кислотами образует соли. Получают анилин восстановлением нитробензола (Н. Н. Ворожцов).[ …]
Плотность 1,022 при 20°. Температура кипения 184.4°, температура плавления—6,15°. На свету и на врздухе быстро окисляется и приобретает бурую окраску. Упругость пара 0,36 мм рт. ст. при 20°. Пары анилина в 3,2 раза тяжелее воздуха, они хорошо сорбируются всеми окружающими предметами. Анилин хорошо растворим в спирте, эфире, сероуглероде, ацетоне, бензоле, хлороформе и других органических растворителях. В 100 мл воды при 20° растворяется 3,4 г анилина. Анилин и его водные растворы обладают слабыми основными свойствами. С кислотами образует соли. Получают анилин восстановлением нитробензола (Н. Н. Ворожцов).[ …]
Анилинацетат. 15 мл анилина растворяют в 100 мл уксусной кислоты.[ …]
В случае применения анилина в пробу после введения уксусной кислоты вносят 0,1 мл перегнанного анилина и доводят объем раствора водой до 4,5 мл. Окрашенные в оранжевый цвет растворы фотометрируют при длине волны 490 нм и толщине слоя 1 см.[ …]
Хроматограмма анилинов и ароматических нитросоединений, полученная на колонке с неполярной фазой при использовании ТИД [5].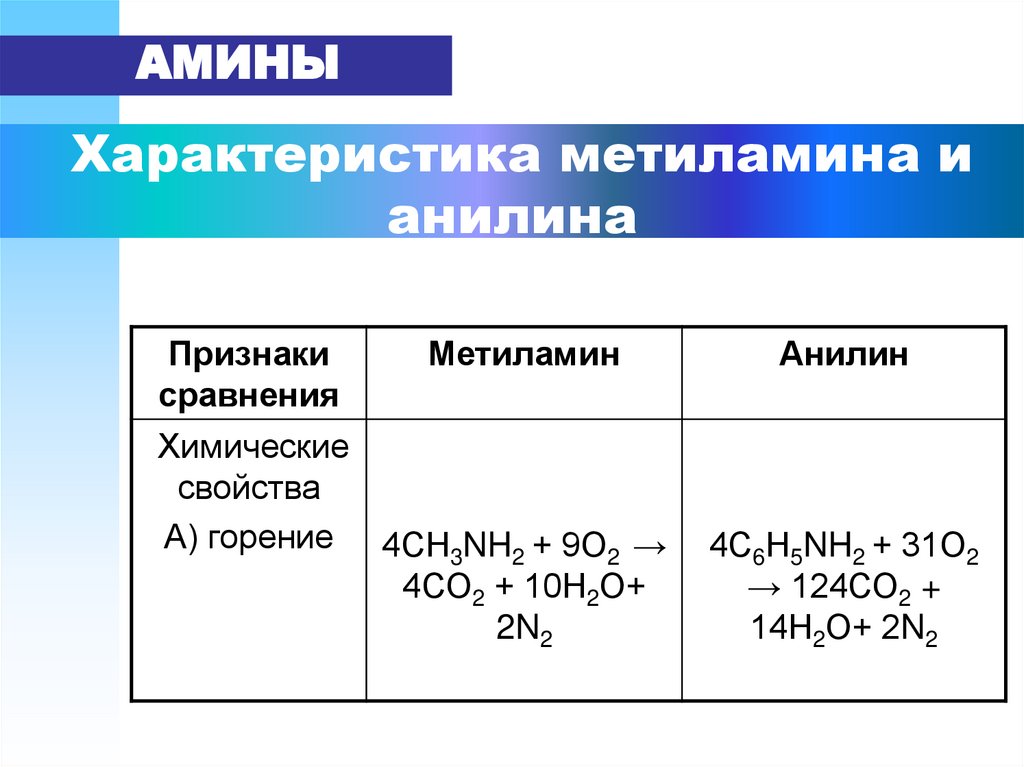 Пики Пики |
Уксуснокислый раствор анилина. К 10 мл ледяной уксусной кислоты прибавляют 1 мл анилина и перемешивают.[ …]
Принцип метода. Фурфурол с анилином в концентрированной уксусной кислоте образует продукт конденсации, окрашивающий раствор в красный цвет. Содержание форфурола определяют колориметрически по стандартной шкале.[ …]
Едкий натр, х.ч., 1 М раствор; анилин, ч.д.а.; уксусная кислота, ледяная; серная кислота, ч.д.а., 10% раствор.[ …]
Через 5 мин вносят 1 мл уксусной кислоты, 0,1 мл анилина и доводят объем раствора водой до 8 мл. Через 10—15 мин окрашенный в желтовато-оранжевый цвет раствор фотометрируют при длине волны 485—495 нм в кювете с толщиной слоя 2 см пли сравнивают интенсивность окраски со стандартной шкалой.[ …]
Определению не мешают бензойная кислота, бензол, толуол, ксилол, бутанол, анилин.[ …]
Кислотный прочный фуксиновый — из анилина и Аш-кислоты.[ …]
По охлаждении вносят 0,5 мл уксусной кислоты, 0,1 мл анилина и разбавляют смесь водой до 4 мл. [ …]
[ …]
В связи с тем что кроме определяемого анилина в воздухе ряда производств могут содержаться другие токсичные первичные амины (например, аминобензойные кислоты и т. п.), для лучшего отделения пятна анилина от пятен сопутствующих веществ изменяют хроматографическую систему. Этим достигаются для всех сопутствующих компонентов значения Р/ больше нуля: суспензию силикагеля готовят на воде, хроматографируют пропусканием вначале системы Б, затем в том же направлении системы В.[ …]
Нигрозины получают сплавлением смеси анилина, солянокислого анилина и нитробензола в присутствии железной стружки. В результате сплавления образуется основа нигрозина, нерастворимая в воде, но растворимая в спирте, анилине и т. п., так называемый спирторастворимый нигрозин. В результате обработки плава щелочью получают жирорастворимый, а серной кислотою — водорастворимый нигрозин. Строение нигрозина не выяснено.[ …]
В присутствии концентрированной уксусной кислоты фурфурол конденсируется с анилином с образованием соединения С4Н30—СН= (СбН4МНг)2, интенсивно окрашенного в красный цвет. Метилфурфурол и оксиметилфурфурол в этих условиях образуют соединения желтого цвета, практически не влияющие на оптическую плотность раствора, если последнюю измерять с желто-зелеными светофильтрами. В анализируемый раствор вводят щавелевую кислоту, двузамещенный фосфат натрия и хлорид натрия для повышения устойчивости получаемой красной окраски. Присутствие свободных минеральных кислот недопустимо. При продолжительном действии солнечного света окраска разрушается.[ …]
Метилфурфурол и оксиметилфурфурол в этих условиях образуют соединения желтого цвета, практически не влияющие на оптическую плотность раствора, если последнюю измерять с желто-зелеными светофильтрами. В анализируемый раствор вводят щавелевую кислоту, двузамещенный фосфат натрия и хлорид натрия для повышения устойчивости получаемой красной окраски. Присутствие свободных минеральных кислот недопустимо. При продолжительном действии солнечного света окраска разрушается.[ …]
Экстракцией удаляют из воды фенолы, жирные кислоты, анилин и другие органические примеси. В табл. 14 даны характеристики некоторых экстрагентов, применяемых для удаления фенолов из воды.[ …]
Примерные соотношения реагентов: 100 частей анилина, 250 частей соляной кислоты (16—17%-й), 55 частей концентрированной серной кислоты, 30 частей медного купороса и 180 частей хромпика.[ …]
В пробирку, в которую вливают 0,5 мл раствора анилина в уксусной кислоте, вносят 4 мл пробы. Содержимое пробирки тщательно перемешивают и через 10 мин измеряют оптическую плотность в кювете толщиной слоя 1 см по сравнению с контролем, который готовят одновременно и аналогично пробе. Определение производят при длине волны 530 нм.[ …]
Определение производят при длине волны 530 нм.[ …]
Сущность метода. Потенциал полуволны анилина при интегральном полярографировании +0,72 В, и-толуидина 0,66 В, при дифференциальном -)- 0,78 -¡- 0,70 В. Чувствительность определения 5 мкг в анализируемом объеме. Определению мешает бензидин.[ …]
Диметиланилин получают нагреванием до 230—240° анилина с соляной кислотой и метиловым спиртом в автоклаве под давлением около 30 атм.[ …]
В каждую пробирку добавляют по 2,5 мл ледяной уксусной кислоты и по 0,5 мл 10 %-ного анилина. После добавления каждого реактива, растворы перемешивают. Через 20 минут измеряют оптическую плотность стандартных растворов на спектрофотометре при длине волны 365 нм. Измерение проводят в кювете с толщиной слоя 10 мм по отношению к раствору сравнения не содержащему 5-нитрофурфурол (стандарт № 1 по таблице).[ …]
Колориметрическое определение по реакции фурфурола с анилином в уксусной кислоте с образованием продукта конденсации, окрашенного в красный цвет.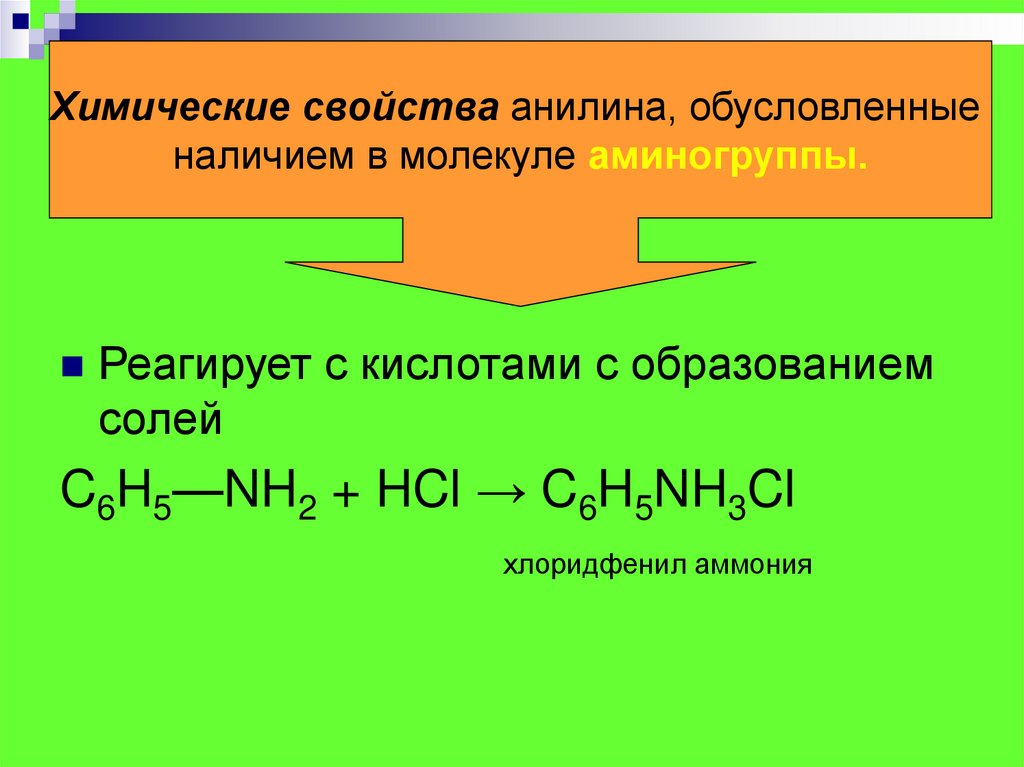 [ …]
[ …]
Составной реагент. Смешивают пиридин, ледяную уксусную кислоту и анилин в соотношении 10 : 5 : 1.[ …]
Существуют многочисленные методы определения небольших количеств анилина и других ароматических аминов посредством диазотирования азотистой кислотой, сочетания с соответствующим фенолом и фотометрирования образующегося азокрасителя.[ …]
Калибровочную кривую строят по серии растворов с содержанием 0—30 мкг анилина, растворенного до 10 мл в разбавленной соляной кислоте (25 мл кислоты плотностью 1,18 разбавляют до 1 л).[ …]
Определению не мешают циклогексанон, ОП-7, сольвент-нафта, пропионовая кислота.[ …]
Для определения пиридина в поверхностных и сточных водах предлагается колориметрический метод с бромцианом и анилином (вариант А — непосредственное измерение и вариант Б — измерение после экстракции) для концентраций от 0,03 мг!л и колориметрический метод с хлорцианом и барбитуровой кислотой для концентраций от 0,02 мг!л.[ …]
Так, например, величина стандартного изобарного потенциала реакции окисления метиламина, диметиламина, этиламина и метилнитрита до 1ч12 в два раза меньше соответствующих величин для реакции окисления до оксидов азота. [ …]
[ …]
Бесцветная маслянистая жидкость с характерным запахом, быстро темнеющая на свету, плотность при 20°С 1,022, температура кипения 184,4°С. Анилин хорошо растворим в эфире, спирте, ацетоне, бензоле, хлороформе и других органических растворителях. При 20°С 3,4 г анилина растворяются в 100 мл воды. Анилин обладает основными свойствами, с кислотами образует соли.[ …]
По нашему предположению реакция протекает следующим образом.[ …]
С помощью пероксида водорода возможна очистка сточных вод от соединений, наиболее часто встречающихся в сточных водах нефтехимических производств: поверхностно-активных веществ [85,86], фенолов [87], сероводорода [88] , органических кислот и спиртов В9] , сульфоамидов, бензтиазола, анилина [90] и др.[ …]
Соли диазония являются неустойчивыми соединениями. Они легко разлагаются при действии температуры, реакционной среды и т. д. Их устойчивость зависит от многих факторов, но в первую очередь от природы исходного амина. Включение в состав амина Ж)2-групп, увеличение молекулярного веса амина и особенно введение сульфогрупп сильно повышают устойчивость образующихся диазосоединений.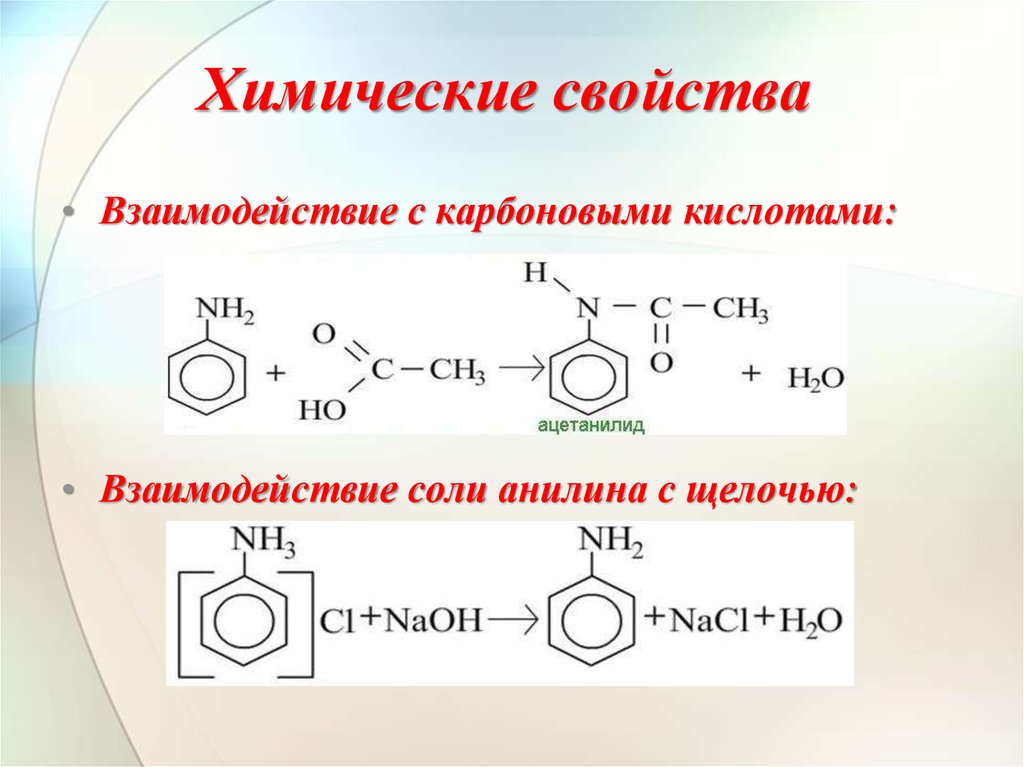 В практических .условиях диазотирование производят взаимодействием амина, ИаЫОг и соляной кислоты при 0—5°, реже при 15° и выше.[ …]
В практических .условиях диазотирование производят взаимодействием амина, ИаЫОг и соляной кислоты при 0—5°, реже при 15° и выше.[ …]
Ванадий довольно распространен в природе, но в чрезвычайно распыленном виде. Содержится также в некоторых железных рудах, нефтях и каменных углях. Его извлекают из руд обработкой их серной кислотой или сплавлением со щелочами. Феррованадаты представляют собой в основном железные соли ванадиевых кислот или смеси окислов ванадия с гидратами окислов железа. Феррованадаты применяют для получения сплавов феррованадия, ванадиевой стали и др. В своих соединениях ванадий бывает двух-, трех-, четырех- и пятивалентный. Наиболее типичными соединениями ванадия являются пятивалентные. При накаливании в токе кислорода ванадий переходит через промежуточные окислы в ванадиевый ангидрид У2Об — оранжевый или коричнево-красный порошок с температурой плавления 690°. Он хорошо растворим в щелочах, образуя ванадиевокислые соли — ванадаты, растворимые в воде. Ванадиевый ангидрид применяется как катализатор в производстве серной кислоты, взамен платины, а также при органических синтезах, в текстильных производствах при крашении и печатании черным анилином и др. Данных о вредном действии на организм металлического ванадия не имеется. Соединения ванадия вызывают изменения со стороны кровообращения, действуют раздражающе на дыхательные органы и кожу.[ …]
Данных о вредном действии на организм металлического ванадия не имеется. Соединения ванадия вызывают изменения со стороны кровообращения, действуют раздражающе на дыхательные органы и кожу.[ …]
Экстракция бутилацетатом обеспечивает близкое к 100%-ному извлечение капролактама из сточных вод различных химических производств [30]. Экстракцию бензолом широко используют при извлечении нитробензола или других нитросоединений из отработанной серной кислоты [5; 28, с. 238]. Нитробензол, в свою очередь, применяют для экстракции анилина из сточных вод производства анилина восстановлением нитробензола. Эти два процесса представляют определенный интерес, так как бензол, содержащий нитробензол, может быть направлен на нитрование, а нитробензол, содержащий анилин, использован для производства анилина. В обоих случаях отпадает стадия регенерации растворителя.[ …]
Наибольшей переработке подверглась часть книги, посвященная определению органических компонентов вод. В ней дано подробное описание метода извлечения органических веществ из воды и группового их разделения; добавлены методы определения: дитиофосфатов, гидрохинона, фенолов с применением пирамидона, пиридина—с барбитуровой кислотой и с анилином и др.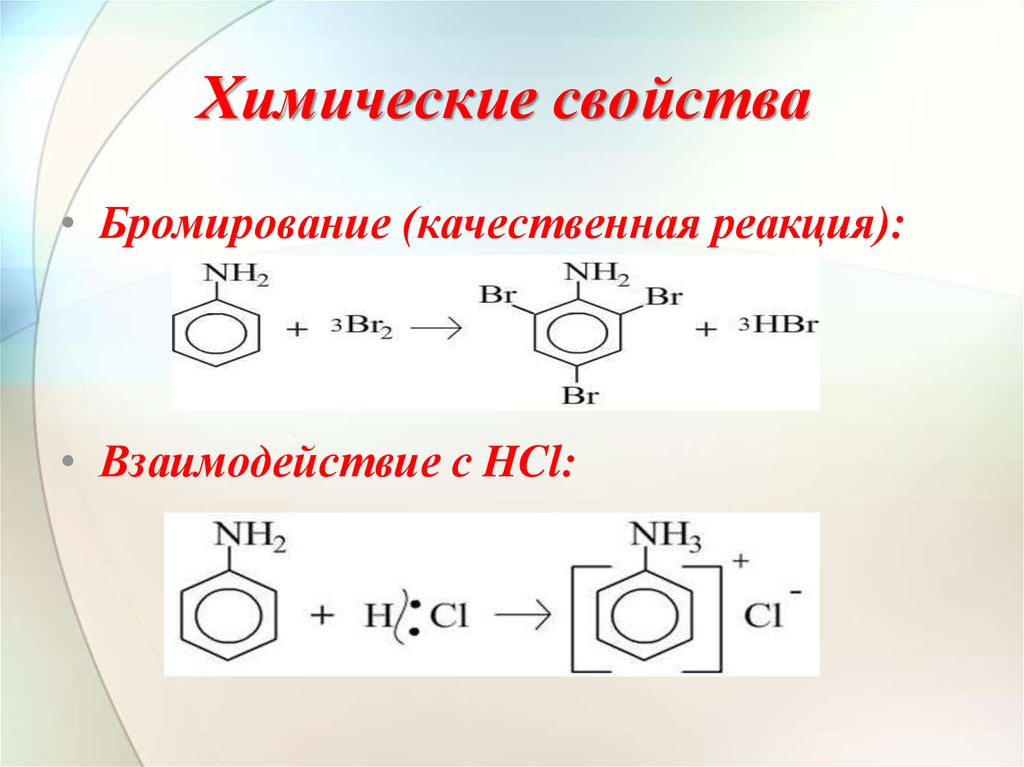 [ …]
[ …]
Определение пентахлорфенолята натрия в воздухе производственных помещений методом ТСХ (283). Определение диметилбензиламина в воздухе методом восходящей ТСХ (286). Определение этиленимина в воздухе методом «канальной» хроматографии в тонком слое (289). Определение дисперсных красителей оранжевого 4К и фиолетового 2С в воздухе производственных помещений методом ТСХ (290). Количественное определение анилина в воздухе производственных помещений методом ТСХ с использованием денситометрии (291). Определение кумарона и ин-дена в воздухе производственных помещений методом ТСХ (293). Определение фурилового спирта в воздухе методом ТСХ (296). Определение анилина в воздухе методом ТСХ (297). Определение акролеина в воздухе методом ТСХ (298). Определение пропилена в воздухе методом бумажной хроматографии (300). Определение алифатических спиртов ряда С4— Сю при их совместном присутствии методом бумажной хроматографии (301). Определение карбоновых кислот С1 — С0 в воздухе при помощи бумажной хроматографии (304). Определение ацетилена в воздухе с помощью импрегнированной хроматографической бумаги (307). Определение винилацетата в воздухе методом бумажной хроматографии (308). Определение стирола в воздухе производственных помещений методом бумажной хроматографии (310). Определение меди, кобальта и никеля в воздухе методом бумажной хроматографии (312).[ …]
Определение ацетилена в воздухе с помощью импрегнированной хроматографической бумаги (307). Определение винилацетата в воздухе методом бумажной хроматографии (308). Определение стирола в воздухе производственных помещений методом бумажной хроматографии (310). Определение меди, кобальта и никеля в воздухе методом бумажной хроматографии (312).[ …]
Органические основания вытесняются из катионита при регенерации 5%-ным раствором МНз в смеси растворителей, состоящей из 80% спирта (этилового или метилового) и 20% воды. При этом концентрация аминов в отработанных растворах может быть доведена приблизительно до 100 г!л. Из таких растворов аммиак и спирт отгоняют и используют в следующей операции регенерации, а от водной фазы отделяют извлеченные из ионообменной смолы сырые органические продукты для дальнейшей их ректификации. Подогрев регенерирующего раствора (или колонны с катионитом, отключенной на регенерацию) до температуры 35—40° С значительно ускоряет процесс отмывки органических веществ из смолы. В качестве примера на рис. 33 приведена технологическая схема ионообменной очистки сточных вод производства хлоранилина от смесей анилина с хлора-нилином. Сточная вода принимается в сборник /, куда дозируется из мерников 2 соляная кислота для понижения pH до 4—4,5. Подкисленная сточная вода насосом 18 подается на фильтр 4, где отделяется от выпавших при подкислении взвесей. Фильтрат принимается в бак 5 и со скоростью около 2 м?/м2 • ч поступает в блок последовательно включенных колонн 6, 7, 8 с общей длиной слоя загруженного в них катионита КУ-2 не менее 3 м.[ …]
В качестве примера на рис. 33 приведена технологическая схема ионообменной очистки сточных вод производства хлоранилина от смесей анилина с хлора-нилином. Сточная вода принимается в сборник /, куда дозируется из мерников 2 соляная кислота для понижения pH до 4—4,5. Подкисленная сточная вода насосом 18 подается на фильтр 4, где отделяется от выпавших при подкислении взвесей. Фильтрат принимается в бак 5 и со скоростью около 2 м?/м2 • ч поступает в блок последовательно включенных колонн 6, 7, 8 с общей длиной слоя загруженного в них катионита КУ-2 не менее 3 м.[ …]
Анилин растворяется в HCl за счет образования: A. хлорид анилина B. о-хлоранилинC. азокраситель D. диазония хлорид
Дата последнего обновления: 17 апр 2023
•
Всего просмотров: 278.1k
•
Просмотров сегодня: 6.47k
Проверено
3
.1k+ просмотров
Подсказка: Для этого В задаче нужно написать полную реакцию анилина с соляной кислотой и после образования продукта изучить его природу и свойства, чтобы выбрать правильный вариант.
Полный пошаговый ответ:
— В заданном вопросе нужно выбрать правильный продукт, образующийся при реакции анилина с соляной кислотой.
— Анилин представляет собой органическое соединение, имеющее основную природу. Молекула образуется при присоединении аминогруппы к бензольному кольцу.
— Итак, соляная кислота, как следует из названия, имеет кислую природу, поэтому, когда она будет реагировать с анилином, произойдет кислотно-щелочная реакция.
— Когда анилин растворяется в соляной кислоте, неподеленная пара, присутствующая в аминогруппе, подвергается частичной делокализации.
— Теперь амин может подвергаться протонированию соляной кислотой.
— В процессе протонирования появляется отрицательный анион кислоты и присоединяется к положительному заряду амина.
— В связи с образованием комплекса анилин будет растворяться в растворе соляной кислоты.
— Сбалансированная химическая реакция между анилином и соляной кислотой:
\[{{\text{C}}_{6}}{{\text{H}}_{5}}\text{N}{{\ text{H}}_{2}}\text{ + HCl}\to \text{ }{{\text{C}}_{6}}{{\text{H}}_{5}}\text {NH}_{3}^{+}\text{C}{{\text{l}}^{-}}\]
— Образовавшийся здесь комплекс известен как хлорид анилина.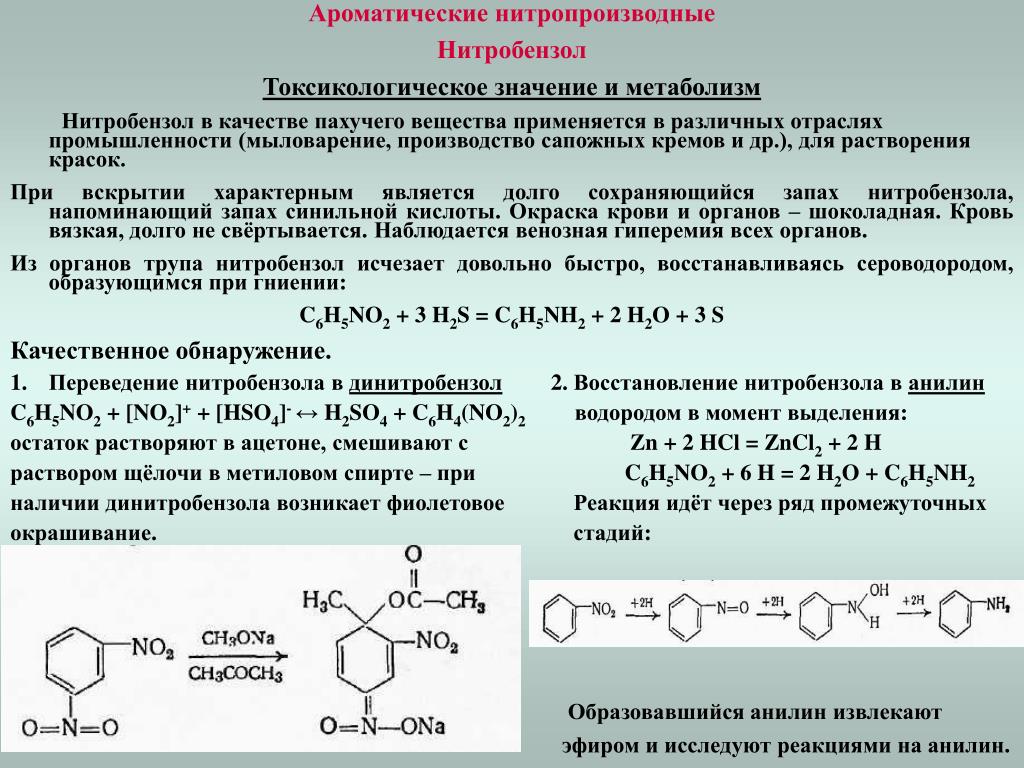
Следовательно, вариант А является правильным ответом.
Примечание: Частичная делокализация электрона — это делокализация пи-электрона, эффект, также известный как резонанс, благодаря которому молекула становится более стабильной. В аммине три пары связей, тогда как одна неподеленная пара.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Студенты также читают
Реакция анилина с персульфатом аммония и концентрированной соляной кислотой: экспериментальные исследования и ТФП
AIST, Национальный институт передовых промышленных наук и технологий (2011).
 База данных спектров органических соединений, SDBS № 1500 . Получено 18 октября 2011 г. с http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/directframetop.cgi.
База данных спектров органических соединений, SDBS № 1500 . Получено 18 октября 2011 г. с http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/directframetop.cgi.Ангиои, С., Полати, С., Роз, М., Ринаудо, К., Джанотти, В., и Дженнаро, М. К. (2005). Сорбционные исследования хлоранилинов на каолините и монтмориллоните. Загрязнение окружающей среды , 134 , 35–43. DOI: 10.1016/j.envpol.2004.07.018.
Артикул КАС Google Scholar
Бадави, Х.М., Фёрнер, В., и Аль-Саади, А.А. (2009). Структурная стабильность, инверсия NH 2 и колебательные отнесения 2,4,6-трихлоранилина и 2,3,5,6-тетрахлоранилина. Журнал молекулярной структуры , 938 , 41–47. DOI: 10.1016/j.molstruc.2009.09.001.
Артикул КАС Google Scholar
Бекке, А. Д. (1988). Приближение обменной энергии функционалом плотности с правильным асимптотическим поведением.
 Physical Review A , 38 , 3098–3100. DOI: 10.1103/PhysRevA.38.3098.
Physical Review A , 38 , 3098–3100. DOI: 10.1103/PhysRevA.38.3098.Артикул КАС Google Scholar
Бекке, А. Д. (1993). Функциональная плотность термохимия III. Роль точного обмена. Журнал химической физики , 98 , 5648–5652. DOI: 10.1063/1.464913.
КАС Google Scholar
Бородкин Г.И., Шубин В.Г. (2005). Ионы азота и проблема прямого электрофильного аминирования ароматических соединений. Российский журнал органической химии , 41 , 473–504. DOI: 10.1007/s11178-005-0193-z.
Артикул КАС Google Scholar
Мальчики, С. Ф., и Бернарди, Ф. (1970). Расчет малых молекулярных взаимодействий по разности отдельных полных энергий. Некоторые процедуры с уменьшенными ошибками. Молекулярная физика , 19 , 553–566. DOI: 10.1080/00268977000101561.

Артикул КАС Google Scholar
Камайони, Д.М., и Швердтфегер, К.А. (2005). Комментарий к «Точные экспериментальные значения свободных энергий гидратации H + , OH − и H 3 O + ». Журнал физической химии A , 109 , 10795–10797. DOI: 10.1021/jp054088k.
Артикул КАС Google Scholar
Чанг, Дж. К., и МакДиармид, А. Г. (1986). «Полианилин»: легирование эмеральдиновой формы протонной кислотой до металлического режима. Синтетические металлы , 13 , 193–205. DOI: 10.1016/0379-6779(86)
- -6.
Артикул КАС Google Scholar
Кларк, Т., Чандрасекар, Дж., Шпицнагель, Г.В., и фон Раге Шлейер, П. (1983). Эффективные базисные наборы, дополненные диффузной функцией, для расчетов анионов. III. Базисный комплект 3-21+G для элементов первого ряда, Li-F.
 Журнал вычислительной химии , 4 , 294–301. DOI: 10.1002/jcc.540040303.
Журнал вычислительной химии , 4 , 294–301. DOI: 10.1002/jcc.540040303.Артикул КАС Google Scholar
Кертисс, Л. А., Рагхавачари, К., Редферн, П. К., Рассолов, В., и Попл, Дж. А. (1998). Теория Гаусса-3 (G3) для молекул, содержащих атомы первого и второго ряда. Журнал химической физики , 109 , 7764–7776. DOI: 10.1063/1.477422.
Артикул КАС Google Scholar
Чирич-Марьянович Г., Конюшенко Е. Н., Трхова М. и Стейскал Дж. (2008a). Химическая окислительная полимеризация сульфата анилина по сравнению с анилином: теория и эксперимент. Синтетические металлы , 158 , 200–211. DOI: 10.1016/j.synthmet.2008.01.005.
Артикул Google Scholar
Чирич-Марьянович, Г., Трхова, М., и Стейскал, Дж. (2006). МНДО-ПМ3 исследование ранних стадий химической окислительной полимеризации анилина.
 Коллекция Чехословацких химических сообщений , 71 , 1407–1426. DOI: 10.1135/cccc20061407.
Коллекция Чехословацких химических сообщений , 71 , 1407–1426. DOI: 10.1135/cccc20061407.Артикул Google Scholar
Чирич-Марьянович, Г., Трхова, М., и Стейскал, Дж. (2008b). Теоретическое исследование окислительной полимеризации анилина с пероксидисульфатом: образование тетрамера. Международный журнал квантовой химии , 108 , 318–333. DOI: 10.1002/qua.21506.
Артикул Google Scholar
Дэвис, М.К. (2009). Хлорирование анилина и метилкарбанилата N -хлорсукцинимидом и синтез 1,3,5-трихлорбензола. Synthetic Communications , 39 , 11:00–11:08. DOI: 10.1080/00397910802499542.
Артикул КАС Google Scholar
Драчинский М., Кастаньо О., Котора М. и Бурж П. (2010). Перегруппировка производных бензола Дьюара, изученная методом DFT. Журнал органической химии , 75 , 576–581.
 DOI: 10.1021/jo 5n.
DOI: 10.1021/jo 5n.Деннингтон, Р., И.И., Кит, Т., Миллам, Дж., Эппиннетт, К., Ховелл, У.Л., и Гиллиленд, Р. (2003). GaussView 03, [программное обеспечение], Университетский парк, Пенсильвания, США: Semichem Inc.
Google Scholar
Фриш, М. Дж., Попл, Дж. А., и Бинкли, Дж. С. (1984). Методы самосогласованных молекулярных орбиталей 25. Дополнительные функции для гауссовых базисных наборов. Журнал химической физики , 80 , 3265–3269. DOI: 10.1063/1.447079.
Артикул КАС Google Scholar
Фриш, М. Дж., Тракс, Г. В., Шлегель, Х. Б., Скусерия, Г. Э., Робб, М. А., Чизман, Дж. Р., Монтгомери, Дж. А., младший, Вревен, Т., Кудин, К. Н., Бурант, Дж. К., Миллам, Дж. М., Айенгар С. С., Томаси Дж., Бароне В., Меннуччи Б., Косси М., Скальмани Г., Рега Н., Петерссон Г.
 А., Накацудзи Х., Хада М., Эхара М., Тойота К., Фукуда Р., Хасэгава Дж., Исида М., Накадзима Т., Хонда Ю., Китао О., Накаи Х., Клене М., Ли, X., Нокс, Дж. Э., Гратчян, Х. П., Кросс, Дж. Б., Баккен, В., Адамо, К., Харамильо, Дж., Гомпертс, Р., Стратманн, Р. Э., Языев, О., Остин, А. Дж., Камми Р., Помелли К., Охтерски Дж. В., Аяла П. Ю., Морокума К., Вот Г. А., Сальвадор П., Данненберг Дж. Дж., Закржевски В. Г., Дапприч С., Дэниелс А. Д., Штамм , М.С., Фаркас, О., Малик, Д.К., Рабак, А.Д., Рагхавачари, К., Форесман, Дж.Б., Ортис, Дж.В., Куи, К., Бабул, А.Г., Клиффорд, С., Циословски, Дж., Стефанов, Б. Б., Лю Г., Ляшенко А., Пискорц П., Комароми И., Мартин Р. Л., Фокс Д. Дж., Кит Т., Аль-Лахам М. А., Пэн С. Ю., Нанаяккара А., Чаллакомб, М., Гилл, П.М.В., Джонсон, Б., Чен, В., Вонг, М., Гонсалес, В.К., и Попл, Дж.А. (2004). Gaussian 03, Revision D.02 [компьютерное программное обеспечение]. Уоллингфорд, Коннектикут, США: Gaussian, Inc.
А., Накацудзи Х., Хада М., Эхара М., Тойота К., Фукуда Р., Хасэгава Дж., Исида М., Накадзима Т., Хонда Ю., Китао О., Накаи Х., Клене М., Ли, X., Нокс, Дж. Э., Гратчян, Х. П., Кросс, Дж. Б., Баккен, В., Адамо, К., Харамильо, Дж., Гомпертс, Р., Стратманн, Р. Э., Языев, О., Остин, А. Дж., Камми Р., Помелли К., Охтерски Дж. В., Аяла П. Ю., Морокума К., Вот Г. А., Сальвадор П., Данненберг Дж. Дж., Закржевски В. Г., Дапприч С., Дэниелс А. Д., Штамм , М.С., Фаркас, О., Малик, Д.К., Рабак, А.Д., Рагхавачари, К., Форесман, Дж.Б., Ортис, Дж.В., Куи, К., Бабул, А.Г., Клиффорд, С., Циословски, Дж., Стефанов, Б. Б., Лю Г., Ляшенко А., Пискорц П., Комароми И., Мартин Р. Л., Фокс Д. Дж., Кит Т., Аль-Лахам М. А., Пэн С. Ю., Нанаяккара А., Чаллакомб, М., Гилл, П.М.В., Джонсон, Б., Чен, В., Вонг, М., Гонсалес, В.К., и Попл, Дж.А. (2004). Gaussian 03, Revision D.02 [компьютерное программное обеспечение]. Уоллингфорд, Коннектикут, США: Gaussian, Inc.Google Scholar
Фукуи, К.
 (1981). Путь химических реакций — подход IRC. Отчеты о химических исследованиях , 14 , 363–368. DOI: 10.1021/ar00072a001.
(1981). Путь химических реакций — подход IRC. Отчеты о химических исследованиях , 14 , 363–368. DOI: 10.1021/ar00072a001.Артикул КАС Google Scholar
Гака, Дж., и Зак, С. (1997). Окислительное хлорирование ацетанилидов хлоридами металлов — пероксидом водорода в кисло-водных средах. Synthetic Communications , 27 , 3291–3299. DOI: 10.1080/00397919708004189.
Артикул Google Scholar
Гонсалес, К., и Шлегель, Х. Б. (1990). Следование пути реакции во внутренних координатах, взвешенных по массе. Журнал физической химии , 94 , 5523–5527. DOI: 10.1021/j100377a021.
Артикул Google Scholar
Господинова Н. и Терлемезян Л. (1998). Проводящие полимеры, полученные окислительной полимеризацией: полианилин. Прогресс в науке о полимерах , 23 , 1443–1484.
 DOI: 10.1016/s0079-6700(98)00008-2.
DOI: 10.1016/s0079-6700(98)00008-2.Артикул КАС Google Scholar
Гриббл, Г. В. (2003). Разнообразие органических галогенов, образующихся в природе. Хемосфера , 52 , 289–297. DOI: 10.1016/s0045-6535(03)00207-8.
Артикул КАС Google Scholar
Холл В.Е., Хигучи Т., Питман И.Х. и Уэкама К. (1972). Аминолиз ангидридов кислот в воде. II. Нелинейные зависимости структура-реакционная способность в реакциях аминолиза фталевого и янтарного ангидридов. Журнал Американского химического общества , 94 , 8153–8156. DOI: 10.1021/ja00778a035.
Артикул Google Scholar
Хантер, К.С., и Ветмор, С.Д. (2007). Влияние окружающей среды на повышение кислотности естественных и поврежденных азотистых оснований ДНК из-за дискретных взаимодействий водородных связей. Журнал физической химии A , 111 , 1933–1942.
 DOI: 10.1021/jp066641j.
DOI: 10.1021/jp066641j.Артикул КАС Google Scholar
Яворски, Дж. С., и Калиновский, М. К. (2007). Электрохимия анилинов. В З. Раппопорт (ред.), Химия анилинов (стр. 871–926). Чичестер, Великобритания: Wiley.
Глава Google Scholar (2001). Сополимеры анилина и нитроанилинов. Часть I. Механизм поликонденсации окисления анилина. Химия и физика материалов , 69 , 154–162. DOI: 10.1016/s0254-0584(00)00393-х.
Артикул Google Scholar
Ковальска М. и Гака Дж. (2002). Хлориды как потенциальные агенты, способствующие образованию хлорорганических соединений при окислении аминов. Польский журнал экологических исследований , 11 (Приложение I) , 41–44.
Google Scholar
Кришнан Р., Бинкли Дж. С., Сигер Р. и Попл Дж.
 А. (1980). Методы самосогласованных молекулярных орбиталей. ХХ. Базисный набор для коррелированных волновых функций. Журнал химической физики , 72 , 650–654. DOI: 10.1063/1.438955.
А. (1980). Методы самосогласованных молекулярных орбиталей. ХХ. Базисный набор для коррелированных волновых функций. Журнал химической физики , 72 , 650–654. DOI: 10.1063/1.438955.Артикул КАС Google Scholar
Крул, М., Врона, М., Пейдж, К.С., и Бейтс, П.А. (2006). Макроскопический p K a расчеты для флуоресцеина и его производных. Журнал химической теории и вычислений , 2 , 15:20–15:29. DOI: 10.1021/ct600235y.
Артикул Google Scholar
Крыговский, Т. М., Захара, Дж. Э., и Шатилович, Х. (2005). Молекулярная геометрия как источник химической информации. Часть 2. Попытка оценить прочность Н-связи: на примере комплексов p -нитрофенолов с основаниями. Журнал физической органической химии , 18 , 110–114. DOI: 10.1002/poc.875.
Артикул КАС Google Scholar
Кулкарни, С.
 Б., Джоши, С.С., и Локханде, К.Д. (2011). Простой и эффективный способ приготовления тонких наноструктурированных полианилиновых пленок: схематическая модель простейшей окислительной химической полимеризации. Журнал химического машиностроения , 166 , 1179–1185. DOI: 10.1016/j.cej.2010.12.032.
Б., Джоши, С.С., и Локханде, К.Д. (2011). Простой и эффективный способ приготовления тонких наноструктурированных полианилиновых пленок: схематическая модель простейшей окислительной химической полимеризации. Журнал химического машиностроения , 166 , 1179–1185. DOI: 10.1016/j.cej.2010.12.032.Артикул КАС Google Scholar
Ли, К., Ян, В., и Парр, Р. Г. (1988). Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Physical Review B , 37 , 785–789. DOI: 10.1103/PhysRevB.37.785.
Артикул КАС Google Scholar
Липтак, М. Д., и Шилдс, Г. К. (2001). Точные p K a расчеты для карбоновых кислот с использованием полного базисного набора и моделей Гаусса-n в сочетании с методами континуальной сольватации CPCM. Журнал Американского химического общества , 123 , 7314–7319.
 DOI: 10.1021/ja010534f.
DOI: 10.1021/ja010534f.Артикул КАС Google Scholar
МакДиармид, А. Г., Чанг, Дж. К., Рихтер, А. Ф., и Эпштейн, А. Дж. (1987). Полианилин: новая концепция проводящих полимеров. Синтетические металлы , 18 , 285–290. DOI: 10.1016/0379-6779(87)90893-9.
Артикул КАС Google Scholar
МакДиармид, А.Г., Манохар, С.К., Мастерс, Дж.Г., Сан, Ю., Вайс, Х., и Эпштейн, А.Дж. (1991). Полианилин: Синтез и свойства пернигранилинового основания. Синтетические металлы , 41 , 621–626. DOI: 10.1016/0379-6779(91)91145-з.
Артикул КАС Google Scholar
Мацуда Ю., Нисики Т., Сакота Н. и Накагава К. (1984). Анодное хлорирование анилина в N,N -диметилформамид и N,N -диметилацетамид. Electrochimica Acta , 29 , 35–39. DOI: 10.1016/0013-4686(84)80034-1.

Артикул КАС Google Scholar
Mattoso, LHC, MacDiarmid, A.G., & Epstein, A.J. (1994). Контролируемый синтез высокомолекулярных полианилина и поли(о-метоксианилина). Синтетические металлы , 68 , 1–11. DOI: 10.1016/0379-6779(94)
-6.
Артикул КАС Google Scholar
Макклелланд, Р. А., Кейли, М. Дж., Давидсе, П. А., и Хаджиалик, Г. (1996). Кислотно-основные свойства ионов арилнитрения. Журнал Американского химического общества , 118 , 4794–4803. DOI: 10.1021/ja954248d.
Артикул КАС Google Scholar
Маклин, А. Д., и Чендлер, Г. С. (1980). Сокращенные базисы Гаусса для молекулярных расчетов. I. Атомы второго ряда, Z =11−18. Журнал химической физики , 72 , 5639–5648. DOI: 10.1063/1.438980.
Артикул КАС Google Scholar
Миртуш С.
 , Скрокко Э. и Томаси Дж. (1981). Электростатическое взаимодействие растворенного вещества со сплошной средой. Прямое использование молекулярных потенциалов AB initio для прогнозирования эффектов растворителя. Химическая физика , 55 , 117–129. DOI: 10.1016/0301-0104(81)85090-2.
, Скрокко Э. и Томаси Дж. (1981). Электростатическое взаимодействие растворенного вещества со сплошной средой. Прямое использование молекулярных потенциалов AB initio для прогнозирования эффектов растворителя. Химическая физика , 55 , 117–129. DOI: 10.1016/0301-0104(81)85090-2.Google Scholar
Миртуш С. и Томаси Дж. (1982). Приближенные оценки изменения электростатической свободной энергии и внутренней энергии в процессах растворения. Химическая физика , 65 , 239–245. DOI: 10.1016/0301-0104(82)85072-6.
Артикул Google Scholar
Паласкак, М. В., и Шилдс, Г. К. (2004). Точные экспериментальные значения свободных энергий гидратации H + , OH − и H 3 O + . Журнал физической химии A , 108 , 3692–3694. DOI: 10.1021/jp049914o.
Артикул КАС Google Scholar
Покон, Э.
 К., Липтак, М. Д., Фельдгус, С., и Шилдс, Г. К. (2001). Сравнение прогнозов CBS-QB3, CBS-APNO и G3 данных депротонирования в газовой фазе. Журнал физической химии A , 105 , 10483–10487. DOI: 10.1021/jp012920p.
К., Липтак, М. Д., Фельдгус, С., и Шилдс, Г. К. (2001). Сравнение прогнозов CBS-QB3, CBS-APNO и G3 данных депротонирования в газовой фазе. Журнал физической химии A , 105 , 10483–10487. DOI: 10.1021/jp012920p.Артикул КАС Google Scholar
Пустаи С., Панчел Дж., Данхази Т. и Фарсанг Г. (2004). Механизм электродимеризации 2,4,6-трихлор- и триброманилинов в незабуференном ацетонитриле. Журнал электроаналитической химии , 571 , 233–239. DOI: 10.1016/j.jelechem.2004.04.020.
Артикул КАС Google Scholar
Сассон, Ю. (1995). Образование углерод-галогенных связей (Cl, Br, I). В S. Patai, & Z. Rappoport (Eds.), Supplement D2. Химия галогенидов, псевдогалогенидов и азидов , (Часть 2, стр. 535–628). Чичестер, Великобритания: Wiley.
Глава Google Scholar
Штейн, С.
 Э. (2011). Электронная книга по химии NIST . Получено 18 октября 2011 г. с http://webbook.nist.gov/cgi/cbook.cgi?Name=2%2C4%2C6-трихлоранилин &Units=SI.
Э. (2011). Электронная книга по химии NIST . Получено 18 октября 2011 г. с http://webbook.nist.gov/cgi/cbook.cgi?Name=2%2C4%2C6-трихлоранилин &Units=SI.Суэдзава Х., Хориике Н., Ямадзаки С., Камачи Х. и Хирота М. (1991). Многоядерные ЯМР-спектроскопические исследования ионных взаимодействий. Взаимодействие катионов азота с ионами галогенидов. Журнал физической химии , 95 , 10787–10796. DOI: 10.1021/j100179a049.
КАС Google Scholar
Саленец, М., Витко, М., Тадеушевич, Р., и Гоклон, Дж. (2006). Применение искусственных нейронных сетей и параметров на основе DFT для прогнозирования кинетики реакции этилбензолдегидрогеназы. Journal of Computer-Aided Molecular Design , 20 , 145–157. DOI: 10.1007/s10822-006-9042-6.
Артикул КАС Google Scholar
Шатылович, Х., Крыговский, Т. М., и Захара-Хореглад, Дж.
 Э. (2007). Структурные последствия водородной связи на больших расстояниях. Влияние Н-связи на ароматичность кольца в комплексах анилин/анилиний/анилид с различными основаниями и кислотами. Журнал химической информации и моделирования , 47 , 875–886. DOI: 10.1021/ci600502w.
Э. (2007). Структурные последствия водородной связи на больших расстояниях. Влияние Н-связи на ароматичность кольца в комплексах анилин/анилиний/анилид с различными основаниями и кислотами. Журнал химической информации и моделирования , 47 , 875–886. DOI: 10.1021/ci600502w.Google Scholar
Тава, Г.Дж., Тополь, И.А., Берт, С.К., Колдуэлл, Р.А., и Рашин, А.А. (1998). Расчет свободной энергии протона при водной сольватации. Журнал химической физики , 109 , 4852–4863. DOI: 10.1063/1.477096.
Артикул КАС Google Scholar
Тополь, И. А., Тава, Г. Дж., Колдуэлл, Р. А., Эйссенштат, М. А., и Берт, С. К. (2000). Кислотность органических молекул в газовой фазе и в водном растворителе. Журнал физической химии A , 104 , 9619–9624. DOI: 10.1021/jp001938h.
Артикул КАС Google Scholar
Тордо, М.
 , и Ваксельман, К. (1995). Реакция Бамбергера во фтористом водороде: использование мягких восстановительных металлов для получения фторароматических аминов. Журнал химии фтора , 74 , 251–254. DOI: 10.1016/0022-1139(95)03257-е.
, и Ваксельман, К. (1995). Реакция Бамбергера во фтористом водороде: использование мягких восстановительных металлов для получения фторароматических аминов. Журнал химии фтора , 74 , 251–254. DOI: 10.1016/0022-1139(95)03257-е.Артикул КАС Google Scholar
Вьяс П.В., Бхатт А.К., Рамачандрайя Г. и Бедекар А.В. (2003). Экологически безопасное хлорирование и бромирование ароматических аминов, углеводородов и нафтолов. Буквы тетраэдра , 44 , 4085–4088. DOI: 10.1016/s0040-4039(03)00834-7.
Артикул КАС Google Scholar (1990). Полимеризация анилина и алкилзамещенных анилинов в присутствии ароматических добавок. Журнал физической химии , 94 , 7716–7721. DOI: 10.1021/j100382a073.
Артикул КАС Google Scholar
Вэй, Ю., Тан, X., Сунь, Ю., и Фокке, В. В. (1989).

Артикул Google Scholar

 База данных спектров органических соединений, SDBS № 1500 . Получено 18 октября 2011 г. с http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/directframetop.cgi.
База данных спектров органических соединений, SDBS № 1500 . Получено 18 октября 2011 г. с http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/directframetop.cgi. Physical Review A , 38 , 3098–3100. DOI: 10.1103/PhysRevA.38.3098.
Physical Review A , 38 , 3098–3100. DOI: 10.1103/PhysRevA.38.3098.
 Журнал вычислительной химии , 4 , 294–301. DOI: 10.1002/jcc.540040303.
Журнал вычислительной химии , 4 , 294–301. DOI: 10.1002/jcc.540040303.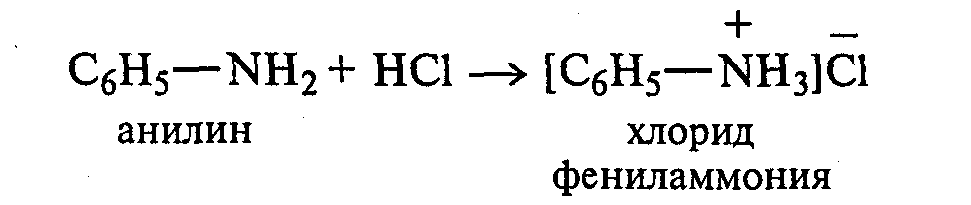 Коллекция Чехословацких химических сообщений , 71 , 1407–1426. DOI: 10.1135/cccc20061407.
Коллекция Чехословацких химических сообщений , 71 , 1407–1426. DOI: 10.1135/cccc20061407. DOI: 10.1021/jo
DOI: 10.1021/jo А., Накацудзи Х., Хада М., Эхара М., Тойота К., Фукуда Р., Хасэгава Дж., Исида М., Накадзима Т., Хонда Ю., Китао О., Накаи Х., Клене М., Ли, X., Нокс, Дж. Э., Гратчян, Х. П., Кросс, Дж. Б., Баккен, В., Адамо, К., Харамильо, Дж., Гомпертс, Р., Стратманн, Р. Э., Языев, О., Остин, А. Дж., Камми Р., Помелли К., Охтерски Дж. В., Аяла П. Ю., Морокума К., Вот Г. А., Сальвадор П., Данненберг Дж. Дж., Закржевски В. Г., Дапприч С., Дэниелс А. Д., Штамм , М.С., Фаркас, О., Малик, Д.К., Рабак, А.Д., Рагхавачари, К., Форесман, Дж.Б., Ортис, Дж.В., Куи, К., Бабул, А.Г., Клиффорд, С., Циословски, Дж., Стефанов, Б. Б., Лю Г., Ляшенко А., Пискорц П., Комароми И., Мартин Р. Л., Фокс Д. Дж., Кит Т., Аль-Лахам М. А., Пэн С. Ю., Нанаяккара А., Чаллакомб, М., Гилл, П.М.В., Джонсон, Б., Чен, В., Вонг, М., Гонсалес, В.К., и Попл, Дж.А. (2004). Gaussian 03, Revision D.02 [компьютерное программное обеспечение]. Уоллингфорд, Коннектикут, США: Gaussian, Inc.
А., Накацудзи Х., Хада М., Эхара М., Тойота К., Фукуда Р., Хасэгава Дж., Исида М., Накадзима Т., Хонда Ю., Китао О., Накаи Х., Клене М., Ли, X., Нокс, Дж. Э., Гратчян, Х. П., Кросс, Дж. Б., Баккен, В., Адамо, К., Харамильо, Дж., Гомпертс, Р., Стратманн, Р. Э., Языев, О., Остин, А. Дж., Камми Р., Помелли К., Охтерски Дж. В., Аяла П. Ю., Морокума К., Вот Г. А., Сальвадор П., Данненберг Дж. Дж., Закржевски В. Г., Дапприч С., Дэниелс А. Д., Штамм , М.С., Фаркас, О., Малик, Д.К., Рабак, А.Д., Рагхавачари, К., Форесман, Дж.Б., Ортис, Дж.В., Куи, К., Бабул, А.Г., Клиффорд, С., Циословски, Дж., Стефанов, Б. Б., Лю Г., Ляшенко А., Пискорц П., Комароми И., Мартин Р. Л., Фокс Д. Дж., Кит Т., Аль-Лахам М. А., Пэн С. Ю., Нанаяккара А., Чаллакомб, М., Гилл, П.М.В., Джонсон, Б., Чен, В., Вонг, М., Гонсалес, В.К., и Попл, Дж.А. (2004). Gaussian 03, Revision D.02 [компьютерное программное обеспечение]. Уоллингфорд, Коннектикут, США: Gaussian, Inc. (1981). Путь химических реакций — подход IRC. Отчеты о химических исследованиях , 14 , 363–368. DOI: 10.1021/ar00072a001.
(1981). Путь химических реакций — подход IRC. Отчеты о химических исследованиях , 14 , 363–368. DOI: 10.1021/ar00072a001. DOI: 10.1016/s0079-6700(98)00008-2.
DOI: 10.1016/s0079-6700(98)00008-2.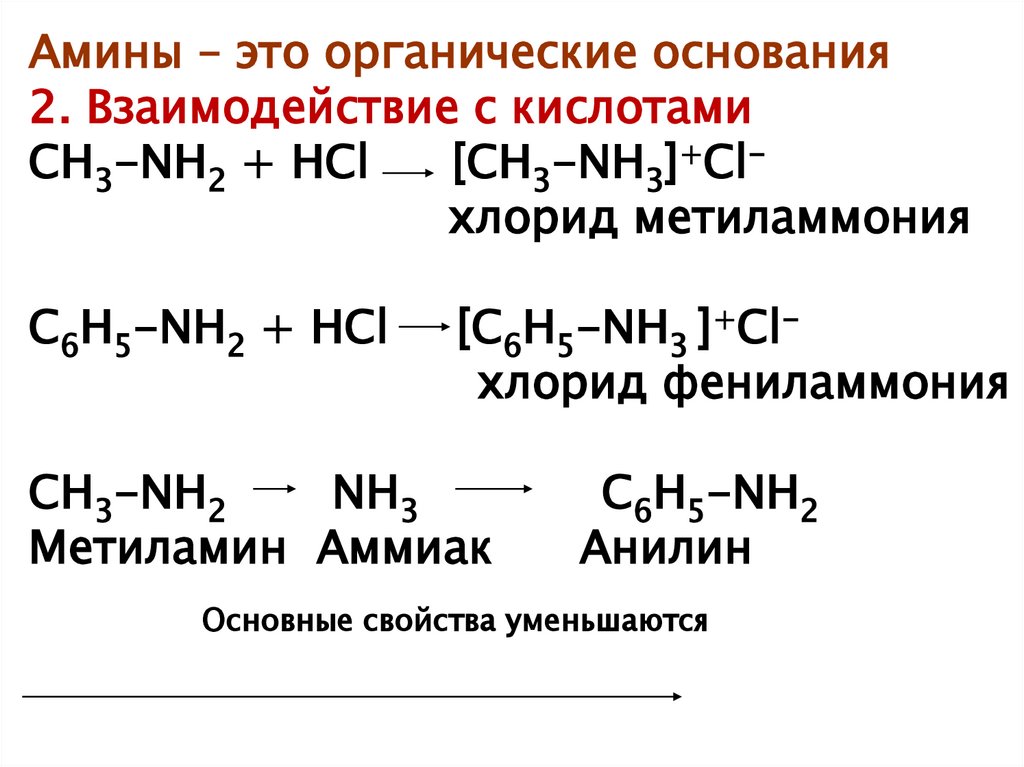 DOI: 10.1021/jp066641j.
DOI: 10.1021/jp066641j. А. (1980). Методы самосогласованных молекулярных орбиталей. ХХ. Базисный набор для коррелированных волновых функций. Журнал химической физики , 72 , 650–654. DOI: 10.1063/1.438955.
А. (1980). Методы самосогласованных молекулярных орбиталей. ХХ. Базисный набор для коррелированных волновых функций. Журнал химической физики , 72 , 650–654. DOI: 10.1063/1.438955.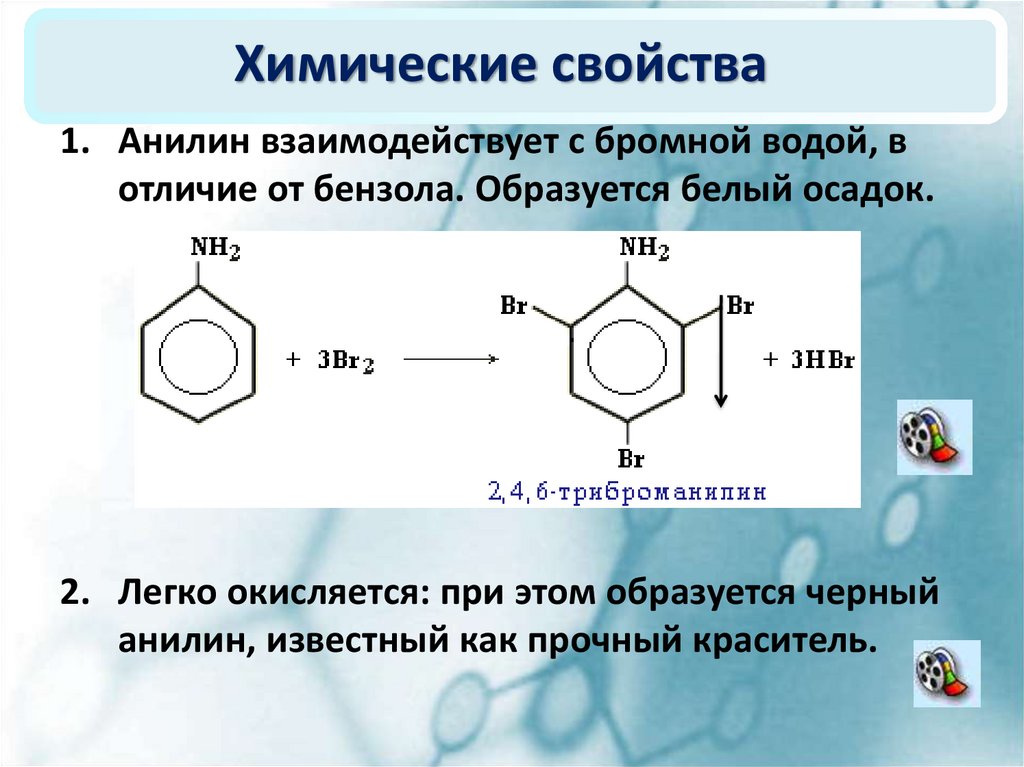 Б., Джоши, С.С., и Локханде, К.Д. (2011). Простой и эффективный способ приготовления тонких наноструктурированных полианилиновых пленок: схематическая модель простейшей окислительной химической полимеризации. Журнал химического машиностроения , 166 , 1179–1185. DOI: 10.1016/j.cej.2010.12.032.
Б., Джоши, С.С., и Локханде, К.Д. (2011). Простой и эффективный способ приготовления тонких наноструктурированных полианилиновых пленок: схематическая модель простейшей окислительной химической полимеризации. Журнал химического машиностроения , 166 , 1179–1185. DOI: 10.1016/j.cej.2010.12.032.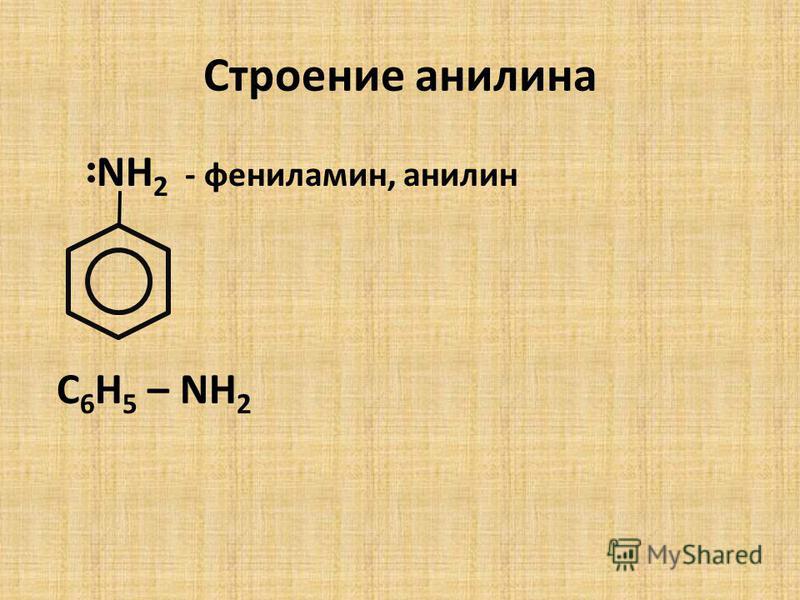 DOI: 10.1021/ja010534f.
DOI: 10.1021/ja010534f.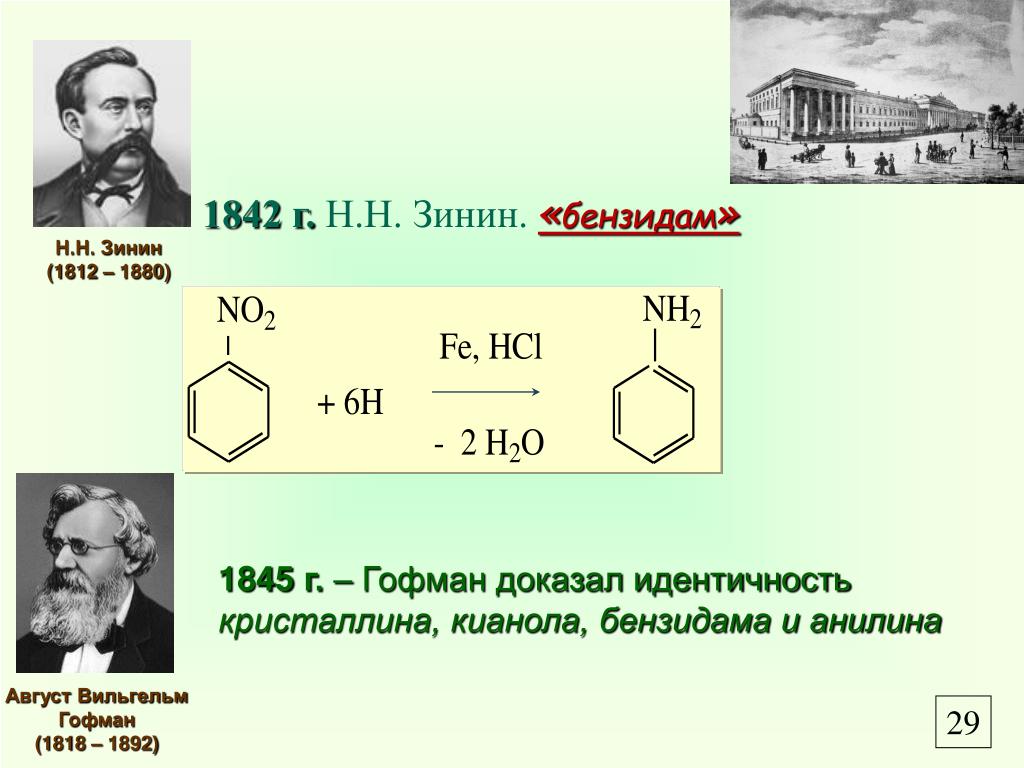
 , Скрокко Э. и Томаси Дж. (1981). Электростатическое взаимодействие растворенного вещества со сплошной средой. Прямое использование молекулярных потенциалов AB initio для прогнозирования эффектов растворителя. Химическая физика , 55 , 117–129. DOI: 10.1016/0301-0104(81)85090-2.
, Скрокко Э. и Томаси Дж. (1981). Электростатическое взаимодействие растворенного вещества со сплошной средой. Прямое использование молекулярных потенциалов AB initio для прогнозирования эффектов растворителя. Химическая физика , 55 , 117–129. DOI: 10.1016/0301-0104(81)85090-2. К., Липтак, М. Д., Фельдгус, С., и Шилдс, Г. К. (2001). Сравнение прогнозов CBS-QB3, CBS-APNO и G3 данных депротонирования в газовой фазе. Журнал физической химии A , 105 , 10483–10487. DOI: 10.1021/jp012920p.
К., Липтак, М. Д., Фельдгус, С., и Шилдс, Г. К. (2001). Сравнение прогнозов CBS-QB3, CBS-APNO и G3 данных депротонирования в газовой фазе. Журнал физической химии A , 105 , 10483–10487. DOI: 10.1021/jp012920p. Э. (2011). Электронная книга по химии NIST . Получено 18 октября 2011 г. с http://webbook.nist.gov/cgi/cbook.cgi?Name=2%2C4%2C6-трихлоранилин &Units=SI.
Э. (2011). Электронная книга по химии NIST . Получено 18 октября 2011 г. с http://webbook.nist.gov/cgi/cbook.cgi?Name=2%2C4%2C6-трихлоранилин &Units=SI.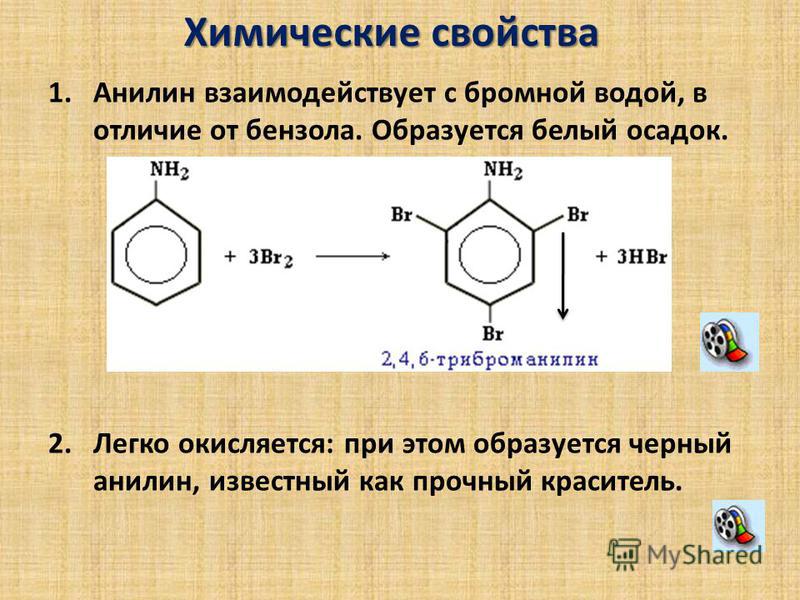 Э. (2007). Структурные последствия водородной связи на больших расстояниях. Влияние Н-связи на ароматичность кольца в комплексах анилин/анилиний/анилид с различными основаниями и кислотами. Журнал химической информации и моделирования , 47 , 875–886. DOI: 10.1021/ci600502w.
Э. (2007). Структурные последствия водородной связи на больших расстояниях. Влияние Н-связи на ароматичность кольца в комплексах анилин/анилиний/анилид с различными основаниями и кислотами. Журнал химической информации и моделирования , 47 , 875–886. DOI: 10.1021/ci600502w.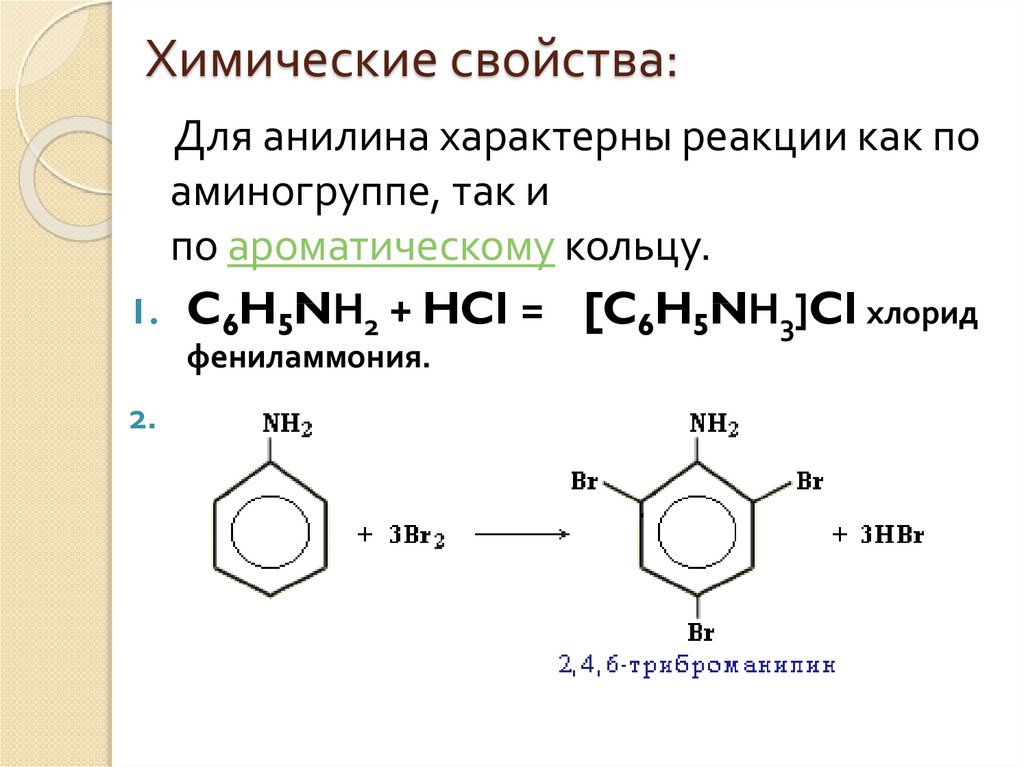 , и Ваксельман, К. (1995). Реакция Бамбергера во фтористом водороде: использование мягких восстановительных металлов для получения фторароматических аминов. Журнал химии фтора , 74 , 251–254. DOI: 10.1016/0022-1139(95)03257-е.
, и Ваксельман, К. (1995). Реакция Бамбергера во фтористом водороде: использование мягких восстановительных металлов для получения фторароматических аминов. Журнал химии фтора , 74 , 251–254. DOI: 10.1016/0022-1139(95)03257-е.
Leave A Comment