Метод электронного баланса
Суть метода электронного баланса заключается в:
- Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется — не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась — составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.
Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
Как это выглядит на практике, рассмотрено на примере задач по шагам.
Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
а) Ag + HNO3 → AgNO3 + NO + H2O
б) Ca +H2SO4 → CaSO4 + H2S + H2O
в) Be + HNO3 → Be(NO3)2 + NO + H2O
Решение.
Для решения данной задачи воспользуемся правилами определения степени окисления.
Составим электронный баланс для каждого элемента реакции окисления Ag + HNO3 → AgNO3 + NO + H
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней окисления каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса — какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась — в данном расчете не участвуют
Ag0 — 1e = Ag+1
N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота.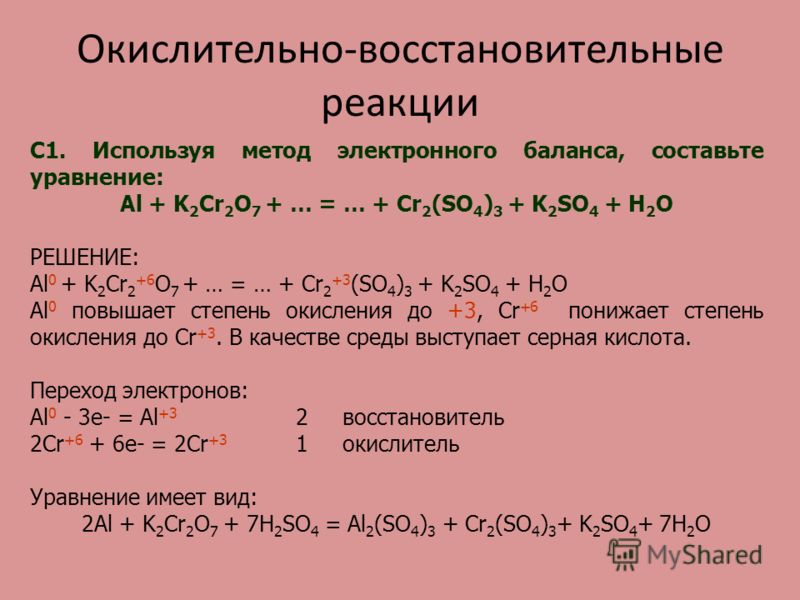 Тогда число теряемых и приобретаемых электронов сравняется.
Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента «3» для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H2O
Ответ:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Составим электронный баланс для каждого элемента реакции окисления Ca +H2SO4 → CaSO4 + H2
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6
Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 — (+2) — (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca0 +H+12S+6O-24 → Ca+2S+6O-24 + H+12S-2 + H+12O-2
Ca0 — 2e = Ca+2 (коэффициент 4)
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Пример «в»Составим электронный баланс для каждого элемента реакции окисления Be + HNO3 → Be(NO3)2 + NO + H2O
HNO3 см. выше
выше
Для Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 — (+2) — (-2)*3*2 ) / 2 = +5
NO см. выше
H2O см. выше
Be0 — 2e = Be+2 (коэффициент 3)
N+5 +3e = N+2 (коэффициент 2)
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O
0
Полный список степеней окисления элементов | Описание курса | Тесты (2)
Метод электронного балланса — Составление уравнений окислительно-восстановительных реакций
9 января 2007
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.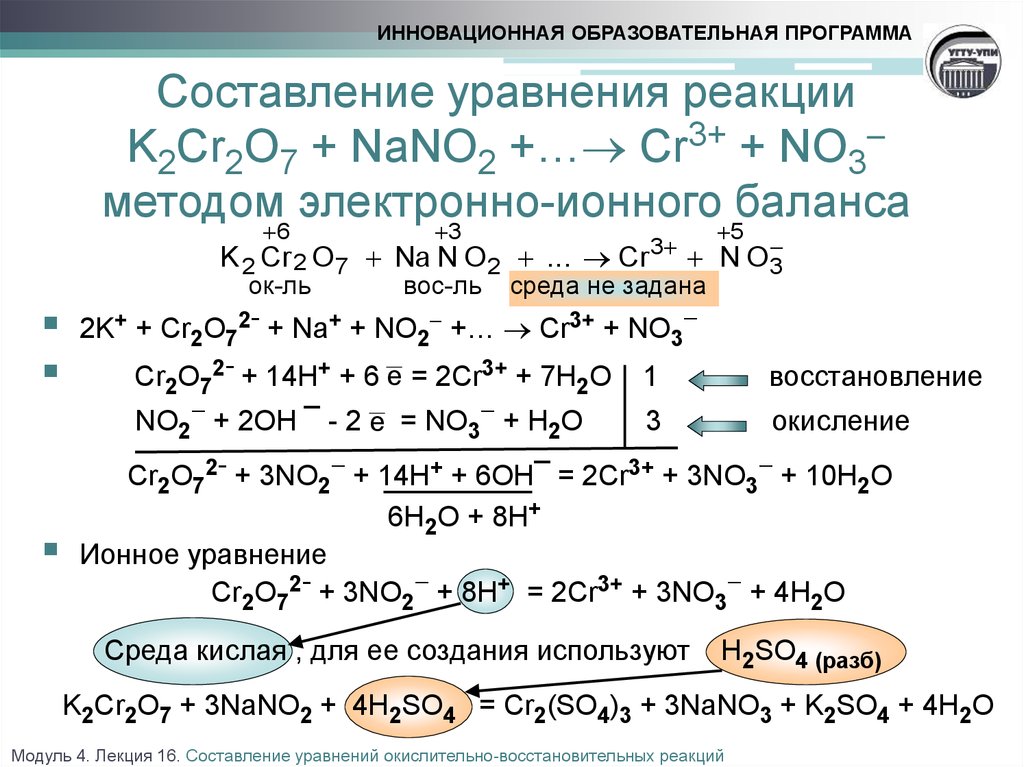
Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь — восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3— = Cu2+ + 2NO3— + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Пример 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl — восстановитель, MnО2 — окислитель. Составляем электронные уравнения:
НCl — восстановитель, MnО2 — окислитель. Составляем электронные уравнения:
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl— + МnО2 = Сl2 + Мn2+ + 2Сl— + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Cl— + MnO2 = Сl2 + Mn2+ + 2Н2О
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции — формулы исходных и полученных веществ:
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (Н2S — восстановитель, КМnО4 — окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2.4 + 3.4 = 20 и в правой части 2.4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2MnO4— + 6H+ = 5S + 2Мn2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
7.4: Балансировка химических уравнений — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 289396
⚙️ Цели обучения
- Объяснить роль индексов и коэффициентов в химических уравнениях.
- Сбалансируйте химическое уравнение, если дано несбалансированное уравнение.
- Объясните роль закона сохранения вещества в химической реакции.
Несмотря на то, что химические соединения распадаются и образуются новые соединения во время химической реакции, атомы в реагентах не исчезают, и новые атомы не появляются в продуктах. В химических реакциях атомы никогда не образуются и не разрушаются. Те же самые атомы, которые присутствовали в реагентах, присутствуют и в продуктах — они просто реорганизованы в другое расположение. В полном химическом уравнении в реагенте и продукте уравнения должно присутствовать одинаковое количество атомов.
В химических реакциях атомы никогда не образуются и не разрушаются. Те же самые атомы, которые присутствовали в реагентах, присутствуют и в продуктах — они просто реорганизованы в другое расположение. В полном химическом уравнении в реагенте и продукте уравнения должно присутствовать одинаковое количество атомов.
Химические уравнения и закон сохранения вещества
В предыдущем разделе реакция между газообразным водородом и газообразным кислородом с образованием воды в газовой фазе была показана в виде химического уравнения:
H 2 ( г ) + O 2 ( г ) → H 2 O ( г )
На молекулярном уровне реакция будет выглядеть примерно так:
Обратите внимание на два атома кислорода в левой части уравнения и только один атом кислорода в правой. Куда делся этот единственный атом кислорода? Материя не может просто исчезнуть. Опять же, атомы никогда не создаются и не разрушаются в химических реакциях.
Теперь давайте рассмотрим, что произойдет, если мы начнем с двух молекул водорода и одной молекулы кислорода:
В результате этой комбинации образуются две молекулы воды — четыре атома водорода и два атома кислорода находятся в левой части уравнение и четыре атома водорода и два атома кислорода справа. Любого нарушения закона сохранения материи удалось избежать. Химическое уравнение для этой реакции выше будет записано как:
2 H 2 ( г ) + O 2 ( г ) → 2 H 2 O ( г ) называется 50 сбалансированной формой химического уравнения
Коэффициенты и индексы
В химических уравнениях используются два типа чисел. Имеется индексов , которые входят в состав химических формул реагентов и продуктов:
\[{\color[rgb]{0,0, 0,0, 1,0}2}\;{\mathrm H}_{\color[rgb]{0,8, 0,0, 0,0}\boxed2}\;(g)\; +\;{\ mathrm O} _ {\color[rgb]{0,8, 0,0, 0,0}\boxed2}\;(g)\;\rightarrow{\color[rgb]{0,0, 0,0, 1,0}2}\ ;{\ mathrm H} _{\color[rgb]{0,8, 0,0, 0,0}\boxed2}\mathrm O\;(g)\nonumber\]
После определения формул для реагентов и продуктов индексы могут быть изменены , а не .
Существуют также коэффициенты , которые помещаются перед химическими формулами, чтобы указать, сколько молекул этого вещества используется или производится:
\[{\color[rgb]{0,0, 0,0, 1,0}\boxed2}\;{\mathrm H}_{\color[rgb]{0,8, 0,0, 0,0}2}\;(g)\; +\;{\ mathrm O} _ {\color[rgb]{0,8, 0,0, 0,0}2}\;(g)\;\rightarrow{\color[rgb]{0,0, 0,0, 1,0}\boxed2}\ ;{\mathrm H}_{\color[rgb]{0,8, 0,0, 0,0}2}\mathrm O\;(g)\nonumber\]
Коэффициенты могут быть изменены, чтобы сбалансировать уравнение. Приведенное выше уравнение показывает, что две молекулы газообразного водорода реагируют с одной молекулой газообразного кислорода с образованием двух молекул воды.
Поскольку идентичность реагентов и продуктов фиксирована, уравнение нельзя сбалансировать, изменив нижние индексы реагентов или продуктов. Это изменило бы химическую идентичность описываемых видов. Например, было уравнение реакции:
\[{\mathrm H}_2\;(g)\;+\;{\mathrm O}_2\;(g)\;\rightarrow{\mathrm H}_2\mathrm O\;(g)\ неномер\]
был уравновешен путем изменения нижнего индекса для кислорода в H 2 O , чтобы стать H 2 O 2 , реакция больше не показывает образование воды. Уравнение действительно сбалансировано. Однако он показывает производство перекиси водорода, совершенно другого вещества:
Уравнение действительно сбалансировано. Однако он показывает производство перекиси водорода, совершенно другого вещества:
\[\cancel{{\mathrm H}_2\;(g)\;+\;{\mathrm O}_2\;(g)\ ;\rightarrow\;{\ mathrm H} _2{\ mathrm O} _ {\color[rgb]{0,8, 0,0, 0,0}2}\;(g)}\nonumber\]
Следовательно, снова химических уравнения уравновешиваются изменением коэффициентов :
\[{\color[rgb]{0.0, 0.0, 1.0}\boxed2}\;{\mathrm H}_2\;(g ) \; + \; {\ mathrm O} _2 \; (g) \; \ rightarrow {\ color [rgb] {0,0, 0,0, 1,0} \ boxed2} \; {\ mathrm H} _2 \ mathrm O \; (g)\nonumber\]
Точно так же, как индексы «1» подразумеваются в химических формулах (формула для воды записывается как H 2 O, а не H 2 O 1 ), коэффициенты «1 » также подразумеваются. Другими словами, коэффициент для O 2 ( г ) в приведенном выше сбалансированном уравнении равно «1», даже если число «1» не написано.
Также может быть полезно думать о коэффициентах в химических уравнениях, как если бы они были коэффициентами в алгебре. Коэффициенты в алгебре записываются перед термином или переменной, а не в середине. Как и в алгебре, коэффициент в химическом уравнении означает умножение. Другими словами, написав «2 H 2 O», мы указываем всего 2 × 2 или 4 атома водорода.
Коэффициенты в алгебре записываются перед термином или переменной, а не в середине. Как и в алгебре, коэффициент в химическом уравнении означает умножение. Другими словами, написав «2 H 2 O», мы указываем всего 2 × 2 или 4 атома водорода.
Уравновешивание химических уравнений
Самый простой и наиболее полезный метод уравновешивания химических уравнений называется «уравновешивание путем проверки», также известное как метод проб и ошибок. Есть несколько стратегий, которые можно использовать, чтобы уменьшить количество проб и ошибок, чтобы получить уравнение, которое в конечном итоге правильно сбалансировано.
⚓️ Стратегии балансировки химических уравнений
- Наиболее сложные формулы обычно следует балансировать в первую очередь.
- Простейшую формулу обычно балансируют в последнюю очередь.
- Для определения коэффициентов может использоваться наименьшее общее кратное между двумя числами.
- Многоатомные ионы (если они присутствуют в обеих частях химического уравнения) могут быть уравновешены как единое целое.

- Дробные коэффициенты иногда необходимы для балансировки уравнения при балансировке оставшейся простейшей формулы. Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целочисленные коэффициенты.
- Подсчитайте количество атомов каждого элемента в каждой части уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
✅ Пример \(\PageIndex{1}\): Окисление алюминия
Сбалансируйте химическое уравнение реакции металлического алюминия с газообразным кислородом с образованием твердого оксида алюминия: O 2 ( г ) → Al 2 O 3 ( s )
Решение
- Самая сложная формула — Al 2 O 3 ( s ) и должна быть сбалансирована первой, а самая простая формула — Al ( s ) и должна быть сбалансирована последней.
- 2 атома кислорода слева и 3 атома кислорода справа.
 Наименьшее общее кратное между 2 и 3 равно 6. Чтобы получить по 6 атомов кислорода с каждой стороны, перед O 2 ( г ) ставится коэффициент «3», а перед O 2 ставится коэффициент «2», а перед перед ал 2 О 3 ( с ):
Наименьшее общее кратное между 2 и 3 равно 6. Чтобы получить по 6 атомов кислорода с каждой стороны, перед O 2 ( г ) ставится коэффициент «3», а перед O 2 ставится коэффициент «2», а перед перед ал 2 О 3 ( с ):
Al ( s ) + 3 O 2 ( г ) → 2 Al 2 O 3 ( s ) 90 атомов алюминия неравномерно аннулирован. В точке 1 атом алюминия слева и 4 атома алюминия справа. Чтобы сбалансировать атомы алюминия, перед Al ставится коэффициент «4» ( s ):
\(\boxed{{\color[rgb]{0,8, 0,0, 0,0}4}\;\mathrm{Al}\;(s)\;+\;{\color[rgb]{0,0, 0,0, 1,0} 3} \; {\ mathrm O} _2 \; (g) \; \ стрелка вправо \; {\ color [rgb] {0,0, 0,0, 1,0} 2} \; {\ mathrm {Al}} _2 {\ матрм O}_3\;(s)}\)
- Необходимо выполнить окончательную проверку, чтобы убедиться, что уравнение остается сбалансированным для всех элементов. Иногда полезно поместить информацию в таблицу и подсчитать каждый атом элемента по мере того, как уравнение уравновешивается:
\[\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm{Al} &\vert\vert\vert\vert&\vert\vert\vert\vert\\\mathrm O&\cancel{\vert\vert\vert\vert}\;\vert&\cancel{\vert\vert\vert\vert} \;\vert\end{массив}\номер\]
✅ Пример \(\PageIndex{2}\): Разложение хлората калия
Сбалансируйте химическое уравнение разложения твердого хлората калия в присутствии тепла с образованием твердого хлорида калия и газообразного кислорода. Обратите внимание, что над стрелкой появляется треугольник, указывающий, что для протекания этой реакции необходимо тепло:
Обратите внимание, что над стрелкой появляется треугольник, указывающий, что для протекания этой реакции необходимо тепло:
\({\mathrm{KClO}}_3\;(s)\;\xrightarrow\triangle\;\mathrm{KCl} \;(s)\;+\;{\mathrm O}_2\;(g)\)
Решение
- Самая сложная формула — KClO 3 ( s ) и должна быть сбалансирована в первую очередь. KCl ( s ) или O 2 ( г ) кажутся одинаково простыми. Однако оказывается, что атомы калия и атомы хлора уже уравновешены, поэтому можно начать с уравновешивания атомов кислорода. На этот раз давайте вести постоянный подсчет.
\(\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагенты}&\mathrm{Продукты}\\\mathrm K&\vert&\vert\\\mathrm{Cl}&\vert&\vert \\\mathrm O&\vert\vert\vert&\vert\vert\end{массив}\)
- 3 атома кислорода слева и 2 атома кислорода справа. Наименьшее общее кратное между 2 и 3 равно 6. Чтобы получить по 6 атомов кислорода с каждой стороны, перед KClO 3 ( s ) ставится коэффициент «2», а перед коэффициентом «3» ставится коэффициент «3».
 перед O 2 ( г ):
перед O 2 ( г ):
\({\color[rgb]{0,0, 0,0, 1,0}2}\;{\mathrm{KClO}}_3\;(s)\;\xrightarrow\triangle\;\mathrm{KCl}\;( s)\;+\;{\color[rgb]{0,0, 0,0, 1,0}3}\;{\mathrm O}_2\;(g)\)
\(\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагенты}&\mathrm{Продукты}\\\mathrm K&\vert\vert&\vert\\\mathrm{Cl}&\vert \vert&\vert\\\mathrm O&\cancel{\vert\vert\vert\vert}\;\vert&\cancel{\vert\vert\vert\vert}\;\vert\end{array}\)
- Теперь это делает атомы калия и хлора неуравновешенными. Однако это легко исправить, поставив коэффициент «2» перед KCl ( s ):
\(\boxed{{\color[rgb]{0,0, 0,0, 1,0}2}\;{\mathrm{KClO}}_3\;(s)\;\xrightarrow\triangle\;{\color[rgb ] {0,8, 0,0, 0,0} 2} \; \ mathrm {KCl} \; (s) \; + \; {\ color [rgb] {0,0, 0,0, 1,0} 3} \; {\ mathrm O} _2 \;(ж)}\)
- Необходимо выполнить окончательную проверку, чтобы убедиться, что уравнение остается сбалансированным для всех элементов.
\(\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагенты}&\mathrm{Продукты}\\\mathrm K&\vert\vert&\vert\vert\\\mathrm{Cl}& \vert\vert&\vert\vert\\\mathrm O&\cancel{\vert\vert\vert\vert}\;\vert&\cancel{\vert\vert\vert\vert}\;\vert\end{array} \)
✅ Пример \(\PageIndex{3}\): Горение бутана
Сбалансируйте химическое уравнение горения жидкого бутана (C 4 H 10 ) в присутствии газообразного кислорода с образованием диоксида углерода и воды в газовой фазе:
C 4 H 10 ( л ) + O 2
4 ( → CO 2 ( г ) + H 2 O ( г )Раствор
- Самая сложная формула C 1 90 4 0 H 3 3 90 43 ( l ) и должно быть сначала уравновешивается, а самая простая формула O 2 ( г ) и балансировать в последнюю очередь.
 Давайте еще раз проведем непрерывный подсчет, на этот раз используя цифры.
Давайте еще раз проведем непрерывный подсчет, на этот раз используя цифры.
\(\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm C&4&1\\ \mathrm H&10&2\\\mathrm O&2&3\end{array}\)
- Слева 4 атома углерода, а справа 1 атом углерода. Наименьшее общее кратное между 4 и 1 равно 4. Чтобы получить 4 атома углерода справа, перед CO 9 ставится коэффициент «4».0042 2 ( г ):
C 4 H 10 ( l ) + O 2 ( г ) → 4 CO 2 ( 90 2 90 2 + 5 90 2 H 902 H 9004 43 О ( г )
\ (\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm C&4&4\\\mathrm H&10&2 \\\mathrm O&2&9\end{array}\)
- 10 атомов водорода слева и 2 атома водорода справа. Наименьшее общее кратное между 10 и 2 равно 10. Чтобы получить 10 атомов водорода справа, перед H 9 ставится коэффициент «5».
 0042 2 О ( г ):
0042 2 О ( г ):
C 4 H 10 ( l ) + O 2 ( г ) → 4 CO 2 ( 90 2 H 5 2 9 044 г )9004 0043 О ( г )
\(\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm C&4&4\\\mathrm H&10&10\\\mathrm O&2&13\end{array}\)
- Неуравновешенными остаются только атомы кислорода, как и предполагалось изначально. В точке 2 атома кислорода слева и 13 атомов кислорода справа. Это означает, что должна быть возможность разместить коэффициент ( x ) перед O 2 ( г ) для баланса уравнения:
C 4 H 10 ( l ) + x O 2 ( г ) → 4 CO 90 2 (
4 9043 ) 5 Н 2 О ( г )- Похоже, настало время использовать Стратегию № 5, указанную выше, используя дробный коэффициент для баланса атомов кислорода, поскольку нам нужно спросить себя: «Какое число, умноженное на два, будет равно 13?» В алгебре этот вопрос будет записан как
\[2x=13\nonnumber\]
Разделив каждую сторону на 2, можно найти решение для x :
\[x=\frac{13}2\nonnumber\]
Другими словами, коэффициент «\(\frac{13}2\)» можно поставить перед O 2 ( g ):
\({\mathrm C}_4{\mathrm H}_{10}\;(l)\;+\;{\textstyle\color[rgb]{0,8, 0,0, 0,0}\frac{13}2 } \; {\ mathrm O} _2 \; (g) \; \ rightarrow {\ color [rgb] {0,0, 0,0, 1,0} 4} \; {\ mathrm {CO}} _2 \; (g) \; +\;{\color[rgb]{0,6, 0,0, 1,0}5}\;{\mathrm H}_2\mathrm O\;(g)\)
\(\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm C&4&4\\ \mathrm H&10&10\\\mathrm O&13&13\end{array}\)
- Как отмечено в Стратегии № 5, обе части уравнений следует умножать на знаменатель, когда используются дробные коэффициенты, чтобы получить целочисленные коэффициенты.

\(2\times\left [{\mathrm C}_4{\mathrm H}_{10}\;(l)\;+\;{\textstyle\color[rgb]{0,8, 0,0, 0,0} \ frac {13} 2} \; {\ mathrm O} _2 \; (g) \; \ rightarrow {\ color [rgb] {0,0, 0,0, 1,0} 4} \; {\ mathrm {CO}} _2 \ ;(g)\;+\;{\color[rgb]{0,6, 0,0, 1,0}5}\;{\mathrm H}_2\mathrm O\;(g)\right]\)
\(\boxed{2\;{\mathrm C}_4{\mathrm H}_{10}\;(l)\;+\;{\color[rgb]{0,8, 0,0, 0,0}13} \; {\ mathrm O} _2 \; (g) \; \ rightarrow {\ color [rgb] {0,0, 0,0, 1,0} 8} \; {\ mathrm {CO}} _2 \; (g) \; + \;{\color[rgb]{0,6, 0,0, 1,0}10}\;{\mathrm H}_2\mathrm O\;(g)}\)
- Необходимо выполнить окончательную проверку, чтобы убедиться, что уравнение остается сбалансирован по всем элементам.
\(\begin{array}{ccc}\mathrm{Элемент}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm C&8&8\\ \mathrm H&20&20\\\mathrm O&26&26\end{массив}\)
✏️ Упражнение \(\PageIndex{1}\)
Уравновесьте следующие химические уравнения.
- \(\mathrm V\;(s)\;+\;{\mathrm O}_2\;(g)\;\rightarrow\;{\mathrm V}_2{\mathrm O}_5\;( с)\)
- \(\mathrm{Mg}\;(s)\;+\;{\mathrm O}_2\;(g)\;\стрелка вправо\;\mathrm{MgO}\;(s)\)
- \({\mathrm C}_6{\mathrm H}_{12}{\mathrm O}_6\;(s)\;+\;{\mathrm O}_2\;(g)\;\rightarrow\ ;{\ mathrm{CO}}_2\;(s)\;+\;{\mathrm H}_2\mathrm O\;(l)\)
- \({\mathrm H}_2{\mathrm O}_2\;(aq)\;\xrightarrow{{\mathrm{MnO}}_2}\;{\mathrm H}_2\mathrm O\;(l) \;+\;{\mathrm O}_2\;(г)\)
- Ответ А
- \({\color[rgb]{0.0, 0.0, 1.0}4}\;\mathrm V\;(s)\;+\;{\color[rgb]{0.0, 0.0, 1.0}5}\; {\ mathrm O} _2 \; (g) \; \ rightarrow \; {\ color [rgb] {0,0, 0,0, 1,0} 2} \; {\ mathrm V} _2 {\ mathrm O} _5 \; (s )\)
- Ответ Б
- \({\color[rgb]{0.0, 0.0, 1.0}2}{\color[rgb]{0.0, 0.0, 1.0}\;}\mathrm{Mg}\;(s)\;+\;{ \ mathrm O} _2 \; (g) \; \ rightarrow \; {\ color [rgb] {0,0, 0,0, 1,0} 2} \; \ mathrm {MgO} \; (s) \)
- Ответ С
- \({\mathrm C}_6{\mathrm H}_{12}{\mathrm O}_6\;(s)\;+\;{\color[rgb]{0,0, 0,0, 1,0}6}\ ; {\ mathrm O} _2 \; (g) \; \ rightarrow \; {\ color [rgb] {0,0, 0,0, 1,0} 6} \; {\ mathrm {CO}} _2 \; (s) \; +\;{\color[rgb]{0,0, 0,0, 1,0}6}\;{\mathrm H}_2\mathrm O\;(l)\)
- Ответ D
- \({\color[rgb]{0,0, 0,0, 1,0}2}\;{\mathrm H}_2{\mathrm O}_2\;(aq)\;\xrightarrow{{\mathrm{MnO}}_2 } \; {\ color [rgb] {0,0, 0,0, 1,0} 2} \; {\ mathrm H} _2 \ mathrm O \; (l) \; + \; {\ mathrm O} _2 \; (g) \)
✅ Пример \(\PageIndex{4}\): Осаждение хлорида свинца(II)
Водные растворы нитрата свинца(II) и хлорида натрия смешивают. -\)) является многоатомным ионом и может быть уравновешен как единое целое.
-\)) является многоатомным ионом и может быть уравновешен как единое целое.
Pb(NO 3 ) 2 ( водный раствор ) + NaCl ( водный раствор ) → PbCl 2 ( с ) + 904 904 NaNO4 900 aq )
\(\ начало {array}{ccc}\mathrm{Единица}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm{Pb}&\vert&\vert\ \{\mathrm{NO}}_3&\vert\vert&\vert\\\mathrm{Na}&\vert&\vert\\\mathrm{Cl}&\vert&\vert\vert\end{массив}\)
- Судя по подсчетам, оказывается, что нитрат-ионы легко уравновешиваются, если поставить цифру «2» перед NaNO 9.0042 3 ( водный номер ).
Pb(NO 3 ) 2 ( водный раствор ) + NaCl ( водный раствор ) → PbCl 2 ( с ) + 0 2 NaNO 3 44 водный )
\(\ begin{массив}{ccc}\mathrm{Единица}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm{Pb}&\vert&\vert \\{\mathrm{NO}}_3&\vert\vert&\vert\vert\\\mathrm{Na}&\vert&\vert\vert\\\mathrm{Cl}&\vert&\vert\vert\end{массив }\)
- В этот момент атомы натрия и хлора разбалансированы.
 Однако это легко исправить, поставив перед NaCl ( aq ) коэффициент «2»:
Однако это легко исправить, поставив перед NaCl ( aq ) коэффициент «2»:
\(\boxed{\mathrm{Pb}{({\mathrm{NO}}_3)}_2\;(aq)\;+\;{\color[rgb]{0,8, 0,0, 0,0}2} \;\ mathrm{NaCl}\;(водный раствор)\;\стрелка вправо\;{\mathrm{PbCl}}_2\;(s)\;+\;{\color[rgb]{0,0, 0,0, 1,0}2 }\;{\mathrm{NaNO}}_3\;(водн.)}\)
- Окончательная проверка показывает, что теперь уравнение сбалансировано для всех элементов.
\(\begin{array}{ccc}\mathrm{Единица}&\mathrm{Реагент}\;\mathrm{Сторона}&\mathrm{Продукт}\;\mathrm{Сторона}\\\mathrm{Pb} &\vert&\vert\\{\mathrm{NO}}_3&\vert\vert&\vert\vert\\\mathrm{Na}&\vert\vert&\vert\vert\\\mathrm{Cl}&\vert\ vert&\vert\vert\end{array}\)
✏️ Упражнение \(\PageIndex{2}\)
Напишите сбалансированное химическое уравнение для этих словных уравнений.
- Газообразный азот реагирует с газообразным водородом с образованием газообразного аммиака.
- Водные растворы нитрата алюминия и карбоната лития смешивают с получением твердого осадка карбоната алюминия и водного раствора нитрата лития.

- Жидкий гексин (C 6 H 10 ) реагирует с газообразным водородом в присутствии платинового катализатора с образованием жидкого гексана (C 6 H 14 ).
- Ответ А
- Н 2 ( г ) + 3 Н 2 ( г ) → 2 NH 3 ( г )
- Ответ Б
- 2 Al(NO 3 ) 3 ( водный раствор ) + 3 Li 2 CO 3 ( водный раствор ) → Al 4 3 9042 2 2 ) 3 ( с ) + 6 LiNO 3 ( водный )
- Ответ C
- \({\mathrm C}_6{\mathrm H}_{10}\;(l)\;+\;{\color[rgb]{0,0, 0,0, 1,0}2}\;{\mathrm H} _2\;(g)\;\xrightarrow{\mathrm{Pt}}\;{\mathrm C}_6{\mathrm H}_{14}\;(l)\)
Резюме
- Чтобы химические уравнения были полезными, они всегда должны быть сбалансированы.
 Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома в обеих частях уравнения.
Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома в обеих частях уравнения. - Коэффициенты в сбалансированном уравнении должны представлять собой простейшее отношение целых чисел. Масса всегда сохраняется в химических реакциях.
Эта страница предоставляется под лицензией CK-12. Ее авторами, ремиксами и/или кураторами Лэнс С. Лунд (Общественный колледж Анока-Рамси), Мелисса Альвиар-Агнью и Генри Агнью. Первоисточник: https://www.ck12.org/c/chemistry/.
ЛИЦЕНЗИЯ ПОД
7.4: Balancing Chemical Equations распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- № на стр.

- Теги
- Уравновешивание химического уравнения
- Коэффициенты и индексы
- источник[1]-chem-47502
- источник[2]-chem-47502
Как сбалансировать химическое уравнение?
проверено Cite
Несмотря на то, что были приложены все усилия для соблюдения правил стиля цитирования, могут быть некоторые расхождения. Пожалуйста, обратитесь к соответствующему руководству по стилю или другим источникам, если у вас есть какие-либо вопросы.
Выбор стиля цитирования
MLAAPAChicago Руководство по стилю
Написано
Анна Дубей
Анна Дубей была стажером редактора Британской энциклопедии.
Анна Дубей
Факт проверен
Редакторы Британской энциклопедии
Редакторы Encyclopaedia Britannica контролируют предметные области, в которых они обладают обширными знаниями, будь то многолетний опыт, полученный в результате работы над этим контентом, или в результате обучения для получения ученой степени. Они пишут новый контент, а также проверяют и редактируют контент, полученный от участников.
Редакция Британской энциклопедии
© Павел Игнатов/stock.adobe.com Уравновешивание химических уравнений является полезным навыком в химии. В основе химических реакций лежит представление о том, что атомы и молекулы часто рекомбинируют в другие молекулы. Реагенты – это вещества, вступающие в химическую реакцию, а в результате реакции образуются продукты. Некоторые примеры химических реакций, которые вы, возможно, знаете, включают ржавчину, возникающую в результате реакции железа с водой и кислородом, и потерю пузырьков соды, возникающую при распаде угольной кислоты на углекислый газ и воду.
Фундаментальным принципом уравнений баланса является закон сохранения массы, который гласит, что материя, то есть физические вещества, такие как атомы и молекулы, не может быть создана или уничтожена. Это означает, что в обеих частях химического уравнения должна быть одинаковая масса атомов и, следовательно, одинаковое количество атомов. Например, рассмотрим простую химическую реакцию Ca + Cl 2 → CaCl 2 . Это уравнение уже уравновешено, потому что в нем одинаковое количество атомов Ca и Cl с каждой стороны. Уравновешивание уравнения включает изменение коэффициентов — чисел, помещаемых перед реагентами или продуктами для их умножения.
Обратите внимание, что коэффициент , который отображается слева от молекулы, отличается от нижнего индекса , который отображается более мелким шрифтом справа от молекулы. Коэффициент представляет количество молекул. Нижний индекс представляет количество атомов данного элемента в каждой молекуле. Например, в 3O 2 коэффициент равен 3, а нижний индекс равен 2. Чтобы определить общее количество присутствующих атомов, умножьте коэффициент на нижний индекс — общее количество молекул, умноженное на количество атомов в каждой молекуле. 3О 2 означает 6 полных атомов O. Уравнения баланса никогда не включают изменение нижнего индекса молекулы, а только изменение коэффициента. Изменение нижнего индекса изменит химический состав молекулы, а не количество молекул.
Например, в 3O 2 коэффициент равен 3, а нижний индекс равен 2. Чтобы определить общее количество присутствующих атомов, умножьте коэффициент на нижний индекс — общее количество молекул, умноженное на количество атомов в каждой молекуле. 3О 2 означает 6 полных атомов O. Уравнения баланса никогда не включают изменение нижнего индекса молекулы, а только изменение коэффициента. Изменение нижнего индекса изменит химический состав молекулы, а не количество молекул.
Так как же сбалансировать уравнение? Вот шаги: Во-первых, посчитайте атомы с каждой стороны. Во-вторых, изменить коэффициент одного из веществ. В-третьих, снова посчитайте количество атомов и оттуда повторяйте шаги два и три, пока не сбалансируете уравнение.
Вот пример химической реакции, которую необходимо сбалансировать: H 2 + O 2 → H 2 O.
Первым шагом является подсчет атомов с каждой стороны. Часто бывает полезно составить диаграмму или список, чтобы вы могли визуализировать числа. С левой стороны 2 H и 2 O, а с правой стороны 2 H и 1 O. Это уравнение еще не сбалансировано, потому что имеется разное количество атомов кислорода.
С левой стороны 2 H и 2 O, а с правой стороны 2 H и 1 O. Это уравнение еще не сбалансировано, потому что имеется разное количество атомов кислорода.
Второй шаг — изменить коэффициент одного из веществ с целью уравнять числа каждого атома слева и справа. Поскольку справа слишком мало атомов О, начните с увеличения коэффициента произведения, H 2 O. При выборе коэффициента старайтесь выбирать как можно более низкий. В этом случае хорошим предположением для коэффициента H 2 O будет 2. Обратите внимание, что изменение коэффициента влияет на все атомы в молекуле: если поставить 2 перед H 2 O, количество обоих Атомы H и O на 2. Кроме того, позаботьтесь об изменении только одного коэффициента за раз, чтобы избежать путаницы.
Шаг третий: снова подсчитайте атомы с каждой стороны и обновите диаграмму. Теперь, когда вы изменили уравнение на H 2 + O 2 → 2H 2 O, слева 2 H и 2 O, а справа 4 H и 2 O. Вы сбалансировали атомы O, но теперь слева слишком мало атомов H! На этом этапе уравновешивания уравнения повторяйте второй и третий шаги, пока количество атомов с каждой стороны не станет равным. Если вы измените коэффициент H 2 на 2, у вас теперь будет 4 H и 2 O слева и 4 H и 2 O справа. Уравнение 2H 2 + O 2 → 2H 2 О сбалансирован.
Если вы измените коэффициент H 2 на 2, у вас теперь будет 4 H и 2 O слева и 4 H и 2 O справа. Уравнение 2H 2 + O 2 → 2H 2 О сбалансирован.
Теперь давайте рассмотрим другую химическую реакцию. Это немного сложнее сбалансировать: CO 2 + H 2 O → C 6 H 12 O 6 + O 2 . Подсчет атомов говорит вам о несбалансированности уравнения. В левой части 1 C, 2 H и 3 O, а в правой части 6 C, 12 H и 8 O. Далее, на шаге два, измените один коэффициент. Попробуйте изменить коэффициент CO 2 на 6, чтобы уравнять количество атомов углерода с каждой стороны. После третьего шага и повторного подсчета атомов у вас теперь есть 6 C, 2 H и 13 O слева, а также 6 C, 12 H и 8 O справа. Затем сбалансируйте атомы H. Изменение коэффициента H 2 O на 6, так что в левой части есть 6 C, 12 H и 18 O, а в правой все еще сохраняется 6 C, 12 H и 8 O. Теперь единственным несбалансированным аспектом являются атомы O.

 Наименьшее общее кратное между 2 и 3 равно 6. Чтобы получить по 6 атомов кислорода с каждой стороны, перед O 2 ( г ) ставится коэффициент «3», а перед O 2 ставится коэффициент «2», а перед перед ал 2 О 3 ( с ):
Наименьшее общее кратное между 2 и 3 равно 6. Чтобы получить по 6 атомов кислорода с каждой стороны, перед O 2 ( г ) ставится коэффициент «3», а перед O 2 ставится коэффициент «2», а перед перед ал 2 О 3 ( с ): перед O 2 ( г ):
перед O 2 ( г ): Давайте еще раз проведем непрерывный подсчет, на этот раз используя цифры.
Давайте еще раз проведем непрерывный подсчет, на этот раз используя цифры. 0042 2 О ( г ):
0042 2 О ( г ):
 Однако это легко исправить, поставив перед NaCl ( aq ) коэффициент «2»:
Однако это легко исправить, поставив перед NaCl ( aq ) коэффициент «2»: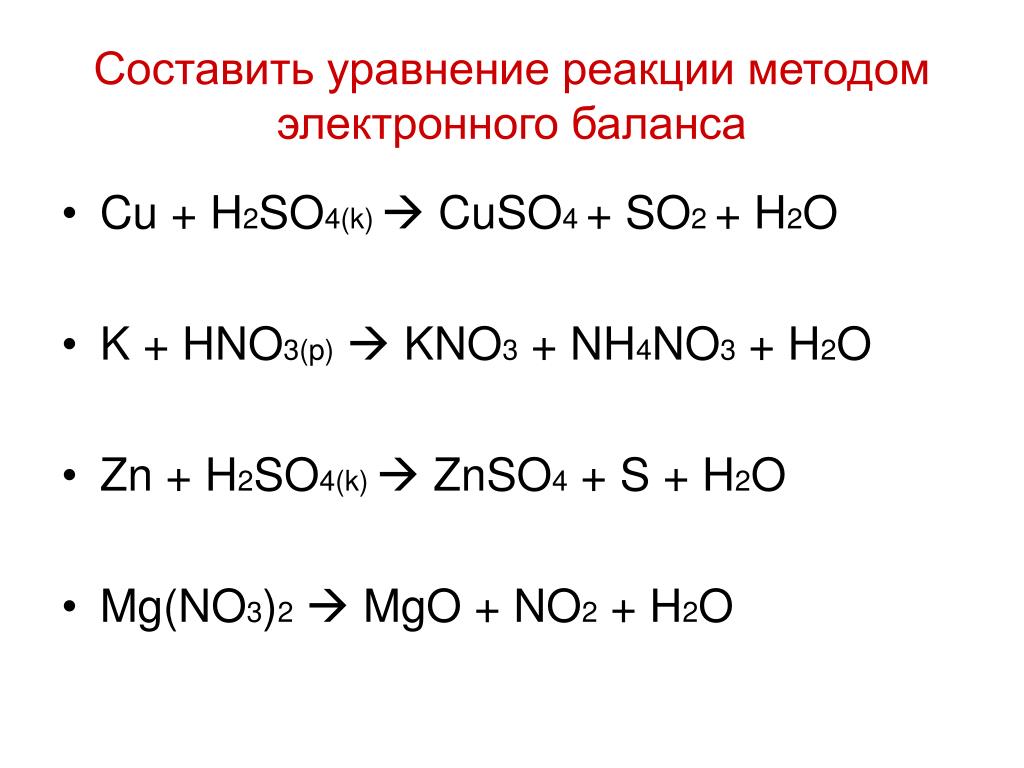
 Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома в обеих частях уравнения.
Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома в обеих частях уравнения.
Leave A Comment