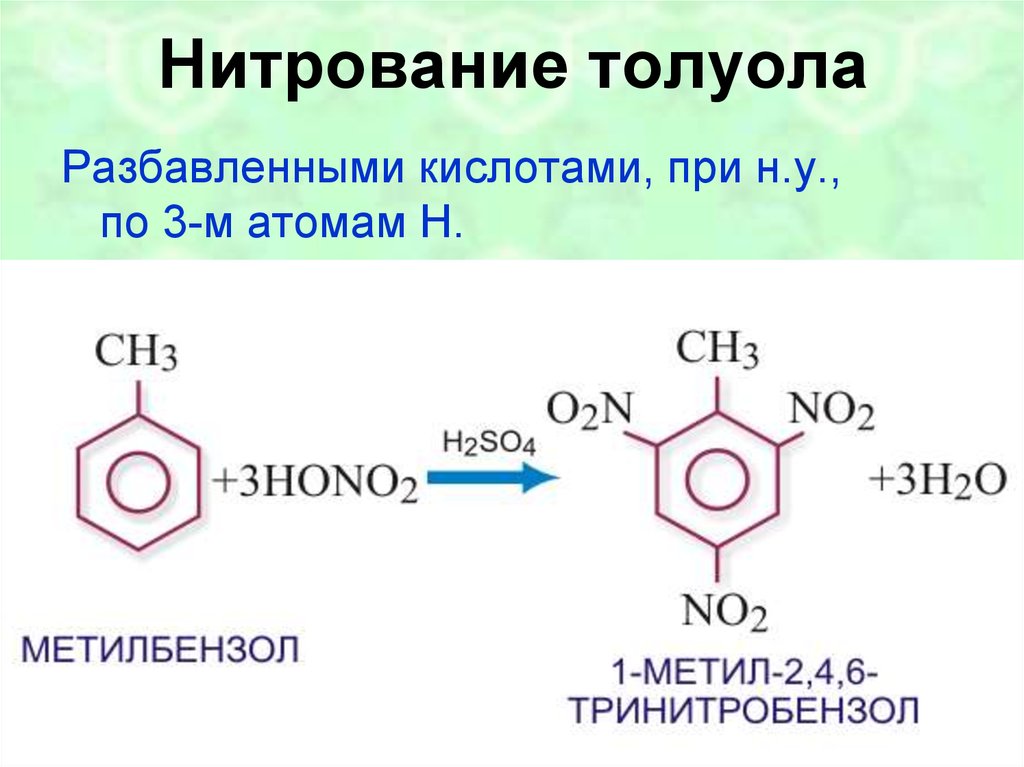
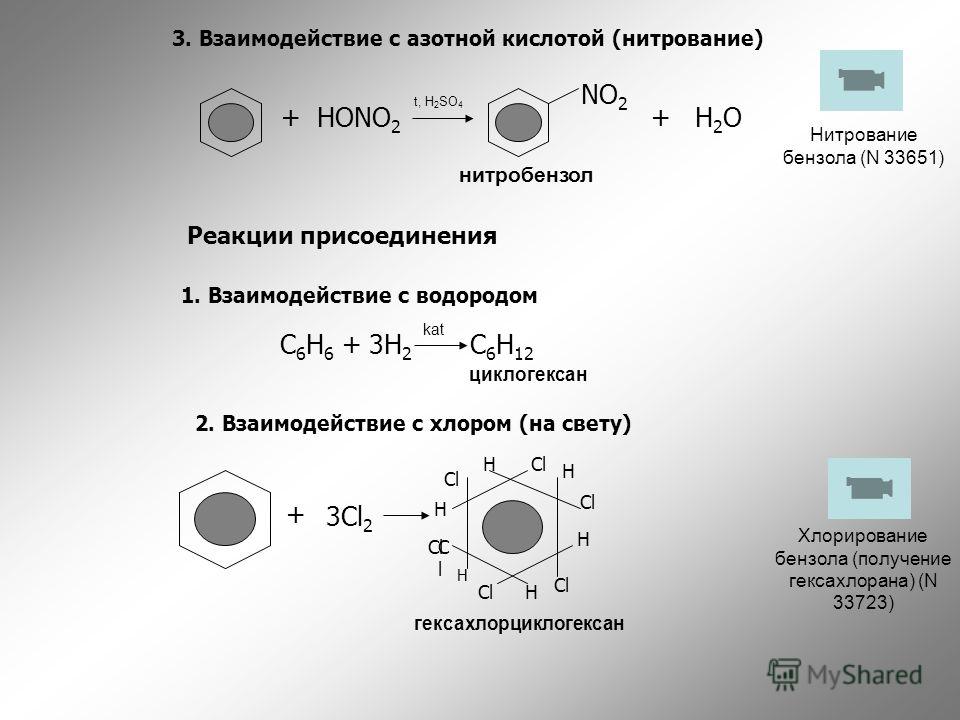
Способ нитрования бензола
Использование: получение нитробензола — сырья для синтеза анилина, бензидина, хинолина, азобензола. Сущность изобретения: бензол нитруют 65-70%-ной азотной кислотой на алюмосиликатах (ZSM-5, ZSM-11, модифицированных окислами железа, и/или стеклянной гранулированной насадке) в непрерывном режиме при температуре 70-90oC, молярном отношении азотной кислоты к бензолу, равном 1,4-1,5. Алюмосиликаты используются многократно, непрореагировавшие бензол и азотную кислоту возвращают на нитрование. Выход 39-82%. Положительный эффект: непрерывный режим с замкнутыми циклами по бензолу и азотной кислоте; ускорение реакции в 2,5-5 раз; увеличение производительности катализатора в 1,2-3,5 раз; повышение выхода в 1,1-2,4 раза. 2 з.п.ф-лы, 1 табл.
Изобретение относится к способам нитрования бензола и может быть использовано для получения нитробензола, который является сырьем для синтеза анилина, бензадина, хинолина, азобензола. Нитробензол имеет также самостоятельное применение.
В промышленности нитрование бензола осуществляется нитрирующей смесью (356% HNO3, 50% H2SO4, 15% H2O) в каскаде емкостных реакторов при температуре 60-70oC [1] Молярное отношение HNO3 к бензолу равно 0,95-0,98.
Основной недостаток этого способа наличие больших количеств (0,0-1,0 т на 1 т нитробензола) трудно утилизируемой отработанной серной кислоты. Кроме того, получаемый нитробензол содержит примеси динитробензола и нитрофенола.
В ряде статей и патентов описаны модификации приведенного способа: адиабатическое [2] и азеотропное [3] нитрование. Сущность первой модификации в ускорении реакции за счет повышения температуры по ходу потока реагентов через реакторы до 140oC. Сущность второй модификации в непрерывном удалении воды из реакционной среды в виде азеотропа с избыточным бензолом, в результате чего появляется возможность возвращать на нитрование серную кислоту без обработки.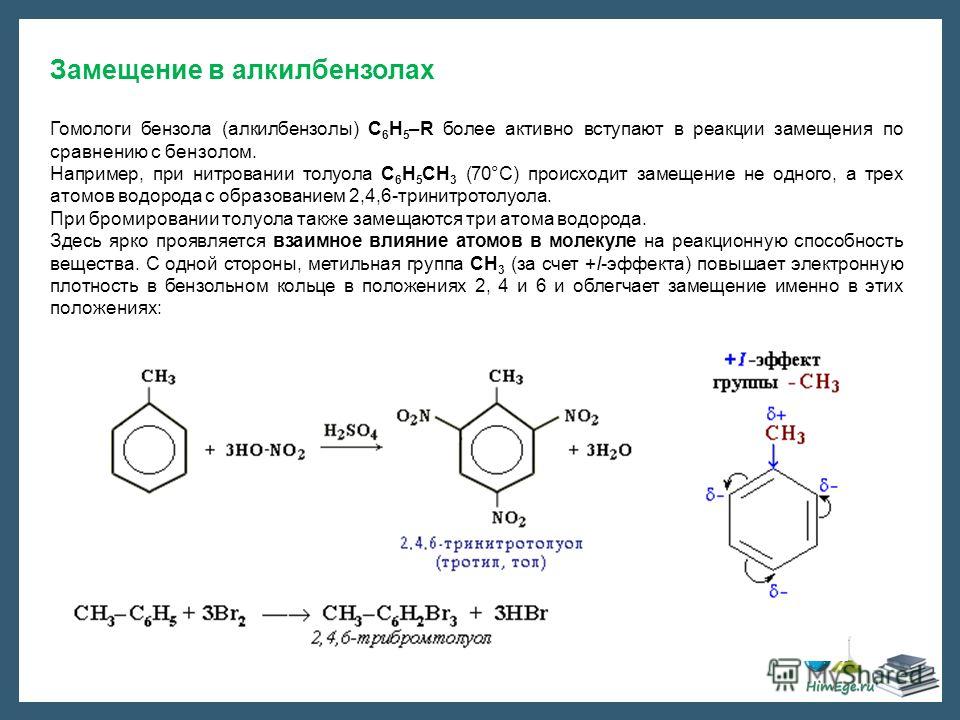 Обладая некоторыми достоинствами, описанные варианты гомогенного нитрования не устраняют из процесса серную кислоту и требуют повышенной температуры.
Обладая некоторыми достоинствами, описанные варианты гомогенного нитрования не устраняют из процесса серную кислоту и требуют повышенной температуры.
В ряде патентов и статей предложены гетерогенно-каталитические способы нитрования ароматических соединений, включая бензол. Подавляющее большинство этих способов имеет какой-либо существенный недостаток: либо дорого и труднодоступен катализатор [4] либо сложны условия реакции (температура до 300oC [5] ), либо низкая эффективность процесса [6] В некоторых случаях необходимо использование активирующих добавок-серной кислоты, уксусного ангидрида [7]). Наиболее перспективным представляется использование в качестве твердых катализаторов синтетических цеолитов. Наиболее часто предлагаемый при этом режим нитрования бензола газофазный (170oC). Нитрурующий агент 65-70% -ная азотная кислота при избытке бензола. Необходимо применение газа-носителя [8] Основной недостаток такого варианта использования цеолита его быстрая дезактивация. Кроме того, повышенная температура содействует протеканию побочных реакций и осложняет аппаратурное оформление процесса.
Кроме того, повышенная температура содействует протеканию побочных реакций и осложняет аппаратурное оформление процесса.
Наиболее близкий к предлагаемому способу процесс нитрования бензола описан в патенте [9] Реакцию осуществляли в стеклянном сосуде в присутствии цеолита ZSM-5 (0,8 г на 1 т бензола). В сосуд вводили 5 г бензола и 12,5 г 61%-ной азотной кислоты. Молярное отношение HNO3 к бензолу равно 1,89. Смесь перемешивали 2 ч при 75oC. Выход нитробензола, не содержащего динитропроизводных, составлял 34% Производительность катализатора 335 кг на 1 т цеолита в 1ч.
Недостатками описанного способа являются невысокие скорость реакции и выход нитробензола и, как следствие, невысокая производительность катализатора и эффективность процесса, что усугубляется его периодическим режимом работы. Отсутствуют данные о возможности повторного использования катализатора и отработанной азотной кислоты, данные по обработке продукта нитрования, по содержанию в нем иных, кроме динитробензола, побочных продуктов, в частности нитрофенола.
Цель изобретения ускорение реакции нитрования, повышение производительности катализатора, интенсификация работы реактора и процесса в целом. Второй целью является создание непрерывного процесса с замкнутым циклом по бензолу и азотной кислоте.
Поставленные задачи достигаются непрерывным покачиванием реагентов через слой цеолита типа ZSM-5 или типа ZSM-11 определенного состава и(или) слой стеклянной насадки, засыпаемых в реактор, в сочетании с повышенной против прототипа концентрацией азотной кислоты, переводом процесса нитрования в непрерывный режим с уменьшением продолжительности контакта реагентов в катализаторе, многократным использованием катализатора после регенерации, возвратом на нитрование непрореагировавшего бензола и отработанной азотной кислоты.
Предлагается использовать цеолиты с размером каналов в пределах 5,1-5,6 , имеющие следующие химические формулы: (0,02-0,03)Na2OAl2O3(27-150)SiO2(0,09-0,5)Fe2O3 Отличительной особенностью способа синтеза таких цеолитов является применение следующей последовательности стадий: получение цеолитного порошка из алюмокремнегеля, силикагеля, смеси силикагелей различного состава или метасиликата натрия в присутствии или отсутствии спиртов, в присутствии одного или нескольких изоморфнозамещающих элементов (алюминию, железо) при температуре не выше 175oC в течение не менее 4 ч; промывка синтезированного порошка до нейтральной pH; удаление органического соединения (спирта) с одновременным декатионированием (удалением части катионов Na) путем обработки раствором HNO3 с концентрацией не более 10% при температуре не выше 100oC в течение не более 4 ч; промывка цеолитного порошка дистиллированной водой; сушка цеолитного порошка при температуре не выше 110oC.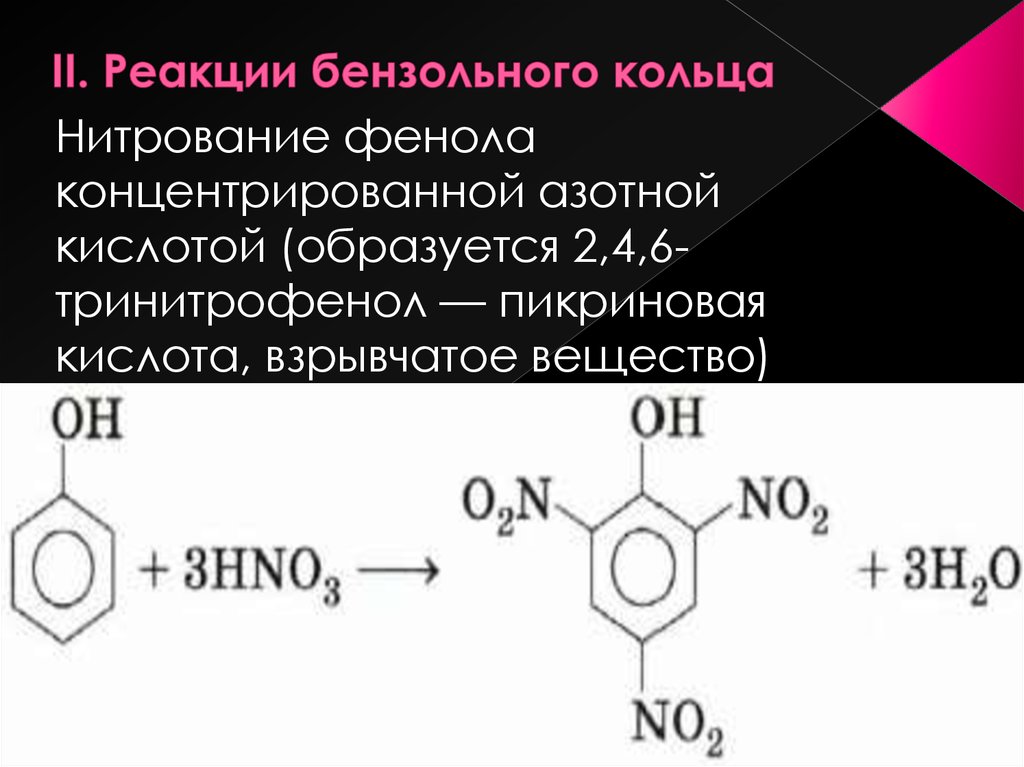 В процессе кристаллизации цеолитов при введении в реакционную смесь, поступающую на гидротермальную обработку, соединений (источников) катионов железа происходит модификация алюмосиликатного каркаса цеолитов.
В процессе кристаллизации цеолитов при введении в реакционную смесь, поступающую на гидротермальную обработку, соединений (источников) катионов железа происходит модификация алюмосиликатного каркаса цеолитов.
Предложенная последовательность стадий приготовления цеолитых катализаторов обеспечивает их активность в реакциях, идущих по кислотно-основному механизму, и описывается в примерах 1, 2.
Гранулированную стеклянную насадку получают измельчением и рассевом стекла.
Нитрование на указанных цеолитах осуществляют азотной кислотой концентрации 65-70% при температуре 70-90oC, молярном отношении азотной кислоты к бензолу 1,4-4,5. Производительность катализатора находится в пределах 400-1188 кг нитробензола на 1 т в 1 ч (392-864 кг на 1 м3 в 1 ч).
Приведенные выше в обобщенной химической формуле цеолитов интервалы величин молей окислов, приходящихся на 1 моль Al2O3, обеспечивая рациональное сочетание активности катализаторов с их селективностью. Увеличение относительного содержания модифицирующих добавок (алюминия, железа) приводит к резкому ускорению побочных реакций, а уменьшение содержания модифицирующих добавок к снижению активности катализатора и ухудшению технологических показателей.
Увеличение относительного содержания модифицирующих добавок (алюминия, железа) приводит к резкому ускорению побочных реакций, а уменьшение содержания модифицирующих добавок к снижению активности катализатора и ухудшению технологических показателей.
При использовании в качестве катализатора стеклянной гранулированной насадки снижаются технологические показатели, но упрощается технология.
Катализаторы алюмосиликаты регенерировали любым способом, например продувкой воздухом при температуре 500oC в течение 1,5 ч.
Уменьшение концентрации азотной кислоты до 65% снижает технологические результаты примерно на 20% Повышение концентрации HNO3 сверх 70% необратимо дезактивирует цеолит.
Осуществление нитрования в приведенных температурном интервале концентраций HNO3 с дифференциацией в зависимости от вида катализатора и некоторых технологических параметров ведет к рациональному сочетанию интенсивности и селективности реакции.
Величина избытка азотной кислоты может быть выбрана в зависимости от желаемого конечного результата: увеличение избытка повышает степень превращения бензола и выход нитробензола за один проход через реактор, но ухудшает чистоту продукта.
В принятых интервалах условий нитрования конкурентоспособность предлагаемого способа сохраняется.
В качестве реактора использовали трубку из стекла или нержавеющей стали с внутренним диаметром 16 мм, высотой рабочей зоны 80 мм, имеющей решетку, на которую насыпали алюмосиликаты. Реагенты подводились к рабочей зоне по системе трубок.
Таким образом, отличительными признаками предлагаемого способа являются: 1. Применение цеолитов типа ZSM-5 или ZSM-11 с молярным отношением SiO2/Al2O3, равным 27-150, модифицированных малыми количествами катионов железа, а также стеклянной гранулированной насадки.
2. Неоднократное повторное использование насадки реактора, катализирующей реакцию нитрования.
3. Непрерывное проведение процесса нитрования, что обеспечивает снижение потерь, отходов, стабилизацию качества продукта, который не содержит динитробензола и нитрофенола.
Перечисленные отличительные признаки позволяют расширить круг катализаторов процесса нитрования бензола, в 2,5-5 раз ускорить реакцию нитрования, повысить в 1,1-2,4 раза выход нитробензола, в 1,2-3,5 раза увеличить производительность катализатора. Создается основа для эффективного непрерывного производства нитробензола.
Сущность способа иллюстрируется следующими примерами.
Пример 1. Реакционную смесь для синтеза цеолитного порошка готовят смешением в 158 мл воды тонкодисперсных 0,98 г затравки цеолита и 31,63 г порошка марки ШСК-Г, содержащего 91,6% SiO2 и 0,33% Al2O3, с последовательным добавлением при перемешивании следующих растворов: 3,65 мл 0,5 М алюмината натрия; 5,1 мл 0,28 М хлорида железа; 15,5 мл 0,2 М борной кислоты; 8,8 мл 11,7 М едкого натра и 12,3 мл бутилового спирта.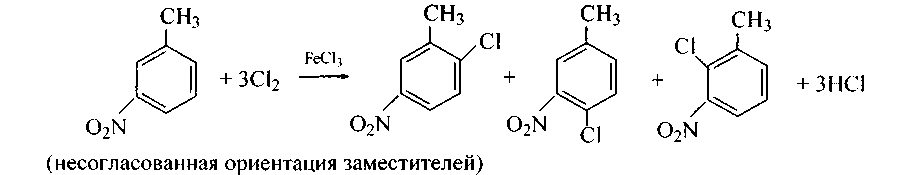
Смесь выдерживают при 170-175oC в течение 4 ч. Цеолитная масса, полученная при синтезе, отмывается водой на фильтре от избытка щелочи, затем к ней добавляют тройное количество 6%-ного раствора HNO3 (что соответствует отношению жидкости к твердому, равному 3), нагревают до 90oC и выдерживают при перемешивании 0,5 ч.
Затем массу отфильтровывают, промывают дистиллированной водой до pH 4-5 и высушивают при температуре 110oC.
Химическая формула конечного продукта: 0,02Na2OAl2O3150SiO20,5Fe2O3 По структуре и составу цеолит соответствует типу ZSM-11.
Пример 2. Синтез цеолита проводят аналогично примеру 1, но в реакционную смесь добавляют 20,3 мл 0,5 М раствора алюмината натрия.
Химическая формула готового продукта: 0,3Na2OAl2O327SiO20,09Fe2O3 По структуре и составу цеолит соответствует типу ZSM-5.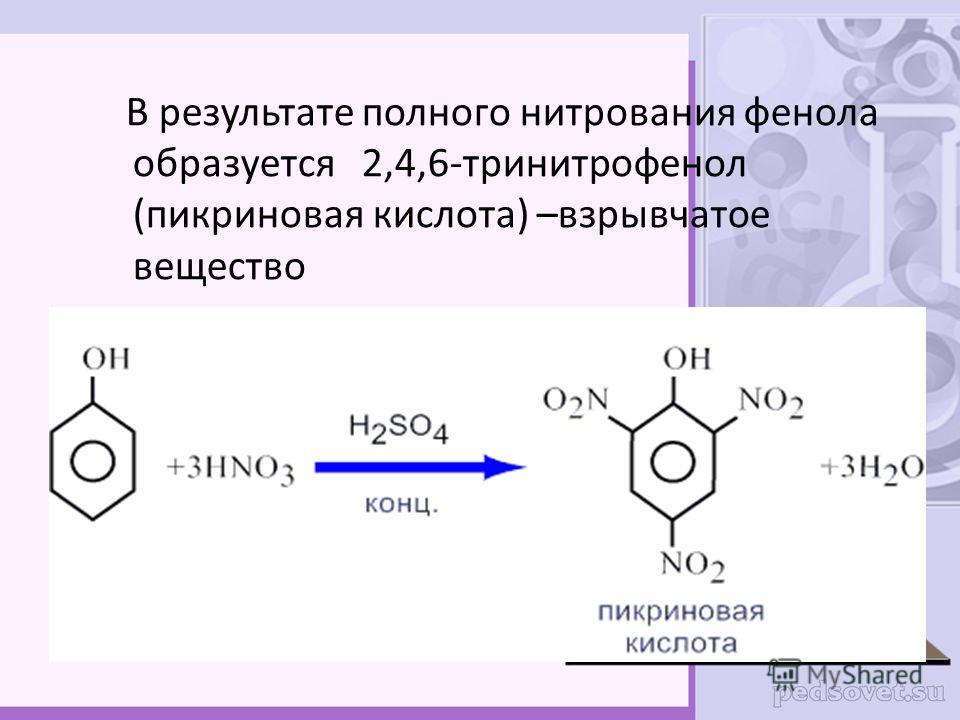
Пример 3. Стеклянный реактор, имеющий опорную решетку для насадки, заполняют стеклянными гранулами размером 1-1,5 мм. Масса насадки в рабочей зоне 15,21 г (11,6 мл). Насадку прогревают в течение 1,5 ч при 135oC с продувкой 17л/ч воздуха. Охлаждают реактор до 80 oC.
Непрерывно прокачивают через реактор в течение 12 ч при средней температуре насадки 81-83oC бензол (скорость 5,9 мл/ч) и 68,6%-ную азотную кислоту (скорость 19,6 мл/ч). Молярное отношение HNO3: бензол 4,5. Продукты нитрования собирают в приемнике отделяют органический слой от водного. Из водного слоя экстрагируют органические вещества метилхлоридом, экстракт объединяют с органическим слоем, смесь промывают водой, высушивают сульфатом натрия, фильтруют, упаривают растворитель. Получают 79,22 г продуктов нитрования, содержащих 92,2 нитробензола, 7,2 бензола, 0,15% нитрофенола, 0,4% неидентифицированных примесей.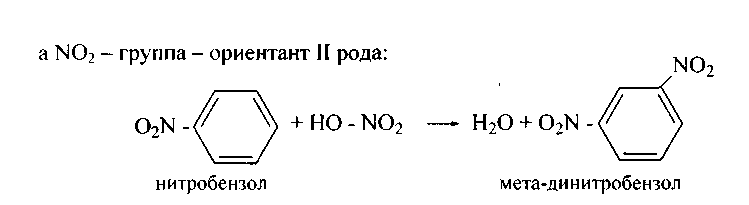 Динитробензол отсутствует. Из полученной смеси промывкой 2,5%-ным раствором NaOH может быть удален нитрофенол. Из оставшейся смеси отгонкой в вакууме (остаточное давление 60-70 мм рт.ст.) при 40oC удаляют бензол, который возвращают на нитрованние. Отработанную азотную кислоту (концентрация 59,4%) после укрепления также возвращают на нитрование. Выход нитробензола за один проход через реактор 72% Производительность насадки реактора по нитробензолу в 1ч на 1 т и на 1 м3 соответственно 400 кг и 525 кг.
Динитробензол отсутствует. Из полученной смеси промывкой 2,5%-ным раствором NaOH может быть удален нитрофенол. Из оставшейся смеси отгонкой в вакууме (остаточное давление 60-70 мм рт.ст.) при 40oC удаляют бензол, который возвращают на нитрованние. Отработанную азотную кислоту (концентрация 59,4%) после укрепления также возвращают на нитрование. Выход нитробензола за один проход через реактор 72% Производительность насадки реактора по нитробензолу в 1ч на 1 т и на 1 м3 соответственно 400 кг и 525 кг.
Пример 4. Рабочую зону стеклянного реактора заполняют (снизу вверх) стеклянной насадкой (цилиндры диаметром 1-1,5 мм, длиной 3-6 мм; гранулы размером 1-1,5 мм и цеолитом типа ZSM-11, полученном в условиях примера 1. Масса и объем стеклянных частиц 5,4 г, 4,5 мл. Масса и объем цеолита 5,58 г, 8,1 мл. Реактор нагревают печью до 500oC и продувают воздухом (20л/ч) при 500-525oC в течение 1,5 ч. Охлаждают реактор до 80oC в течение 4,7 ч ведут нитрование при средней температуре 76oC. Прокачивая через реактор бензол (5,9 мл/ч) и 69,5%-ную азотную кислоту (18,1 мл/ч). Молярное отношение HNO3: бензол 4,2. После обработки, описанной в примере 3, получают 30,68 г смеси, содержащей 94,8% нитробензола, 4,8% бензола, 0,4% нитрофенола. Динитробензол отсутствует. Выход нитробензола за один проход через реактор 75% Производительность насадки реактора по нитробензолу в 1ч на 1 т 560 кг, на 1 м3 488 кг.
Прокачивая через реактор бензол (5,9 мл/ч) и 69,5%-ную азотную кислоту (18,1 мл/ч). Молярное отношение HNO3: бензол 4,2. После обработки, описанной в примере 3, получают 30,68 г смеси, содержащей 94,8% нитробензола, 4,8% бензола, 0,4% нитрофенола. Динитробензол отсутствует. Выход нитробензола за один проход через реактор 75% Производительность насадки реактора по нитробензолу в 1ч на 1 т 560 кг, на 1 м3 488 кг.
Пример 5. На решетку стеклянного реактора насыпают 5,57 г (4,5мл) стеклянной насадки использовавшейся в примере 4 и поверх нее 4,56 г (8,5 мл) цеолита типа ZSM-5, полученного в условиях примера 2 и прошедшего три цикла нитрования и регенерации. Прокаливают и охлаждают реактор, как описано в примере 4, и проводят непрерывно в течение 21,9 ч нитрование при средней температуре 81-84oC, прокачивая через реактор бензол (12 мл/ч) и 70%-ную азотную кислоту (12мл/ч). Молярное отношение HNO3:бензол 1,4. Смесь, собранную в приемнике на выходе из реактора, разделяют на органическую и водную фазы.
Органическую фазу промывают водой (0,39 г на 1 т органической фазы), 2,6% -ным раствором гидроксида натрия (0,17 г на 1 г органической фазы) и снова водой (0,33 на 1 г органической фазы). Высушивают смесь сульфатом натрия (0,024 г на 1 г органической фазы), деканируют жидкость. Получают 295,0 г смеси органических продуктов, содержащей 51,7% нитробензола, 48,2% бензола, 0,1% неидентифицированных примесей. Динитробензол и нитрофенол отсутствуют. От этой смеси при температуре 36oC и остаточном давлении 15 мм рт.ст. отгоняют бензол, который возвращают на нитрование.
Водную фазу промывают бензолом (0,36 г на 1 г водной фазы). Экстракт, содержащий извлеченные из отработанной азотной кислоты органического вещества, используют в дальнейшем в качестве исходного продукта для нитрования. Промытую отработанную азотную кислоту (концентрация 57%) укрепляют дымящейся кислотой до 65% и в дальнейшем используют в качестве нитрирующего агента.
Выход нитробензола за один проход реагентов через реактор в первые 21,9 ч нитрования составил 41% Часовая производительность насадки реактора по нитробензолу составила в этот период 688 кг на 1 т и 536 кг на 1 м3.
Без какого-либо воздействия на насадку реактора продолжают при температуре 82oC процесс нитрования, уменьшив скорости подачи бензола и 70%-ной азотной кислоты до 8,5 мл/ч. После 10 ч нитрования и описанной выше обработки продуктов получают 94,4 г смеси нитробензола (67,9%) и бензола (32,1%). Выход нитробензола 54% Производительность насадки по нитробензолу в 1ч составила 633 кг га 1 т, 493 кг на 1 м3.
Продолжают нитрование при 80oC, подавая в реактор экстракт (см. выше) и отработанную укрепленную азотную кислоту, полученные на первом отрезке цикла нитрования. После 13,6 ч нитрования имеют 123,7 г смеси нитробензола (56%), бензола (43,9% ) и неидентифицированных примесей (0,1%).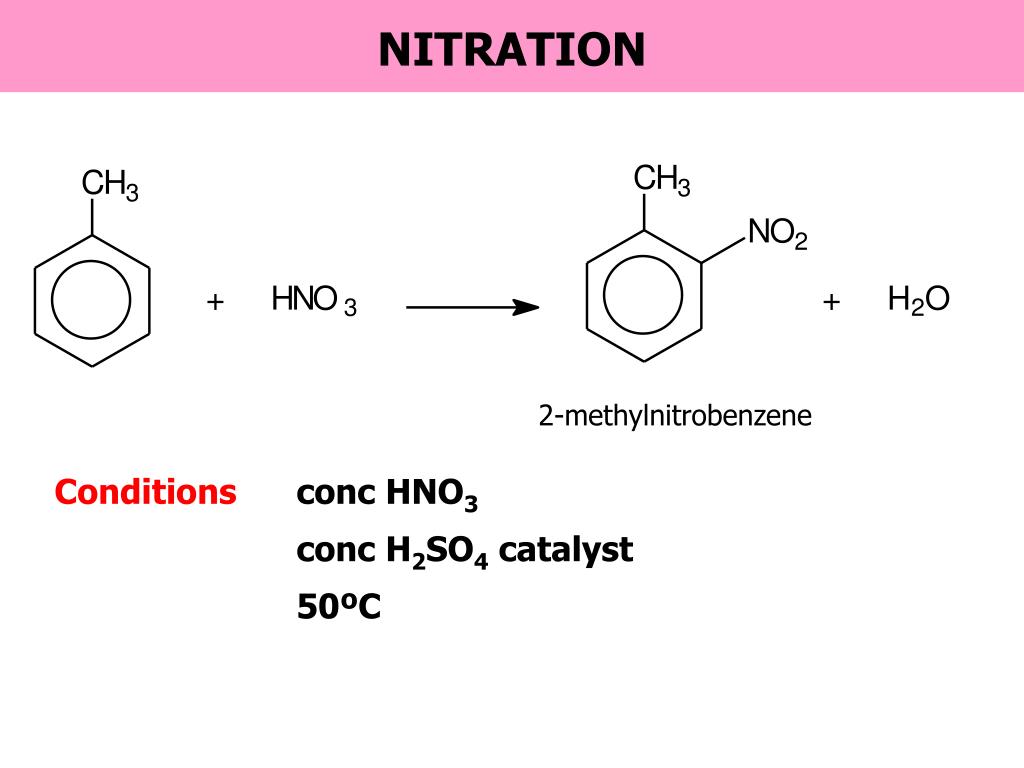 Выход нитробензола 43% С 1 т насадки получают в 1ч 504 кг нитробензола, 1 м3 392 кг.
Выход нитробензола 43% С 1 т насадки получают в 1ч 504 кг нитробензола, 1 м3 392 кг.
Пример 6. Рабочую зону стеклянного реактора заполняют (снизу вверх) стеклянной насадкой, использовавшейся в примере 3 (4,11 г, 3,2 мл), и свежим цеолитом типа ZSM-5, использовавшимся в примере 5 (4,98 г, 9,3 мл). Прокаливают реактор при 200-225oC в течение 1,5 ч с подачей 17 л/ч воздуха, затем охлаждают до 80oC.
Проводят нитрование при средней температуре насадки 84oC в течение 10,7 ч, подавая бензол со скоростью 13,8 мл/ч, а 69,3%-ную азотную кислоту со скоростью 18,0 мл/ч. Молярное отношение HNO3: бензол 1,8.
Обрабатывают продукт нитрования аналогично примеру 3 с получением 160,5 г смеси органических продуктов, содержащих 72,2% нитробензола, 27,7% бензола и 0,1% неидентифицированных примесей. Динитробензол и нитрофенол отсутствуют.
Выход нитробензола за один проход реагентов через реактор составил 54% Часовая производительность насадки реактора по нитробензолу составила 1183 кг на 1 т и 864 кг на 1 м3 насадки.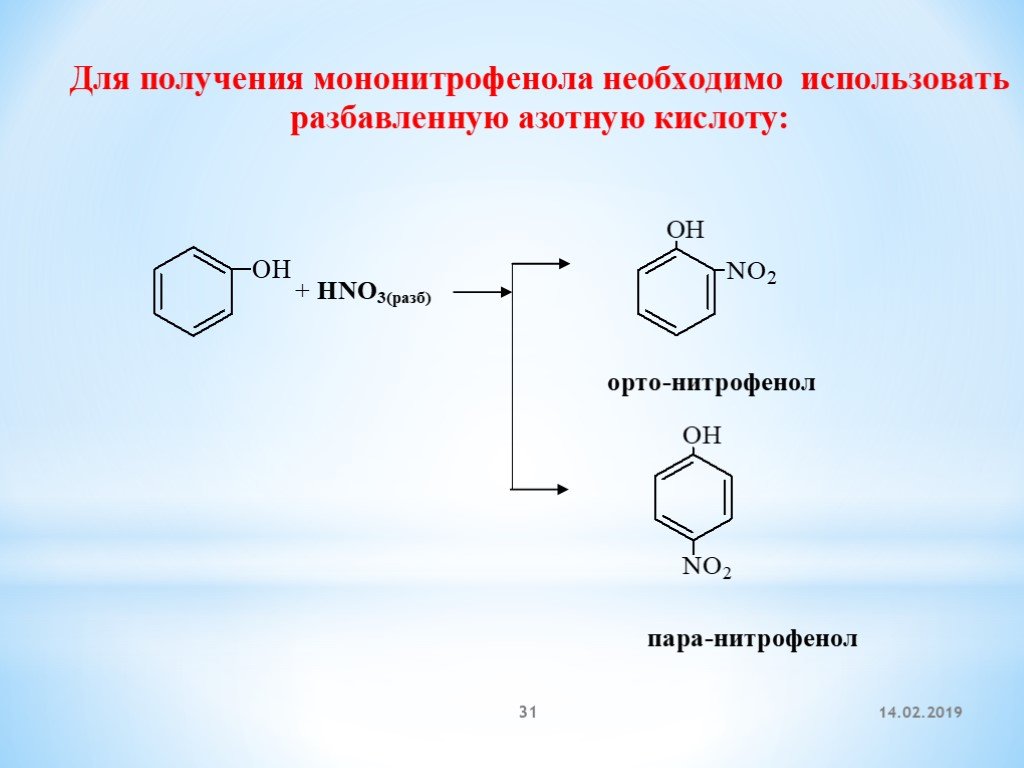
Пример 7. Проводят нитрование в реакторе из стали Х18Н10Т, содержащем в рабочей зоне 7,5 г (5,4 мл) стеклянной насадки и 4,21 г (8,0 мл) цеолита типа ZSM-5, использовавшегося в примере 5. Насадка прошла два цикла нитрования и регенерации. Прокачивают через реактор при температуре 85oC бензол и 68,6% -ную азотную кислоту в течение 10 ч. Оба реагента подают со скоростями 12 мл/ч, что соответствует молярному отношению HNO3:бензол 1,4.
Продукт реакции обрабатывают так же, как в примере 5, и получают 132,94 г смеси нитробензола (48,3%) с бензолом (51,7%).
Выход нитробензола составил 39% Часовые производительности 1 т и 1 м3 насадки соответственно 548 и 479 кг.
Уменьшают скорость прокачивания бензола до 8,5 мл/ч, в результате чего отношение NHO3:бензол возрастает до 1,9 и продолжают нитрование еще 9,2 ч.
Органическая часть продукта нитрования, обработанного по примеру 5, представляет собой смесь нитробензола и бензола в соотношении 62,6:37,4.
Выход нитробензола за один проход реагентов через реактор составил 50% съем нитробензола с 1 т и 1 м3 насадки 508 кг и 444 кг соответственно.
В таблице приведены условия и результаты нитрования, достигнутые в прототипе и примерах 3-7 данного изобретения.
Таким образом, предлагаемый способ нитрования бензола по сравнению с известным способом позволяет в 2,5-5 раз ускорить реакцию нитрования; в 1,2-3,5 раза увеличить производительность катализатора; в 1,1-2,4 раза повысить выход нитробензола; разработать технологию нитрования бензола в непрерывном режиме с замкнутыми циклами по бензолу и азотной кислоте.
Указанные преимущества в сочетании с расширением круга применяемых алюмосиликатов и возможностью их многократного использования открывают перспективу промышленной реализации нового процесса нитрования бензола.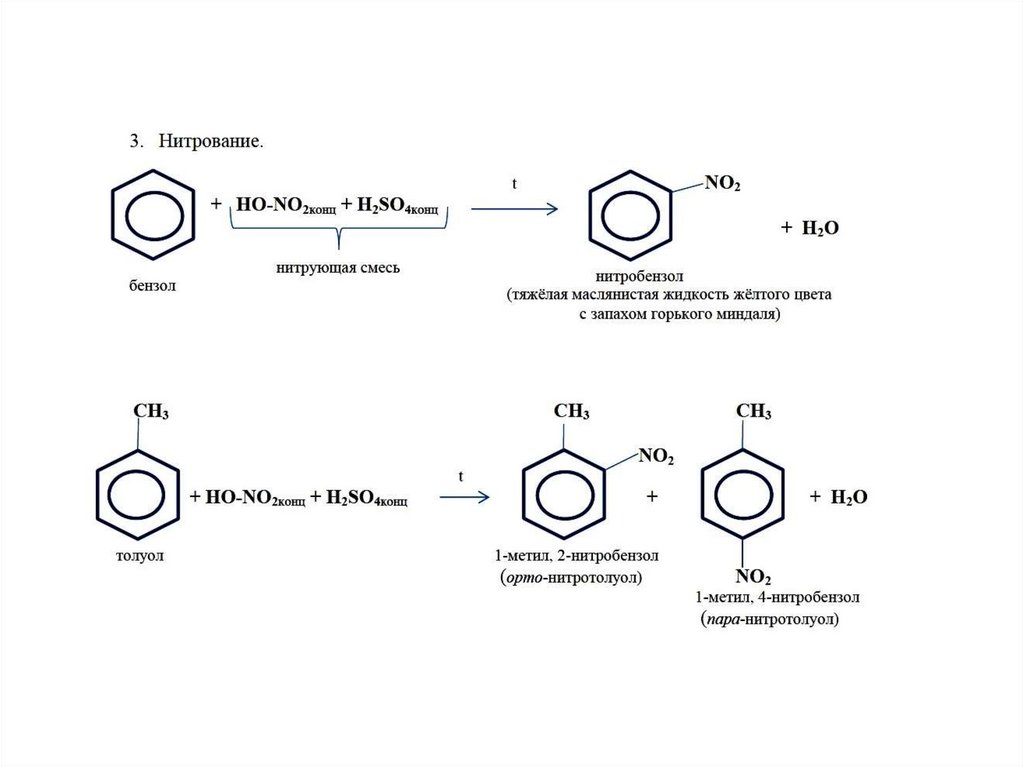
Источники информации, принятые во внимание:
1. М. В.Горелик, Л.С.Эфрос. Основы химии и технологии ароматических соединений. М. Химия, 1992, с.140.
2. Патент США N 4.021.498.
3. Европейская патентная заявка N 395556.
4. PCT Int. Appl. WO 9000,087.
5. Заявка Японии 249755.
6. Патент США 3957889.
7. Патент США 5030776.
8. W. F. Holderich and van Bekkum. Stud. Surf. Sci. Catal. v.58(1991),p. 677.
9. Патент Японии 63-225339.
Формула изобретения
1. Способ нитрования бензола водными растворами азотной кислоты в присутствии алюмосиликатов при нагревании, отличающийся тем, что его осуществляют непрерывно и в качестве алюмосиликатов используют стеклянную гранулированную насадку и (или) цеолиты ZSM-5 и ZSM-11, модифицированные окислами железа.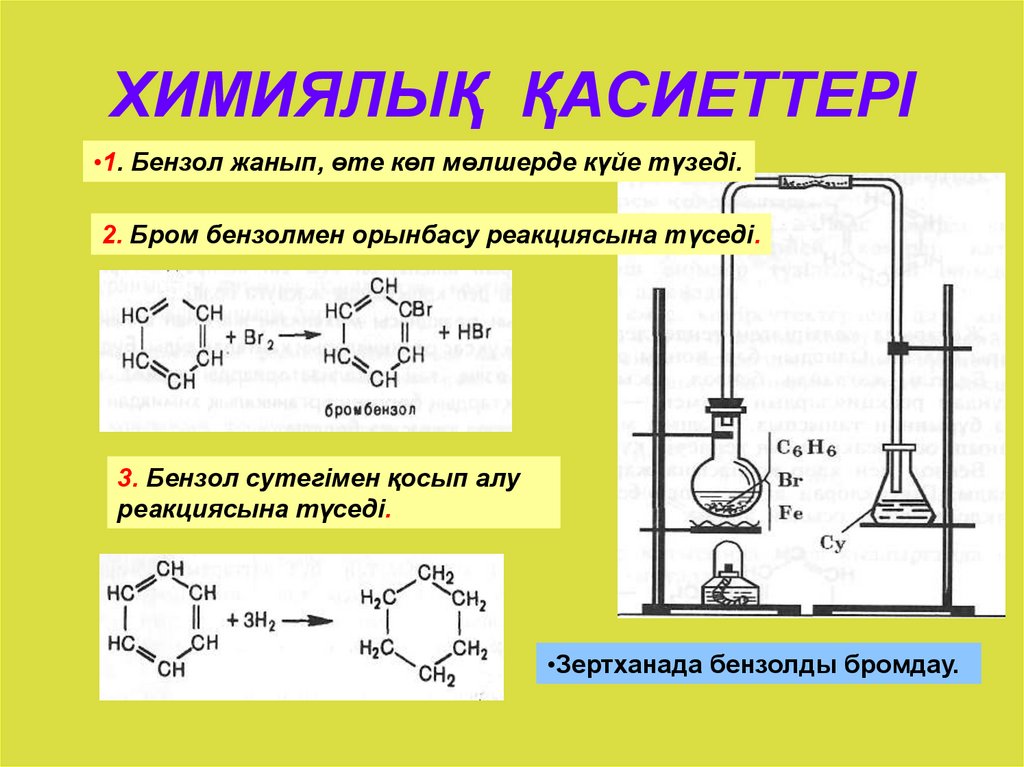
2. Способ по п. 1, отличающийся тем, что нитрование на алюмосиликатах осуществляют 65-70%-ной азотной кислотой при молярном отношении азотная кислота бензол, равном 1,4-4,5.
3. Способ по п. 1, отличающийся тем, что алюмосиликаты, загружаемые в реактор, используют многократно, а непрореагировавшие бензол и азотную кислоту возвращают на нитрование.
РИСУНКИ
Рисунок 1
8. Химические свойства.
Реакции электрофильного замещения в ароматическом ядре (SЕ).
Арены вступают в
ионные реакции, протекающие по механизму
электрофильного замещения, обозначаемого
символом SE (от англ. substitution
electrophilic).
Реакция начинается с возникновения π
– комплекса, из которого затем образуется
-комплекс,
и завершается стабилизацией -комплекса
за счёт отщепления протона.
Механизм реакции электрофильного присоединения.
а) Образование π – комплекса:
Электрофильный реагент Е+ атакует π-электронное облако ароматического кольца, и за счёт слабого электростатического взаимодействия образуется неустойчивый π-комплекс. Ароматическая система при этом не нарушается. Эта стадия протекает быстро.
+ Е+ Е+
π – Комплекс
б) Образование σ-комплекса:
На этой медленной стадии идёт образование ковалентной связи между электрофильной частицей и одним из атомов углерода бензольного кольца. Связь образуется за счёт двух электронов кольца и сопровождается переходом одного из атомов углерода из sp2— в sp
 е. он становится
тетраэдрическим. Ароматическая система
при этом нарушается. Четыре оставшиеся
π-электрона распределяются между пятью
атомами углерода цикла и молекула
бензола превращается в карбкатион, или
σ-комплекс.
е. он становится
тетраэдрическим. Ароматическая система
при этом нарушается. Четыре оставшиеся
π-электрона распределяются между пятью
атомами углерода цикла и молекула
бензола превращается в карбкатион, или
σ-комплекс.Е Н
Е+
π – Комплекс σ – Комплекс (Карбкатион)
в) Отщепление протона.
Нарушение ароматичности энергетически невыгодно, поэтому структура σ-комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом. При этом два электрона возвращаются в π-систему и тем самым восстанавливается ароматичность.
Е Н Е
— Н+
σ – Комплекс
Реакции электрофильного
замещения в ароматическом ряду широко
используются в промышленности для
синтеза многих производных бензола.
1. Галогенирование.
Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов, которыми чаще всего являются безводные галогениды алюминия AlCl3, AlBr3 и железа FeCl3, FeBr3.
Н Cl
FeCl3, 25°С
+ Cl2 + НCl
Бензол Хлорбензол
Эта реакция используется только для получения хлор- и бром- замещённых аренов. Реакция с фтором протекает слишком бурно, так как фтор очень активен и получить фторзамещённые продукты невозможно. Реакция иодирования аренов практически не осуществляется ввиду очень низкой активности йода.
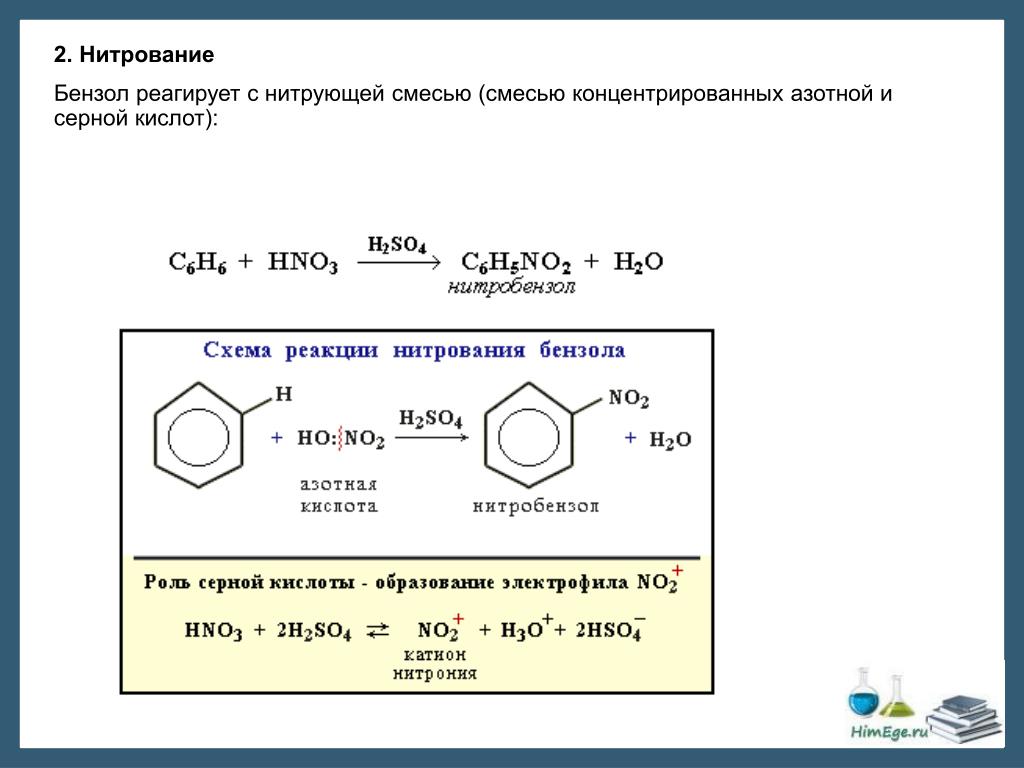
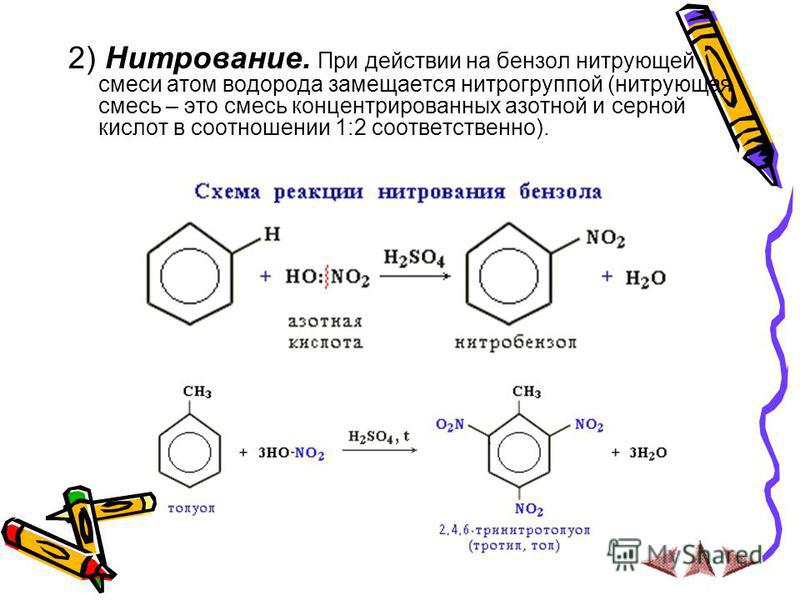
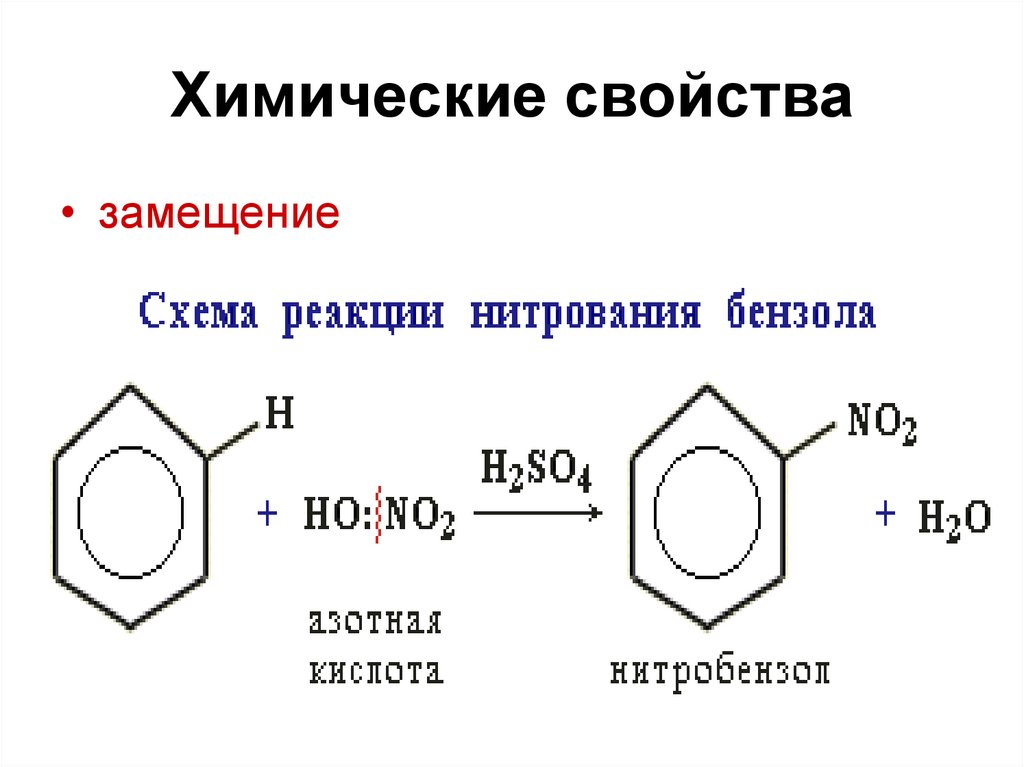
2 . Нитрование.
Бензол очень медленно
реагирует с концентрированной азотной
кислотой даже при нагревании. Однако
при действии на него смеси концентрированных
азотной и серной кислот, так называемой
нитрующей
смеси, легко
происходит реакция нитрования, т. е.
замещение водорода в ядре на нитрогруппу
– NO
Однако
при действии на него смеси концентрированных
азотной и серной кислот, так называемой
нитрующей
смеси, легко
происходит реакция нитрования, т. е.
замещение водорода в ядре на нитрогруппу
– NO
Н NO2
H2SO4, 50°С
+ HNO3 + Н2O
Бензол Нитробензол
Атакующей электрофильной частицей в этой реакции является нитроил-катион NO2+, который образуется при взаимодействии азотной и серной кислот.
H
NO3 + 2H2SO
Нитроил- Гидрок-
катион соний
ион
3. Сульфирование.
Сульфирование.
В результате этой реакции происходит замещение водорода в бензольном ядре на сульфогруппу – SO3H. Бензол взаимодействует с дымящей серной кислотой при комнатной температуре. Дымящей называется серная кислота, в которой растворён оксид серы (VI). Именно нейтральная молекула оксида серы (VI), или триоксида серы, является электрофильным реагентом.
Н SO3Н
H2SO4, 25°С
+ SO3
Бензол Оксид серы (VI) Бензолсульфокислота
В отличие от других
реакций электрофильного замещения
сульфирование аренов является обратимой
реакцией. При нагревании с водой в кислой
среде происходит обратная реакция –
десульфирование
с образованием исходного ароматического
углеводорода.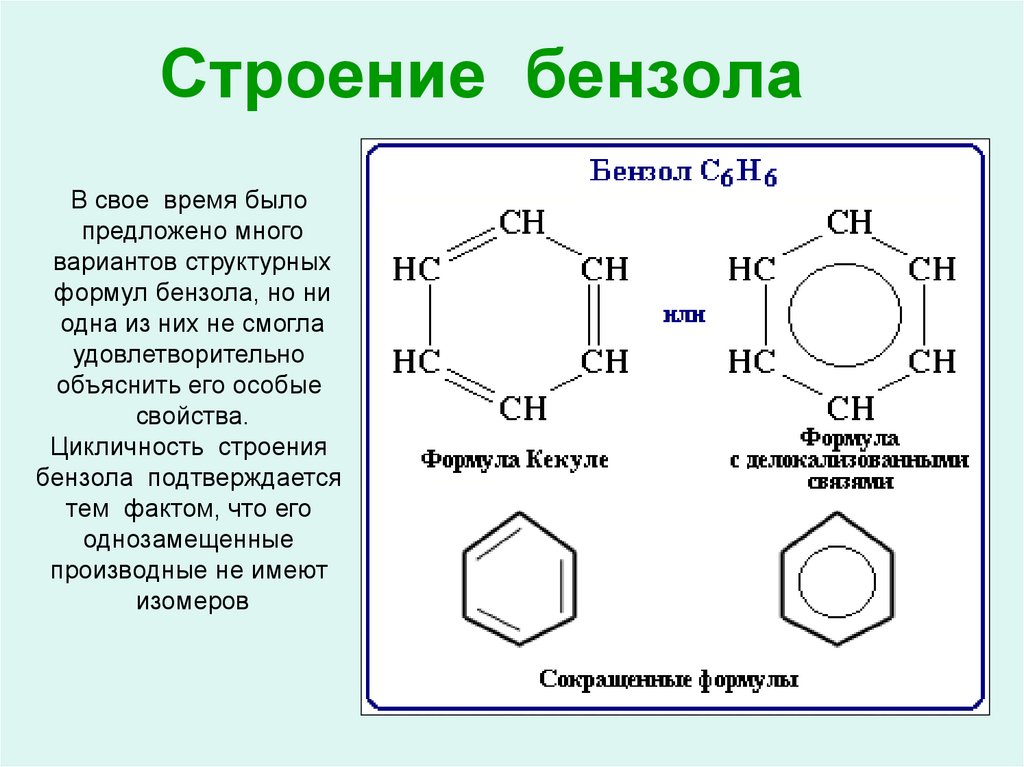
SO3Н
H2O, t°
+ + H2SO4
Бензолсульфокислота Бензол
4. Алкилирование.
В результате этой реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола – алкилбензолов. Эта реакция известна под названием алкилирования по Фриделю-Крафтсу (1877).
Алкилирование протекает при действии на ароматические углеводороды галогеналканов в присутствии катализаторов – галогенидов алюминия. С помощью катализатора происходит поляризация молекулы галогеналкана с образованием из неё электрофильной частицы.
R – Cl + AlCl3 R+[AlCl4]—
В
зависимости от строения радикала в
галогеналкане различают реакции
метилирования, этилирования и т.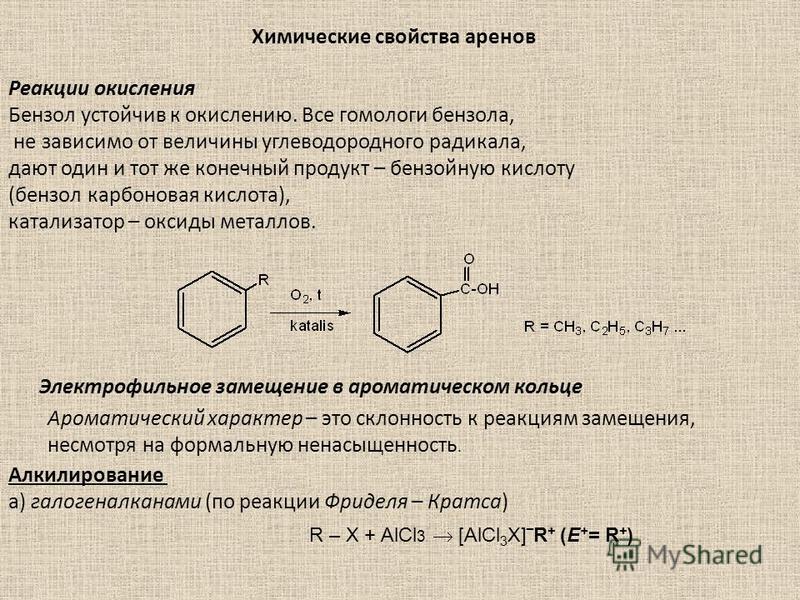 д.
д.
Н
CH
AlCl3
+ CH3Cl + HCl
Бензол Метилхлорид Толуол
Реакции окисления и восстановления.
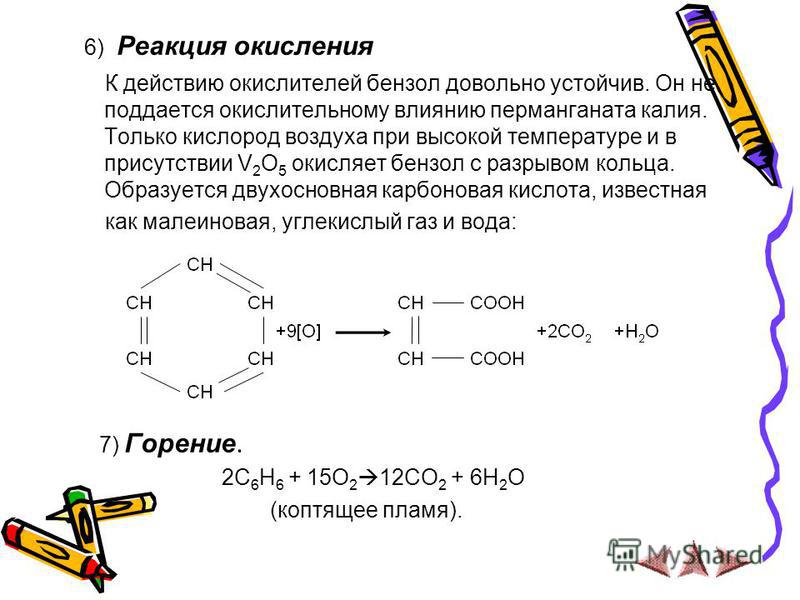
1. Окисление.
Отличительной чертой ароматических углеводородов является их устойчивость к окислению. В обычных условиях на бензол не действуют такие сильные окислители как азотная кислота, хромовая смесь, перманганат калия. По устойчивости к действию окислителей арены сходны с алканами. Однако арены, как и алканы, могут подвергаться окислению в жёстких условиях в присутствии катализаторов.
2. Восстановление.
Реакция присоединения
водорода к бензолу (гидрирование) идёт
в жёстких условиях в присутствии
металлических катализаторов (Ni,
Pt,
Pd).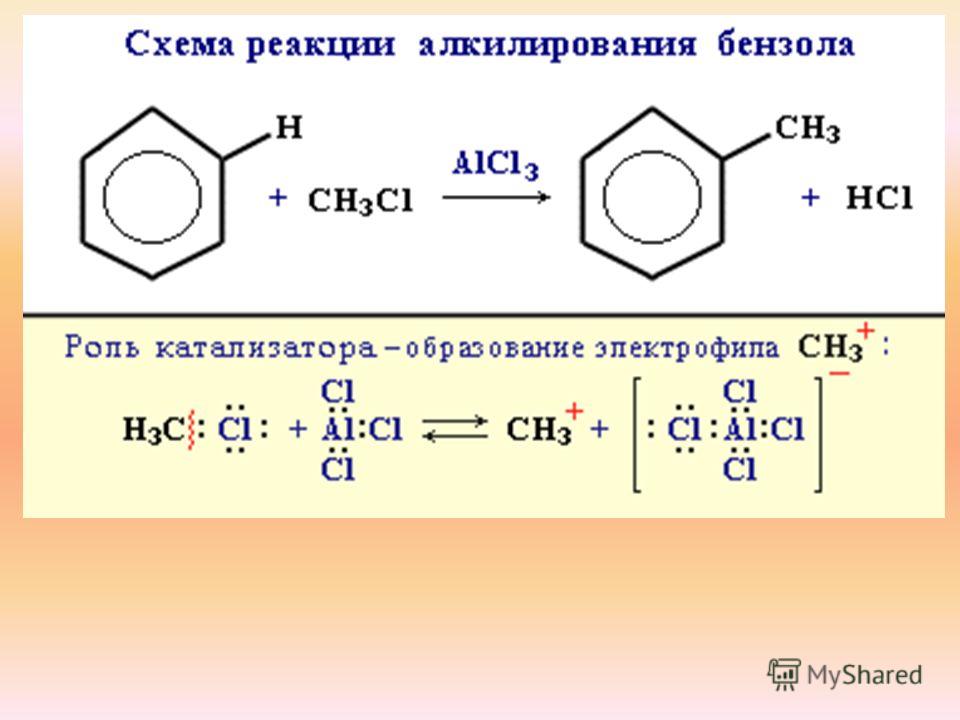 Молекула бензола присоединяет три
молекулы водорода и превращается в
циклогексан, а гомологи бензола – в
производные циклогексана.
Молекула бензола присоединяет три
молекулы водорода и превращается в
циклогексан, а гомологи бензола – в
производные циклогексана.
СН
СН2
НС СН Н2
+ 3Н2
СН2
НС СН Н2С СН2
СН
Бензол Циклогексан
Реакции в боковой цепи.
1. Галогенирование.
Гомологи
бензола имеют ряд особенностей в
химическом поведении, связанных с
наличием в их молекулах алкильных
радикалов.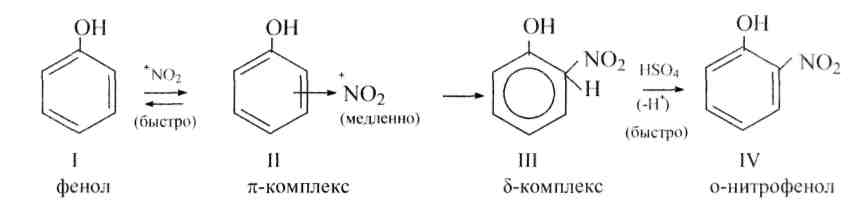 По химическим свойствам
алкильные радикалы подобны алканам.
Атомы водорода в них замещаются на
галоген в условиях свободно-радикальной
реакции замещения. Влияние бензольного
кольца на алкильные заместители приводит
к тому, что замещается всегда атом
водорода у атома углерода, непосредственно
связанного с ароматическим кольцом (у
α-атома углерода).
По химическим свойствам
алкильные радикалы подобны алканам.
Атомы водорода в них замещаются на
галоген в условиях свободно-радикальной
реакции замещения. Влияние бензольного
кольца на алкильные заместители приводит
к тому, что замещается всегда атом
водорода у атома углерода, непосредственно
связанного с ароматическим кольцом (у
α-атома углерода).
СН3 СН2Cl
Cl2hν Cl2hν
— HCl — HCl
Толуол Фенилхлорметан (бензилхлорид)
СНCl2 СCl3
Cl2hν
+ HCl
Фенилдихлорметан Фенилтрихлорметан
СН2СН3 СНClСН3
Cl2hν
+ HCl
Этилбензол 1-Фенил-1-хлорметан
2. Окисление.
Окисление.
Боковые цепи в гомологах бензола подвергаются окислению при действии сильных окислителей, таких, как азотная кислота, хромовая смесь, перманганат калия. Боковой алкильный радикал независимо от длины углеродной цепи окисляется в карбоксильную группу. Окисляемое соединение должно иметь хотя бы один атом водорода у α-атома углерода, т. е., у того, который непосредственно связан с ароматическим кольцом. Продуктами окисления являются ароматические карбоновые кислоты.
СН3 COOH СН2СН3
[O] [O]
Толуол Бензойная кислота Этилбензол
Мезомерный эффект. Правила замещения в производных бензола.
Важнейшим фактором, определяющим
химические свойства молекулы, является
распределение в ней электронной
плотности. Характер распределения
зависит от взаимного влияния атомов.
Характер распределения
зависит от взаимного влияния атомов.
В молекулах, имеющих только σ-связи, взаимное влияние атомов в случае их различной электроотрицательности осуществляется через индуктивный эффект. В молекулах, представляющих собою сопряжённые системы, проявляется действие другого эффекта – мезомерного, или эффекта сопряжения.
Влияние заместителя, передающееся по сопряжённой системе π-связей, называется мезомерным эффектом сопряжения, и обозначается буквой М.
Молекула бензола является сопряжённой системой с равномерным распределением электронной плотности. Однако, это равномерное распределение π-электронного облака нарушается, если в бензольное кольцо вводится какой-нибудь заместитель. Пол влиянием заместителя происходит перераспределение электронной плотности в бензольном кольце. В результате этого меняется реакционная способность ароматического кольца, прежде всего в реакциях электрофильного замещения.
Заместители можно
разделить на две группы в зависимости
от проявляемого ими мезомерного эффекта:
электронодонорные и электроноакцепторные.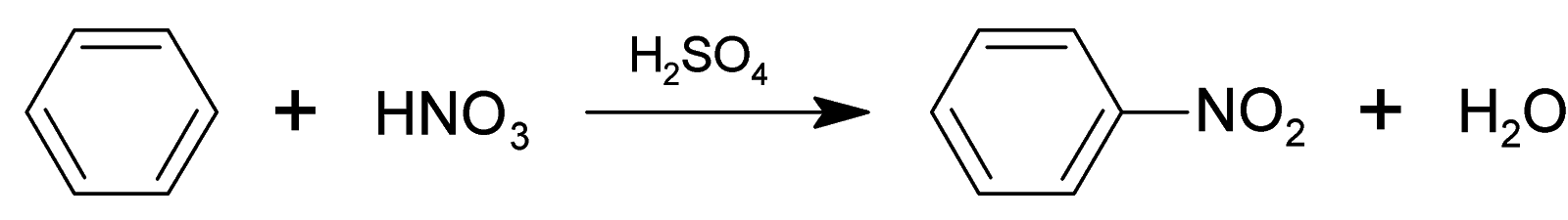
Электронодонорные заместители проявляют + М-эффект и повышают электронную плотность в сопряжённой системе. К электронодонорным заместителям относятся гидроксильная группа – ОН и аминогруппа – NH2. Неподелённая пара электронов гетероатомов этих групп вступает в общее сопряжение с π-электронной системой бензольного кольца и увеличивает длину сопряжённой системы. Под влиянием электронодонорных заместителей происходит перераспределение электронной плотности в бензольном кольце с некоторым её сосредоточением в орто- и пара-положениях.
Н
δ-
δ-
δ-
δ-
δ-
:О :NH2
δ-
Фенол Анилин
Электроноакцепторные
заместители проявляют – М-эффект и
снижают электронную плотность в
сопряжённой системе.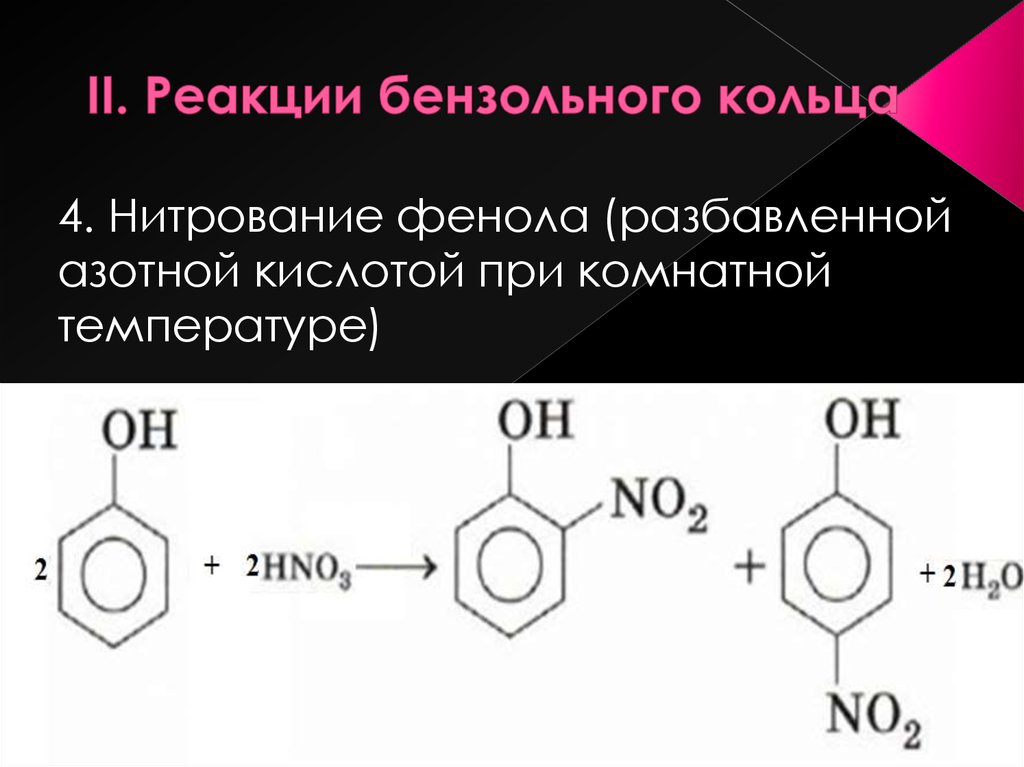 К электроноакцепторным
заместителям относятся нитрогруппа –
NO2,
сульфогруппа – SO3H,
альдегидная – СНО и карбоксильная –
СООН группы. Эти заместители образуют
с бензольным кольцом общую сопряжённую
систему. Поскольку они содержат более
электроотрицательные атомы (азот,
кислород), то общее
π-электронное облако смещается в сторону
этих групп. Таким образом электронная
плотность бензольного кольца в целом
понижается и в результате её
перераспределения некоторый частичный
отрицательный заряд возникает в мета-положении.
К электроноакцепторным
заместителям относятся нитрогруппа –
NO2,
сульфогруппа – SO3H,
альдегидная – СНО и карбоксильная –
СООН группы. Эти заместители образуют
с бензольным кольцом общую сопряжённую
систему. Поскольку они содержат более
электроотрицательные атомы (азот,
кислород), то общее
π-электронное облако смещается в сторону
этих групп. Таким образом электронная
плотность бензольного кольца в целом
понижается и в результате её
перераспределения некоторый частичный
отрицательный заряд возникает в мета-положении.
O O Н О
N C
δ-
δ-
δ-
δ-
Нитробензол Бензальдегид
Поскольку
электронодонорные заместители повышают
электронную плотность бензольного
кольца, то они способствуют протеканию
реакций электрофильного замещения.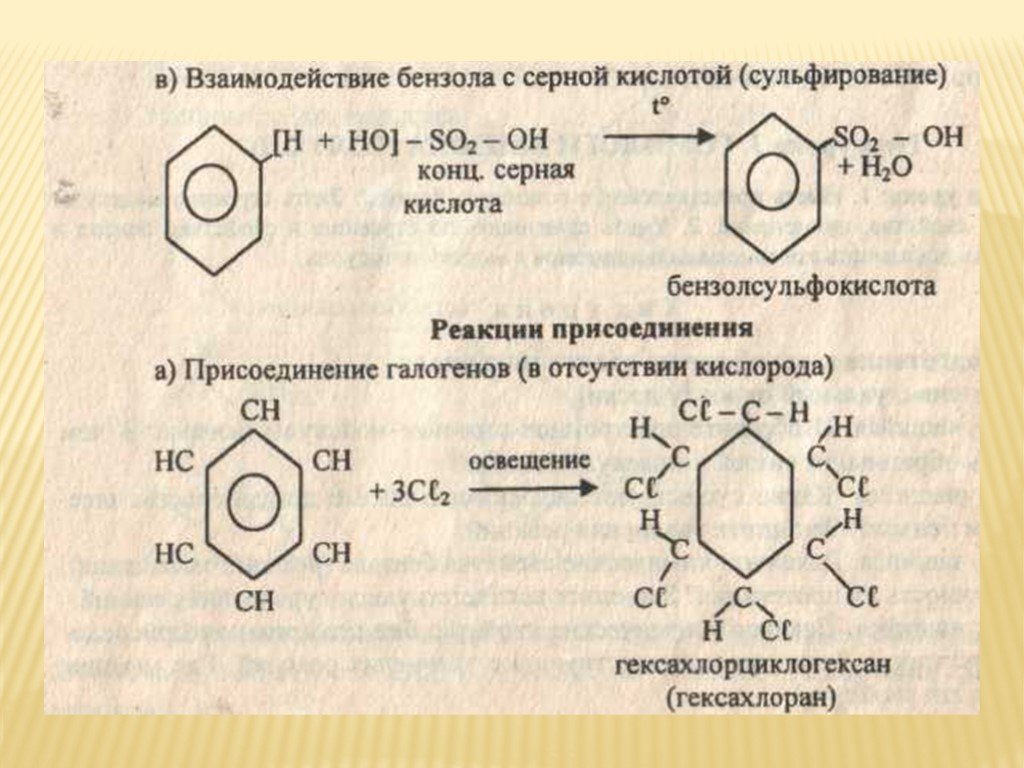 При
этом вновь вступающая в молекулу
электрофильная группа будет направляться
уже имеющимся в бензольном кольце
заместителем в орто- и пара-положения,
т. е. в положения с наибольшей электронной
плотностью. В связи с этим электронодонорные
заместители называют заместителями
I рода,
или орто- и пара-ориентантами.
Кроме гидроксильной группы – ОН и
аминогруппы – NH2,
к заместителям I
рода относятся также галогены и алкильные
группы. Алкильные группы не могут
участвовать в общем сопряжении, но они
проявляют + I-эффект,
действие которого в наибольшей степени
испытывает
π-электронная плотность.
При
этом вновь вступающая в молекулу
электрофильная группа будет направляться
уже имеющимся в бензольном кольце
заместителем в орто- и пара-положения,
т. е. в положения с наибольшей электронной
плотностью. В связи с этим электронодонорные
заместители называют заместителями
I рода,
или орто- и пара-ориентантами.
Кроме гидроксильной группы – ОН и
аминогруппы – NH2,
к заместителям I
рода относятся также галогены и алкильные
группы. Алкильные группы не могут
участвовать в общем сопряжении, но они
проявляют + I-эффект,
действие которого в наибольшей степени
испытывает
π-электронная плотность.
СН3 СН3 СН3
δ-
Br
δ-
Br2; FeBr3 +
— HBr
δ-
Br
Толуол о-Бромтолуол п-Бромтолуол
Замещение в производных
бензола, имеющих заместители I
рода, происходит легче, чем в самом
бензоле.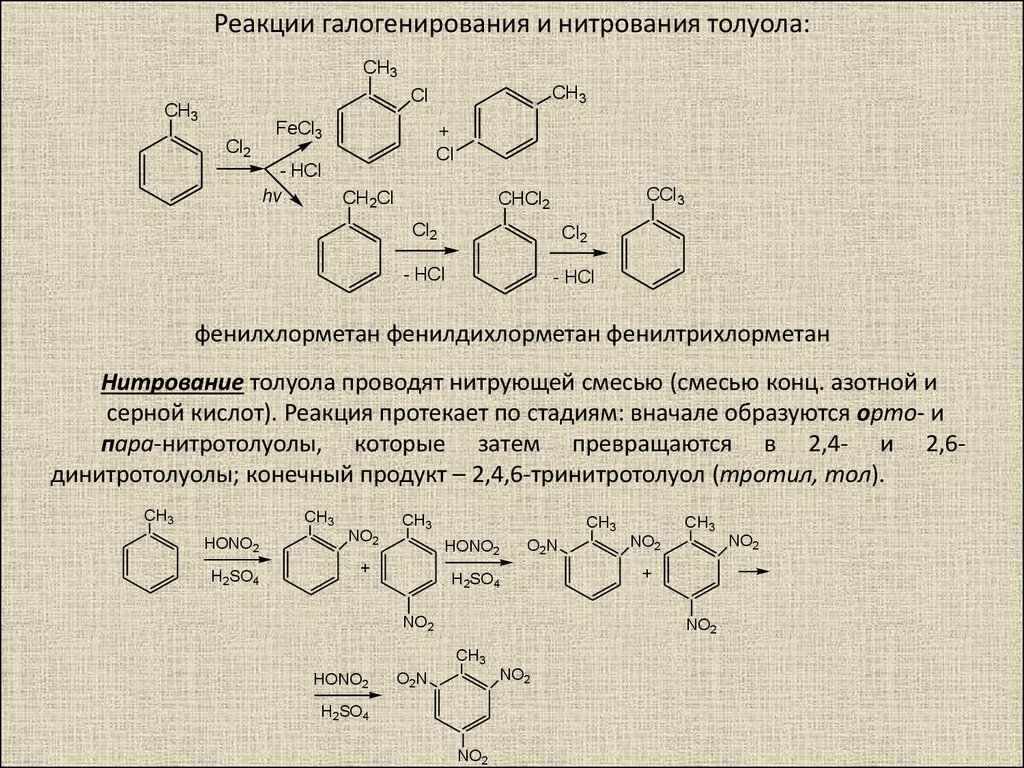
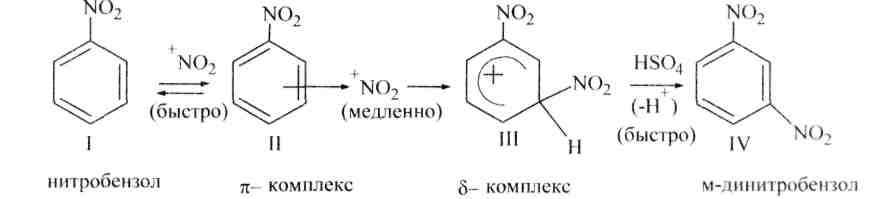
Электроноакцепторные заместители, снижая электронную плотность кольца, понижают его реакционную способность в реакциях электрофильного замещения. Поэтому эти реакции протекают труднее, чем с бензолом. В то же время эти заместители ориентируют вновь вступающие электрофильные группы в мета-положение. В связи с этим электроноакцепторные заместители называют заместителями II рода, или мета-ориентантами. К этой группе принадлежат нитрогруппа – NО2, сульфогруппа – SO3H, альдегидная группа – СНО, карбоксильная группа – СООН. Реакции электрофильного замещения в производных бензола, имеющих заместители II рода, протекают значительно медленнее. Например, нитрование нитробензола идёт в 10 000 раз медленнее, чем нитрование бензола.
δ-
O O
N NO2
HNO3; H2SO4
δ-
-H2O
NO2
Нитробензол м-Динитробензол
Нитрование и сульфирование бензола
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 937
Нитрование и сульфирование бензола являются двумя примерами электрофильного ароматического замещения.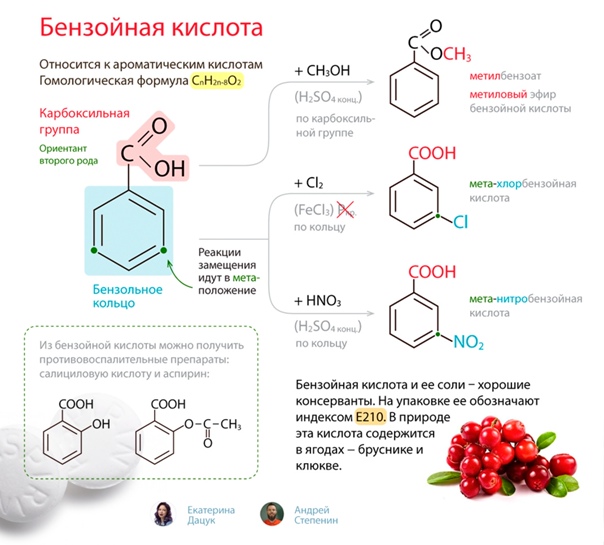 Ион нитрония (NO 2 + ) и триоксид серы (SO 3 ) являются электрофилами и по отдельности реагируют с бензолом с образованием нитробензола и бензолсульфоновой кислоты соответственно.
Ион нитрония (NO 2 + ) и триоксид серы (SO 3 ) являются электрофилами и по отдельности реагируют с бензолом с образованием нитробензола и бензолсульфоновой кислоты соответственно.
Нитрование бензола
Источником иона нитрония является протонирование азотной кислоты серной кислотой, что вызывает потерю молекулы воды и образование иона нитрония.
Серная кислота Активация азотной кислоты
Первым этапом нитрования бензола является активация HNO 3 с серной кислотой для получения более сильного электрофила, иона нитрония.
Поскольку ион нитрония является хорошим электрофилом, он подвергается воздействию бензола с образованием нитробензола.
Механизм
(Резонансные формы промежуточного соединения можно увидеть в обобщенном электрофильном ароматическом замещении)
Сульфирование бензола
Сульфирование представляет собой обратимую реакцию, в результате которой образуется бензолсульфокислота при добавлении триоксида серы и дымящейся серной кислоты.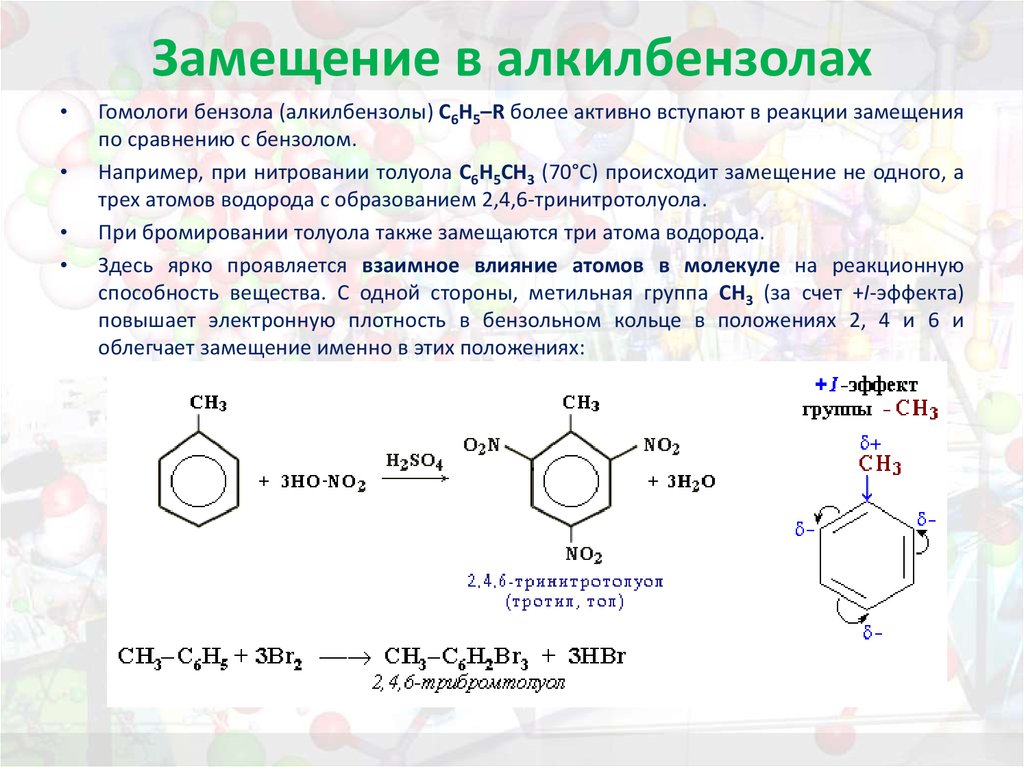 Реакцию обращают, добавляя горячую водную кислоту к бензолсульфоновой кислоте с получением бензола.
Реакцию обращают, добавляя горячую водную кислоту к бензолсульфоновой кислоте с получением бензола.
Механизм
Для получения бензолсульфокислоты из бензола добавляют дымящую серную кислоту и триоксид серы. Дымящаяся серная кислота, также называемая олеумом , представляет собой концентрированный раствор растворенного триоксида серы в серной кислоте. Сера в триоксиде серы электрофильна, потому что атомы кислорода оттягивают от нее электроны, потому что кислород очень электроотрицательный. Бензол атакует серу (и происходит последующий перенос протона) с образованием бензолсульфоновой кислоты.
Обратное сульфирование
Сульфирование бензола является обратимой реакцией. Триоксид серы легко реагирует с водой с образованием серной кислоты и тепла. Следовательно, при добавлении тепла к бензолсульфокислоте в разбавленном водном растворе серной кислоты реакция меняется на обратную.
Дополнительные применения нитрования и сульфирования
Нитрование используется для присоединения азота к бензольному кольцу, которое можно использовать в дальнейшем в реакциях замещения.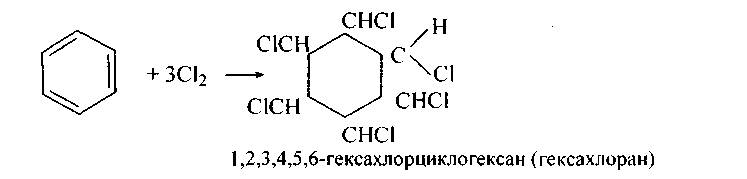 Нитрогруппа действует как циклический дезактиватор. Наличие азота в кольце очень полезно, поскольку его можно использовать как направляющую группу, а также как маскирующую аминогруппу. Продукты ароматического нитрования являются очень важными промежуточными продуктами в промышленной химии.
Нитрогруппа действует как циклический дезактиватор. Наличие азота в кольце очень полезно, поскольку его можно использовать как направляющую группу, а также как маскирующую аминогруппу. Продукты ароматического нитрования являются очень важными промежуточными продуктами в промышленной химии.
Поскольку сульфирование является обратимой реакцией, его также можно использовать в дальнейших реакциях замещения в виде направляющей блокирующей группы, поскольку ее легко удалить. Сульфогруппа блокирует углерод от воздействия других заместителей и после завершения реакции может быть удалена обратным сульфированием. Бензолсульфокислоты также используются в синтезе моющих средств, красителей и сульфаниламидных препаратов. Безенсульфонилхлорид является предшественником сульфаниламидов, которые используются в химиотерапии.
Внешние ссылки
Ароматическое сульфирование
- Википедия: http://en.Wikipedia.org/wiki/Ароматическое_сульфирование
- Видео: http://www.
 youtube.com/watch?v=s1qJ1…eature=related
youtube.com/watch?v=s1qJ1…eature=related - Интерактивная 3D-реакция: http://www.chemtube3d.com/Electrophi…20benzene.html
Ароматическое азотирование
- Википедия: http://en.Wikipedia.org/wiki/Нитирование
- Видео: http://www.youtube.com/watch?v=i7ucl…eature=related
- Интерактивная 3D-реакция: http://www.chemtube3d.com/Electrophi…20benzene.html
Задачи
1. Какие реагенты требуются для следующей реакции:
2. Что является продуктом следующей реакции:
3. Почему важно, чтобы нитрование бензола азотной кислотой происходит в серной кислоте?
4. Напишите подробный механизм сульфирования бензола, включая все резонансные формы.
5. Нарисуйте энергетическую диаграмму нитрования бензола. Нарисуйте промежуточные продукты, исходные материалы и продукты. Обозначьте переходные состояния. (Подсказки по вопросам 1 и 2 см. в разделе «Электрофильное ароматическое замещение»)
По другим проблемам, связанным с электрофильным ароматическим замещением и аналогичными реакциями, см.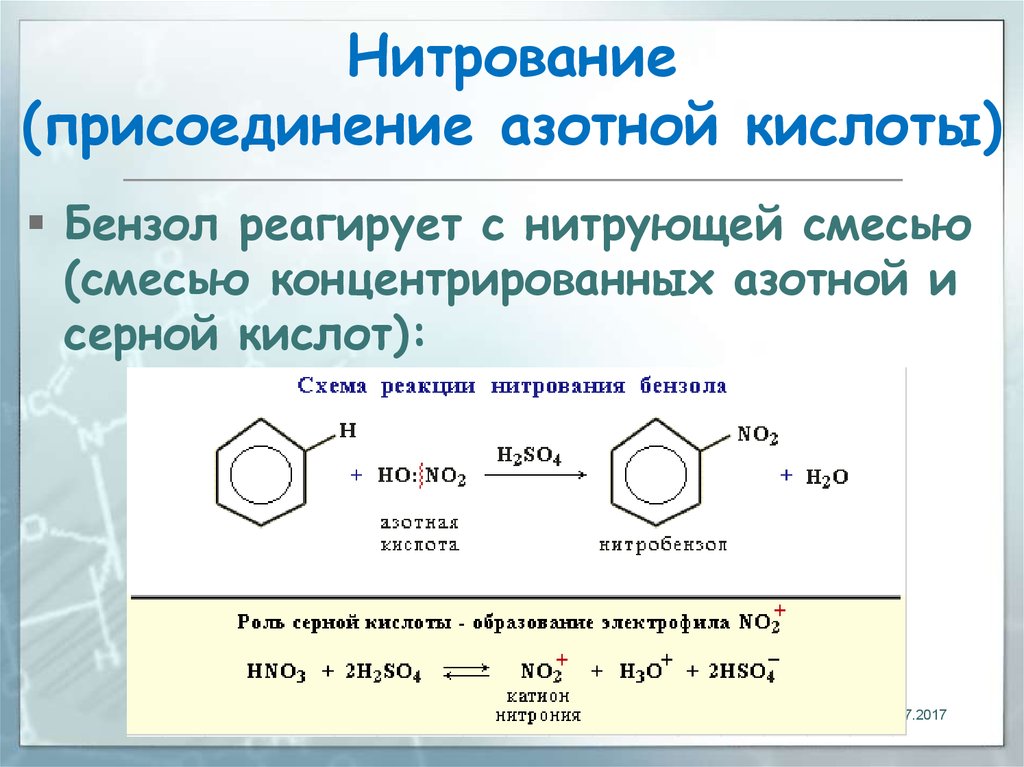 :
:
- Электрофильное ароматическое замещение
- Активация и деактивация бензольных колец
- Электрофильная атака на дизамещенные бензолы
Растворы
1. SO 3 и H 2 SO 4 (дымящие)
2.
3. Серная кислота необходима для получения хорошей электрофильной формы. Серная кислота протонирует азотную кислоту с образованием иона нитрония (молекула воды теряется). Ион нитрония является очень хорошим электрофилом и открыт для атаки бензолом. Без серной кислоты реакция не пойдет.
4.
5.
Ссылки
- Лаали, Кеннет К. и Волкар Дж. Геттверт. «Электрофильное нитрование ароматических соединений в ионных жидких растворителях». Журнал органической химии 66 (декабрь 2000 г.): 35-40. Американское химическое общество.
- Малхотра, Рипудаман, Субхаш С. Наранг и Джордж А. Олах. Нитрование: методы и механизмы. Нью-Йорк: VCH Publishers, Inc.
 , 1989. .
, 1989. . - Солс, Томас В., Уолтер Х. Рюггеберг и Сэмюэл Л. Норвуд. «О механизме сульфирования ароматического ядра и образования сульфонов». Журнал органической химии 66 (1955): 455-465. Американское химическое общество.
- Фоллхардт, Питер. Органическая химия: структура и функции. 5-е изд. Бостон: WH Freeman & Company, 2007. .
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги

 youtube.com/watch?v=s1qJ1…eature=related
youtube.com/watch?v=s1qJ1…eature=related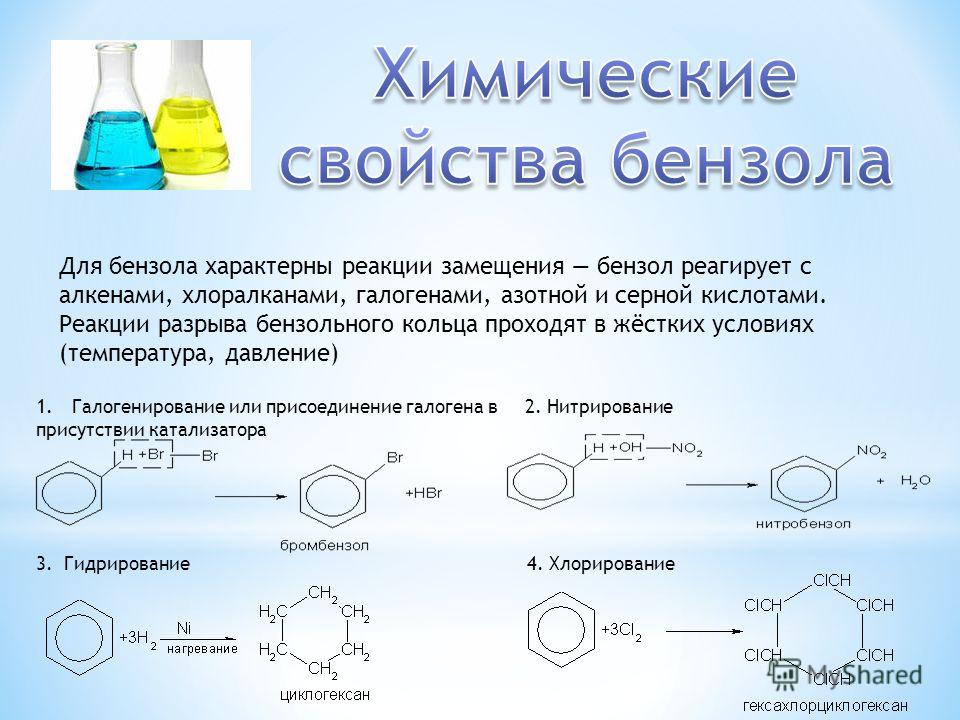 , 1989.
, 1989.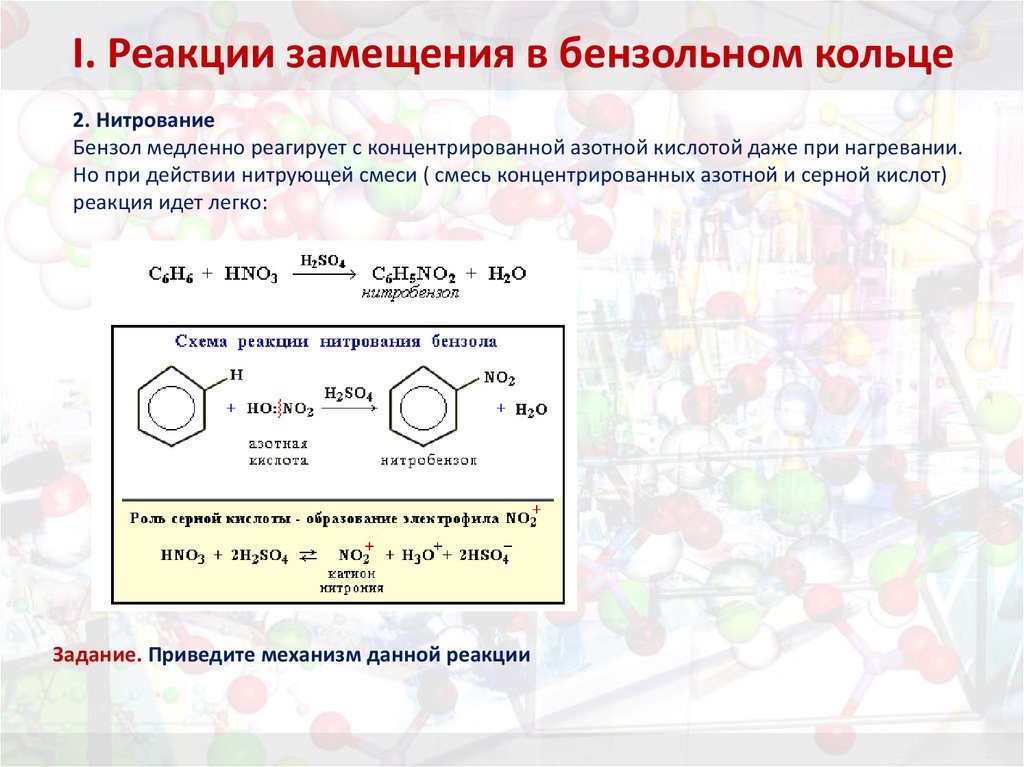
 Только около 5% продукта составляет 3-нитрометилбензол. Метильные группы называются 2,4-направляющими .
Только около 5% продукта составляет 3-нитрометилбензол. Метильные группы называются 2,4-направляющими .
Leave A Comment