чертежи, гибридизация, форма, заряды, пара и подробные факты —
By Даршана Фендаркар
В этой статье «Структура Льюиса Sih5» различные факты, такие как рисунок структуры Льюиса, формальный расчет заряда, гибридизация, структура с некоторыми подробными пояснениями описаны ниже.
Sih5 также называют силаном или моносиланом, это бесцветный горючий и ядовитый газ с сильным резким запахом. Sih5 реагирует с окислителями, когда мы вдыхаем силан, он очень токсичен, поражает кожу, глаза и слизистые оболочки. Молекула Sih5 содержит один атом кремния, окруженный четырьмя атомами водорода.
Давайте посмотрим на следующие темы в этой статье
- Как нарисовать Льюиса структура для SIh5
- Одиночные пары структуры Льюиса SIh5
- Правило октета структуры Льюиса SIh5
- Формальные обвинения структуры Льюиса SIh5
- Гибридизация SIh5
- SIh5 полярный или неполярный
- SIh5 форма структуры Льюиса
- Резонанс структуры Льюиса SIh5
Делая Структура Льюиса молекулы Sih5 первое, что нужно запомнить, это сколько валентных электронов всех атомов в молекуле принимают участие в химической связи.
Когда мы рисуем Структура Льюиса для Sih5 мы всегда знаем число электронов, присутствующих на самой внешней оболочке атомов, входящих в структуру Льюиса.
Одиночные пары структуры Льюиса SIh5В молекуле Sih5 центральный атом кремния содержит четыре валентных электрона, а атом водорода имеет одну валентность. электрон, так что в силане четыре атома водорода присоединены к кремнию, следовательно, общее число валентных электронов в молекуле Sih5 составляет восемь. Sih5=[ 4+ (1×4)] = 8.
Атом кремния является менее электроотрицательным атомом, чем водород, поэтому он расположен в центре, а вокруг атома кремния лежат четыре атома водорода.
Правило октета структуры Льюиса SIh5Для стабильной Структура Льюиса, все атомы в присутствующих молекулах должны удовлетворять правилу октета, правило октета гласит, что для достижения стабильной конфигурации валентная оболочка атома содержит восемь электронов, которые напоминают электронную конфигурацию ближайшего благородного газа.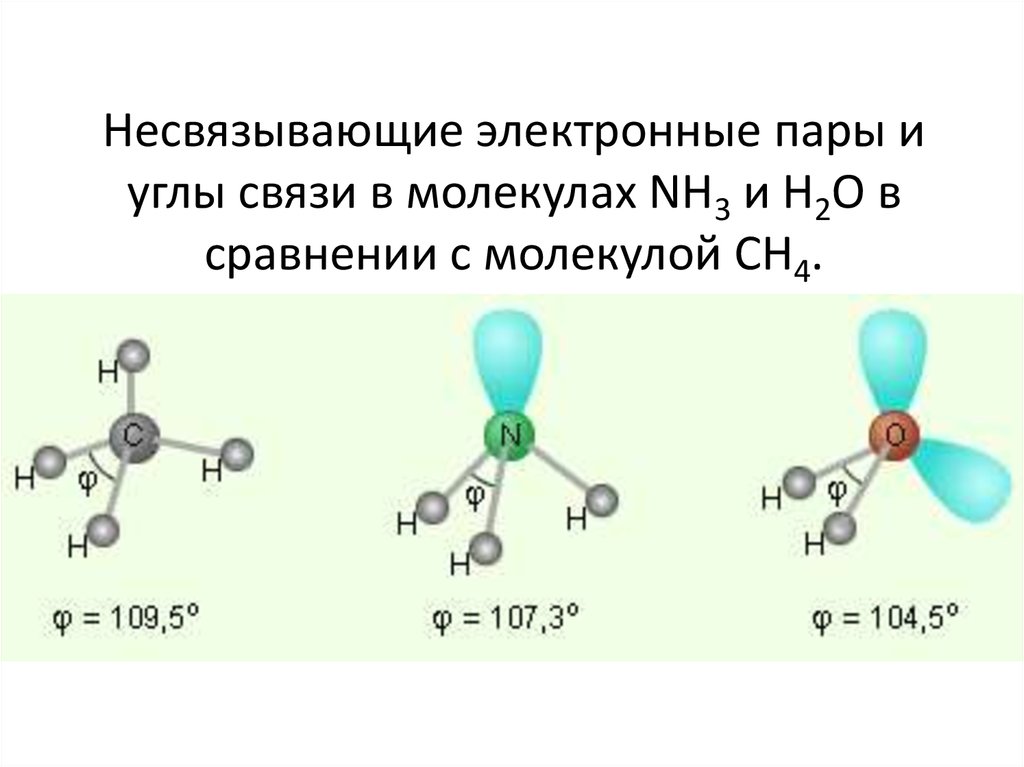
В молекуле Sih5 атому водорода требуется только один электрон, чтобы завершить свой октет, в то время как атому кремния требуется четыре электрона, чтобы завершить свой октет и стать стабильным.
атомы кремния и водорода делят один электрон друг с другом и завершают свой октет, водород имеет два валентных электрона, а кремний имеет восемь валентных электронов, таким образом, они завершают свой октет.
Формальные обвинения структуры Льюиса SIh5Если в какой-либо молекуле есть разница между электроотрицательностью обоих атомов, то она имеет на ней некоторый формальный заряд, но в молекуле Sih5 нет существенной разницы в электроотрицательности, следовательно, формальный заряд на молекуле Sih5 равен нулю.
Гибридизация SIh5Гибридизация — это процесс, при котором атомные орбитали обоих атомов в молекуле собираются вместе и объединяются друг с другом, образуя гибридную орбиталь путем прямого перекрывания сигма-связи, в то время как поперечные параллели перекрываются, образуя пи-связь.
В молекуле Sih5 электронная конфигурация кремния такова:
Си: 1с2 2s2 2p6 3s2 3p2
Си: [Ар] 3с2 3p2
Гибридная орбиталь Sih5На приведенной выше диаграмме s-орбиталь и три p-орбитали объединяются и образуют 4 гибридных 3p-орбитали.3 орбиталей эти 4 гибридные орбитали образуют четыре сигма-связи с четырьмя атомами водорода. Следовательно, гибридизация для Si представляет собой sp3 в Sih5.
SIh5 полярный или неполярныйКомпания полярный или неполярный природа молекулы зависит от разницы между значением электроотрицательности атома который присутствует в молекуле. В молекуле Sih5 разница в электроотрицательности невелика. Таким образом, молекула силана неполярна по своей природе. Но кремний и атом водорода имеют на себе частичные положительный и отрицательный заряды.
SIh5 форма структуры ЛьюисаСогласно теории VSEPR, молекулярная геометрия зависит от центрального атома молекулы, окружающих атомов молекулы и неподеленных пар от центрального атома, поэтому в случае молекулы Sih5 центральным атомом является кремний. .
.
который окружен четырьмя атомами водорода, а у кремния нет неподеленной пары электронов, поэтому он показывает AX4Геометрия типа E в соответствии с теорией VSEPR. Молекула, имеющая четыре окружающих атома без одинокой пары, демонстрирует тетраэдрическую геометрию. Так, силан (Sih5) демонстрирует тетраэдрическую геометрию с валентным углом 109°.o а длина связи Si-H составляет 1.4798 A.o
Резонанс структуры Льюиса SIh5Резонанс – это химическое явление, при котором все свойства молекулы невозможно объяснить одной структурой. Здесь задействовано много канонических структур. Но не каждая молекула может проявлять резонанс.
Sih5 структура льюиса не проявляет резонанса, потому что нет делокализации электронов и есть наличие одинарных связей. Так что движения нет. Sih5 также не имеет неподеленной пары электронов. Значит нет резонанса структуры Sih5 Льюиса Структура
Часто задаваемый вопросСколько валентных электронов имеет Sih5?Ответ: В молекуле Sih5 центральный атом атома кремния содержит четыре валентных электрона, в то время как атом водорода имеет один валентный электрон, поэтому в силане к кремнию присоединены четыре атома водорода, следовательно, в молекуле Sih5 присутствует восемь валентных электронов.
Ответ: Силан имеет один атом кремния, присоединенный к четырем атомам водорода, четыре одинарные связи вокруг центрального атома кремния и отсутствие неподеленной пары электронов на обоих атомах.
Неэмпирический квантовохимический расчет молекулы Sih5
Отчёт о лабораторной работе № 1
Студентки гр. О-24
Пропастенко Кати
Неэмпирический квантовохимический расчет молекулы SiH4.
ЦЕЛИ И ЗАДАЧИ РАСЧЕТА.
Цель расчета: Определение критериев выбора и изучение принципов построения стандартного базисного набора для расчета молекулярных систем. Изучение методов интерпретации результатов расчета и представления молекулы в виде вектора свойств на их основе. Знакомство с программным комплексом GAMESS.
Задача расчета:
Выбрать наименьший из возможных
оптимальный базис для неэмпирического
расчета длин связей и валентных углов
молекулы SiH4 с по программному
комплексу GAMESS с точностью порядка 0. 01 Å
для длин связей и 1 градус для валентных
углов, сравнимой с экспериментальной.
На основании результатов расчета оценить
стабильность и факторы, определяющие
реакционную способность этой молекулы.
01 Å
для длин связей и 1 градус для валентных
углов, сравнимой с экспериментальной.
На основании результатов расчета оценить
стабильность и факторы, определяющие
реакционную способность этой молекулы.
2. ХАРАКТЕРИСТИКА И ОБОСНОВАНИЕ МЕТОДА РАСЧЕТА.
Расчет молекулы SiH
4 осуществлен по программному комплексу GAMESS в стандартном базисном наборе Попла 6-31G*. Этот базис является валентно-расщепленным. Валентные МО представлены линейными комбинациями 2 сжатых комбинаций гауссовых орбиталей, остовные МО – 1-й. На каждом неводородном атоме также центрировано по 6 компонент поляризационных d-функций. Таким образом, базис для расчета молекулы SiH4 состоит из 27 функций:1*Si (1(1s) + 4(2s + 2p) + 2*4(3s + 3p) + 6(3d)) +
4*H (2(1s)=27
Все валентные базисные функции двухэкспоненциальные (6-
31G*), остовные 1s МО — одноэкспоненциальны. s-
и p-сжатия, соответствующие (с формальной
точки зрения) одному главному квантовому
числу n, свернуты в sp-оболочки [(2s + 2p), (3s
+ 3p)] и представлены различными линейными
комбинациями гауссовых примитивов с
одинаковыми экспонециальными множителями.
s-
и p-сжатия, соответствующие (с формальной
точки зрения) одному главному квантовому
числу n, свернуты в sp-оболочки [(2s + 2p), (3s
+ 3p)] и представлены различными линейными
комбинациями гауссовых примитивов с
одинаковыми экспонециальными множителями.Каждая экспонента остовного сжатия представлена линейной комбинацией из 6 гауссовых примитивов (
6-31G*). Каждая экспонента сжатия для валентных электронов представлена линейной комбинацией либо из 3 (6-Базис 6-31G
* является наименьшим из возможных базисов для расчета длин связей и валентных углов молекулы SiH4 с экспериментальной точностью. Добавление поляризационных d-функций (6-31G*) учитывает поляризацию «рыхлых» электронных оболочек атомов галогенов при образовании связей (обеспечивает уменьшение длины связей ~ 0.05 Å). 3. ИНТЕРПРЕТАЦИЯ
РЕЗУЛЬТАТОВ РАСЧЕТА.
1. Оценка стабильности молекулы.
Энтальпия образования молекулы SiH4 из простых веществ равна:
fH0 (SiH4) = E(SiH4) – 1/2E(Si2) – 2E(H2) = -241,2246 + ½*75.37903 +2*1.12683= -0,25184 а.е. = =-104,205 кДж/моль
Вывод: Молекула SiH4 стабильна в стандартных условиях.
2. Свойства связей молекулы SiH4
Уточненная геометрия и порядки связей молекулы SiH4:
Связь Å порядок связи Si-H 1.124 0.942 | Валентный угол град H/Si\H 109. |
Обычно неэмпирические расчеты в базисе
6-31G* позволяют получить геометрию
молекул, подобных исследуемой (СCl4, CНF3, СНCl3), с экспериментальной
точностью. Аналогичной степени точности
следует ожидать и для молекулы SiH
Валентность атомов по Коулсону в молекуле SiH4:
ATOM ВАЛЕНТНОСТЬ
1 Si 3.864
2 H 0.971
Сопоставляя длину связей в молекуле SiH4 с их порядком и валентностью атомов, можно сделать вывод: Связи в молекуле SiH4 ковалентные.
3. Энергетическая диаграмма (а.е.):
№ орбитали | Энергия | |
4 | -4,2344 | |
5 | -4,2344 | |
6 | -0,7298 | |
7 | -0,4847 | |
8 | -0,4847 | |
9 | ||
10 | 0,1642 | |
11 | 0,1642 | |
12 | 0,1642 | |
13 | 0,2548 | |
14 | 0,3372 |
4.
Энергия НВМО молекулы SiH4 отрицательна (-0,4846 а.е.).
Вывод: Молекула SiH4 электрофил.
5. Определение жесткости и мягкости молекулы.
ВЗМО молекулы SiH4 трижды вырождена. Разница ее энергии и энергии более низколежащих МО невелика (0,2451 а.е.).
Вывод: Молекула SiH4 является жестким реагентом.
Жесткость молекулы SiH4
= (ЕНВМО – ЕВЗМО) = ½(0,1642+ 0,4847) = 0,32445 а.е.
Мягкость молекулы SiH4:
S==1,5410 а.е.-1
6. Определение положения реакционных центров.
Реакционная способность молекулы SiH4 как жесткого реагента определяется
зарядами на атомах. Распределение
зарядов на атомах по Малликену следующее:
Распределение
зарядов на атомах по Малликену следующее:
ATOM ЗАРЯД
1 Si 0.413130
Максимальный отрицательный заряд на атоме H.
Вывод: Атомы H – наиболее вероятные центры электрофильной атаки.
7. Оценка растворимости.
Электрический дипольный момент молекулы SiH
4имеет небольшую величину 0.00 D.Вывод: Молекула SiH4 растворима преимущественно в неполярных растворителях.
Sih5 Структура Льюиса за 6 шагов (с изображениями)
Джей Рана / 17 марта 2023 г.
Итак, вы уже видели изображение выше, верно?
Позвольте мне вкратце объяснить приведенное выше изображение.
Структура Льюиса Sih5 имеет атом кремния (Si) в центре, который окружен четырьмя атомами водорода (H).
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса Sih5, то просто оставайтесь со мной, и вы получите подробное пошаговое объяснение по рисованию структуры Льюиса Sih5.
Итак, давайте перейдем к этапам рисования структуры Льюиса Sih5.
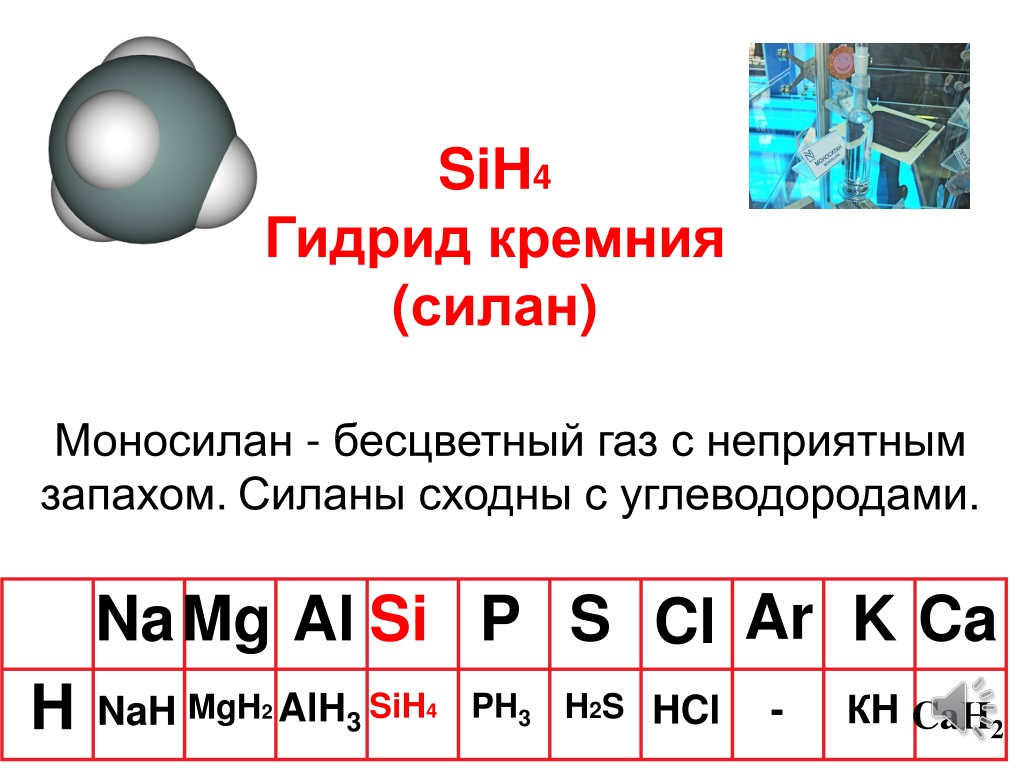
Шаг 1: Найдите общее количество валентных электронов в молекуле Sih5 Чтобы найти общее количество валентных электронов в молекуле Sih5, прежде всего, вы должны знать количество валентных электронов, присутствующих в атоме кремния, а также в атоме водорода.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны кремния, а также водорода, используя периодическую таблицу.
Общее количество валентных электронов в молекуле Sih5
→ Валентные электроны от атома кремния:
Кремний является элементом 14-й группы периодической таблицы.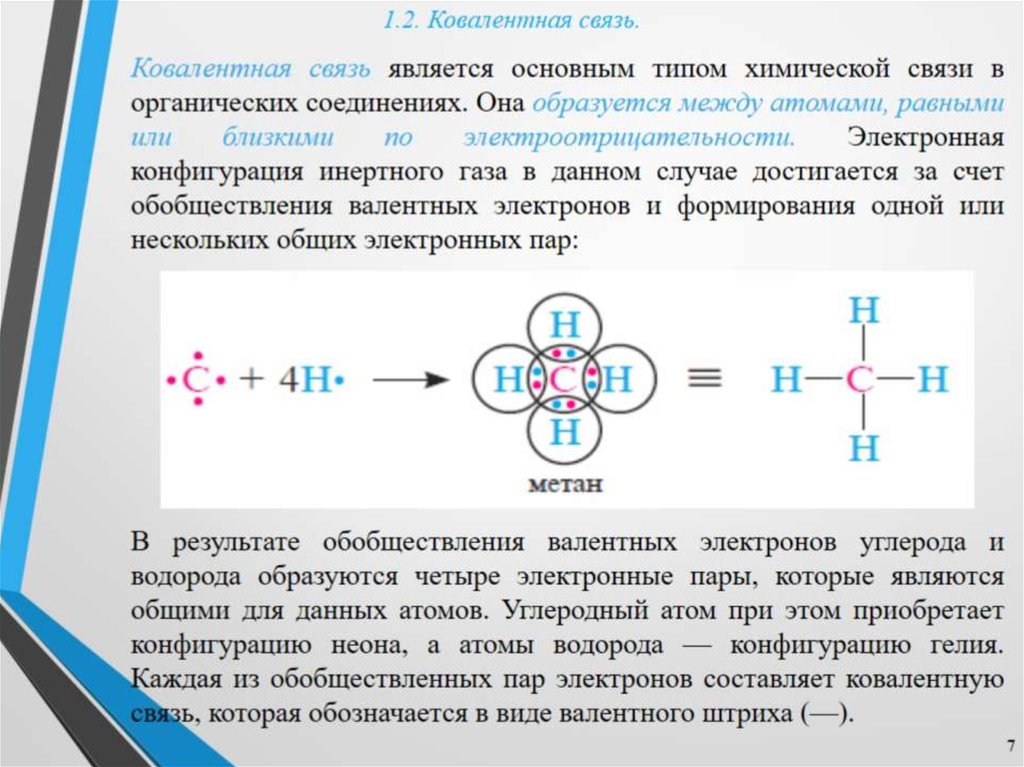 [1] Следовательно, количество валентных электронов, присутствующих в кремнии, равно 4 .
[1] Следовательно, количество валентных электронов, присутствующих в кремнии, равно 4 .
Вы можете видеть 4 валентных электрона, присутствующих в атоме кремния, как показано на изображении выше.
→ Валентные электроны от атома водорода:
Водород является элементом 1 группы периодической таблицы. [2] Следовательно, валентный электрон, присутствующий в водороде, равен 1 .
Вы можете видеть, что в атоме водорода присутствует только 1 валентный электрон, как показано на изображении выше.
Следовательно,
Всего валентных электронов в молекуле Sih5 = валентные электроны, отданные 1 атому кремния + валентные электроны, отданные 4 атомам водорода = 4 + 1(4) = 8 .
Шаг 2: Выберите центральный атом При выборе центрального атома вы должны помнить, что менее электроотрицательный атом остается в центре.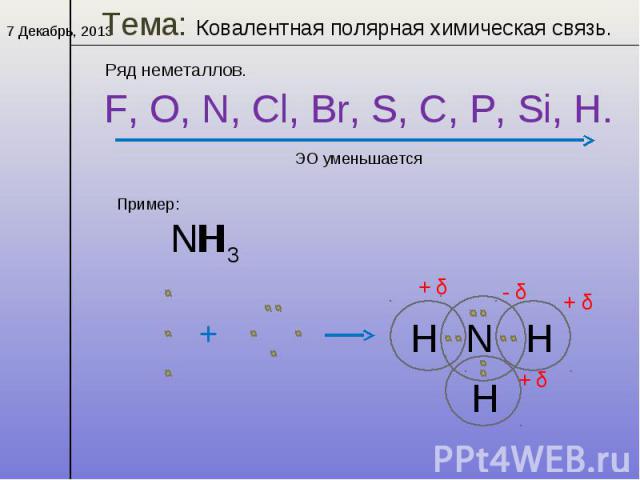
(Помните: Если в данной молекуле присутствует водород, то всегда кладите водород снаружи.)
Здесь данная молекула — Sih5 и содержит атом кремния (Si) и атомы водорода (H).
Вы можете увидеть значения электроотрицательности атома кремния (Si) и атома водорода (H) в приведенной выше таблице Менделеева.
Если сравнить значения электроотрицательности кремния (Si) и водорода (H), то атом водорода менее электроотрицательный. Но по правилу мы должны держать водород снаружи.
Итак, здесь атом кремния (Si) является центральным атомом, а атомы водорода (H) являются внешними атомами.
Шаг 3: Соедините каждый атом, поместив между ними электронную паруТеперь в молекуле Sih5 вы должны поместить электронные пары между атомом кремния (Si) и атомами водорода (H).
Это указывает на то, что кремний (Si) и водород (H) химически связаны друг с другом в молекуле Sih5.
Шаг 4: Сделайте внешние атомы стабильными На этом этапе вам нужно проверить стабильность внешних атомов.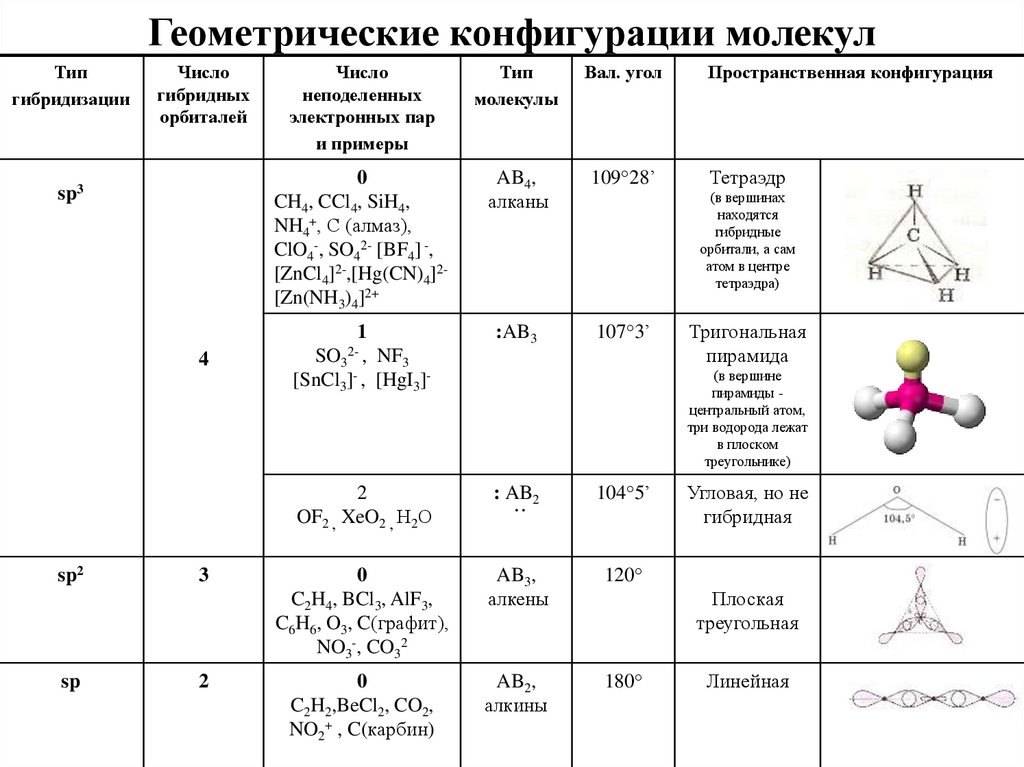
Здесь, на эскизе молекулы Sih5, вы можете видеть, что внешние атомы являются атомами водорода.
Эти внешние атомы водорода образуют дуплет и, следовательно, они стабильны.
Кроме того, на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле Sih5.
Молекула Sih5 имеет в общей сложности 8 валентных электронов , и все эти валентные электроны используются в приведенном выше наброске Sih5.
Следовательно, на центральном атоме не осталось электронных пар.
Итак, теперь давайте перейдем к следующему шагу.
Шаг 5: Проверьте октет центрального атомаНа этом шаге вы должны проверить, стабилен ли центральный атом кремния (Si).
Чтобы проверить стабильность центрального атома кремния (Si), мы должны проверить, образует ли он октет или нет.
На изображении выше видно, что атом кремния образует октет. Это означает, что у него 8 электронов.
Следовательно, центральный атом кремния стабилен.
Теперь давайте перейдем к последнему шагу, чтобы проверить, устойчива ли структура Льюиса Sih5.
Шаг 6: Проверка стабильности структуры ЛьюисаТеперь вы подошли к последнему шагу, на котором вам нужно проверить стабильность структуры Льюиса Sih5.
Стабильность структуры Льюиса можно проверить с помощью концепции формального заряда.
Короче говоря, теперь вам нужно найти формальный заряд на атоме кремния (Si), а также на атомах водорода (H), присутствующих в молекуле Sih5.
Для расчета формального сбора необходимо использовать следующую формулу;
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы Sih5 на изображении, приведенном ниже.
Для атома кремния (Si):
Валентные электроны = 4 (поскольку кремний находится в группе 14)
Связывающие электроны = 8
Несвязывающие электроны = 0
Для атома водорода (H):
Валентный электрон = 1 (поскольку водород находится в группе 1)
Связывающие электроны = 2
Несвязывающие электроны = 0
| 1 9 = | Валентные электроны | – | (Связывающие электроны)/2 | – | 910905 Несвязывающие электроны 91 | ||||||||||||
| Си | = | 4 | – | 8/2 | – | 0 | = | 0 | 6 2 Н | = | 1 | – | 2/2 | – | 0 | = | 0 |
Из приведенных выше расчетов формального заряда видно, что атом кремния (Si), а также атом водорода (H) имеет «104» 900 формальных зарядов.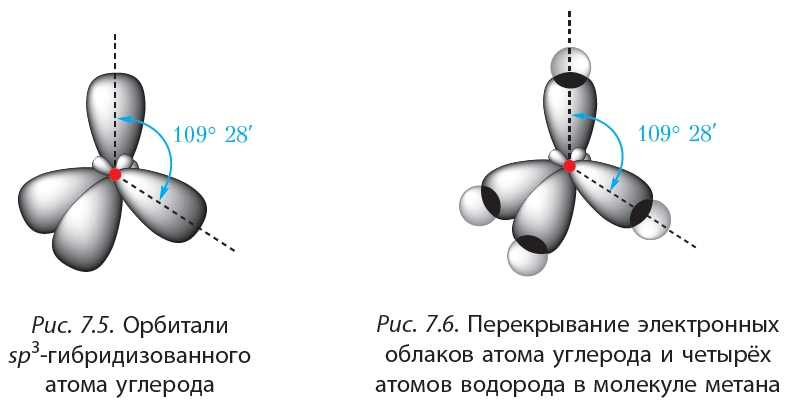 заряжать.
заряжать.
Это указывает на то, что приведенная выше структура Льюиса Sih5 стабильна и в приведенной выше структуре Sih5 нет дальнейших изменений.
В приведенной выше структуре точек Льюиса Sih5 вы также можете представить каждую пару связывающих электронов (:) как одинарную связь (|). Сделав это, вы получите следующую структуру Льюиса Sih5.
Надеюсь, вы полностью поняли все вышеперечисленные шаги.
Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже.
Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания:
OCl2 Структура Льюиса за 6 шагов (с изображениями)
Итак, вы уже видели изображение выше, верно?
Позвольте мне вкратце объяснить приведенное выше изображение.
Структура Льюиса OCl2 имеет атом кислорода (O) в центре, который окружен двумя атомами хлора (Cl). Между атомом кислорода (O) и каждым атомом хлора (Cl) имеется 2 одинарные связи.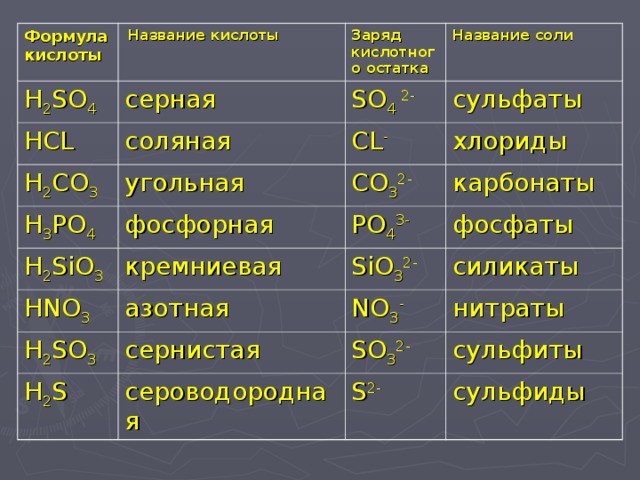 Есть 2 неподеленные пары на атоме кислорода (O) и 3 неподеленные пары на обоих атомах хлора (Cl).
Есть 2 неподеленные пары на атоме кислорода (O) и 3 неподеленные пары на обоих атомах хлора (Cl).
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса OCl2 (дихлорид кислорода), то просто оставайтесь со мной, и вы получите подробное пошаговое объяснение по рисованию структуры Льюиса OCl2.
Итак, давайте перейдем к этапам рисования структуры Льюиса OCl2.
Шаг 1: Найдите общее количество валентных электронов в молекуле OCl2 Чтобы найти общее количество валентных электронов в молекуле OCl2 (дихлорид кислорода), прежде всего, вы должны знать количество валентных электронов, присутствующих в атоме кислорода, а также в атоме хлора. атом.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны кислорода, а также хлора, используя периодическую таблицу.
Общее количество валентных электронов в молекуле OCl2
→ Валентные электроны, определяемые атомом кислорода:
Кислород является элементом 16-й группы периодической таблицы.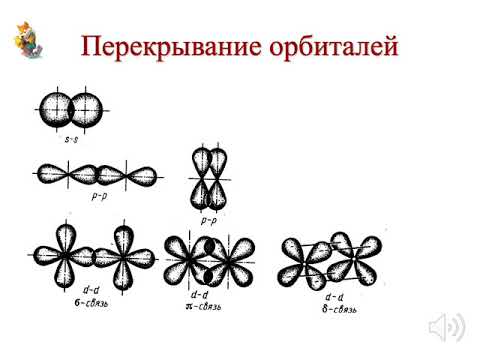 [1] Следовательно, количество валентных электронов в кислороде равно 6 .
[1] Следовательно, количество валентных электронов в кислороде равно 6 .
Вы можете видеть 6 валентных электронов, присутствующих в атоме кислорода, как показано на изображении выше.
→ Валентные электроны от атома хлора:
Хлор является элементом 17 группы периодической таблицы. [2] Следовательно, количество валентных электронов, присутствующих в хлоре, равно 7 .
Вы можете видеть 7 валентных электронов, присутствующих в атоме хлора, как показано на изображении выше.
Следовательно,
Общее количество валентных электронов в молекуле OCl2 = валентные электроны, отдаваемые 1 атому кислорода + валентные электроны, отданные 2 атомам хлора = 6 + 7(2) = 20 .
Шаг 2: Выберите центральный атом При выборе центрального атома вы должны помнить, что менее электроотрицательный атом остается в центре.
Здесь данная молекула представляет собой OCl2 (дихлорид кислорода) и содержит атом кислорода (O) и атомы хлора (Cl).
Вы можете увидеть значения электроотрицательности атома кислорода (O) и атома хлора (Cl) в приведенной выше периодической таблице.
Если сравнить значения электроотрицательности кислорода (O) и хлора (Cl), то атом кислорода менее электроотрицательный.
Итак, здесь атом кислорода (O) является центральным атомом, а атомы хлора (Cl) являются внешними атомами.
Шаг 3: Соедините каждый атом, поместив между ними пару электроновТеперь в молекуле OCl2 вы должны поместить пары электронов между атомами кислорода (O) и атомами хлора (Cl).
Это указывает на то, что кислород (O) и хлор (Cl) химически связаны друг с другом в молекуле OCl2.
Шаг 4: Сделайте внешние атомы стабильными. Поместите оставшуюся пару валентных электронов на центральный атом. Теперь на этом этапе вы должны проверить стабильность внешних атомов.
Здесь на эскизе молекулы OCl2 видно, что внешние атомы — это атомы хлора.
Эти внешние атомы хлора образуют октет и, следовательно, они стабильны.
Кроме того, на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле OCl2.
Молекула OCl2 имеет в общей сложности 20 валентных электронов , и из них только 16 валентных электронов используются в приведенном выше эскизе.
Итак, число оставшихся электронов = 20 – 16 = 4 .
Вы должны поместить эти 4 электронов на центральный атом кислорода в приведенном выше наброске молекулы OCl2.
Теперь давайте перейдем к следующему шагу.
Шаг 5: Проверьте октет центрального атомаНа этом шаге вы должны проверить, стабилен ли центральный атом кислорода (O).
Чтобы проверить стабильность центрального атома кислорода (O), мы должны проверить, образует ли он октет или нет.
На изображении выше видно, что атом кислорода образует октет. Это означает, что у него 8 электронов.
Следовательно, центральный атом кислорода стабилен.
Теперь давайте перейдем к последнему шагу, чтобы проверить, является ли структура Льюиса OCl2 стабильной или нет.
Шаг 6: Проверка стабильности структуры ЛьюисаТеперь вы подошли к последнему шагу, на котором вам нужно проверить стабильность структуры Льюиса OCl2.
Стабильность структуры Льюиса можно проверить с помощью концепции формального заряда.
Короче говоря, теперь вам нужно найти формальный заряд атомов кислорода (O), а также атомов хлора (Cl), присутствующих в молекуле OCl2.
Для расчета формального сбора необходимо использовать следующую формулу;
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы OCl2 на изображении ниже.
Для атома кислорода (O):
Валентные электроны = 6 (поскольку кислород находится в группе 16)
Связывающие электроны = 4
Несвязывающие электроны = 4
Для атома хлора (Cl):
17)
Связывающие электроны = 2
Несвязывающие электроны = 6
| Формальный заряд | = | 6 Валентные электроны 009 – | (связывающие электроны)/2 | – | несвязывающие электроны | ||
| O | 6 9125 6 =– | 4/2 | – | 4 | = | 0 | |
| кл. |

 28
28
Leave A Comment