Тест ЕГЭ по физике решать онлайн
1. Тело движется вдоль оси Oх. На рисунке приведён график зависимости проекции скорости тела \( {\upsilon _x} \) от времени t.
Определите путь, пройденный телом в интервале времени от 12 до 18 с.
Верный ответ: 25
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15531.
2. Скорость груза массой 0,6 кг равна 4 м/с. Какова кинетическая энергия груза?
Ответ: ________________ Дж.
Верный ответ: 4,8
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15382.
3. Период вертикальных свободных колебаний пружинного маятника равен 0,5 с.
Ответ: ________________ с.
Верный ответ: 1
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15863.
4. Два одинаковых вертикальных сообщающихся цилиндрических сосуда заполнены водой и закрыты поршнями массами M1 = 1 кг и M2 = 2 кг. Когда система находится в равновесии, правый поршень с площадью основания 100 см2 расположен ниже левого на величину h = 10 см.
1. Если на левый поршень поместить груз массой т = 1 кг, поршни будут находиться на одном уровне.2. Если вместо воды в сосуды налить керосин, то в состоянии равновесия левый поршень будет выше правого на 12,5 см. 3. Если на левый поршень поместить груз массой т = 0,5 кг, разность уровней между левым и правым поршнями составит 6 см.4. Взаимное расположение поршней при заданных массах зависит от плотности материала, из которого они изготовлены.5. Если на правый поршень поместить груз массой т = 1 кг, разность уровней между левым и правым поршнями составит 15 см.
3. Если на левый поршень поместить груз массой т = 0,5 кг, разность уровней между левым и правым поршнями составит 6 см.4. Взаимное расположение поршней при заданных массах зависит от плотности материала, из которого они изготовлены.5. Если на правый поршень поместить груз массой т = 1 кг, разность уровней между левым и правым поршнями составит 15 см.
Верный ответ: 12
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15504.
5. Камень брошен вверх под углом к горизонту. Сопротивление воздуха пренебрежимо мало. Как меняются по мере подъёма камня полная механическая энергия и модуль импульса камня?
Для каждой величины определите соответствующий характер изменения:
1) не изменилась
2) уменьшилась
3) увеличилась
Запишите в таблицу выбранные цифры для каждой физической величины.
Верный ответ: 12
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15715.
6. В момент t = 0 мячик бросают с начальной скоростью \( {{\vec \upsilon }_0} \) под углом α к горизонту с балкона высотой h (см. рисунок). Графики А и Б отображают зависимости физических величин, характеризующих движение мячика в процессе полёта, от времени t. Установите соответствие между графиками и физическими величинами, зависимости которых от времени эти графики могут отображать. Сопротивлением воздуха — пренебречь. Потенциальная энергия мячика отсчитывается от уровня у = 0.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ГРАФИКИ
А)
Б)
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
1) потенциальная энергия мячика
2) проекция импульса мячика на ось y
3) кинетическая энергия мячика
4) проекция импульса мячика на ось x
Верный ответ: 14
P.
При обращении указывайте id этого вопроса — 15566.
7. При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул аргона увеличилась в 2 раза. Конечная температура газа равна 600 К. Какова начальная температура газа?
Ответ: ________________ К.
Верный ответ: 300
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15627.
8. У идеального теплового двигателя Карно температура нагревателя равна 227 °С, а температура холодильника равна -23 °С. Определите КПД теплового двигателя.
Ответ: ________________ %.
Верный ответ: 50
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15508.
9. Вещество массой 6 кг находится в сосуде. На рисунке показан график изменения температуры t вещества по мере поглощения им количества теплоты Q. Первоначально вещество было в твёрдом состоянии. Какова удельная теплота плавления вещества?
Ответ: ________________ кДж/кг.
Верный ответ: 25
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15929.
10. Объём сосуда, содержащего 1 моль аргона, уменьшили вдвое и добавили в сосуд 1 моль гелия. Температура в сосуде поддерживается постоянной. Выберите из предложенного списка все утверждения, которые верно отражают результаты этого опыта.
1. Плотность газа в сосуде не изменилась.2. Внутренняя энергия аргона не изменилась.3. Парциальное давление аргона не изменилось. 4. Парциальные движения аргона и гелия в конце процесса одинаковы.5. Концентрации аргона и гелия в сосуде одинаковы.
4. Парциальные движения аргона и гелия в конце процесса одинаковы.5. Концентрации аргона и гелия в сосуде одинаковы.
Верный ответ: 245
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15720.
11. На рисунках А и Б приведены графики двух процессов: 1-2 и 3-4, каждый из которых совершает 1 моль разреженного гелия. Графики построены в координатах p-T и p-V, где p — давление, V — объём и T — абсолютная температура газа.
Установите соответствие между графиками и утверждениями, характеризующими изображённые на графиках процессы.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ГРАФИКИ
А)
Б)
УТВЕРЖДЕНИЯ
1) Газ получает положительное количество теплоты, при этом его внутренняя энергия увеличивается.
2) Газ отдаёт положительное количество теплоты, при этом его внутренняя энергия остаётся постоянной.
3) Газ получает положительное количество теплоты и совершает положительную работу.
4) Над газом совершают положительную работу, при этом газ отдаёт положительное количество теплоты.
Верный ответ: 43
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15661.
12. Во сколько раз уменьшится модуль сил взаимодействия двух небольших металлических шариков одинакового диаметра, имеющих заряды q1
Ответ: в ________________ раз(а).
Верный ответ: 8
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15572.
13. Плавкий предохранитель розетки бортовой сети грузовика с напряжением 24 В снабжён надписью: «30 А». Какова максимальная суммарная мощность электрических приборов, которые можно одновременно включить в эту розетку, чтобы предохранитель не расплавился?
Ответ: ________________ Вт.
Верный ответ: 720
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15813.
14. Луч света падает на плоское зеркало. Угол между падающим и отражённым лучами равен 30°. Чему равен угол между падающим лучом и зеркалом?
Ответ: ________________ градусов.
Верный ответ: 75
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15934.
15. Алюминиевый проводник АБ подвешен на тонких медных проволочках и подключён к источнику постоянного напряжения так, как показано на рисунке. Справа от проводника находится северный полюс постоянного магнита. Ползунок реостата плавно перемещают вправо.
Алюминиевый проводник АБ подвешен на тонких медных проволочках и подключён к источнику постоянного напряжения так, как показано на рисунке. Справа от проводника находится северный полюс постоянного магнита. Ползунок реостата плавно перемещают вправо.
Из приведённого ниже списка выберите все верные утверждения о процессах, происходящих в рамке.
1. Линии индукции магнитного поля, созданного магнитом, вблизи проводника АБ направлены вправо.2. Сопротивление реостата уменьшается.3. Силы натяжения проволочек, на которых подвешен проводник АБ, увеличиваются.4. Сила тока, протекающего по проводнику АБ, уменьшается.5. Сила Ампера, действующая на проводник АБ, уменьшается.
Верный ответ: 134
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15815.
16. Неразветвлённая электрическая цепь постоянного тока состоит из источника тока и подключённого к его выводам резистора.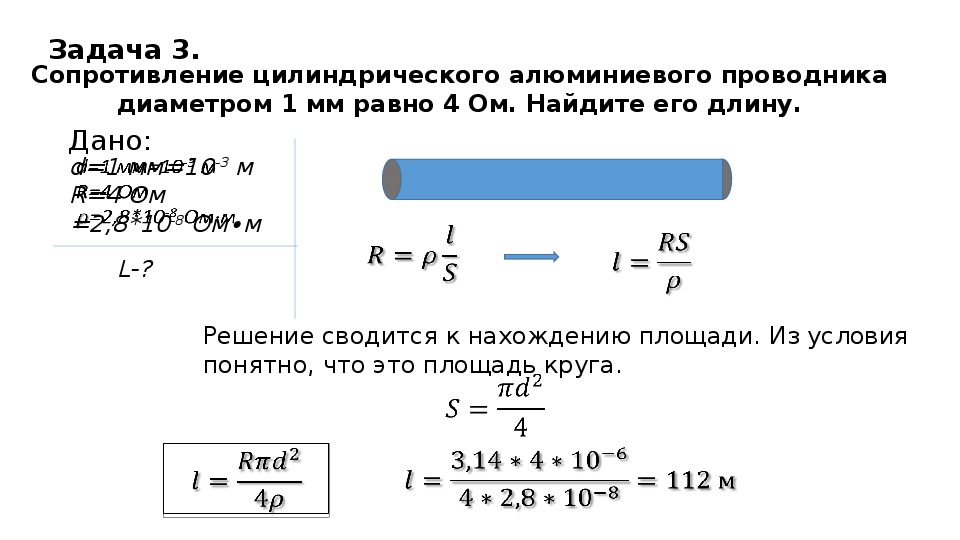 Как изменятся при увеличении сопротивления резистора сила тока в цепи и внутреннее сопротивление источника?
Как изменятся при увеличении сопротивления резистора сила тока в цепи и внутреннее сопротивление источника?
Для каждой величины определите соответствующий характер изменения:
1) не изменяется
2) уменьшается
3) увеличивается
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Верный ответ: 21
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15606.
17. Исследуется электрическая цепь, собранная по схеме, представленной на рисунке.
Определите формулы, которые можно использовать для расчётов показаний амперметра и вольтметра. Измерительные приборы считать идеальными.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами. {156}Eu \)?
{156}Eu \)?
Ответ: ________________ мг.
Верный ответ: 5
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15968.
19. На установке, представленной на фотографиях (рис. а — общий вид, рис. б — фотоэлемент), исследовали зависимость кинетической энергии фотоэлектронов от частоты падающего света. Для этого в прорезь осветителя помещали различные светофильтры и измеряли запирающее напряжение. В первой серии опытов использовался светофильтр, пропускающий только фиолетовый свет, а во второй — пропускающий только зелёный свет.
Как изменяются модуль запирающего напряжения и максимальная кинетическая энергия фотоэлектронов при переходе от первой серии опытов ко второй? Для каждой величины определите соответствующий характер изменения.
1) не изменяется
2) уменьшается
3) увеличивается
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Цифры в ответе могут повторяться.
Верный ответ: 22
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15639.
20. Выберите все верные утверждения о физических явлениях, величинах и закономерностях. Запишите цифры, под которыми они указаны.
1. Инфракрасное, ультрафиолетовое и видимое излучения — излучения электромагнитной природы, различающиеся скоростью распространения в вакууме.2. Масса покоя ядра всегда больше массы покоя слагающих его протонов и нейтронов.3. Пар над поверхностью жидкости является насыщенным, если за одно и то же время с поверхности жидкости в среднем вылетает меньшее число молекул, чем число молекул, возвращающихся обратно в жидкость.4. Сила Лоренца не действует на заряженные частицы, движущиеся параллельно линиям индукции однородного магнитного поля.5. Скорость тела относительно неподвижной системы отсчёта равна геометрической сумме скорости тела относительно подвижной системы отсчёта и скорости подвижной системы относительно неподвижной.
Верный ответ: 45
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15529.
21. Даны следующие зависимости величин:
А) зависимость давления идеального газа в изобарном процессе от температуры
Б) зависимость силы тока через участок цепи, содержащий резистор, от сопротивления резистора при постоянном напряжении на участке цепи
В) зависимость энергии фотона от длины волны
Установите соответствие между этими зависимостями и видами графиков, обозначенных цифрами 1-5. Для каждой зависимости А-В подберите соответствующий вид графика и запишите в таблицу выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Верный ответ: 422
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15830.
22. Погрешность прямого измерения силы динамометром, на котором висит груз, равна цене деления. Каков вес груза?
Ответ: (________ ± ________) Н.
Верный ответ: 121
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15520.
23. Школьник изучает свободные колебания нитяного маятника. В его распоряжении имеется пять маятников, характеристики которых указаны в таблице. Какие два маятника необходимо взять школьнику для того, чтобы на опыте выяснить, зависит ли период свободных колебаний маятника от длины маятника? Шарики сплошные.
Запишите в ответе номера выбранных маятников.
Верный ответ: 14
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15701.
Часть 2
24. Один моль гелия участвует в циклическом процессе 1-2-3-4-1, график которого изображён на рисунке в координатах p-T, где p — давление газа, T — абсолютная температура. Опираясь на законы молекулярной физики и термодинамики, сравните работу газа в процессе 2-3 и модуль работы внешних сил в процессе 4-1. Постройте график цикла в координатах p-V, где p — давление газа, V — объём газа.
1. Работа газа в процессе 2-3 больше модуля работы внешних сил в процессе 4-1: A23 > |A41|.
2. Поскольку работа газа в термодинамике численно равна площади фигуры под графиком p(V), где p — давление газа, V — объём газа, перестроим график цикла в эти координаты. Процесс 1-2 является изохорным, поскольку его график проходит через начало координат, в нём абсолютная температура и давление газа увеличились в 4 раза. Процесс 2-3 является изотермическим, в координатах p-V его графиком является гипербола. Согласно закону Бойля — Мариотта pV = const, уменьшение в 2 раза давления приведёт к увеличению в 2 раза объёма газа. В процессе 3-4 газ изохорно уменьшил свою абсолютную температуру и давление в 2 раза, а в процессе 4-1 изобарно вернулся в исходное состояние, согласно закону Гей-Люссака V/T = const, уменьшив абсолютную температуру и свой объём в 2 раза (см. рисунок).
Согласно закону Бойля — Мариотта pV = const, уменьшение в 2 раза давления приведёт к увеличению в 2 раза объёма газа. В процессе 3-4 газ изохорно уменьшил свою абсолютную температуру и давление в 2 раза, а в процессе 4-1 изобарно вернулся в исходное состояние, согласно закону Гей-Люссака V/T = const, уменьшив абсолютную температуру и свой объём в 2 раза (см. рисунок).
3. Из графика видно, что работа газа в процессе 2-3 численно равна площади под гиперболой 2-3 и A23 > 2p0 (2V0 — V0) = 2p0V0, а модуль работы внешних сил в процессе 4-1 |A41| = p0 (2V0 -V0) = p0V0.
Таким образом, A23 > |A41|.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15552.
25. Груз массой 120 кг удерживают с помощью рычага, приложив к его концу вертикально направленную силу величиной 300 Н (см. рисунок). Рычаг состоит из шарнира без трения и длинного однородного стержня массой 30 кг. Расстояние от оси шарнира до точки подвеса груза равно 1 м. Определите длину стержня.
Груз массой 120 кг удерживают с помощью рычага, приложив к его концу вертикально направленную силу величиной 300 Н (см. рисунок). Рычаг состоит из шарнира без трения и длинного однородного стержня массой 30 кг. Расстояние от оси шарнира до точки подвеса груза равно 1 м. Определите длину стержня.
Правило для моментов сил относительно оси, проходящей через шарнир перпендикулярно
плоскости рисунка: \( F(L — b) + mg\left( {\frac{L}{2} — b} \right) = Mgb \), где m — масса стержня.
Проведя преобразования, получим
\( L = \frac{{b\left( {F + g\left( {m + M} \right)} \right)}}{{F + \frac{{mg}}{2}}} \)\( = \frac{{1 \cdot \left( {300 + 10 \cdot 150} \right)}}{{300 + 150}} = \) 4 м.
Ответ: L = 4 м.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15523.
26. На металл падает поток фотонов с частотой в 3,5 раза больше «красной границы» фотоэффекта. Во сколько раз увеличится максимальная кинетическая энергия фотоэлектронов, вылетающих из этого металла, если частоту падающего света увеличить в 2 раза?
Во сколько раз увеличится максимальная кинетическая энергия фотоэлектронов, вылетающих из этого металла, если частоту падающего света увеличить в 2 раза?
Запишем уравнение Эйнштейна для фотоэффекта для первого случая:
hν1 = hνкр + E1, где ν1 = 3,5νкр.
Следовательно: E1 = 2,5hνкр.
Для второго случая: hν2 = hνкр +E2, и по условию ν2 = 2ν1. Следовательно, E2 = 6hνкр.
Отсюда: E2 = 2,4E1. Максимальная кинетическая энергия фотоэлектронов, вылетающих из металла, увеличится в 2,4 раза.
Ответ: в 2,4 раза.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15764.
27. В сосуде объёмом V = 0,02 м3 с жёсткими стенками находится одноатомный газ при атмосферном давлении. В крышке сосуда имеется отверстие площадью s, заткнутое пробкой. Максимальная сила трения покоя F пробки о края отверстия равна 100 Н. Пробка выскакивает, если газу передать количество теплоты не менее 15 кДж. Определите значение s, полагая газ идеальным. Массой пробки пренебречь.
В крышке сосуда имеется отверстие площадью s, заткнутое пробкой. Максимальная сила трения покоя F пробки о края отверстия равна 100 Н. Пробка выскакивает, если газу передать количество теплоты не менее 15 кДж. Определите значение s, полагая газ идеальным. Массой пробки пренебречь.
Пробка выскочит, если сила, с которой газ давит изнутри на пробку, превысит суммарную силу давления атмосферного воздуха снаружи на пробку и трения пробки о края отверстия. А это произойдёт, когда давление газа превысит атмосферное давление на величину \( \Delta p = \frac{F}{s} \), откуда: \( s = \frac{F}{{\Delta p}} \).
Поскольку изначально давление газа в сосуде равно атмосферному, именно такое изменение давления газа в сосуде определяет предельное количество теплоты, переданное газу.
Поскольку объём V газа не меняется, изменение давления газа связано с изменением его температуры T. Согласно уравнению Менделеева — Клапейрона \( V \cdot \Delta p = \nu R \cdot \Delta T \), где \( \nu \) — количество газообразного вещества. { — 4}} \) м2.
{ — 4}} \) м2.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15525.
28. На горизонтальном столе лежат два параллельных друг другу рельса: a и b, замкнутых двумя одинаковыми металлическими проводниками: AC и ED (см. рисунок). Вся система проводников находится в однородном магнитном поле, направленном вертикально вниз. Модуль индукции магнитного поля равен B, расстояние между рельсами \( l \) скорости проводников υ1 и υ2, сопротивление каждого из проводников R. Какова сила тока в цепи? Сопротивлением рельсов пренебречь.
1. Согласно закону электромагнитной индукции ЭДС в контуре AEDC пропорциональна скорости изменения потока вектора магнитной индукции:
\( \left| {{\varepsilon _{инд}}} \right| = \left| {\frac{{\Delta \Phi }}{\Delta t}} \right| = \left| {B\frac{{\Delta S}}{{\Delta t}}} \right| = Bl\left( {{\upsilon _1} + {\upsilon _2}} \right) \) (1)
2. { — 19}} \cdot 250}} \) ≈ 2,6 ⋅ 10-3 м = 2,6 мм
{ — 19}} \cdot 250}} \) ≈ 2,6 ⋅ 10-3 м = 2,6 мм
Ответ: d ≈ 2,6 мм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 15737.
30. Снаряд разорвался в полёте на две равные части, одна из которых продолжила движение в направлении движения снаряда, а другая — в противоположную сторону. В момент разрыва суммарная кинетическая энергия осколков увеличилась за счёт энергии взрыва на величину \(\Delta \)E = 600 кДж. Модуль скорости осколка, летящего по направлению движения снаряда, равен 900 м/с, а модуль скорости второго осколка — 100 м/с. Найдите массу снаряда. Обоснуйте применимость законов, используемых для решения задачи.
Обоснование
Задачу будем решать в инерциальной системе отсчёта, связанной с поверхностью Земли. Будем считать все тела материальными точками. Трением снаряда и осколков о воздух пренебрежём. 2}}} = 4,8 \) кг
2}}} = 4,8 \) кг
Ответ: \( m \) = 4,8 кг
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 21073.
Основное уравнение МКТ идеального газа
ОпределениеИдеальный газ — газ, удовлетворяющий трем условиям:
- Молекулы — материальные точки.
- Потенциальная энергия взаимодействия молекул пренебрежительно мала.
- Столкновения между молекулами являются абсолютно упругими.
Реальный газ с малой плотностью можно считать идеальным газом.
Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
- По шкале Цельсия — t. Единица измерения — 1 градус Цельсия (1 oC).
- По шкале Кельвина — T. Единица измерения — 1 Кельвин (1 К).
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
∆t = ∆T
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
T = t + 273
Если особо важна точность, следует использовать более точную формулу:
T = t + 273,15
Пример №1. Температура воды равна oC. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p=23..n−Ek
p — давление идеального газа, n — концентрация молекул газа, −Ek — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
p=13..m0n−v2 | m0— масса одной молекулы газа; n — концентрация молекул газа; −v2 — среднее значение квадрата скорости молекул газа. Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости: v=√−v2 |
p=13. | ρ — плотность газа |
p=nkT | k — постоянная Больцмана (k = 1,38∙10–3 Дж/кг) T — температура газа по шкале Кельвина |
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:
Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
v=√3kTm0..=√3RTM..
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
R=NAk=8,31 Дж/К·моль
Температура — мера кинетической энергии молекул идеального газа:
−Ek=32. .kT
.kT
T=2−Ek3k..
Полная энергия поступательного движения молекул газа определяется формулой:
E=N−Ek
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:
Следовательно:
Составим систему уравнений:
Отсюда:
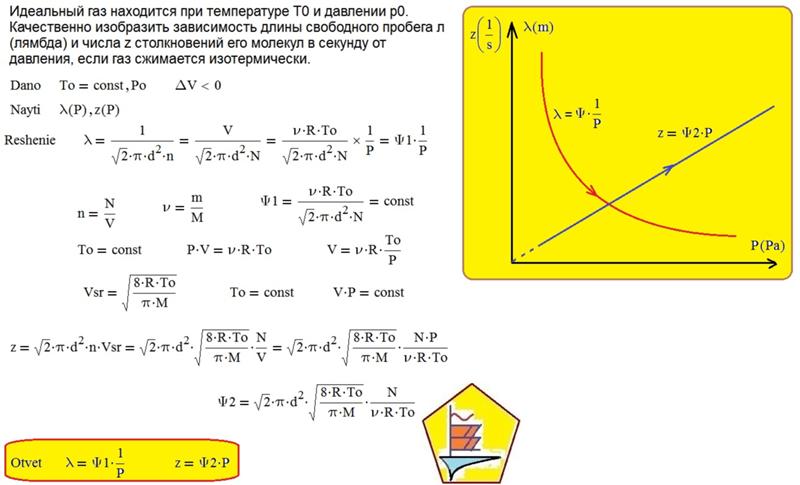
Задание EF19012На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3..
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1..=p2V2T2..
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17560Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
Ответ:
а) 13..p1
б) 2p1
в) 23..p1
г) 43..p1
Алгоритм решения
1. Записать исходные данные.
Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для состояний 1 и 2.
4.Выразить искомую величину.
Решение
Исходные данные:
• Начальное давление: p0.
• Начальная концентрация молекул: n1 = 3n.
• Конечная концентрация молекул: n2 = n.
• Начальная средняя энергия хаотичного движения молекул: Ek1 = Ek.
• Конечная средняя энергия хаотичного движения молекул: Ek2 = 2Ek.
Основное уравнение МКТ:
p=23..n−Ek
Составим уравнения для начального и конечного состояний:
p1=23..n1−Ek1=23..3n−Ek=2n−Ek
p2=23..n2−Ek2=23..n2−Ek=43..n−Ek
Отсюда:
n−Ek=p12..=3p24..
p2=4p16..=23..p1
.
.
Ответ: вpазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18416 Цилиндрический сосуд разделён неподвижной теплоизолирующей перегородкой. В одной части сосуда находится кислород, в другой – водород, концентрации газов одинаковы. Давление кислорода в 2 раза больше давления водорода. Чему равно отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода?
В одной части сосуда находится кислород, в другой – водород, концентрации газов одинаковы. Давление кислорода в 2 раза больше давления водорода. Чему равно отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода?Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Концентрации кислорода и водорода в сосуде равны. Следовательно, n1 = n2 = n.
• Давление кислорода вдвое выше давления водорода. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23..n−Ek
Применим его для обоих газов и получим:
p1=23. .n1−Ek1 или 2p=23..n−Ek1
.n1−Ek1 или 2p=23..n−Ek1
p2=23..n2−Ek2 или p=23..n−Ek2
Выразим среднюю кинетическую энергию молекул газа из каждого уравнения:
−Ek1=3pn..
−Ek2=3p2n..
Поделим уравнения друг на друга и получим:
−Ek1−Ek2..=3pn..·2n3p..=2
.
Ответ: 2pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18824 В одном сосуде находится аргон, а в другом – неон. Средние кинетические энергии теплового движения молекул газов одинаковы. Давление аргона в 2 раза больше давления неона. Чему равно отношение концентрации молекул аргона к концентрации молекул неона?Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение концентрации молекул аргона к концентрации молекул неона.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Средние кинетические энергии теплового движения молекул газов одинаковы. Следовательно, −Ek1=−Ek2=−Ek.
Следовательно, −Ek1=−Ek2=−Ek.
• Давление аргона в 2 раза больше давления неона. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23..n−Ek
Применим его для обоих газов и получим:
p1=23..n1−Ek1 или 2p=23..n1−Ek
p2=23..n2−Ek2 или p=23..n2−Ek
Выразим концентрации молекул газа из каждого уравнения:
n1=3p−Ek..
n2=3p2−Ek..
Поделим уравнения друг на друга и получим:
n1n2..=3p−Ek..·2−Ek3p..=2
Ответ: 2pазбирался: Алиса Никитина | обсудить разбор | оценить
Алиса Никитина | Просмотров: 10k
Закон идеального газа — AP Chemistry
Все ресурсы AP Chemistry
6 диагностических тестов 225 практических тестов Вопрос дня Карточки Learn by Concept
← Предыдущая 1 2 3 Следующая →
AP Chemistry Help » Растворы и состояния вещества » Газы » Закон об идеальном газе
Каково конечное давление газа, имеющего первоначальное давление 10 атм при объеме 50 л, если объем теперь составляет 25 л?
Возможные ответы:
5 атм
50 Атм
10 Атм
25 Атм
20 Атм
Правильный ответ:
20 Атм
Пояснение:
Используйте P1V1 = P2V2
P1 = 10 атм; V1 = 50 л
P2 = Х; V2 = 25 л
(10 атм)(50 л) = (x)(25 л)
500 = 25x
x = 20
Сообщить об ошибке
Образец идеального газа нагревается в 2-литровом сосуде при температуре 320 Кельвинов. Давление в сосуде 2,5 атм. Каково будет новое давление в сосуде, если объем уменьшить вдвое, а температуру понизить до 250 Кельвинов?
Давление в сосуде 2,5 атм. Каково будет новое давление в сосуде, если объем уменьшить вдвое, а температуру понизить до 250 Кельвинов?
Возможные ответы:
Правильный ответ:
Пояснение:
Поскольку газ идеальный, мы можем использовать вариант закона для идеального газа, чтобы найти неизвестное конечное давление.
Поскольку мы знаем, что количество молей между обоими сосудами постоянно (и R также является постоянным), мы можем просто сравнить три фактора, которыми манипулируют два сосуда: давление, объем и температура. Используя комбинацию закона Бойля и закона Шарля, мы можем сравнить два сосуда друг с другом, используя следующее уравнение.
Используйте данные значения для расчета конечного давления.
Сообщить об ошибке
Идеальный газ занимает 60 л при 2 атм. Каким будет новое давление, если газ сжать до 30 л?
Каким будет новое давление, если газ сжать до 30 л?
Возможные ответы:
Правильный ответ:
Объяснение:
Закон идеального газа (модифицированный)
P 1 В 1 = P 2 В 2
P1 = 2 атм; V1 = 60 л; Р2 = ?; V2 = 30 л
(2)(60) = (X)(30)
P2 = 4 атм
Сообщить об ошибке
Аммиак создается в соответствии с приведенным ниже сбалансированным уравнением.
Реакцию можно проводить в жестком контейнере. Восемь молей газообразного водорода смешаны с двумя молями газообразного азота. Начальное давление, действующее на баллон, равно 5 атм.
Если предположить, что реакция завершится, какое давление будет оказываться на сосуд после того, как реакция произойдет?
Возможные ответы:
Правильный ответ:
Объяснение:
Поскольку общее давление зависит от количества молей в сосуде, мы можем использовать соотношение молей до и после реакции, чтобы определить конечное давление в сосуде. В сосуде изначально десять молей газа, восемь молей водорода и два моля азота.
В сосуде изначально десять молей газа, восемь молей водорода и два моля азота.
Следующим шагом является определение того, сколько молей аммиака образовалось в результате реакции и остался ли избыток реагента после реакции. Поскольку отношение газообразного водорода к газообразному азоту составляет 1:3, только шесть молей газообразного водорода будут использованы для реакции со всеми двумя молями газообразного азота.
Остается два моля избыточного газообразного водорода. Используя стехиометрию и молярные отношения, мы определяем, что четыре моля аммиака образуются в реакции, которая потребляет два моля азота.
Четыре моля аммиака плюс два оставшихся моля газообразного водорода дают шесть молей всего газа после завершения реакции.
Шесть молей — это 60% начального количества молей в контейнере, поэтому конечное давление будет равно 60% начального давления. Мы можем решить, используя закон идеального газа.
Сообщить об ошибке
Сколько молей газообразного кислорода содержится в объеме 10 л при 1 атм и 25 o C? (МВт кислородного газа = 32 г/моль)
Возможные ответы:
2,5 моль
4 моль
14 моль
0,41 моль
0,041 моль
Правильный ответ:
10. 41414
41414
. Правильный ответ:
9000 4. 0,414141414. Объяснение:
использовать PV = nRT
n = PV/RT
P = 1 атм; V = 10 л; R = 0,0821 лат/мольК; T = 298 K (НЕОБХОДИМО переключить температуру на K)
n = моли газа
n = (1 атм)(10 л)/(0,0821 латм/мольK)(298K)
n= 0,41 моль
Сообщить об ошибке
Сколько молей будет у газа, который ведет себя идеально, если он занимает 2 л при 4 атм при температуре 37 o C?
Возможные ответы:
2,63 моль
0,379 моль
3,18 моль
0,314 моль
0,6 моль
Правильный ответ:
0,314 моль
Объяснение:
Используйте PV = nRT
n = PV/RT
= (2 л)(4 атм) / (0,0821 лат/мольK)(310 K) <-- необходимо заменить T на K
= 8/25,451
= 0,314 моль
Сообщить об ошибке
Если давление образца одного моля идеального газа увеличить с 2 атм до 3 атм при постоянном объеме, а начальная температура была 20°C, какова конечная температура образец?
Возможные ответы:
439,5K
303K
30K
195,3K
Правильный ответ:
439,5K
Пояснение:
Поскольку масса и объем образца идеального газа остаются постоянными, изменение давления вызывает только прямое изменение температуры. Это можно вывести из следующего уравнения идеального газа:
Это можно вывести из следующего уравнения идеального газа:
Сообщить об ошибке
Сколько молей углекислого газа занимает 16-литровый объем при давлении 760 Торр и температуре 250К?
Возможные ответы:
Правильный ответ:
Объяснение:
Мы можем рассчитать число молей, используя закон идеального газа:
Единицы всегда должны быть в единицах СИ: атм, литры, кельвины и т. д. Для этого вопроса у нас есть единицы СИ для всего, кроме давление, которое дается в торр, а не в атм.
Теперь, когда у нас есть правильные единицы измерения, мы можем использовать заданные значения давления, температуры и объема, чтобы найти количество молей присутствующего газа.
Сообщить об ошибке
Образец идеального газа массой 2 моль, объемом 3 л и температурой 298 К испытывает понижение давления на 4 атм. Чему равен конечный объем, если масса и температура остаются постоянными?
Чему равен конечный объем, если масса и температура остаются постоянными?
Возможные ответы:
Правильный ответ:
Пояснение:
Сначала нужно найти начальное давление, подставив начальные условия в уравнение идеального газа.
Уменьшение этого значения на 4 атм приводит к конечному давлению 12,31 атм, которое можно подставить в уравнение идеального газа, чтобы найти конечный объем.
Поскольку изменяются только давление и объем, можно также использовать закон Бойля после нахождения начального и конечного значений давления.
Сообщить об ошибке
Образец газообразного хлора заполняет сосуд при температуре . Сосуд имеет объем 3 л и испытывает давление 3 атм. Какова масса газообразного хлора в сосуде?
Возможные ответы:
Правильный ответ:
Пояснение:
Эта задача требует, чтобы мы заменили моли газа в законе идеального газа массой на молярную массу.
Затем мы можем выделить массу газообразного хлора в сосуде.
Хлор двухатомный, поэтому его молекулярная масса будет вдвое больше атомной массы.
Температура должна быть выражена в градусах Кельвина.
Используя эти значения, мы можем определить массу газообразного хлора в сосуде.
Сообщить об ошибке
← Предыдущий 1 2 3 Следующий →
Уведомление об авторских правах
Все ресурсы AP Chemistry
6 Диагностические тесты 225 практических тестов Вопрос дня Карточки Learn by Concept
ChemTeam: Закон идеального газа: задачи №11
Задача №11: Сколько молей газа содержится в 890,0 мл при температуре 21,0 °C и давлении 750,0 мм рт.ст.?
Обратите внимание на деление 750 на 760. Это делается для перевода давления из мм рт. ст. в атм, поскольку значение R содержит атм в качестве единицы измерения давления. Если бы мы использовали мм рт. ст., единицы давления не сокращались бы, и нам нужно, чтобы они сокращались, потому что мы требуем моль (и только моль) в ответе.
Если бы мы использовали мм рт. ст., единицы давления не сокращались бы, и нам нужно, чтобы они сокращались, потому что мы требуем моль (и только моль) в ответе.
Проблема №12: 1,09 г H 2 содержится в 2,00-литровом контейнере при 20,0 °C. Какое давление в этом сосуде в мм рт.
Обратите внимание на деление 1.09 на 2.02. Это делается для того, чтобы преобразовать граммы в моли, потому что значение R содержит моль как единицу количества вещества. Если бы мы использовали g, единица моль в R не сокращалась бы, и нам нужно, чтобы она сокращалась, потому что мы требуем, чтобы atm (и только atm) был в ответе.
Задача №13: Рассчитайте объем, занимаемый 3,00 моль газа при температуре 24,0 °C и давлении 762,4 мм рт.
Задача № 14: Сколько молей газа будет содержаться в газе, находящемся в сосуде объемом 100,0 мл при температуре 25,0 °C и давлении 2,50 атмосферы?
Задача № 15: Сколько молей газа содержится в газе, находящемся в сосуде объемом 37,0 л при температуре 80,00 °C и давлении 2,50 атм?
В = [(1,27 моль) (0,08206 л атм моль¯ 1 К¯ 1 ) (273,0 К)] / 1,00 атмили
(22,4 л/1,00 моль) = (х/1,27 моль)
3) Изменится ли ответ, если газом будет кислород? Криптон? Углекислый газ? Метан?
Нет, нет, нет, нет.Точная идентичность газа не имеет значения для количества присутствующих молей. Кстати, обратите внимание, что, поскольку температура и давление были бы одинаковыми, в одном и том же объеме будет содержаться одинаковое количество молекул газа, т.е. молей газа. Это гипотеза Авогадро.
Задача № 17: При каком давлении 0,150 моль газообразного азота при 23,0 °C заняли бы 8,90 л?
Решение:
P = нРТ/ВP = [(0,150 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (296,0 K)] / 8,90 л
Задача №18: Какой объем заняли бы 32,0 г газа NO 2 при 3,12 атм и 18,0 °C?
Решение:
В = нРТ / ПВ = [(32,0 г / 46,0 г моль¯ 1 ) (0,08206 л атм моль¯ 1 K¯ 1 ) (291,0 K)] / 3,12 атм
Обратите внимание на перевод граммов в моли (32,0/46,0).
Задача №19: Сколько молей газа содержится в баллоне объемом 50,0 л при давлении 100,0 атм и температуре 35,0 °С? Если газ весит 79,14 г, какова его молекулярная масса?
Решение:
n = PV/RTn = [(100,0 атм) (5,00 л)] / [(0,08206 л атм моль¯ 1 К¯ 1 ) (308,0 К)]
n = 19,7828 моль (я сохранил некоторые сторожевые цифры).
мол. вес. = 79,14 г / 19,7828 моль = 4,00 г/моль (до 3 значащих цифр)
Задача №20: Количество идеального газа при температуре 290,9 К имеет объем 17,05 л при давлении 1,40 атм. Каково давление этой газовой пробы, если объем уменьшить вдвое, а абсолютную температуру умножить на четыре?
Решение:
1) Рассчитайте количество молей газа (я не упомянул единицы измерения):
n = [(1,40) (17,05)] / [(0,08206) (290,9)] = 1,00 моль2) Снова используйте PV = nRT, но разделите объем на два и умножьте температуру на 4. Используйте значение моля из приведенного выше и найдите P:
P = [(1,00) (0,08206) (290,9 x 4)] / (17,05/2) = 11,2 атм
Есть и другой, более концептуальный способ объяснить ответ. Сначала подумаем о связи между давлением и объемом (они обратно пропорциональны). Затем мы подумаем о взаимосвязи между абсолютной температурой и давлением (они связаны напрямую).
Если объем уменьшится в два раза, что произойдет с давлением? Давление ПОВЫШАЕТСЯ в два раза. Таким образом, ваше давление удвоится. Р = 1,40 умножить на 2 = 2,80 атм.
Если абсолютная температура увеличивается, давление увеличивается на ту же величину. Следовательно, поскольку температура умножается на 4, то и давление следует умножать на 4. P = 2,80 умножить на 4 = 11,2 атм.
Задача №21: Полностью сдутый шарик имеет массу 0,5 г. Когда он заполнен неизвестным газом, масса увеличивается до 1,7 г. Вы замечаете на баллоне с неизвестным газом, что он занимает объем 0,4478 л при температуре 50 °С. Вы замечаете, что температура в комнате 25 °C. Определите газ.
Решение:
1) Используйте закон Чарльза, чтобы получить объем при 25 °C:
0,4478 / 323 = х / 298
2) Предположим, что баллон находится под давлением 1,00 атм. Используйте PV = nRT, чтобы получить количество молей газа:
(1,00) (0,41314) = (х) (0,08206) (298)
3) Разделите граммы газа (1,7 г — 0,5 г = 1,2 г) на моли, чтобы получить молекулярную массу:
1,2 г / 0,01689466 моль = 71,0 г/мольГаз хлор Cl 2
Между прочим, использование закона Шарля на первом этапе предполагает, что все содержимое газового баллона было выпущено. Если мы предположим, что канистра разряжена лишь частично, то мы не сможем решить эту проблему.
Если мы предположим, что канистра разряжена лишь частично, то мы не сможем решить эту проблему.
Задача № 22: Образец газа массой 10,20 г имеет объем 5,25 л при 23,0 °C и 751 мм рт.ст. Если к этому постоянному объему 5,25 л добавить 2,30 г того же газа и поднять температуру до 67,0 градусов Цельсия, каково будет новое давление газа?
Решение:
1) Используйте PV = nRT для определения молей образца 10,20 г:
(751 мм рт.ст./760 мм рт.ст. атм -1 ) (5,25 л) = (n) (0,08206 л атм моль -1 К -1 ) (296 К)n = 0,21358 моль
2) Определите молекулярную массу газа:
10,20 г/0,21358 моль = 47,757 г/моль
3) Определить количество молей 2,30 г газа:
2,30 г / 47,757 г/моль = 0,04816 моль
4) Определить новое давление с новым количеством молей и при новой температуре:
(P) (5,25 л) = (0,26174 моль) (0,08206 л атм моль -1 К -1 ) (340 К)Р = 1,39 атм.
Примечание: 0,26174 получилось из 0,21358 плюс 0,04816.
Задача № 23: Газ, состоящий только из углерода и водорода, имеет эмпирическую формулу CH 2 . Газ имеет плотность 1,65 г/л при 27,0 °C и 734,0 торр. Определите молярную массу и молекулярную формулу газа.
Решение:
1) Используйте PV = nRT для определения количества молей газа в 1,00 л:
(734,0 торр/760,0 торр атм -1 ) (1,00 л) = (n) (0,08206 л атм моль -1 К -1 ) (300, К)n = 0,039231 моль
2) Определите молекулярную массу газа:
1,65 г/0,039231 моль = 42,06 г/моль
3) Определите молекулярную формулу:
«Эмпирическая формула веса» CH 2 = 14,027«Эмпирическая формула веса» ед. CH 2 присутствует:
42,06 / 14,027 = 2,998 = 3Молекулярная формула C 3 H 6
Имейте в виду, что «вес по эмпирической формуле» не является стандартным термином в химии.
Задача № 24: 13,9 грамма неизвестного газа помещены в сосуд объемом 5,00 л. Его начальное давление составляет 58,6 кПа, а начальная температура — 60,0 °C. Как называется этот газ?
Решение:
1) Используйте PV = nRT:
(58,6 кПа) (5,00 л) = (n) (8,31447 л кПа моль -1 К -1 ) (333 К)n = 0,10582 моль
Здесь я нашел значение R.
2) Определите молекулярную массу:
13,9 г/0,10582 моль = 131,4 г/мольИзучение периодической таблицы приводит нас к идентификации газа как ксенона.
Задача №25: Колба на 19,5 л при 15 °C содержит смесь трех газов: N 2 (2,50 моль), He (0,38 моль) и Ne (1,34 моль). Рассчитайте парциальное давление неона в смеси.
Решение:
1) Определить общее количество молей газа:
2,50 + 0,38 + 1,34 = 4,22 моль
2) Используйте PV = nRT:
(х) (19,5 атм) = (4,22 моль) (0,08206) (288 К)х = 5,115 атм
Определите парциальное давление неона:
5,115 х (1,34/4,22) = 1,62 атм.Примечание: (1,34/4,22) определяет молярную долю неона.
Задача №26: Колба объемом 1,00 л заполнена 1,25 г аргона при температуре 25,0 °C. Затем в ту же колбу добавляют пары этана, пока общее давление не станет равным 1,050 атм. Какова масса этана, добавленного в колбу?
Решение:
1) Определить парциальное давление Ar:
PV = нРТ(P) (1,00 л) = (1,25 г/39,948 г/моль) (0,08206 л атм/моль К) (298 К)
P = 0,76518 атм
2) Определить парциальное давление этана:
1,050 атм − 0,76518 атм = 0,28482 атм
3) Определить количество молей добавленного этана:
PV = нРТ(0,28482 атм) (1,00 л) = (n) (0,08206 л атм/моль К) (298 К)
n = 0,011647 моль
4) Определите массу этана:
(0,011647 моль) (30,0694 г/моль) = 0,350 г (до трех цифр)
Бонусная задача №1: Давление паров воды при 25 °C составляет 23,76 торр. Если в сосуд объемом 2,0 л налить 1,50 г воды, будет ли в нем жидкость? Если да, то какая масса жидкости?
Если в сосуд объемом 2,0 л налить 1,50 г воды, будет ли в нем жидкость? Если да, то какая масса жидкости?
Решение:
1) Используя закон идеального газа, определите, сколько молей газа необходимо испарить, чтобы получить давление 23,76 торр.
PV = нВУP = давление газа в атм = 23,76 торр x (1 атм / 760 торр) = 0,0313 атм
В = объем газа в л = 2,0
n = моль газа = ?
R = газовая постоянная = 0,08206 л атм/К моль
T = температура по Кельвину = 25 °C + 273 = 298 Kn = PV / RT = (0,0313)(2,0) / (0,08206)(298) = 0,00255992 моль H 2 Газ O
2) Определите массу водяного пара:
0,00255992 моль H 2 газ O x (18,015 г H 2 O / 1 моль H 2 O) = 0,046117 г H 2 O газ
3) Количество жидкости H 2 O в контейнере:
всего г H 2 O − g H 2 O газ —> 1,50 − 0,046117 = 1,45 г H 2 O жидкий (до трех знаков)
Бонусная задача № 2: Контейнер A содержит газ N 2 массой 56,2 г и в 4,4 раза больше объема контейнера B, который содержит аргон (Ar) при той же температуре и давлении. Какова масса Ar (в г) в контейнере B?
Какова масса Ar (в г) в контейнере B?
Решение:
1) Для этой задачи есть два представляющих интерес уравнения:
PV = нРТ
n = m/M, где M — молярная масса газа, а m — масса газа
2) Подставляя одно в другое, имеем вот что:
PV = (м/м)RTпереставить его на это:
ВМ/м = RT/P
3) Некоторые факторы постоянны, некоторые переменны:
R всегда является константой.
Проблема указывает, что P и T также являются постоянными.Это означает, что RT/P является постоянным.
4) Что означает:
ВМ/м = константа
5) Так как есть ВМ/м для азота и ВМ/м для аргона, мы имеем это:
V 1 M 1 /м 1 = V 2 M 2 /м 2перекрестное умножение:
M 2 V 1 M 1 = M 1 V 2 M 2
Разделите на V 1 M 1 :
м 2 = м 1 (В 2 /В 1 ) (М 2 /М 1 )
6) Присвоить значения и решить:
Контейнер A (азот): V 1 = 4,4V 2 , M 1 = 28,0 г/моль
Контейнер B (аргон): V 2 = V 2 , M 2 = 40,0 г/мольМасса Ar в контейнере B = (56,2 г) (V 2 /4,4V 2 ) (40,0/28,0) = 18,2 г (для 3-значной фиг.

 .ρ−v2
.ρ−v2 Точная идентичность газа не имеет значения для количества присутствующих молей. Кстати, обратите внимание, что, поскольку температура и давление были бы одинаковыми, в одном и том же объеме будет содержаться одинаковое количество молекул газа, т.е. молей газа. Это гипотеза Авогадро.
Точная идентичность газа не имеет значения для количества присутствующих молей. Кстати, обратите внимание, что, поскольку температура и давление были бы одинаковыми, в одном и том же объеме будет содержаться одинаковое количество молекул газа, т.е. молей газа. Это гипотеза Авогадро.

Leave A Comment