Строение атома азота – электронная схема
4.7
Средняя оценка: 4.7
Всего получено оценок: 202.
4.7
Средняя оценка: 4.7
Всего получено оценок: 202.
Азот (N) – газ, содержание которого в атмосфере составляет около 78 %. Азот входит в состав аминокислот и нуклеотидов. Строение атома азота определяет физические и химические свойства элемента.
Строение
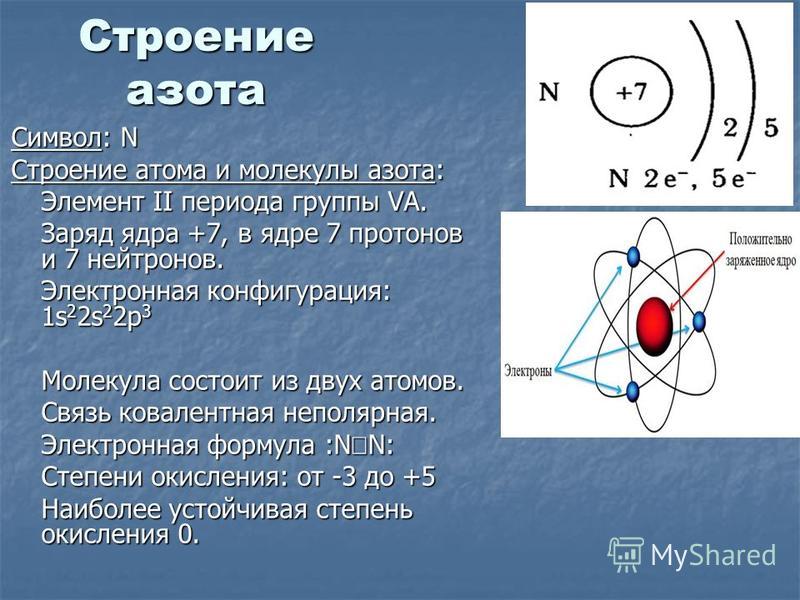
Азот – седьмой элемент периодической таблицы, расположенный в пятой группе и втором периоде. Относительная атомная масса равна 14. В природных условиях встречаются два изотопа азота – 14N и 15N.
Рис. 1. Азот в таблице Менделеева.Азот состоит из ядра с зарядом +7 и семи электронов, распределённых по двум энергетическим уровням. Нахождение элемента в пятой группе указывает на количество электронов на внешнем уровне и высшую валентность. В невозбуждённом состоянии на внешнем энергетическом уровне находится три электрона, поэтому азот может проявлять две валентности – III и V.
Запись электронного строения атома азота – 1s22s22p3 или +7 N)2)5.
Физические свойства
Азот – двухатомный (N2) газ без запаха и вкуса, плохо растворимый в воде. Азот может находиться в газообразном, жидком и твёрдом состояниях. В сжиженной форме азот имеет температуру кипения -196°С. При -209,86°C азот становится твёрдым. Под влиянием разных температур кристаллическая решётка твёрдого азота может изменяться, создавая модификации элемента.
Рис. 2. Жидкий и твёрдый азот.Химические свойства
Атомы азота соединены тройной связью (N ≡ N), что обеспечивает максимальную прочность. Даже при нагревании азота до 3000°C наблюдается незначительное разложение молекул (до 0,1 % от взятого количества газа). Именно поэтому азот – химически малоактивный элемент. В соединениях при нагревании азот легко расстаётся с другими элементами.
Основные химические свойства азота приведены в таблице.
Взаимодействие | Продукт реакции | Пример |
С металлами (реагирует с сильными восстановителями) | Соль | 6Li + N2 → 2Li3N |
Окисление под действием электрического тока | Оксид азота | O2 + N |
С водородом в присутствии катализатора (Fe), под действием температуры (400 °С) и давления (200 атм) | Аммиак | 3H2 + N2 → 2NH3 |
С неметаллами при высоких температурах | Соль | 2B + N2 → 2BN |
Соединения азота с металлами и неметаллами называются нитридами.
Азот не реагирует с кислотами, водой и основаниями. Невозможно непосредственное взаимодействие молекул азота с серой и галогенами. Более активно с этими веществами при нормальных условиях реагирует атомарный азот.
Применение
Несмотря на пассивность азота, элемент широко применяется в промышленности. Кроме того, азот входит в состав клеток, без него невозможно построение белка и ДНК.
Рис. 3. Азот в составе ДНК.Азот используется при производстве:
- удобрений;
- взрывчатых веществ;
- медикаментов;
- красителей;
- пластмассы;
- искусственных волокон;
- аммиака.
Жидкий азот используется для охлаждения, заморозки, а также для окисления двигателей ракет. Оксид азота применяется в качестве наркоза и для производства аэрозолей.
Что мы узнали?
Рассмотрели схему строения азота, его физические, химические свойства, применение. Азот состоит из положительно заряженного ядра и двух электронных оболочек, на которых находится семь электронов. Азот – малоактивный газ. Молекула азота состоит из двух атомов элемента, соединённых тройной связью. Азот может находиться в трёх агрегатных состояниях. Элемент реагирует с некоторыми металлами, неметаллами и кислородом. Азот используется в промышленности, медицине, сельском хозяйстве. Кроме того, азот входит в состав живых организмов.
Азот – малоактивный газ. Молекула азота состоит из двух атомов элемента, соединённых тройной связью. Азот может находиться в трёх агрегатных состояниях. Элемент реагирует с некоторыми металлами, неметаллами и кислородом. Азот используется в промышленности, медицине, сельском хозяйстве. Кроме того, азот входит в состав живых организмов.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 202.
А какая ваша оценка?
Химические связи азота
Химические связи азота
Строение и свойства соединений азота определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы и электронные эффекты ее фрагментов.
На внешнем электронном уровне атом азота имеет три атомные орбитали, которые содержат по одному электрону, и одну АО, занятую двумя электронами.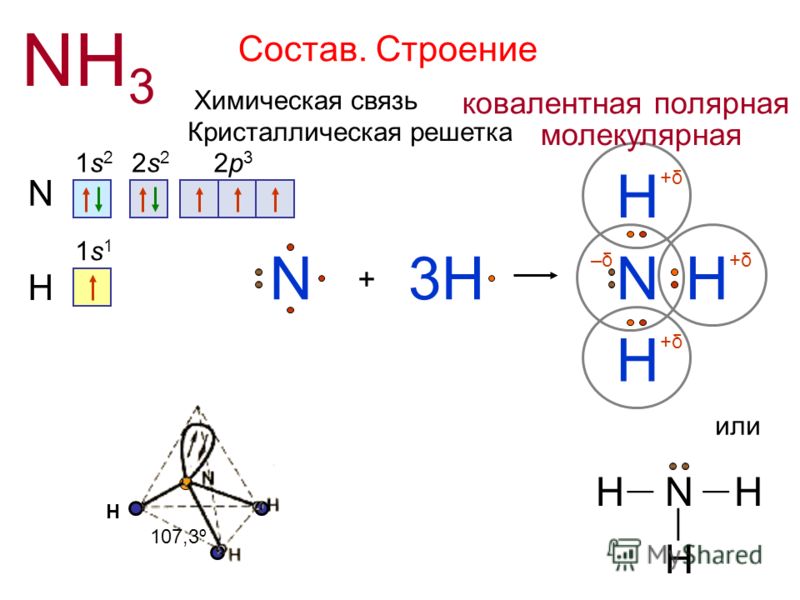
В этом случае азот приобретает максимальную валентность 4. Четырехвалентный азот в аммониевых ионах несет на себе положительный заряд и может участвовать в образовании ионной связи (подобно иону аммония [NH4]+):
По донорно-акцепторному типу (также за счет электронной пары азота) образуется связь N+–O– в нитрогруппе:
Связь N+
 Однако вследствие сопряжения O(sp2)-N(sp2)-O(sp2), как показано выше, обе связи азот-кислород равноценны.
Таким образом, азот может проявлять валентность 3 или 4 и при различной гибридизации образовывать разнообразные связи с другими атомами.
Однако вследствие сопряжения O(sp2)-N(sp2)-O(sp2), как показано выше, обе связи азот-кислород равноценны.
Таким образом, азот может проявлять валентность 3 или 4 и при различной гибридизации образовывать разнообразные связи с другими атомами.
Из значений электроотрицательностей азота (3,0), водорода (2,1), углерода (2,5) и кислорода (3,5) следует, что связи азота с водородом, кислородом или углеродом являются ковалентными полярными.
Электроны связи азота с кислородом, напротив, смещены от атома азота к кислороду, электроотрицательность которого выше.
Характер химических связей и распределение электронной плотности на атомах в молекуле определяют свойства вещества и его поведение в химических реакциях.
- Полярность связей азота с водородом, кислородом и углеродом способствует их гетеролитическому разрыву. Следовательно, реакции с участием этих связей будут происходить преимущественно по ионному механизму.
- Соединения, содержащие атом азота с неподеленной электронной парой, могут проявлять свойства оснований (присоединять протон) и нуклеофильных реагентов (отдавать электронную пару на связь с углеродом).
- Молекулы с полярными группами N–Н, способны к образованию
2.3: Официальные обвинения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31385
Цели
После завершения этого раздела вы сможете
- вычислить формальный заряд атома в органической молекуле или ионе.

- определяет и распознает схемы связывания атомов углерода, водорода, кислорода, азота и галогенов, формальный заряд которых равен нулю.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенный ниже ключевой термин.
- валентные электроны
- связывающие и несвязывающие электроны
- официальное обвинение
- карбокатионы
Учебные заметки
Более важно, чтобы учащиеся научились легко идентифицировать атомы с нулевым формальным зарядом, чем вычислять формальный заряд каждого атома в органическом соединении. Студентам будет полезно запомнить «нормальное» количество связей и несвязывающих электронов вокруг атомов, формальный заряд которых равен нулю.
Определение формального заряда атома
Формальный заряд (\(FC\)) сравнивает количество электронов вокруг «нейтрального атома» (атома, не входящего в молекулу) с количеством электронов вокруг атома в молекуле. Формальный заряд приписывается атому в молекуле, предполагая, что электроны во всех химических связях распределяются поровну между атомами, независимо от относительной электроотрицательности. Чтобы вычислить формальные заряды, мы связываем электроны в молекуле с отдельными атомами в соответствии со следующими правилами:
Формальный заряд приписывается атому в молекуле, предполагая, что электроны во всех химических связях распределяются поровну между атомами, независимо от относительной электроотрицательности. Чтобы вычислить формальные заряды, мы связываем электроны в молекуле с отдельными атомами в соответствии со следующими правилами:
- Несвязывающие электроны относятся к атому, на котором они расположены.
- Связывающие электроны делятся поровну между двумя связанными атомами, поэтому один электрон от каждой связи переходит к каждому атому.
Формальный заряд каждого атома в молекуле можно рассчитать с помощью следующего уравнения:
\[FC = \text{(количество валентных электронов в свободном атоме)} − \text{(количество неподеленных пар электронов) } −\dfrac{1}{2} (\text{количество связывающих электронов}) \label{2.3.1} \]
Чтобы проиллюстрировать этот метод, рассчитаем формальный заряд атомов в аммиаке (\(\ce{Nh4}\)), структура Льюиса которого выглядит следующим образом:
Нейтральный атом азота имеет пять валентных электронов (это в группе 15). Из структуры Льюиса атом азота в аммиаке имеет одну неподеленную пару и три связи с атомами водорода. Подставляя в уравнение \ref{2.3.1}, получаем
Из структуры Льюиса атом азота в аммиаке имеет одну неподеленную пару и три связи с атомами водорода. Подставляя в уравнение \ref{2.3.1}, получаем
\[\begin{align*} FC (N) &= (\text{5 валентных электронов}) − (\text{2 электрона неподеленной пары}) − \dfrac{1}{2} (\text{6 связывающих электронов}) \\[4pt] &= 0 \end{align*} \]
Нейтральный атом водорода имеет один валентный электрон. Каждый атом водорода в молекуле не имеет несвязывающих электронов и имеет одну связь. Используя уравнение \ref{2.3.1} для расчета формального заряда водорода, мы получаем
\[\begin{align*} FC (H) &= (\text{1 валентных электронов}) − (\text{0 неподеленной пары электронов}) − \dfrac{1}{2} (\text{2 связывающих электрона}) \\[4pt] &= 0 \end{align*} \]
Сумма формальных зарядов каждого атома должен быть равен общему заряду молекулы или иона. В этом примере азот и каждый водород имеют формальный нулевой заряд. При суммировании общий заряд равен нулю, что согласуется с общим нейтральным зарядом молекулы \(\ce{Nh4}\). {+}}\). 9{+}}\) выглядит следующим образом:
{+}}\). 9{+}}\) выглядит следующим образом:
Атом азота в аммонии имеет ноль несвязывающих электронов и 4 связи. Таким образом, используя уравнение \ref{2.3.1}, формальный заряд атома азота равен
\[\begin{align*} FC (N) &= (\text{5 валентных электронов}) − (\text{0 неподеленной пары электронов}) − \dfrac{1}{2} (\text{8 связывающих электронов}) \\[4pt] &= +1 \end{align*} \]
Каждый атом водорода имеет одну связь и ноль несвязывающих электронов. Таким образом, формальный заряд каждого атома водорода равен 9.{-}}\).
- Ответить
.
Определение заряда атомов в органических структурах
Рассмотренный выше метод расчета формальных зарядов атомов является важной отправной точкой для начинающего химика-органика и хорошо работает при работе с небольшими структурами. Но этот метод становится неоправданно трудоемким при работе с более крупными конструкциями. Было бы исключительно утомительно определять формальные заряды каждого атома 2′-дезоксицитидина (одного из четырех строительных блоков нуклеозидов, составляющих ДНК) с помощью уравнения \ref{2. 3.1}. Когда вы приобретете больше опыта работы с органическими структурами, вы сможете быстро взглянуть на этот тип сложной структуры и определить заряды на каждом атоме.
3.1}. Когда вы приобретете больше опыта работы с органическими структурами, вы сможете быстро взглянуть на этот тип сложной структуры и определить заряды на каждом атоме.
2′-дезоксицитидин
Вам необходимо развить способность быстро и эффективно рисовать большие структуры и определять формальные заряды. К счастью, для этого требуется лишь некоторая практика в распознавании общих паттернов связи.
Органическая химия имеет дело только с небольшой частью таблицы Менделеева, настолько, что становится удобно уметь распознавать формы связи этих атомов. На рисунке ниже представлены наиболее важные формы склеивания. Они будут подробно обсуждены ниже. Важно отметить, что большинство атомов в молекуле нейтральны. Обратите особое внимание на нейтральные формы элементов ниже, потому что именно так они будут выглядеть большую часть времени.
| Атом | Положительный | Нейтральный | Отрицательный |
|---|---|---|---|
| С | |||
| Н | |||
| О | |||
| Cl (галогены) |
Углерод
Углерод, самый важный элемент для химиков-органиков.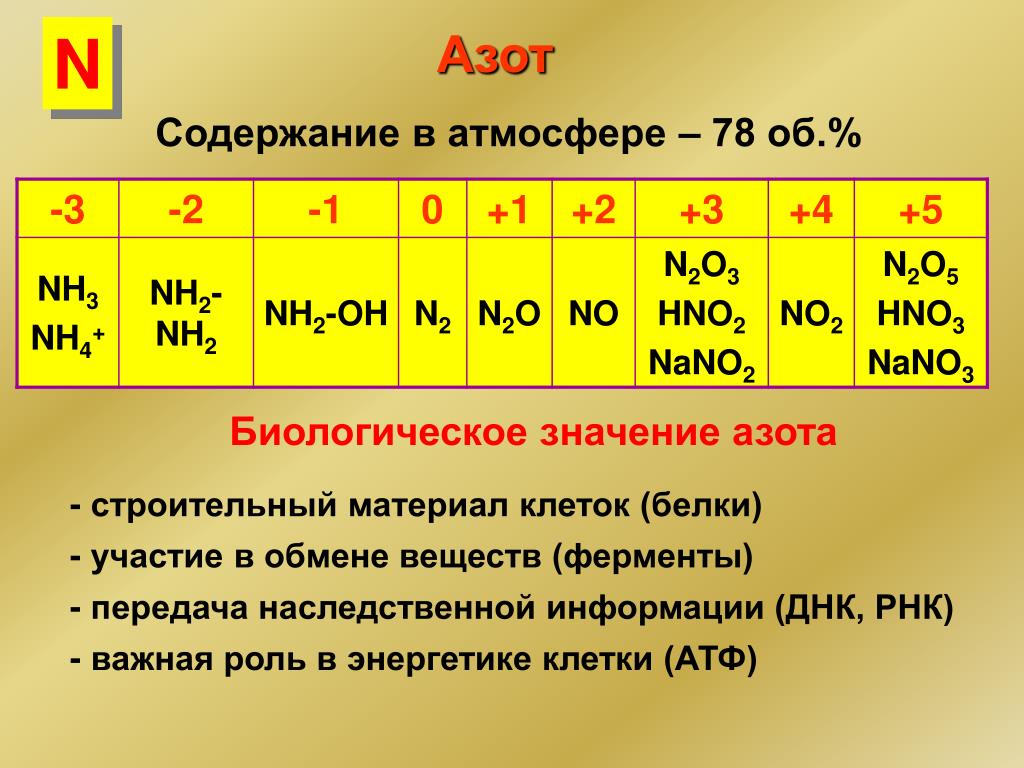 В структурах метана, метанола, этана, этена и этина имеется четыре связи с атомом углерода. И каждый атом углерода имеет формальный нулевой заряд. Другими словами, углерод равен 9.0054 четырехвалентный , что означает, что он обычно образует четыре связи.
В структурах метана, метанола, этана, этена и этина имеется четыре связи с атомом углерода. И каждый атом углерода имеет формальный нулевой заряд. Другими словами, углерод равен 9.0054 четырехвалентный , что означает, что он обычно образует четыре связи.
Углерод обычно образует четыре связи
Углерод четырехвалентен в большинстве органических молекул, но есть исключения. Далее в этой главе и на протяжении всей книги приводятся примеры органических ионов, называемых «карбокатионами» и «карбанионами», в которых атом углерода имеет положительный или отрицательный формальный заряд соответственно. Карбкатионы образуются, когда углерод имеет только три связи и не имеет неподеленных пар электронов. Карбкатионы имеют только 3 валентных электрона и формальный заряд 1+. Карбанионы образуются, когда атом углерода имеет три связи плюс одну неподеленную пару электронов. Карбанионы имеют 5 валентных электронов и формальный заряд 1-.
| карбокатион: 3 связи и нет одиночной пары | карбанион: 3 связи и одна неподеленная пара | углеродный радикал: 3 связи и один неспаренный электрон |
Два других возможных варианта — углеродные радикалы и карбены, формальный заряд которых равен нулю. Углеродный радикал имеет три связи и один неспаренный электрон. Углеродные радикалы имеют 4 валентных электрона и формальный заряд, равный нулю. Карбены представляют собой высокореактивные соединения, в которых атом углерода имеет две связи и одну неподеленную пару электронов, что придает ему формальный нулевой заряд. Хотя карбены встречаются редко, вы встретите их в разделе 8.10 Добавление карбенов к алкенам.
Вы, безусловно, должны использовать методы, которые вы изучили, чтобы проверить правильность этих формальных обвинений для приведенных выше примеров. Что еще более важно, прежде чем вы продвинетесь дальше в изучении органической химии, вам нужно будет просто распознать эти закономерности (и закономерности, описанные ниже для других атомов) и быть в состоянии быстро идентифицировать атомы углерода, несущие положительные и отрицательные формальные заряды. осмотр.
Что еще более важно, прежде чем вы продвинетесь дальше в изучении органической химии, вам нужно будет просто распознать эти закономерности (и закономерности, описанные ниже для других атомов) и быть в состоянии быстро идентифицировать атомы углерода, несущие положительные и отрицательные формальные заряды. осмотр.
Водород
Обычный образец связи для водорода прост: атомы водорода в органических молекулах обычно имеют только одну связь, неспаренные электроны отсутствуют и формальный заряд равен нулю. Исключением из этого правила являются протоны H + , ион гидрида, H — , и водородный радикал, H . . Протон представляет собой водород без связей и неподеленных пар и с формальным зарядом 1+. Ион гидрида представляет собой водород без связей, пару электронов и формальный заряд 1-. Радикал водорода представляет собой атом водорода без связей, с одним неспаренным электроном и формальным зарядом 0. Поскольку эта книга посвящена органической химии применительно к живым существам, мы не увидим «голых» протонов. и гидриды как таковые, потому что они слишком реакционноспособны, чтобы присутствовать в такой форме в водном растворе. Тем не менее, идея протона будет очень важна, когда мы будем обсуждать кислотно-основную химию, а идея иона гидрида станет очень важной гораздо позже в книге, когда мы будем обсуждать органические реакции окисления и восстановления. Однако, как правило, все атомы водорода в органических молекулах имеют одну связь и не имеют формального заряда.
Поскольку эта книга посвящена органической химии применительно к живым существам, мы не увидим «голых» протонов. и гидриды как таковые, потому что они слишком реакционноспособны, чтобы присутствовать в такой форме в водном растворе. Тем не менее, идея протона будет очень важна, когда мы будем обсуждать кислотно-основную химию, а идея иона гидрида станет очень важной гораздо позже в книге, когда мы будем обсуждать органические реакции окисления и восстановления. Однако, как правило, все атомы водорода в органических молекулах имеют одну связь и не имеют формального заряда.
Нейтральный водород: одна связь, нет неподеленной пары
Кислород
Обычное расположение кислорода с формальным нулевым зарядом — это когда атом кислорода имеет 2 связи и 2 неподеленные пары. Другими вариантами являются кислород с 1 связью и 3 неподеленными парами, который имеет формальный заряд 1-, и кислород с 3 связями и 1 неподеленной парой, который имеет формальный заряд 1+. Все три формы кислорода соответствуют правилу октета.
Все три формы кислорода соответствуют правилу октета.
| нейтральный кислород: 2 связи и 2 неподеленные пары | отрицательный кислород: 1 связь и 3 неподеленные пары | положительный кислород: 3 связи и одна неподеленная пара |
Если у него есть две связи и две неподеленные пары, как в воде, у него будет формальный заряд, равный нулю. Если он имеет одну связь и три неподеленные пары, как в гидроксид-ионе, он будет иметь формальный заряд 1-. Если он имеет три связи и одну неподеленную пару, как в ионе гидроксония, он будет иметь формальный заряд 1+.
Кислород также может существовать в виде радикала, например, когда атом кислорода имеет одну связь, две неподеленные пары и один неспаренный (свободнорадикальный) электрон, что придает ему формальный нулевой заряд. А пока сконцентрируйтесь на трех основных нерадикальных примерах, так как они будут составлять большинство кислородсодержащих молекул, с которыми вы столкнетесь в органической химии.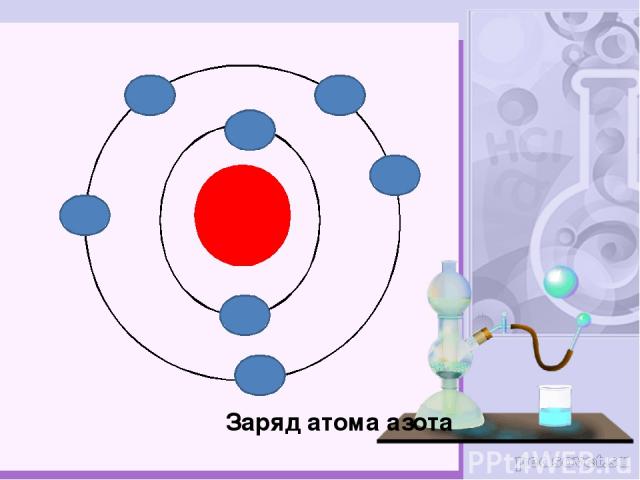
Азот
Азот имеет две основные схемы связывания, каждая из которых соответствует правилу октета:
| нейтральный азот: 3 связи и 1 неподеленная пара | положительный азот: 4 связи | отрицательный азот: 2 связи и 2 неподеленные пары |
Если азот имеет три связи и неподеленную пару, он имеет формальный нулевой заряд. Если у него четыре связи (и нет неподеленной пары), он имеет формальный заряд 1+. В довольно необычной модели связи отрицательно заряженный азот имеет две связи и две неподеленные пары.
Фосфор и сера
Два элемента третьего ряда обычно встречаются в биологических органических молекулах: фосфор и сера. Хотя оба этих элемента имеют другие схемы связывания, которые имеют значение для лабораторной химии, в биологическом контексте сера почти всегда следует той же схеме связи/формального заряда, что и кислород, в то время как фосфор присутствует в форме иона фосфата (PO 4 ).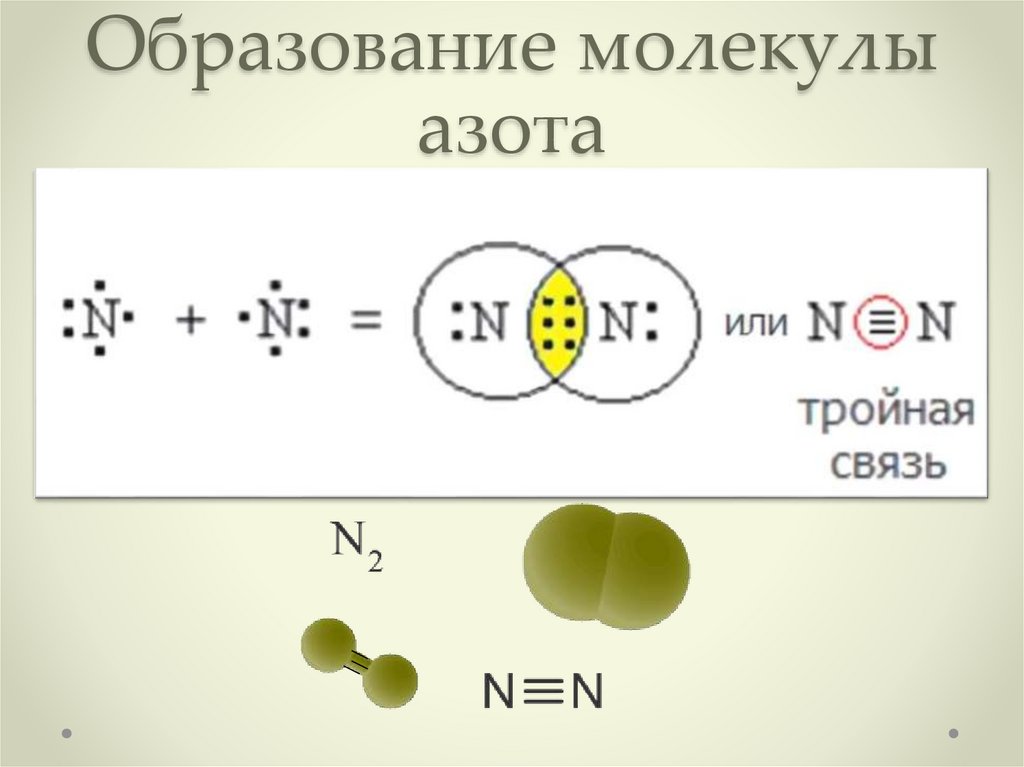 3 — ), где он имеет пять связей (почти всегда с кислородом), нет неподеленных пар и формальный заряд равен нулю. Помните, что элементы в третьей строке периодической таблицы имеют d орбиталей в их валентной оболочке, а также s и p орбиталей и, таким образом, не связаны правилом октетов.
3 — ), где он имеет пять связей (почти всегда с кислородом), нет неподеленных пар и формальный заряд равен нулю. Помните, что элементы в третьей строке периодической таблицы имеют d орбиталей в их валентной оболочке, а также s и p орбиталей и, таким образом, не связаны правилом октетов.
Галогены
Галогены (фтор, хлор, бром и йод) очень важны в лабораторной и медицинской органической химии, но менее распространены в природных органических молекулах. Галогены в органических соединениях обычно имеют одну связь, три неподеленных пары и формальный заряд, равный нулю. Иногда, особенно в случае брома, встречаются реакционноспособные частицы, в которых галоген имеет две связи (обычно в трехчленном кольце), две неподеленные пары и формальный заряд 1+.
Общие схемы нейтральной связи для галогенов
Общая схема положительной связи для галогенов
Эти правила, если их усвоить и усвоить так, что вам не нужно будет даже думать о них, довольно быстро рисовать большие органические структуры, дополненные формальными обвинениями.
После того, как вы научились рисовать структуры Льюиса, не всегда необходимо рисовать неподеленные пары на гетероатомах, так как вы можете предположить, что вокруг каждого атома присутствует надлежащее количество электронов, чтобы соответствовать указанному формальному заряду (или его отсутствию). ). Однако иногда вытягиваются одиночные пары, если это помогает сделать объяснение более ясным.
Упражнение \(\PageIndex{2}\)
Пожалуйста, определите атом с ненейтральным зарядом в следующем атоме:
- Ответ
Рисунок Льюисовской структуры ионных молекулярных соединений
Ион гидроксида, OH — , нарисован простым изображением атома кислорода с его шестью валентными электронами, а затем добавлением еще одного электрона для учета отрицательного заряда. Изменяя количество валентных электронов, характеристики связи кислорода теперь меняются. Теперь у кислорода есть три несвязывающие неподеленные пары, и он может образовать только одну связь с водородом.
Чтобы нарисовать структуру Льюиса иона гидроксония, H 3 O + , вы снова начинаете с атома кислорода с его шестью валентными электронами, затем отнимаете один, чтобы учесть положительный заряд, чтобы получить кислород пять валентные электроны. Кислород имеет одну несвязывающую неподеленную пару и три неспаренных электрона, которые можно использовать для образования связей с тремя атомами водорода.
Использование формальных зарядов для различения структур Льюиса
В качестве примера того, как можно использовать формальные заряды для определения наиболее стабильной структуры Льюиса для вещества, мы можем сравнить две возможные структуры для CO 2 . Обе структуры соответствуют правилам электронной структуры Льюиса.
CO
21. C менее электроотрицателен, чем O, поэтому он является центральным атомом.
2. C имеет 4 валентных электрона, а каждый O имеет 6 валентных электронов, всего 16 валентных электронов.
3. Помещение одной электронной пары между C и каждым O дает O–C–O с 12 оставшимися электронами.
4. Разделение оставшихся электронов между атомами О дает три неподеленных пары на каждом атоме:
Эта структура имеет октет электронов вокруг каждого атома O, но только 4 электрона вокруг атома C.
5. У центрального атома не осталось электронов.
6. Чтобы дать атому углерода октет электронов, мы можем преобразовать две неподеленные пары атомов кислорода в связывающие электронные пары. Однако есть два способа сделать это. Мы можем либо взять по одной электронной паре от каждого кислорода, чтобы сформировать симметричную структуру, либо взять обе электронные пары от одного атома кислорода, чтобы получить асимметричную структуру:
Обе электронные структуры Льюиса дают всем трем атомам октет. Как мы выбираем между этими двумя возможностями? Формальные заряды для двух электронных структур Льюиса CO2 следующие:
Обе структуры Льюиса имеют общий формальный заряд, равный нулю, но структура справа имеет заряд 1+ на более электроотрицательном атоме (O). Таким образом, симметричная структура Льюиса слева предсказывается как более стабильная, и это фактически структура, наблюдаемая экспериментально. Помните, однако, что формальные обвинения делают 9{−}}\)), который используется в печати и в качестве ингибитора коррозии против кислых газов, имеет как минимум две возможные электронные структуры Льюиса. Нарисуйте две возможные структуры, присвойте формальные заряды всем атомам в обеих и решите, какое расположение электронов является предпочтительным.
Таким образом, симметричная структура Льюиса слева предсказывается как более стабильная, и это фактически структура, наблюдаемая экспериментально. Помните, однако, что формальные обвинения делают 9{−}}\)), который используется в печати и в качестве ингибитора коррозии против кислых газов, имеет как минимум две возможные электронные структуры Льюиса. Нарисуйте две возможные структуры, присвойте формальные заряды всем атомам в обеих и решите, какое расположение электронов является предпочтительным.
Дано: химических видов
Запрошено: Электронные структуры Льюиса, формальные заряды и предпочтительное расположение структуры для SCN − .
B Рассчитайте формальный заряд каждого атома, используя уравнение \ref{2.3.1}.
C Предскажите, какая структура предпочтительнее, исходя из формального заряда каждого атома и его электроотрицательности по отношению к другим присутствующим атомам. {-}}\) и используйте формальные заряды, чтобы предсказать, какая из них более стабильна. (Примечание: \(\ce{N}\) — центральный атом.) 9{-}}\). В каждом случае используйте описанный метод расчета формального заряда, чтобы убедиться, что нарисованные вами структуры действительно несут показанные заряды.
{-}}\) и используйте формальные заряды, чтобы предсказать, какая из них более стабильна. (Примечание: \(\ce{N}\) — центральный атом.) 9{-}}\). В каждом случае используйте описанный метод расчета формального заряда, чтобы убедиться, что нарисованные вами структуры действительно несут показанные заряды.
Ответить
2.3: Formal Charges распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами выступили Стивен Фармер, Дитмар Кеннеполь, Лейн Морш, Криста Каннингем, Тим Содерберг, Уильям Ройш и Уильям Ройш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- автор@Дитмар Кеннеполь
- автор@Криста Каннингем
- автор@Лейн Морш
- автор@Стивен Фармер
- автор @ Тим Содерберг
- автор@William Reusch
- связывающих и несвязывающих электронов
- карбокатионы
- официальное обвинение
- валентных электрона
Видео с вопросами: почему азот более электроотрицателен, чем бериллий
Почему элемент азот более электроотрицательный, чем элемент бериллий?
Стенограмма видео
Почему элемент азот более электроотрицательный, чем элемент бериллий? (A) Азот имеет большее количество электронов в аналогичном объеме, что приводит к большей электроотрицательности. (B) Азот имеет большее количество протонов и, следовательно, эффективный ядерный заряд, который сильнее притягивает связывающие электроны. (C) Связующая пара электронов ближе к ядру в бериллии, чем в азоте. (D) Бериллий – это металл, а металлы имеют более высокие значения электроотрицательности, чем неметаллы того же периода. (E) Электроотрицательность увеличивается по мере восхождения по группам периодической таблицы.
(B) Азот имеет большее количество протонов и, следовательно, эффективный ядерный заряд, который сильнее притягивает связывающие электроны. (C) Связующая пара электронов ближе к ядру в бериллии, чем в азоте. (D) Бериллий – это металл, а металлы имеют более высокие значения электроотрицательности, чем неметаллы того же периода. (E) Электроотрицательность увеличивается по мере восхождения по группам периодической таблицы.
Чтобы ответить на этот вопрос, нам нужно определить, почему азот более электроотрицателен, чем бериллий. Электроотрицательность — это тенденция атома притягивать общие электроны связи. Поскольку азот более электроотрицательный, чем бериллий, атом азота должен сильнее притягивать общие электроны связи, чем атом бериллия. Чтобы понять почему, давайте взглянем на атом азота и атом бериллия. Атом азота имеет семь протонов в ядре, два электрона на первой электронной оболочке и пять электронов на второй электронной оболочке. Атом бериллия имеет четыре протона в ядре, два электрона на первой электронной оболочке и два электрона на второй электронной оболочке. Мы видим, что оба этих атома имеют одинаковое количество электронных оболочек и одинаковое количество самых внутренних электронов.
Мы видим, что оба этих атома имеют одинаковое количество электронных оболочек и одинаковое количество самых внутренних электронов.
Давайте рассмотрим внешний электрон в каждом атоме. Каждый из этих электронов испытывает одинаковую степень отталкивания от самых внутренних электронов. Самые внешние электроны в каждом атоме также испытывают силу притяжения к положительно заряженному ядру. Поскольку положительный заряд в ядре атома азота больше, чем положительный заряд в ядре атома бериллия, самые внешние электроны в атоме азота будут сильнее притягиваться к ядру, чем самые внешние электроны в атоме бериллия. Другими словами, суммарный положительный заряд электрона или эффективный заряд ядра больше в атоме азота, чем в атоме бериллия.
Кроме того, поскольку внешние электроны в атоме азота сильнее притягиваются к ядру, атом азота будет меньше атома бериллия. Радиус атома и эффективный заряд ядра влияют на электроотрицательность. Электроны в общей связи с атомом азота будут и ближе к ядру, и сильнее притягиваться из-за большего эффективного заряда ядра, чем электроны в общей связи с атомом бериллия.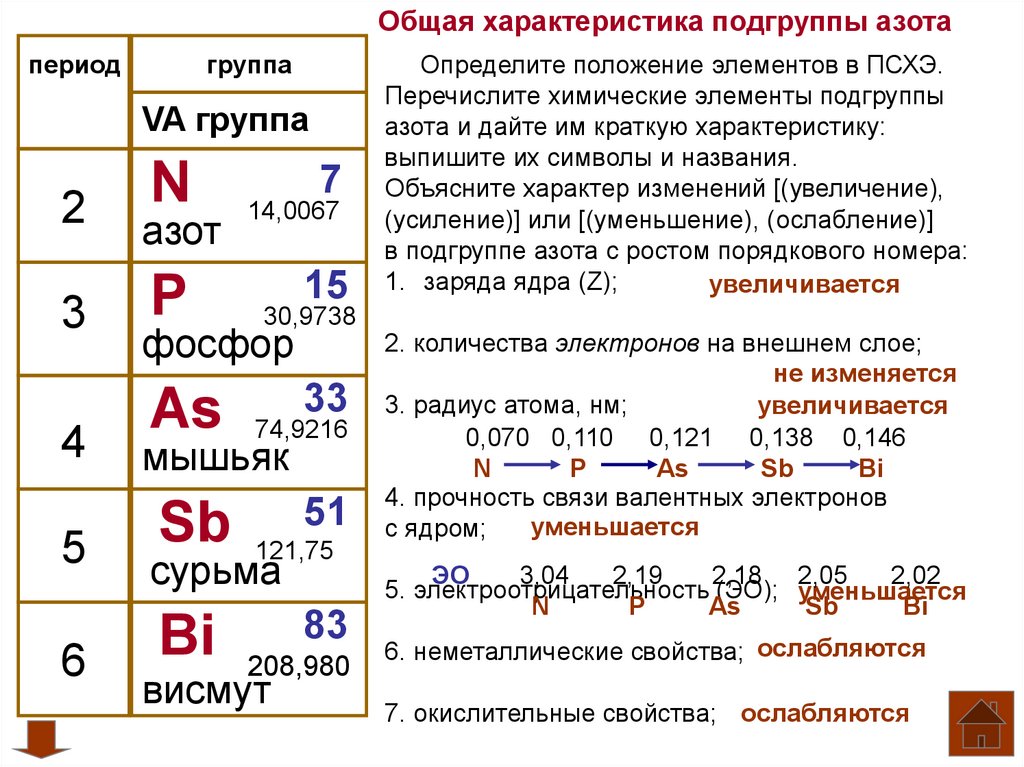


Leave A Comment