Напишите уравнения реакций с помощью которых можно осуществить следующие превращения / Открытый урок
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Li→Li2O→LiOH →LiCI→LiNO3
Решение:
1) 4 Li + O2 = 2Li 2O
2) Li2O + H2O = 2LiOH
3) LiOH + HCI = LiCI + H2O
4) LiCI + AgNO3 = LiNO3 + AgCI↓
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Na→Na2O→NaOH →NaCI→NaNO3
Решение:
1) 4 Na + O2 = 2 Na 2O
2) Na2O + H2O = 2 NaOH
3) NaOH + HCI = Na CI + H2O
4) NaCI + AgNO3 = NaNO3 + AgCI↓
Решение:
1) 2Na + 2H2O à 2NaOH + H2
2) NaOH + CO2 (артық мөлш. ) à NaHCO3
) à NaHCO3
3) 2NaHCO3 à Na2CO3 + CO2↑ + H2O
4) Na2CO3+ H2SO4 →Na2SO4+ CO2↑ + H2O
5) Na
6) Na CI электролиз-à Na+ + CI—
— K │ Na+ + 1е → Na0 бөлінеді
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения K→K2O→KOH →KCI→KNO3
Решение:
1) 4K + O2 = 2K2O
2) K2O + H2O = 2KOH
3) KOH + HCI = KCI + H2O
4) KCI + AgNO3 = KNO3 + AgCI↓
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения
Решение:
1) 2K + 2H2O à 2KOH + 2H2↑
2) KOH + CO2 à K2CO3 + H2O
3) K2CO3 + H2O à KHCO3+ KOH
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Ca → CaH2 →Ca(OH)2 → Ca(HCO3 )2→ CaCО3 → CaCI2 → Ca3(PО4)2
Решение:
1) Ca + H2 à CaH2
2) CaH2 + 2H2O à Ca(OH)2 + 2H2↑ сумен тез әр-ді
3) Ca(OH)2+ 2H2СO3 → Ca(HCO3 )2 + 2H2O
4) Ca(HCO3 )2 →СaСO3↓+ CO2↑ + H2O
5) СaСO3 + 2HCI →СaСI2 + CO2↑ + H2O
6) 3 СaСI2 + 2Н3PО4 à Ca3(PО4)2+ 6HCI
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения
Решение:
1) 2Ca + O2 à 2CaO
2) CaO + H2O à Ca(OH)2
3) Ca(OH)2 + CО2 → CaCО3↓ + H2O
4) CaCО3+ CO2 + H2O→ Ca(HCO3 )2
5) Ca(HCO3 )2+ Ca(OH)2 →2СaСO3↓ + H2O
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения MgCI2→ Mg→ MgSO4 → Mg
Решение:
1) MgCI2 à Mg + CI2↑
2) Mg + H2SO4 → MgSO4 + H2↑
3) 3MgSO4 + 2Na3PO4 à Mg3(PО4)2↓ + 3Na2SO4
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения BaO → Ba(OH)2 → BaCI2 → BaSO4
Решение:
1) BaO + H2O à Ba(OH)2
2) Ba(OH)2 + 2HCI → BaCI2 + 2H2O
3) BaCI2+ H2SO4 à BaSO4+ 2HCI
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Al→Al2O3→Al2( SO4)3 → AI(OH)3 → AICI3
↓
NaAIO2
Решение:
1) 4AI + 3O2 à 2AI2O3
2) AI2O3 + 3H2SO4 à AI2(SO4)3 + 3H2O
3) AI2(SO4)3 + 3NaOH à 2AI(OH)
4) AI(OH)3 + 3HCI à AICI3 + 3H2O
5) AI2O3 + 2NaOHà 2NaAIO2 + H2O
AI2O3 + Na2CO3à 2NaAIO2 + CO2↑
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Al→Al2O3→ AICI3 →Al(NO3)3 → AI(OH)3 → Al2O3→Al
Решение:
1) 4AI + 3O2 à 2AI2O
2) AI2O3+ 6HCI→ 2AICI3+ 3H2O
3) AICI3+ 3 NaOH à AI(OH)3↓ + 3NaCI
4) 2AI(OH)3 à AI2O3+ 3H2O
5) 2AI2O3 → 4AI + 3O2
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Cu → CuO → CuCI2→Cu(OH)2 → СuO → CuSO4
Решение:
1) 2Cu+ O2 = 2CuO
2) CuO + HCI= CuCI2 + H2O
3) CuCI2 + 2NaOH = Cu(OH)
4) Cu(OH)2 à CuO+ H2O
5) CuO + H2SO4 à CuSO4+ H2O
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения Cu → х → CuCI2→ у → CuSO4
Решение:
1) 2Cu+ O2 = 2CuO
2) CuO + 2 HCI= CuCI2 + H2O (X)
3) CuCI2 + 2NaOH = Cu(OH)2 + 2NaCI
4) Cu(OH)2 + H2SO4 à CuSO4+ H2O
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения
Решение:
1) 2 Zn + O2 = 2ZnO
2) ZnO + H2SO4 =ZnSO4 + H2O
3) ZnSO4 + 2KOH = Zn(OH)2+ K2SO4
4) Zn(OH)2 +2HNO3 = Zn(NO3)2 + 2H2O
5) 3Zn(NO3)2 +2H3PO4 = Zn3(PO4)2↓ + 6HNO3
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения
Cr →CrCI3 → Cr(OH)3 → NaCrO2
↓
Na3[Cr(OH)6]
Решение:
1) 2Cr + 3CI2 à 2CrCI3
2) CrCI3+ 3NaOH = Cr(OH)3↓ + 3NaCI
3) Cr(OH)3+ NaOH = NaCrO2 + 2H2O
4) Cr(OH)3+ 3NaOH à Na3[Cr(OH)6]
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения
Решение:
1) 2Cr(OH)3 + 3 H2SO4 à Cr2 (SO4)3 + 3H2O
2) Cr2 (SO4)3 + 2KMnO4 + 7H2O à K2Cr2O + 2Mn(OH)4 + 3 H2SO4
3) K2Cr2O + 2KOH à 2 K2CrO4 + H2O
Скачать публикацию
Задания С3.
 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения…
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения…Задания С3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
t0, Сакт. CH3Cl, AlCl3 Сl2, УФ КОН водн.,t0
1. Этин ? Х1 ? толуол ? Х2 ? Х3 ? С6Н5-СН2-ООСН
H2SO4 разб. H2SO4 конц. t0 Br2 KOH, H2O, t0
2. Калий ? этилат калия ? Х1 ? СН2 = СН2 ? Х2 ? Х3
Н2О 12000 t0, кат. СН3Cl, AlCl3Cl2,УФ
3. Карбид алюминия ? Х1 ? Х2 ? бензол ? Х3 ? Х4
KMnO4, H+CaCO3 t0
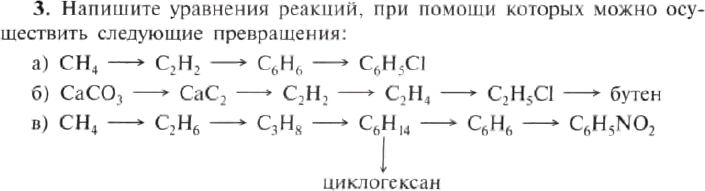
4. CaC2 ? этин ? этаналь ? Х1 ? Х2 ? Х3
CaC2 ? этин ? этаналь ? Х1 ? Х2 ? Х3
СН3Cl, AlCl3 СН3ОН, Н+
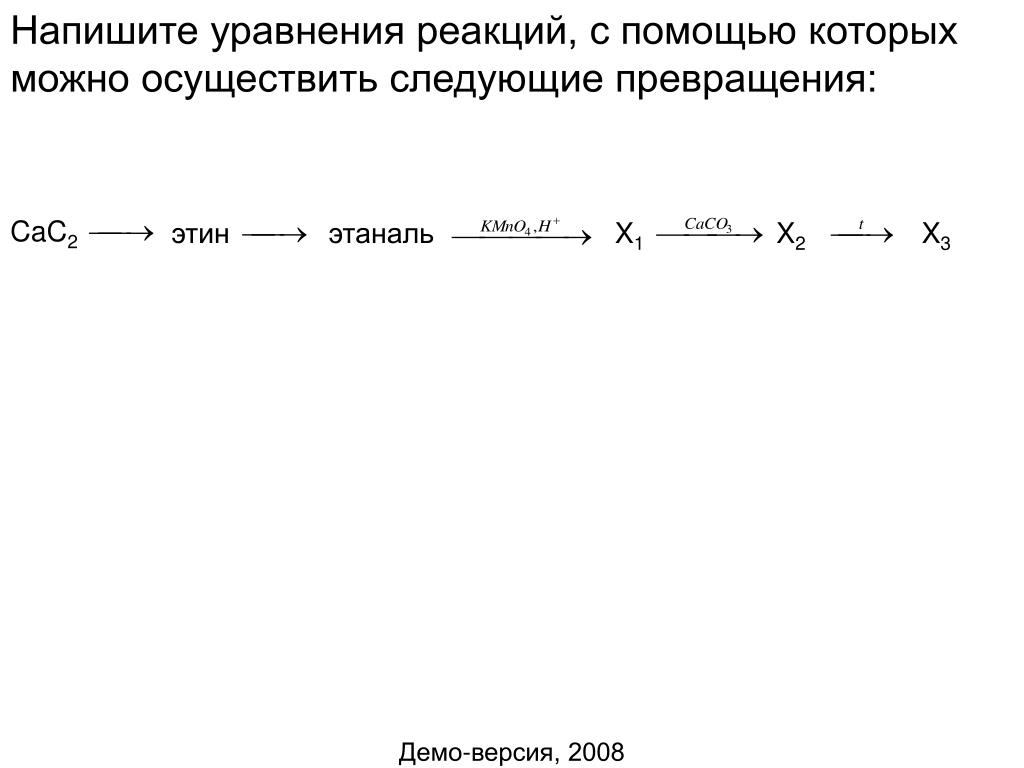
5. Метан ? Х1 ? бензол ? Х2 ? бензойная кислота ? Х3
Br2, свет КОН(спирт.) HBrNa
6. СН3-СН2-СН(СН3)-СН3 ? Х1 ? Х2 ? Х1 ? Х3 ? СО2
NaMnO4, NaOH электролиз Cl2, светKOH, H2OH2SO4, t0
7. СН3СНО ? Х1 ? С2Н6 ? Х2 ? Х3 ? (С2Н5)2О
H2O, Hg2+ KMnO4, H+ NaOH CH3I H2O, H+
8. С2Н2 ? Х1 ? СН3СООН ? Х2 ? Х3 ? уксусная кислота
Н2, кат. Na HCl KMnO4, H2SO4
Na HCl KMnO4, H2SO4
9. СН4 ? НСНО? Х1 ? Х2 ? Х1 ? Х3
С, t Br2 ,h?KOH(спирт.)KMnO4, H2O
10. С2Н2 ? Х1 ? С6Н5С2Н5 ? Х2 ? Х3 ? Х4
[Ag(NH3)2]OHCl2,h?NaOH(спирт.) СН3ОН, Н+ полимеризация
11. СН3-СН2-СНО ? Х1 ? Х2 ? Х3 ? Х4 ? Х5
H2SO4, 2000Cкат., t[Ag(NH3)2]OH HCl KMnO4, H2O
12. Этанол ? Х1 ? Х2 ? Ag2C2? Х2 ? Х3
Cакт. , tCl2, FeCl3,tKMnO4
, tCl2, FeCl3,tKMnO4
13. С2Н2 ? Х1 ? Х2 ? С6Н5СН3 ? СН3-С6Н4—NO2 ? Х3
электролиз Cl2, h?NaOH, H2OH2SO4 (конц), t ‹ 1400
14. СН3СООН? Х1 ? С2Н6 ? Х2 ? Х3 ? Х4
Н2, Ni, t HBr [Ag(NH3)2]OH
15. СН3СНО ? Х1 ? Х2 ? этилен ? СН3СНО ? Х3
Задания С3
(решения и ответы)
1.
Cакт., t 1) 3C2H2? C6H6 AlCl3 2) C6H6 + CH3Cl ? C6H5CH3 + HCl h? 3) C6H5CH3 + Cl2 ? C6H5CH2Cl + HCl H2O 4) C6H5CH2Cl + KOH ? C6H5CH2OH + KCl H2SO4, t 5) C6H5CH2OH + HCOOH ? C6H5CH2OOCH + H2O
2.
1) 2K + 2C2H5OH ? 2C2H5OK + H2
2) C2H5OK + H2SO4 ? C2H5OH + K2SO4
H2SO4, t
3) C2H5OH ? C2H4 + H2O
4) CH2=CH2 + Br2 ? CH2Br-CH2Br
H2O
5) CH2Br-CH2Br + 2KOH ? CH2OH-CH2OH + 2KBr
3.
1) Al4C3 + 12H2O ? 3CH4 + 4Al(OH)3
t
2) 2CH4 ? C2H2 + 3H2
Cакт., t
3) 3C2H2 ? C6H6
AlCl3
4) C6H6 + CH3Cl ? C6H5CH3 + HCl
h?
5) C6H5CH3 + Cl2 ? C6H5CH2Cl + HCl
4. 1) CaC2 + 2H2O ? Ca(OH)2 + C2H2 Hg2+ 2) C2H2 + H2O ? CH3CHO 3) 5CH3CHO+ 2KMnO4 + 3H2SO4 ? 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O 4) 2CH3COOH + CaCO3 ? (CH3COO)2Ca + H2O + CO2 t 5) (CH3COO)2Ca ? CaCO3 + CH3-CO-CH3
5.
t 1) 2CH4 ? C2H2 + 3H2 Cакт., t 2) 3C2H2 ? C6H6 AlCl3 3) C6H6 + CH3Cl ? C6H5CH3 + HCl 4) 5C6H5CH3 + 6KMnO4 + 9H2SO4 ? 5CH3COOH + 3K2SO4 + 6MnSO4 + 14H2O H2SO4, t 5) CH3COOH + CH3OH ? CH3COOCH3 + H2O 1) CH3-CH2-CH(CH3)-CH3 + Br2 ? CH3-CH2-CBr(CH3)-CH3 + HBr 2) CH3-CH2-CBr(CH3)-CH3 + KOH(спирт.) ? CH3-CH=C(CH3)-CH3 + H2O + KBr 3) CH3-CH=C(CH3)-CH3 + HBr ?CH3-CH2-CBr(CH3)-CH3 t 4) 2CH3-CH2-CBr(CH3)-CH3 + 2Na ? CH3-CH2-C(CH3)2-C(CH3)2-CH2-CH3 + 2NaBr t 5) 2C10H22+ 31O2 ? 20CO2? + 22H2O 1) CH3CHO + 2NaMnO4 + 3NaOH ? CH3COONa + 2Na2MnO4 + 2H2O эл. 2) 2CH3COONa ? C2H6 + 2NaHCO3 + H2? h? 3) C2H6 + Cl2 ? C2H5Cl + HCl H2O 4) C2H5Cl + KOH ? C2H5OH + NaCl H2SO4, t 5) 2C2H5OH ? C2H5-O-C2H5 + H2O
 ток
ток
8.
Hg2+ 1) C2H2 + H2O ? CH3COH 2) 5CH3CHO + 2KMnO4 + 3H2SO4 ? 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O 3) CH3COOH + NaOH ? CH3COONa + H2O 4) CH3COONa + CH3I ? CH3COOCH3 + NaI H+ 5) CH3COOCH3 + H2O ? CH3COOH + CH3OH
9. t, кат.
t, кат.
1) CH4 + O2 ?HCHO + H2O
t, кат.
2) HCHO + H2 ? CH3OH
3) 2CH3OH + 2Na ? 2CH3ONa + H2?
4) CH3ONa + HCl ? 2CH3OH + NaCl
5) 5CH3OH + 6KMnO4 + 9H2SO4 ? 5CO2? + 6MnSO4 + 3K2SO4 + 19H2O
10.
1) 3C2H2 ? C6H6 AlCl3 2) C6H6 + C2H5Cl ? C6H5C2H5 + HCl h? 3) C6H5C2H5 + Br2 ? C6H5-CHBr-CH3 + HBr 4) C6H5-CHBr-CH3 + KOH(спирт.) ? C6H5-CH=CH2+KBr + H2O 5) 3C6H5-CH=CH2 + 2KMnO4 + 4H2O ? 3C6H5-CH(OH)-CH2OH + 2MnO2 + 2KOH
11. t 1) CH3-CH2-CHO + 2[Ag(NH3)2]OH ? CH3-CH2-CHOOH + 2Ag + 4NH3 + H2O h? 2) CH3-CH2-CHOOH + Cl2 ? CH3-CHCl-COOH + HCl 3) CH3-CHCl-COOH + NaOH(спирт.) ? CH2=CH-COOH + NaCl + H2O H2SO4, t 4) CH2=CH-COOH + CH3OH ? CH2=CH-COOCH3 + H2O t,кат. 5) nCH2=CH-COOCH3 ? (-CH2-CH-)n | COOCH3
12.
H2SO4, 2000C 1) C2H5OH ? CH2=CH2 + H2O t, Pt 2) CH2=CH2 ? C2H2 + H2 3) C2H2 + 2[Ag(NH3)2]OH ? C2Ag2?+ 4NH3 + 2H2O 4) C2Ag2 + 2HCl ? C2H2 + 2AgCl
4.
 3 Кислотно-основные реакции. Введение в химию
3 Кислотно-основные реакции. Введение в химиюЦели обучения
К концу этого раздела вы сможете:
- Идентифицировать некоторые распространенные кислоты и основания
- Дайте определение кислотно-основным реакциям
- Распознавать и идентифицировать примеры кислотно-щелочных реакций
- Прогноз продуктов кислотно-щелочных реакций.
Кислоты и основания
Определение кислоты часто цитируется как: любое соединение, которое увеличивает количество ионов водорода (H + ) в водном растворе. Химической противоположностью кислоты является основание. Эквивалентное определение основания состоит в том, что основание – это соединение, которое увеличивает количество гидроксид-иона (OH — ) в водном растворе. Эти первоначальные определения были предложены Аррениусом (тот же человек, который предложил диссоциацию ионов) в 1884 году, поэтому они упоминаются как определение по Аррениусу кислоты и основания соответственно.
Вы можете понять, что, основываясь на описании атома водорода, H 9Ион 0019 + — это атом водорода, потерявший свой одинокий электрон; то есть H + — это просто протон. Действительно ли у нас есть голые протоны, движущиеся в водном растворе? Нет. Более вероятно, что ион H + присоединился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водный раствор), молекулу воды с присоединенным к ней дополнительным ионом водорода. как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + обрабатываются одинаково.
В целях этого краткого введения мы рассмотрим только наиболее распространенные типы кислотно-щелочных реакций, происходящих в водных растворах. {+}(водн.)[/latex]
{+}(водн.)[/latex]
Процесс, представленный этим уравнением, подтверждает, что хлористый водород является кислотой. При растворении в воде ионы H 3 O + образуются в результате химической реакции, в которой ионы H + переходят от молекул HCl к молекулам H 2 O (рис. 1).
Рисунок 1. Когда газообразный хлористый водород растворяется в воде, (а) он реагирует как кислота, передавая протоны молекулам воды с образованием (б) ионов гидроксония (и сольватированных ионов хлорида).Природа HCl такова, что ее реакция с водой, как только что описана, практически на 100% эффективна: практически каждая молекула HCl, которая растворяется в воде, подвергается этой реакции. Кислоты, которые полностью реагируют таким образом, называются сильными кислотами , а HCl является одним из немногих обычных кислотных соединений, которые классифицируются как сильные (таблица 1).
 Общие сильные кислоты
Общие сильные кислотыЗначительно большее количество соединений ведут себя как слабые кислоты и лишь частично реагируют с водой, оставляя подавляющее большинство растворенных молекул в их исходной форме и генерируя относительно небольшое количество ионов гидроксония.
| Составная формула | Наименование в водном растворе |
|---|---|
| ВЧ | фтористоводородная кислота |
| ХКН | синильная кислота |
| HC 2 H 3 O 2 | уксусная кислота |
| HNO 2 | азотистая кислота |
| HClO | хлорноватистая кислота |
| HClO 2 | кислота хлористая |
| Н 2 SO 3 | сернистая кислота |
| Н 2 СО 3 | угольная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
Таблица 2. Общие слабые кислоты Общие слабые кислоты | |
Слабые кислоты широко распространены в природе, они частично ответственны за острый вкус цитрусовых, ощущение жжения от укусов насекомых и неприятные запахи, связанные с запахом тела. Известным примером слабой кислоты является уксусная кислота, основной ингредиент пищевых уксусов: 9{-}[/latex](рисунок 2). Использование двойной стрелки в приведенном выше уравнении обозначает аспект частичной реакции этого процесса, понятие, полностью рассмотренное в главах, посвященных химическому равновесию.)
Рисунок 2. (a) Фрукты, такие как апельсины, лимоны и грейпфруты содержат слабокислотную лимонную кислоту. б) уксус содержит слабую уксусную кислоту. (кредит a: модификация работы Скотта Бауэра; кредит b: модификация работы Brücke-Osteuropa/Wikimedia Commons) Основание представляет собой вещество, которое растворяется в воде с образованием гидроксид-ионов, ОН — . Наиболее распространенными основаниями являются ионные соединения, состоящие из катионов щелочных или щелочноземельных металлов (группы 1 и 2) в сочетании с ионом гидроксида, например NaOH и Ca(OH) 2 . Когда эти соединения растворяются в воде, ионы гидроксида высвобождаются непосредственно в раствор. Например, KOH и Ba(OH) 2 растворяются в воде и полностью диссоциируют с образованием катионов (K + и Ba 2+ соответственно) и ионов гидроксида OH — . Эти основания, наряду с другими гидроксидами, полностью диссоциирующими в воде, считаются 9{-}(aq)[/latex]
Когда эти соединения растворяются в воде, ионы гидроксида высвобождаются непосредственно в раствор. Например, KOH и Ba(OH) 2 растворяются в воде и полностью диссоциируют с образованием катионов (K + и Ba 2+ соответственно) и ионов гидроксида OH — . Эти основания, наряду с другими гидроксидами, полностью диссоциирующими в воде, считаются 9{-}(aq)[/latex]
Это уравнение подтверждает, что гидроксид натрия является основанием. При растворении в воде NaOH диссоциирует с образованием ионов Na + и OH — . Это также верно для любого другого ионного соединения, содержащего ионы гидроксида. Поскольку процесс диссоциации практически завершен, когда ионные соединения растворяются в воде в типичных условиях, NaOH и другие ионные гидроксиды классифицируются как сильные основания.
В отличие от ионных гидроксидов, некоторые соединения образуют гидроксид-ионы при растворении в результате химической реакции с молекулами воды. {-}(водн.)[/latex]
{-}(водн.)[/latex]
В обычных условиях только около 1% растворенного аммиака присутствует в виде ионов NH 4 + .
Рисунок 3. Аммиак является слабым основанием, используемым в различных областях. (а) Чистый аммиак обычно применяется в качестве сельскохозяйственного удобрения. (b) Разбавленные растворы аммиака являются эффективными бытовыми чистящими средствами. (кредит a: модификация работы Национальной службы охраны ресурсов; кредит b: модификация работы pat00139)Кислотно-основные реакции
Кислотно-щелочная реакция — это реакция, в которой ион водорода H + переносится от одного химического соединения к другому. Такие реакции имеют центральное значение для многочисленных природных и технологических процессов, начиная от химических превращений, происходящих в клетках, в озерах и океанах, и заканчивая промышленным производством удобрений, фармацевтических препаратов и других веществ, необходимых обществу. Поэтому предмет кислотно-щелочной химии заслуживает тщательного обсуждения.
Поэтому предмет кислотно-щелочной химии заслуживает тщательного обсуждения.
Реакция между кислотой и основанием называется кислотно-щелочной реакцией или реакцией нейтрализации . Хотя кислоты и основания имеют свой собственный уникальный химический состав, кислота и основание нейтрализуют химический состав друг друга, образуя довольно безобидное вещество — воду. На самом деле, общая кислотно-щелочная реакция представляет собой
кислота + основание [латекс]\longrightarrow[/latex] вода + соль
, где термин соль используется для определения любого ионного соединения (растворимого или нерастворимого). ), который образуется в результате реакции между кислотой и основанием. В химии слово 9Соль 0313 относится не только к поваренной соли. Например, сбалансированное химическое уравнение для реакции между HCl(водн.) и KOH(водн.) имеет вид
HCl(водн.) + KOH(водн.) [латекс]\longrightarrow[/латекс] H 2 O(л) + KCl(aq)
, где соль представляет собой KCl. Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Однако в реакции между HCl(водн.) и Mg(OH) 2 (водн.) требуются дополнительные молекулы HCl и H 2 O, чтобы сбалансировать химическое уравнение:
Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Однако в реакции между HCl(водн.) и Mg(OH) 2 (водн.) требуются дополнительные молекулы HCl и H 2 O, чтобы сбалансировать химическое уравнение:
2 HCl(водн.) + Mg(OH) 2 (водн.) [латекс]\longrightarrow[/латекс] 2 H 2 O(л) + MgCl 2 (водн.)
Здесь соль представляет собой MgCl 2 . Это одна из нескольких реакций, которые происходят, когда тип антацида — основание — используется для лечения желудочной кислоты.
Существуют кислотно-основные реакции, которые не подчиняются приведенному выше «общему кислотно-основному уравнению». Например, сбалансированное химическое уравнение для реакции между HCl (водн.) и NH 3 (водн.) равно 9.0005
HCl(водн.) + NH 3 (водн.) [латекс]\longrightarrow[/латекс] NH 4 Cl(водн.)
Пример 1
Напишите реакции нейтрализации каждой кислоты и основания.
A) HNO 3 (AQ) и BA (OH) 2 (AQ) B) H 3 PO 4 (AQ) и CA (OH) 2 (AQ)
40004 Решение
Сначала мы напишем химическое уравнение с формулами реагентов и ожидаемых продуктов; тогда мы сбалансируем уравнение.
a) Ожидаемыми продуктами являются вода и нитрат бария, поэтому начальная химическая реакция будет следующей: 2 O(ℓ) + Ba(NO 3 ) 2 (водный)
Чтобы сбалансировать уравнение, нам нужно понять, что будет две молекулы H 2 O, поэтому две молекулы HNO 3 требуются:
2HNO 3 (водн.) + Ba(OH) 2 (водн.) [латекс]\longrightarrow[/латекс] 2H 2 O(ℓ) + Ba(NO 3 ) 2 (водный)
Это химическое уравнение теперь сбалансировано.
b) Ожидаемыми продуктами являются вода и фосфат кальция, поэтому исходное химическое уравнение имеет вид латекс] H 2 O(ℓ) + Ca 3 (PO 4 ) 2 (s)
Согласно правилам растворимости Ca 3 (PO 3 4 )0034 нерастворим, поэтому он имеет метку фазы (s). Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы уравновесить уравнение:
Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы уравновесить уравнение:
2 H 3 PO 4 (водн.) + 3 Ca(OH) 2 (водн.) [латекс]\longrightarrow[/латекс]6 H 2 O(ℓ) + Ca 3 (PO 4 ) 2 (s)
Это химическое уравнение теперь сбалансировано.
Проверь себя
Напишите реакцию нейтрализации H 2 SO 4 (водн.) и Sr(OH) 2 (водн.).
Ответ
H 2 SO 4 (AQ) +SR (OH) 2 (aq) [Latex] \ longrightRow [/latex] 2 H 2 o ) + SrSO 4 (водн.)
Реакции нейтрализации представляют собой один из типов химических реакций, которые протекают, даже если один реагент не находится в водной фазе. Например, химическая реакция между HCl(aq) и Fe(OH) 3 (т) все еще протекает по уравнению
3 HCl(водн. ) + Fe(OH) 3 (т) [латекс]\longrightarrow[/латекс]3 H 3 (водн.)
) + Fe(OH) 3 (т) [латекс]\longrightarrow[/латекс]3 H 3 (водн.)
, хотя Fe(OH) 3 не растворяется. Когда известно, что Fe(OH) 3 (s) является компонентом ржавчины, это объясняет, почему некоторые чистящие растворы для пятен ржавчины содержат кислоты — в результате реакции нейтрализации образуются растворимые и смываемые продукты. Одним из способов удаления ржавчины и пятен ржавчины является промывка кислотами, такими как HCl, но HCl следует использовать с осторожностью!
Полные и суммарные ионные реакции для реакций нейтрализации будут зависеть от того, растворимы ли реагенты и продукты, даже если кислота и основание реагируют. Например, в реакции HCl(водн.) и NaOH(водн.)
HCl(водн.) + NaOH(водн.) [латекс]\longrightarrow[/латекс]H 2 O(л) + NaCl(водн.)
полная ионная реакция
H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) [латекс]\longrightarrow[/latex]H 2 O(ℓ) + Na + (водн. ) + Cl − (водн.)
) + Cl − (водн.)
они имеют
H + (водн.) + OH — (водн.) [латекс]\longrightarrow[/латекс] H 2 O(ℓ)
в качестве результирующего ионного уравнения. Если бы мы хотели записать это с точки зрения иона гидроксония, H 3 O + (водн.), мы бы написали это как
H 3 O + (водн.) + OH − (водн.) [латекс]\longrightarrow[/латекс] 2H 2 O(л)
За исключением введения дополнительной молекулы воды, эти два суммарных ионных уравнения эквивалентны.
Исследуйте микроскопические представления о сильных и слабых кислотах и основаниях.
Газообразующие кислотно-основные реакции
Движущей силой некоторых кислотно-щелочных реакций является образование газа. Обычно образуются газы H 2 , O 2 и CO 9 .0033 2 .
Например:
2HCl(водн.) + Na 2 CO 3 (водн. ) [латекс]\longrightarrow[/латекс] H 2 CO 3 (водн.) + 2NaCl(водн.) [латекс]\longrightarrow[/латекс ] CO 2 (г) + H 2 O(ж) + 2NaCl(водн.)
) [латекс]\longrightarrow[/латекс] H 2 CO 3 (водн.) + 2NaCl(водн.) [латекс]\longrightarrow[/латекс ] CO 2 (г) + H 2 O(ж) + 2NaCl(водн.)
Приведенный выше пример можно рассматривать как кислотно-щелочную реакцию с последующим разложением. Движущей силой в этом случае является газообразование. Разложение H 2 CO 3 на CO 2 и H 2 O — очень распространенная реакция. Как Na 2 CO 3 , так и NaHCO 3 в смеси с кислотой приводят к газообразующей кислотно-основной реакции.
HCl(водн.) + NaHCO 3 (водн.) [латекс]\longrightarrow[/латекс] H 2 CO 3 (водн.) + NaCl(водн.) [латекс]\longrightarrow[/латекс] CO 2 (г) + H 2 O(ж) + NaCl(водн.)
Приложение «Еда и напитки»: Кислоты в продуктах питания
Многие продукты и напитки содержат кислоты. Кислоты придают кислый вкус пищевым продуктам, что может сделать их более приятными. Например, апельсиновый сок содержит лимонную кислоту, H 3 С 6 Н 5 О 7 . Обратите внимание, как эта формула показывает атомы водорода в двух местах; первые написанные атомы водорода — это атомы водорода, которые могут образовывать ионы H + , а вторые написанные атомы водорода являются частью цитрат-иона, C 6 H 5 O 7 3− . Лимоны и лаймы содержат гораздо больше лимонной кислоты — примерно в 60 раз больше, — поэтому эти цитрусовые более кислые, чем большинство апельсинов. Уксус представляет собой примерно 5% раствор уксусной кислоты (HC 2 H 3 O 2 ) в воде. Яблоки содержат яблочную кислоту (H 2 C 4 H 4 O 5 ; название яблочная кислота происходит от ботанического названия рода яблок, malus ), а молочная кислота (3HC 3903 5 O 3 ) содержится в вине и кисломолочных продуктах, таких как йогурт и некоторые твороги.
Например, апельсиновый сок содержит лимонную кислоту, H 3 С 6 Н 5 О 7 . Обратите внимание, как эта формула показывает атомы водорода в двух местах; первые написанные атомы водорода — это атомы водорода, которые могут образовывать ионы H + , а вторые написанные атомы водорода являются частью цитрат-иона, C 6 H 5 O 7 3− . Лимоны и лаймы содержат гораздо больше лимонной кислоты — примерно в 60 раз больше, — поэтому эти цитрусовые более кислые, чем большинство апельсинов. Уксус представляет собой примерно 5% раствор уксусной кислоты (HC 2 H 3 O 2 ) в воде. Яблоки содержат яблочную кислоту (H 2 C 4 H 4 O 5 ; название яблочная кислота происходит от ботанического названия рода яблок, malus ), а молочная кислота (3HC 3903 5 O 3 ) содержится в вине и кисломолочных продуктах, таких как йогурт и некоторые твороги.
В Таблице 3 «Различные кислоты, содержащиеся в пищевых продуктах и напитках» перечислены некоторые кислоты, содержащиеся в пищевых продуктах либо в естественном виде, либо в виде добавок. Часто в качестве добавок используются соли кислотных анионов, такие как глутамат натрия (MSG), который представляет собой натриевую соль, полученную из глутаминовой кислоты. Читая список, вы должны прийти к неизбежному выводу, что избежать кислот в еде и напитках невозможно.
| Название кислоты | Кислотная формула | Использование и внешний вид |
|---|---|---|
| уксусная кислота | HC 2 H 3 O 2 | ароматизатор; найдено в уксусе |
| адипиновая кислота | Н 2 С 6 Н 8 О 4 | ароматизатор; содержится в обработанных пищевых продуктах и некоторых антацидах |
| альгиновая кислота | различные | загуститель; содержится в напитках, мороженом и продуктах для похудения |
| аскорбиновая кислота | HC 6 H 7 O 6 | антиоксидант, также известный как витамин С; содержится во фруктах и овощах |
| бензойная кислота | HC 6 H 5 CO 2 | консервант; содержится в обработанных пищевых продуктах |
| лимонная кислота | Н 3 С 6 Н 5 О 7 | ароматизатор; содержится в цитрусовых |
| дегидроуксусная кислота | HC 8 H 7 O 4 | консервант, особенно для клубники и тыквы |
| эритробиновая кислота | HC 6 H 7 O 6 | антиоксидант; содержится в обработанных пищевых продуктах |
| жирные кислоты | разные | загуститель и эмульгатор; содержится в обработанных пищевых продуктах |
| фумаровая кислота | Н 2 С 4 Н 2 О 4 | ароматизатор; кислотный реагент в некоторых разрыхлителях |
| глутаминовая кислота | H 2 C 5 H 7 НЕТ 4 | ароматизатор; содержится в обработанных пищевых продуктах и помидорах, некоторых сырах и соевых продуктах |
| молочная кислота | HC 3 H 5 O 3 | ароматизатор; содержится в вине, йогурте, твороге и других кисломолочных продуктах |
| яблочная кислота | Н 2 С 4 Н 4 О 5 | ароматизатор; содержится в яблоках и незрелых фруктах |
| фосфорная кислота | H 3 Заказ на покупку 4 | ароматизатор; встречается в некоторых колах |
| пропионовая кислота | HC 3 H 5 O 2 | консервант; найдено в выпечке |
| сорбиновая кислота | HC 6 H 7 O 2 | консервант; содержится в обработанных пищевых продуктах |
| стеариновая кислота | HC 18 H 35 O 2 | антислеживающий агент; найдено в леденцах |
| янтарная кислота | Н 2 С 4 Н 4 О 4 | ароматизатор; содержится в вине и пиве |
| винная кислота | Н 2 С 4 Н 4 О 6 | ароматизатор; содержится в винограде, бананах и тамариндах |
Таблица 3.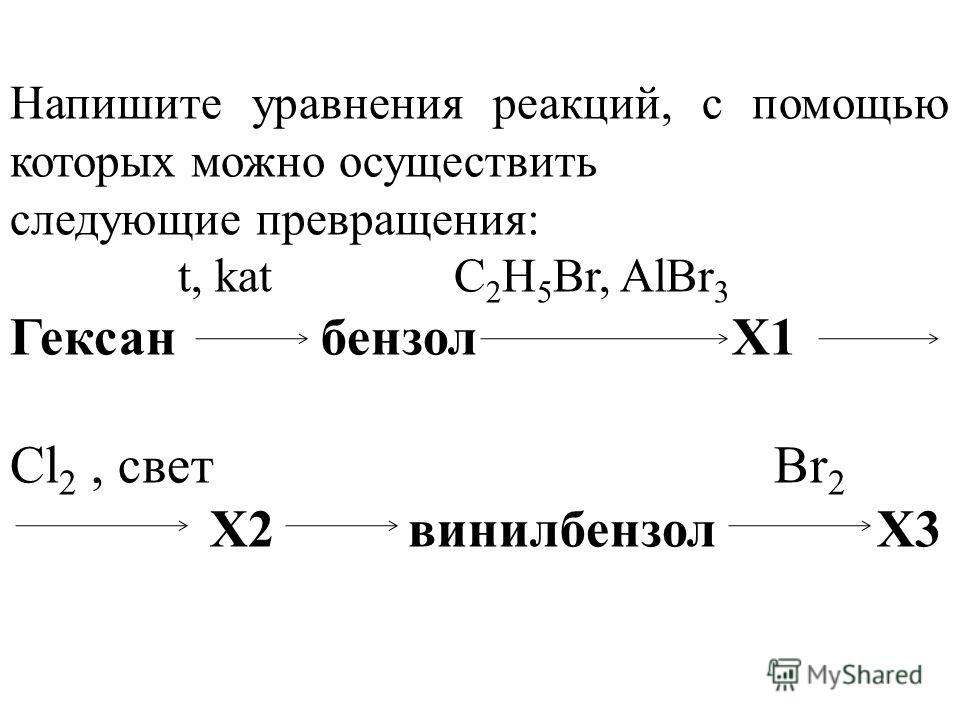 Различные кислоты, содержащиеся в продуктах питания и напитках
Различные кислоты, содержащиеся в продуктах питания и напитках
Ключевые понятия и резюме
Химические реакции классифицируются по схожим моделям поведения. Кислотно-основные реакции включают перенос ионов водорода между реагентами.
Общие кислотно-щелочные реакции, также называемые реакциями нейтрализации, можно резюмировать следующим уравнением реакции:
КИСЛОТА(водн.) + ОСНОВАНИЕ(водн.) [латекс]\longrightarrow[/латекс] H 2 O(л) + СОЛЬ(водн.) или (тв)
ДВИЖУЩЕЙ СИЛОЙ общей кислотно-щелочной реакции является образование воды.
Газообразующие кислотно-щелочные реакции можно резюмировать следующим уравнением реакции:
КИСЛОТА (водн.) + NaHCO 3 или Na 2 CO 3 (водн.) [латекс]\longrightarrow[/латекс] H 2 O(л) + CO 2 (г) + СОЛЬ (водн.) или (тв)
ДВИЖУЩЕЙ СИЛОЙ газообразующей кислотно-основной реакции является образование газа. Есть три способа
Существует три способа представления реакции нейтрализации с использованием молекулярного уравнения, полного ионного уравнения или результирующего ионного уравнения, как описано в разделе 6.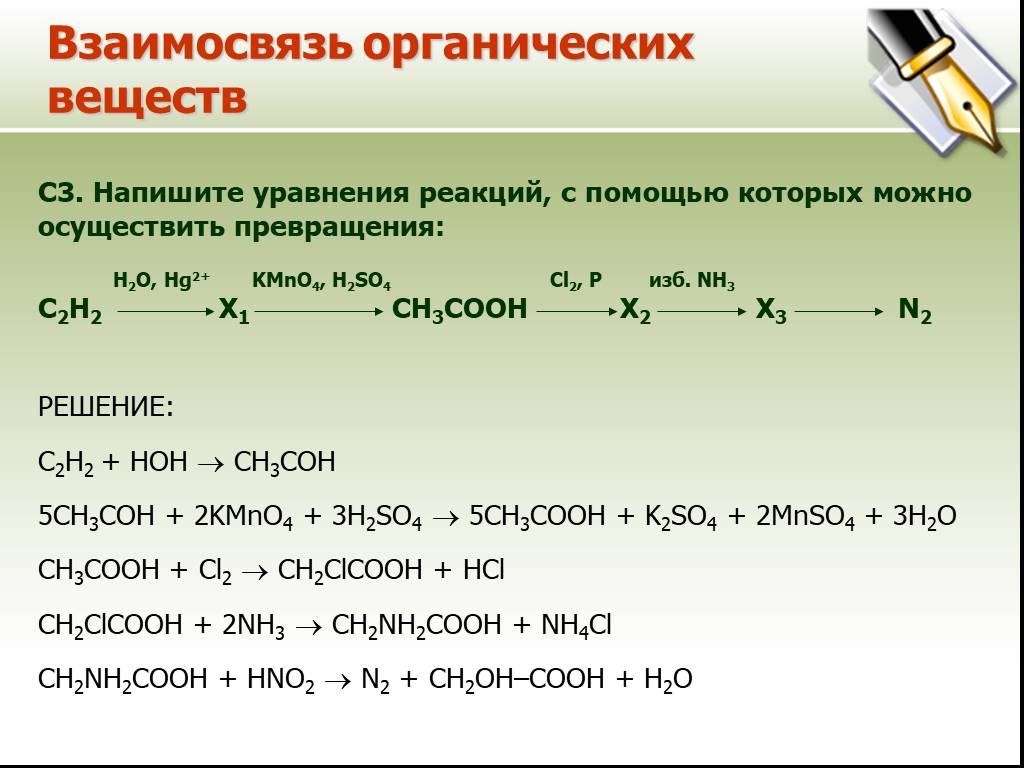 1.
1.
Глоссарий
кислота: вещество, которое производит H 3 O + при растворении в воде
кислотно-щелочная реакция: реакция, включающая перенос иона водорода между реагентами
основание: вещество, образующее OH − при растворении в воде
реакция нейтрализации: реакция между кислотой и основанием с образованием соли и воды
соль: ионное соединение, которое может быть образовано реакцией кислоты с основанием, содержащим катион и анион, кроме гидроксида или оксида
сильная кислота: кислота, которая полностью реагирует при растворении в воде с образованием ионов гидроксония
сильное основание: основание, которое полностью реагирует при растворении в воде с образованием гидроксид-ионов
слабая кислота: кислота, которая лишь в незначительной степени реагирует при растворении в воде с образованием ионов гидроксония
слабое основание: основание, которое лишь в незначительной степени реагирует при растворении в воде с образованием ионов гидроксида
Химическая реакция | Определение, уравнения, примеры и типы
сжигание
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье
Клод-Луи Бертолле
Вильгельм Оствальд
Анри-Луи Ле Шателье
Сэр Дерек Х.
 Р. Бартон
Р. Бартон
- Похожие темы:
- кислотно-основная реакция механизм реакции катализ окислительно-восстановительная реакция ионообменная реакция
См. весь связанный контент →
Последние новости
23 февраля 2023 г., 11:10 по восточноевропейскому времени (AP)
Сдвиг Израиля вправо обостряет его связи с евреями США
Множество еврейских лидеров США бьют тревогу о том, что они видят угрозу израильской демократии в новом правительстве
Основные вопросы
Каковы основы химических реакций?
- Химическая реакция – это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты. Вещества – это либо химические элементы, либо соединения.
- Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
 Свойства продуктов отличаются от свойств реагентов.
Свойства продуктов отличаются от свойств реагентов. - Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Подробнее ниже: Основные понятия о химических реакциях
химический элемент
Узнайте об этом типе вещества, которое не может быть разложено на более простые вещества обычными химическими процессами.химическое соединение
Узнайте об этом типе вещества, которое можно разложить на более простые вещества с помощью обычных химических процессов.Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современному взгляду на химические реакции, связи между атомами в реагентах должны быть разрушены, а атомы или фрагменты молекул снова собираются в продукты путем образования новых связей. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
химическая связь
Узнайте о различных типах химической связи.кислотно-основная реакция: реакции кислот Льюиса
Узнайте о кислотно-основных реакциях Льюиса.Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типу реагентов, по результату реакции и по механизму реакции. Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Подробнее читайте ниже: Классификация химических реакций
кислотно-щелочные реакции
Узнайте о кислотно-щелочных реакциях.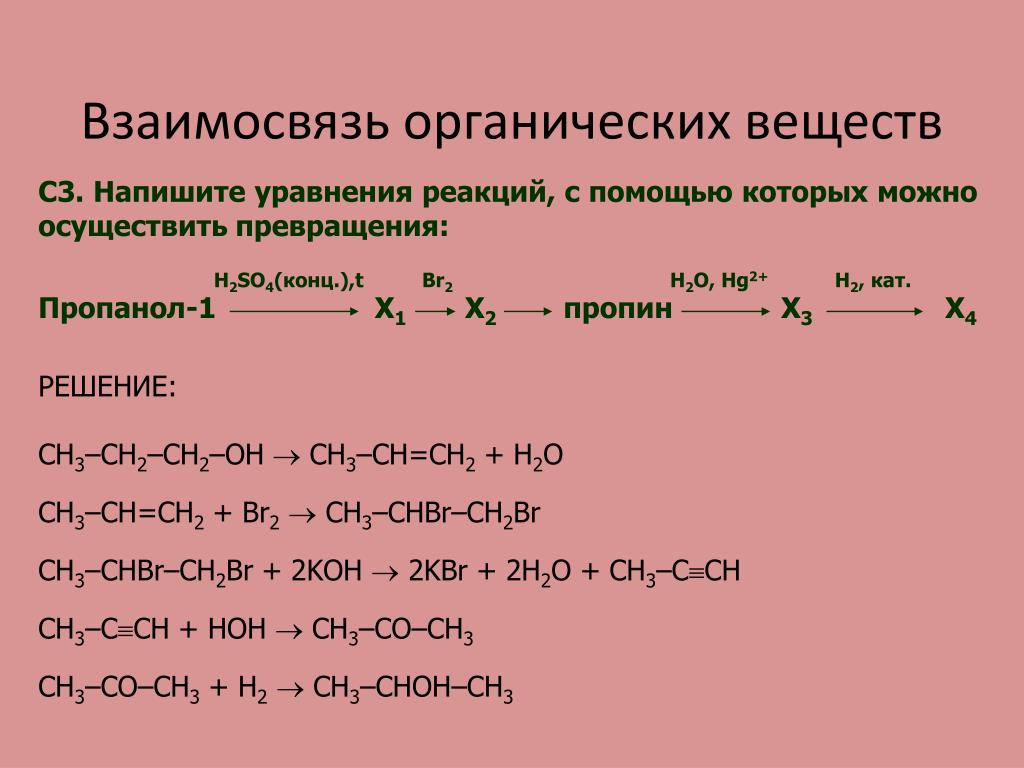
окислительно-восстановительная реакция
Узнайте об окислительно-восстановительных или окислительно-восстановительных реакциях.цепная реакция
Узнайте о цепных или самоподдерживающихся реакциях.Сводка
Прочтите краткий обзор этой темы
химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, плавка железа, изготовление стекла и гончарных изделий, пивоварение, производство вина и сыра — вот лишь некоторые примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции следует отличать от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. В любом физическом состоянии вода (H 2 O) — это одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако если вода в виде льда, жидкости или пара встречается с металлическим натрием (Na), атомы перераспределяются с образованием новых веществ: молекулярного водорода (H 2 ) и гидроксида натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Исторический обзор
Концепция химической реакции возникла примерно 250 лет назад. Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Викторина «Британника»
Все тонкости химии
Первые серьезные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в 18 веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Влияние французского химика Антуана-Лорана Лавуазье было особенно заметным, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Elementary Treatise on Chemistry ), Лавуазье определил 33 «элемента» — вещества, не разделенные на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, прибавляемый при окислении элементов, и приписал результат соединению элемента с кислородом. Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Другим событием исторического значения, касающимся химических реакций, было развитие атомной теории. Большая заслуга в этом принадлежит английскому химику Джону Дальтону, постулировавшему свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции связаны с перестройкой атомов с образованием новых веществ. Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, в том числе закона сохранения материи (материя не создается и не разрушается) и закона постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.

 Р. Бартон
Р. Бартон Свойства продуктов отличаются от свойств реагентов.
Свойства продуктов отличаются от свойств реагентов.
Leave A Comment