Строение белков
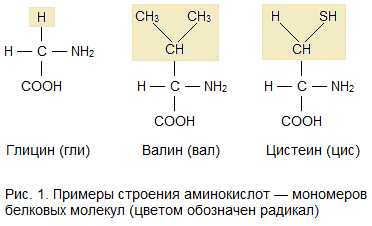
Среди органических веществ белки, или протеины, — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50 — 80% сухой массы клетки.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рис. 1)
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между —CO- и —NH- группами разных аминокислотных остатков полипептидной цепи. Водородные связи малопрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль — вторичная структура белка.
Третичная структура — трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула
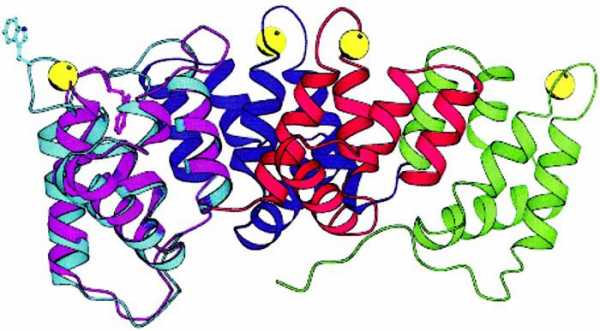
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение природной структуры белка называют денатурацией. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде полипептидной цепи.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки
Другие заметки по биологии
edu.glavsprav.ru
Строение и функции белков
Разделы:
Урок изучения нового материала в 10-м классе. Данный материал учащиеся уже изучали в 9 классе, поэтому некоторые понятия им уже известны. Соответственно с ребятами ведется диалог о строении и функциях белков. С помощью учителя учащиеся узнают о классификации ферментов.
Для того, чтобы активизировать деятельность учащихся на уроке, приводятся интересные факты о белках, которые помогают ребятам и нацеливают их на дальнейшее усвоение нового материала. Так же для этих целей предлагается провести лабораторную работу. На данном уроке основная масса изучаемого материала записывается в виде таблиц, схемы, которые учитель строит в ходе урока вместе и учениками. Качество изучаемого материала проверяется в виде фронтального опроса. Урок рассчитан как на детей-аудиалов, так и визуалов.
Цель урока: дать представление о строении и функции белков.
Задачи: продолжить расширение и углубление знаний важнейших органических веществах клетки на основе изучения строения и функции белков, сформировать знания функциях белков и их важнейшей роли в органическом мире, продолжить формирование умения выявлять связи между строением и функциями веществ.
Основные понятия: белки, протеины, протеиды, пептид, пептидная связь, простые и сложные белки, первичная, вторичная, третичная и четвертичная структуры белков денатурация.
Средства обучения: таблицы по общей биологии, иллюстрирующие строение молекул белков; лабораторное оборудование для проведения лабораторной работы “Расщепление пероксида водорода с помощью ферментов, содержащихся в плетках листа элодеи”.
Ход урока
I. Изучение нового материала.
1. Рассказ учителя (или фрагмент лекции) об особенностях строения молекул белков как биополимеров, состоящих из большого количества разных аминокислот, между которыми происходит полимеризация на основе пептидной связи. Зарисовка и запись на доске и в тетрадях учащихся.
2. Самостоятельное изучение учащимися текста учебника (С.42) о классификации белков.
3. Беседа об уровнях организации белковой молекулы и химической основы каждого из четырех уровней (структур) этой молекулы, о денатурации как утрате белковой молекулы своей природной структуры.
Структура белковой молекулы.
| Структура белка | Характеристика | Тип связи | |
| Первичная | Линейная структура – последовательность аминокислот в полипептидной цепи, которая определяет все другие структуры молекулы, а также свойства и функции белка. | Пептидная. | |
| Вторичная | Закручивание полипептидной цепи в спираль или складывание в “гармошку”. | ||
| Третичная | Глобулярный белок: упаковка вторичной
структуры в глобулу; фибриллярный белок: несколько вторичных структур, уложенных параллельными слоями, или скручивание нескольких вторичных структур наподобие каната в суперспираль. |
Ионные, водородные, дисульфидные, гидрофобные. | |
| Четвертичная | Встречается редко. Комплекс из нескольких третичных структур органической природы и неорганическое вещество, например, гемоглобин. | Ионные, водородные, гидрофобные. |
4. Рассказ учителя о многообразии функций белков с краткой записью в тетрадях сущности функций: структурной, ферментативной, транспортной, защитной, регуляторной, энергетической, сигнальной.
5. Лабораторная работа “Расщепление пероксида водорода с помощью ферментов, содержащихся в клетках листа элодеи”.
Ход работы:
а. Приготовьте микропрепарат листа элодеи и рассмотрите его под микроскопом.
в. Объясните, с чем связано выделение пузырьков из теток листа, что это за газ, на какие вещества может расщепиться пероксид водорода, какие ферменты участвуют в этом процессе?
г. Капните каплю пероксида на предметное стекло и, рассмотрев его под микроскопом, опишите наблюдаемую, картину. Сравните состояние пероксида водорода в листе элодеи и на стекле, сделайте выводы.
По завершении лабораторной работы следует провести беседу о биохимических реакциях, протекающих при участии белковых катализаторов-ферментов как основе жизнедеятельности клеток и организмов.
Химические свойства белков обусловлены их различным аминокислотным составом. Существуют белки хорошо растворимые в воде и совершенно нерастворимые, химически активные и устойчивые к действию различных агентов, способные укорачиваться и растягиваться и т. д.
Под влиянием различных факторов – высокой температуры, действия химических веществ, облучения, механического воздействия – может произойти разрушение структур белковой молекулы. Нарушение природной структуры белка называется денатурацией. Если воздействие перечисленных факторов было недолгим и несильным, то белок может вернуть свою природную структуру – обратимая денатурация (ренатурация), если же воздействие было долгим или сильным, то происходит нарушение не только третичной и вторичной структур, но и первичной – необратимая денатурация (рис. 3).
Функции белков.
| Функция | Характеристика |
| 1. Строительная (структурная). | Входят в состав клеточных мембран и органоидов клетки (липопротеиды и гликопротеиды), участвуют в образовании стенок кровеносных сосудов, хрящей, сухожилий (коллаген) и волос (кератин). |
| 2. Двигательная | Обеспечивается сократительными белками (актин и миозин), которые обуславливают движение ресничек и жгутиков, сокращение мышц, перемещение хромосом при делении клетки, движение органов растений. |
| 3. Транспортная. | Связывают и переносят с током крови многие химические соединения, например, гемоглобин и миоглобин транспортируют кислород, белки сыворотки крови переносят гормоны, липиды и жирные кислоты, различные биологически активные вещества. |
| 4. Защитная. | Выработка антител (иммуноглобулинов) в ответ на проникновение в нее чужеродных веществ (антигенов), которые обеспечивают иммунологическую защиту; участие в процессах свертывания крови (фибриноген и протромбин). |
| 5, Сигнальная (рецепторная). | Прием сигналов из внешней среды и передача команд в клетку за счет изменения третичной структуры встроенных в мембрану белков в ответ на действие факторов внешней среды. Например, гликопротеины (встроены в гликокал икс), опсин (составная часть светочувствительных пигментов родопсина и йодопсина), фитохром (светочувствительный белок растений). |
| 6. Регуляторная. | Белки-гормоны оказывают влияние на обмен веществ, т. е. обеспечивают гомеостаз, регулируют рост, размножение, развитие и другие жизненно важные процессы. Например, инсулин регулирует уровень глюкозы в крови, тироксин – физическое и психическое развитие и т.д. |
| 7. Каталитическая (ферментативная). | Белки-ферменты ускоряют биохимические процессы в клетке. |
| К. Запасающая | Резервные белки животных: альбумин (яйца) запасает воду, ферритин – железо в клетках печени, селезенки; миоглобин – кислород в мышечных волокнах, казеин (молоко) и белки семян – источник питания для зародыша. |
| 9. Пищевая (основной источник аминокислот). | Белки пищи – основной источник аминокислот (особенно незаменимых) для животных и человека; казеин (белок молока) – основной источник аминокислот для детенышей млекопитающих. |
| 10. Энергетическая. | Являются источником энергии – при окислении 1 г белка выделяется 17,6 кДж энергии, но организм использует белки в качестве источника энергии очень редко, например, при длительном голодании. |
Ферменты (энзимы) – это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при умеренной температуре, нормальном давлении и нейтральной среде. В таких условиях реакции синтеза или распада веществ протекали бы очень медленно, если бы не подвергались воздействию ферментов. Ферменты ускоряют реакцию без изменения ее общего результата за счет снижения энергии активации. Это означает, что в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулам, которые вступают в реакцию. Ферменты отличаются от химических катализаторов высокой степенью специфичности, т. е. фермент катализирует только одну реакцию или действует только на один тип связи. Скорость ферментативных реакций зависит от многих факторов – природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т.д.
Классификация ферментов.
| Группа | Катализируемые реакции, примеры |
| Оксидоредуктазы. | Окислительно-восстановительные реакции: перенос атомов водорода (Н) и кислорода (О) или электронов от одного вещества к другому, при этом окисляется первый и восстанавливается второй. Участвуют во всех процессах биологического окисления, например, вдыхании: АН + В А ВН (окисленный) или А + О АО (восстановленный). |
| Трансферазы. | Перенос группы атомов (метильной,
ацильной, фосфатной или аминогруппы) от одного вещества к другому.
Например, перенос остатков фосфорной кислоты от АТФ на глюкозу или
фруктозу под действием фототрансфераз: АТФ + глюкоза глюкозо-6-фосфат + АДФ. |
| Гидролазы. | Реакции расщепления сложных
органических соединений на более простые путем присоединения молекул
воды в месте разрыва химической связи (гидролиз). Например, амилаза (гидролизирует
крахмал), липаза (расщепляет жиры), трипсин (расщепляет белки) и др.: АВ + Н20 АОН + ВН. |
| Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, С-О, C-S. Например, декарбоксилаза отщепляет карбоксильную группу: |
| Изомеразы | Внутримолекулярные перестройки,
превращение одного изомера в другой (изомеризация): глюкозо-6-фосфат глюкозо-1-фосфат. |
| Лигазы (синтетазы) | Реакции соединения двух молекул с
образованием новых связей С–О, С–S, С–N, С–С, с использованием энергии
АТФ. Например, фермент валин-тРНК-синтетаза, под действием которого
образуется комплекс валин– тРНК: АТФ + валин + тРНК АДФ + Н3Р04 + валин-тРНК. |
Механизм действия фермента представлен на рис. 4. В молекуле каждого фермента имеется активный центр – это один или более участков, в которых происходит катализ за счет тесного контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа), или отдельная аминокислота. Активный центр может формироваться связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы – коферментами или кофакторами. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (комплементарности) друг другу.
Молекула фермента изменяет глобулярную форму молекулы субстрата. Молекула субстрата, присоединяясь к ферменту, тоже в определенных пределах изменяет свою конфигурацию для увеличения реакционности функциональных групп центра.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
II. Обобщающая беседа об основополагающей роли белков как самых необходимых химических соединений для жизней деятельности всего живого на Земле.
III. Закрепление знаний в процессе беседы с помощью следующих вопросов:
- Какие органические вещества клетки можно назвать самыми важными?
- Каким образом создается бесконечное разнообразие белков?
- Что собой представляют мономеры биополимера белка?
- Как формируется пептидная связь?
- Что собой представляет первичная структура белка?
- Каким образом происходит переход первичной структуры молекул белка во вторичную, а затем– в третичную и четвертичную?
- Какие функции могут выполнять белковые молекулы?
- Чем обусловлено многообразие функций белковых молекул?
- Приведите примеры белков, выполняющих самые разные функции. При ответе можно использовать следующую схему:
Биологические функции белков.
Это интересно.
Многие молекулы очень велики и по длине, и по молекулярной массе. Так, молекулярная масса инсулина – 5700, белка-фермента рибонуклеазы – 127 ООО, яичного альбумина – 36 ООО, гемоглобина – 65 ООО. В состав различных белков входят самые разные аминокислоты. Набор всех двадцати видов аминокислот содержит: казеин молока, миозин мышц и альбумин яйца. В белке-ферменте рибонуклеазе – 19, в инсулине – 18 аминокислот. Коллективу ученых под руководством академика Ю.А. Овчинникова удалось расшифровать сложную структуру белка родопсина, ответственного за процесс зрительного восприятия.
Кровь осьминогов, моллюсков и пауков имеет голубой цвет, потому что переносчиком кислорода у них служит не красный гемоглобин, содержащий атомы железа, а гемоцианин с атомами меди.
Почти половина необходимых нам белков, углеводов, 70–80% витаминов, значительное количество минеральных солей, аминокислот и других питательных элементов содержится в хлебе.
Американские ученые выделили из растения (семейство Пентадипландовых), произрастающего в Западной Африке, белок, который слаще сахара в 2 тыс. раз. Этот шестой известный науке сладкий белок, названный бразеином, содержится в плодах, которые с большой охотой поедают местные обезьяны. Биохимики расшифровали строение молекул сладкого белка, в каждой из них содержится 54 аминокислотных остатка.
IV. Домашнее задание: Изучить § 11, ответить на вопросы на с. 46. Приготовить сообщения или рефераты на темы: “Белки – биополимеры жизни”, “Функции белков – основа жизнедеятельности каждого организма на Земле”, “Денатурация и ренатурация, ее практическое значение”, “Многообразие ферментов, их роль в жизнедеятельности клеток и организмов” и др.
Используемые ресурсы:
- Каменский А.А.Общая биология 10–11: учеб.для общеобразоват. учреждений.– М.:Дрофа, 2006.
- Козлова Т.А. Тематическое и поурочное планирование по биологии к учебнику А.А.Каменского и др. “Общая биология 10–11”. – М.: Издательство “Экзамен”, 2006.
- Биология. Общая биология. 10–11 классы: рабочая тетрадь к учебнику Каменского А.А. и др. “Общая биология 10–11”– М.: Дрофа, 2011.
- Кириленко А.А. Молекулярная биология. Сборник заданий для подготовки к ЕГЭ: уровни А,В,С: учебно-методическое пособие. – Ростов н/Д: Легион, 2011.
6.08.2012
xn--i1abbnckbmcl9fb.xn--p1ai
Заполните таблицу. Особенности строения белковой молекулы Структура молекулы белка Особенности строения
Особенности строения белковой молекулы
Структура белкововой молекулы — сложная пространственная структура, обладающая первичным, вторичным, третичным и четвертичным уровнями организации. Особенности структурной организации белковой молекулы определяются первичным уровнем ее организации.
Первичная структура белковой молекулы — полипептидная цепь с линейной последовательностью амнокислот, связанных между собой за счет пептидной связи. Первичная структура белка наиболее прочная из всех. В отношений всех свойств, которыми будет обладать белковая молекула, эта структура является определящюей. Все остальные структурные уровни организации образуются в соответствии с особенностями строения первичного уровня по принципу самосборки. Внешние факторы не оказывают влияние на этот процесс.
Вторичная структура белковой молекулы — структура белковой молекулы, образующаяся за счёт скручивания линейной последовательности аминокислот первичной структуры с образованием спирали, многочисленные витки которой связаны между собой водородными связями.
Третичная структура белковой молекулы — структура белковой молекулы, образующаяся за счет наложения одних частей спирали белковой молекулы на другие, формирование между этими частями различного рода связей: водородных ковалентных ионных, дисульфидных (при наличии аминокислоты цистин), гидрофобных. Третичная структура имеет вид глобулы. При третичном уровне организации белковой молекулы возможность принимать участие в химических реакциях, проявлять химическую активность остается только у тех аминокислотных остатков, которые имеют поверхностное расположение.
Четвертичная структура белковой молекулы — структура белковой молекулы, представляющая собой сложную пространственную организацию нескольких полипептидных цепей, связанных между собой за счет различных химических связей. Эти связи аналогичны таковым в третичном уровне организации белковой молекулы. Полипептидные цепи, принимающие участие в образовании четвертичной структы белковой молекулы, могут быть одинаковыми или иметь различное строение.
shkolnikru.com
Строение белковой молекулы.
Для описания строения белковой молекулы были введены понятия о первичной, вторичной, третичной и четвертичной структурах белковой молекулы. В последние годы появились еще такие понятия, как сверхвторичная структура, характеризующая энергетически предпочтительные агрегаты вторичной структуры, и домены – части белковой глобулы, представляющие собой достаточно обособленные глобулярные области.
Количество и последовательность расположения аминокислот, и местоположение дисульфидных связей в полипептидной цепи определяют первичную структуру белка. Между первичной структурой белка и его функцией у данного организма существует самая тесная связь. Для того, чтобы белок выполнял свойственную ему функцию, необходима совершенно определенная последовательность аминокислот в полипептидной цепи этого белка. Даже небольшие изменения в первичной структуре могут значительно изменять свойства белка и соответственно его функции. Например, в эритроцитах здоровых людей содержится белок– гемоглобин с определенной последовательностью аминокислот. Небольшая часть людей имеет врожденную аномалию структуры гемоглобина: их эритроциты содержат гемоглобин, у которого в одном положении вместо глутаминовой кислоты (заряженной, полярной) содержится аминокислота валин (гидрофобная, неполярная). Такой гемоглобин существенно отличается по физико-химическим и биологическим свойствам от нормального. Появление гидрофобной аминокислоты, приводит к возникновению «липкого» гидрофобного контакта (эритроциты плохо передвигаются в кровеносных сосудах), к изменению формы эритроцита (из двояковогнутого в серповидный), а также к ухудшению переноса кислорода и т.д. Дети, родившееся с этой аномалией, в раннем детстве погибают от серповидноклеточной анемии.
Исчерпывающие доказательства в пользу утверждения, что биологическая активность определяется аминокислотной последовательностью, были получены, после искусственного синтеза фермента рибонуклеазы (Меррифилд). Синтезированный полипептид с той же аминокислотной последовательностью, что и естественный фермент, обладал такой же ферментативной активностью.
Исследования последних десятилетий показали, что первичная структура закреплена генетически и в свою очередь определяет вторичную, третичную и четвертичную структуры белковой молекулы и ее общую конформацию. Первым белком, у которого была установлена первичная структура, был белковый гормон инсулин (содержит 51 аминокислоту). Это было сделано в 1953 г. Фредериком Сэнгером. К настоящему времени расшифрована первичная структура более десяти тысяч белков, но это очень небольшое количество, если учесть, что в природе белков около 1012.
Зная первичную структуру белка, можно точно написать его структурную формулу, если белок представлен одной полипептидной цепью. Если в состав белка входит несколько полипептидных цепей, то их предварительно разъединяют, используя специальные реактивы. Для определения первичной структуры отдельной полипептидной цепи, методами гидролиза с использованием аминокислотных анализаторов, устанавливают ее аминокислотный состав. Затем, применяя специальные методы и реагенты, определяют природу концевых аминокислот. Для установления порядка чередования аминокислот, полипептидную цепь подвергают ферментативному гидролизу, при котором образуются осколки этой полипептидной цепи – короткие пептиды. Эти пептиды разделяют методом хроматографии и устанавливают последовательность аминокислот в каждом. Таким образом, достигается этап, когда последовательность аминокислот в отдельных пептидах (фрагментах белка) известна, но остается невыясненной последовательность самих пептидов. Последнюю устанавливают с помощью так называемых перекрывающихся пептидов. Для этого используются какой-либо другой фермент, расщепляющий исходную полипептидную цепь в других участках, и определяют аминокислотную последовательность вновь полученных пептидов. Пептиды, образованные под действием двух ферментов, содержат одинаковые фрагменты аминокислотных последовательностей., совмещая их устанавливают общую аминокислотную последовательность полипептидной цепи.
Большой вклад в изучение строения белковой молекулы сделали Л.Полинг и Р.Кори. Обратив внимание на то, что в молекуле белка больше всего пептидных связей, они первыми провели кропотливые рентгеноструктурные исследования этой связи. Изучили длины связей, углы под которыми располагаются атомы, направление расположения атомов относительно связи. На основании исследований были установлены следующие основные характеристики пептидной связи.
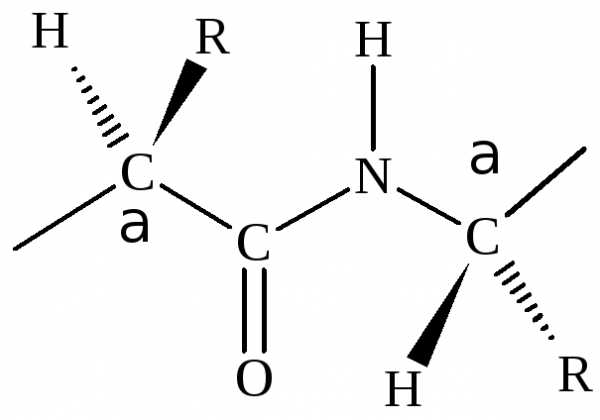
1. Четыре атома пептидной связи и два присоединенных -углеродных атома лежат в одной плоскости. ГруппыRи Н-углеродных атомов лежат вне этой плоскости.
2. Атомы О и Н пептидной связи и два -углеродных атома иR-группы имеют транс-ориентацию относительно пептидной связи.
3. Длина связи С-N, равная 1,32 Å, имеет промежуточное значение между длиной двойной ковалентной связи (1,21 Å) и однородной ковалентной связи (1,47 Å). Отсюда следует, что связь С-Nимеет частично характер двойной связи. Т.е. пептидная связь может существовать в виде резонансных и таутамерных структур, в кето-енольной форме.
Вращение вокруг связи –С=N– затруднено и все атомы, входящие в пептидную группу, имеют планарную транс-конфигурацию. Цис-конфигурация является энергетически менее выгодной и встречается лишь в некоторых циклических пептидах. Каждый планарный пептидный фрагмент содержит две связи с-углеродными атомами, способными к вращению. Это связи С–N(угол вращения вокруг этой связи обозначается) и связь С–С (угол вращения вокруг этой связи обозначается).
Пептидная связь по своей химической природе является ковалентной и придает высокую прочность первичной структуре белковой молекулы. Являясь повторяющимся элементом полипептидной цепи и имея специфические особенности структуры, пептидная связь влияет не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи.
Вторичная структура белковой молекулы образуется в результате того или иного вида свободного вращения вокруг связей, соединяющих -углеродные атомы в полипептидной цепи.
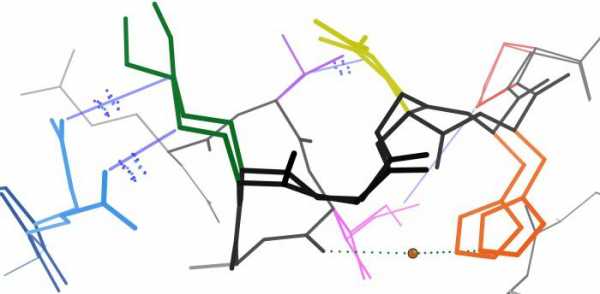
В природных полипептидных цепях обнаружены три основных типа структуры: -спираль, складчатый лист и статистический клубок. Спиральная структура образуется если в цепи одинаковые углы поворотов () для всех связей С–Nи углом поворота () для всех связей С–С и равны соответственно –48º и –57º. Наиболее часто встречается правозакрученная-спираль. Эта структура очень стабильна, т.к. в ней почти или полностью отсутствуют стерические затруднения, особенно дляR-групп боковых цепей аминокислот.R-группы аминокислот направлены наружу от центральной оси-спирали. В-спирали диполи =С=О иN–Н соседних пептидных связей ориентированы оптимальным образом (почти коаксиальны) для дипольного взаимодействия, образуя вследствие этого обширную систему внутримолекулярных кооперативных водородных связей, стабилизирующих-спираль. Шаг спирали (один полный виток) 5,4Å включает, 3,6 аминокислотных остатка.
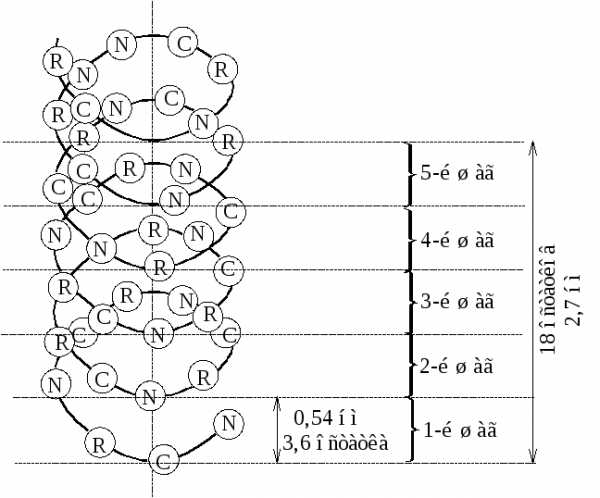
Рисунок 1 – Структура и параметры -спирали белка
Спиральную структуру могут нарушить два фактора:
1) в наличие остатка пролина, циклическая структура которого вносит излом в пептидную цепь – нет группы –NН2, поэтому невозможно образования внутрицепочечной водородной связи;
2) если в полипептидной цепи подряд расположено много остатков аминокислот, имеющих положительный заряд (лизин, аргинин) или отрицательный заряд (глутаминовой, аспарагиновой кислот), в этом случае сильное взаимное отталкивание одноименнозаряженных групп (–СОО–или –NН3+) значительно превосходит стабилизирующее влияние водородных связей в-спирали.
Структура типа складчатого листа также стабилизирована водородными связями между теми же диполями =NН……О=С. Однако в этом случае возникает совершенно иная структура, при которой остов полипептидной цепи вытянут таким образом, что имеет зигзагообразную структуру. Углы вращения для связей С-N()и С-С()близки соответственно к –120+1350. Складчатые участки полипептидной цепи проявляют кооперативные свойства, т.е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные
одинаковонаправленные полипептидные цепи или антипараллельные,
которые укрепляются благодаря водородным связям между этими цепями. Такие структуры называются -складчатые листы (рисунок 2).
Рисунок 2 – -структура полипептидных цепей
-Спиральные складчатые листы – это упорядоченные структуры, в них имеется регулярная укладка аминокислотных остатков в пространстве. Участки белковой цепи с нерегулярной укладкой аминокислотных остатков в пространстве, которые также удерживаются благодаря водородным связям – называются неупорядоченными, бесструктурными – статистическим клубком. Все эти структуры возникают самопроизвольно и автоматически вследствие того, что данный полипептид имеет определенную аминокислотную последовательность, которая предопределена генетически. -спирали и-структуры обуславливают определенную способность белков к выполнению специфических биологических функций. Так,-спиральная структура (-кератин) хорошо приспособлена к тому, чтобы образовывать наружные защитные структуры-перья, волосы, рога, копыта.-структура способствует образованию гибких и нерастяжимых нитей шелка и паутины, а конформация белка коллагена обеспечивает высокую прочность на разрыв, необходимую для сухожилий. Наличие только-спиралей или-структур характерно для нитевидных-фибрилярных белков. В составе глобулярных-шаровидных белков содержание-спиралей и-структур и бесструктурных участков сильно варьирует. Например: инсулин спирализован-на 60%, фермент рибонуклеаза – 57%, белок куриного яйца лизоцим – на 40%.
Сведения о чередовании аминокислотных остатков в полипептидной цепи, а также о наличии в белковой молекуле спирализованных, складчатых и неупорядоченных участков еще не дают полного представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу.
Эти особенности строения белка выясняются при изучении его третичной структуры, под которой понимают общее расположение в пространстве в определенном объеме полипептидной цепи.
Третичная структура устанавливается с помощью рентгеноструктурного анализа. Первая модель молекулы белка – миоглобина, отражающая его третичную структуру, была создана Дж. Кендрю с сотрудниками в 1957г. Несмотря на большие трудности к настоящему времени удалось установить третичную структуру более 1000 белков, в том числе гемоглобина, пепсина, лизоцима, инсулина и т.д.
Третичная структура белков образуется путем дополнительного складывания пептидной цепи содержащей -спираль,-структуры и участки без периодической структуры. Третичная структура белка формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот группируются внутри белковой молекулы, в то время как полярные радикалы ориентируются в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы – глобула. В такой форме белковая молекула характеризуется минимальной свободной энергией. На конформацию возникшей глобулы оказывают влияние такие факторы как рН раствора, ионная сила раствора, а также взаимодействие белковых молекул с другими веществами.
В последнее время появились доказательства, что процесс формирования третичной структуры не является автоматическим, а регулируется и контролируется специальными молекулярными механизмами. В этом процессе задействованы специфические белки – шапероны. Основными функциями их являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы.
Стабилизация третичной структуры обеспечивается благодаря нековалентным взаимодействиям между атомными группировками боковых радикалов следующих типов:
водородные связи могут возникать между функциональными группами боковых радикалов. Например, между ОН группой тирозина и –Nв кольце остатка гистидина.
электростатические силы притяжения между радикалами, несущими противоположно заряженные ионные группы (ион-ионные взаимодействия), например отрицательно заряженная карбоксильная группа (– СОО–) аспарагиновой кислоты и (NН3+) положительно заряженной-аминогруппой остатка лизина.
гидрофобные взаимодействия обусловлены силами Ван-дер-Ваальса между неполярными радикалами аминокислот. (Например, группами –СН3– аланина.
Стабилизируется третичная структура и ковалентной дисульфидной связью (–S–S–) между остатками цистеина. Эта связь очень прочная и присутствует не во всех белках. Важную роль эта связь играет в белковых веществах зерна и муки, т.к. оказывает влияние на качество клейковины, структурно-механические свойства теста и соответственно на качество готовой продукции – хлеба и т.д.
Белковая глобула не является абсолютно жесткой структурой: в известных приделах возможны обратимые перемещения частей пептидной цепи относительно друг друга с разрывом небольшого количества слабых связей и образования новых. Молекула как бы дышит, пульсирует в разных своих частях. Эти пульсации не нарушают основного плана конформации молекулы, подобно тому, как тепловые колебания атомов в кристалле не изменяют структуру кристалла, если температура не настолько велика, что наступает плавление.
Только после приобретения белковой молекулой естественной, нативной третичной структуры он проявляет свою специфическую функциональную активность: каталитическую, гормональную, антигенную и т.д. Именно при образовании третичной структуры происходит формирование активных центров ферментов, центров ответственных за встраивание белка в мультиферментный комплекс, центров, ответственных за самосборку надмолекуляных структур. Поэтому любые воздействия (термические, физические, механические, химические), приводящие к разрушению этой нативной конформации белка (разрыв связей), сопровождается частичной или полной потерей белком его биологических свойств.
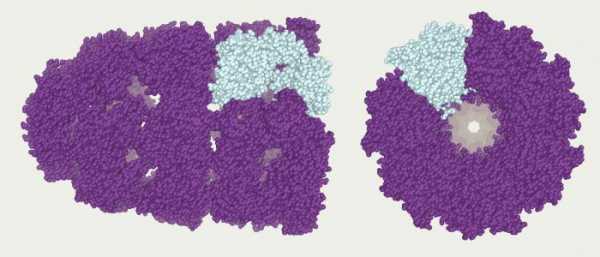
Изучение полных химических структур некоторых белков показало, что в их третичной структуре выявляются зоны, где сконцентрированы гидрофобные радикалы аминокислот, и полипептидная цепь фактически обматывается вокруг гидрофобного ядра. Более того, в ряде случаев в белковой молекуле обособляются два и даже три гидрофобных ядра, в результате возникает 2-х или 3-х ядерная структура. Такой тип строения молекулы характерен для многих белков, обладающих каталитической функцией (рибонуклеаза, лизоцим и т.д.). Обособленная часть или область молекулы белка обладающая в определенной степени структурной и функциональной автономией называется доменом. У ряда ферментов, например, обособленны субстрат-связывающие и кофермент связывающие домены.
Третичная структура белка имеет прямое отношение к его форме, которая может быть различной: от шарообразной до нитевидной. Форма белковой молекулы характеризуется таким показателем, как степень асимметрии (отношение длинной оси к короткой). У фибриллярных или нитевидных белков степень асимметрии больше 80. При степени асимметрии меньше 80 белки относятся к глобулярным. Большинство из них имеет степень асимметрии 3-5, т.е. третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи, приближающейся по форме к шару.
В биологическом отношении фибриллярные белки играют очень важную роль, связанную с анатомией и физиологией животных. У позвоночных на долю этих белков приходится 1/3 от их общего содержания. Примером фибрилярных белков может служить белок шелка – фиброин, который состоит из нескольких антипараллельных цепей со структурой складчатого листа. Белок -кератин содержит от 3-7 цепей. Коллаген имеет сложную структуру, в которой 3 одинаковые левовращающие цепи скручены вместе с образованием правовращающей тройной спирали. Эта тройная спираль стабилизирована многочисленными межмолекулярными водородными связями. Наличие таких аминокислот, как гидроксипролина и гидроксилизина также вносит вклад в образование водородных связей, стабилизирующих структуру тройной спирали. Все фибриллярные белки плохо растворимы или совсем нерастворимы в воде, так как в их составе содержится много аминокислот, содержащих гидрофобные, нерастворимые в водеR-группы изолейцин, фенилаланин, валин, аланин, метионин. После специальной обработки нерастворимый и неперевариваемый коллаген превращается в желатин-растворимую смесь полипептидов, который затем используют в пищевой промышленности.
Глобулярные белки выполняют разнообразные биологические функции. Они выполняют транспортную функцию, т.е. переносят питательные вещества, неорганические ионы, липиды и т.д. К этому же классу белков принадлежат гормоны, а также компоненты мембран и рибосом. Все ферменты тоже глобулярные белки.
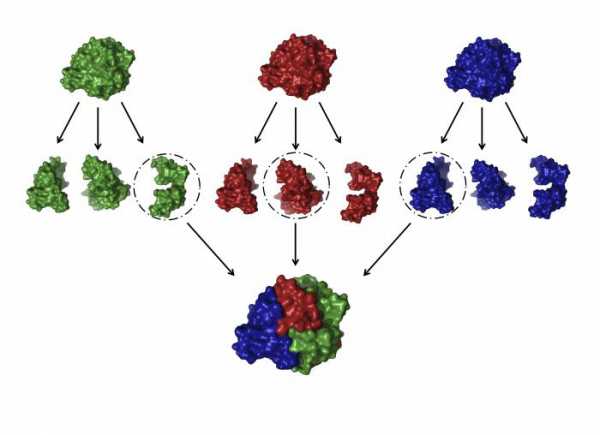
Белки содержащие две или большее число полипептидных цепей называют олигомерными белками для них характерно наличие четвертичной структуры. Полипептидные цепи (промеры) в таких белках могут быть либо одинаковыми либо разными. Олигомерные белки называют гомогенными, если их протомеры одинаковы и гетерогенными, если их протомеры различны. Например-белок гемоглобин состоит из 4-х цепей: двух -и двух -протомеров. Фермент-амилаза состоит из 2-х одинаковых полипептидных цепей. В олигомерных белках каждая из полипептидных цепей характеризуется своей вторичной и третичной структурой, и называется субъединицей или протомером. Протомеры взаимодействуют друг с другом не любой частью своей поверхности, а определенным участком (контактной поверхностью). Контактные поверхности имеют такое расположение атомных группировок, между которыми возникают водородные, ионные, гидрофобные связи. Кроме того, геометрия протомеров также способствует их соединению. Протомеры подходят друг к другу, как ключ к замку. Такие поверхности называются комплиментарными. Каждый протомер взаимодействует с другим во множестве точек, это приводит к тому, что соединение с другими полипептидными цепями или белками невозможно. Такие комплиментарные взаимодействия молекул лежат в основе всех биохимических процессов в организме. Под четвертичной структурой понимают расположение полипептидных цепей (протомеров) относительно друг друга, т.е. способ их совместной укладки и упаковки с образованием нативной конформации олигомерного белка, в результате чего белок обладает той или иной биологической активностью.
studfiles.net
5.Белки, их строение и функции.
Белки и их строение.
Среди органических компонентов клетки самыми важными являются белки. Они очень разнообразны и по строению, и по функциям. Содержание белков в различных клетках может колебаться от 50 до 80%. Белки представляют собой высокомолекулярные (молекулярная масса до 1,5 млн углеродных единиц) органические соединения. Кроме С, О, Н, N, в состав белков могут входить S, Р, Fe. Белки построены из мономеров, которыми являются аминокислоты. Поскольку в состав молекул белков может входить большое число аминокислот, то их молекулярная масса бывает очень большой.
В клетках разных живых организмов встречается свыше 170 различных аминокислот, но бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Из них может быть образовано 2 432 902 008 176 640 000 комбинаций, т. е. различных белков, которые будут обладать совершенно одинаковым составом, но различным строением. Но и это огромное число не предел — белок может состоять и из большего числа аминокислотных остатков, и, кроме того, каждая аминокислота может встречаться в белке несколько раз.
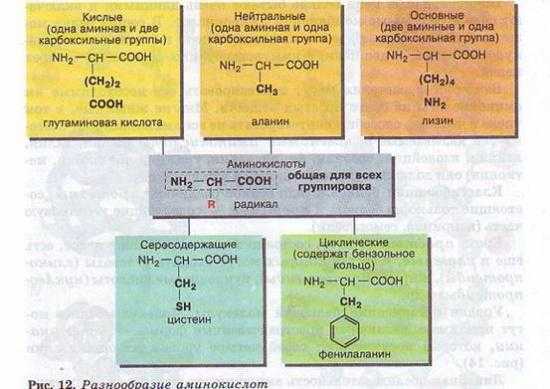
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—Nh3) с основными свойствами, другая — карбоксильной группой (—СООН) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение (рис. 12).
Наличие в одной молекуле аминокислоты и основной, и кислотной групп обусловливает их амфотерность и высокую реактивность. Через эти группы происходят соединения аминокислот при образовании белка. В ходе реакции полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной — образуется пептид (греч. peptos — сваренный). К свободным карбоксильной и аминогруппе могут присоединяться другие аминокислоты, удлиняя «цепь», называющуюся полипептидной. На одном конце такой цепи всегда будет группа МН2 (этот конец называется N-концом), а на другом конце — группа СООН (этот конец получил название С-конца) (рис. 13).
Полипептидные цепи белков бывают очень длинными и включают самые различные комбинации аминокислот. В состав белка может входить не одна, а две полипептидные цепи и более. Так, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырех цепей.
Бактерии и растения могут синтезировать все необходимые им аминокислоты из более простых веществ. Многие животные, в том числе и человек, способны синтезировать не все аминокислоты, поэтому так называемые незаменимые аминокислоты (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин) они должны получать с пищей в готовом виде.
Классификация белков.
Среди белков различают протеины, состоящие только из белков, и протеиды — содержащие небелковую часть (например, гемоглобин).
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные, в состав которых могут входить углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды) и др.
Уровни организации белковой молекулы.
Молекулы белков могут принимать различные пространственные формы — конформации, которые представляют собой четыре уровня их организации (рис. 14).
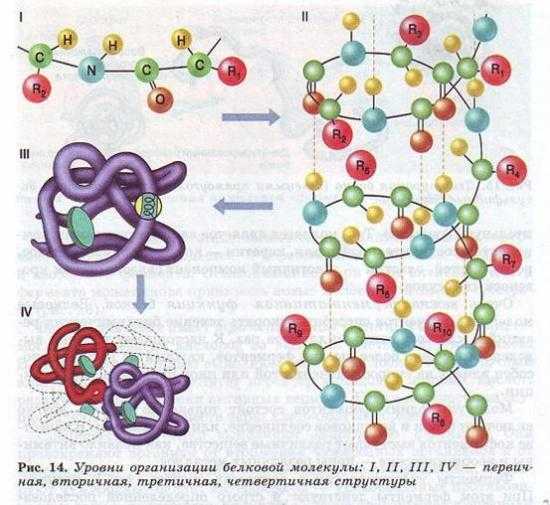
Линейная последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Вторичная структура белков возникает в результате образования водородных связей между группами —СООН и —Nh3 -разных аминокислотных остатков полипептидной цепи. Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру.
Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию, имеющую вид клубка (глобулу). Прочность третичной структуры обеспечивается ионными, водородными и дисульфидными ( — S-S-) связями между остатками цистеина, а также гидрофобным взаимодействием.
Четвертичная структура характерна не для всех белков.
Она возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех таких субъединиц.
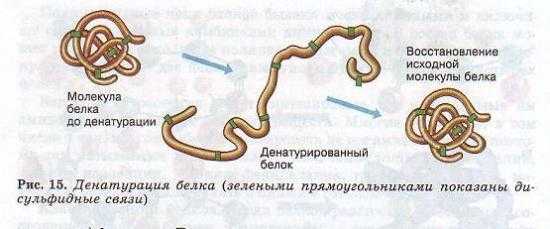
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникать под воздействием температуры, химических веществ, обезвоживания, облучения и других факторов. Если при денатурации не нарушена первичная структура, то при восстановлении нормальных условий белок способен воссоздавать свою структуру (рис. 15). Отсюда следует, что все особенности строения макромолекулы белка определяются его первичной структурой.
Функции белков.
Белки выполняют целый ряд функций как в каждой клетке, так и в целом организме. Функции белков многообразны.
Белки являются основой всех биологических мембран, всех органоидов клетки, таким образом они выполняют структурную (строительную ) функцию.- (Рис. 15.) . Так, коллаген является важным составным компонентом соединительной ткани, кератин — компонент перьев, волос, рогов, ногтей, эластин — эластичный компонент связок, стенок кровеносных сосудов.
Очень важна ферментативная функция белков.
Белковые молекулы ферментов способны ускорять течение биохимических реакций в клетке в сотни миллионов раз. К настоящему времени выделено и изучено более тысячи ферментов, каждый из которых способен влиять на скорость течения той или иной биохимической реакции.
Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент, В качестве коферментов выступают различные вещества, как правило витамины и неорганические — ионы различных металлов.
Ферменты участвуют как в процессах синтеза, так и распада. При этом ферменты действуют в строго определенной последовательности, они специфичны для каждого вещества и ускоряют только определенные реакции. Встречаются ферменты, которые катализируют несколько реакций. Избирательность действия ферментов на разные химические вещества связана с их строением. Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром.
Субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре, Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные молекулы в силу их пространственного соответствия, они подходят друг к другу, «как ключ к замку».
На заключительном этапе химической реакции комплекс «фермент—субстрат» распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества-субстрата (рис. 16).
Важное значение имеет транспортная функция белков.
Так, гемоглобин переносит кислород из легких к клеткам других тканей. В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ. Белки-переносчики осуществляют перенос веществ через клеточные мембраны. Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения. Так, антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки; интерфероны — универсальные противовирусные белки; фибриноген, тромбин и другие предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Роль белка в жизни клетки огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счете набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Белки. Протеины. Протеиды. Пептид. Пептидная связь. Простые и сложные белки. Первичная, вторичная, третичная и четвертичная структуры белков. Денатурация. 1. Какие вещества называются белками? 2. Что такое первичная структура белка? 3. Как образуются вторичная, третичная и четвертичная структуры белка? 4. Что такое денатурация белка? 5. По какому признаку белки делятся на простые и сложные? 6. Какие функции белков вам известны? 7. Какую роль выполняют белки-гормоны? 8. Какую функцию выполняют белки-ферменты? 9. Почему белки редко используются в качестве источника энергии?
Белок яйца является типичным протеином. Выясните, что с ним произойдет, если на него подействовать водой, спиртом, ацетоном, кислотой, щелочью, растительным маслом, высокой температурой и т. д.
1. Измельчите клубень сырого картофеля до состояния кашицы. Возьмите три пробирки и в каждую положите небольшое количество измельченного картофеля.
Первую пробирку поместите в морозилку холодильника, вторую — на нижнюю полку холодильника, а третью — в банку с теплой водой (t = 40 °С). Через 30 мин достаньте пробирки и в каждую капните небольшое количество пероксида водорода. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты.
Возьмите три пробирки и в каждую из них положите небольшое количество измельченного сырого картофеля. В первую пробирку с картофелем капните несколько капель воды, во вторую — несколько капель кислоты (столовый уксус), а в третью — щелочи. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты. Сделайте выводы. Ферменты значительно превосходят другие катализаторы по специфичности, каталитической активности и способны действовать в мягких условиях (невысокие температуры, нормальное давление и т.д.). Они способны в течение миллисекунд обеспечить протекание сложных многостадийных реакций, для проведения которых химику в современной лаборатории потребовались бы дни, недели или даже месяцы. Например, одна молекула фермента каталазы расщепляет в 1 мин более 5 млн молекул пероксида водорода (Н2О2), который образуется в организме при окислении различных соединений. Так как молекулы белков, построенные из аминокислот, необычайно велики и сложны, то для их изображения используют специальную общепринятую символику. Каждая аминокислота обозначается тремя латинскими буквами. Многие живые организмы способны вырабатывать одни аминокислоты из других и поэтому им не очень важно, какие аминокислоты содержатся в белках пищи. Но некоторые животные, в том числе человек, должны получать подавляющее число аминокислот с пищей, так как ряд аминокислот, называемых незаменимыми, в их организме не вырабатывается, но они необходимы для жизнедеятельности.
studfiles.net
строение и функции. Свойства белков
Как известно, белки — основа зарождения жизни на нашей планете. По теории Опарина-Холдейна именно коацерватная капля, состоящая из молекул пептидов, стала основой зарождения живого. Это и не вызывает сомнений, ведь анализ внутреннего состава любого представителя биомассы показывает, что эти вещества есть во всем: растениях, животных, микроорганизмах, грибах, вирусах. Причем они очень разнообразны и макромолекулярны по природе.
Названий у этих структур четыре, все они являются синонимами:
- белки;
- протеины;
- полипептиды;
- пептиды.
Белковые молекулы
Их количество поистине неисчислимо. При этом все белковые молекулы можно разделить на две большие группы:
- простые — состоят только из аминокислотных последовательностей, соединенных пептидными связями;
- сложные — строение и структура белка характеризуются дополнительными протолитическими (простетическими) группами, называемыми еще кофакторами.
При этом сложные молекулы также имеют свою классификацию.
Градация сложных пептидов
- Гликопротеиды — тесно связанные соединения белка и углевода. В структуру молекулы вплетаются простетические группы мукополисахаридов.
- Липопротеиды — комплексное соединение из белка и липида.
- Металлопротеиды — в качестве простетической группы выступают ионы металлов (железо, марганец, медь и другие).
- Нуклеопротеиды — связь белка и нуклеиновых кислот (ДНК, РНК).
- Фосфопротеиды — конформация протеина и остатка ортофосфорной кислоты.
- Хромопротеиды — очень схожи с металлопротеидами, однако элемент, входящий в состав простетической группы, представляет собой целый окрашенный комплекс (красный — гемоглобин, зеленый — хлорофилл и так далее).
У каждой рассмотренной группы строение и свойства белков различны. Функции, которые они выполняют, также варьируются в зависимости от типа молекулы.
Химическое строение белков
С данной точки зрения протеины — это длинная, массивная цепь аминокислотных остатков, соединяющихся между собой специфическими связями, называемыми пептидными. От боковых структур кислот отходят ответвления — радикалы. Такое строение молекулы было открыто Э. Фишером в начале XXI века.
Позже более подробно были изучены белки, строение и функции белков. Стало ясно, что аминокислот, образующих структуру пептида, всего 20, но они способны комбинироваться самым разным способом. Отсюда и разнообразие полипептидных структур. Кроме того, в процессе жизнедеятельности и выполнения своих функций белки способны претерпевать ряд химических превращений. В результате они меняют структуру, и появляется уже совсем новый тип соединения.
Чтобы разорвать пептидную связь, то есть нарушить белок, строение цепей, нужно подобрать очень жесткие условия (действие высоких температур, кислот или щелочей, катализатора). Это объясняется высокой прочностью ковалентных связей в молекуле, а именно в пептидной группе.
Обнаружение белковой структуры в условиях лаборатории проводится при помощи биуретовой реакции — воздействия на полипептид свежеосажденным гидроксидом меди (II). Комплекс пептидной группы и иона меди дает ярко-фиолетовую окраску.
Существует четыре основные структурные организации, каждая из которых имеет свои особенности строения белков.
Уровни организации: первичная структура
Как уже упоминалось выше, пептид — это последовательность аминокислотных остатков с включениями, коферментами или же без них. Так вот первичной называют такую структуру молекулы, которая является природной, естественной, представляет собой истинно аминокислоты, соединенные пептидными связями, и больше ничего. То есть полипептид линейного строения. При этом особенности строения белков такого плана — в том, что такое сочетание кислот является определяющим для выполнения функций белковой молекулы. Благодаря наличию данных особенностей возможно не только идентифицировать пептид, но и предсказать свойства и роль совершенно нового, еще не открытого. Примеры пептидов, обладающих природным первичным строением, — инсулин, пепсин, химотрипсин и другие.
Вторичная конформация
Строение и свойства белков этой категории несколько меняются. Такая структура может сформироваться изначально от природы либо при воздействии на первичную жестким гидролизом, температурой или иными условиями.
Данная конформация имеет три разновидности:
- Ровные, правильные, стереорегулярные витки, построенные из остатков аминокислот, которые закручиваются вокруг основной оси соединения. Удерживаются вместе только водородными связями, возникающими между кислородом одной пептидной группировки и водородом другой. Причем строение считается правильным из-за того, что витки равномерно повторяются через каждые 4 звена. Такая структура может быть как левозакрученной, так и правозакрученной. Но в большинстве известных белков преобладает правовращающий изомер. Такие конформации принято называть альфа-структурами.
- Состав и строение белков следующего типа отличается от предыдущего тем, что водородные связи образуются не между рядом стоящими по одной стороне молекулы остатками, а между значительно удаленными, причем на достаточно большое расстояние. По этой причине вся структура принимает вид нескольких волнообразных, извитых змейкой полипептидных цепочек. Есть одна особенность, которую должен проявлять белок. Строение аминокислот на ответвлениях должно быть максимально коротким, как у глицина или аланина, например. Этот тип вторичной конформации носит название бета-листов за способность будто слипаться при образовании общей структуры.
- Относящееся к третьему типу строение белка биология обозначает как сложные, разноразбросанные, неупорядоченные фрагменты, не обладающие стереорегулярностью и способные изменять структуру под воздействием внешних условий.
Примеров белков, имеющих вторичную структуру от природы, не выявлено.
Третичное образование
Это достаточно сложная конформация, имеющая название «глобула». Что собой представляет такой белок? Строение его основывается на вторичной структуре, однако добавляются новые типы взаимодействий между атомами группировок, и вся молекула словно сворачивается, ориентируясь, таким образом, на то, чтобы гидрофильные группировки были направлены внутрь глобулы, а гидрофобные — наружу.
Этим объясняется заряд белковой молекулы в коллоидных растворах воды. Какие же типы взаимодействий здесь присутствуют?
- Водородные связи — остаются без изменений между теми же самыми частями, что и во вторичной структуре.
- Гидрофобные (гидрофильные) взаимодействия — возникают при растворении полипептида в воде.
- Ионные притяжения — образуются между разнозаряженными группами аминокислотных остатков (радикалов).
- Ковалентные взаимодействия — способны формироваться между конкретными кислотными участками — молекулами цистеина, вернее, их хвостами.
Таким образом, состав и строение белков, обладающих третичной структурой, можно описать как свернутые в глобулы полипептидные цепи, удерживающие и стабилизирующие свою конформацию за счет разных типов химических взаимодействий. Примеры таких пептидов: фосфоглицераткеназа, тРНК, альфа-кератин, фиброин шелка и другие.
Четвертичная структура
Это одна из самых сложных глобул, которую образуют белки. Строение и функции белков подобного плана очень многогранны и специфичны.
Что собой представляет такая конформация? Это несколько (в некоторых случаях десятки) крупных и мелких полипептидных цепей, которые формируются независимо друг от друга. Но затем за счет тех же взаимодействий, что мы рассматривали для третичной структуры, все эти пептиды скручиваются и переплетаются между собой. Таким образом получаются сложные конформационные глобулы, которые могут содержать и атомы металлов, и липидные группировки, и углеводные. Примеры таких белков: ДНК-полимераза, белковая оболочка табачного вируса, гемоглобин и другие.
Все рассмотренные нами структуры пептидов имеют свои методы идентификации в лабораторных условиях, основанные на современных возможностях использования хроматографии, центрифугирования, электронной и оптической микроскопии и высоких компьютерных технологиях.
Выполняемые функции
Строение и функции белков тесно коррелируют друг с другом. То есть каждый пептид играет определенную роль, уникальную и специфическую. Встречаются и такие, которые способны выполнять в одной живой клетке сразу несколько значительных операций. Однако можно в обобщенном виде выразить основные функции белковых молекул в организмах живых существ:
- Обеспечение движения. Одноклеточные организмы, либо органеллы, или некоторые виды клеток способны к передвижениям, сокращениям, перемещениям. Это обеспечивается белками, входящими в состав структуры их двигательного аппарата: ресничек, жгутиков, цитоплазматической мембраны. Если же говорить о неспособных к перемещениям клетках, то белки могут способствовать их сокращению (миозин мышц).
- Питательная или резервная функция. Представляет собой накопление белковых молекул в яйцеклетках, зародышах и семенах растений для дальнейшего восполнения недостающих питательных веществ. При расщеплении пептиды дают аминокислоты и биологически активные вещества, которые необходимы для нормального развития живых организмов.
- Энергетическая функция. Помимо углеводов, силы организму могут давать и белки. При распаде 1 г пептида высвобождается 17,6 кДж полезной энергии в форме аденозинтрифосфорной кислоты (АТФ), которая расходуется на процессы жизнедеятельности.
- Сигнальная и регуляторная функция. Заключается в осуществлении тщательного контроля за происходящими процессами и передачи сигналов от клеток к тканям, от них к органам, от последних к системам и так далее. Типичным примером может служить инсулин, который строго фиксирует количество глюкозы в крови.
- Рецепторная функция. Осуществляется путем изменения конформации пептида с одной стороны мембраны и вовлечения в реструктуризацию другого конца. При этом и происходит передача сигнала и необходимой информации. Чаще всего такие белки встраиваются в цитоплазматические мембраны клеток и осуществляют строгий контроль над всеми веществами, проходящими через нее. Также оповещают о химических и физических изменениях окружающей среды.
- Транспортная функция пептидов. Ее осуществляют белки-каналы и белки-переносчики. Роль их очевидна — транспортировка необходимых молекул к местам с низкой концентрацией из частей с высокой. Типичным примером служит перенос кислорода и диоксида углерода по органам и тканям белком гемоглобином. Ими же осуществляется доставка соединений с невысокой молекулярной массой через мембрану клетки внутрь.
- Структурная функция. Одна из важнейших из тех, которые выполняет белок. Строение всех клеток, их органелл обеспечивается именно пептидами. Они подобно каркасу задают форму и структуру. Кроме того, они же ее поддерживают и видоизменяют в случае необходимости. Поэтому для роста и развития всем живым организмам необходимы белки в рационе питания. К таким пептидам можно отнести эластин, тубулин, коллаген, актин, кератин и другие.
- Каталитическая функция. Ее выполняют ферменты. Многочисленные и разнообразные, они ускоряют все химические и биохимические реакции в организме. Без их участия обычное яблоко в желудке смогло бы перевариться только за два дня, с большой вероятностью загнив при этом. Под действием каталазы, пероксидазы и других ферментов этот процесс происходит за два часа. В целом именно благодаря такой роли белков осуществляется анаболизм и катаболизм, то есть пластический и энергетический обмен.
Защитная роль
Существует несколько типов угроз, от которых белки призваны оберегать организм.
Во-первых, химическая атака травмирующих реагентов, газов, молекул, веществ различного спектра действия. Пептиды способны вступать с ними в химическое взаимодействие, переводя в безобидную форму или же просто нейтрализуя.
Во-вторых, физическая угроза со стороны ран — если белок фибриноген вовремя не трансформируется в фибрин на месте травмы, то кровь не свернется, а значит, закупорка не произойдет. Затем, наоборот, понадобится пептид плазмин, способный сгусток рассосать и восстановить проходимость сосуда.
В-третьих, угроза иммунитету. Строение и значение белков, формирующих иммунную защиту, крайне важны. Антитела, иммуноглобулины, интерфероны — все это важные и значимые элементы лимфатической и иммунной системы человека. Любая чужеродная частица, вредоносная молекула, отмершая часть клетки или целая структура подвергается немедленному исследованию со стороны пептидного соединения. Именно поэтому человек может самостоятельно, без помощи лекарственных средств, ежедневно защищать себя от инфекций и несложных вирусов.
Физические свойства
Строение белка клетки весьма специфично и зависит от выполняемой функции. А вот физические свойства всех пептидов схожи и сводятся к следующим характеристикам.
- Вес молекулы — до 1000000 Дальтон.
- В водном растворе формируют коллоидные системы. Там структура приобретает заряд, способный варьироваться в зависимости от кислотности среды.
- При воздействии жестких условий (облучение, кислота или щелочь, температура и так далее) способны переходить на другие уровни конформаций, то есть денатурировать. Данный процесс в 90% случаев необратим. Однако существует и обратный сдвиг — ренатурация.
Это основные свойства физической характеристики пептидов.
fb.ru
Строение белковой молекулы — Мегаобучалка
Полипептидное строение белков. Первые белковые вещества выделили более 250 лет назад, а во второй половине 18 — начале 19 вв. уже неоднократно описывали белковые вещества растений и животных.
В настоящее время хорошо известен химический элементарный состав белков. Они обычно содержат 50—55% С, 21—23% 02, 15—17% N2, около 7% Н2, от 0 до 3% S. В сложные белки, кроме того, могут входить Р и некоторые металлы.
По современным данным, наиболее часто в составе различных белков обнаруживают 20 видов аминокислот. Именно для 20 аминокислот существует генетический код в виде триплетов (тройки нуклеотидов в ДНК). Иногда в белках присутствуют и другие аминокислоты, они образуются в результате модификации белков уже после их биосинтеза, являются некодируемыми (цистин, гидроксипролин, гидроксилизин и некоторые другие). В составе белков обнаружены только α-аминокислоты, в подавляющем большинстве в L-конфигурации.
Аминокислоты соединяются друг с другом ковалентной пептидной или амидной связью. Образование ее происходит за счет аминогруппы (NH2) одной аминокислоты и карбоксильной группы (—СООН) другой с выделением молекулы воды.
О R2 O R2
II I II I
H2N—СН—С—ОН + Н—N—СН—СООН →H2N—СН—С—N—CH—СООН + Н20
I I I I
R1 H R1 H
Транспептиднаясвязь
В природе распространена транспептидная связь, реже встречается менее устойчивая цис-пептидная связь. Пептидная связь является частично двойной, частично одинарной, между этими структурами есть взаимный переход. Время жизни одинарной связи несколько больше, чем двойной (6:4), пептидная связь на 60% одинарна и на 40% двойная.
В результате явления резонанса образуется флуктуирующая, динамическая связь, которую невозможно описать на основе одной валентной структуры. Так как вращение вокруг двойной связи заторможено, все атомы пептидной связи оказываются расположенными примерно в одной плоскости, т. е. она планарна, только вокруг атома азота связи отчасти сохраняют пирамидальный характер. В настоящее время установлены все валентные углы и длины связей в пептидных группировках (рис. 3).
Рис. 3. Межатомные растояния (нм) и углы в пептидной связи. Все атомы внутри рамки находятся примерно в одной плоскости.
Образованные аминокислотами полимеры называют пептидами или белками в зависимости от числа входящих в них структурных единиц. Условно принято, что пептиды, содержащие до 20 аминокислотных остатков, относятся к олигопептидам, среди них различают ди-, три-, тетрапептиды и т. д. Полипептиды имеют в молекуле от 20 до 50 аминокислотных остатков. Пептидные цепи, объединяющие более 50 аминокислот и имеющие молекулярную массу свыше 6 тыс., относятся к белкам.
Самый низкомолекулярный белок — гормон инсулин, состоящий из 51 аминокислотного остатка. Число аминокислотных звеньев в белке может доходить до нескольких сотен и даже тысяч. Количество видов белков в природе огромно, их разнообразие связано с различным набором аминокислот, входящих в белок, и порядком их чередования в молекуле. Так, уже из трех аминокислот можно получить 6 различных трипептидов, из четырех – 24 тетрапептида, пяти — 120 пентапептидов, из 11—40 млн. изомеров, а из 20 разных аминокислот, каждая из которых встречается только один раз, теоретически может образовываться астрономическое число (2·1018) изомеров. Однако в живой природе реализуется только малая доля возможных изомеров.
Для описания строения белковых молекул были введены понятия о первичной, вторичной, третичной и четвертичной структурах.
Первичная структура.Под первичной структурой белковой молекулы понимают порядок чередования аминокислот в полипепдептидной цепи (или цепях) и местоположение дисульфидных связей. Полипептидная цепь содержит на одном конце свободную аминогруппу (N-конец), на другом — карбоксильную группу (С-конец). За начало цепи принимается ее N-конец, именно отсюда начинается отсчет аминокислот. Это совпадает с направлением синтеза полипептидной цепи на рибосоме, которое в свою очередь отвечает направлению 5’—3´ мРНК.
Аминогруппа на N-конце полипептидной цепи может быть иногда ацетилированной, присоединившей остаток уксусной кислоты (СНз—СО—NH). Блокированные за счет ацетилирования N-концы характерны также для белков оболочки многих растительных вирусов, некоторых вирусов животных и бактерий.
На С-конце встречается либо свободная карбоксильная группа (у большинства белков), либо амидированная (некоторые гормоны, пчелиный яд). Модификации С-конца более редки по сравнению с N-концевыми модификациями.
Названия отдельных пептидов образуются в соответствии с составляющими их аминокислотными остатками, начиная с N-конца. При этом в названиях всех аминокислот, за исключением последней, меняется окончание на «ил». Например, L-аланил-L-цистеил-L-метионин. Полная аминокислотная последовательность белков указывается в виде сокращенных названий аминокислот. Принято трехбуквенное и однобуквенное обозначение аминокислот (табл. 5).

Таблица 5. Обозначения аминокислотных остатков
Основная связь первичной структуры белков – пептидная связь. Эта связь достаточно жесткая и поэтому конформационная подвижность ее ограничена.
Различия в структуре гомологичных белков также дают ценную информацию о роли отдельных аминокислотных остатков в функционировании молекулы. Остатки, находящиеся в активных участках или определяющие конформацию полипептидной цепи, не могут быть изменены генетически или путем химической модификации без влияния на функцию. Так, известные в настоящее время вариации первичной структуры в цитохроме с разных видов живых организмов не связаны со значительными изменениями функциональных свойств белка, поскольку наименее изменяемыми являются участки вблизи связывания гема, а также участки, ответственные за пространственную укладку
цепи.
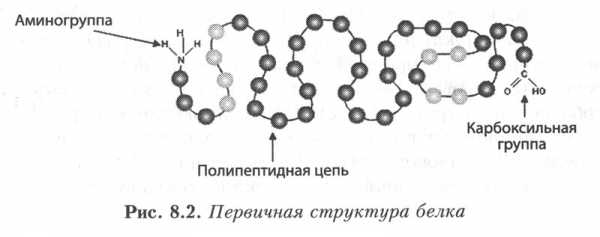
Рис. 4. Первичная структура белка
Установление чередования аминокислот в белках показало также, что в процессе эволюции происходило удвоение и слияние генов. С дупликации соответствующих генов обычно начинается дифференциация белков.
Вторичная структура.Вторичная структура — это упорядоченное пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокислот. Она образуется за счет замыкания водородных связей между пептидными группами. Вторичная структура представлена в основном такими регулярными структурами как α-спираль, складчатые слои (β-структура), β-изгиб. Часть полипептидной цепи не имеет упорядоченного строения, такие участки называют аморфными или бесструктурными областями.
В α-спиральных участках и участках с β-складчатой структурой все последовательно расположенные пептидные звенья полипептидной цепи имеют идентичные взаимные ориентации, поскольку все торсионные углы φ и все углы ψ у Сα одинаковы. В таком случае участок полипептидной цепи имеет линейную структуру, которая формируется из линейных групп.
Линейная группа представляет собой виток спирали, параметры которой (смещение вдоль оси, приходящееся на повторяющийся элемент, число элементов на виток, радиус и др.) зависят от величины углов ф и ψ. Спираль с числом элементов в витке менее двух невозможна. В белках обнаружено несколько типов линейных групп, не имеющих стерических затруднений; они стабилизированы водородными связями либо в пределах одного участка полипептидной цепи (спираль), либо между соседними участками (β-складчатая структура).
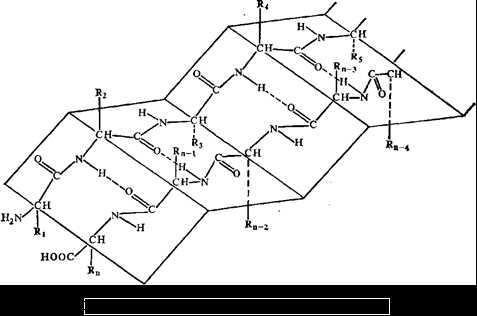
Рис. 5. Антипараллельная β-структура белка.
Складчатые слои могут образовываться не только одной полипептидной цепью (при этом водородные связи будут внутри данной цепи), но и группой близко расположенных полипептидных цепей в молекуле (водородные связи будут замыкаться между цепями). β-Структура второго типа характерна для таких фибриллярных белков, как фиброин шелка, кератин волос, состоящих из нескольких полипептидных цепей. У глобулярных белков в формировании β-складчатой структуры принимает участие обычно около 15% аминокислотных остатков полипептидной цепи. Большинство складчатых слоев содержит менее шести цепей. Как правило, складчатые слои не являются плоскими, для них характерна небольшая левая закрученность.
 Третичная структура.Третичная структура характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации. Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью. Третичная структура имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной. Таким образом, у глобулярных белков третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару. В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей ковалентные, ионные, или солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи). Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.
Третичная структура.Третичная структура характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации. Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью. Третичная структура имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной. Таким образом, у глобулярных белков третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару. В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей ковалентные, ионные, или солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи). Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.
Фибриллярные белки выполняют в организме, в основном, структурную функцию. Это плохо растворимые или нерастворимые белки, отличающиеся высоким содержанием неполярных аминокислот. К ним принадлежат, например, белки соединительных и сократительных тканей, волос, кожи, некоторые белки клеточных оболочек растений, водорослей и ряд других белков.
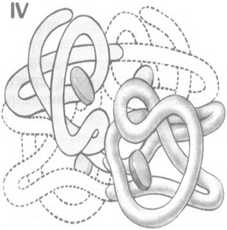 Четвертичная структура.Четвертичную структуру имеют те белки, молекула которых состоит из двух и более полипептидных цепей, связанных нековалентно. Четвертичная структура характерна, как правило, для белков, относительная молекулярная масса которых больше 50 000—100 000. Белки, имеющие четвертичную структуру, называются олигомерными.
Четвертичная структура.Четвертичную структуру имеют те белки, молекула которых состоит из двух и более полипептидных цепей, связанных нековалентно. Четвертичная структура характерна, как правило, для белков, относительная молекулярная масса которых больше 50 000—100 000. Белки, имеющие четвертичную структуру, называются олигомерными.
Под четвертичной структурой понимают способ взаимного расположения в пространстве отдельных полипептидных цепей в молекуле, характер связей между ними. К белкам с четвертичной структурой относят иногда и сложные надмолекулярные белковые структуры, в которых объединяются до нескольких сотен субъединиц, например, жгутики бактерий, головки вирусов и т. д.
megaobuchalka.ru

Leave A Comment