ОГЭ по химии | Задание 3
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22
Разбор сложных заданий в тг-канале:
Посмотреть
Задача 1
Какой вид химической связи в молекуле аммиака?
- ковалентная неполярная
- ковалентная полярная
- металлическая
- ионная
Задача 2
Ковалентная полярная связь образуется между атомами
- натрия и брома
- серы и кислорода
- водорода
- калия и хлора
Задача 3
Какое из указанных веществ имеет ионную связь?
- H2S
- NaCl
- H2
- Cl2O
Задача 4
Длина ковалентной связи наибольшая в молекуле
- H2Te
- H2O
- H2Se
- H2S
Задача 5
Какое из указанных веществ имеет ковалентную неполярную связь?
- сахар
- вода
- фуллерен
- поваренная соль
Задача 6
Химическая связь в хлориде кальция
- ковалентная полярная
- ионная
- ковалентная неполярная
- металлическая
Задача 7
Ионная связь характерна для каждого из двух веществ:
- карбида алюминия и угольной кислоты
- хлорида лития и гидрида кальция
- угарного газа и этилового спирта
- серы и нитрата железа(III…
Задача 8
Формулы веществ только с ковалентными полярными связями приведены в ряду
- HCl, N2
- Br2, HI
- СH4, NH3
- Na2O, PH3
Задача 9
Какое из указанных веществ имеет металлическую связь?
- Fe3C
- Si
- Be
- P
Задача 10
Для какого вещества характерна ковалентная полярная связь?
- MgO
- Br2
- NO
- Al
Задача 11
Для какого вещества характерна ионная связь?
- K2S
- SO2
- S8
Задача 12
Какой вид химической связи характерен для вещества, формула которого P4?
- ковалентная неполярная
- ковалентная полярная
- металлическая
- ионная
Задача 13
Одинаковый вид химической связи имеют хлороводород и
- бром
- вода
- хлорид калия
- водород
Задача 14
В гидроксиде бария связи
- только ионные
- только ковалентные полярные
- как ионные, так и ковалентные неполярные
- как ковалентные полярные, так и ионные
Задача 15
В гидроксиде кальция связи
- только ионные
- только ковалентные полярные
- как ионные, так и ковалентные неполярные
- как ковалентные полярные, так и ионные
Задача 16
В каком ряду записаны вещества только с ионной связью?
- сероуглерод, вода, нашатырь
- хлорид натрия, бромид кальция, оксид бария
- фосфат калия, сероводород, аммиак
- угарный газ, аргон,…
Задача 17
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
- фосфат натрия и нитрид калия
- фосфин и водород
- аммиак и сероуглерод…
Задача 18
Одинаковый вид химической связи имеют алмаз и
- карбид кальция
- хлороводород
- фосфор
- вода
Задача 19
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
- I2 и H2Te
- HBr и N2
- Fe и HF
- CO и SO2
Задача 20
Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
- кислород и углерод
- вода и хлороводород
- сероводород и водород
- аммиак и хлорид натрия
1 2
Популярные материалы
ОГЭ по химии.
 Разбор задания № 5
Разбор задания № 521.0121.01 | Нет комментариев | 15ч
Химия ОГЭ 2020, часть 1. Задание 5 с комментариями экспертов (разбор задания № 5 на 3 примерах). Материал для подготовки к экзамену.
ОГЭ по химии. Разбор задания № 5
Пример 1.
Решение задания (с комментариями)
Пример 2.
Решение задания (с комментариями)
Пример 3.
Решение задания (с комментариями)
Ответами к заданиям 1–19 являются цифра или последовательность цифр.
Пример 1.
ОГЭ по химии. Задание 5
Из предложенного перечня выберите вещество, имеющее два типа связи.
- 1) оксид кремния
- 2) бромид калия
- 3) сероводород
- 4) пероксид натрия
Ответ: [ ].
Решение задания (с комментариями)
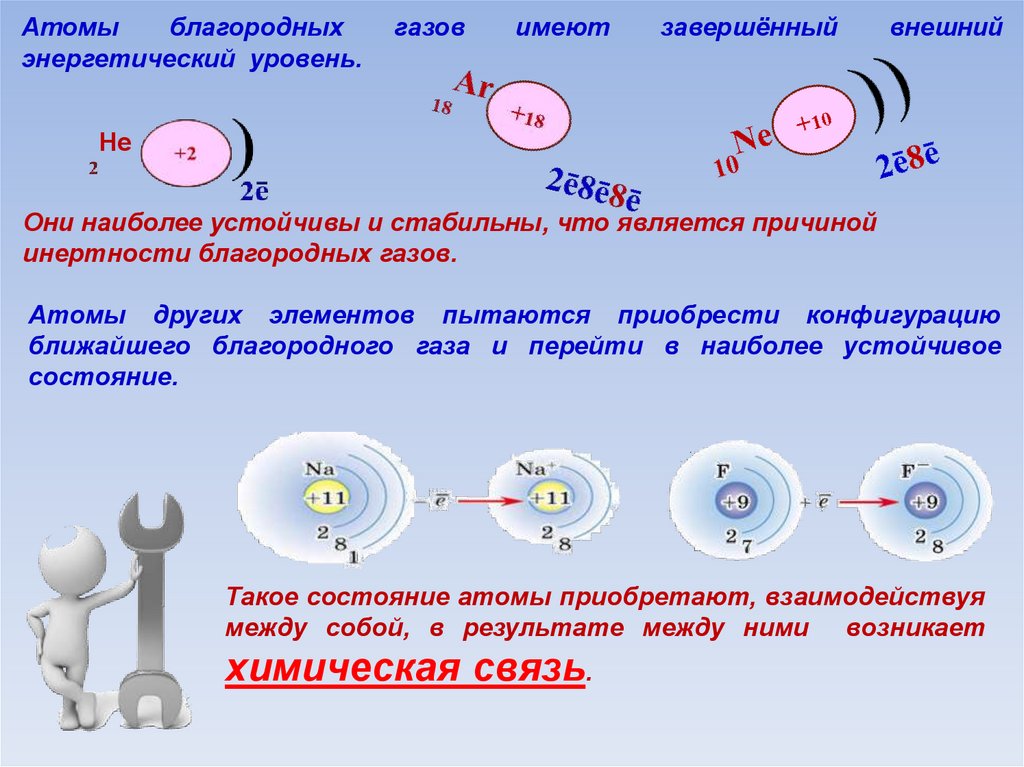
Базовые знания. Ионная связь образуется между противоположно заряженными ионами. Она возникает между катионами металлов (или катионами аммония NH4+) и простыми или сложными анионами (Сl–, О2–, S2–, ОН–, SO42– …). Ковалентная неполярная связь образуется между атомами одинаковых неметаллов. Ковалентная полярная связь возникает между атомами различных неметаллов в сложных веществах (химических соединениях). Металлы образуются в результате объединения атомов металлов с помощью металлической связи. К металлам относят все элементы побочных подгрупп и элементы главных подгрупп, расположенные ниже условной линии, проведённой от бора (второй период, III группа) к астату (шестой период, главная подгруппа VII группы).
Она возникает между катионами металлов (или катионами аммония NH4+) и простыми или сложными анионами (Сl–, О2–, S2–, ОН–, SO42– …). Ковалентная неполярная связь образуется между атомами одинаковых неметаллов. Ковалентная полярная связь возникает между атомами различных неметаллов в сложных веществах (химических соединениях). Металлы образуются в результате объединения атомов металлов с помощью металлической связи. К металлам относят все элементы побочных подгрупп и элементы главных подгрупп, расположенные ниже условной линии, проведённой от бора (второй период, III группа) к астату (шестой период, главная подгруппа VII группы).
Вывод: необходимо определить положение элементов, входящих в соединение, в Периодической системе химических элементов Д.И. Менделеева, классифицировать их на металлы и неметаллы и определить тип химической связи между этими элементами.
1) Оксид кремния SiO2 состоит из атомов кремния и кислорода.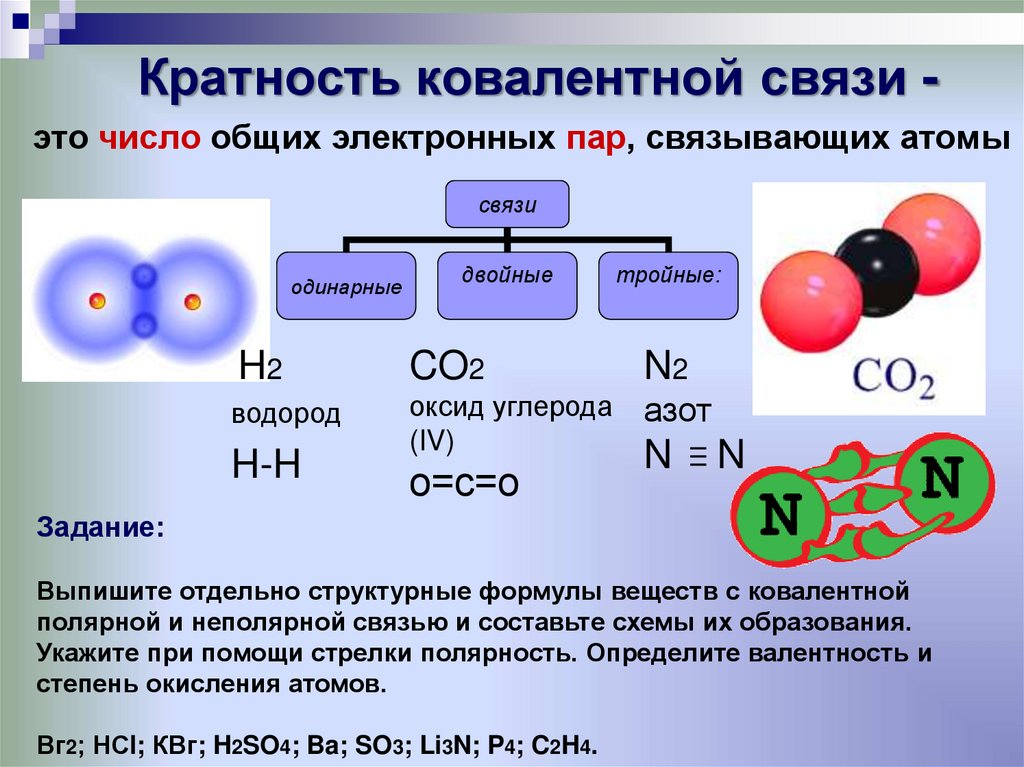
Кремний (Si) находится в главной подгруппе IV группы третьего периода, неметалл; кислород (О) находится в главной подгруппе VI группы второго периода, неметалл.
Вывод: вещество образовано двумя различными неметаллами (неМе(1)–неМе(2)), в SiO2 – связь ковалентная полярная. Ответ неверный.
2) Бромид калия КВr состоит из калия и брома.
Калий (К) находится в главной подгруппе I группы четвёртого периода, металл; бром (Вг) находится в главной подгруппе VII группы четвёртого периода, неметалл.
Вывод: вещество образовано металлом и неметаллом (М+ не М–), связь в КВr – ионная. Ответ неверный.
3) Сероводород H2S состоит из атомов водорода и серы.
Водород (Н) находится в главной подгруппе I группы первого периода, неметалл; сера (S) находится в главной подгруппе VI группы третьего периода, неметалл.
Вывод: вещество образовано двумя различными неметаллами (неМе(1)–неМе(2)), в H2S – связь ковалентная полярная.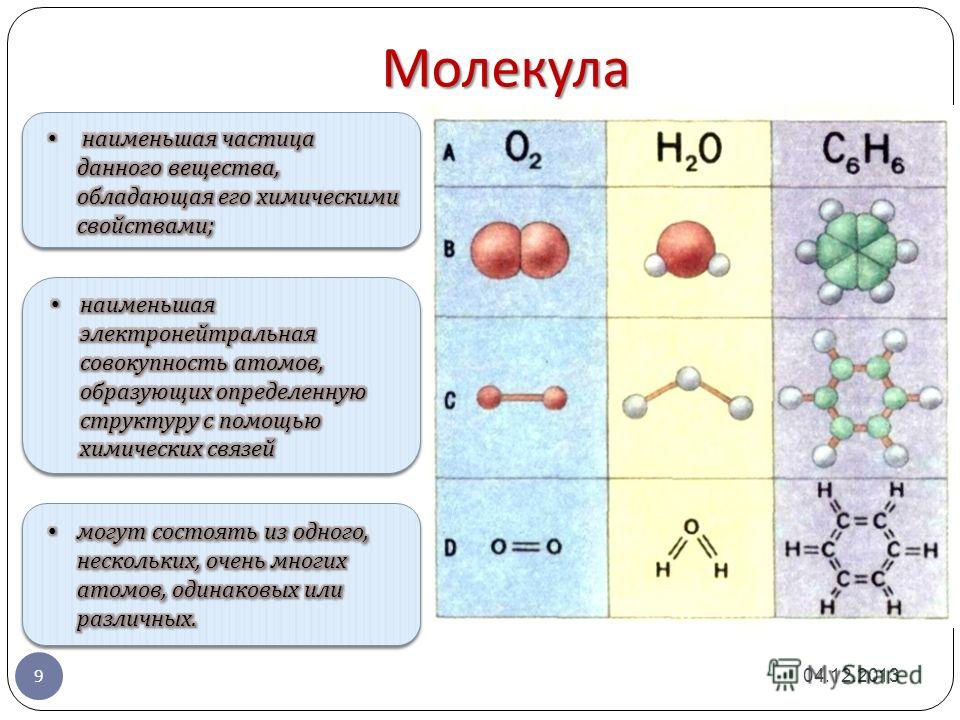 Ответ неверный.
Ответ неверный.
4) Пероксид натрия Na2O2 состоит из атомов натрия и кислорода.
Натрий (Na) находится в главной подгруппе I группы третьего периода, металл; кислород (О) находится в главной подгруппе VI группы второго периода, неметалл.
Вывод: в соединении имеется два типа связи. Между катионами натрия (Na+) и анионами кислорода (O22–) – связь ионная (ответ правильный). Между атомами кислорода – связь ковалентная неполярная (связь между атомами с одинаковой электроотрицательностью).
Ответ: 1, 4.
Пример 2.
ОГЭ по химии. Задание 5
Какой вид химической связи в молекуле аммиака?
- 1) ковалентная неполярная
- 2) ковалентная полярная
- 3) металлическая
- 4) ионная
Ответ: [ ].
Решение задания (с комментариями)
Простые вещества – неметаллы образуются с помощью ковалентной неполярной связи.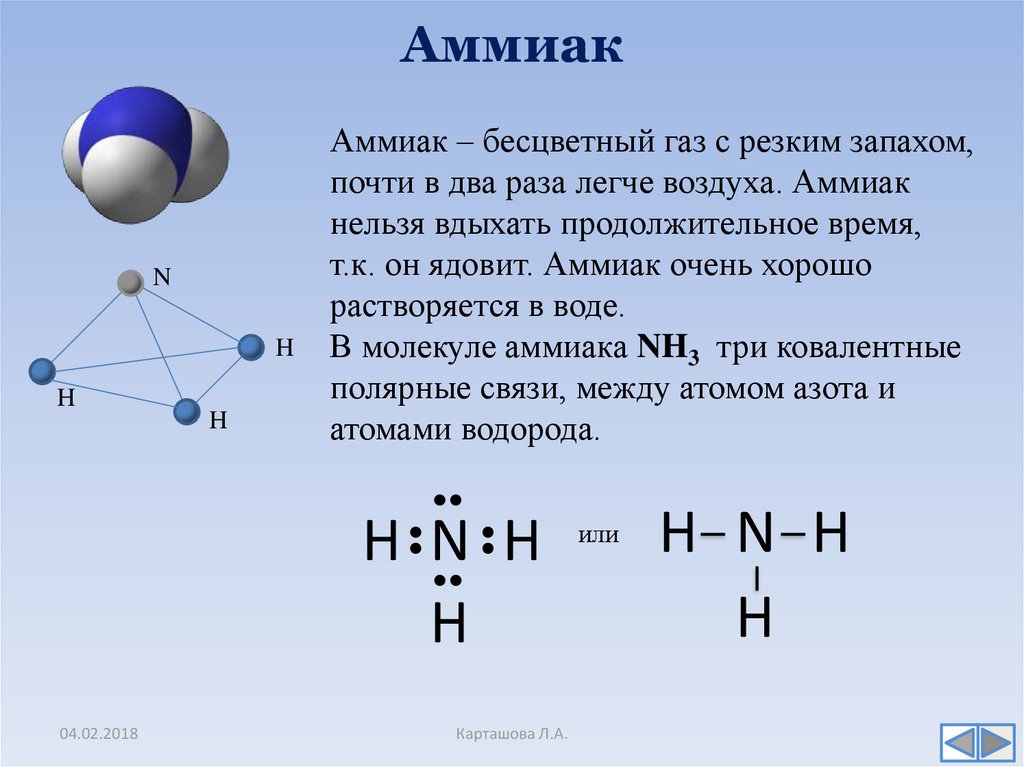 Компактные металлы образуются в результате возникновения металлической связи. В сложных веществах между атомами неметаллов могут возникать как полярные, если соединяются различные атомы, так и неполярные, между одинаковыми атомами, ковалентные связи. Между атомами типичных металлов и типичных неметаллов возникают ионные связи. Ионные связи имеются также в солях аммония.
Компактные металлы образуются в результате возникновения металлической связи. В сложных веществах между атомами неметаллов могут возникать как полярные, если соединяются различные атомы, так и неполярные, между одинаковыми атомами, ковалентные связи. Между атомами типичных металлов и типичных неметаллов возникают ионные связи. Ионные связи имеются также в солях аммония.
Вывод: надо написать формулу аммиака и определить, между какими атомами имеются химические связи, и тип этих связей.
Формула аммиака NH3.
Элемент азот 7N находится в главной подгруппе V группы второго периода, неметалл.Элемент водород 1Н находится в главной подгруппе I группы первого периода, неметалл.
Вывод: связь между атомами N и Н – ковалентная полярная.
Ответ: 2.
Пример 3.
ОГЭ по химии. Задание 5
Одинаковый вид химической связи имеют графит и
- 1) медь
- 2) бромоводород
- 3) сера
- 4) аммиак
Ответ: [ ].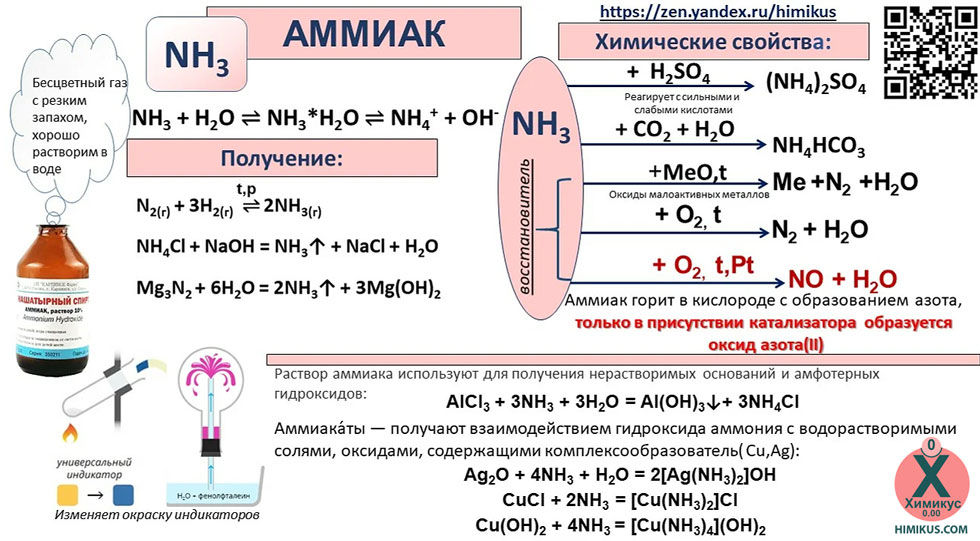
Решение задания (с комментариями)
Графит – простое вещество, образованное углеродом. Углерод – неметалл, связи в графите – ковалентные неполярные. Вывод: среди предложенных веществ необходимо определить простое вещество, образованное неметаллом.
1) Медь – металл. Вывод: ответ неверный.
2) Бромоводород НВг – сложное вещество, образованное атомами элементов–неметаллов, связь в молекуле ковалентная полярная. Вывод: ответ неверный.
3) Сера – простое вещество, образованное элементом–неметаллом. Связи – ковалентные неполярные. Вывод: правильный ответ найден, оставшийся вариант рассматривать не будем.
Ответ: 3.
Вы смотрели: Химия ОГЭ 2020, часть 1. Задание 5 с комментариями (разбор задания на трех примерах). Материал для подготовки к экзамену.
Факты об аммиаке
Техническая информация
Копия документа Факты об аммиаке (техническая информация) доступна в формате Adobe Portable Document Format (PDF, 63 КБ, 3 стр.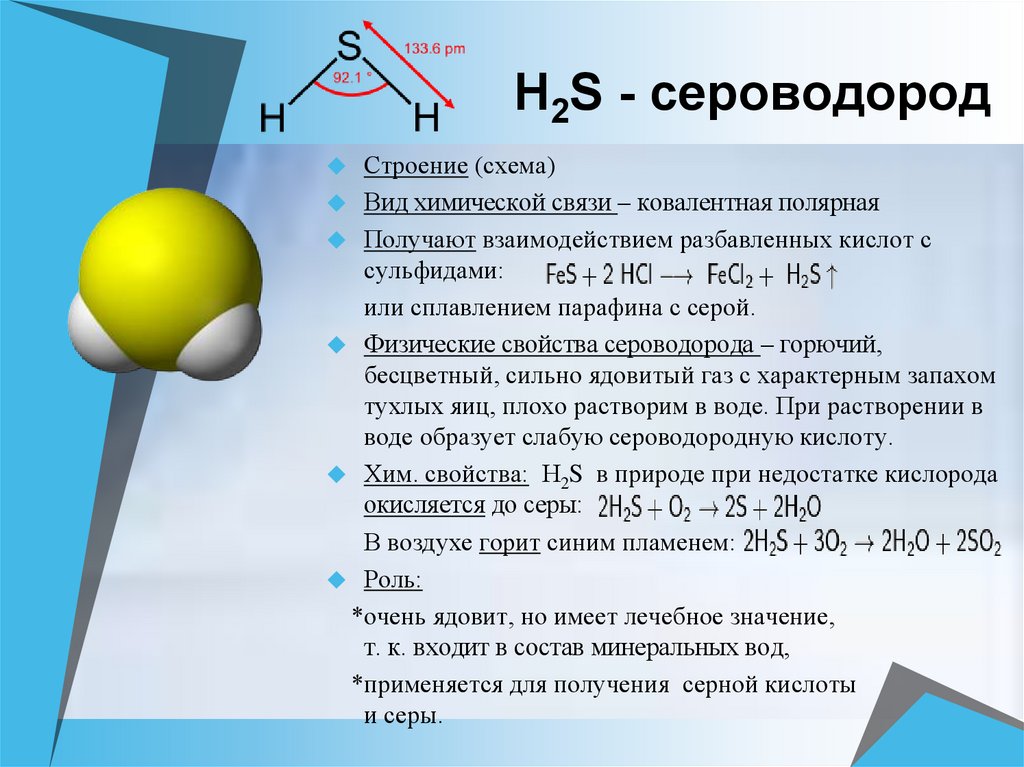 )
)
Примечание для читателя: Этот информационный бюллетень предназначен для обеспечения общей осведомленности и обучения по конкретному химическому агенту. Для получения информации о готовности и реагировании (например, для сотрудников службы экстренного реагирования и скорой медицинской помощи) см. следующие ресурсы Департамента:
- Карточка готовности и реагирования на химический терроризм (PDF, 45 КБ, 7 стр.)
- Настенная диаграмма «Химический терроризм» (PDF, 97 КБ, 1 стр.)
Что такое аммиак?
Аммиак (NH 3 ) является одним из наиболее часто производимых промышленных химикатов в Соединенных Штатах. Он используется в промышленности и торговле, а также естественным образом присутствует в организме человека и в окружающей среде. Аммиак необходим для многих биологических процессов и служит предшественником для синтеза аминокислот и нуклеотидов. В окружающей среде аммиак является частью азотного цикла и образуется в почве в результате бактериальных процессов.
Некоторые химические/физические свойства аммиака:
- При комнатной температуре аммиак представляет собой бесцветный сильно раздражающий газ с резким удушливым запахом.
- В чистом виде известен как безводный аммиак и гигроскопичен (легко впитывает влагу).
- Аммиак обладает щелочными свойствами и вызывает коррозию.
- Газообразный аммиак легко растворяется в воде с образованием гидроксида аммония, щелочного раствора и слабого основания.
- Газообразный аммиак легко сжимается и под давлением образует прозрачную жидкость.
- Аммиак обычно транспортируют в виде сжатой жидкости в стальных контейнерах.
- Аммиак не легко воспламеняется, но контейнеры с аммиаком могут взорваться при воздействии высокой температуры.
Как используется аммиак?
Около 80% аммиака, производимого промышленностью, используется в сельском хозяйстве в качестве удобрения. Аммиак также используется в качестве газообразного хладагента для очистки воды и в производстве пластмасс, взрывчатых веществ, текстиля, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Бытовые чистящие растворы аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака. Растворы аммиака для промышленного использования могут иметь концентрацию 25% или выше и вызывать коррозию.
Аммиак также используется в качестве газообразного хладагента для очистки воды и в производстве пластмасс, взрывчатых веществ, текстиля, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Бытовые чистящие растворы аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака. Растворы аммиака для промышленного использования могут иметь концентрацию 25% или выше и вызывать коррозию.
Как люди могут подвергаться воздействию аммиака?
Большинство людей подвергаются воздействию аммиака при вдыхании газа или паров. Поскольку аммиак существует в природе, а также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, в промышленных и коммерческих помещениях также означает, что воздействие может произойти в результате случайного выброса или преднамеренного террористического нападения.
Безводный газообразный аммиак легче воздуха и будет подниматься вверх, так что обычно он рассеивается и не оседает в низинах.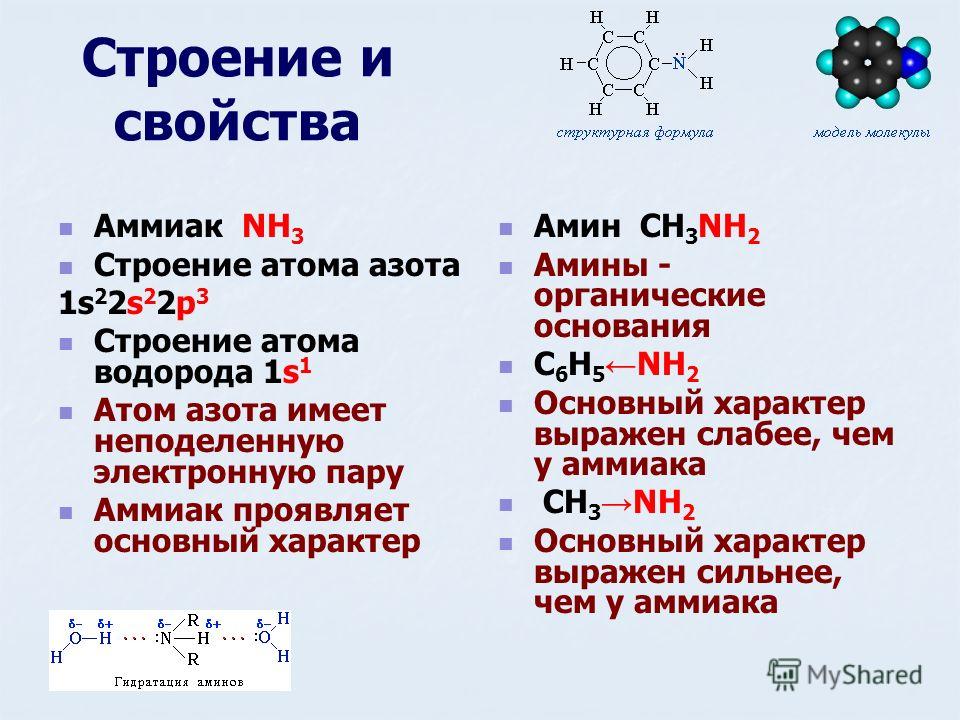 Однако в присутствии влаги (например, при высокой относительной влажности) сжиженный безводный газообразный аммиак образует пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или в низинах с плохим воздушным потоком, где люди могут подвергнуться воздействию.
Однако в присутствии влаги (например, при высокой относительной влажности) сжиженный безводный газообразный аммиак образует пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или в низинах с плохим воздушным потоком, где люди могут подвергнуться воздействию.
Каков механизм действия аммиака?
Аммиак сразу же при контакте с имеющейся влагой кожи, глаз, полости рта, дыхательных путей и особенно слизистых поверхностей взаимодействует с образованием очень едкого гидроксида аммония. Гидроксид аммония вызывает некроз тканей за счет разрушения липидов клеточных мембран (омыление), что приводит к разрушению клеток. Когда клеточные белки разрушаются, вода извлекается, что приводит к воспалительной реакции, вызывающей дальнейшее повреждение.
Каковы непосредственные последствия воздействия аммиака на здоровье?
Вдыхание: Аммиак вызывает раздражение и коррозию. Воздействие высоких концентраций аммиака в воздухе вызывает немедленное жжение в носу, горле и дыхательных путях. Это может вызвать бронхиолярный и альвеолярный отек и разрушение дыхательных путей, приводящее к дыхательной недостаточности или недостаточности. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осознание длительного воздействия низких концентраций.
Это может вызвать бронхиолярный и альвеолярный отек и разрушение дыхательных путей, приводящее к дыхательной недостаточности или недостаточности. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осознание длительного воздействия низких концентраций.
Дети, подвергшиеся воздействию тех же концентраций паров аммиака, что и взрослые, могут получить большую дозу, поскольку у них больше отношение площади поверхности легких к массе тела и повышенное отношение минутного объема к массе. Кроме того, они могут подвергаться воздействию более высоких концентраций, чем взрослые в том же месте, из-за их меньшего роста и более высоких концентраций паров аммиака, изначально обнаруженных у земли.
Контакт с кожей или глазами: Воздействие низких концентраций аммиака в воздухе или в растворе может вызвать быстрое раздражение кожи или глаз.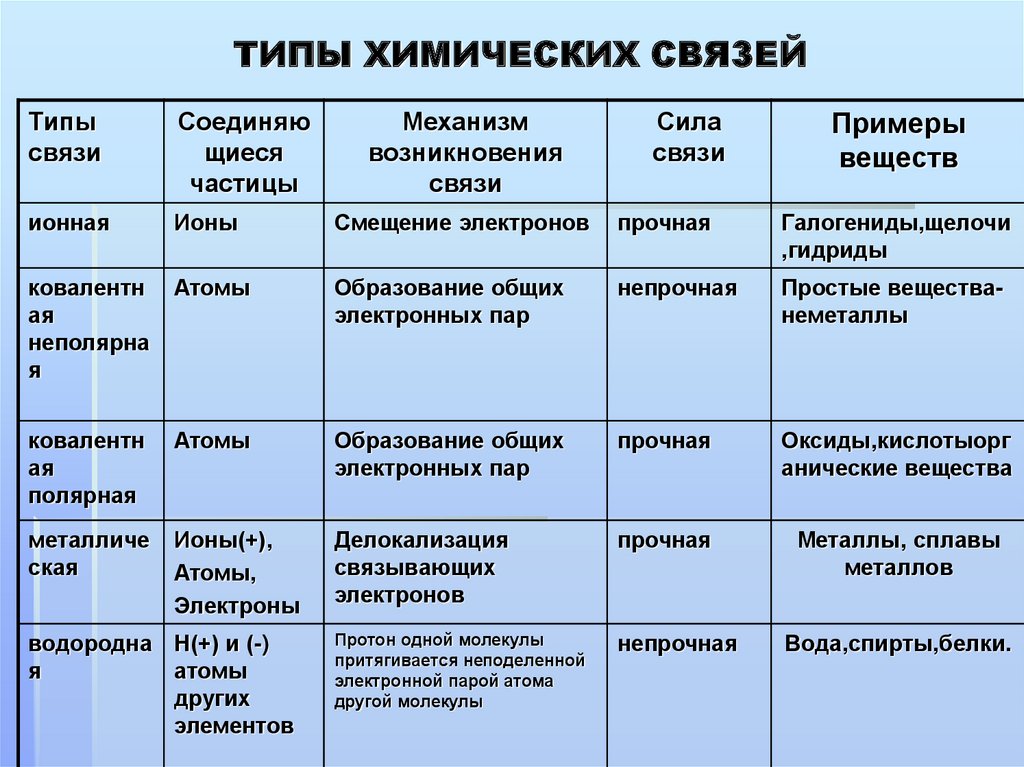 Более высокие концентрации аммиака могут вызвать серьезные травмы и ожоги. Контакт с концентрированными растворами аммиака, такими как промышленные чистящие средства, может привести к коррозионным повреждениям, включая ожоги кожи, необратимое повреждение глаз или слепоту. Полная степень повреждения глаз может не проявляться в течение недели после воздействия. Контакт со сжиженным аммиаком также может вызвать обморожение.
Более высокие концентрации аммиака могут вызвать серьезные травмы и ожоги. Контакт с концентрированными растворами аммиака, такими как промышленные чистящие средства, может привести к коррозионным повреждениям, включая ожоги кожи, необратимое повреждение глаз или слепоту. Полная степень повреждения глаз может не проявляться в течение недели после воздействия. Контакт со сжиженным аммиаком также может вызвать обморожение.
Проглатывание: Воздействие высоких концентраций аммиака при проглатывании раствора аммиака приводит к коррозионному поражению полости рта, горла и желудка. Проглатывание аммиака обычно не приводит к системному отравлению.
Как лечить воздействие аммиака?
Противоядия от отравления аммиаком не существует, но последствия аммиака можно лечить, и большинство людей выздоравливают. Немедленное обеззараживание кожи и глаз большим количеством воды очень важно. Лечение состоит из поддерживающих мер и может включать введение увлажненного кислорода, бронходилататоров и обеспечение проходимости дыхательных путей. Попавший внутрь нашатырный спирт разбавляют молоком или водой.
Попавший внутрь нашатырный спирт разбавляют молоком или водой.
Помогут ли лабораторные тесты принять решение о лечении, если кто-то подвергся воздействию аммиака?
Лабораторные анализы на воздействие аммиака бесполезны при принятии решений о неотложной помощи. Доступны медицинские тесты, которые могут обнаружить аммиак в крови или моче. Однако, поскольку аммиак обычно присутствует в организме, результаты этих анализов не могут служить биомаркерами воздействия. После воздействия низких уровней аммиак либо быстро выводится из организма, либо метаболизируется до соединений, обнаруживаемых эндогенно в заметных количествах. Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не изменились или изменились минимально по сравнению с предыдущими уровнями. Воздействие высоких концентраций оказывает немедленное и явное токсическое действие, что обычно обеспечивает достаточную основу для диагностики.
Как я могу получить дополнительную информацию об аммиаке?
Позвоните по следующим номерам или посетите веб-сайты, указанные в разделе «Источники».
- Горячая линия Центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний. 2004. ToxFAQ для аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/tfacts126.html
Агентство регистрации токсичных веществ и заболеваний. 2004. Руководство по медицинскому контролю (MMG) аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/MHMI/mmg126.html
Центры по контролю и профилактике заболеваний. 2003. Бюллетени готовности и реагирования на чрезвычайные ситуации в области общественного здравоохранения. Министерство здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.bt.cdc.gov/agent/ammonia/index.asp
Министерство здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.bt.cdc.gov/agent/ammonia/index.asp
Этот информационный бюллетень основан на самой последней информации. Он может обновляться по мере поступления новой информации.
Обновлено: 28 июля 2004 г.
Факты об аммиаке
Общая информация
Копия Факты об аммиаке (общая информация) доступна в формате Adobe Portable Document Format (PDF, 63 КБ, 3 стр.)
Примечание для читателя: Этот информационный бюллетень предназначен для предоставления общей информации и информации о конкретном химическом агенте. Для получения информации о готовности и реагировании (например, для сотрудников службы экстренного реагирования и скорой медицинской помощи) см. следующие ресурсы Департамента:
- Карточка готовности и реагирования на химический терроризм (PDF, 45 КБ, 7 стр.)
- Настенная диаграмма «Химический терроризм» (PDF, 97 КБ, 1 стр.
 )
)
Что такое аммиак?
Аммиак является одним из наиболее широко производимых химических веществ в Соединенных Штатах. В чистом виде он известен как безводный аммиак. Аммиак также вырабатывается в организме человека и обычно встречается в природе. Он необходим организму как строительный блок для производства белков и других сложных молекул. В природе аммиак возникает в почве в результате бактериальных процессов. Он также образуется при разложении растений, животных и животных отходов.
Какими свойствами обладает аммиак?
Аммиак представляет собой бесцветный сильнораздражающий газ с резким удушливым запахом. Он легко растворяется в воде с образованием раствора гидроксида аммония, который может вызвать раздражение и ожоги. Газообразный аммиак легко сжимается и под давлением образует прозрачную бесцветную жидкость. Обычно его транспортируют в виде сжатой жидкости в стальных баллонах. Аммиак не легко воспламеняется, но контейнеры с аммиаком могут взорваться при воздействии высокой температуры.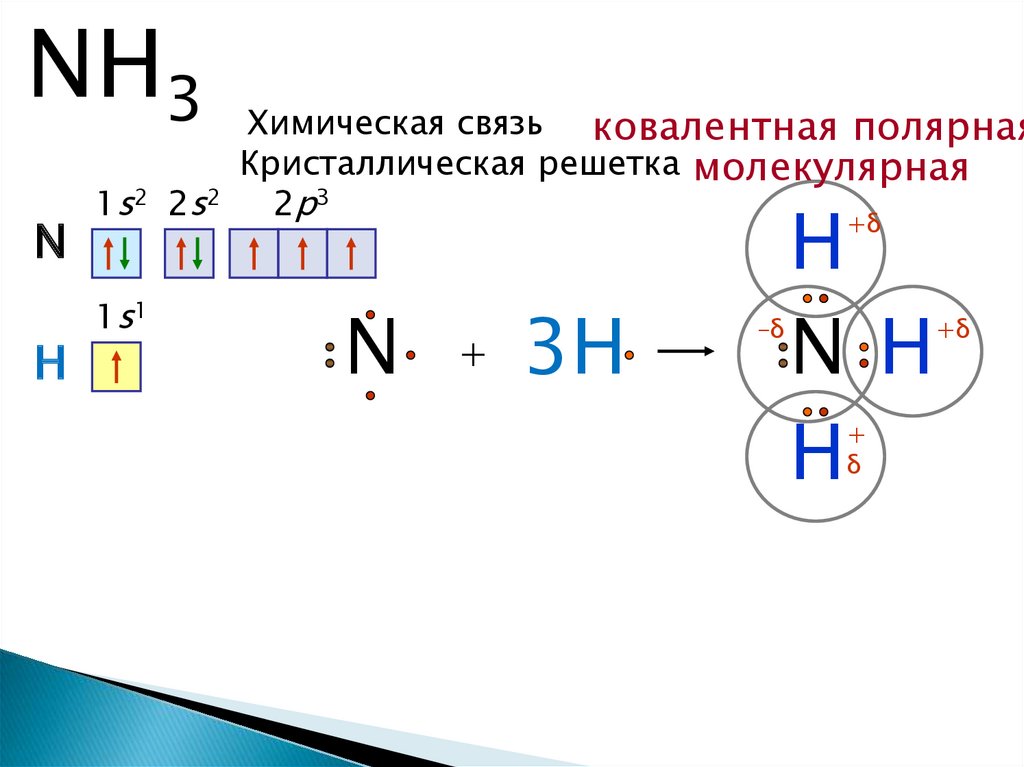
Как используется аммиак?
Около 80% аммиака, производимого в промышленности, используется в сельском хозяйстве в качестве удобрения. Аммиак также используется в качестве газообразного хладагента, для очистки воды и в производстве пластмасс, взрывчатых веществ, тканей, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Моющие растворы для промышленного использования содержат более высокие концентрации аммиака и могут быстро вызвать раздражение и ожоги.
Как люди могут подвергаться воздействию аммиака?
Большинство людей подвергается воздействию аммиака при вдыхании его газа или паров. Поскольку аммиак существует в природе, а также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, в промышленных и коммерческих помещениях означает, что воздействие может также произойти в результате случайного выброса или преднамеренного террористического нападения.
Газообразный аммиак легче воздуха и будет подниматься вверх, поэтому обычно не оседает в низинах. Однако в присутствии влаги аммиак может образовывать пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или другим низменным участкам.
Как действует аммиак на организм?
Когда аммиак попадает в организм в результате дыхания, проглатывания или контакта с кожей, он вступает в реакцию с водой с образованием гидроксида аммония. Это химическое вещество очень агрессивно и повреждает клетки организма при контакте.
Каковы специфические признаки и симптомы отравления аммиаком?
Аммиак вызывает коррозию. Тяжесть последствий для здоровья зависит от пути воздействия, дозы и продолжительности воздействия. Воздействие высоких концентраций аммиака в воздухе вызывает немедленное жжение в глазах, носу, горле и дыхательных путях и может привести к слепоте, повреждению легких или смерти. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла.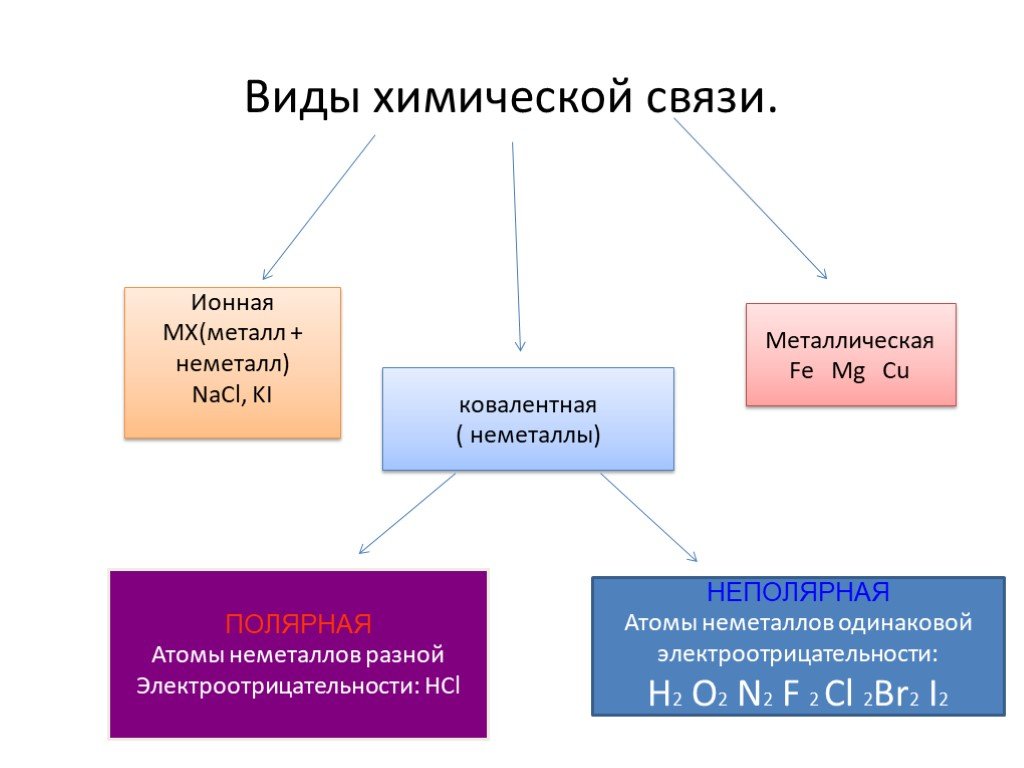
Проглатывание аммиака может вызвать ожоги рта, горла и желудка. Контакт кожи или глаз с концентрированным аммиаком также может вызвать раздражение и ожоги.
Что делать, если вы считаете, что могли подвергнуться воздействию большого количества аммиака?
Если вы подверглись воздействию большого количества аммиака, например, в результате опрокидывания автоцистерны или протечки железнодорожной цистерны, выполните следующие действия:
- Быстро отойдите от места, где, по вашему мнению, вы подверглись воздействию. Если выброс был в помещении, выйдите на улицу.
- Если вы находитесь вблизи места выброса аммиака, координаторы по чрезвычайным ситуациям могут попросить вас либо эвакуироваться из района, либо «укрыться на месте». «Укрыться на месте» означает оставаться в помещении, чтобы избежать воздействия химического вещества. Находясь в помещении, закройте и заприте все двери и окна; выключите кондиционеры, вентиляторы и обогреватели; и закрыть заслонки камина.

- Для получения дополнительной информации об эвакуации во время химической аварии см. Факты об эвакуации . Для получения дополнительной информации об укрытии на месте во время химической аварийной ситуации см. 9.0156 Факты об укрытии на месте .
- Если вы находитесь вблизи места выброса аммиака, координаторы по чрезвычайным ситуациям могут попросить вас либо эвакуироваться из района, либо «укрыться на месте». «Укрыться на месте» означает оставаться в помещении, чтобы избежать воздействия химического вещества. Находясь в помещении, закройте и заприте все двери и окна; выключите кондиционеры, вентиляторы и обогреватели; и закрыть заслонки камина.
- Быстро снимите одежду, на которой может быть аммиак. Если возможно, одежду, которую обычно снимают через голову (например, футболки и свитера), следует срезать с тела, чтобы предотвратить дополнительный контакт с возбудителем.
- Поместите одежду в полиэтиленовый пакет и плотно завяжите его.
- Не трогайте пластиковый пакет и ждите инструкций по правильной утилизации.
- Утилизация одежды в герметичном пакете помогает защитить вас и других людей от любого дополнительного воздействия.
- Храните упакованную одежду в безопасном месте, недоступном для людей, особенно детей.
- Быстро смойте аммиак с кожи большим количеством воды с мылом и промойте глаза большим количеством воды.

- Снимите и утилизируйте контактные линзы.
- Перед тем, как надеть очки, промойте их водой с мылом.
- Не используйте отбеливатель для удаления аммиака с кожи.
- При необходимости немедленно обратитесь за медицинской помощью.
Как лечить отравление аммиаком?
Чтобы уменьшить последствия воздействия аммиака, важно как можно быстрее промыть глаза и кожу большим количеством воды.
Противоядия от отравления аммиаком не существует, но последствия аммиака можно лечить, и большинство жертв выздоравливают. Людям с серьезными признаками и симптомами (такими как сильный или постоянный кашель или ожоги в горле) может потребоваться госпитализация.
Помогут ли лабораторные исследования принять решение о лечении, если кто-то подвергся воздействию аммиака?
Лабораторные анализы на воздействие аммиака бесполезны при принятии решений о неотложной помощи. Есть тесты, которые могут обнаружить аммиак в крови и моче. Однако эти тесты не могут точно определить, подвергался ли кто-либо воздействию аммиака из внешнего источника, потому что аммиак также обычно содержится в организме. Человек, подвергшийся воздействию вредных количеств аммиака, сразу заметит это из-за сильного неприятного запаха; сильный вкус; и, вероятно, раздражение кожи, глаз, носа и горла.
Однако эти тесты не могут точно определить, подвергался ли кто-либо воздействию аммиака из внешнего источника, потому что аммиак также обычно содержится в организме. Человек, подвергшийся воздействию вредных количеств аммиака, сразу заметит это из-за сильного неприятного запаха; сильный вкус; и, вероятно, раздражение кожи, глаз, носа и горла.
Как я могу получить дополнительную информацию об аммиаке?
Позвоните по следующим номерам или посетите веб-сайты, указанные в разделе «Источники».
- Горячая линия Центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний. 2004. ToxFAQ для аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия.

 )
)
Leave A Comment