Основные функции белков в организме, их свойства и роль
Что такое белки
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью.
Этот класс органических веществ можно рассматривать с точки зрения двух наук: биологии и химии. Начнем с биологической роли белков.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Биологические функции белков
Строительная, или пластическая
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
Транспортная
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Регуляторная
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма. Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Защитная
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена. Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательная
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
Сигнальная
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.
Запасающая
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Энергетическая
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия. При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
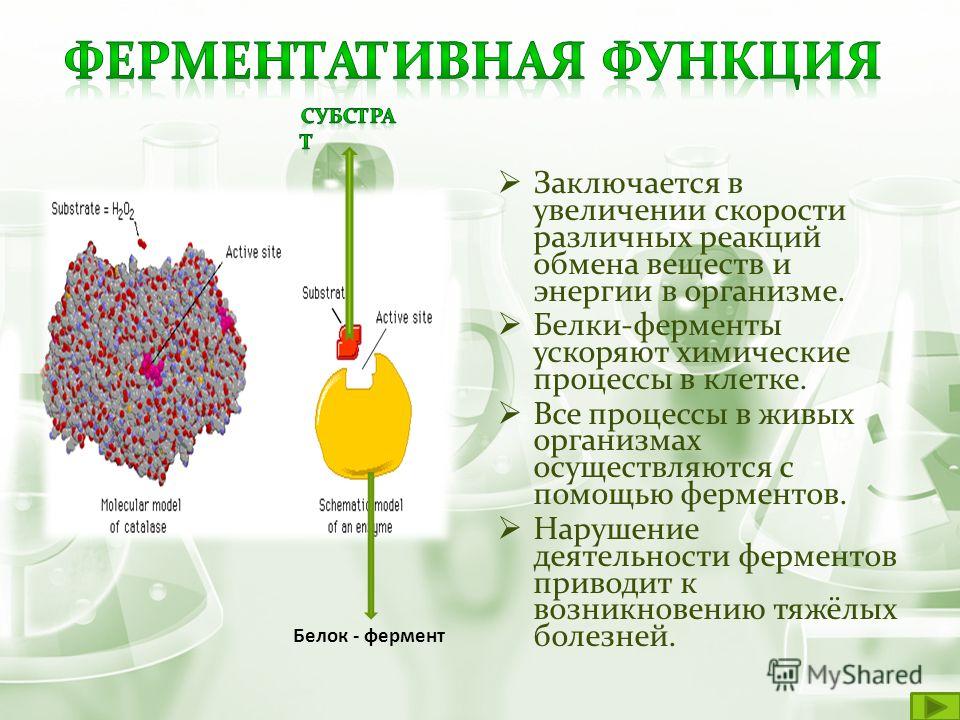
Каталитическая
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Питательная, или резервная
Эту функцию выполняют резервные белки, которые являются источником питания для плода. Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Функция антифриза
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
Белки как класс органических соединений
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот. Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Гидролиз
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.
Денатурация
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
The image is a derivative of «Protein structure vector illustration» by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
Как видно из условий, обратимость зависит от условий протекания реакций. Чем они жестче, тем меньше вероятность обратимости реакции.
Биуретовая реакция (качественная реакция на белок)
Раствор белка + NaOH(10%-й р-р) + CuSO4 = фиолетовое окрашивание.
Ксантопротеиновая реакция (качественная реакция на белок)
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.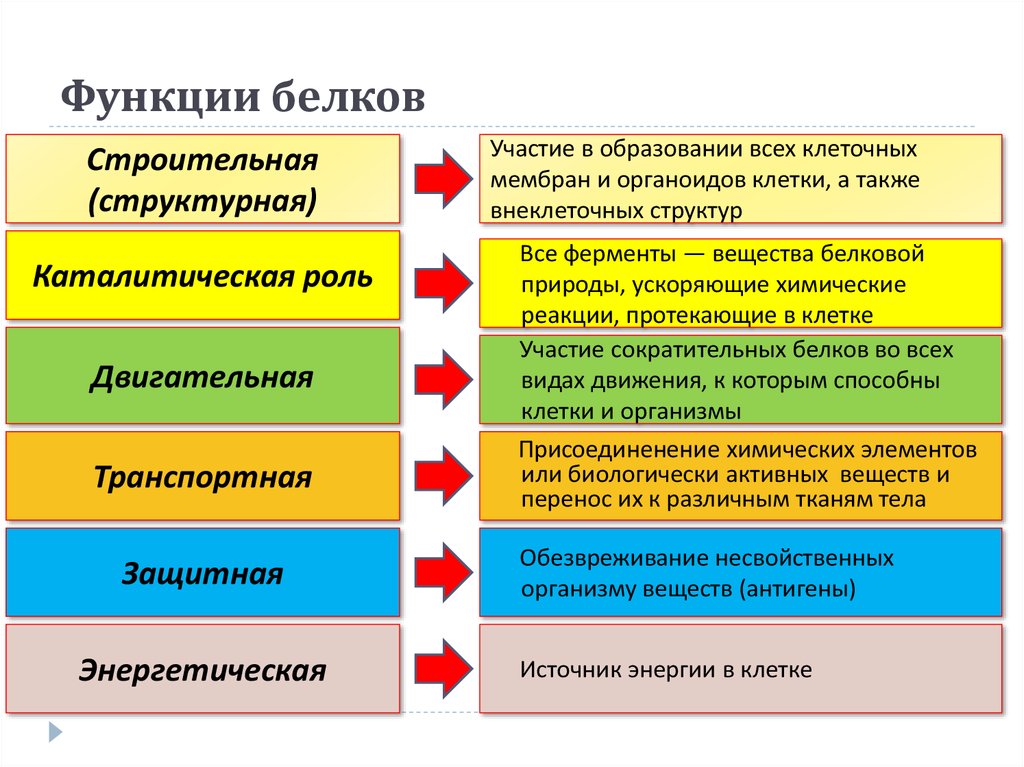
Реакция Фоля (цистеиновая проба)
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.
Вопросы для самопроверки
Какая из структур белка является самой прочной?
Первичная
Вторичная
Третичная
Четвертичная
Какую из перечисленных функций способен выполнять белок?
Результативную
Регуляторную
Регулятивную
Растворную
За счет какой связи образуется первичная структура белка?
Ионной
Водородной
Пептидной
Ковалентной неполярной
При гидролизе белка получается (получаются).
 ..
..Аминокислоты, образующие этот белок
Углекислый газ
Аминокислота и вода
Белок гидролизу не подвергается
Какая реакция с белком дает фиолетовое окрашивание?
Ксантопротеиновая
Цистеиновая
Биуретовая
Денатурация
Еще больше наглядных примеров функций белков в клетках живых организмов — на онлайн-курсах химии в Skysmart.
Ответы на вопросы
a
b
c
a
c
ФУНКЦИИ БЕЛКОВ. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
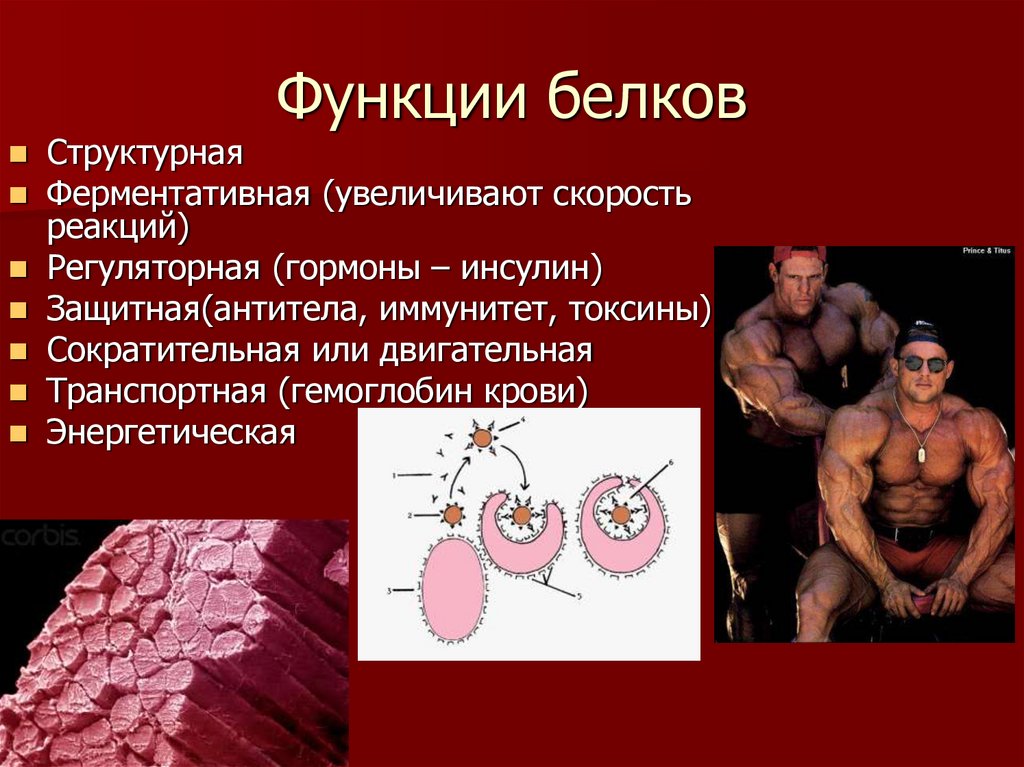
Белки выполняют множество самых разнообразных функций, характерных для живых организмов, с некоторыми из которых мы познакомимся более подробно при дальнейшем изучении курса. Ниже рассматриваются главные и в некотором смысле уникальные биологические функции белков, несвойственные или лишь частично присущие другим классам биополимеров.
Каталитическая функция.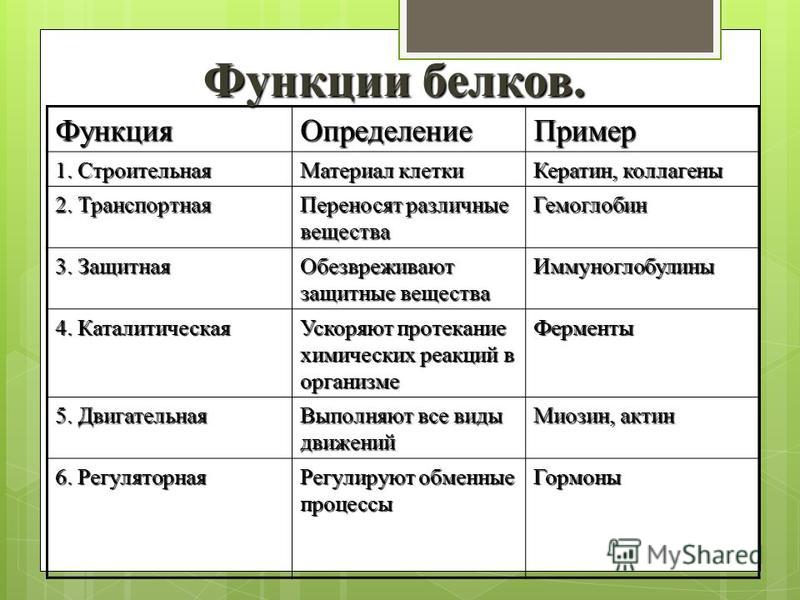 К 1995 г. было идентифицировано более 3400 ферментов.
Большинство известных в настоящее время ферментов, называемых
биологическими катализаторами, является белками. Эта функция белков, хотя и не
оказалась уникальной, определяет скорость химических реакций в биологических
системах.
К 1995 г. было идентифицировано более 3400 ферментов.
Большинство известных в настоящее время ферментов, называемых
биологическими катализаторами, является белками. Эта функция белков, хотя и не
оказалась уникальной, определяет скорость химических реакций в биологических
системах.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная
система, которая обеспечивает синтез специфических защитных белков-антител в
ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных
белков.
Сократительная функция.
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают
по количеству первое место среди других белков тела человека.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во многих других клетках организма (см. далее). Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки,
являющиеся источниками питания для плода, например белки яйца (овальбумины).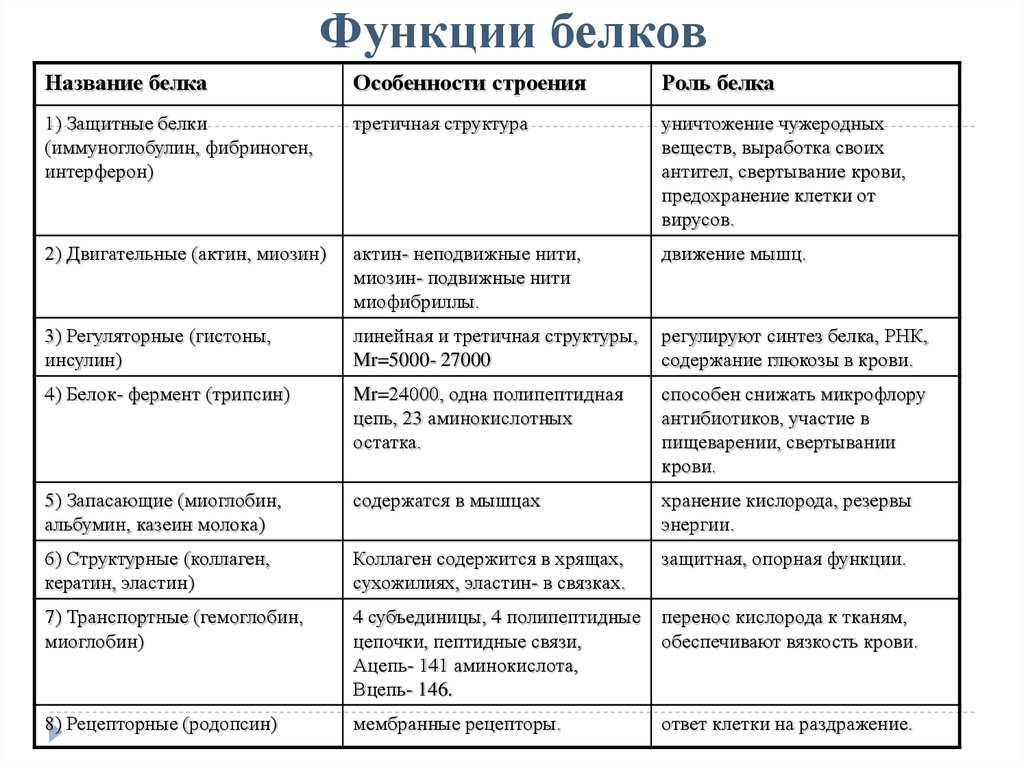 Основной белок молока (казеин) также выполняет главным образом питательную
функцию. Ряд других белков используется в организме в качестве источника
аминокислот, которые в свою очередь являются предшественниками биологически
активных веществ, регулирующих процессы метаболизма.
Основной белок молока (казеин) также выполняет главным образом питательную
функцию. Ряд других белков используется в организме в качестве источника
аминокислот, которые в свою очередь являются предшественниками биологически
активных веществ, регулирующих процессы метаболизма.
Можно назвать еще некоторые другие жизненно важные функции белков. Это, в частности, экспрессия генетической информации, генерирование и передача нервных импульсов, способность поддерживать онкотическое давление в клетках и крови, буферные свойства, поддерживающие физиологическое значение рН внутренней среды, и др.
Таким
образом, из этого далеко не полного перечня основных функций белков видно, что
указанным биополимерам принадлежит исключительная и разносторонняя роль в живом
организме. Если попытаться выделить главное, решающее свойство, которое
обеспечивает многогранность биологических функций белков, то следовало бы
назвать способность белков строго избирательно, специфически соединяться с
широким кругом разнообразных веществ.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Защитная функция белков и липидов грудного молока
Обзор
. 1998;74(2):163-76.
дои: 10.1159/000014021.
М Хамош 1
принадлежность
- 1 Отделение педиатрии, Медицинский центр Джорджтаунского университета, Вашингтон, округ Колумбия, 20007, США.

- PMID: 9691157
- DOI: 10.1159/000014021
Обзор
М Хамош. Биол Неонат. 1998.
. 1998;74(2):163-76.
дои: 10.1159/000014021.
Автор
М Хамош 1
принадлежность
- 1 Отделение педиатрии, Медицинский центр Джорджтаунского университета, Вашингтон, округ Колумбия, 20007, США. [email protected].
 edu
edu
- PMID: 9691157
- DOI: 10.1159/000014021
Абстрактный
Грудное молоко обеспечивает младенцу защиту от инфекционных заболеваний. Эта защита обеспечивается несколькими механизмами: специфической направленной защитой антител против патогенов в окружающей среде младенца (через молочные IgA, IgG и IgM) и неспецифической защитой широкого спектра действия, обеспечиваемой несколькими различными механизмами. Это: бактерицидное действие (лактоферрин), бактериостатическое действие (лактоферрин, лизоцим), лизис микроорганизмов (лизоцим), противовирусное действие (лактоферрин, продукты переваривания молочного жира), антипротозойная активность (свободные жирные кислоты, образующиеся при желудочном и кишечном переваривании молока). жира) и действие лиганда (ингибирование адгезии Helicobacter pylori к слизистой оболочке желудка каппа-казеином). В дополнение к этим защитным функциям белков и липидов грудного молока некоторые ферменты, присутствующие в грудном молоке, могут обеспечивать защиту, образуя компоненты, обладающие бактерицидным действием (зависимая от солей желчных кислот липаза, пероксидаза), предотвращающие воспалительные реакции (фактор активации тромбоцитов ацетилгидролаза), или защитить целостность белков молока (антипротеазы).
жира) и действие лиганда (ингибирование адгезии Helicobacter pylori к слизистой оболочке желудка каппа-казеином). В дополнение к этим защитным функциям белков и липидов грудного молока некоторые ферменты, присутствующие в грудном молоке, могут обеспечивать защиту, образуя компоненты, обладающие бактерицидным действием (зависимая от солей желчных кислот липаза, пероксидаза), предотвращающие воспалительные реакции (фактор активации тромбоцитов ацетилгидролаза), или защитить целостность белков молока (антипротеазы).
Похожие статьи
Биоактивные белки грудного молока.
Лённердал Б. Лённердаль Б. J Педиатр Здоровье ребенка. 2013 март;49 Приложение 1:1-7. doi: 10.1111/jpc.12104. J Педиатр Здоровье ребенка. 2013. PMID: 23448314
Соединения грудного молока, ингибирующие адгезию мутантных стрептококков к покрытому лигандом гидроксиапатиту in vitro.

Даниэльссон Ниеми Л., Хернелл О., Йоханссон И. Даниэльссон Ниеми Л. и др. Кариес рез. 2009;43(3):171-8. дои: 10.1159/000213888. Epub 2009 23 апреля. Кариес рез. 2009. PMID: 193
Противовоспалительные механизмы биоактивных белков молока в кишечнике новорожденных.
Чаттертон Д.Е., Нгуен Д.Н., Беринг С.Б., Сангильд П.Т. Чаттертон Д.Э. и соавт. Int J Biochem Cell Biol. 2013 авг; 45(8):1730-47. doi: 10.1016/j.biocel.2013.04.028. Epub 2013 6 мая. Int J Biochem Cell Biol. 2013. PMID: 23660296 Обзор.
Пептидомный анализ переваривания грудного молока в желудке младенцев выявляет характерные для белка модели деградации.
Даллас, округ Колумбия, Герреро А., Халди Н., Боргезе Р.
 , Бхандари А., Андервуд М.А., Лебрилла CB, Герман Дж.Б., Бариле Д.
Даллас, округ Колумбия, и др.
Дж Нутр. 2014 июнь; 144 (6): 815-20. doi: 10.3945/jn.113.185793. Epub 2014 3 апр.
Дж Нутр. 2014.
PMID: 24699806
Бесплатная статья ЧВК.
, Бхандари А., Андервуд М.А., Лебрилла CB, Герман Дж.Б., Бариле Д.
Даллас, округ Колумбия, и др.
Дж Нутр. 2014 июнь; 144 (6): 815-20. doi: 10.3945/jn.113.185793. Epub 2014 3 апр.
Дж Нутр. 2014.
PMID: 24699806
Бесплатная статья ЧВК.Рекомбинантные белки грудного молока.
Лённердал Б. Лённердаль Б. Программа Nestle Nutr Workshop Ser Pediatr. 2006;58:207-15; обсуждение 215-7. дои: 10.1159/000095064. Программа Nestle Nutr Workshop Ser Pediatr. 2006. PMID: 16
6 Обзор.
Посмотреть все похожие статьи
Цитируется
Эксклюзивное материнское молоко по сравнению с эксклюзивной смесью для роста и здоровья недоношенных детей с очень низкой массой тела при рождении: Фаза II проекта Pre-B и систематический обзор Центра анализа данных.

Тейлор С.Н., Фентон Т.Р., Грох-Варго С., Гура К., Мартин Ч.Р., Гриффин И.Дж., Розга М., Молони Л. Тейлор С.Н. и соавт. Фронт Педиатр. 2022, 25 февраля; 9:793311. doi: 10.3389/fped.2021.793311. Электронная коллекция 2021. Фронт Педиатр. 2022. PMID: 35280446 Бесплатная статья ЧВК.
Кобылье молоко: состав, свойства и применение в медицине.
Мусаев А., Садыкова С., Анамбаева А., Сайжанова М., Балканай Г., Кольбаев М. Мусаев А, и др. Арч Рази Инст. 2021 31 октября; 76 (4): 1125-1135. doi: 10.22092/ari.2021.355834.1725. электронная коллекция 2021 окт. Арч Рази Инст. 2021. PMID: 35096348 Бесплатная статья ЧВК. Обзор.
Коэволюция передачи сигналов липидов грудного молока и термогенной жировой ткани.

Рёсер Т. Рёзер Т. Биомолекулы. 2021 16 ноября; 11 (11): 1705. doi: 10.3390/biom11111705. Биомолекулы. 2021. PMID: 34827703 Бесплатная статья ЧВК. Обзор.
Необходимость изучения грудного молока как биологической системы.
Кристиан П., Смит Э.Р., Ли С.Е., Варгас А.Дж., Бремер А.А., Райтен Д.Дж. Кристиан П. и др. Am J Clin Nutr. 2021 8 мая; 113(5):1063-1072. дои: 10.1093/ajcn/nqab075. Am J Clin Nutr. 2021. PMID: 33831952 Бесплатная статья ЧВК.
Иммуномодулирующие белки грудного молока связаны с развитием состава тела младенцев в течение первого года лактации.
Гриднева З., Лай К.Т., Ри А., Тие В.Дж., Уорд Л.С., Мюррей К., Хартманн П.Е., Геддес Д.Т. Гриднева З. и соавт.
 Педиатр Рез. 2021 март;89(4):911-921. doi: 10.1038/s41390-020-0961-z. Эпаб 2020 21 мая.
Педиатр Рез. 2021.
PMID: 32438370
Педиатр Рез. 2021 март;89(4):911-921. doi: 10.1038/s41390-020-0961-z. Эпаб 2020 21 мая.
Педиатр Рез. 2021.
PMID: 32438370
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Атомная модель человеческого защитного белка/катепсина А предлагает структурную основу для галактосиалидоза
1. D’ Azzo A, Hoogeveen A, Reuser A J J, Robinson D, Galjaard H. Proc Natl Acad Sci USA. 1982;79:4535–4539. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. d’Azzo A, Andria G, Strisciuglio P, Galjaard H. In: The Metabolic and Molecular Bases of Inherited Disease. Скривер С. Р., Боде А. Л., Слай В. С., Валле Д., редакторы. Нью-Йорк: Макгроу-Хилл; 1995. С. 2825–2837. [Google Scholar]
3. Wenger D A, Tarby T J, Wharton C. Biochem Biophys Res Commun. 1978; 82: 589–595. [PubMed] [Google Scholar]
Biochem Biophys Res Commun. 1978; 82: 589–595. [PubMed] [Google Scholar]
4. Андрия Г., Стрисчиуглио П., Понтарелли Г., Слай В. С., Додсон В. Э. В: Сиалидазы и сиалидоз. Перспективы наследственных метаболических заболеваний. Теттаманти Г., Дюран П., Ди Донато С., редакторы. Милан, Италия: Edizioni Ermes; 1981. стр. 379–395. [Google Scholar]
5. Galjart NJ, Gillemans N, Harris A, van der Horst GTJ, Verheijen FW, Galjaard H, d’Azzo A. Cell. 1988; 54: 755–764. [PubMed] [Google Scholar]
6. Galjart NJ, Morreau H, Willemsen R, Gillemans N, Bonten EJ, d’Azzo A. J Biol Chem. 1991; 266:14754–14762. [PubMed] [Google Scholar]
7. Руденко Г., Бонтен Э. Дж., д’Аццо А., Хол В. Г. Дж. Структура. 1995; 3: 1249–1259. [PubMed] [Google Scholar]
8. Bonten E J, Galjart N J, Willemsen R, Usmany M, Vlak J M, d’Azzo A. J Biol Chem. 1995;270:26441–26445. [PubMed] [Google Scholar]
9. Jackman H L, Tan F L, Tamei H, Buerling-Harbury C, Li X Y, Skidgel R A, Erdos E G. J Biol Chem. 1990; 265:11265–11272. [PubMed] [Google Scholar]
J Biol Chem. 1990; 265:11265–11272. [PubMed] [Google Scholar]
10. Jackman H L, Morris P W, Deddish P A, Skidgel R A, Erdos E G. J Biol Chem. 1992; 267: 2872–2875. [PubMed] [Google Scholar]
11. Hanna W L, Turbov J M, Jackman H L, Tan F, Froelich C J. J Immunol. 1994; 153:4663–4672. [PubMed] [Google Scholar]
12. Verheijen F, Brossmer R, Galjaard H. Biochem Biophys Res Commun. 1982;108:868–875. [PubMed] [Google Scholar]
13. Verheijen FW, Palmeri S, Hoogeveen AT, Galjaard H. Eur J Biochem. 1985; 149: 315–321. [PubMed] [Google Scholar]
14. Томас Г. Х., Боде А. Л. В: Метаболические и молекулярные основы наследственных заболеваний. Скривер С. Р., Боде А. Л., Слай В. С., Валле Д., редакторы. Нью-Йорк: Макгроу-Хилл; 1995. С. 2529–2561. [Google Scholar]
15. Suzuki Y, Sakuraba H, Oshima A. In: Метаболические и молекулярные основы наследственных заболеваний. Скривер С. Р., Боде А. Л., Слай В. С., Валле Д., редакторы. Нью-Йорк: Макгроу-Хилл; 1995. стр. 2785–2823. [Google Scholar]
стр. 2785–2823. [Google Scholar]
16. Zhou X-Y, Galjart NJ, Willemsen R, Gillemans N, Galjaard H, d’Azzo A. EMBO J. 1991;10:4041–4048. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Shimmoto M, Fukuhara Y, Itoh K, Oshima A, Sakuraba H, Suzuki Y. J Clin Invest. 1993; 91: 2393–2398. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Zhou X-Y, van der Spoel A, Rottier R, Hale G, Willemsen R, Berry G T, Strisciuglio P, Andria G, d’Azzo A. Hum Mol Genet . 1996;5:1977–1987. [PubMed] [Google Scholar]
19. Neufeld E F. Annu Rev Biochem. 1991; 60: 257–280. [PubMed] [Google Scholar]
20. Ляо Д-И, Бреддам К., Свит Р. М., Буллок Т., Ремингтон С. Дж. Биохимия. 1992; 31: 9796–9812. [PubMed] [Google Scholar]
21. Элслигер М.-А., Потье М. Белки: структура, функция и генетика. 1994; 18:81–93. [PubMed] [Google Scholar]
22. Jones TA, Zou JY, Cowan SW, Kjeldgaard M. Acta Crystallogr A. 1991; 47:110–119. [PubMed] [Академия Google]
23. Проект совместных вычислений. Acta Crystallogr D. 1994;50:760–763. [PubMed] [Google Scholar]
Проект совместных вычислений. Acta Crystallogr D. 1994;50:760–763. [PubMed] [Google Scholar]
24. Kraulis P J. J Appl Crystallogr. 1991; 24: 946–950. [Google Scholar]
25. Merritt E A, Murphy M E P. Acta Crystallogr D. 1994; 50:869–873. [PubMed] [Google Scholar]
26. Galjart NJ, Gillemans N, Meijer D, d’Azzo A. J Biol Chem. 1990; 265:4678–4684. [PubMed] [Google Scholar]
27. Эндрицци Дж. А., Бреддам К., Ремингтон С. Дж. Биохимия. 1994; 33:11106–11120. [PubMed] [Академия Google]
28. Harpaz Y, Gerstein M, Chothia C. Structure. 1994; 2: 641–649. [PubMed] [Google Scholar]
29. Williamson D. Blood Rev. 1993; 7:146–163. [PubMed] [Google Scholar]
30. Wilson C, Wardell MR, Weisgraber KH, Mahley RW, Agard DA. Science. 1991; 252:1817–1822. [PubMed] [Google Scholar]
31. Wilson C, Mau T, Weisgraber KH, Wardell MR, Mahley RW, Agard DA. Structure. 1994; 2: 713–718. [PubMed] [Google Scholar]
32. Цанг Т.С., Бентли Д.Р., Мибашан Р.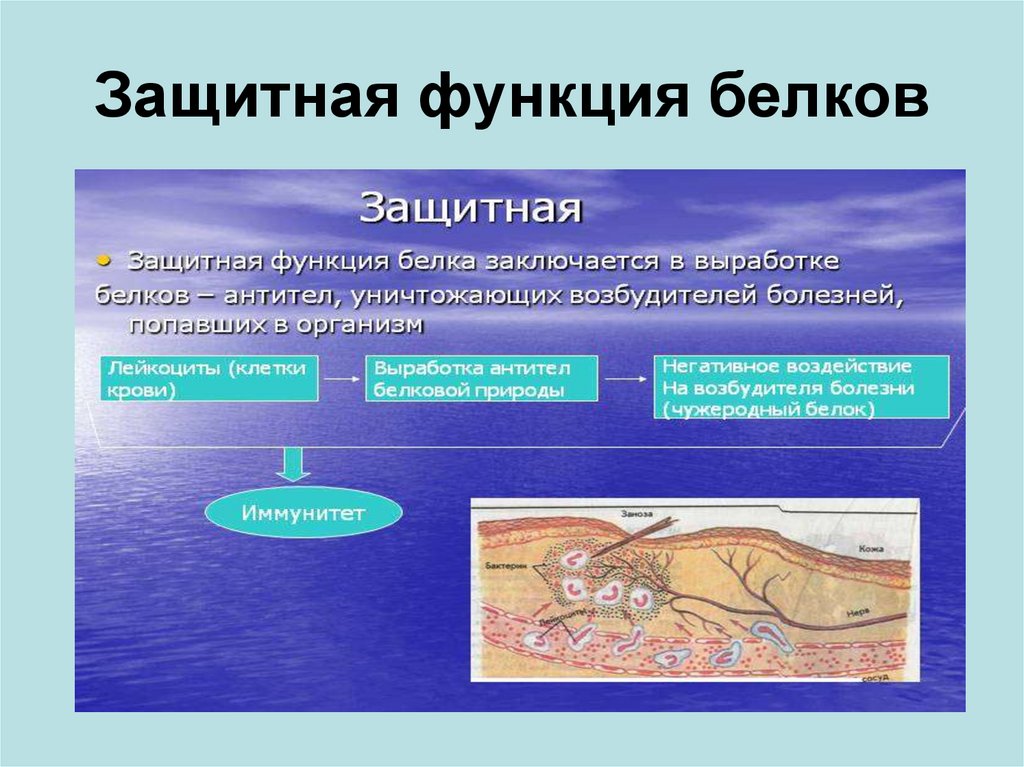 С., Джаннелли Ф. EMBO J. 1988;7:3009–3015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
С., Джаннелли Ф. EMBO J. 1988;7:3009–3015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Хамагути Н., Робертс Х., Стаффорд Д. В. Биохимия. 1993; 32: 6324–6329. [PubMed] [Google Scholar]
34. Lin S-W, Lin CN, Hamaguchi N, Smith KJ, Shen MC. Кровь. 1994; 84: 1866–1873. [PubMed] [Google Scholar]
35. Cooper D N. Ballière’s Clinical Haemotology. 1994; 7: 637–674. [PubMed] [Google Scholar]
36. Stein PE, Carrell R W. Nat Struct Biol. 1995; 2: 96–113. [PubMed] [Академия Google]
37. Танака К., Йокота И., Коутс П.М., Штраус А.В., Келли Д.П., Чжан З., Грегерсен Н., Андресен Б.С., Мацубара И., Кертис Д., Чен И. Т. Hum Mutat. 1992; 1: 271–279. [PubMed] [Google Scholar]
38. Андресен Б. С., Дженсен Т. Г., Бросс П., Кнудсен И., Винтер В., Кёльвраа С., Болунд Л., Дин Дж. Х., Чен И. Т., Ван Хоув Дж. Л. К., Кертис Д., Йокота И., Танака К. , Пак Ким Дж. Дж., Грегерсен Н. Ам Дж. Хам Генет. 1994; 54: 975–988. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39.

 ..
..
 edu
edu
 , Бхандари А., Андервуд М.А., Лебрилла CB, Герман Дж.Б., Бариле Д.
Даллас, округ Колумбия, и др.
Дж Нутр. 2014 июнь; 144 (6): 815-20. doi: 10.3945/jn.113.185793. Epub 2014 3 апр.
Дж Нутр. 2014.
PMID: 24699806
Бесплатная статья ЧВК.
, Бхандари А., Андервуд М.А., Лебрилла CB, Герман Дж.Б., Бариле Д.
Даллас, округ Колумбия, и др.
Дж Нутр. 2014 июнь; 144 (6): 815-20. doi: 10.3945/jn.113.185793. Epub 2014 3 апр.
Дж Нутр. 2014.
PMID: 24699806
Бесплатная статья ЧВК.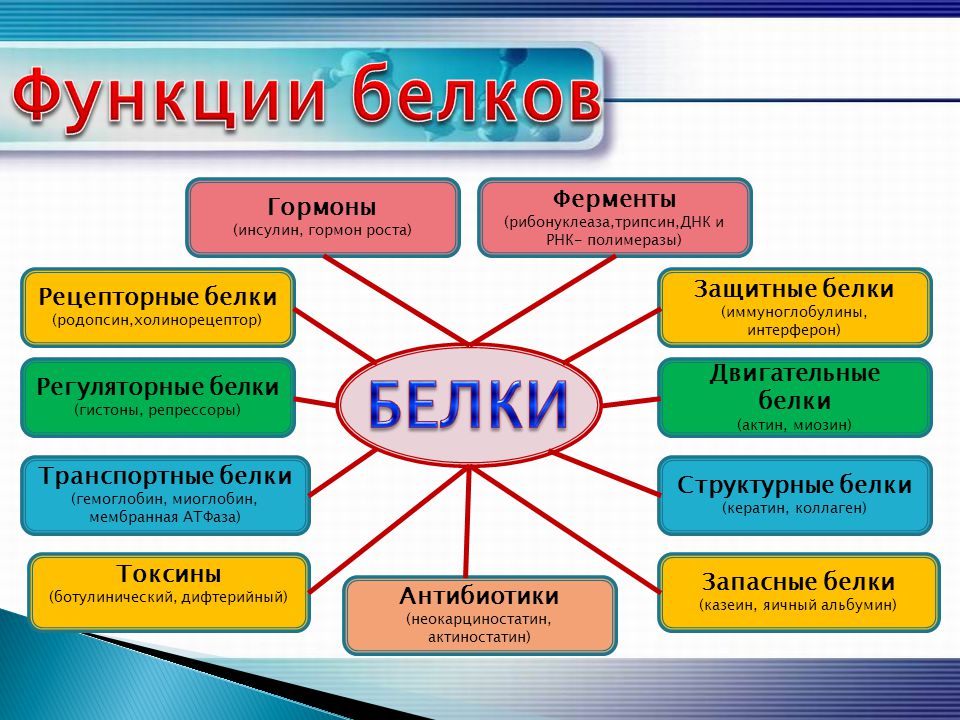

 Педиатр Рез. 2021 март;89(4):911-921. doi: 10.1038/s41390-020-0961-z. Эпаб 2020 21 мая.
Педиатр Рез. 2021.
PMID: 32438370
Педиатр Рез. 2021 март;89(4):911-921. doi: 10.1038/s41390-020-0961-z. Эпаб 2020 21 мая.
Педиатр Рез. 2021.
PMID: 32438370
Leave A Comment