Наиболее известны выпускаемые этой фирмой поверхностно-активные вещества под торговыми наименованиями Спан (сложные эфиры сорбитана и высших жирных кислот, растворимые в масле) и Твин (растворимые в воде полиоксиэтилированные продукты, получаемые из Спана ). [c.179]
Дания лучшей устойчивости такой суспензии порошок какао обрабатывают ш,елочными растворами. В результате омыления жиров, входящих в состав какао-масла, на поверхности частиц какао осаждается небольшое количество солей жирных кислот, растворимых в воде, которые, являясь ПАВ, стабилизируют, суспензию в воде.
Олеиновая кислота применяется для изготовления мазей для чистки металлов. Калиевая соль ее образует мягкое, или медицинское, мыло (стр. 161). Свинцовая соль олеиновой кислоты, в отличие от свинцовых солей насыш,енных жирных кислот, растворима в эфире. Пользуясь этим свойством ее выделяют из смеси с другими кислотами при анализе жиров. Олеиновая кислота является сильно выраженным поверхностно активным веществом. [c.134]
Натриевые и калиевые соли жирных кислот растворимы в воде и представляют собой мыла (стр. 148) соли щелочноземельных [c.122]
Жирные кислоты, растворимые в петролейном эфире, разделяли по растворимости свинцовых солей [6,7]. Получено 81% кислот, свинцовые соли которых растворимы в серном эфире. [c.100]
Единственным эффективным катализатором карбонилирования олефинов является кобальт, который можно применять в виде мелкораздробленного металла или различных его соединений, особенно солей нафтеновых и жирных кислот, растворимых в органических жидкостях. В настоящее время общепринято, что в условиях карбонилирования все эти вещества переходят в карбонилы кобальта, которые и являются истинными катализаторами процесса.
Все жирные кислоты растворимы в спирте и эфире. Удельные веса у низших членов ряда больше единицы с повышением молекулярного веса удельные веса уменьшаются. [c.260]
В процессе переваривания жира играет весьма важную роль желчь она способствует эмульгированию жира, активирует липазу поджелудочной железы, необходимую для гидролиза жира, и образует с высшими жирными кислотами растворимые в воде комплексы, легко всасывающиеся стенкой кишечника. [c.140]
Щелочные водные растворы. Воздействие щелочных растворов на продукты нефтепереработки и другие жировые загрязнения обусловлено в значительной степени способностью щелочей понижать поверхностное натяжение, способствуя тем самым диспергированию частиц загрязнений, размягченных при повышенной температуре растворов. Одновременно при воздействии щелочных растворов с высоким pH на загрязнения, содержащие жирные кислоты (стеариновую, пальмитиновую и др.), происходит омыление последних — образование солей жирных кислот, растворимых в воде, либо переходящих в коллоидное состояние, что также способствует их удалению.
Удельный вес жирных кислот меньше единицы, т. е. они легче воды. Жирные кислоты, за исключением низкомолекулярных, практически в воде не растворяются. В органических растворителях (спирте, этиловом и петролейном эфирах, бензола, сероуглероде, четыреххлористом углероде и т. п.) жирные кислоты растворимы. С увеличением молекулярного веса жирных кислот их растворимость в органических растворителях снижается. Оксикислоты практически нерастворимы в петролейном эфире и холодном бензине, но растворимы в этиловом эфире и спирте.
Метод Бертрама неприменим для анализа масел, содержащих насыщенные кислоты с числом углеродных атомов в цепи менее 10 (например, кокосовое масло), так как магниевые соли низших жирных кислот растворимы в воде. [c.111]
Фотоколориметрические методы основаны на образовании окрашенной медной соли жирной кислоты, растворимой в хлороформе в присутствии триэтаноламина.
Диэфиры полиэтилен- и полипропиленгликолей с длинноцепочечными жирными кислотами растворимы в моторных бензинах- и частично в минеральных маслах. Они могут применяться для двухтактных двигателей, обеспечивая достаточную степень смазывания при незначительном образовании отложений на выхлопных окнах при содержании 0,5—1,0% (масс.) масла в топливе [6.111]. [c.121]
Наиболее эффективным катализатором гидроформилирования олефинов является кобальт, который можно применять в виде мелкораздробленного металла или различных его соединений, особенно солей нафтеновых и жирных кислот, растворимых в органических жидкостях. В настоящее время общепринято, что в усло-
В качестве инициаторов полимеризации могут быть применены такие вещества, как перекись бензоила или перекиси жирных кислот, растворимые в мономере, но в обычных системах полимеризации они значительно менее эффективны, чем водорастворимые инициаторы (например, перекись водорода, персульфат калия, диазониевые соли и др.). В промышленности применяют главным образом соли надкислот, например персульфаты или пербораты. Выбор инициатора зависит и от природы других компонентов полимеризуемой смеси. [c.365]
Стабилизаторы, инертные в отношении распада ПВХ, по своему действию, по-видимому, близки к свинцовым солям, однако с тем различием, что они (преимущественно соли жирных кислот) растворимы в полимере и поэтому на их основе получаются прозрачные изделия.
Растворимость эпоксидных смол, модифицированных жирными кислотами, зависит от содержания жирных кислот. Неэтерифицированные эпоксидные смолы растворяются в сильно полярных растворителях, например кетонах. Смолы с небольшим содержанием жирных кислот
Урок 2. Липиды, их структура и функции
Липиды – небольшие молекулы, их молекулярная масса составляет несколько сотен дальтон. Обычно в молекулах липидов имеются и гидрофильные, и гидрофобные группы, но в целом липиды имеют гидрофобные свойства. Липиды плохо растворимы в воде, зато хорошо растворяются в органических растворителях (спирте, ацетоне, хлороформе). Исторически липиды были выделены в отдельный класс веществ именно по этому признаку – как соединения, растворимые не в воде, а в менее полярных органических растворителях. К липидам относятся такие соединения, как фосфолипиды, нейтральные жиры, стероиды и воска. В живых организмах липиды выполняют несколько важных функций.
Структурная функция
Все клетки отграничены от окружающей среды наружной мембраной, которая примерно наполовину (по массе) состоит из липидов и наполовину – из белков. Способность липидов выполнять структурную функцию не ограничивается клеточным уровнем: медоносная пчела лепит свои соты из воска, из воскоподобных веществ состоит и кутикула наземных растений – тонкий слой на поверхности листьев и стеблей, уменьшающий испарение.
Энергетическая функция
Клетка может окислять липиды и использовать выделяющуюся энергию для своих нужд. При окислении нейтральных до углекислого газа и воды жиров выделяется много энергии – около 9,3 килокалорий на грамм. Жиры часто служат запасными питательными веществами. У высших позвоночных животных для этой цели используется особая ткань – жировая клетчатка. У растений запасы жиров нередко встречаются в семенах.
Регуляторная функция
Липиды могут выполнять и ряд других функций. Так, накопление липидов организмами планктона и нектона уменьшает их удельный вес и облегчает плавание в толще воды (такой механизм используют также акулы). Подкожная жировая клетчатка может служить механической защитой для внутренних органов, а у теплокровных животных она является теплоизолятором.
В молекулах фосфолипидов присутствуют различные по химическим свойствам составные части: «головка» и два «хвоста». В состав головки входят остатки глицерина, фосфорной кислоты и спирта. «Головка» гидрофильна и электрически заряжена, вода охотно с ней взаимодействует. «Хвосты» представляют собой остатки жирных кислот, содержащие множество СН2-групп. Поляризация связи С–Н очень слабая, так что «хвосты» вполне гидрофобны, и они «стремятся» избежать взаимодействия с водой.
|
Рис. 1. Фосфолипид фосфатидилхолин |
В состав фосфолипидов входят как насыщенные жирные кислоты, не содержащие двойных связей, так и ненасыщенные. Очень распространенными жирными кислотами являются пальмитиновая CH3(CH2)14COOH, стеариновая CH3(CH2)16COOH, олеиновая CH3(CH2)7–СH=CH–(CH2)7COOH, пальмитоолеиновая CH3(CH2)5–СH=CH–(CH2)7COOH. В состав одной молекулы фосфолипида обычно входят остатки разных жирных кислот, причем ненасыщенная жирная кислота обычно располагается ближе к фосфату. Природные липиды содержат в основном цис-изомеры ненасыщенных жирных кислот. Транс-изомеры образуются при искусственной переработке растительных жиров – например, при получении маргарина. В последнее время выяснилось, что потребление транс-изомеров жирных кислот вредно для здоровья: оно увеличивает риск возникновения атеросклероза и онкологических заболеваний.
|
Рис. 2. Ионы пальмитиновой и олеиновой кислот |
Если молекулы фосфолипидов поместить на поверхность водного слоя, то, очевидно, что гидрофильные «головки» будут обращены в воду, а гидрофобные «хвосты» будут выталкиваться из воды. Образуется монослой – поверхностная пленка толщиной в одну молекулу. Если же «затолкать» молекулы фосфолипидов в воду целиком, то тогда «головки» будут обращены к воде (наружу), а «хвосты» – от воды (внутрь). Такие небольшие скопления молекул называются мицеллами.
|
Рис. 3. Структуры, образуемые фосфолипидами в воде |
К образованию мицелл более склонны не фосфолипиды, а жирные кислоты, имеющие только один гидрофобный «хвост» – мицеллы получаются, например, при растворении мыла в воде
Фосфолипиды чаще образуют другую структуру – липидный бислой. В составе бислоя молекулы фосфолипидов располагаются в два ряда: «головки» будут обращены к воде, а «хвосты» упрятаны внутрь. Липидный бислой составляет основу всех клеточных мембран – мембрана представляет собой «липидное озеро», в котором плавают белки.
Липидный бислой непроницаем для заряженных ионов – они не могут проникнуть через его гидрофобную центральную зону. Для того чтобы транспортировать ионы через мембрану, в клетке имеются специальные белки-переносчики. Через бислой не могут пройти крупные молекулы – белки, полисахариды, нуклеиновые кислоты. Липидный бислой проницаем для небольших гидрофобных молекул, а также для совсем мелких полярных, но не заряженных – таких как Н2О, СО2, а также О2.
Нейтральные жиры представляют собой эфиры глицерина и остатков трех жирных кислот. Они более гидрофобны, чем фосфолипиды, и располагаются внутри клетки в виде нерастворимых жировых включений.
|
Рис. 4. Модель молекулы тристеарата |
В состав жиров также могут входить остатки насыщенных и ненасыщенных жирных кислот. Первые преобладают в животных жирах, а вторые – в растительных. Насыщенные жирные кислоты имеют более высокую температуру плавления, поэтому подсолнечное масло при комнатной температуре является жидкостью, а сливочное масло и говяжий жир – твердыми телами. В состав жиров сливочного масла входят насыщенные кислоты с меньшим числом углеродных атомов, чем у жиров говяжьего жира, поэтому сливочное масло плавится при меньшей температуре. Как и молекулы фосфолипидов, молекулы нейтральных жиров обычно содержат остатки разных жирных кислот.
Жирные кислоты могут синтезироваться из углеводов и аминокислот, из-за этого ожирение наступает при избыточном питании не только жирами, но и другими продуктами.
Еще один класс липидов – стероиды. Это небольшие гидрофобные молекулы, производные холестерина. Они содержат в своем составе систему связанных углеводородных колец – три шестиатомных и одно пятиатомное. Стероидами являются такие гормоны надпочечников, как глюкокортикоиды (например, кортизол), играющие важнейшую роль в развитии стресса, и минералокортикоиды (альдостерон), уменьшающие выведение почками воды и ионов натрия из организма. К стероидным относятся мужские и женские половые гормоны (тестостерон и эстрадиол), а также прогестины (прогестерон).
|
Рис. 5. Холестерин и два стероидных гормона |
В печени из холестерина синтезируются желчные кислоты, которые затем поступают в желчь. Эти соединения содержат как гидрофильные, так и гидрофобные группы. В водной среде они легко образуют мицеллы. В просвете кишечника в эти мицеллы включаются молекулы жиров из съеденной пищи – сами по себе нейтральные жиры почти нерастворимы, а в составе мицелл образуют эмульсию и становятся доступными для действия пищеварительных ферментов.
Сам холестерин – не гормон, а необходимый компонент клеточных мембран у высших организмов; у бактерий он встречается редко.
Интересен механизм действия стероидных гормонов на клетки-мишени. Стероиды – это небольшие гидрофобные молекулы, они легко проникают через наружную мембрану клетки. Белки-рецепторы, связывающие эти гормоны, расположены в цитоплазме. После связывания со стероидом белок-рецептор активируется и идет из цитоплазмы в ядро. В ядре гормон-рецепторный комплекс связывается с ДНК и регулирует активность некоторых генов (ДНК и гены рассматриваются на уроке 8). Каждый класс стероидных гормонов имеет свои собственные рецепторы и регулирует только определенные гены.
|
Рис. 6. Механизм действия стероидных гормонов |
Так, глюкокортикоиды – гормоны стресса – активируют различные гены, отвечающие за обеспечения организма энергией, и угнетают гены, отвечающие за накопление запасных питательных веществ. Ведь стрессовая реакция служит для мобилизации организма на борьбу или бегство, а тут уж не до запасания. Минералокортикоиды активируют гены фермента Na+/K+–АТФазы, который возвращает в кровь из первичной мочи натрий, а вместе с ним и воду.
Еще одна группа важнейших регуляторов жизнедеятельности организма – это простагландины. Они образуются из арахидоновой кислоты – одной из полиненасыщенных жирных кислот. Сперва простагландины были обнаружены в предстательной железе – простате – с чем и связано их название, однако вскоре они были найдены в самых разных клетках, тканях и органах.
Простагландины иногда называют тканевыми гормонами. Дело в том, что в организме у них довольно короткое время жизни, поэтому они действуют локально, в том же органе, в котором и вырабатываются.
|
Рис. 7. Слева – арахидоновая кислота, справа – простагландин Е2 |
Существует много разных классов простагландинов, они обладают различным, иногда прямо противоположным физиологическим действием. Так, простагландин Е2 расширяет стенки кровеносных сосудов, увеличивает их проницаемость, это вещество вырабатывается при воспалении и вызывает многие его симптомы. Простагландин F2 действует на сосуды противоположным образом – сужает и уменьшает проницаемость – он обладает противовоспалительным действием. Однако при беременности эти соединения действуют одинаково, усиливая сокращения гладкой мускулатуры матки.
Простагландин I2 (простациклин) препятствует агрегации тромбоцитов и тормозит свертывание крови, тогда как тромбоксан А2 (очень похожее на простагландины вещество, тоже синтезируемое из арахидоновой кислоты) активирует эти два процесса.
Еще один класс производных арахидоновой кислоты – лейкотриены – играют ключевую роль в развитии такой тяжелой болезни как бронхиальная астма. Они вызывают сокращение гладких мышц дыхательных путей, что приводит к спазму бронхов и неукротимому кашлю, без специальной медицинской помощи больной может задохнуться и умереть.
Широко распространенное лекарство аспирин угнетает синтез простагландинов. Оно обладает противовоспалительным и жаропонижающим действием.
В организме человека всасывание липидов происходит в тонком кишечнике. Жирные кислоты и глицерин поступают из просвета кишки в клетки эпителия кишечника. Там из них синтезируются нейтральные жиры, которые в комплексе со специальными белками и холестерином образуют особые частицы диаметром 0,1–1 мкм – хиломикроны. Хиломикроны поступают из клеток кишечника в лимфатическую систему, затем в кровоток и разносятся по всему организму.
Кроме хиломикронов, перенос жиров от одной ткани к другой осуществляют т. н. липопротеины очень низкой плотности (ЛПОНП). Они образуются в печени – там синтезируется и белковая, и жировая часть этих комплексов, а к другим тканям переносятся с кровотоком. ЛПОНП также содержат холестерин. После усвоения жиров различными тканями организма липопротеиновые частицы, содержащие холестерин, становятся т. н. липопротеинами низкой плотности (ЛПНП). На поверхности почти всех клеток человеческого организма есть специальные белки–рецепторы ЛПНП. Когда ЛПНП связываются с этими рецепторами, клетка поглощает их, внутри клетки холестерин освобождается и используется для клеточных нужд.
|
Рис. 8. Усвоение холестерина клеткой через ЛПНП |
При развитии опасного заболевания, атеросклероза, холестерин начинает откладываться на стенках кровеносных сосудов, образуя т. н. склеротические бляшки. Это может привести к закупорке и повреждению сосудов. Больным атеросклерозом часто назначают диету с пониженным содержанием холестерина, однако этот липид в значительных количествах вырабатывается в самом организме, так что такая диета не может предотвратить развитие заболевания.
Механизм развития атеросклероза изучен далеко не полностью. По-видимому, на первом этапе происходит самопроизвольное окисление жирных кислот, содержащихся в ЛПНП. Такие «испорченные» липопротеины откладываются на стенках кровеносных сосудов, что вызывает прикрепление к измененной сосудистой стенке защитных клеток – макрофагов. Макрофаги, прикрепленные к стенке сосуда, начинают активно поглощать из плазмы крови холестерин, причем не через рецепторы ЛПНП, а через совсем другие, т. н. рецепторы-мусорщики. Макрофаг оказывается напичканным холестерином, он и дает начало склеротической бляшке. Известно, что у людей с наследственными дефектами рецепторов ЛПНП атеросклероз развивается уже в детском возрасте.
Запасание триглицеридов происходит в специальной ткани – жировой клетчатке. При голодании в клетках этой ткани происходит распад триглицеридов, и свободные жирные кислоты переносятся к другим органам белком плазмы крови – сывороточным альбумином.
Краткое содержание урока
|
Свойства жиров — урок. Химия, 8–9 класс.
Физические свойства
Различают жиры растительные и животные.
Растительные жиры часто называют маслами (подсолнечное, кукурузное, оливковое, рапсовое). При комнатной температуре они находятся в жидком агрегатном состоянии. Но есть и исключения. Например, кокосовое масло при обычных условиях — твёрдый жир.

Оливковое масло
Жиры животного происхождения при комнатной температуре, как правило, находятся в твёрдом агрегатном состоянии, но при небольшом нагревании становятся жидкими. Реже встречаются жидкие животные жиры, например, рыбий жир. Твёрдые жиры не имеют кристаллического строения и представляют собой мазеподобные субстанции.

Сливочное масло
Температура плавления жира зависит от его состава.
В состав твёрдых жиров входят преимущественно остатки высших насыщенных карбоновых кислот (пальмитиновой и стеариновой).
В состав растительных масел входят преимущественно глицериды высших ненасыщенных карбоновых кислот (олеиновой и др.).
Все жиры легче воды и в воде не растворяются. Растворить жир можно органическим растворителем — бензином, хлороформом, бензолом.
Химические свойства
- Жидкий жир может присоединять водород, т. е. подвергаться гидрированию. Радикалы ненасыщенных кислот превращаются в радикалы насыщенных карбоновых кислот, и жир становится твёрдым. Так растительные масла превращают в твёрдые жиры и получают маргарин.

Маргарин
- Жиры могут вступать в реакцию с водой в присутствии минеральных кислот. Происходит кислотный гидролиз (разложение водой). При этом образуются глицерин и карбоновые кислоты:
- Если гидролиз проводят в присутствии щёлочи, то происходит омыление жира. В результате образуются соли карбоновых кислот, которые называют мылами:
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 221 с.
Жиры | CHEMEGE.RU
| Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами). . |

Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:

| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С17Н33СООН (содержит одну двойную связь в радикале) СН3—(СН2)7—СН = СН—(СН2)7—СООН |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С17Н31СООН (две двойные связи в радикале) СН3-(СН2)4-СН = СН-СН2-СН = СН-СООН |
| Стеариновая кислота С17Н35 — СООН | Линоленовая кислота С17Н29СООН (три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:

Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |

1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия. |

2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |

| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca2+ и Mg2+ дают с высшими кислотами нерастворимые в воде соли.
| Например, тристеарат глицерина взаимодействует с сульфатом кальция |

Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата.

Далее алкилсульфат гидролизуется щелочью:

Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Введение в биологию (V) — caenogenesis — LiveJournal
Тема VЛИПИДЫ И МЕМБРАНЫ
В отличие от белков или углеводов, липиды не имеют никакой общей формулы. Это просто собирательное название всех гидрофобных биологически активных соединий. Вот, например, холестерин, спирт с огромной гидрофобной частью. Его производные — стероидные гормоны, которые вырабатываются у человека корой надпочечников и половыми железами. Все они относятся к липидам.

Заодно начнем привыкать к тому, что такие сложные формулы, как правило, не рисуют целиком, до каждого атома. На подобной формуле любой уголок обозначает атом углерода, у которого все свободные валентности по умолчанию заполнены атомами водорода. А если убрать единственную здесь двойную связь, то оставшееся ядро из четырех колец (трех шестиугольников и одного пятиугольника) будет называться замечательным словом “циклопентанпергидрофенантрен”. Это и есть основа для создания разнообразных стероидов, формулами которых загромождать изложение не будем.

Другая важная группа липидов — жирные кислоты, то есть карбоновые кислоты с длинными (10-20 атомов углерода и больше) углеводородными “хвостами”. Чем длиннее “хвост”, тем хуже кислота растворяется в воде. Жирные кислоты, у которых в цепочке более 12 атомов углерода, называют высшими. 
Жирные кислоты бывают насыщенные (без двойных связей в углеводородной цепочке) или ненасыщенные (с двойными связями). Насыщенные высшие жирные кислоты при комнатной температуре — твердые вещества, а ненасыщенные — жидкости. Связано это с более компактной упаковкой насыщенных «хвостов», в которых нет создаваемых двойными связями изломов и изгибов.

Несколько примеров жирных кислот: линолевая, олеиновая, пальмитиновая, стеариновая, линоленовая. Ненасыщенные жирные кислоты особенно распространены у растений (например, в растительных маслах).
У насыщенных жирных кислот «хвосты» прямые, у ненасыщенных изогнутые в местах двойных связей. Из-за этого молекула может приобрести причудливую форму, особенно если двойных связей несколько. На картинке — модель молекулы линоленовой кислоты, у которой в «хвосте» три двойных связи.

В водном растворе молекулы жирных кислот и их солей образуют мицеллы — шарообразные скопления, где гидрофобные “хвосты” обращены внутрь, минимизируя контакт с водой, а гидрофильные “головки” — наружу, поскольку они-то взаимодействуют с водой хорошо. Это довольно обычное поведение вещества, в молекуле которого есть одновременно гидрофобная и гидрофильная группы.

Жирные кислоты, а вернее их соли, постоянно используются человеком в качестве моющих средств. На картинке — один из самых распространенных компонентов мыла, стеарат натрия (соль стеариновой кислоты). Четко выделена гидрофильная головка, а остальная часть молекулы представляет собой гидрофобный хвост.

Механизм моющего действия мыла следующий. В сосуде слева молекулы мыла просто образуют мицеллу. В сосуде справа они растворяют свои углеводородные хвосты в капле “грязи” (которая, как правило, гидрофобна) и разбивают ее на мелкие капельки, которые легко смыть. Вещества с такой активностью называются детергентами.

Детергенты бывают очень разными по химической структуре; их гидрофильные части могут быть положительно заряженными, отрицательно заряженными или вовсе незаряженными, а просто полярными. Но молекула любого детергента обязательно включает гидрофобный «хвост» и гидрофильную «головку». Довольно много соединений такого типа входит в состав живых организмов.

Вспомним, что любая карбоновая кислота может образовать с любым спиртом сложный эфир. При этом от кислоты отщепится -OH, от спирта -H, они образуют воду, а остатки кислоты и спирта замыкаются в единую молекулу со сложноэфирной группой -CO-O- посредине. Спиртом, участвующим в этой реакции, вполне может быть и глицерин, у которого гидроксильных групп три. Сложный эфир глицерина и трех жирных кислот называется жиром.

Типичный пример жира, в данном случае ненасыщенного (из трех остатков жирных кислот ненасыщенных тут два). Растительные масла — жидкие, потому что в них больше ненасыщенных жиров, чем у животных. Хотя в целом и насыщенные, и ненасыщенные жирные кислоты есть и у тех и у других, различается только их вклад.

Жиры — ценные источники энергии, именно поэтому они часто запасаются в клетках соединительной ткани у животных, как вот, например, у суслика.

А теперь познакомимся с еще одним важным для нас соединением — фосфорной кислотой (H3PO4). Напомним, что валентность фосфора — 5. На картинке присутствуют два способа изображения молекулы: графическая формула, игнорирующая пространственное расположение связей, и структурная, показывающая его. Вновь будем иметь в виду, что “фосфорная кислота” и “фосфат” (то есть ее соль) в биохимии практически синонимы, в подавляющем большинстве случаев эти понятия свободно заменяются друг на друга.

Сложный эфир глицерина, двух жирных кислот и фосфорной кислоты называется фосфолипидом. Можно сказать, что фосфолипид — это как бы жир, у которого вместо одного из остатков жирных кислот тем же способом присоединен фосфат. Такая молекула состоит из гидрофильной “головки” (включающей остатки глицерина и фосфата) и двух гидрофобных “хвостов” (жирных кислот). При фосфате бывают еще дополнительные боковые цепи, у разных фосфолипидов разные.

Один из самых распространенных фосфолипидов — фосфатидилхолин. Он приведен только в качестве примера. В других фосфолипидах на месте холина может быть аминокислота серин или что-нибудь еще.

Именно из фосфолипидов в основном состоят клеточные мембраны. Тут используется их физическое свойство: собираться в воде в двойной слой гидрофобными “хвостами” внутрь и гидрофильными “головками” наружу. Замкнутый пузырек, образованный таким двойным слоем молекул, называется везикулой. Вся клеточная мембрана — это в некотором смысле сильно разросшаяся везикула.
На картинке показано, как на границе гидрофильного раствора (вода) и гидрофобного (масло) молекулы фосфолипидов ориентируются хвостами в сторону масла, а головками в сторону воды. Если же никакого масла поблизости нет, то молекулы фосфолипидов располагаются головками в сторону воды, а хвостами друг к другу, и получается двойной слой, который сразу замыкается в везикулу, чтобы не было неустойчивых свободных краев. Это чисто физическое явление, которое запросто может иметь место и вне живых клеток.

Вот схема того, как фосфолипиды «собираются» в клеточную мембрану. Молекула фосфолипида нарисована двумя способами — во всех деталях (в качестве примера тут взят уже знакомый нам фосфатидилхолин) и в виде головки с двумя хвостиками. Таким молекулы собираются в двойной слой хвостиками друг к другу, головками к воде. Справа — простейшая схема участка типичной мембраны.

На самом деле биологические мембраны никогда не состоят только из одних фосфолипидов. Типичная клеточная мембрана — фосфолипидный бислой во встроенными в него интегральными белками, которые обычно являются или рецепторными (принимают сигналы из внешней среды и передают их внутрь клетки), или транспортными (переносят те или иные молекулы с одной стороны мембраны на другую). Часть белка, проходящая сквозь образованный «хвостами» внутренний слой мембраны, как правило, представляет собой альфа-спираль, целиком состоящую из гидрофобных аминокислот, боковые цепи которых торчат наружу. Если белок достаточно сложный, таких альфа-спиралей вполне может быть несколько. Кроме того, к мембранным белкам снаружи часто прикреплены ковалентными связями дополнительные цепочки, состоящие не из аминокислот, а из углеводов. Они бывают нужны в первую очередь для взаимодействия между клетками.

Тут мы видим кое-какие дополнительные детали. Во-первых, кроме фосфолипидов в мембране есть холестерин — его молекулы раскрашены желтым (если сравнить с уже знакомой нам формулой холестерина, видно, что каждая молекула своей гидроксильной группой обращена к воде, а массивной гидрофобной частью внутрь мембраны). Во-вторых, изнутри ко многим интегральным белкам прикреплены элементы цитоскелета — внутриклеточной системы опорных структур, тоже состоящей из белков. Но обе эти особенности есть далеко не у всех клеток.
В целом можно назвать как минимум три основные функции липидов: энергетическая (жиры), структурная (фосфолипиды, холестерин) и сигнальная (стероиды). Но надо иметь в виду, что липиды в силу самой природы этого сборного понятия крайне разнообразны, даже при том, что они (в отличие от белков) не являются полимерами. Мы обсудили далеко не все их группы.
Муравьиная кислота — простейший представитель насыщенных карбоновых кислот. В молекуле муравьиной кислоты содержится один атом углерода (как у метана), поэтому её ещё называют метановой кислотой. Это единственная кислота, в которой карбоксильная группа соединена с атомом водорода, а не с углеводородным радикалом.
Строение молекулы муравьиной кислоты можно представить следующим образом:
Сокращённая структурная формула муравьиной кислоты HCOOH, а молекулярная формула — Ch3O2.
Муравьиная кислота — резко пахнущая жидкость, хорошо растворимая в воде. Она ядовита. При попадании на кожу вызывает ожоги.
Содержится в выделениях муравьёв, в жгучих волосках крапивы, в хвое сосны.

Уксусная кислота — гомолог муравьиной. В её молекуле — два атома углерода, один из которых входит в состав функциональной группы. Другое название уксусной кислоты — этановая.

Сокращённая формула уксусной кислоты Ch4COOH, молекулярная — C2h5O2.
Уксусная кислота — бесцветная жидкость с характерным резким запахом, неограниченно растворимая в воде.
При температуре \(16,5\) °С безводная уксусная кислота превращается в твёрдое кристаллическое вещество, похожее на лёд. Поэтому её иногда называют ледяной уксусной кислотой.
Ледяная уксусная кислота
\(70\)–\(80\) % раствор уксусной кислоты называют уксусной эссенцией, а \(5\)–\(9\) % раствор применяется в быту под названием столового уксуса.
Высшие карбоновые кислоты — твёрдые, без запаха, нерастворимые в воде вещества.
Стеариновая кислота имеет состав C17h45COOH, или C18h46O2. Это белое, жирное на ощупь вещество. Запаха не имеет. В воде не растворяется. Входит в состав жиров.

Стеариновая кислота
Такие же свойства у пальмитиновой кислоты C15h41COOH, или C16h42O2.
Ненасыщенная олеиновая кислота C17h43COOH отличается от насыщенной агрегатным состоянием. Она представляет собой маслянистую жидкость. В воде не растворяется.
Олеиновая кислота
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 216 с.
Низшие насыщенные карбоновые кислоты (С1-С3) при обычных условиях представляют собой легкоподвижные жидкости, обладающие характерным острым запахом. 
 Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Кислоты состава С4-С9 – вязкие маслянистые жидкости с неприятным запахом, напоминающим запах пота, плохо растворимые в воде (разветвленные кислоты до С13 — жидкости). Высшие карбоновые кислоты (с С10) — твердые вещества, без запаха, нерастворимые в воде.
Алифатические карбоновые кислоты с количеством атомов углерода более 10 относят к высшим жирным кислотам (ВЖК), так как подавляющее большинство из них могут быть выделены из жиров животного или растительного происхождения.
Ненасыщенные кислоты при комнатной температуре – жидкости. Все дикарбоновые и ароматические кислоты при комнатной температуре – кристаллические вещества.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях. С увеличением молекулярной массы кислот растворимость в воде уменьшается. Высшие карбоновые кислоты, например, пальмитиновая С15Н31СООН и стеариновая С17Н35СООН – бесцветные твердые вещества, не растворимые в воде.
Монокарбоновые кислоты хорошо растворяются также во многих органических растворителях.

С увеличением числа атомов углерода в молекулах кислот и соответственно, с ростом относительной молекулярной массы температура кипения увеличивается, запах ослабевает и исчезает.
Температуры плавления кислот с четным числом углеродных атомов имеют более высокие температуры плавления, чем с нечетным числом. С увеличением числа углеродных атомов в молекуле кислоты температура плавления уменьшается и где-то после С25 практически сходит на нет.
При одной и той же длине углеводородного радикала температуры плавления и кипения ненасыщенных кислот зависят от наличия кратных связей – с ростом их числа соответствующие температуры уменьшаются.
Температуры кипения и плавления кислот значительно выше температур кипения и плавления спиртов и альдегидов с тем же количеством атомов углерода.
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей. Водородная связь, образуемая водородом гидроксильной группы одной молекулы с карбонильным кислородом другой, более прочная, чем в спиртах.
В твердом и жидком состоянии молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей в устойчивые циклические димеры:
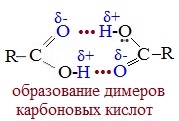
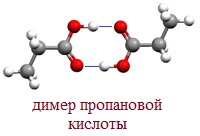
Между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
Молекулы муравьиной и уксусной кислот за счёт водородных связей могут образовывать димеры, которые не разрушаются даже в паровой фазе. 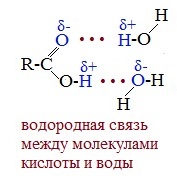 Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Растворимость карбоновых кислот в воде несколько выше, чем у спиртов, так как и с водой кислоты образуют более прочные водородные связи.
В водных растворах кислоты образуют линейные димеры:
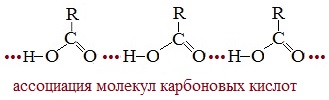

Отсутствие среди карбоновых кислот газообразных веществ связано с межмолекулярной ассоциацией (соединением) молекул посредством водородных связей.
 Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
 Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
3-9% водный раствор кислоты известен под названием столового уксуса, который применяется как приправа к пище. 70-80% уксусная кислота называется уксусной эссенцией.
Уксусная кислота смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.
Видеоопыт «Замораживание уксусной кислоты (демонстрация ледяной уксусной кислоты)»

Пальмитиновая и стеариновая кислоты — твердые вещества, белого цвета, жирные на ощупь, нерастворимы в воде, умеренно растворимы в спирте, эфире, хлороформе и других органических растворителях.
 Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,40С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,40С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
Видеоопыт «Возгонка бензойной кислоты»
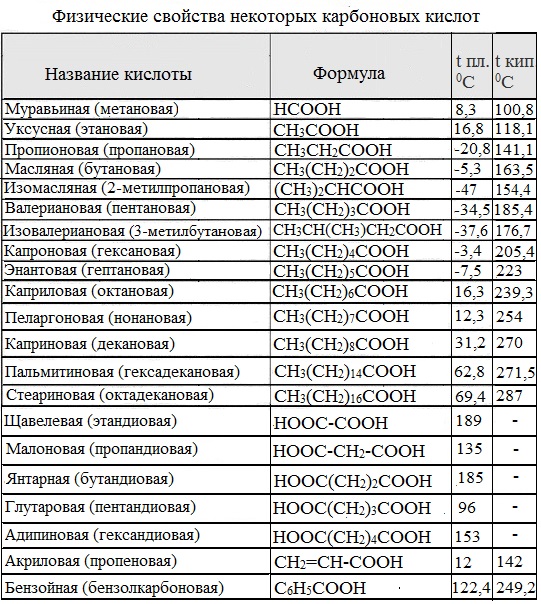
Карбоновые кислоты
Что такое жирорастворимые витамины?
Витамины классифицируются как жирорастворимые или водорастворимые. Это различие между двумя группами очень важно, поскольку оно определяет, как каждый витамин действует в организме. Жирорастворимые витамины растворимы в липидах (жирах). Эти витамины обычно всасываются в жировые шарики (так называемые хиломикроны), которые проходят через лимфатическую систему тонкого кишечника и попадают в общее кровообращение в организме.
Хранится в организме для будущего использования
Организм не нуждается в этих витаминах каждый день , так как в отличие от водорастворимых витаминов, которые нуждаются в регулярной замене в организме, жирорастворимые витамины хранятся в организме для дальнейшего использования Они хранятся в основном в печени и жировых тканях. Хотя это хорошо нам помогает, мы можем создать запас этих витаминов, чтобы они были там, когда они нам нужны, но если мы потребляем больше, чем нужно, это приводит к токсичности.
Организм может испытывать дефицит жирорастворимых витаминов, если потребление жиров слишком мало или если нарушает всасывание жиров , например, из-за определенных лекарств, которые препятствуют всасыванию жира из кишечника или определенных заболеваний такой как муковисцидоз, при котором наблюдается дефицит ферментов поджелудочной железы, который аналогичным образом препятствует всасыванию жира из кишечника.
Жирорастворимые витамины содержатся главным образом в жирных продуктах, таких как животные жиры, в том числе сливочное масло и сало, растительные масла, молочные продукты, печень и жирная рыба. Вам также может быть интересно узнать, что, в отличие от водорастворимых витаминов, жирорастворимые витамины не разрушаются в процессе приготовления.
Необходим для потребления с пищей
Лучший способ принимать любые жирорастворимые добавки — с пищей — ваш организм не сможет растворить или усвоить витамин, иначе .Стакан молока с низким содержанием жира, например, обеспечит достаточное количество жира, чтобы помочь вашему организму усваивать витамин.
Жирорастворимые витамины:
- Витамин A
- Витамин D
- Витамин E
- Витамин K
Витамин A
Также известен как ретинол и выполняет несколько важных функций, включая укрепление иммунитета против инфекций, помогая зрению в тусклом свете, и участвует в поддержании здоровья кожи и накладок некоторых частей тела, таких как нос.
Витамин D
Помогает регулировать количество кальция и фосфатов в организме, которые, в свою очередь, необходимы для поддержания здоровья костей и зубов.
Витамин Е
Помогает поддерживать клеточную структуру, защищая клеточные мембраны.
Витамин К
Необходим для свертывания крови, что означает правильное заживление ран. Появляется все больше доказательств того, что витамин К также необходим для укрепления костей.
Здоровая сбалансированная диета — лучший способ потреблять все необходимые нам питательные вещества.Однако иногда это невозможно, и тогда добавки могут помочь. Эта статья не предназначена для замены медицинской консультации. Пожалуйста, проконсультируйтесь с вашим лечащим врачом, прежде чем пытаться какие-либо добавки или травяные лекарства.

Leave A Comment