Устойчивая восьмиэлектронная оболочка — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Устойчивые восьмиэлектронные оболочки, на которые химики обратили внимание еще до квантовомеханического описания строения атома, представляют собой набор из восьми электронов на самых внешних s -, рх -, ру — и р2 — орбиталях. Своеобразное строение периодической таблицы обусловлено последовательностью энергетических уровней атомов и задержкой в заселении d — и / — орбиталей. При заселении электронами s — и р-валентных орбиталей в каждом п-м периоде образуются типические элементы. Элементы, атомы которых имеют замкнутую оболочку с конфигурацией s2p6, называются благородными газами. [1]
| А в молекуле азота атомы имеют три общие электронные пары. [2] |
Получается устойчивая восьмиэлектронная оболочка около каждого ядра. Два электрона ( электронная пара) принадлежат обоим атомам в одинаковой мере.
| Характеристические плоскости кубической решетки.| Плоский эквивалент тетраэдрической решетки с валентными связями атомов. [4] |
Соответственно в среднем каждый атом обладает устойчивой восьмиэлектронной оболочкой. [5]
У бора на внешнем уровне 7 электронов, до образования устойчивой восьмиэлектронной оболочки не хватает всего одного электрона, значение электроотрицателъности высокое, поэтому более характерным является присоединение электронов, т.е. неметаллические свойства. [6]
Заполненность валентной зоны соответствует в корпускулярном аспекте ( § 1 — 2) наличию у всех атомов
Возникновение оксониевого комплекса можно объяснить тем, что карбениевые ионы, стремясь достроить электронную конфигурацию карбиноидного атома до устойчивой восьмиэлектронной оболочки, взаимодействуют с неподеленной парой электронов кислородного атома.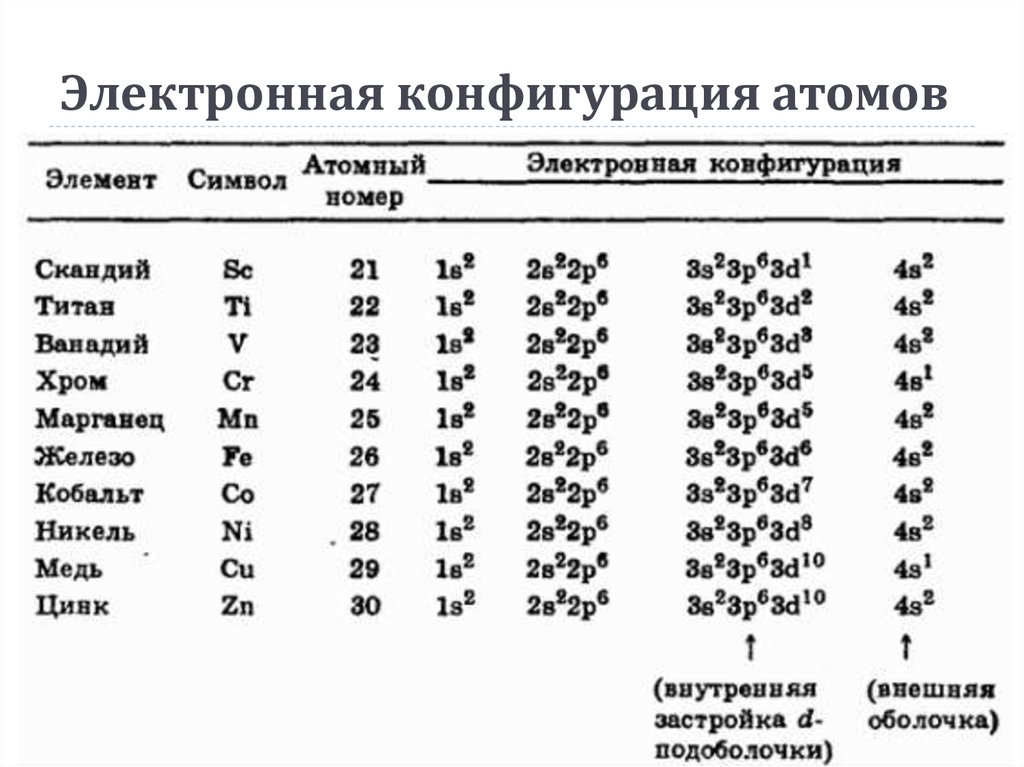 [8]
[8]
Благодаря наличию секстета электронов ион карбония неустой-чив Т1 ыа1Ьма рснмионнослцсобен; н-зто м отношении ойГотлйч а ет г ся-от — ТШна — аммония, обладающего
В молекуле хлористого натрия валентный электрон атома натрия, играющего роль донора, оттянут к атому хлора, в результате чего натрий приобрел положительный заряд и устойчивую восьмиэлектронную оболочку неона, а хлор стал заряженным отрицательно и его внешняя электронная оболочка дополнилась до октета, как в аргоне. Формула Na Cl — указывает на ионный характер этой соли, что подтверждается ее свойствами как электролита. Углерод, расположенный в середине второго периода периодической системы, проявляет лишь слабую склонность к приобретению или отдаче электронов. [10]
Установлено, что атомы элементов, у которых на внешнем слое находится восемь электронов, не могут отдавать ни одного из них, атомы элементов, не имеющих такой устойчивой восьмиэлектронной оболочки, могут отдавать или принимать валентные электроны. [11]
[11]
Установлено, что атомы элементов, у которых на внешнем слое находится восемь электронов, не могут отдавать ни одного из них, атомы элементов, не имеющих такой устойчивой восьмиэлектронной оболочки, могут отдавать или принимать валентные электроны. [12]
| Образование свободных носителей заряда в кремнии. собственном ( а, б, электронном ( 0, г и дырочном (., е. [13] |
Из рис. 1.5, а видно, что в собственном полупроводнике — кремнии четыре валентных электрона его атома находятся в связи с четырьмя валентными электронами соседних атомов кремния, образуя устойчивую восьмиэлектронную оболочку. [14]
| Фрагмент периодической системы элементов Д. И. Менделеева. [15] |
Страницы: 1 2
Строение атома. Электронные оболочки атома
Похожие презентации:
Сложные эфиры.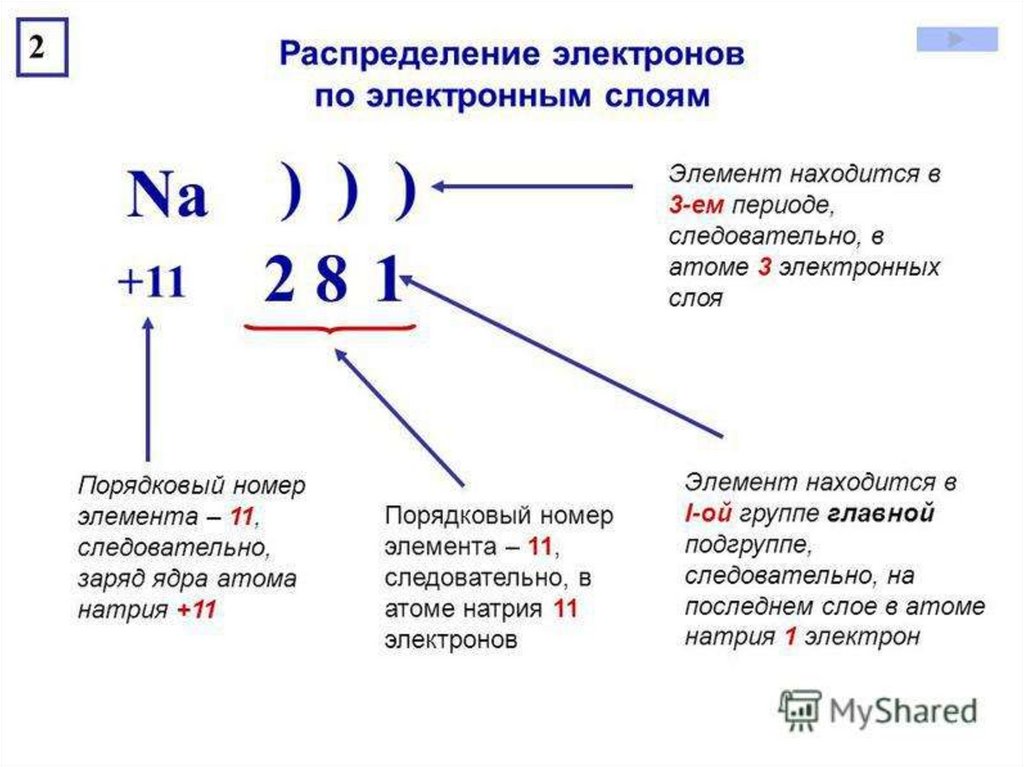 Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Строение атома. Электронные оболочки атома.
Ачкасова Юлия МаксимовнаУчитель-консультант школы
Н.И. Лобачевского
2. Атом
— наименьшая электронейтральная частицахимического элемента, являющаяся
носителем его свойств.
3. Атом
ЯДРОЭЛЕКТРОННАЯ
ОБОЛОЧКА
нуклоны
нейтроны
Не заряжены
протоны
Положительно заряжены
электроны
Отрицательно заряжены
4. Атом
Число p+ = числу e- =порядковому номеруэлемента (Z)
5. Изотопы
6. Электронная оболочка
— cовокупность всех электронов ватоме,
окружающих ядро.

7. Электронные уровни
Орбиталь– это область наиболее вероятногоместонахождения электрона в пространстве.
Номер периода = числу эл. Уровней
Состояние электрона в атоме описывается 4
квантовыми числами:
1. Главное квантовое число n;
2. Побочное (орбитальное) квантовое число l;
3. Магнитное квантовое число ml;
4. Спиновое квантовое число ms.
8. Главное квантовое число
определяет энергетическийуровень электрона (равно номеру
периода). Принимает любые
целочисленные значения,
начиная с n=1 (n=1,2,3,…) и
соответствует номеру периода.
9. Орбитальное квантовое число
Определяет геометрическую форму атомной орбитали.Принимает любые целочисленные значения с l = 0 (l = n -1)
10. Магнитное квантовое число
11. Спиновое квантовое число
Определяетнаправление
вращения электрона
12. Основные квантово-механические законы
• Принцип Паули.• Принцип наименьшей энергии.
• Правило Гунда (Хунда).

13. Принцип Паули
Хотя бы одно из квантовых чисел n, l, ml иms, должно обязательно различаться
проекцией спина.
14. Принцип наименьшей энергии
Электроны в основном состоянии заполняюторбитали в порядке повышения уровня их
энергии. Первыми заполняются орбитали с
минимальными уровнями
энергии- сначала заполняются
те подуровни, для которых
сумма значений квантовых
чисел m и l является наименьшей.
15. Правило Хунда
В данном подуровне электроны стремятсязанять энергетические состояния таким
образом, чтобы их суммарный спин был
максимальным, суммарный спин
спаренных электронов равен нулю.
16. Электронная оболочка
Уровень- > подуровень -> орбиталь1
s
2
s
p
3
s
p d
4
s
p d f
17. Электронная оболочка
1s22s2 2p6
3s2 3p6 3d10
4s2 4p6 4d10 4f14
число электронов
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max.
 18 электронов
18 электронов4 уровень = max. 32 электрона
18. Электронные орбитали
fd
p
s
Электроны сначала
заполняют свободные
орбитали, затем пара!
Спины на орбитали
направлены
противоположно!
19. Электронная формула
1. Число e- = числу p+ =порядковому номеру2. Число электронов на внешнем уровне =
номеру группы
3. Число эл. уровней = номер периода
20. Составляем формулу
3 период = 3 уровняNa
+11
281
1s2 2s2 2p6 3s1
1 уровень
2 у-нь
3 у-нь
Номер группы = число e- на последнем
уровне
Суммарное число e- в
атоме = порядковому
номеру элемента
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
21. Составляем формулу
S+ 16
286
1s2 2s22p6 2s23p4
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max.
 32 электрона
32 электрона22. Составляем формулу
Сa+ 20
4s
2882
3p
3s
1s2 2s22p6 3s23p6 4s2
2s
1s
2p
23. Возбужденное состояние атома
24. Электронные формулы ионов
25. Решите:
Электронную конфигурацию 1s22s22p6имеют частицы:
1. Na 1s22s22p63s1
2. O 1s22s22p4
22s22p6
–
1s
3. F
4. Na+ 1s22s22p6
5. S2- 1s22s22p63s23p6
26. Решите:
Хлорид-ион имеет такую же электроннуюконфигурацию, как и: Сl- 1s22s22p63s23p6
1. катион кальция Ca2+ 1s2 2s2 2p6 3s2 3p6.
2. гидрид-анион H- 1s2
3. атом брома Br 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
4. атом натрия Na 1s2 2s2 2p6 3s1
5. сульфид-анион S2- 1s2 2s2 2p6 3s2 3p6
27. Решите:
Восьмиэлектронную внешнюю оболочку восновном состоянии имеют частицы:
1. Al3+ 13-3 = 10 1s22s22p6
2. C2+ 6-2 = 4 1s22s2
3. S2- 16+2 = 18 1s22s22p63s23p6
22s22p5
9:
1s
4. F
22s22p63s2
5+
17-5
=
12
1s
5.
 Cl
Cl28. Решите:
Один неспаренный электрон на внешнемуровне в основном состоянии имеют
атомы:
1. Al 1s22s22p63s23p1
2. C 1s22s22p2
4. F 1s22s22p5
5. Fe 1s22s22p63s23p63d64s2
Спасибо за внимание!
English Русский Правила
Почему на внешней оболочке всего восемь электронов?
Последняя обновленная дата: 31 марта 2023 г.
•
Общее представление: 193,8K
•
Просмотры сегодня: 3,69K
Ответ
Проверено
193,8K+ виды
HINT: 9003 атом состоит из трех основных частиц: протонов, электронов и нейтронов. Атом – мельчайшая частица, в центре которой находятся протоны и нейтроны, а вокруг него вращаются электроны.
Полный ответ:
Атомы различных элементов имеют тенденцию приобретать, терять или делиться валентными электронами во время образования молекул, так что в их валентных оболочках имеется восемь электронов или октетов. Это правило октета или электронная теория химической связи была предложена Косселем и Льюисом. Правило октета относится к важнейшему принципу, согласно которому атомы, которые связаны, имеют восемь общих внешних электронов. Это, безусловно, означает, что валентная оболочка атома имеет сходство с инертным газом. Правило октета гласит, что атомы предпочитают иметь восемь электронов только на своих полных внешних оболочках. Достигнув восьми электронов на своих внешних оболочках, атомы получат или потеряют валентные электроны. Более того, атомы делают это, связываясь друг с другом. Причем эти связи могут быть между одним и тем же одинаковым элементом или с разными элементами.
Это правило октета или электронная теория химической связи была предложена Косселем и Льюисом. Правило октета относится к важнейшему принципу, согласно которому атомы, которые связаны, имеют восемь общих внешних электронов. Это, безусловно, означает, что валентная оболочка атома имеет сходство с инертным газом. Правило октета гласит, что атомы предпочитают иметь восемь электронов только на своих полных внешних оболочках. Достигнув восьми электронов на своих внешних оболочках, атомы получат или потеряют валентные электроны. Более того, атомы делают это, связываясь друг с другом. Причем эти связи могут быть между одним и тем же одинаковым элементом или с разными элементами.
Атомы кажутся наиболее стабильными с целой внешней оболочкой, содержащей восемь электронов, когда они являются первичными, что способствует тому, что широко называют правилом октетов. Его внешние электроны или те, что находятся на орбитали с самой высокой энергией, подтверждают свойства ассоциированных в питании атомов. Это происходит из-за квантовой природы атомов, где электроны представляют собой единицу, организованную в оболочки: есть пара электронов в первой, называемой К-оболочкой, восемь во второй (L-оболочке), восемнадцать в третьей. (оболочка М). В большинстве случаев атомы сливаются в молекулы, пытаясь индуцировать валентные электроны, заполнившие полную оболочку.
Это происходит из-за квантовой природы атомов, где электроны представляют собой единицу, организованную в оболочки: есть пара электронов в первой, называемой К-оболочкой, восемь во второй (L-оболочке), восемнадцать в третьей. (оболочка М). В большинстве случаев атомы сливаются в молекулы, пытаясь индуцировать валентные электроны, заполнившие полную оболочку.
Примечание:
Помните, что атомы не достигают стабильности, только отдавая или принимая валентные электроны. Иногда стабильность достигается за счет различных типов связей путем обмена электронами. Химическая связь — это, по сути, сила притяжения между любыми двумя атомами в молекуле, необходимая для поддержания стабильности.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверки 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класса 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класса 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класса 12 химии JEE_Main
Тенденции сомнений
орбиталей — Почему атомы с восемью электронами во внешней оболочке чрезвычайно стабильны?
спросил
Изменено 29 дней назад
Просмотрено 7к раз
$\begingroup$
Атомы, имеющие восемь электронов на внешней оболочке, чрезвычайно стабильны.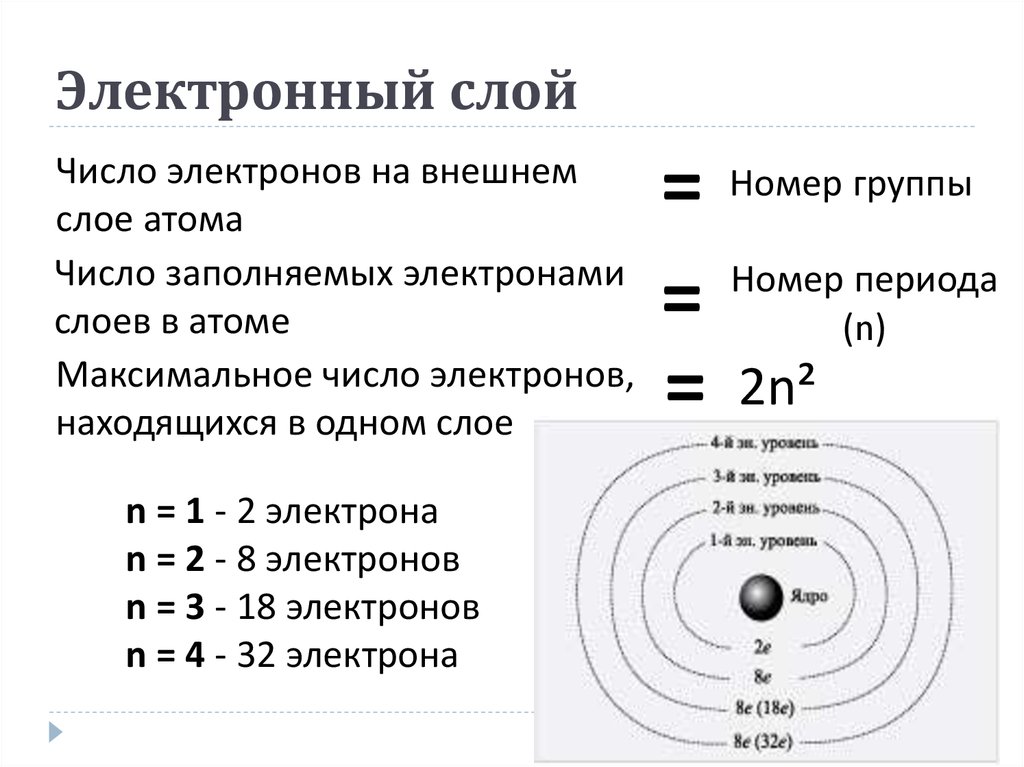
Почему атомы с восемью электронами на внешней оболочке чрезвычайно стабильны?
- орбитали
- атомы
$\endgroup$
1
$\begingroup$
Во-первых, это не совсем так. Это верно для первой строки периодической таблицы (от лития до неона). Это почти верно для второго ряда (от натрия до аргона). Но и там есть исключения. Кроме того, это вообще неверно для элементов за пределами первых двух столбцов.
Причина повышенной устойчивости первых двух строк кроется в квантовой механике. Классически мы можем отметить, что там нет $d$ электронов. Другой способ взглянуть на это с классической точки зрения состоит в том, что ранние элементы были слишком малы, чтобы вокруг них могло находиться слишком много других атомов или групп атомов.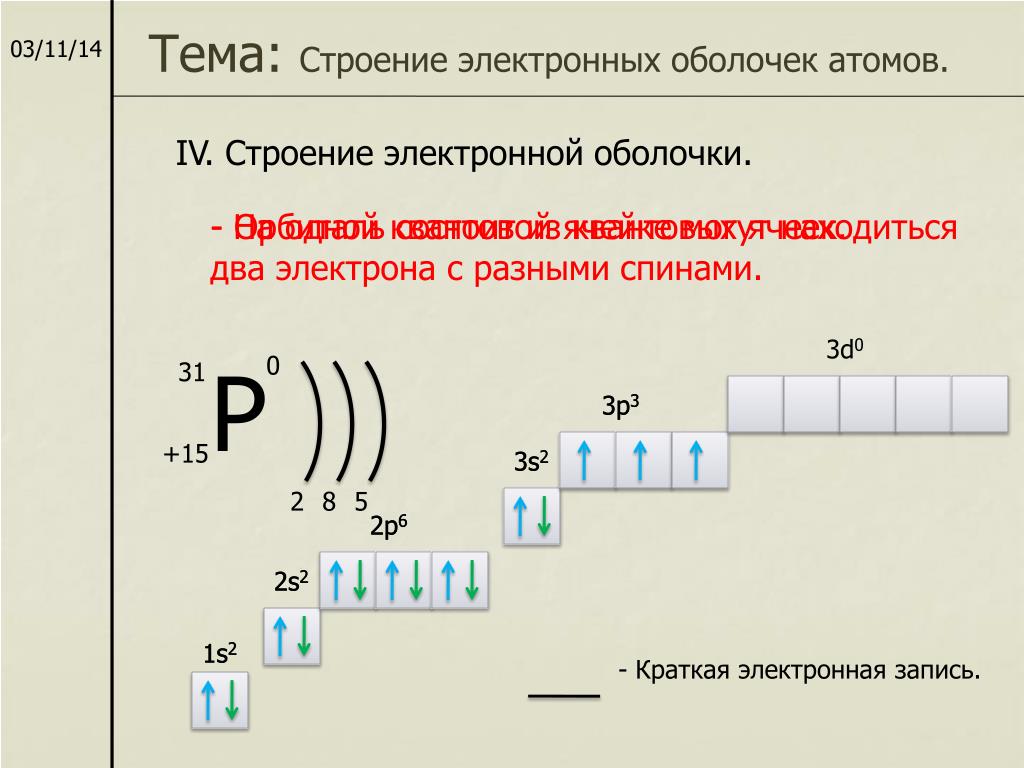 Это имеет тенденцию исчезать по мере того, как вы спускаетесь вниз по периодической диаграмме, и атомы становятся «толстее». Типичным примером является платинохлористоводородная кислота
Это имеет тенденцию исчезать по мере того, как вы спускаетесь вниз по периодической диаграмме, и атомы становятся «толстее». Типичным примером является платинохлористоводородная кислота
Большинство переходных металлов также могут иметь более четырех групп вокруг себя.
Я подозреваю, что это не очень полезное объяснение. Как я уже сказал, ответ на самом деле лежит в квантовой механике. При поиске «теории молекулярных орбиталей» можно найти одну ссылку здесь.
$\endgroup$
0
$\begingroup$
Это видео хорошо объясняет ваш вопрос.
Суть в том, что принцип запрета Паулиса гласит, что два электрона (или вообще фермиона) не могут находиться в одном и том же квантовом состоянии.
Это потому, что электроны принципиально неразличимы, а их волновые функции — нет.

Leave A Comment