Тестирование по теме » Химическая связь»
Тестирование по теме « Химическая связь»
1. Только ковалентными связями образованы оба вещества пары
1) 2) 3) 4)
Ответ: 3
2. В какой молекуле есть ковалентная неполярная связь?
1) C2H6 2) CH4 3) NO2 4) HCl
Ответ: 1
3. В какой молекуле есть ковалентная неполярная связь?
1) H2O2 2) H2O 3) SF2 4) CaF2
Ответ: 1
4. Вещество, в котором ковалентная связь образована по донорно-акцепторному механизму
1) нитрат аммония 2) хлорвинил 3) этиленгликоль 4) карбид кальция
Ответ: 1
5. Как ионные, так и ковалентные связи участвуют в образовании
1) хлорида натрия 2) карбида кальция 3) оксида кремния 4) глюкозы
Ответ: 2
6. Укажите молекулу, в которой длина связи наибольшая.
1) Н
Ответ: 4
7. Укажите молекулу, в которой длина связи наименьшая.
1) F2 2) Сl2 3) HI 4) HF
Ответ: 4
8. Как ковалентной, так и ионной связью образована частица
1) C2H5OH 2) NH4NO3 3) NaCl 4) C6H6
Ответ: 2
9. Химическая связь в молекуле метана такая же, как и в
1) P4 2) NH4Cl 3) NaAlO2 4) N2O3
Ответ: 4
10. Наибольшая энергия связи между атомами углерода — в молекуле
1) С2Н2 2) С2Н4
Ответ: 1
11. Наименьшая энергия связи между атомами углерода — в молекуле
1) С2Н2 2) С2Н4 3) С2Н6 4) С6Н6
Ответ: 3
12.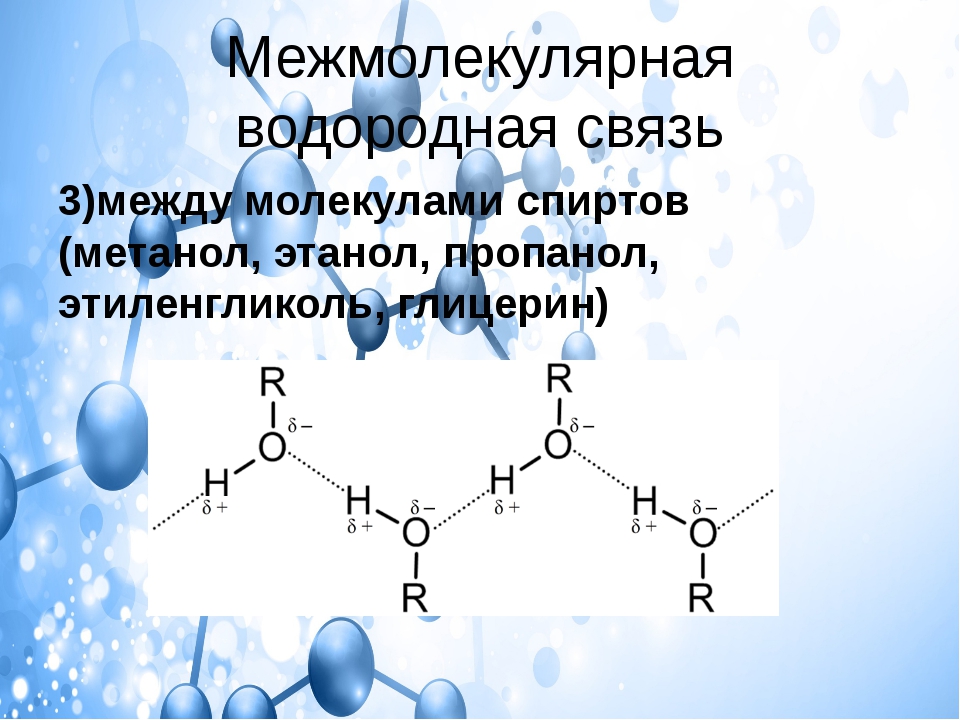 В каком веществе реализуются ковалентные полярные связи?
В каком веществе реализуются ковалентные полярные связи?
1) 2) 3) 4)
Ответ: 4
13. В каком веществе реализуются ковалентные неполярные связи?
1) 2) 3) 4) (алмаз)
Ответ: 4
14. В каком веществе хлор образует ковалентные полярные связи?
Ответ: 4
15. В каком веществе кислород образует ковалентные полярные связи?
1) 2) 3) 4)
Ответ: 3
16. Ковалентную полярную связь кислород образует в
1) 2) 3) 4)
Ответ: 2
17. Ковалентную полярную связь хлор образует в
1) 2) 3) 4)
Ответ: 1
18. Двойная связь имеется в молекуле
1) 2) 3) 4)
Ответ: 2
19. В какой молекуле есть двойная связь?
1) 2) 3) 4)
Ответ: 3
20. Наиболее полярна химическая связь в молекуле
1) хлора 2) хлороводорода 3) сероводорода 4) фтороводорода
Ответ: 4
21. В молекуле какого вещества имеются π-связи?
1) 2) 3) 4)
Ответ: 4
22. В какой молекуле химическая связь наиболее полярна?
1) 2) 3) 4) Ответ: 1
23. В каком соединении азота имеется ионная связь?
1) 2) 3) 4) Ответ: 3
24. В каком соединении фосфора имеется ионная связь?
1) 2) 3) 4)
Ответ: 4
25. Ковалентная полярная связь характерна для каждого из двух веществ:
1) углекислого газа и сероводорода 2) азота и аммиака 3) хлороводорода и хлорида натрия 4) оксида лития и гидроксида лития
Ответ: 1
26. Укажите вещество, в котором кислород образует ионные связи.
1) озон 2) оксид кальция 3) углекислый газ 4) вода
Ответ: 2
27. Соединения с ковалентной неполярной связью расположены в ряду:
1) 2) 3) 4)
Ответ: 1
28. Вещества только с ковалентной полярной связью указаны в ряду:
1) 2) 3) 4)
Ответ: 3
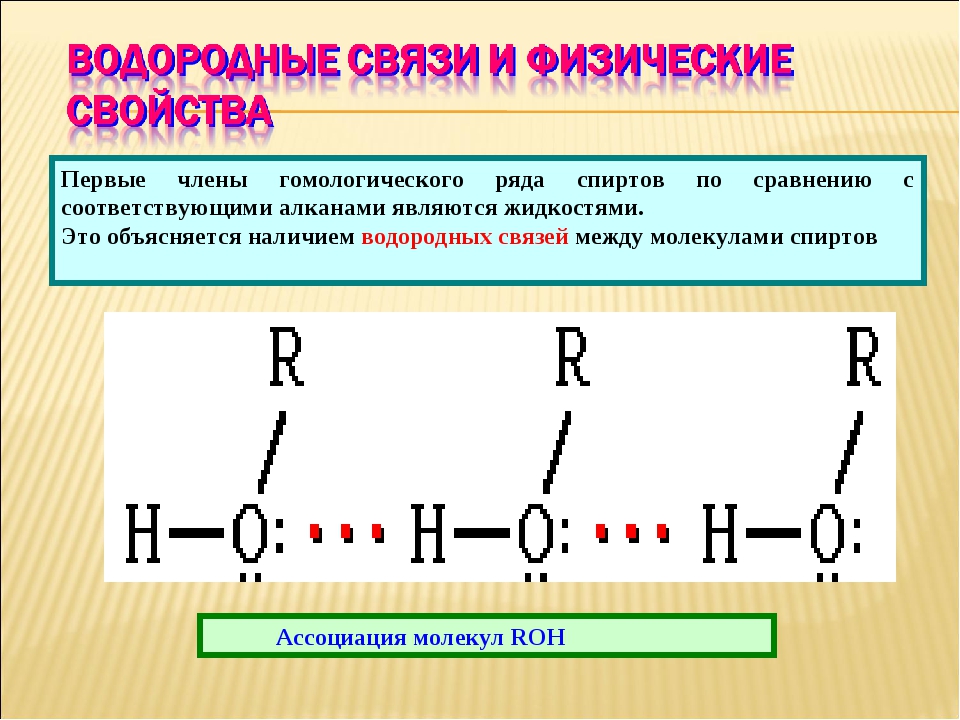
29. Водородная связь характерна для
Водородная связь характерна для
1) алканов 2) аренов 3) спиртов 4) алкинов
Ответ: 3
30. Химическая связь между молекулами воды
1) водородная 2) ионная 3) ковалентная полярная 4) ковалентная неполярная
Ответ: 1
31. Только ковалентные связи имеет каждое из двух веществ:
1) 2) 3) 4)
Ответ: 4
32. Веществом с ковалентной полярной связью является
1) 2) 3) 4)
Ответ: 3
33. Неполярная ковалентная связь характерна для каждого из двух веществ:
1) воды и алмаза 2) водорода и хлора 3) меди и азота 4) брома и метана
Ответ: 2
34. Ковалентная полярная связь характерна для вещества
1) 2) 3) 4)
Ответ: 4
35. Ковалентная неполярная связь характерна для
1) 2) 3) 4)
Ответ: 1
36. Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19?
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
Ответ: 1
37. Ковалентная неполярная связь характерна для каждого из двух веществ:
1) азота и кислород 2) воды и аммиака 3) меди и азота 4) брома и метана
Ответ: 1
38. Водородные связи образуются между молекулами
1) метанола 2) метана 3) ацетилена 4) метилформиата
Ответ: 1
39. Вещества с ковалентной полярной связью находятся в ряду:
1) 2) 3) 4)
Ответ: 1
40. Веществу с ионным типом связи отвечает формула
1) 2) 3) 4)
Ответ: 4
41. Веществом с ионной связью является
1) 2) 3) 4)
Ответ: 1
42. Соединению с ковалентной связью соответствует формула
1) 2) 3) 4)
Ответ: 4
43. Вещество с ковалентной неполярной связью имеет формулу
1) 2) 3) 4)
Ответ: 2
44. Водородные связи образуются между молекулами
1) фтороводорода 2) хлорметана 3) диметилового эфира 4) этилена
Ответ: 1
45.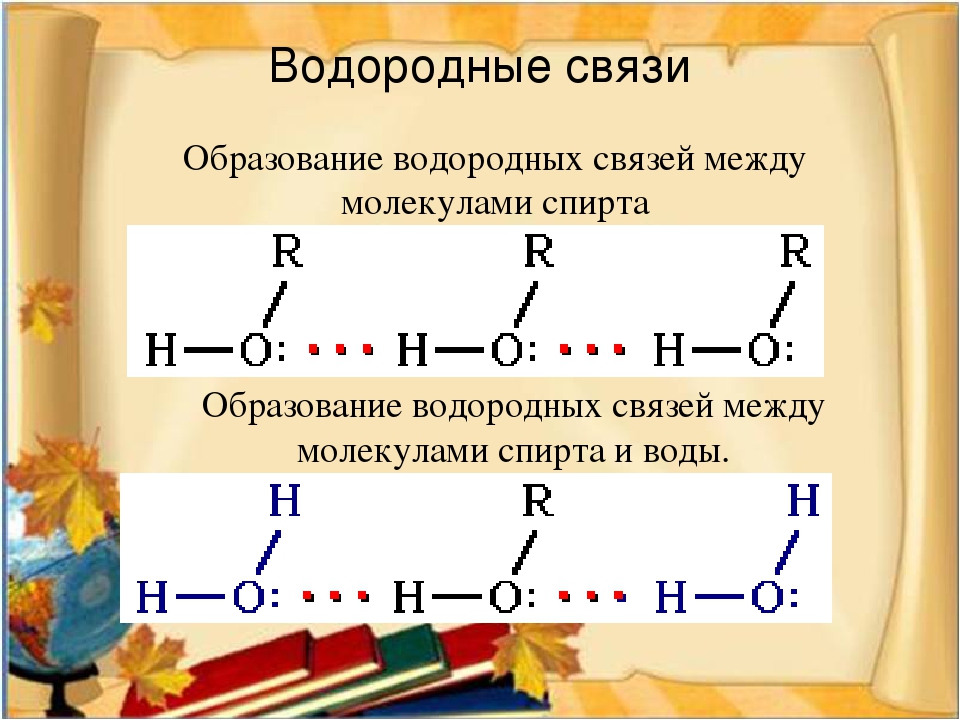 Водородная связь образуется между молекулами
Водородная связь образуется между молекулами
1) этана 2) бензола 3) водорода 4) этанола
Ответ: 4
46. В каком соединении полярность связи наименьшая?
1) 2) 3) 4) Ответ: 3
47. В молекулах хлороводорода и брома химическая связь соответственно
1) ковалентная полярная и ковалентная неполярная 2) ионная и ковалентная полярная
3) ковалентная неполярная и ковалентная полярная 4) ионная и ковалентная неполярная
Ответ: 1
48. Ковалентная неполярная связь характерна для
1) 2) 3) 4)
Ответ: 1
49. Водородные связи образуются между молекулами
1) глицерина 2) этилена 3) пропина-1 4) толуола
Ответ: 1
50. Веществом с ковалентной полярной связью является
1) 2) 3) 4)
Ответ: 3
51. Водородная связь характерна для
1) алкенов 2) простых эфиров 3) первичных спиртов 4) аренов
Ответ: 3
52. Вещества только с ковалентной полярной связью указаны в ряду:
1) 2) 3) 4)
Ответ: 3
53. Водородные связи образуются между молекулами
1) уксусной кислоты 2) углекислого газа 3) ацетилена 4) сероводородной кислоты
Ответ: 1
54. Веществом с ковалентной неполярной связью является
1) 2) 3) 4)
Ответ: 3
55. Ковалентная неполярная связь характерна для каждого из двух веществ:
1) водорода и хлора 2) воды и алмаза 3) меди и азота 4) брома и метана
Ответ: 1
56. Веществу с ионным типом связи отвечает формула
1) 2) 3) 4)
Ответ: 4
57. Ионный характер связи наиболее выражен в соединении
1) 2) 3) 4)
Ответ: 2
58. Химическая связь в молекулах метана и хлорида кальция соответственно
1) ковалентная полярная и металлическая 2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная 4) ковалентная полярная и ионная
Ответ: 4
59. Полярность ковалентной связи в ряду веществ
Полярность ковалентной связи в ряду веществ
1) изменяется периодически 2) не изменяется 3) увеличивается 4) уменьшается
Ответ: 4
60. Ковалентную полярную связь имеет каждое из двух веществ:
1) и 2) и 3) и 4) и
Ответ: 1
61. Химическая связь в молекуле водорода
1) ионная 2) водородная 3) ковалентная полярная 4) ковалентная неполярная
Ответ: 4
62. Ковалентную полярную связь имеет соединение хлора с
1) водородом 2) калием 3) магнием 4) натрием
Ответ: 1
63. Веществом с ковалентной связью является
1) 2) 3) 4)
Ответ: 4
7. Задание 3 № 2888. Ковалентную полярную связь имеет каждое из двух веществ:
1)
2)
3)
4)
Ответ: 1
8. Задание 3 № 3017. Химическая связь в бромиде натрия
1) ковалентная неполярная
2) ионная
3) ковалентная полярная
4) металлическая
Ответ: 2
9. Задание 3 № 3060. Ковалентная связь образуется между атомами
1)
2)
3)
4)
Ответ: 1
10. Задание 3 № 3146. Химическая связь в сульфиде калия
1) ионная
2) водородная
3) металлическая
4) ковалентная
Ответ: 1
11. Задание 3 № 3275. Химическая связь в метане и хлориде кальция соответственно
1) ковалентная полярная и металлическая
2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
Ответ: 4
12. Задание 3 № 4227. В какой молекуле ковалентная связь «элемент – кислород» наиболее полярна?
1)
2)
3)
4)
Ответ: 4
13. Задание 3 № 4267. В какой молекуле ковалентная связь «элемент – фтор» наиболее полярна?
1)
2)
3)
4)
Ответ: 4
14. Задание 3 № 4349. Веществом с ковалентной полярной связью является
Задание 3 № 4349. Веществом с ковалентной полярной связью является
1)
2)
3)
4)
Ответ: 3
15. Задание 3 № 4389. Водородная связь образуется между молекулами
1) толуола
2) водорода
3) метаналя
4) метановой кислоты
Ответ: 4
16. Задание 3 № 4429. Кислород образует ионные связи в
1)
2)
3)
4)
Ответ: 2
17. Задание 3 № 4469. Хлор образует ковалентные полярные связи в
1)
2)
3)
4)
Ответ: 2
18. Задание 3 № 4522. Веществом с ковалентной связью является
1)
2)
3)
4)
Ответ: 3
19. Задание 3 № 4562. Ковалентная связь образуется между атомами
1) и
2) и
3) и
4) и
Ответ: 3
20. Задание 3 № 4602. Ионная связь образуется между
1) и
2) и
3) и
4) и
Ответ: 2
21. Задание 3 № 4666. Наиболее полярна химическая связь в молекуле
1)
2)
3)
4)
Ответ: 2
22. Задание 3 № 4706. В молекуле какого из веществ имеется π-связь?
1) метанола
2) водорода
3) метаналя
4) аммиака
Ответ: 3
Тест по теме «Химическая связь» 11 класс (базовый уровень) | Тест по химии (11 класс) на тему:
1 вариант.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr,Na2O,KI
3) SO2.P4.CaF2
4) h3S,Br2,K2S
3. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl,NaCl. Cl2
Cl2
2) O2.h3O.CO2
3) h3O.Nh4.Ch5
4) NaBr.HBr.CO
4. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
5. Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) h3S 4) MgCl2
6. Вещество с ковалентной неполярной связью имеет формулу
1) Nh4 2) Сu 3) h3S 4) I2
7. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
8. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
9. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1)ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
10. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
11.Молекулярную кристаллическую решетку имеет соединение: 1) сероводород; 2)хлорид натрия; 3)кварц; 4)медь.
12. Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) Nh4 4) СНзОН
13. Составьте схемы образования связей в веществах: метан, фтор. Определите вид связи и тип кристаллической решетки.
2 вариант.
1. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
2. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
3. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CS2 и РС15
4. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl
2} СО, CuO, Ch4Cl
3} BaS,C6H6,h3
4} C6H5NO2, F2, CC14
5.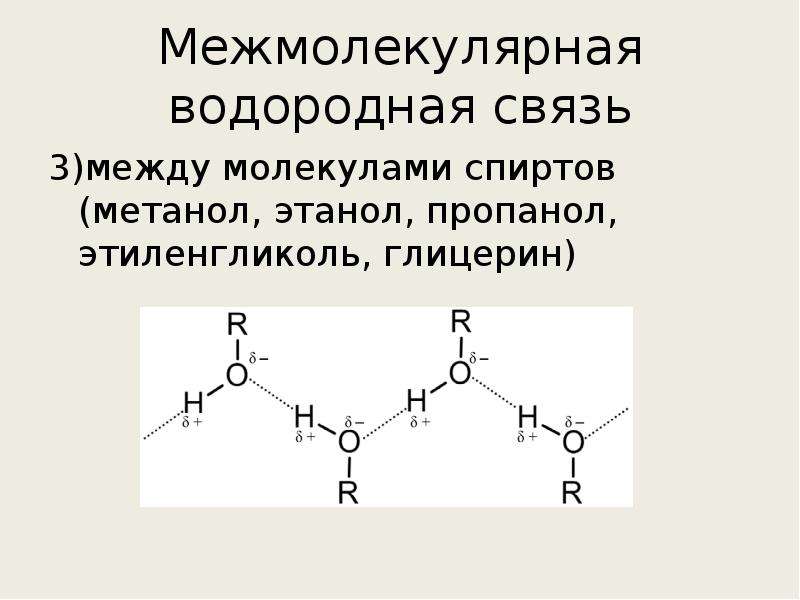 Ковалентную связь имеет каждое из веществ, указанных в ряду:
Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5N02, SО2, CHC13
6. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1} С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
7. Вещества молекулярного строения характеризуются
1)высокой температурой плавления 2) низкой температурой плавления 3) твердостью 4) электропроводностью.
8. В каком ряду записаны формулы веществ только с ковалентной полярной
связью?
1) С12, NO2, НС1 2) HBr,NO,Br2 3) h3S.h3O.Se
4) HI,h3O,Ph4
9. Веществом с ионной связью является:
1) Са 2) MgS 3) h3S 4) NН3
10.Атомную кристаллическую решетку имеет каждое из двух веществ:
1) оксид кремния (IV) и оксид углерода (IV)
2) алмаз и кремний
3) хлор и иод
4) хлорид калия и фторид железа (III)
11.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1)вода и сероводород
2)бромид калия и азот
3)аммиак и водород
4)кислород и метан
12. . Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 1 образует с водородом химическую связь
1)ковалентную полярную 2) ковалентную неполярную 3) ионную 4) металлическую
13. Составьте схемы образования связей в веществах: нитрид натрия, кислород. Определите вид связи и тип кристаллической решетки.
Урок №8 — 9. Виды и механизмы образования химической связи. Характеристики химической связи
Повторите!
Электроотрицательность химических элементов
Сущность и виды химической связи
Ковалентная связь. Полярная и неполярная ковалентные связи
Ионная связь
Электронная природа химических связей в органических веществах
Сущность химической связи. Виды химической связи
Виды химической связи
I. Сущность химической связи
1. Устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершён до 8 электронов (Н, Не – до 2 электронов).
2. Завершённый внешний уровень имеют атомы VIII A группы.
3. одиночные атомы связанные атомы
○ + ○ → ○○ + Е
Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.
4. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении и его состояние наиболее энергетически выгодное.
5. Пути завершения внешнего уровня атомов:
· образование общих электронных пар
· отдача или присоединение электронов
· обобществление электронов.
II. Виды химической связи
1. Ионная (∆ЭО > 1,7) – связь, осуществляемая за счёт сил электростатического притяжения ионов (Отдача или присоединение ионов).
Мещ – О, Г, S; Мещз – О, Г, S.
2. Ковалентная (∆ЭО = 0 – 1,7) — связь осуществляемая путём образования общих электронных пар.
· неполярная(∆ЭО = 0) – связь между одинаковыми атомами неметаллов.
· полярная(0<∆ЭО<1,7) – связь между разными атомами неметаллов, или неметаллом и неактивным металлом (AlCl3).
Свойства ковалентной связи:
1) Длина – межъядерное расстояние
2) Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
F – F | O = O | N ≡ N | C ≡ O Одна из трёх связей О→С по донорно-акцепторному механизму |
155 кДж/моль | 498 кДж/моль | 946 кДж/моль | 1065 кДж/моль |
3) Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен;
азот может быть трехвалентен в молекуле
аммиака NH3 и
четырёхвалентен в ионе аммония NH4+ (валентные
возможности расширяются за счёт участия неподелённой электронной пары атома
азота в образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность – обуславливает форму молекулы в пространстве.
Ковалентная
связь образуется в направлении максимального перекрывания электронных орбиталей
взаимодействующих атомов при образовании σ – связей. (см. «гибридизация»)
3. Металлическая – связь за счёт обобществления валентных электронов в кристаллической решётке металла. Это связь в металлах и сплавах (примерно в 3-4 раза слабее одинарной ковалентной)
4. Водородная – связь между атомом водорода и сильноэлекроотрицательным элементом F, O, N, Cl. (примерно 15-20 раз слабее ковалентной)
· внутримолекулярная – белки, полипептиды
· межмолекулярная – вода, спирты, аммиак, аминокислоты и др.
Тестовые задания для закрепления:
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr, Na2O, KI
3) SO2, P4, CaF2
4) H2S, Br2, K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) NH3 и HCI
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2
2) O2, H2O, CO2
3) H2O, NH3, CH4
4) NaBr, HBr, CO
5. В каком ряду
записаны формулы веществ только с ковалентной полярной связью?
В каком ряду
записаны формулы веществ только с ковалентной полярной связью?
1) С12, NO2, НС1
2) HBr, NO, Br2
3) H2S, H2O, Se
4) HI, H2O, PH3
6. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) H2S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаС12 2) MgS 3) H2S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) NH3 2) Сu 3) H2S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВr 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1) ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
14. В
молекуле какого вещества длина
связи между атомами углерода наибольшая?
В
молекуле какого вещества длина
связи между атомами углерода наибольшая?
1) ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВr
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) H2S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3) брома 4) йода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) йода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4H10, NO2, NaCl
2) СО, CuO, CH3Cl
3) BaS, C6H6, H2
4) C6H5NO2, F2, CC14
24. Ковалентную
связь имеет каждое из веществ, указанных в ряду:
Ковалентную
связь имеет каждое из веществ, указанных в ряду:
1) СаО, С3Н6, S8
2) Fe , NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5N02, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3H6, NO2, NaF
2) КС1, CH3Cl, C6H1206
3) P2O5, NaHSO4, Ba
4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1) СF4
2) CCl4
3) CBr4
4) CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
30. Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная.
 Способы образования ковалентной связи. Характеристики ковалентной св
Способы образования ковалентной связи. Характеристики ковалентной свА4 Химическая связь.
Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи.
Вариант 1 – 1,5,9,13,17,21,25,29,33,37,41,45,49,53,57,61,65
Вариант 2 – 2,6,10,14,18,22,26,30,34,38,42,46,50,54,58,62,66
Вариант 3 – 3,7,11,15,19,23,27,31,35,39,43,47,51,55,59,63,67
Вариант 4 – 4,8,12,16,20,24,28,32,36,40,44,48,52,56,60,64,68
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КСl 2) NaBr,Na2O,KI 3) SO2.P4.CaF2 4) H2S,Br2,K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2 2) SO3 и Н2О 3) С2Н6 и HNO3 4) NH3 и HCI
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl,NaCl,Cl2 2) O2,H2O,CO2 3) H2O,NH3,CH4 4) NaBr,HBr,CO
5. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) Сl2, NO2, НСl 2) HBr,NO,Br2 3) H2S,H2O,Se 4) HI,H2O,PH3
6.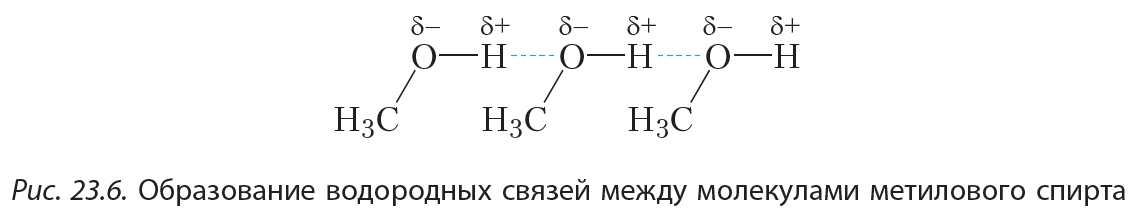 Ковалентная
неполярная связь характерна для
Ковалентная
неполярная связь характерна для
1) Сl2 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) H2S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаСl2 2) MgS 3) H2S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) NH3 2) Сu 3) H2S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
11. Между атомами с одинаковой электроотрицательностью образуется химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
12. Ковалентная полярная связь характерна для
1) KCl 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1)ковалентную полярную 2) ковалентную неполярную
3) ионную 4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1)ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота 2) сероводорода 3) метана 4) хлора
16. Водородные связи образуются между
молекулами
Водородные связи образуются между
молекулами
1) диметилового эфира 2) метанола 3) этилена 4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НСl 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
19. Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О 2) СО2 и К2О 3) H2S и Na2S 4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3) брома 4) иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4H10, NO2, NaCl 2) СО, CuO, CH3Cl 3) BaS,C6H6,H2 4) C6H5NO2, F2, CCl4
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8 2) Fe,NaNO3, CO 3) N2, CuCO3, K2S 4) C6H5N02, SО2, CHC13
25. Ковалентную связь имеет каждое из
веществ, указанных в ряду:
Ковалентную связь имеет каждое из
веществ, указанных в ряду:
1) С3Н4, NO, Na2O 2) СО, СН3С1, PBr3 3) Р2Оз, NaHSO4, Сu 4) C6H5NO2, NaF, ССl4
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3Ha,NO2, NaF 2) КСl , CH3Cl, C6H1206 3) P2O5, NaHSO4, Ba 4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода 2) хлора 3) фосфина 4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4 2)CCl4 3)CBr4 4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
1) 1 2) 2 3) 3 4) 4
30. Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
1) 1 2) 2 3) 3 4) 4
31.В веществах, образованных путем соединения одинаковых атомов, химическая связь
1)ионная 2) ковалентная полярная 3) водородная 4) ковалентная неполярная
32. Атомы химических элементов второго периода периодической системы Д.И. Менделеева образуют соединения с ионной химической связью состава 1) LiF 2) CO2 3) Al2O3 4) BaS
33. Соединениями с ковалентной полярной
и ковалентной неполярной связью являются
соответственно 1) вода и сероводород
2) бромид калия и азот 3) аммиак и водород
4) кислород и метан
Соединениями с ковалентной полярной
и ковалентной неполярной связью являются
соответственно 1) вода и сероводород
2) бромид калия и азот 3) аммиак и водород
4) кислород и метан
34. Ковалентная неполярная связь характерна для 1)воды 2) аммиака 3) азота 4) метана
35. Химическая связь в молекуле фтороводорода
1) ковалентная полярная 3) ионная
2) ковалентная неполярная 4) водородная
36.Выберите пару веществ, все связи в которых — ковалентные:
1) NаСl, НСl 2) СО2, ВаО 3) СН3Сl, СН3Nа 4) SO2, NO2
37. В иодиде калия химическая связь
1) ковалентная неполярная 3) металлическая
2) ковалентная полярная 4) ионная
38. В сероуглероде СS2 химическая связь
1) ионная 2) металлическая
3) ковалентная полярная 4) ковалентная неполярная
39. Ковалентная неполярная связь реализуется в соединении
1) СrО3 2)Р2О5 3) SO2 4) F2
40.Вещество с ковалентной полярной связью имеет формулу 1)KCl 2)HBr 3)Р4 4)CaCl2
41. Соединение с ионным характером химической связи
1)хлорид фосфора 2)бромид калия 3)оксид азота (II) 4)барий
42. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная 2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная
43. Ионную связь образуют 1) Н и S
2) Р и С1 3) Сs
и Вr
4) Si
и F
Ионную связь образуют 1) Н и S
2) Р и С1 3) Сs
и Вr
4) Si
и F
44. Какой тип связи в молекуле Н2?
1) Ионная 2) Водородная 3) Ковалентная неполярная 4) Донорно-акцепторная
45. Веществом с ковалентной полярной связью являются
1)оксид серы (IV) 2)кислород 3)гидрид кальция 4)алмаз
46. В молекуле фтора химическая связь
1) ковалентная полярная 2) ионная 3) ковалентная неполярная 4) водородная
47. В каком ряду перечислены вещества только с ковалентной полярной связью:
1) СН4 Н2 Сl2 2)NH3 HBr CO2 3) PCl3 KCl CCl4 4) H2S SO2 LiF
48. В каком ряду все вещества имеют ковалентную полярную связь?
1) НСl, NаСl, Сl2 2) О2 Н2О, СО2 3) Н2O, NH3, СН4 4) КВr, НВr, СО
49. В каком ряду перечислены вещества только с ионным типом связи:
1) F2O LiF SF4 2) PCl3 NaCl CO2 3) KF Li2O BaCl2 4) СаF2 CH4 CCl4
50. Соединение с ионной связью образуется при взаимодействии
1) CH4 и O2 2)NH3 и HCl 3) C2H6 и HNO3 4) SO3 и H2O
51. Водородная связь образуется между молекулами 1) этана 2) бензола 3) водорода 4) этанола
52. В каком веществе есть водородные связи? 1) Сероводород 2)Лед 3) Бромоводород 4) Бензол
53. Связь, образующаяся между элементами
с порядковыми номерами 15 и 53
Связь, образующаяся между элементами
с порядковыми номерами 15 и 53
1)ионная 2)металлическая
3)ковалентная неполярная 4)ковалентная полярная
54. Связь, образующаяся между элементами с порядковыми номерами 16 и 20
1)ионная 2)металлическая
3)ковалентная полярная 4)водородная
55. Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3)ковалентная 4) донорно-акцепторная
56. Водородные связи образуются между молекулами
1) водорода 2) формальдегида 3) уксусной кислоты 4) сероводорода
57. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) Сl2, NH3, НСl 2) НВr, NO, Вr2 3) Н2S, Н2O, S8 4) НI, Н2О, РН3
58.В каком веществе есть одновременно ионные и ковалентные химические связи?
1) Хлорид натрия 2) Хлороводород 3) Сульфат натрия 4) Фосфорная кислота
59. Более выраженный ионный характер имеет химическая связь в молекуле
1)бромида лития 2)хлорида меди 3)карбида кальция 4)фторида калия
60. В каком веществе все химические связи — ковалентные неполярные?
1) Алмаз 2) Оксид углерода (IV) 3) Золото 4) Метан
61.
Установите соответствие между веществом
и видом связи атомов в этом веществе.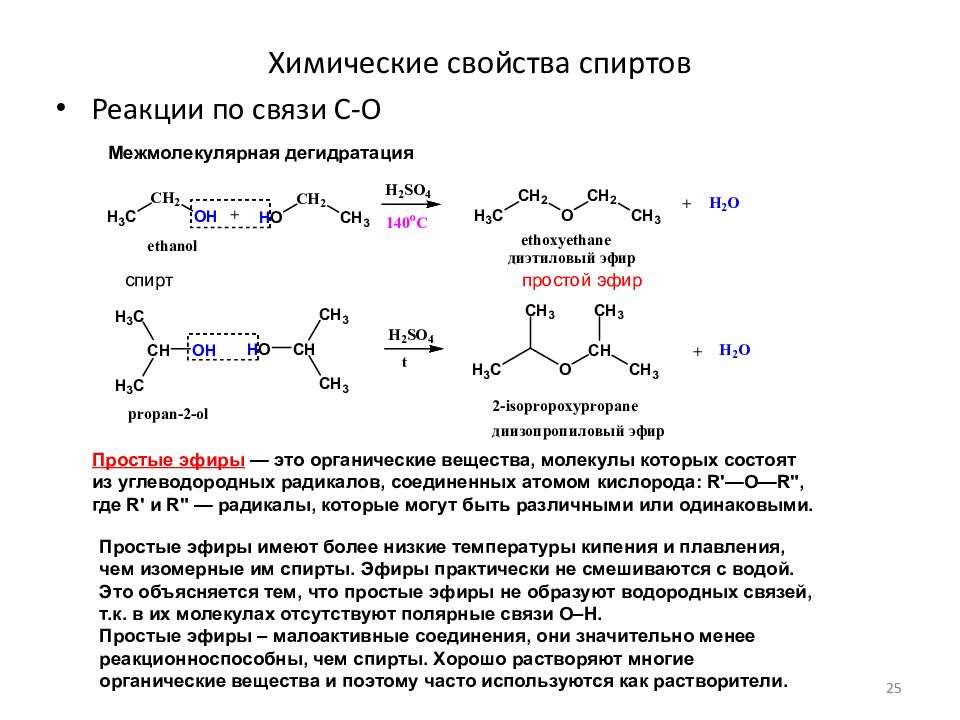
НАЗВАНИЕ ВЕЩЕСТВА ВИД СВЯЗИ
1)цинк А) ионная
2) азот Б) металлическая
3) аммиак В) ковалентная полярная
4) хлорид кальция Г) ковалентная неполярная
62. Установите соответствие
ВИД СВЯЗИ СОЕДИНЕНИЕ
1) ионная А) Н2
2) металлическая Б) Ва
3) ковалентная полярная В) НF
4) ковалентная неполярная Г) ВаF2
63. В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму? 1)КСl 2)ССl4 3) NН4Сl 4)СаСl2
64. Укажите молекулу, в которой энергия связи — наибольшая:1) N≡N 2) Н-Н 3) О=О 4) Н-F
65. Укажите молекулу, в которой химическая связь — самая прочная:1) НF 2) НСl 3) НВr 4) HI
66. Наиболее прочная химическая связь имеет место в молекуле 1) F2 2) Сl2 3) O2 4) N2
67. Прочность связи увеличивается в ряду 1) Cl2-O2-N2 2) О2— N2-Сl2 3) О2-Сl2-N2 4) Сl2-N2-O2
68. Укажите ряд, характеризующийся увеличением длины химической связи
1)O2, N2, F2, Cl2 2)N2, O2, F2, Cl2 3)F2, N2, O2, Cl2 4)N2, O2, Cl2, F2
Задания №3 с решениями
Разберем задания №3 из вариантов ЕГЭ за 2016 год.
Перед решением советуем повторить тему «Виды химической связи».
Задания с решениями.
Задание №1.
Соединения с ковалентной неполярной связью расположены в ряду:
1. O2, Cl2, h3
2. HCl, N2, F2
3. O3, P4, h3O
4. Nh4, S8, NaF
Объяснение: нам нужно найти такой ряд, в котором будут только простые вещества, так как ковалентная неполярная связь образуется только между атомами одного и того же элемента. Правильный ответ — 1.
Задание №2.
Вещества с ковалентной полярной связью указаны в ряду:
1. CaF2, Na2S, N2
2. P4, FeCl2, Nh4
3. SiF4, HF, h3S
4. NaCl, Li2O, SO2
Объяснение: здесь нужно найти ряд, в котором только сложные вещества и, к тому же, все неметаллы. Правильный ответ — 3.
Задание №3.
Водородная связь характерна для
1. Алканов 2. Аренов 3. Спиртов 4. Алкинов
Объяснение: водородная связь образуется между ионом водорода и электроотрицательным ионом. Такой набор, среди перечисленных, есть только у спиртов.
Правильный ответ — 3.
Задание №4.
Химическая связь между молекулами воды
1. Водородная
2. Ионная
3. Ковалентная полярная
4. Ковалентная неполярная
Объяснение: между атомами О и Н в воде образуется ковалентная полярная связь, так как это два неметалла, а вот между молекулами воды связь водородная. Правильный ответ — 1.
Задание №5.
Только ковалентные связи имеет каждое из двух веществ:
1. CaO и C3H6
2. NaNO3 и CO
NaNO3 и CO
3. N2 и K2S
4. Ch5 и SiO2
Объяснение: соединения должны состоять только из неметаллов, то есть правильный ответ — 4.
Задание №6.
Веществом с ковалентной полярной связью является
1. О3 2. NaBr 3. Nh4 4. MgCl2
Объяснение: ковалентная полярная связь образуется между атомами разных неметаллов. Правильный ответ — 3.
Задание №7.
Неполярная ковалентная связь характерна для каждого из двух веществ:
1. Воды и алмаза
2. Водорода и хлора
3. Меди и азота
4. Брома и метана
Объяснение: неполярная ковалентная связь характерна для соединения атомов одного и того же элемента-неметалла. Правильный ответ — 2.
Задание №8.
Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19?
1. Ионная
2. Металлическая
3. Ковалентная полярная
4. Ковалентная неполярная
Объяснение: это элементы — фтор и калий, то есть неметалл и металл соответственно, между такими элементами может образоваться только ионная связь. Правильный ответ — 1.
Задание №9.
Веществу с ионным типом связи отвечает формула
1. Nh4 2. HBr 3. CCl4 4. KCl
Объяснение: ионная связь образуется между атомом металла и атомом неметалла, то есть правильный ответ — 4.
Задание №10.
Одинаковый вид химической связи имеют хлороводород и
1. Аммиак
2. Бром
3. Хлорид натрия
4. Оксид магния
Объяснение: хлороводород имеет ковалентную полярную связь, то есть нам нужно найти вещество, состоящее из двух разных неметаллов — это аммиак.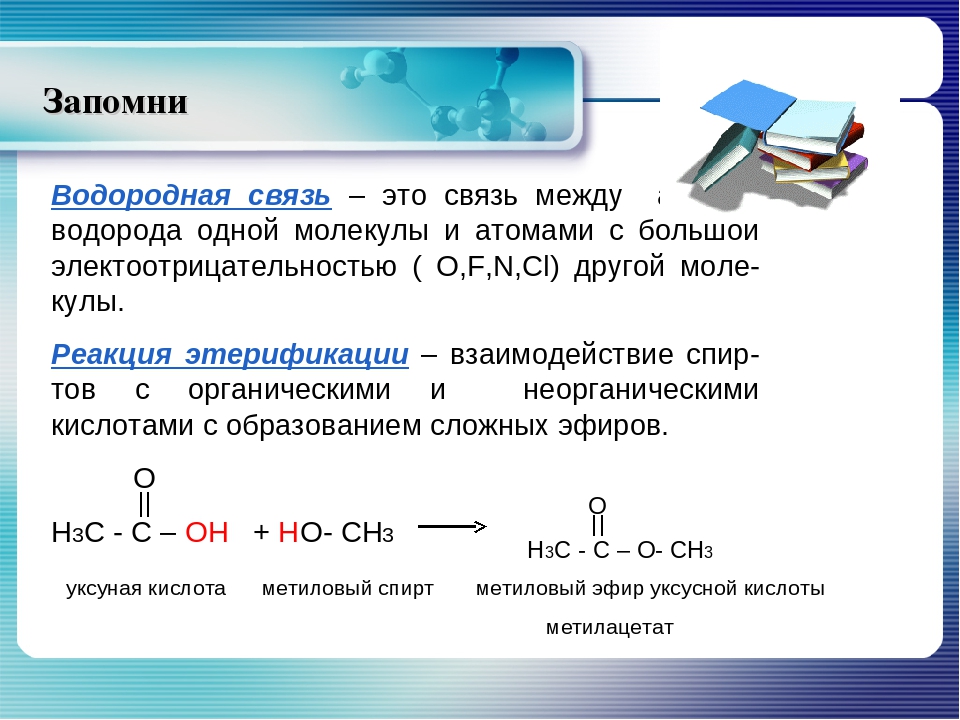
Правильный ответ — 1.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельного решения.
1. Водородные связи образуются между молекулами
1. Фтороводородная кислота
2. Хлорметан
3. Диметиловый эфир
4. Этилена
2. Соединению с ковалентной связью соответствует формула
1. Na2O 2. MgCl2 3. CaBr2 4. HF
3. Вещество с ковалентной неполярной связью имеет формулу
1. h3O 2. Br2 3. Ch5 4. N2O5
4. Веществом с ионной связью является
1. CaF2 2. Cl2 3. Nh4 4. SO2
5. Водородные связи образуются между молекулами
1. Метанола
2. Метана
3. Ацетилена
4. Метилформиата
6. Ковалентная неполярная связь характерна для каждого из двух веществ:
1. Азота и озона
2. Воды и аммиака
3. Меди и азота
4. Брома и метана
7. Ковалентная полярная связь характерна для вещества
1. KI 2. CaO 3. Na2S 4. Ch5
8. Ковалентная неполярная связь характерна для
1. I2 2. NO 3. CO 4. SiO2
9. Веществом с ковалентной полярной связью является
1. Cl2 2. NaBr 3. h3S 4. MgCl2
10. Ковалентная неполярная связь характерна для каждого из двух веществ:
1. Водорода и хлора
2. Воды и алмаза
3. Меди и азота
4. Брома и метана
В данной заметке использовались задания из сборника ЕГЭ 2016-го года под редакцией А.А. Кавериной.
ВВЕДЕНИЕ
%PDF-1.5
%
1 0 obj
>
/Metadata 2 0 R
/Outlines 3 0 R
/PageLayout /OneColumn
/Pages 4 0 R
/StructTreeRoot 5 0 R
/Type /Catalog
>>
endobj
6 0 obj /Comments ()
/Company ()
/CreationDate (D:20150227082350+03’00’)
/Creator
/Keywords ()
/ModDate (D:20150227082401+03’00’)
/Producer (Adobe PDF Library 10.0)
/SourceModified (D:20150227051859)
/Subject ()
/Title
>>
endobj
2 0 obj
>
stream
2015-02-27T08:24:01+03:002015-02-27T08:23:50+03:002015-02-27T08:24:01+03:00Acrobat PDFMaker 10. 1 для Worduuid:c8f0c946-4918-45cd-9d6b-1bad6009c878uuid:9ca518a8-22ec-4c0b-9cd6-94beb6243623
1 для Worduuid:c8f0c946-4918-45cd-9d6b-1bad6009c878uuid:9ca518a8-22ec-4c0b-9cd6-94beb6243623
`vfǘܲKdwmcSǚ!k08lۺk@3,lΨn7?،tOX2?㖘 gɈB_A{wyIBFsWn;1[
Спирты.
 Тренировочные задания для подготовки к ЕГЭ.
Тренировочные задания для подготовки к ЕГЭ.Спирты. Тестовые задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, которые справедливы для метанола:
1) является жидкостью с характерным запахом
2) является токсичным
3) имеет атом углерода в состоянии sp2-гибридизации
4) является вторичным спиртом
5) плохо растворим в воде
РешениеЗадание №2
Выберите два утверждения, которые справедливы для метанола:
1) является электролитом
2) не вступает в реакцию внутримолекулярной дегидратации
3) плохо растворяется в воде
4) между молекулами есть водородные связи
5) является изомером этанола
РешениеЗадание №3
Выберите два утверждения, которые справедливы для этанола:
1) все связи в молекуле ковалентные неполярные
2) хорошо растворим в воде
3) не вступает в реакцию внутримолекулярной дегидратации
4) изменяет окраску индикаторов
5) обладает наркотическим действием на организм человека
РешениеЗадание №4
Выберите два утверждения справедливых для этанола:
1) проявляет сильные кислотные свойства
2) является электролитом
3) получают сбраживанием сахаристых веществ
4) содержит один первичный атом углерода
5) используют в медицине
РешениеЗадание №5
Выберите два утверждения, которые справедливы для всех одноатомных спиртов:
1) жидкости с характерным запахом
2) токсичны
3) содержат межмолекулярные водородные связи
4) при окислении дают альдегиды
5) их можно обнаружить с помощью гидроксида меди (II)
РешениеЗадание №6
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует метанол:
- 1. СH3OH
- 2. KOH
- 3. Н2
- 4. KMnO4
- 5. C2H6
Задание №7
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует этанол:
- 1.
 [Ag(NH3)2]OH
[Ag(NH3)2]OH - 2. Na
- 3. HBr
- 4. Cu
- 5. Cu(OH)2
Задание №8
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует пропанол-1:
- 1. CH3COOH
- 2. KOH
- 3. СH3OH
- 4. FeCl3
- 5. Н2
Задание №9
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует пропанол-2:
1) гидроксид меди (II)
2) оксид алюминия
3) пропановая кислота
4) пропанол-2
5) ацетат натрия
РешениеЗадание №10
Из предложенного перечня веществ выберите два таких, с которыми не реагирует метанол:
- 1. KOH
- 2. С2H5OH
- 3. CuO
- 4. Cu
- 5. HBr
Задание №11
Из предложенного перечня веществ выберите два таких, с которыми не реагирует этанол:
- 1. CH3-O-CH3
- 2. Na
- 3. HBr
- 4. K2Cr2O7
- 5. Cu(OH)2
Задание №12
Из предложенного перечня веществ выберите два таких, с которыми не реагирует пропанол-1:
1) этан
2) аммиак
3) этаналь
4) гидроксид натрия
5) метанол
РешениеЗадание №13
Из предложенного перечня веществ выберите два таких, с которыми не реагирует пропанол-2:
- 1. H2
- 2. H2O
- 3. CuO
- 4. HCl
- 5. CH3CHO
Задание №14
Из предложенного перечня веществ выберите два таких, которые нельзя получить из метанола в одну стадию:
1) диметиловый эфир
2) ацетон
3) синтез-газ
4) метилат натрия
5) метилацетат
РешениеЗадание №15
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этаналь
2) метилэтаноат
3) этилат калия
4) этилформиат
5) дихлорэтан
РешениеЗадание №16
Из предложенного перечня веществ выберите два таких, которые нельзя получить из метанола в одну стадию:
1) метиламин
2) метилат натрия
3) этилформиат
4) метаноат натрия
5) метаналь
РешениеЗадание №17
Из предложенного перечня веществ выберите два таких, которые нельзя получить из пропанола-1 в одну стадию:
1) этилпропаноат
2) пропилацетат
3) пропен
4) пропанон
5) дипропиловый эфир
РешениеЗадание №18
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этановую кислоту
2) этилен
3) этандиол-1,2
4) 1,2-дихлорэтан
5) диэтиловый эфир
РешениеЗадание №19
Из предложенного перечня веществ выберите два таких, которые можно получить из метанола в одну стадию:
1) метилэтиловый эфир
2) этилметаноат
3) диизопропиловый эфир
4) хлорметан
5) метан
РешениеЗадание №20
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) ацетальдегид
2) дивинил
3) этилхлорид
4) этиленгликоль
5) метилацетат
РешениеЗадание №21
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этилат натрия
2) этиламин
3) изопрен
4) этан
5) уксусную кислоту
РешениеЗадание №22
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этановая кислота
2) ацетон
3) диэтиловый эфир
4) бутадиен-1,3
5) этан
РешениеЗадание №23
Из предложенного перечня веществ выберите два таких, которые нельзя получить из пропанола-2 в одну стадию:
1) этилпропаноат
2) изопропилацетат
3) пропен
4) пропановую кислоту
5) диизопропиловый эфир
РешениеЗадание №24
Из предложенного перечня реакций выберите две таких, с помощью которых нельзя получить пропанол-2 в одну стадию:
1) гидратация пропена
2) взаимодействие 1-хлорпропана с водным раствором щелочи
3) гидрирование пропанона
4) гидролиз изопропилацетата
5) взаимодействие 1-хлорпропана со спиртовым раствором щелочи
РешениеЗадание №25
Из предложенного перечня реакций выберите две таких, с помощью которых нельзя получить этанол в одну стадию:
1) гидролиз метиформиата
2) гидрирование этаналя
3) щелочной гидролиз метилацетата
4) гидролиз этилата калия
5) гидратация этилена
РешениеЗадание №26
Из предложенного перечня реакций выберите две таких, с помощью которых нельзя получить пропанол-2 в одну стадию:
1) гидратация пропина
2) гидролиз изопропилпропионата
3) гидрирование пропена
4) щелочной гидролиз изопропилформиата
5) гидратация пропена
РешениеЗадание №27
Из предложенного перечня выберите две реакции, в которые может вступать бутанол-1:
1) внутримолекулярная дегидратация
2) гидрирование
3) взаимодействие со щелочами
4) этерификация
5) гидролиз
РешениеЗадание №28
Из предложенного перечня реакций, выберите две таких, в которые не может вступать бутанол-1:
1) межмолекулярная дегидратация
2) окисление
3) этерификация
4) гидрирование
5) гидролиз
РешениеЗадание №29
Из предложенного перечня веществ выберите два таких, из которых нельзя получить при дегидрировании кетон:
1) бутанол-2
2) пропанол-2
3) бутанол -1
4) о-крезол.
5) циклогексанол
РешениеЗадание №30
Из предложенного перечня веществ выберите два таких, из которых можно получить при окислении кетон:
1) бутанол-2
2) пропанол-1
3) толуол
4) бутанол-1
5) 3-метилпентанол-2
РешениеЗадание №31
Из предложенного перечня веществ выберите два таких, которые являются спиртами:
1) толуол
2) кумол
3) фенол
4) пентанол
5) метанол
РешениеЗадание №32
Из предложенного перечня веществ выберите два таких, которые не являются спиртами:
1) глицерин
2) кумол
3) крезол
4) пентанол-2
5) этиленгликоль
РешениеЗадание №33
Из предложенного перечня веществ выберите два таких, которые являются спиртами:
1) бутанол
2) изопропилбензол
3) гидроксибензол
4) о-ксилол
5) циклогексанол
РешениеЗадание №34
Из предложенного перечня веществ выберите два таких, которые являются спиртами:
1) пропаналь
2) фенилметанол
3) гидроксибензол
4) кумол
5) изопропанол
РешениеЗадание №35
Из предложенного перечня реакций, характеризующих свойства спиртов, выберите две таких, которые сопровождаются разрывом связи С―О в молекуле спирта:
1) C2H5OH+ CH3OH → C2H5OCH3 + H2O
2) 2C2H5OH + 2Na → 2C2H5ONa + H2
3) CH3OH + CH3COOH ⇆ CH3COOCH3+H2O
4) CH3OH+HCl → CH3Cl+H2O
5) HO-CH2-CH2-OH + 2K → KO-CH2-CH2-OK + H2
РешениеЗадание №36
Из предложенного перечня реакций, характеризующих свойства спиртов, выберите две таких, которые сопровождаются разрывом связи С―О в молекуле спирта:
1) HO-CH2-CH2-OH + 2K → KO-CH2-CH2-OK + H2
2) 2C2H5OH + 2Na → 2C2H5ONa + H2
3) CH3OH + CH3COOH ⇆ CH3COOCH3 + H2O
4) 2CH3OH → CH3OCH3 + H2O
5) CH3OH + HBr → CH3Br + H2O
РешениеЗадание №37
Из предложенного перечня реакций, характеризующих свойства спиртов, выберите две таких, которые сопровождаются разрывом связи O―H в молекуле спирта:
1) CH3OH + HCl → CH3Cl + H2O
2) CH3OH + CH3COOH ⇆ CH3COOCH3 + H2O
3) C2H5OH → CH2=CH2 + H2O
4) C2H5OH + CuO → CH3CHO + H2O + Cu
5) HO-CH2-CH2-OH + 2HCl → Cl-CH2-CH2-Cl + H2O
РешениеЗадание №38
Из предложенного перечня реактивов, выберите два таких, с помощью которых можно обнаружить этанол
1) хлороводород
2) оксид меди (II)
3) гидроксид меди (II)
4) метанол
5) калий
РешениеЗадание №39
Из предложенного перечня веществ, выберите два таких, которые являются одноатомными спиртами.
1) глицерин
2) бензиловый спирт
3) этиленгликоль
4) метанол
5) сорбит
РешениеЗадание №40
Из предложенного перечня веществ, выберите два таких, с которыми этанол вступает в реакцию этерификации.
- 1. CH3OH
- 2. CH3CHO
- 3. HOCH2CH2OH
- 4. CH3COOH
- 5. H2SO4
Задание №41
Из предложенного перечня веществ, выберите два таких, которые могут образоваться в результате взаимодействия этанола с концентрированной серной кислотой
1) этилен
2) этаналь
3) диэтиловый эфир
4) этан
5) этановая кислота
РешениеЗадание №42
Из предложенного перечня веществ, выберите два таких, которые могут образоваться в результате взаимодействия пропанола-2 с концентрированной серной кислотой.
1) пропадиен
2) пропаналь
3) дипропиловый эфир
4) пропен
5) диизопропиловый эфир
РешениеЗадание №43
Из предложенного перечня веществ, выберите два таких, которые при взаимодействии с этанолом образуют хлорэтан
1) хлорид натрия
2) хлорид меди (II)
3) хлорид фосфора (V)
4) хлорид фосфора (III)
5) хлорметан
РешениеЗадание №44
Из предложенного перечня веществ, выберите два таких, которые при взаимодействии с этанолом образуют хлорэтан
- 1. SOCl2
- 2. FeCl3
- 3. C2H5Cl
- 4. Cu[(NH3)2]Cl
- 5. HCl
Задание №45
Из предложенного перечня формул, выберите две, которые соответствуют формуле предельного одноатомного спирта
- 1. СnH2n+2O
- 2. СnH2nO
- 3. СnH2n+2O2
- 4. СnH2n+1OH
- 5. СnH2nO2
Задание №46
Из предложенного перечня веществ выберите два таких, с которыми реагирует натрий:
1) этен
2) этин
3) этанол
4) толуол
5) этан
РешениеЗадание №47
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует натрий:
1) изопрен
2) ксилол
3) бензол
4) пропанол-2
5) циклогексанол
РешениеИз предложенного перечня классов органических соединений, выберите два таких, которые образуются в реакциях дегидратации спиртов.
1) алкены
2) сложные эфиры
3) простые эфиры
4) альдегиды
5) кетоны
РешениеЗадание №49
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию этерификации с карбоновыми кислотами
1) фенол
2) бензиловый спирт
3) этаналь
4) пентанол
5) м-крезол
РешениеЗадание №50
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с пропанолом
- 1. HCOOH
- 2. HBr
- 3. Cu(OH)2
- 4. С2Н4
- 5. Br2(р-р)
Задание №51
Из предложенного перечня реакций, выберите две таких, в которые могут вступать все предельные одноатомные спирты:
1) дегидрирование
2) нейтрализации
3) этерификация
4) окисление
5) поликонденсация
РешениеЗадание №52
Из предложенного перечня реакций, выберите две таких, в которые могут вступать предельные одноатомные спирты:
1) нейтрализации
2) дегидрирование
3) полимеризации
4) дегидратация
5) гидрирование
РешениеЗадание №53
Из предложенного перечня реакций, выберите две таких, которые характерны для предельных одноатомных спиртов:
1) нейтрализации
2) дегидрирование
3) гидратация
4) дегидратация
5) поликонденсация
РешениеЗадание №54
Из предложенного перечня соединений, выберите два таких, которые способны вступать в реакцию внутримолекулярной дегидратации:
1) метанол
2) циклогексанол
3) фенол
4) стирол
5) пропанол-2
РешениеЗадание №55
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с циклогексанолом:
- 1. CuO
- 2. NaOH
- 3. Br2(р-р)
- 4. HCl
- 5. Cu(OH)2
Задание №56
Из предложенного перечня реагентов выберите такие, которые вступают в реакцию с циклогексанолом:
- 1.
 H2
H2 - 2. K
- 3. Cu
- 4. KOH
- 5. K2Cr2O7, H2SO4
Задание №57
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с циклогексанолом:
- 1. H2O
- 2. СН4
- 3. СН3СООН
- 4. СН3ОН
- 5. [Аg(NH3)2]OH
Спирты. Задания на установление соответствия.
Задание №1
Установите соответствие между названием алкена и основным продуктом его взаимодействия с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКЕН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
1) этен 2) пропен 3) бутен-1 4) бутен-2 | 1) пропанол-1 2) этаналь 3) этанол 4) пропанол-2 5) бутанол-1 6) бутанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №2
Установите соответствие между названием алкена и основным продуктом его взаимодействия с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКЕН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
1) 2,3-диметилбутен-1 2) 2,3-диметилбутен-2 3) 2-метилбутен-1 4) 3,3-диметилбутен-1 | 1) 2,3-диметилбутанол-2 2) 2,2-диметилбутанол-2 3) 2-метилбутанол-1 4) 2,2-диметилбутанол-3 5) 2-метилбутанол-2 6) 3,3-диметилбутанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №3
Установите соответствие между названием алкена и основным продуктом его взаимодействия с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКЕН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
1) 3-метилпентен-1 2) 2-метилбутен-1 3) пентен-1 4) 3,3-диметилбутен-1 | 1) 3-метилпентанол-2 2) 2-метилбутанол-2 3) пентанол-1 4) пентанол-2 5) 2,2-диметилбутанол-3 6) 3,3-диметилбутанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №4
Установите соответствие между назвванием спирта и продуктом его внутримолекулярной дегидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПИРТ | ПРОДУКТ ДЕГИДРАТАЦИИ |
А) пропанол-2 Б) пропанол-1 В) бутанол-1 Г) этанол | 1) бутен-1 2) пропен 3) этилен 4) этан 5) бутен-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №5
Установите соответствие между названием спирта и возможным продуктом его внутримолекулярной дегидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПИРТ | ПРОДУКТ ДЕГИДРАТАЦИИ |
А) пропанол-2 Б) пропанол-1 В) бутанол-1 Г) бутанол-2 | 1) бутен-2 2) пропан 3) бутен-1 4) пропен 5) бутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №6
Установите соответствие между названием спирта и основным продуктом его внутримолекулярной дегидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПИРТ | ПРОДУКТ ДЕГИДРАТАЦИИ |
А) 2-метилпропанол-2 Б) 2,4-диметилпентанол-3 В) 3-метилбутанол-2 Г) 2-метилбутанол-2 | 1) 2,4-диметилпентен-3 2) 3-метилбутен-2 3) 2-метилпропен 4) 2,4-диметилпентен-2 5) 2-метилбутен-2 6) 2,4-диметилпентен-1 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №7
Установите соответствие между схемой реакции и возможным органическим продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
А) CH3OH Б) CH3OH + CuO В) C2H5OH Г) C2H5OH | 1) ацетальдегид 2) метаналь 3) диэтиловый эфир 4) углекислый газ 5) диметиловый эфир 6) этан 7) метилэтиловый эфир |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №8
Установите соответствие между исходными веществами и возможным органическим продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
А) CH3-CH(OH)-CH3 Б) CH3-CH2-CH2-OH В) CH3-CH2-CH(OH)-CH3 Г) CH3-CH2-CH(OH)-CH3 | 1) пропен 2) бутен-2 3) диизопропиловый эфир 4) бутен-1 5) дипропиловый эфир 6) бутанон |
Запишите в таблицу выбранные цифры под соответствующими буквами.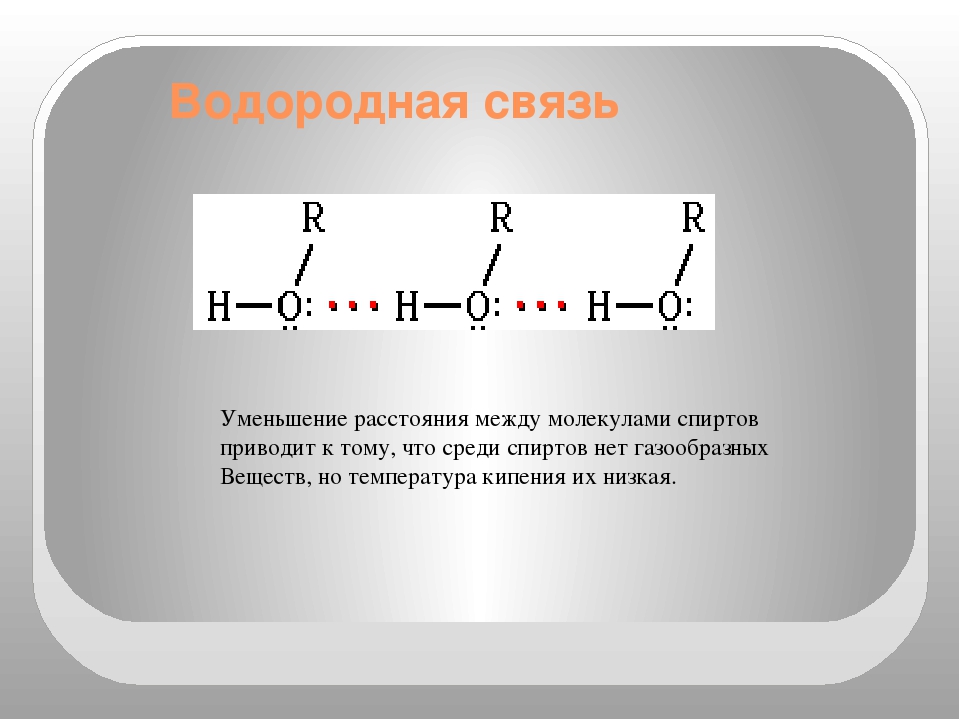
Задание №9
Установите соответствие между реагирующими веществами и возможным органическим продуктом реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
А) C2H5OH + HCl → Б) CH3-CH2-CH2-OH + HCl → В) C2H5OH + PCl5 → Г) CH3OH+HCOOH | 1) метилацетат 2) метилформиат 3) хлорметан 4) хлорэтан 5) 2-хлорпропан 6) 1-хлорпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №10
Установите соответствие парой веществ и органическим продуктом, образующимся при действии на их смесь концентрированной серной кислоты при нагревании: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
А) C2H5OH + CH3COOH Б) HCOOH + CH3-CH(OH)-CH3 В) СH3COOH + CH3OH Г) C2H5OH + С2H5COOH | 1) метилэтаноат 2) этилацетат 3) метилпропионат 4) изопропилформиат 5) этилпропионат 6) пропилацетат |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №11
Установите соответствие между формулой сложного эфира и одним из продуктов его кислотного гидролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| СЛОЖНЫЙ ЭФИР | ПРОДУКТ ГИДРОЛИЗА |
А) СH3COOCH(CH3)2 Б) С2H5COOCH3 В) С2H5COOC2H5 Г) СH3COOCH2CH2CH3 | 1) бутановая кислота 2) пропанол-1 3) метанол 4) этанол 5) метановая кислота 6) пропанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №12
Установите соответствие между исходными веществами и органическим продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
А) C2H5OH + HСl → Б) C2H5OH + K → В) CH3OH + KOH → Г) C2H5OH + SOCl2 → | 1) хлорэтан 2) 1,1-дихлорэтан 3) этилат калия 4) этаноат калия 5) метилат калия 6) вещества не взаимодействуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №13
Установите соответствие между исходными веществами и углеродсодержащим продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | УГЛЕРОДСОДЕРЖАЩИЙ ПРОДУКТ |
А) CH3OH + KMnO4 + H2SO4 Б) C2H5OH + KMnO4 + H2SO4 В) C2H5OH + KMnO4 + KOH Г) CH3-CH2-CH2-OH + KMnO4 + H2SO4 | 1) метаналь 2) метановая кислота 3) углекислый газ 4) уксусная кислота 5) ацетат калия 6) пропановая кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №14
Установите соответствие между названием спирта и продуктом, который образуется при окислении вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
А) пропанол-2 Б) метанол В) циклогексанол Г) этанол | 1) пропаналь 2) метаналь 3) ацетон 4) ацетальдегид 5) циклогексен 6) циклогексанон 7) углекислый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №15
Установите соответствие между названием спирта и продуктом, который образуется при его окислении оксидом меди (II) при нагревании: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СПИРТА | ПРОДУКТ ОКИСЛЕНИЯ |
А) циклогексанол Б) бензиловый спирт В) пропанол-2 Г) пропанол-1 | 1) циклогексан 2) бензойная кислота 3) пропанон 4) пропаналь 5) циклогексанон 6) бензальдегид |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №16
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
А) циклогексанол + HCl Б) бензиловый спирт + HCl В) циклогексанол + Na Г) бензиловый спирт + CH3OH | 1) циклогексанолят натрия 2) бензилат натрия 3) бензоат натрия 4) метилбензиловый эфир 5) хлорциклогексан 6) хлорфенилметан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №17
Установите соответствие между схемой реакции и основным органическим продуктом, который образуется в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
А) циклогексанол + KOH → Б) бензиловый спирт + Na → В) циклогексанол Г) фенилметанол + CH3COOH → | 1) циклогексен 2) бензоат натрия 3) бензилат натрия 4) бензилацетат 5) циклогексанон 6) исходные вещества не взаимодействуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №18
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
А) этилат натрия и вода Б) метилат натрия и хлорэтан В) метилат натрия и вода Г) метилат натрия и соляная кислота | 1) хлорметан 2) этанол 3) метилэтиловый эфир 4) диметиловый эфир 5) диэтиловый эфир 6) метанол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №19
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
А) метанол и этанол Б) метанол и аммиак В) пропанол-1 и муравьиная кислота Г) метанол и оксид меди(II) | 1) пропилформиат 2) метилацетат 3) метилэтиловый эфир 4) метиламин 5) метилпропионат 6) метаналь |
Запишите в таблицу выбранные цифры под соответствующими буквами.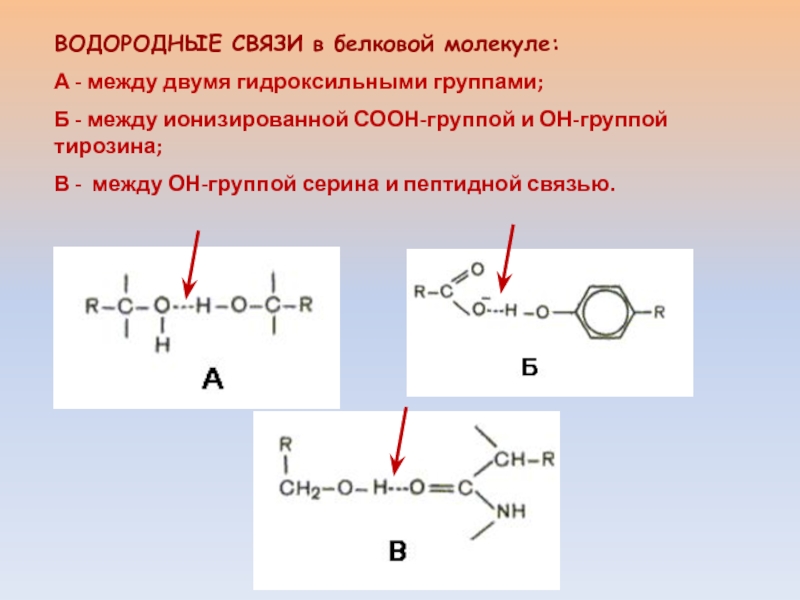
Задание №20
Установите соответствие между схемой реакции и продуктом, образующимся в результате ее протекания: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ |
А) этанол Б) C2H5OH+ HNO3 В) C2H5OH + SOCl2 Г) C2H5OH + HCl | 1) CH3CH2Cl 2) CH3CH2NO2 3) CH3CH2ONO2 4) ClCH2CH2Cl 5) CH2=CH2 6) CH2=CH-CH=CH2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЦепочки на спирты.
Задание №6
Навеску неизвестного соединения массой 4,4 г сожгли в избытке кислорода, в результате чего в качестве продуктов сгорания образовались только углекислый газ объемом 5,6 л и вода массой 5,4 г. Определите молекулярную формулу данного соединения и его структуру, если известно, что его молекула содержит четвертичный атом углерода.
Решениеn(CO2) = V(CO2)/Vm = 5,6/22,4 = 0,25 моль, следовательно, n(C) = n(CO2) = 0,25 моль,
тогда, m(C) = n(C)⋅M(C) = 0,25⋅12 = 3 г,
n(H2O) = m(H2O)/M(H2O) = 5,4/18 = 0,3 моль, следовательно, n(H) = 2⋅n(H2O) = 2⋅0,3 = 0,6 моль,
тогда, m(H) = n(H)⋅M(H) = 0,6⋅1 = 0,6 г,
m(O) = m(в-ва) — m(C) — m(H) = 4,4 – 3 – 0,6 = 0,8 г,
n(O) = m(O)/M(O) = 0,8/16 = 0,05 моль,
n(С):n(H):n(O) = 0,25:0,6:0,05 = 5:12:1
Таким образом, простейшая формула искомого соединения C5H12O.
Предположим, что простейшая формула совпадает с истинной. Тогда, искомым веществом может являться какой-либо предельный нециклический одноатомный спирт. В условии сказано, что искомое вещество содержит четвертичный углеродный атом. Единственным подходящим веществом в таком случае является 2,2-диметилпропанол-1, структурная формула которого:
Тогда, искомым веществом может являться какой-либо предельный нециклический одноатомный спирт. В условии сказано, что искомое вещество содержит четвертичный углеродный атом. Единственным подходящим веществом в таком случае является 2,2-диметилпропанол-1, структурная формула которого:
Задание №7
При сжигании 5,8 г неизвестного вещества в качестве продуктов сгорания образовались только вода и углекислый газ, масса которого составила 13,2 г. Определите молекулярную формулу вещества и его структуру, если известно, что оно содержит кислород с массовой долей 27,59%. При этом само вещество может быть получено в одну стадию из циклогексена.
Решениеn(CO2) = m(CO2)/M(CO2) = 13,2/44 = 0,3 моль, следовательно, n(C) = n(CO2) = 0,3 моль,
m(C) = n(C) ·M(C) = 0,3·12 = 3,6 г,
m(O) = m(в-ва)·w(O) = 5,8·0,2759 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
m(H) = m(в-ва) – m(O) – m(C) = 5,8 – 1,6 – 3,6 = 0,6 г, следовательно,
n(H) = m(H)/M(H) = 0,6/1 = 0,6 моль,
n(С):n(H):n(O) = 0,3:0,6:0,1 = 3:6:1
Таким образом, простейшая формула искомого соединения C3H6O.
Соединений с такой истинной молекулярной формулой, которые могли бы быть получены в одну стадию из циклогексена не существует. Поэтому попробуем удвоить простейшую формулу. Получаем C6H12O2. Искомым соединением может быть циклогександиол-1,2 со структурной формулой:
Задание №8
Навеску неизвестного соединения массой 7,4 г сожгли в избытке кислорода. В результате сгорания данной порции вещества в качестве продуктов сгорания образовались только 8,96 л углекислого газа и 11,2 л паров воды (в пересчете на н.у.). Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно реагирует с щелочными металлами, а также является устойчивым к окислению раствором перманганата калия.
Решениеn(CO2) = V(CO2)/Vm = 8,96/22,4 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
тогда, m(C) = n(C)·M(C) = 0,4·12 = 4,8 г,
n(H2O) = V(H2O)/Vm = 11,2/22,4 = 0,5 моль, следовательно, n(H) = 2n(H2O) = 2·0,5 = 1 моль,
тогда, m(H) = n(H)·M(H) = 1·1 = 1 г,
m(O) = m(в-ва) — m(H) — m(С) = 7,4 – 1 – 4,8 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
n(C):n(H):n(O) = 0,4:1:0,1 = 4:10:1
Таким образом, простейшая формула искомого органического вещества C4H10O.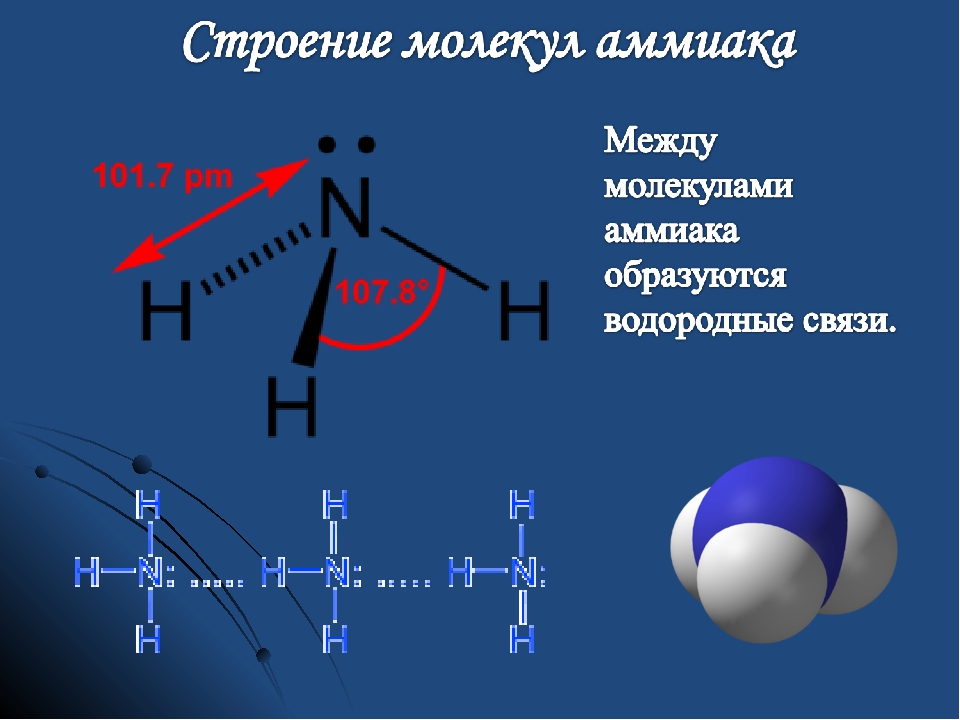
Данная формула, очевидно, является также и истинной молекулярной, поскольку ее удвоение, утроение и т.д. приводит к невозможному для органического вещества составу молекулы.
Исходя из того, что искомое соединение является устойчивым к окислению раствором перманганата калия, можно заключить, что им является третбутиловый спирт:
3.8: Эфиры — Химия LibreTexts
Цели обучения
- Опишите структурное различие между спиртом и эфиром, которое влияет на физические характеристики и реакционную способность каждого из них.
- Назовите простые эфиры.
- Опишите структуру и использование некоторых эфиров.
С общей формулой ROR ‘простой эфир можно рассматривать как производное воды, в котором оба атома водорода замещены алкильными или арильными группами. Его также можно рассматривать как производное спирта (ROH), в котором атом водорода группы ОН заменен второй алкильной или арильной группой:
\ [\ mathrm {HOH \ underset {H \: atom} {\ xrightarrow {replace \: both}} ROR ‘\ underset {of \: OH \: group} {\ xleftarrow {replace \: H \: atom} } ROH} \]
Простые эфиры имеют простые общие названия, образованные из названий групп, связанных с атомом кислорода, за которыми следует общее название ether .Например, CH 3 –O – CH 2 CH 2 CH 3 представляет собой метилпропиловый эфир. Если обе группы одинаковы, перед названием группы должен стоять префикс di -, как в случае диметилового эфира (CH 3 –O – CH 3 ) и диэтилового эфира CH 3 CH 2 — O – CH 2 CH 3 .
Молекулы эфира не имеют атома водорода на атоме кислорода (то есть группы ОН). Следовательно, между молекулами эфира нет межмолекулярной водородной связи, и поэтому простые эфиры имеют довольно низкие температуры кипения для данной молярной массы.Действительно, простые эфиры имеют температуры кипения примерно такие же, как и у алканов сопоставимой молярной массы, и намного ниже, чем у соответствующих спиртов (Таблица \ (\ PageIndex {1} \)).
| Концентрированная структурная формула | Имя | Молярная масса | Температура кипения (° C) | Межмолекулярная водородная связь в чистой жидкости? |
|---|---|---|---|---|
| Канал 3 Канал 2 Канал 3 | пропан | 44 | –42 | нет |
| CH 3 OCH 3 | диметиловый эфир | 46 | –25 | нет |
| Канал 3 Канал 2 ОН | спирт этиловый | 46 | 78 | да |
| Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 | пентан | 72 | 36 | нет |
| Канал 3 Канал 2 ОКН 2 Канал 3 | диэтиловый эфир | 74 | 35 | нет |
| Канал 3 Канал 2 Канал 2 Канал 2 ОН | спирт бутиловый | 74 | 117 | да |
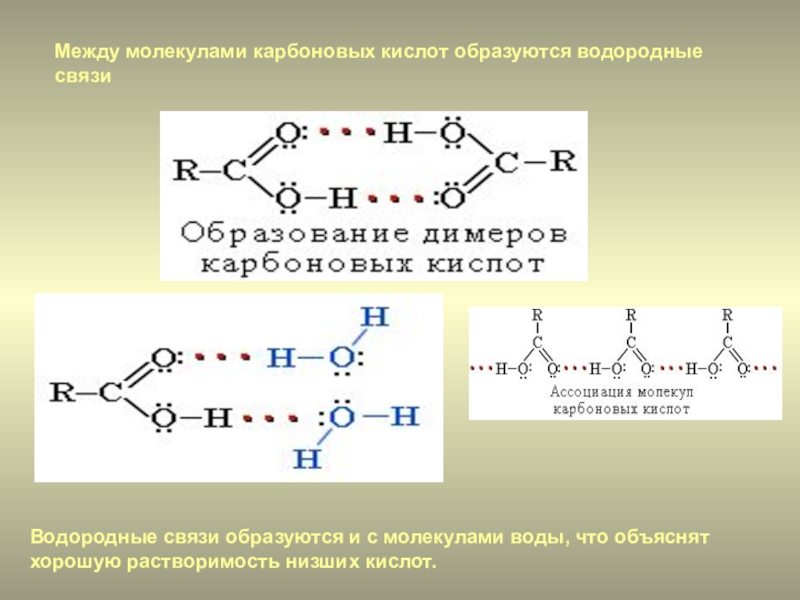
Однако молекулы эфира имеют атом кислорода и участвуют в водородных связях с молекулами воды. Следовательно, эфир имеет примерно такую же растворимость в воде, как и спирт, изомерный с ним. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворяются. растворим в воде (8 г / 100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как и спирт, изомерный с ним. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворяются. растворим в воде (8 г / 100 мл воды).
Пример \ (\ PageIndex {1} \)
Какое общее название у каждого эфира?
- Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3
Раствор
- Углеродные группы по обе стороны от атома кислорода представляют собой пропильные (CH 3 CH 2 CH 2 ) группы, поэтому соединение представляет собой дипропиловый эфир.
- Трехуглеродная группа присоединена к среднему атому углерода, поэтому это изопропильная группа. Одноуглеродная группа представляет собой метильную группу. Соединение представляет собой изопропилметиловый эфир.
Упражнение \ (\ PageIndex {1} \)
Какое общее название у каждого эфира?
Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3
Для вашего здоровья: эфиры как общие анестетики
Общий анестетик действует на мозг, вызывая бессознательное состояние и общую нечувствительность к ощущениям или боли.Диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) был первым используемым общим анестетиком.
Уильям Мортон, бостонский дантист, ввел диэтиловый эфир в хирургическую практику в 1846 году. На этой картине изображена операция в Бостоне в 1846 году, в которой диэтиловый эфир использовался в качестве анестетика. Вдыхание паров эфира вызывает потерю сознания, подавляя активность центральной нервной системы. Источник: Картина Уильяма Мортона Эрнеста Борд.
Вдыхание паров эфира вызывает потерю сознания, подавляя активность центральной нервной системы. Источник: Картина Уильяма Мортона Эрнеста Борд.Диэтиловый эфир относительно безопасен, поскольку существует довольно большой разрыв между дозой, обеспечивающей эффективный уровень анестезии, и смертельной дозой.Однако, поскольку он легко воспламеняется и имеет дополнительный недостаток, заключающийся в том, что он вызывает тошноту, его заменили более новыми ингаляционными анестетиками, включая фторсодержащие соединения галотан, энфлуран и изофлуран. К сожалению, безопасность этих соединений для персонала операционной была поставлена под сомнение. Например, женщины, работающие в операционных, подвергшихся воздействию галотана, чаще страдают выкидышами, чем женщины в общей популяции.
Эти три современных галогенсодержащих анестетика для ингаляции менее воспламеняемы, чем диэтиловый эфир.
Сводка
Чтобы дать эфирам общие названия, просто назовите группы, присоединенные к атому кислорода, после чего укажите общее название ether . Если обе группы одинаковы, имени группы должен предшествовать префикс di -. Молекулы эфира не имеют группы ОН и, следовательно, межмолекулярной водородной связи. Следовательно, простые эфиры имеют довольно низкие температуры кипения для данной молярной массы. Молекулы эфира имеют атом кислорода и могут вступать в водородную связь с молекулами воды.Молекула эфира имеет примерно такую же растворимость в воде, как и спирт, изомерный с ней.
Упражнения по обзору концепции
Почему диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) имеет гораздо более низкую точку кипения, чем 1-бутанол (CH 3 CH 2 CH 2 CH 2 ОЙ)?
Что более растворимо в воде — этилметиловый эфир (CH 3 CH 2 OCH 3 ) или 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH)? Объяснять.

Ответы
Диэтиловый эфир не имеет межмолекулярной водородной связи, поскольку отсутствует группа ОН; 1-бутанол имеет ОН и участвует в межмолекулярных водородных связях.
Этилметиловый эфир (три атома углерода, один атом кислорода) более растворим в воде, чем 1-бутанол (четыре атома углерода, один атом кислорода), хотя оба могут вступать в водородную связь с водой.
Упражнения
Как этанол может давать два разных продукта при нагревании с серной кислотой? Назовите эти продукты.
Какой из этих эфиров изомерен этанолу — CH 3 CH 2 OCH 2 CH 3 , CH 3 OCH 2 CH 3 или CH 3 OCH 3 ?
Назовите каждое соединение.
- Канал 3 ОКН 2 Канал 2 Канал 3
Назовите каждое соединение.
- Канал 3 Канал 2 Канал 2 Канал 2 Канал 3
- Канал 3 Канал 2 Канал 2 Канал 2 Канал 3
Изобразите структуру каждого соединения.
- метилэтиловый эфир
- трет -бутилэтиловый эфир
Изобразите структуру каждого соединения.
- диизопропиловый эфир
- циклопропилпропиловый эфир
Ответы
Внутримолекулярная (и H, и OH происходят из одной и той же молекулы) дегидратация дает этилен; межмолекулярная (H происходит от одной молекулы, а OH происходит от другой молекулы) дегидратация дает диэтиловый эфир.

- метилпропиловый эфир
- этилизопропиловый эфир
- Канал 3 ОКН 2 Канал 3
Водородная связь — Химия LibreTexts
На этой странице объясняется происхождение водородной связи — относительно сильной формы межмолекулярного притяжения.
Доказательства водородной связи
Многие элементы образуют соединения с водородом. Если вы нанесете на график точки кипения соединений элементов группы 4 с водородом, вы обнаружите, что точки кипения увеличиваются по мере того, как вы спускаетесь по группе.
Повышение температуры кипения происходит из-за того, что молекулы становятся больше с увеличением количества электронов, и поэтому дисперсионные силы Ван-дер-Ваальса становятся больше. Если вы повторите это упражнение с соединениями элементов групп 5, 6 и 7 с водородом, произойдет нечто странное.
Хотя по большей части тенденция в точности такая же, как и в группе 4 (по точно таким же причинам), температура кипения соединения водорода с первым элементом в каждой группе аномально высока. В случае NH 3 , H 2 O и HF должны быть некоторые дополнительные межмолекулярные силы притяжения, требующие значительно большей тепловой энергии для разрушения. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
Происхождение водородных связей
Молекулы с этой дополнительной связью:
Сплошная линия представляет собой связь в плоскости экрана или бумаги.Пунктирные связи уходят обратно в экран или бумагу от вас, а клиновидные выходят к вам. Обратите внимание, что в каждой из этих молекул:
- Водород присоединяется непосредственно к одному из наиболее электроотрицательных элементов, в результате чего водород приобретает значительный положительный заряд.

- Каждый из элементов, к которым присоединен водород, не только существенно отрицателен, но также имеет по крайней мере одну «активную» неподеленную пару.
- Одинокие пары на 2-м уровне имеют электроны, содержащиеся в относительно небольшом объеме пространства, которое, следовательно, имеет высокую плотность отрицательного заряда.Одинокие пары на более высоких уровнях более расплывчаты и не так привлекательны для положительных вещей.
Рассмотрим две приближающиеся друг к другу молекулы воды.
Водород + настолько сильно притягивается к неподеленной паре, что это почти как если бы вы начинали образовывать координационную (дательный ковалентный) связь. Это не так далеко, но притяжение значительно сильнее, чем обычное диполь-дипольное взаимодействие. Водородные связи имеют примерно одну десятую прочности средней ковалентной связи и постоянно разрушаются и преобразовываются в жидкой воде.Если вы уподобите ковалентную связь между кислородом и водородом стабильному браку, водородная связь имеет статус «просто хороших друзей».
Вода как «идеальный» пример водородной связи
Обратите внимание, что каждая молекула воды потенциально может образовывать четыре водородные связи с окружающими молекулами воды. Есть ровно нужное количество + атомов водорода и неподеленных пар, так что каждый из них может участвовать в образовании водородных связей. Вот почему температура кипения воды выше, чем у аммиака или фтороводорода.В случае аммиака количество водородных связей ограничено тем фактом, что каждый азот имеет только одну неподеленную пару. В группе молекул аммиака недостаточно неподеленных пар, чтобы удовлетворить все водороды. Во фтористом водороде проблема заключается в нехватке водорода. В воде их ровно нужное количество. Воду можно рассматривать как «идеальную» систему с водородными связями.
На диаграмме показаны потенциальные водородные связи, образующиеся с ионом хлорида, Cl — . Хотя неподеленные пары в ионе хлорида находятся на трехуровневом уровне и обычно не будут достаточно активными для образования водородных связей, в этом случае они становятся более привлекательными из-за полного отрицательного заряда хлора.
Хотя неподеленные пары в ионе хлорида находятся на трехуровневом уровне и обычно не будут достаточно активными для образования водородных связей, в этом случае они становятся более привлекательными из-за полного отрицательного заряда хлора.
Каким бы сложным ни был отрицательный ион, всегда будут неподеленные пары, с которыми атомы водорода из молекул воды могут связывать водородные связи.
Водородная связь в спиртах
Спирт — это органическая молекула, содержащая группу -O-H.Любая молекула, которая имеет атом водорода, присоединенный непосредственно к кислороду или азоту, способна образовывать водородные связи. Такие молекулы всегда будут иметь более высокие температуры кипения, чем молекулы аналогичного размера, которые не имеют группы -O-H или -N-H. Водородная связь делает молекулы более «липкими», и для их разделения требуется больше тепла.
Этанол, CH 3 CH 2 -O-H, и метоксиметан, CH 3 -O-CH 3 , оба имеют одинаковую молекулярную формулу, C 2 H 6 O.
У них такое же количество электронов и длина молекулы. Притяжения Ван-дер-Ваальса (как дисперсионные силы, так и диполь-дипольные притяжения) в каждом из них будут примерно одинаковыми. Однако у этанола есть атом водорода, присоединенный непосредственно к кислороду, и этот кислород по-прежнему имеет точно такие же две неподеленные пары, что и в молекуле воды. Между молекулами этанола может происходить водородная связь, хотя и не так эффективно, как в воде. Водородная связь ограничена тем фактом, что в каждой молекуле этанола есть только один водород с достаточным зарядом +.
В метоксиметане неподеленные пары кислорода все еще присутствуют, но атомов водорода недостаточно для образования водородных связей. За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к очень электроотрицательному элементу, чтобы возникла водородная связь. Температуры кипения этанола и метоксиметана показывают драматический эффект, который водородная связь оказывает на липкость молекул этанола:
Температуры кипения этанола и метоксиметана показывают драматический эффект, который водородная связь оказывает на липкость молекул этанола:
| этанол (с водородными связями) | 78.5 ° С | |
| метоксиметан (без водородных связей) | -24,8 ° С |
Водородная связь в этаноле подняла его температуру кипения примерно на 100 ° C.
Важно понимать, что водородные связи существуют в дополнение к притяжению Ван-дер-Ваальса. Например, все следующие молекулы содержат одинаковое количество электронов, а первые две имеют примерно одинаковую длину. Более высокая температура кипения бутан-1-ола обусловлена дополнительной водородной связью.
При сравнении двух спиртов (содержащих группы -ОН), обе точки кипения высоки из-за дополнительных водородных связей из-за водорода, присоединенного непосредственно к кислороду, но это не одно и то же. Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление в молекуле делает ван-дер-ваальсовое притяжение менее эффективным, чем у более длинного бутан-1-ола.
Водородная связь в азоте, содержащем органические молекулы
Водородная связь также возникает в органических молекулах, содержащих группы N-H, точно так же, как это происходит в аммиаке.Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин), до больших молекул, таких как белки и ДНК. Две нити знаменитой двойной спирали в ДНК удерживаются вместе водородными связями между атомами водорода, присоединенными к азоту на одной нити, и неподеленными парами на другой азоте или кислородом на другой.
Авторы и авторство
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Межмолекулярные силы — MCAT Physical
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее то информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как как ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
спиртов и эфиров
спиртов и эфировСпирты и эфиры
Именование спиртов
Спирты содержат группу OH, присоединенную к насыщенному углероду.Распространенные названия спиртов: исходя из названия алкильной группы.
| СН 3 ОН | Метиловый спирт | ||
| Канал 3 Канал 2 ОН | Этиловый спирт | ||
| CH 3 CHOHCH 3 | Изопропиловый спирт |
Систематическая номенклатура спиртов добавляет окончание -ol к названию родительский алкан и использует номер для обозначения углерода, который несет группу ОН.Систематическое название для изопропиловый спирт, например, представляет собой 2-пропанол.
| СН 3 ОН | Метанол | ||
| Канал 3 Канал 2 ОН | Этанол | ||
| CH 3 CHOHCH 3 | 2-пропанол |
| Практическая задача 6: Более 50 органических соединений имеют
был изолирован от масла, которое дает характерный запах розы. Нажмите здесь, чтобы проверить свой ответ на практическая задача 6 |
Метанол, или метиловый спирт, также известен как древесный спирт , потому что он был Первоначально изготавливался путем нагревания дров до перегонки жидкости.Метанол очень токсичен, и многие люди ослепли или умерли, выпив его. Этанол или этиловый спирт — это алкоголь, связанный с «алкогольными» напитками. Это было сделано как минимум 6000 лет, добавляя дрожжи в растворы, богатые сахаром или крахмалом. В дрожжевые клетки получают энергию в результате катализируемых ферментами реакций, которые превращают сахар или крахмал в этанол и CO 2 .
C 6 H 12 O 6 ( водн. ) 2 CH 3 CH 2 OH ( водн. ) + 2 СО 2 ( г )
Когда концентрация спирта достигает 10–12% по объему, дрожжевые клетки погибают.Бренди, ром, джин и различные виски с более высокой концентрацией алкоголя приготовленный путем перегонки спирта, полученного в результате этой реакции брожения. Этанол не так же токсичен, как метанол, но все же опасен. Большинство людей отравлены кровью уровень алкоголя около 0,1 грамма на 100 мл. Повышение уровня алкоголя в концентрация крови от 0,4 до 0,6 г / 100 мл может привести к коме или смерти.
Определение уровня алкоголя в крови
Метод выбора для определения того, водит ли человек в состоянии алкогольного опьянения в состоянии алкогольного опьянения или за рулем DWI в состоянии алкогольного опьянения, является алкотестер, на который R. Ф. Боркенштейн в 1958 году. Химия алкотестера основана на реакции
между алкоголем в выдыхаемом воздухе и ионом хромата или дихромата.
Ф. Боркенштейн в 1958 году. Химия алкотестера основана на реакции
между алкоголем в выдыхаемом воздухе и ионом хромата или дихромата.
3 CH 3 CH 2 OH ( г ) + 2 Cr 2 O 7 2- ( водн. ) + 16 H + ( водн. ) 3 CH 3 CO 2 H ( водн. ) + 4 Cr 3+ ( водн. ) + 11 H 2 O ( л )
Прибор содержит две ампулы с небольшими образцами бихромата калия. растворяется в серной кислоте.Одна из этих ампул используется в качестве эталона. Другой открыт и образец выдыхаемого воздуха, который нужно проанализировать, добавляется в эту ампулу. Если алкоголь присутствует в дыхание, он восстанавливает желто-оранжевый ион Cr 2 O 7 2- до зеленый Cr 3+ ион. Степень, в которой цветовой баланс между двумя ампулами беспокоит — это прямое измерение количества алкоголя в образце выдыхаемого воздуха. Затем измерения содержания алкоголя в выдыхаемом воздухе преобразуются в оценки концентрация алкоголя в крови, предполагая, что 2100 мл воздуха выдыхается из в легких содержится столько же алкоголя, сколько в 1 мл крови.
Измерения, сделанные с помощью алкотестера, выражаются в процентах содержания алкоголя в крови. концентрация (BAC). В большинстве штатов BAC 0,10% достаточно для DUI или DWI. убеждение. (Это соответствует концентрации алкоголя в крови 0,10 грамма алкоголя. на 100 мл крови.)
Этанол окисляется до CO 2 и H 2 O алкогольдегидрогеназой.
ферменты в организме. Эта реакция выделяет 30 килоджоулей на грамм, что делает этанол
лучший источник энергии, чем углеводы (17 кДж / г), и почти такой же хороший источник
энергия в виде жира (38 кДж / г).Унция спиртного напитка крепостью 80 может обеспечить до 3%
среднесуточное потребление калорий и употребление алкоголя могут способствовать ожирению. Много
однако алкоголики недоедают из-за отсутствия витаминов в калориях.
они получают из спиртных напитков.
Много
однако алкоголики недоедают из-за отсутствия витаминов в калориях.
они получают из спиртных напитков.
Растворимость спиртов
Как правило, полярные или ионные вещества растворяются в полярных растворителях; неполярный вещества растворяются в неполярных растворителях.В результате углеводороды не растворяются в вода. Часто говорят, что они не смешиваются (буквально «не смешиваются») с водой. Спирты, как и следовало ожидать, обладают свойствами между крайними значениями углеводородов и вода. Когда углеводородная цепь короткая, спирт растворим в воде. Здесь нет ограничение на количество метанола (CH 3 OH) и этанола (CH 3 CH 2 OH), например, он может растворяться в определенном количестве воды. Поскольку углеводородная цепь становится длиннее, спирт становится менее растворимым в воде, как показано в таблице ниже.Один конец молекул спирта имеет настолько неполярный характер, что считается гидрофобным. (буквально «ненавидящий воду»). Другой конец содержит группу -OH, которая может образовывать водородные связи с соседними молекулами воды и поэтому считается гидрофильным (буквально «водолюбивый»). По мере удлинения углеводородной цепи гидрофобный характер молекулы увеличивается, и растворимость спирта в вода постепенно уменьшается, пока не становится практически нерастворимой в воде.
Растворимость спиртов в воде
| Формула | Имя | Растворимость в Вода (г / 100 г) | ||
| СН 3 ОН | метанол | бесконечно растворим | ||
| Канал 3 Канал 2 ОН | этанол | бесконечно растворим | ||
| Канал 3 (Канал 2 ) 2 ОН | пропанол | бесконечно растворим | ||
| Канал 3 (Канал 2 ) 3 ОН | бутанол | 9 | ||
| Канал 3 (Канал 2 ) 4 ОН | пентанол | 2. 7 7 | ||
| Канал 3 (Канал 2 ) 5 ОН | гексанол | 0,6 | ||
| Канал 3 (Канал 2 ) 6 ОН | гептанол | 0,18 | ||
| Канал 3 (Канал 2 ) 7 ОН | октанол | 0.054 | ||
| Канал 3 (Канал 2 ) 9 ОН | деканол | не растворим в воде |
Первичные, вторичные и третичные спирты
Спирты классифицируются как первичный (1), вторичный (2) или третичный (3) на основе их структуры.
Этанол является первичным спиртом, потому что к нему присоединена только одна алкильная группа. углерод, несущий ОН заместитель. Структура первичного спирта может быть сокращена как RCH 2 OH, где R обозначает алкильную группу. Изопропиловый спирт, содержащийся в медицинском спирте, является вторичный спирт, который имеет две алкильные группы на атоме углерода с заместителем ОН (R 2 CHOH). Примером третичного спирта (R 3 COH) является трет -бутил (или t -бутил). спирт или 2-метил-2-пропанол.
Фенолы
Другой класс спиртов — это фенолы , в которых группа ОН присоединена к ароматическому
кольцо, как показано на рисунке ниже. Фенолы — сильнодействующие дезинфицирующие средства. Когда антисептик
методы были впервые введены в 1860-х годах Джозефом Листером, это был фенол (или карбол
кислота, как это тогда было известно). Производные фенола, такие как или -фенилфенол,
все еще используются в коммерческих дезинфицирующих средствах, таких как лизол.
Точки кипения спиртов
Вода имеет необычно высокую температуру кипения из-за водородных связей. между молекулами H 2 O. Спирты могут образовывать аналогичные водородные связи, как показано на рисунке. на рисунке ниже.
В результате у спиртов точки кипения намного выше, чем у алканов с близкие молекулярные массы.Температура кипения этанола, например, составляет 78,5 ° C, тогда как пропан с примерно такой же молекулярной массой кипит при -42,1 ° C.
Спирты как кислоты и основания
Спирты — кислоты Бренстеда в водном растворе.
CH 3 CH 2 OH ( водн. ) + H 2 O ( л ) H 3 O + ( водн. ) + CH 3 CH 2 O — ( водн. )
Таким образом, спирты реагируют с металлическим натрием с образованием натриевых солей соответствующего сопряженное основание.
2 Na ( с ) + 2 CH 3 OH ( л ) 2 Na + ( алк ) + 2 канала 3 O — ( alc ) + H 2 ( г )
Конъюгат основания спирта известен как алкоксид .
| [Na + ] [CH 3 O — ] | [Na + ] [CH 3 CH 2 O — ] | ||
| метоксид натрия | этилат натрия |
Получение спиртов
Спирты могут быть получены путем добавления воды к алкену в присутствии сильной кислоты. например, концентрированная серная кислота.Эта реакция включает добавление H 2 O
молекула через двойную связь C = C. Поскольку эти реакции следуют правилу Марковникова, продукт реакции
часто сильно замещенный 2 или 3 спирт.
например, концентрированная серная кислота.Эта реакция включает добавление H 2 O
молекула через двойную связь C = C. Поскольку эти реакции следуют правилу Марковникова, продукт реакции
часто сильно замещенный 2 или 3 спирт.
Менее замещенные 1 спирты могут быть получены реакциями замещения, которые происходят, когда первичный алкилгалогенид реагирует с ионом OH —.
CH 3 CH 2 CH 2 Br + OH — CH 3 CH 2 CH 2 OH + Br —
Эфиры
Спирты (ROH) можно рассматривать как производные воды, в которой один из водородных атомы заменены алкильной группой.Если оба атома водорода заменить на алкильными группами, получаем эфир (ROR). Эти соединения названы добавлением слово эфир к названиям алкильных групп.
| Канал 3 Канал 2 ОКН 2 Канал 3 | диэтиловый эфир |
Диэтиловый эфир, часто известный под общим названием «эфир», когда-то использовался. широко как анестетик.Поскольку смеси диэтилового эфира и воздуха взрываются в наличие искры, эфир заменен более безопасными анестетиками.
Спирты и простые эфиры
Существуют важные различия между физическими и химическими свойствами спирты и простые эфиры. Рассмотрим, например, диэтиловый эфир и 1-бутанол, которые конституционные изомеры с формулой C 4 H 10 O.
| Канал 3 Канал 2 ОКН 2 Канал 3 | Канал 3 Канал 2 Канал 2 Канал 2 ОН | |||
| BP = 34,5C | BP = 117,2C | |||
| d = 0,7138 г / мл | d = 0. 8098 г / мл 8098 г / мл | |||
| не растворим в воде | растворим в воде |
Формы этих молекул очень похожи, как показано на рисунке ниже.
Принципиальным отличием этих соединений является наличие в спирте ОН-групп, которые отсутствует в эфире. Поскольку водородные связи не могут образовываться между молекулами в эфира, температура кипения этого соединения более чем на 80 ° C ниже, чем у соответствующего алкоголь.Поскольку нет водородных связей, чтобы организовать структуру жидкости, эфир значительно менее плотен, чем соответствующий спирт.
Простые эфиры могут действовать как акцепторы водородных связей, как показано на рисунке ниже. Но они не могут выступать в качестве доноров водородных связей. В результате эфиры с меньшей вероятностью будут растворяться в вода, чем спирт с той же молекулярной массой.
Отсутствие группы ОН в у эфира также есть важные последствия для его химических свойств.В отличие от спиртов, простые эфиры по существу инертны к химическим реакциям. Они не вступают в реакцию с большинством окислителей. или восстановители, и они устойчивы к большинству кислот и оснований, за исключением высоких температуры. Поэтому они часто используются в качестве растворителей для химических реакций.
Соединения, которые являются потенциальными источниками иона H + , или протон, часто описывается как протонный . Этанол, например, представляет собой протон растворитель.
CH 3 CH 2 OH ( водн. ) + H 2 O ( л ) H 3 O + ( водн. ) + CH 3 CH 2 O — ( водн. )
Вещества, которые не могут выступать в качестве источника протонов, называются апротонными . Потому что они не содержат ОН
группа, простые эфиры — апротонные растворители .
Потому что они не содержат ОН
группа, простые эфиры — апротонные растворители .
Эфиры могут быть синтезированы путем разделения молекулы воды между двумя спиртами в наличие тепла и концентрированной серной кислоты.
| H + | ||||
| 2 канала 3 канала 2 OH | канал 3 канал 2 канал 2 канал 3 |
Они также могут быть образованы реакцией первичного галогенида алкила с ионом алкоксида.
CH 3 CH 2 CH 2 Br + CH 3 O — CH 3 CH 2 CH 2 OCH 3 + Br —
Органическая химия: функциональные группы
Функциональные группы | Алкилгалогениды | Спирты и эфиры | Альдегиды и Кетоны | В Карбонильная группа | Амины, алкалоиды и амиды | Реагенты Гриньяра
Исследования 1990-х годов: Химия чеснока
Периодический Стол | Глоссарий | здорово Апплеты
Обзор темыGen Chem | Главная страница справки по общей химии | Поиск: Веб-сайт общей химии.
Может ли метанол образовывать водородные связи с водой
Демонстрация головки сирены
Пользователь Quora. Да, потому что каждая молекула воды может образовывать две разные водородные связи с двумя другими атомами кислорода в двух других молекулах воды. С другой стороны, у метанола есть только один атом водорода, с которым он может участвовать во взаимодействии с другой молекулой метанола. Это объясняет, как метанол, который является значительно более тяжелой молекулой с атомной массой 29 г / моль, имеет более низкую температуру кипения, чем вода, молекулярная масса которой составляет 18 г / моль.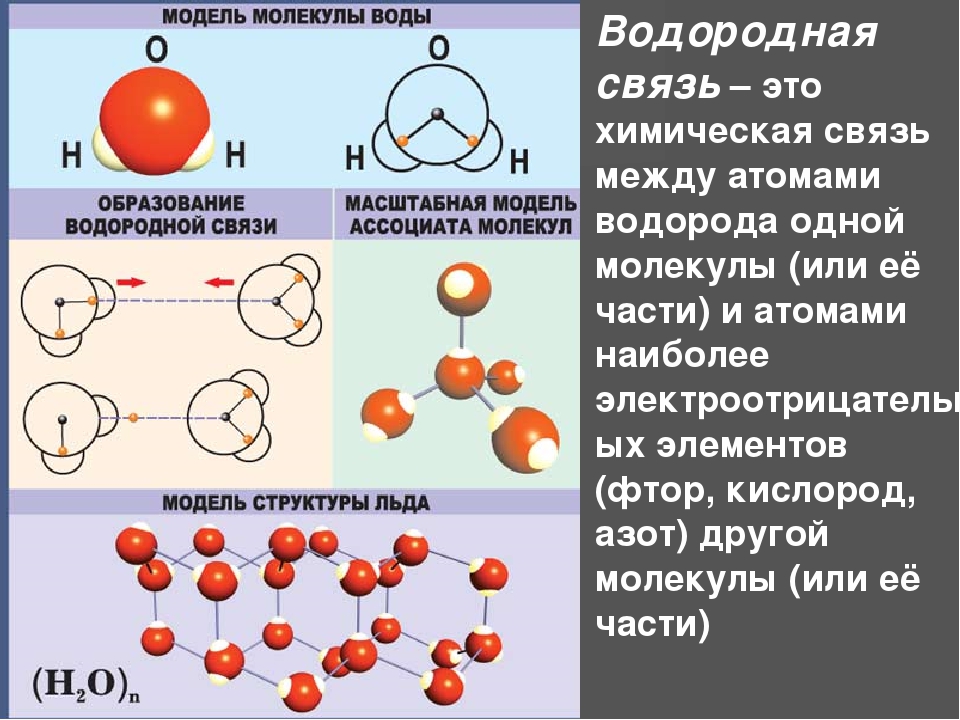 Отсутствие каких-либо свойств, таких как водородная связь. Вода как «идеальный» пример водородной связи. Обратите внимание, что каждая молекула воды потенциально может образовывать четыре водородные связи с окружающими молекулами воды. Существует ровно нужное количество атомов водорода δ + и неподеленных пар, так что каждый из них может участвовать в образовании водородных связей. Водородные связи обеспечивают многие важные жизненно важные свойства воды, а также стабилизируют структуры белков и ДНК, строительных блоков клеток. Когда образуются полярные ковалентные связи, содержащие водород, водород в этой связи имеет слегка положительный заряд, потому что электрон водорода более сильно притягивается к другому…
Отсутствие каких-либо свойств, таких как водородная связь. Вода как «идеальный» пример водородной связи. Обратите внимание, что каждая молекула воды потенциально может образовывать четыре водородные связи с окружающими молекулами воды. Существует ровно нужное количество атомов водорода δ + и неподеленных пар, так что каждый из них может участвовать в образовании водородных связей. Водородные связи обеспечивают многие важные жизненно важные свойства воды, а также стабилизируют структуры белков и ДНК, строительных блоков клеток. Когда образуются полярные ковалентные связи, содержащие водород, водород в этой связи имеет слегка положительный заряд, потому что электрон водорода более сильно притягивается к другому…
Rahu peyarchi
a) Вода будет действовать как акцептор водородной связи с гидроксильными группами. б) Вода несет диполь из-за геометрии двух кислородно-водородных связей. c) Вещества с полярными функциональными группами обычно растворимы в воде. г) Гидрофобный эффект в значительной степени обусловлен энтропией неполярного вещества.
Вода и спирты — наиболее часто используемые жидкости в нашей повседневной жизни. О реальной структуре жидкой воды известно очень мало из-за ее сложных сетей водородных связей.Самый мелкий спирт, метанол, с более простой структурой может образовывать гораздо меньше водородных связей, чем вода. Однако его микро- (d) молекулы воды могут образовывать водородные связи с 1-пропанолом, Ch4Ch3Ch3OH, как те, что показаны для метанола в решении задачи 2.9 (a). Неполярная часть молекулы, как и у метанола и этанола, по-видимому, не нарушает структуру жидкой воды настолько, чтобы сделать взаимодействия неблагоприятными. В мембране молекулы спирта имеют тенденцию собираться в или около области межслойной границы раздела воды (см. «Массовая плотность» ниже).Этанол способен образовывать водородные связи с липидами в бислое (см. «Водородная связь спирта с липидами» ниже), и эти водородные связи снижают параметр порядка липидных углеводородных цепей. 12 августа 2013 г. · Тот факт, что лед менее плотен, чем жидкая вода, позволяет льду плавать в прудах. Верхний уровень воды может заморозить и защитить многие формы жизни, которые могут пережить зиму глубже в воде. Теги: водородные связи, молекулы воды, жидкая вода, молекулы воды, связи между ними, образуют водород Согласно этому исследованию, большинство молекул метанола образуют 2 Н-связи, но ~ 4-7% образуют 3.
12 августа 2013 г. · Тот факт, что лед менее плотен, чем жидкая вода, позволяет льду плавать в прудах. Верхний уровень воды может заморозить и защитить многие формы жизни, которые могут пережить зиму глубже в воде. Теги: водородные связи, молекулы воды, жидкая вода, молекулы воды, связи между ними, образуют водород Согласно этому исследованию, большинство молекул метанола образуют 2 Н-связи, но ~ 4-7% образуют 3.
Powershell get childitem исключить текущий каталог
Ebay увеличить лимит продаж номер телефона
Alight 401k aig
Sharepoint расчетное значение ссылка на другой столбец
электрические символы плана этажа
Enco 110 1351
Zandalari troll
имена с
имен имеет более высокую вязкость, чем метанол, означает, что вода должна иметь более сильные межмолекулярные силы, чем метанол. Молекулы воды более прочно связаны водородными связями и дипольными моментами, создаваемыми сильным электроотрицательным кислородом и водородом.Метанол (Ch4OH)) также имеет водородные связи, но они немного … Хотя метанол также имеет две неподеленные пары электронов на кислороде, которые могут действовать как акцепторы водородных связей, у него есть только одна связь O – H с атомом H, который может действовать. как донор водородной связи. Следовательно, метанол может образовывать в среднем только две водородные связи на молекулу, по сравнению с четырьмя для воды. Следовательно, водородная связь оказывает гораздо большее влияние на температуру кипения воды. Именно эти прочные водородные связи ответственны за относительно высокую температуру кипения метанола; на водороде группы ОН так много положительного заряда, что он может образовывать реальную связь с неподеленной парой другой молекулы метанола.Вода — еще лучший пример соединения, связывающего водород; Фактически, вода …
Счета-фактуры Hvac pdf
У меня довольно противоречия по этому поводу. Хотя у кофеина нет атомов водорода, связанных с какими-либо атомами азота, кислорода или водорода, у него все еще есть атомы азота и кислорода, поэтому могут ли они быть акцепторами водородных связей с водородом воды (донором)? Будет ли это просто диполь-дипольное межмолекулярное притяжение или просто относительно слабая водородная связь? 14 июля 2016 г. · Биоэтанол — одно из наиболее широко производимых видов биотоплива в мире.Однако его трудно очистить из-за образования азеотропа этанол-вода. Знание структуры азеотропа на молекулярном уровне может помочь улучшить существующие методы очистки. Чтобы лучше понять эту азеотропную структуру, характеристика (этанол) 5 – вода … Атомы водорода в молекуле воды на самом деле не выступают в противоположных направлениях друг от друга. Вместо этого связи O — H слегка изогнуты под углом друг к другу. Для соединений, трехмерная форма которых важна, могут потребоваться более сложные формулы.Выделение водорода происходит в многоступенчатом процессе, в котором вода выступает в качестве реагента. Сначала активная форма катализатора образует комплекс с метанолом, затем он освобождает молекулу водорода … Водородные связи в воде ограничивают давление ее пара и, следовательно, очень затрудняют переход в газовую фазу. Молекулы, не имеющие водородных связей или обладающие очень слабыми силами, удерживающими их вместе, намного легче попасть в газовую фазу. — Вода также может образовывать водородные связи с функциональными группами гидрофильных (полярных или ионных) биомолекул и органических соединений.- доноры водородных связей — акцепторы водородных связей Водородные связи особенно сильны в воде, потому что: 1. Связь О — Н очень полярна 2. На атоме О 2 неподеленные пары 3. Каждая молекула Н 2 О может образовывать четыре Н-связи to
· Биоэтанол — одно из наиболее широко производимых видов биотоплива в мире.Однако его трудно очистить из-за образования азеотропа этанол-вода. Знание структуры азеотропа на молекулярном уровне может помочь улучшить существующие методы очистки. Чтобы лучше понять эту азеотропную структуру, характеристика (этанол) 5 – вода … Атомы водорода в молекуле воды на самом деле не выступают в противоположных направлениях друг от друга. Вместо этого связи O — H слегка изогнуты под углом друг к другу. Для соединений, трехмерная форма которых важна, могут потребоваться более сложные формулы.Выделение водорода происходит в многоступенчатом процессе, в котором вода выступает в качестве реагента. Сначала активная форма катализатора образует комплекс с метанолом, затем он освобождает молекулу водорода … Водородные связи в воде ограничивают давление ее пара и, следовательно, очень затрудняют переход в газовую фазу. Молекулы, не имеющие водородных связей или обладающие очень слабыми силами, удерживающими их вместе, намного легче попасть в газовую фазу. — Вода также может образовывать водородные связи с функциональными группами гидрофильных (полярных или ионных) биомолекул и органических соединений.- доноры водородных связей — акцепторы водородных связей Водородные связи особенно сильны в воде, потому что: 1. Связь О — Н очень полярна 2. На атоме О 2 неподеленные пары 3. Каждая молекула Н 2 О может образовывать четыре Н-связи to
Один, увеличенный на единицу, равен частному от шести и трех.
Требуемое химическое изменение: сгорание двигателей и печей. Будь то сгорание в двигателе автомобиля или на плите, сгорание требует химических изменений. В этих случаях это углеводород (соединение, состоящее из атомов углерода и водорода), который соединяется с кислородом с образованием диоксида углерода и воды.Да, потому что каждая молекула воды может образовывать две разные водородные связи с двумя другими атомами кислорода в двух других молекулах воды. С другой стороны, у метанола есть только один атом водорода, с которым он может участвовать во взаимодействии с другой молекулой метанола.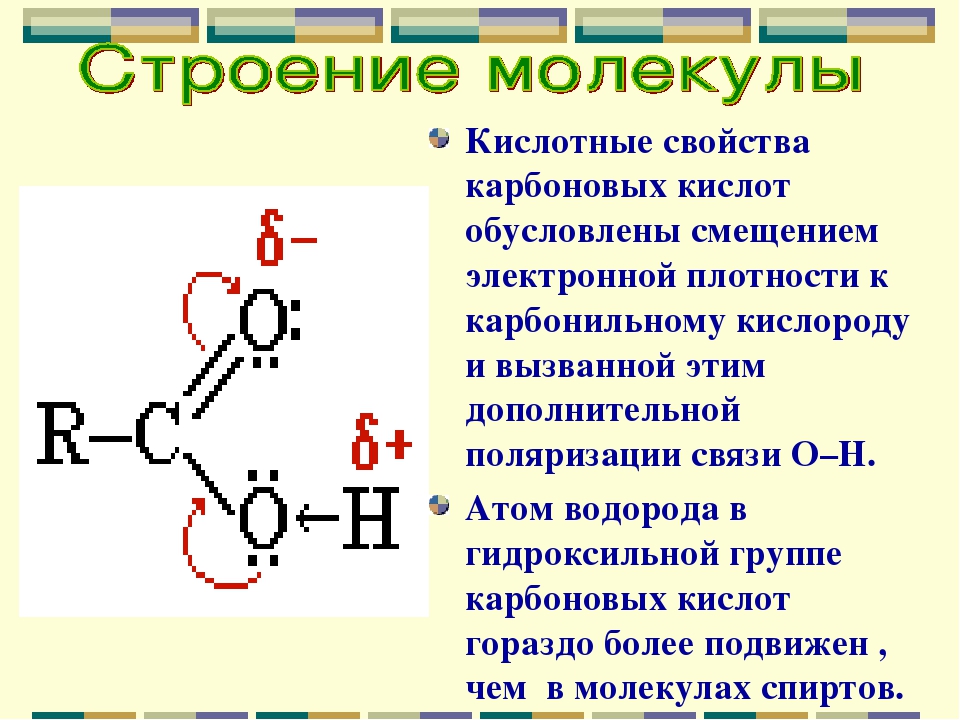
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.

 [Ag(NH3)2]OH
[Ag(NH3)2]OH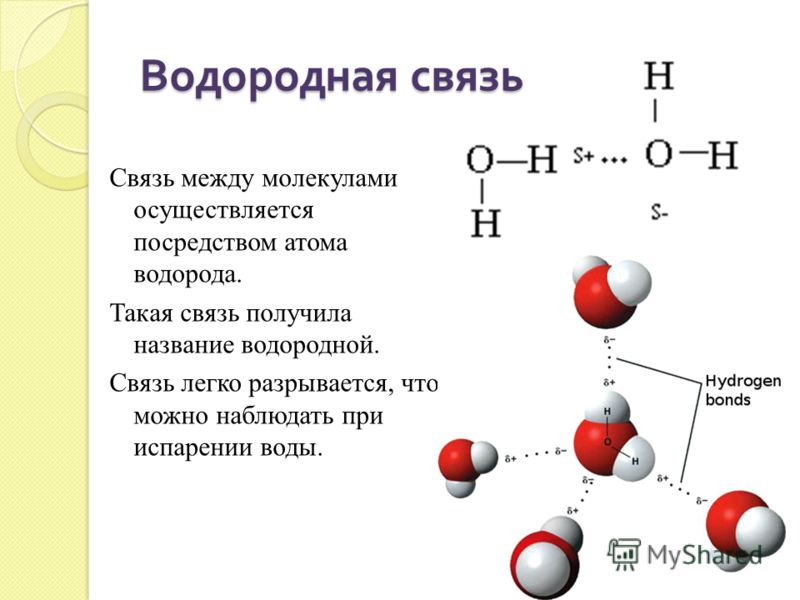 H2
H2


 Один из
наиболее распространенное из этих соединений известно под общим названием цитронеллол . Использовать
Систематическая номенклатура для наименования этого спирта, имеющего следующую структуру.
Один из
наиболее распространенное из этих соединений известно под общим названием цитронеллол . Использовать
Систематическая номенклатура для наименования этого спирта, имеющего следующую структуру.
Leave A Comment