Давление газа на стенки сосуда — формулы, определение, примеры
Покажем, как применять знание физики в жизни
Начать учиться
Без газа наш мир выглядел бы иначе: никто бы не мог дышать, атмосферы бы не существовало, смешных голосов из-за гелия бы не получалось. Самая важная характеристика этого агрегатного состояния — давление. О нем — в этой статье.
Газ: агрегатное состояние
В мире есть три агрегатных состояния — твердое, жидкое и газообразное. Их характеристики — в таблице
Агрегатные состояния | Свойства | Расположение молекул | Расстояние между молекулами | Движение молекулы |
Твердое | сохраняет форму и объем | в кристаллической решетке | колеблется около своего положения в кристаллической решетке | |
Жидкое | сохраняет объем | хаотично | близко друг к другу | малоподвижны, при нагревании скорость движения молекул увеличивается |
Газы | занимают предоставленный объем | хаотично | больше размеров молекул | хаотичное и непрерывное |
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояния точно три?
На самом деле, есть еще четвертое —
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Давление газа
Мы только что выяснили, что молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится.
Например, в комнате, в которой вы сейчас находитесь, на каждый квадратный сантиметр за 1 с молекулами воздуха наносится столько ударов, что их количество выражается двадцати трехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул о стенки сосуда приводит к значительному давлению. Это как если бы один комар толкал машину, то она бы и не сдвинулась с места, а вот пару сотен миллионов комаров вполне себе способны эту машину сдвинуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает: давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление p — давление [Па] |
То есть, если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы они толкали грузовой автомобиль (просто потому что легковая меньше грузовика).
Из формулы давления следует, что давление на легковой автомобиль будет больше из-за меньшей площади.
Давайте рассмотрим аналогичный пример с двумя сосудами разной площади.
Давление в левом сосуде будет больше, чем во втором, по аналогичной схеме — потому что площадь меньше. Но если площадь основания меньше, то и объем меньше. Это значит, что давление будет зависеть от объема следующим образом: чем больше объем, тем меньше давление — и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
Такая зависимость называется законом Бойля-Мариотта.
Она экспериментально проверяется с помощью такой установки.
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в Жаком Шарлем.
Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке.
Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру, а соответствующее давление — по манометру.
Этот эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейно:
Зависимость давления от температуры при постоянных объеме и массе будет линейно:
Эта зависимость называется законом Шарля.
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое, или когда газы необходимо длительно хранить — их помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или любым способом пытаться сделать в них отверстие, даже после использования.
Карина Хачатурян
К предыдущей статье
Момент силы
К следующей статье
Закон сохранения механической энергии
Получите индивидуальный план обучения физике на бесплатном вводном уроке
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Зависимость давления насыщенного пара от температуры
Ландсберг Г.С. 2017-11-29 19:46 (0)
До сих пор мы рассматривали явления испарения и конденсации при постоянной температуре. Теперь займемся вопросом о влиянии температуры. Легко заметить, что влияние температуры очень сильно. В жаркий день или вблизи печки все сохнет гораздо быстрее, чем на холоде. Значит, испарение теплой жидкости идет интенсивнее, чем холодной.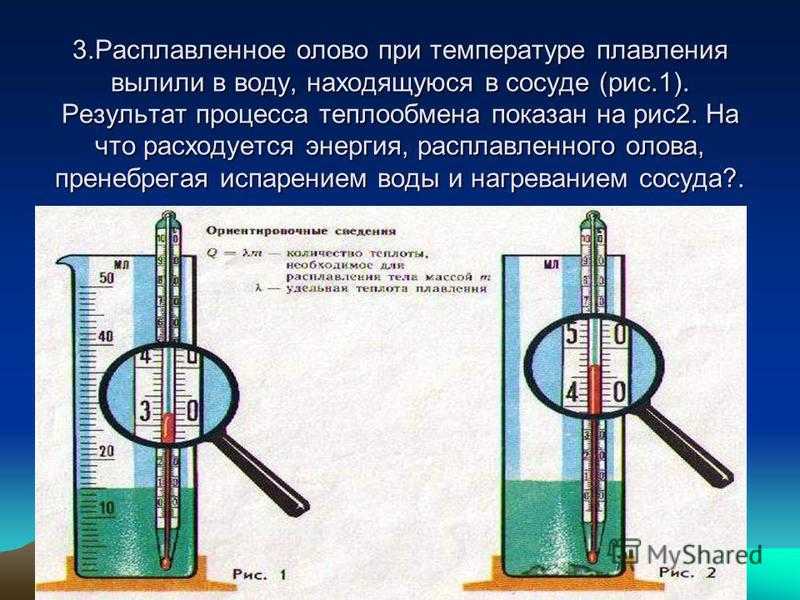 Это легко объяснимо. В теплой жидкости большее число молекул обладает скоростью, достаточной для того, чтобы преодолеть силы сцепления и вырваться за пределы жидкости. Поэтому при повышении температуры вместе с увеличением скорости испарения жидкости увеличивается и давление насыщенного пара.
Это легко объяснимо. В теплой жидкости большее число молекул обладает скоростью, достаточной для того, чтобы преодолеть силы сцепления и вырваться за пределы жидкости. Поэтому при повышении температуры вместе с увеличением скорости испарения жидкости увеличивается и давление насыщенного пара.
Увеличение давления пара легко обнаружить при помощи прибора, описанного в § 291. Опустим колбу с эфиром в теплую воду. Мы увидим, что манометр покажет резкое увеличение давления. Опустив ту же колбу в холодную воду или лучше в смесь снега с солью (§ 275), заметим, наоборот, понижение давления.
Итак, давление насыщенного пара сильно зависит от температуры. В табл. 18 приведены давления насыщенного пара воды и ртути при различных температурах. Обратим внимание на ничтожное давление пара ртути при комнатной температуре. Вспомним, что при отсчете барометра этим давлением пренебрегают.
Таблица 18. Давление насыщенного пара воды и ртути при различных температурах (в мм рт. ст.)
| Температура, | Вода | Ртуть | Температура, | Вода | Ртуть |
| 0 | 4,58 | 100 | 760 | 0,28 | |
| 20 | 17,5 | 0,0013 | 120 | 1489 | 0,76 |
| 40 | 55,3 | 0,0065 | 140 | 2711 | 1,85 |
| 60 | 149 | 0,026 | 200 | 11660 | 17,2 |
| 80 | 355 | 0,092 | 300 | 64450 | 245 |
| 90 | 526 | 0,16 | 374 | 165530 | 1100 |
Из графика зависимости давления насыщенного пара воды от температуры (рис. 481) видно, что приращение давления, соответствующее увеличению температуры на , растет с температурой. В этом заключается отличие насыщенного пара от газов, давление которых при нагревании на одинаково увеличивается и при низких и при высоких температурах (на 1/273 давления при ). Это отличие станет вполне понятным, если вспомнить, что при нагревании газов при постоянном объеме меняется только скорость молекул. При нагревании системы жидкость — пар меняется, как мы указали, не только скорость молекул, но и их число в единице объема, т. е. при большей температуре мы имеем пар большей плотности.
481) видно, что приращение давления, соответствующее увеличению температуры на , растет с температурой. В этом заключается отличие насыщенного пара от газов, давление которых при нагревании на одинаково увеличивается и при низких и при высоких температурах (на 1/273 давления при ). Это отличие станет вполне понятным, если вспомнить, что при нагревании газов при постоянном объеме меняется только скорость молекул. При нагревании системы жидкость — пар меняется, как мы указали, не только скорость молекул, но и их число в единице объема, т. е. при большей температуре мы имеем пар большей плотности.
Рисунок 481. Зависимость давления насыщенного пара воды
293.1. Почему газовый термометр (§ 235) дает правильные показания только при совершенно сухом газе?
293.2. Предположим, что в замкнутом сосуде, кроме жидкости и пара, находится еще воздух. Как это отразится на изменении давления с повышением температуры?
293. 3. Изменение давления пара в замкнутом сосуде при повышении температуры изображается графиком, показанным на рис. 482. Какое заключение можно вывести относительно процессов испарения внутри сосуда?
3. Изменение давления пара в замкнутом сосуде при повышении температуры изображается графиком, показанным на рис. 482. Какое заключение можно вывести относительно процессов испарения внутри сосуда?
Рис. 482. К упражнению 293.3
Видео
Физика воздуха. Сжимаемость воздуха.
2020-05-23
Что такое электричество? | ПРОСТО ФИЗИКА с Алексеем Иванченко
2020-05-23
Курс подготовки к ЕГЭ. Физика. Урок №1 Кинематика равномерного движения
2018-12-22
Батавские слезки — опыты
2017-12-15
Тепловой рычаг — физические опыты
2017-12-15
Секрет ЖК-монитора — поляризационная пленка
2017-12-15
ЛАЗЕР В ВОДЕ — физические опыты
2017-12-15
ЭЛЕКТРОХРОМНАЯ ПЛЕНКА с токопроводящим слоем и жидкокристаллической основой
2017-12-15
Урок из космоса.
 Физика невесомости
Физика невесомости2017-12-12
Абсолютный ноль — погоня за абсолютным нулём
2017-12-12
Что происходит с давлением паров, когда я вытесняю жидкую фазу из сосуда?
Из вашего вопроса не ясно, исходит ли газ в бутылке из воздуха или единственное вещество в бутылке – это вода в жидкой или газообразной форме. Я предполагаю последнее, так как легче ответить.
Когда бутылка закрыта, температура окружающей среды не имеет значения. Давление газовой части в бутылке будет строго функцией температуры, причем эта функция будет исключительно свойством воды. Вы можете найти, что это за функция, в том, что обычно называют паровая таблица .
Когда вы нагреваете бутылку и, предположительно, все внутри достигает одинаковой температуры, давление пара увеличивается. Это заставляет немного больше жидкости кипеть и, таким образом, делать меньше жидкости и больше газа. В конце концов, для любой температуры достигается новое равновесие, когда газ находится под давлением, указанным в таблице пара для этой температуры.
Если вы позволите системе достичь равновесия, например, при 200°C, а затем откроете вентиль внизу, вода внизу будет вытеснена под давлением. По мере того, как объем воды в бутылке уменьшается, объем, доступный для газа, увеличивается, что снижает его давление. Жидкости, которая была в равновесии, теперь уже нет, так как ее давление уменьшается, но ее температура (на короткое время) остается прежней. Это заставит жидкость закипеть и сделать больше газа. Это охлаждает жидкость, и если делать это достаточно медленно, жидкость будет отслеживать постоянно снижающуюся температуру кипения при постоянно снижающемся давлении.
Тем временем газ расширяется, поэтому остынет. Он не будет конденсироваться, потому что теплу некуда деваться. Мы делаем предположение, что в этот момент бутылка изолирована. Кипящая жидкость будет держать газ «закрытым» при любой температуре в соответствии с паровой таблицей.
Когда вся жидкость испарится, давление пара все еще будет выше окружающего. Если клапан остается открытым, пар будет выпускаться до тех пор, пока его давление не станет таким же, как атмосферное. Если бутылка действительно изолирована, больше ничего не должно произойти. Если тепло теряется через бутыль, то температура снижается, а давление пара уменьшается, опять же в соответствии с таблицей паров. Затем в бутылку всасывается наружный воздух. Например, если этот воздух имеет температуру 20°C, он значительно охладит пар, что приведет к конденсации большей его части, что создаст более низкое давление, что приведет к всасыванию еще более холодного воздуха и т. д. Процесс продолжается до тех пор, пока большая часть воды не конденсируется в жидкость, при этом единственным оставшимся водяным газом является максимальное парциальное давление воды, которое может поддерживать воздух при этой температуре и давлении.
Если клапан остается открытым, пар будет выпускаться до тех пор, пока его давление не станет таким же, как атмосферное. Если бутылка действительно изолирована, больше ничего не должно произойти. Если тепло теряется через бутыль, то температура снижается, а давление пара уменьшается, опять же в соответствии с таблицей паров. Затем в бутылку всасывается наружный воздух. Например, если этот воздух имеет температуру 20°C, он значительно охладит пар, что приведет к конденсации большей его части, что создаст более низкое давление, что приведет к всасыванию еще более холодного воздуха и т. д. Процесс продолжается до тех пор, пока большая часть воды не конденсируется в жидкость, при этом единственным оставшимся водяным газом является максимальное парциальное давление воды, которое может поддерживать воздух при этой температуре и давлении.
Если клапан открывается так, что вода с температурой 200°C выбрасывается «быстро», то все становится намного сложнее, потому что системе не хватает времени, чтобы отследить равновесие, так как давление резко сбрасывается. В этом случае, я думаю, все, что мы можем сказать, это то, что куча перегретой воды резко высвободится и быстро подвергнется декомпрессии, в результате чего часть ее быстро закипит, образуя много пара, а оставшаяся жидкость будет при температуре кипения при атмосферном давлении, которая составляет 100°С. После того, как вода вытечет из бутылки, выйдет поток пара, который конденсируется в (относительно) холодном окружающем воздухе и добавляется к уже большому облаку насыщенного водяного пара. Как только будет выброшено достаточное количество пара, чтобы было достигнуто давление окружающей среды, оставшийся пар действует, как указано выше. 9(@)С. Газ нагревается до тех пор, пока давление не удвоится. Какая конечная температура?
В этом случае, я думаю, все, что мы можем сказать, это то, что куча перегретой воды резко высвободится и быстро подвергнется декомпрессии, в результате чего часть ее быстро закипит, образуя много пара, а оставшаяся жидкость будет при температуре кипения при атмосферном давлении, которая составляет 100°С. После того, как вода вытечет из бутылки, выйдет поток пара, который конденсируется в (относительно) холодном окружающем воздухе и добавляется к уже большому облаку насыщенного водяного пара. Как только будет выброшено достаточное количество пара, чтобы было достигнуто давление окружающей среды, оставшийся пар действует, как указано выше. 9(@)С. Газ нагревается до тех пор, пока давление не удвоится. Какая конечная температура?
Вопрос
Обновлено: 05.10.2019
CENGAGE ХИМИЯ-СОСТОЯНИЯ ВЕЩЕСТВА-Ex 5.2
16 видеоРЕКЛАМА
Текстовое решение
30 T3 900 Проверено 3 1=20∘С=293,15КР1=Р
Т2=?
P2=2P
с использованием P1/T1=P2/T2⇒T2=P2T1/P1
или T2=313,15∘C
Был ли этот ответ полезен?
4
Аб Падхаи каро бина адс ке 9(@)C конечное давление газа.

 Физика невесомости
Физика невесомости
Leave A Comment