05. Простые и сложные вещества
К уроку химии > 8 класс > 05. Простые и сложные вещества
|
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: h3, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: h3O, Nh4, OF2, h3SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).

Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Bh4 — боран
B2H6 — диборан
Ch5 — метан
Sih5 — силан
Nh4 — аммиак
Ph4 — фосфин
Ash4 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.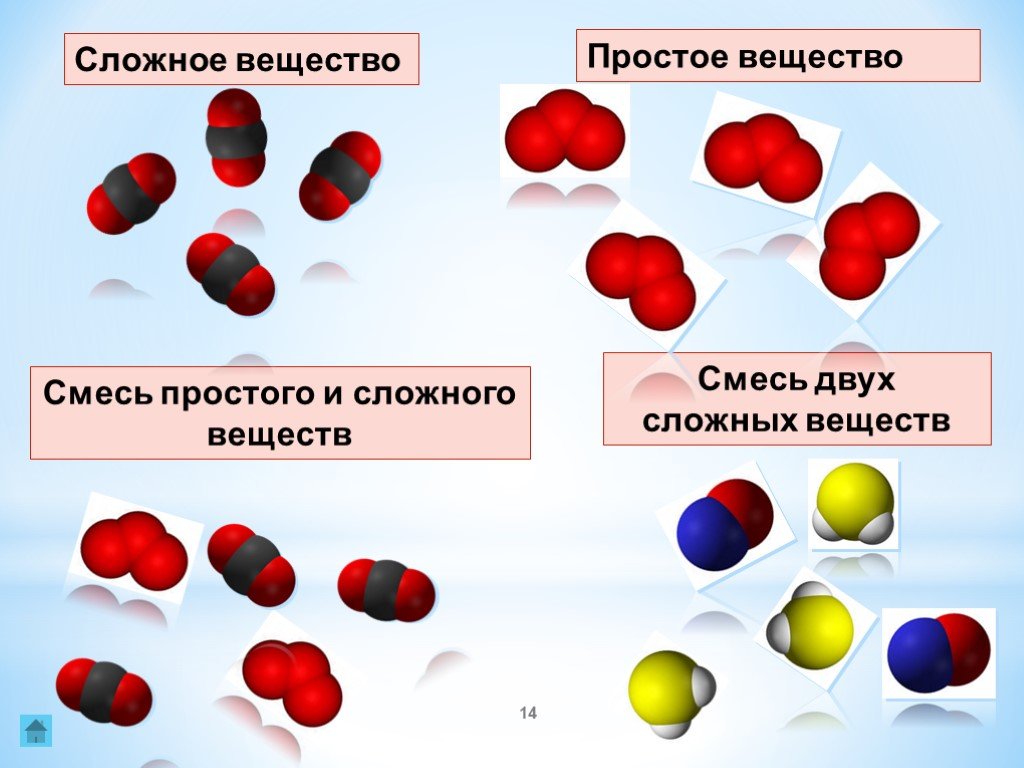
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — h3SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — h3CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония Nh5+
Пример
NaOH, Nh5OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
h3SO4, HNO3, h3Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или Nh5+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(Nh5)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | |||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | h3S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | h3SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | h3SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | h3CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | h3SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | h4PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Simply Complex > News > USC Dornsife
Формула проста, но h3O — одно из самых замечательных веществ во Вселенной.
Это что-то вроде загадки: соединение, состоящее всего из двух химических элементов, один из которых является самым простым в известной вселенной. Пара атомов водорода, крепко держащаяся за один атом кислорода, создает обманчиво минималистское устройство, которое противоречит его огромной универсальности и важности.
Ценность воды как ресурса общеизвестна. Без постоянного снабжения цивилизация, какой мы ее знаем, не существовала бы.
Но как вещество — как молекула — вода ускользает от чуда большинства людей. Что очень плохо, на самом деле, потому что это весьма примечательно.
Что очень плохо, на самом деле, потому что это весьма примечательно.
Формованные и связанные
Основная молекулярная формула воды, H₂O, предполагает простую структуру из трех атомов на прямой линии. Но физические свойства трех атомов требуют другого расположения — V-образной формы с кислородом в конце. Эта нелинейная форма превращает воду в замечательную субстанцию с поразительными способностями.
Форма «V» возникает из-за расположения электронов в молекуле, которое вызывает дисбаланс электрического заряда, при этом кислородная точка «V» немного более отрицательна, чем противоположный конец возле атомов водорода. Это небольшое разделение означает, что молекулы воды поляризованы — один полюс положительный, а другой отрицательный.
Полярность электрического заряда лежит в основе удивительных свойств воды. Слегка отрицательный конец одной молекулы воды притягивает слегка положительный конец другой и наоборот, что ученые называют водородной связью.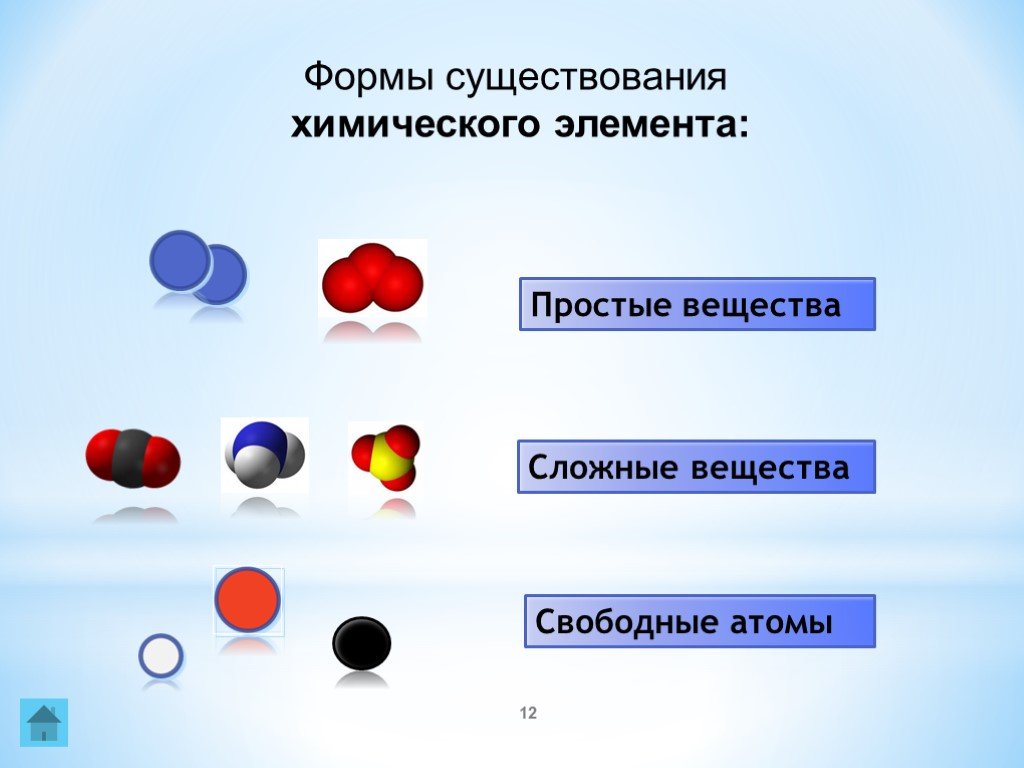
Водородные связи между молекулами воды исключительно прочны, что придает им склонность цепляться друг за друга, что чаще всего проявляется в виде поверхностного натяжения. Например, вода в наполненном до краев сосуде выглядит выпуклой, если смотреть сбоку из-за поверхностного натяжения. А некоторые существа, такие как водомерки, могут использовать поверхностное натяжение, чтобы скользить по поверхности прудов.
Водородные связи также позволяют воде прилипать к посторонним веществам. Это клейкое свойство позволяет растениям вытягивать воду из земли через корни и до кончиков листьев, игнорируя притяжение.
Полярная природа воды и ее форма делают ее легче в твердом состоянии, чем в жидком. Это потому, что молекулярные V образуют воздушные кристаллические структуры при замерзании, делая лед менее плотным, чем его жидкая форма. Таким образом, лед плавает по рекам и озерам, образуя щит против холодного воздуха сверху и удерживая воду внизу от замерзания, что позволяет рыбам и другим водным видам выживать в более холодных краях.
Водородные связи воды также приводят к еще одной важной характеристике — более высокой, чем ожидалось, температуре кипения, объясняет Джессика Парр, профессор (преподаватель) химии. Парр получила докторскую степень по химии в USC Dornsife в 2007 году и с тех пор преподает общую химию студентам. Ее диссертационное исследование было сосредоточено на понимании того, как водородные связи реагируют на воздействие интенсивного света.
«Если бы вода не была способна образовывать такие прочные водородные связи, она кипела бы при минус 200 градусах Цельсия, — объясняет Парр, — намного ниже ее фактической точки замерзания 0 градусов Цельсия. Это означает, что он будет существовать на Земле в основном в виде газа, что сделает жизнь в том виде, в каком мы ее знаем, невозможной. Вместо этого наша планета залита водой, всего около 366 миллионов миллиардов галлонов.
Универсальный растворитель
Полярная природа воды также делает ее исключительным растворителем, способным растворять самые разные вещества.
«Мы называем его «универсальным растворителем», потому что он может растворять не все, а очень многое», — говорит Парр. «Многие другие молекулы разборчивы в том, с чем они взаимодействуют и как они работают вместе, но вода будет взаимодействовать практически со всем».
Например, его положительные и отрицательные центры притягивают и легко разводят заряженные атомы, называемые ионами, из которых состоят такие соли, как хлорид натрия, обычно используемый в кулинарии. Положительно заряженные атомы натрия и отрицательно заряженные хлориды находят удобный дом среди поляризованных молекул воды.
Но вода также может растворять вещества, не состоящие из ионов, например сахара. Однако вместо того, чтобы разделять отдельные атомы молекулы сахара, молекулы воды прокладывают себе путь между каждой молекулой сахара, находя слабозаряженные части для водородной связи. Это ослабляет связи между молекулами сахара, отталкивая их друг от друга и в конечном итоге превращая в раствор.
«Пока присутствует один атом, который заставляет другую молекулу взаимодействовать с водой, вода будет это делать», — говорит Парр.
Становится странно
Вода не всегда ведет себя так, как ожидалось. Хотя он чаще всего переходит из твердого состояния (льда) в жидкое, а затем в газообразное (пар или пар) и наоборот, когда его температура поднимается и падает, он может совершить прыжок прямо из льда в пар при правильных условиях.
«Если вы когда-нибудь замечали, что ваши кубики льда со временем становятся меньше, то это потому, что они сублимируются в морозильной камере — лед сразу превращается в газ», — объясняет Парр. Эта сублимация происходит из-за низкой влажности внутри морозильной камеры, что позволяет нескольким молекулам воды выходить из льда в воздух без предварительного таяния.
В обратном процессе, называемом отложением, газообразная вода внезапно замерзает, так и не превратившись в жидкость. Так образуется снег. И когда условия подходящие, снег может пропустить стадию таяния и сублимировать обратно в атмосферу, что является особой проблемой для подверженных засухе районов, таких как Калифорния, которые полагаются на таяние снежного покрова в качестве источника воды.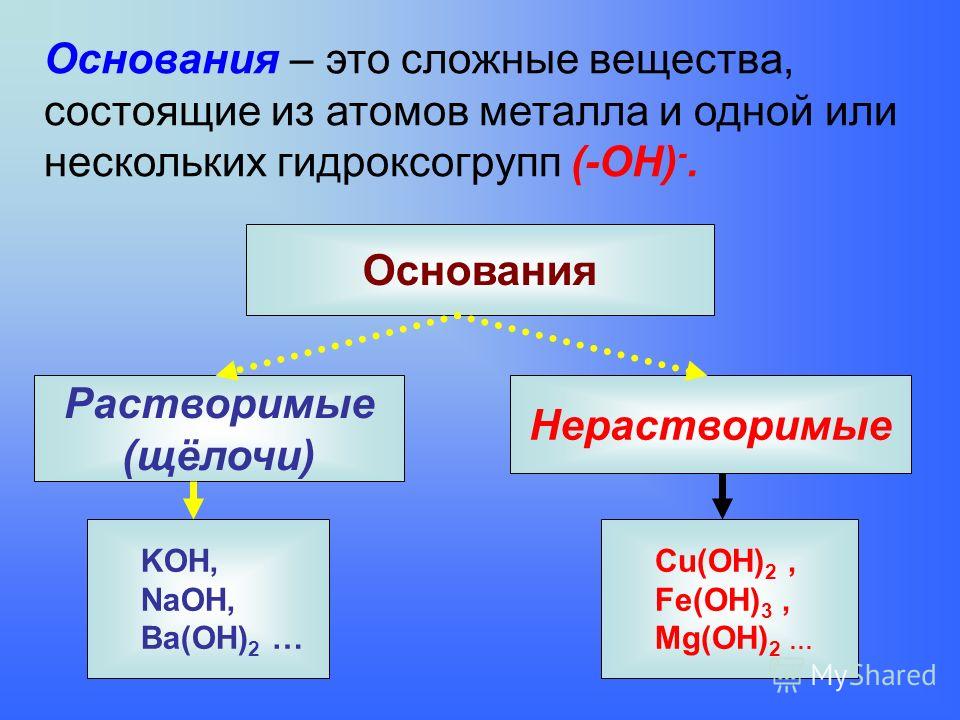
Но вода может быть еще более странной.
«Лед имеет множество различных кристаллических форм, но он также может существовать в форме, напоминающей стекло — аморфное твердое вещество, которое находится где-то между жидкостью и твердым телом и все еще может течь», — говорит Парр. По словам Парра, когда молекулы воды сливаются при очень низких температурах и давлениях — представьте себе космическое пространство — образующийся лед также может вести себя как стекло. Ученые подозревают, что это может быть одна из самых распространенных форм воды во Вселенной.
Тайны и чудеса продолжаются
Несмотря на широкое распространение во Вселенной и на Земле, а также на давнее знакомство людей с водой, вода продолжает удивлять.
Ученые недавно обнаружили форму под названием «суперионный лед». Существуя при чрезвычайно высоком давлении, например, в ядре планет, он, по-видимому, играет роль в поддержании магнитных полей Земли.
И хотя вода в чистом виде не является электрическим проводником, она ведет себя неожиданно при воздействии электрического поля. Александр Бендерский из USC Dornsife, адъюнкт-профессор химии, и Стивен Кронин из инженерной школы USC Viterbi недавно обнаружили, что молекулы воды вблизи электрода выстраиваются иначе, чем те, что дальше.
Александр Бендерский из USC Dornsife, адъюнкт-профессор химии, и Стивен Кронин из инженерной школы USC Viterbi недавно обнаружили, что молекулы воды вблизи электрода выстраиваются иначе, чем те, что дальше.
«Мы смогли увидеть, как молекулы взаимодействуют с электрическим полем так, как никто раньше не понимал», — сказал Бендерский. Открытие может изменить то, как химики контролируют реакции, в том числе процессы изготовления лекарств и очистки воды для питья.
По мере того, как исследователи продолжают исследовать это универсальное, неожиданное вещество, потенциально раскрывая более странные свойства, вода может оказаться самой сложной простой молекулой во Вселенной.
3.4: Классификация вещества по его составу
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47456
Цели обучения
- Объяснить разницу между чистым веществом и смесью.

- Объясните разницу между элементом и соединением.
- Объясните разницу между гомогенной смесью и гетерогенной смесью.
Один из полезных способов организации нашего понимания материи состоит в том, чтобы представить себе иерархию, простирающуюся от самых общих и сложных до самых простых и фундаментальных (рис. \(\PageIndex{1}\)). Материю можно разделить на две широкие категории: чистые вещества и смеси. A чистое вещество — это форма материи, которая имеет постоянный состав (это означает, что она везде одинакова) и свойства, которые являются постоянными для всей пробы (это означает, что существует только один набор свойств, таких как температура плавления, цвет, температура кипения и т. д. по всему делу). Материал, состоящий из двух или более веществ, представляет собой смесь . Элементы и соединения являются примерами чистых веществ. Вещество, которое нельзя разложить на химически более простые компоненты, — элемент 9. 0012 . Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разложить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. На сегодняшний день в известной Вселенной насчитывается около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
0012 . Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разложить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. На сегодняшний день в известной Вселенной насчитывается около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Обыкновенная поваренная соль называется хлоридом натрия. Он считается веществом , поскольку имеет однородный и определенный состав. Все образцы хлорида натрия химически идентичны. Вода также является чистым веществом. Соль легко растворяется в воде, но соленую воду нельзя отнести к веществу, так как ее состав может быть разным. Вы можете растворить небольшое количество соли или большое количество в заданном количестве воды. Смесь — это физическая смесь двух или более компонентов, каждый из которых сохраняет свою идентичность и свойства в смесь . Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Смесь — это физическая смесь двух или более компонентов, каждый из которых сохраняет свою идентичность и свойства в смесь . Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Однородная смесь представляет собой смесь, в которой состав однороден по всей смеси. Описанная выше соленая вода является однородной, поскольку растворенная соль равномерно распределена по всей пробе соленой воды. Часто гомогенную смесь легко спутать с чистым веществом, потому что они оба однородны. Отличие в том, что состав вещества всегда одинаков. Количество соли в соленой воде может варьироваться от одного образца к другому. Все растворы считаются гомогенными, поскольку растворенный материал присутствует в одинаковом количестве во всем растворе.
Гетерогенная смесь представляет собой смесь, состав которой неоднороден по всей смеси. Овощной суп представляет собой неоднородную смесь. Любая данная ложка супа будет содержать различное количество различных овощей и других компонентов супа.
Фаза
Фаза – это любая часть образца, имеющая однородный состав и свойства. По определению чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а вместо этого образуют два отдельных слоя. Каждый из слоев называется фазой.
Пример \(\PageIndex{1}\)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок, содержащий атомы алюминия и кислорода в соотношении 2:3
- селен
Дано : химическое вещество
Запрашиваемый : его классификация
- Определите, является ли вещество химически чистым. Если оно чистое, то вещество является либо элементом, либо соединением.
 Если вещество можно разделить на элементы, оно является соединением.
Если вещество можно разделить на элементы, оно является соединением. - Если вещество не является химически чистым, оно представляет собой либо гетерогенную смесь, либо гомогенную смесь. Если его состав везде однороден, то это однородная смесь.
Раствор
- A) Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрованием.
B) Поскольку состав раствора везде однороден, это гомогенная смесь . - A) Апельсиновый сок содержит как твердые, так и жидкие частицы (мякоть); он не является химически чистым.
B) Поскольку его состав не везде однороден, апельсиновый сок представляет собой гетерогенную смесь . - A) Компакт-диск представляет собой твердый материал, содержащий более одного элемента, по краям которого видны участки разного состава.
 Следовательно, компакт-диск не является химически чистым.
Следовательно, компакт-диск не является химически чистым.
B) Области разного состава указывают на то, что компакт-диск представляет собой гетерогенную смесь. - A) Оксид алюминия представляет собой отдельное химически чистое соединение .
- A) Селен является одним из известных элементов .
Упражнение \(\PageIndex{1}\)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- заправка для салата «ранчо»
- сахар столовый (сахароза)
- Ответ а:
- гомогенная смесь (раствор)
- Ответ б:
- элемент
- Ответ c:
- гетерогенная смесь
- Ответ д:
- компаунд
Пример \(\PageIndex{2}\)
Как бы химик классифицировал каждый пример материи?
- морская вода
- почва
- вода
- кислород
Раствор
- Соленая вода действует так, как если бы она была одним веществом, даже если она содержит два вещества — соль и воду.
 Соленая вода представляет собой однородную смесь или раствор.
Соленая вода представляет собой однородную смесь или раствор. - Почва состоит из мелких кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество. В частности, поскольку вода состоит из водорода и кислорода, она представляет собой соединение.
- Кислород, вещество, элемент.
Упражнение \(\PageIndex{2}\)
Как бы химик классифицировал каждый образец вещества?
- кофе
- водород
- яйцо
- Ответ а:
- гомогенная смесь (раствор), если это фильтрованный кофе
- Ответ б:
- элемент
- Ответ c:
- гетерогенная смесь
Резюме
Вещество можно разделить на две широкие категории: чистые вещества и смеси. Чистое вещество – это форма материи, которая имеет постоянный состав и свойства, постоянные во всем образце. Смеси представляют собой физические комбинации двух или более элементов и/или соединений. Смеси можно разделить на гомогенные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения – это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из атомов одного типа.
Смеси представляют собой физические комбинации двух или более элементов и/или соединений. Смеси можно разделить на гомогенные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения – это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из атомов одного типа.
Словарь
- Элемент: вещество, состоящее только из атомов одного типа.
- Соединение: вещество, состоящее из более чем одного типа атомов, связанных вместе.
- Смесь: комбинация двух или более элементов или соединений, которые не прореагировали, чтобы связать друг друга; каждая часть смеси сохраняет свои свойства.
Взносы и атрибуции
3.4: Классификация материалов в соответствии с их составом распространяется по лицензии CK-12, авторами, ремиксами и/или кураторами являются Мариса Альвиар-Агнью, Генри Агнью, Стивен Лоуэр и Стивен Лоуэр.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СК-12
- Показать страницу TOC
- нет на стр.







 Если вещество можно разделить на элементы, оно является соединением.
Если вещество можно разделить на элементы, оно является соединением. Следовательно, компакт-диск не является химически чистым.
Следовательно, компакт-диск не является химически чистым.  Соленая вода представляет собой однородную смесь или раствор.
Соленая вода представляет собой однородную смесь или раствор.
Leave A Comment