Тест на тему «типы химических связей». Основные типы химической связи Тест «Типы связей и кристаллических решеток»
Тест «Типы связей и кристаллических решеток»
Вариант №1
А1 В молекуле сероуглерода CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
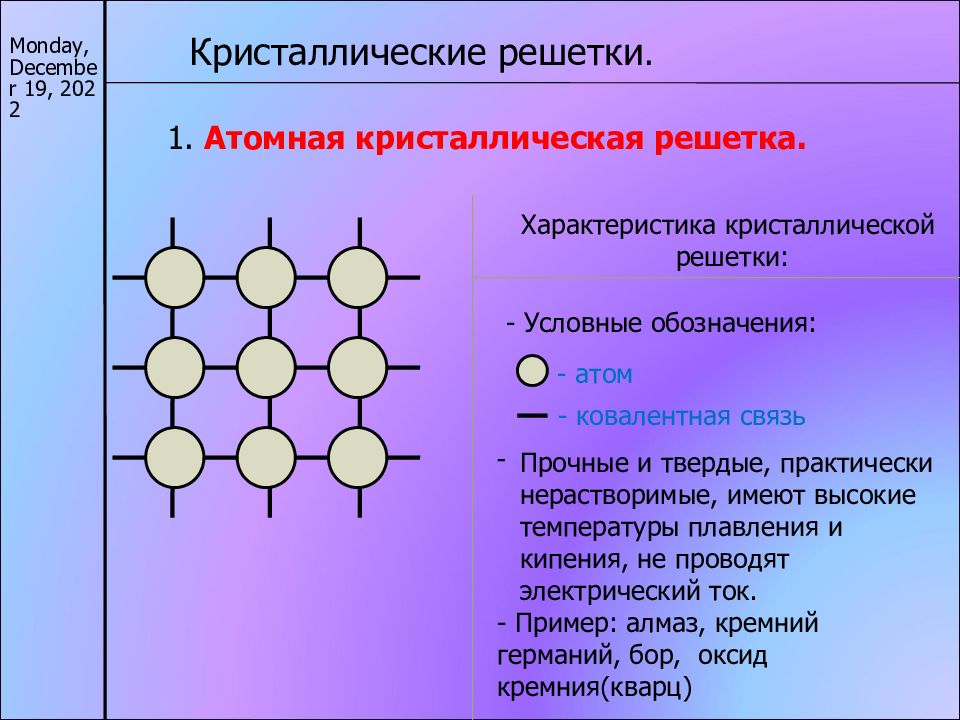
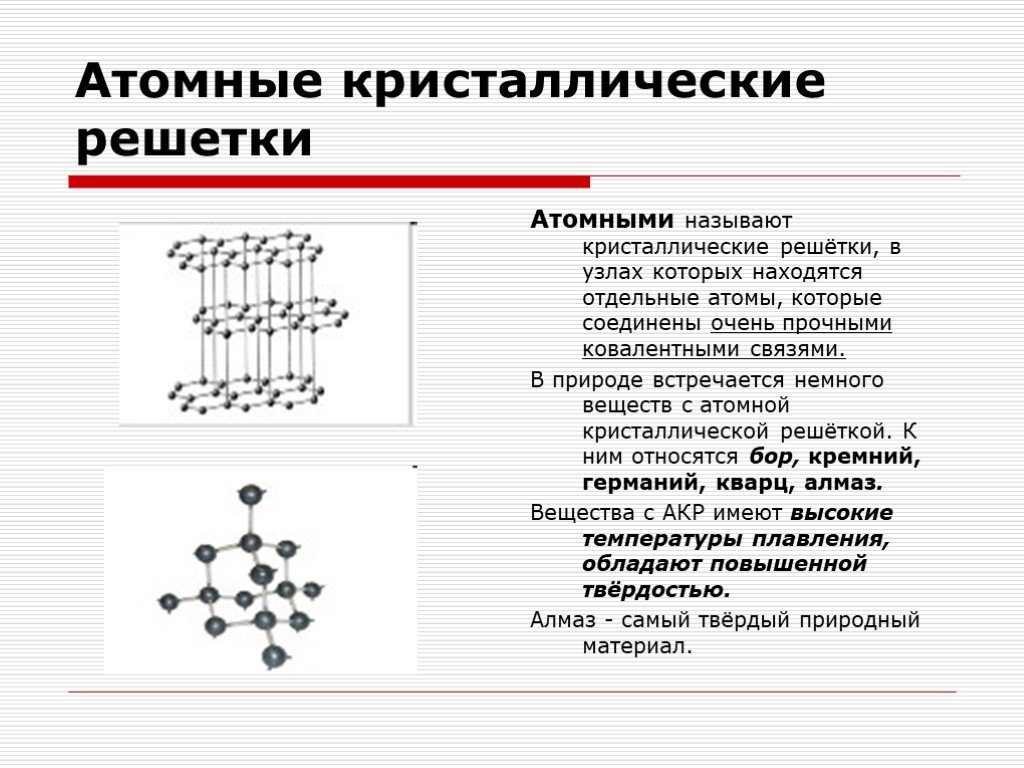
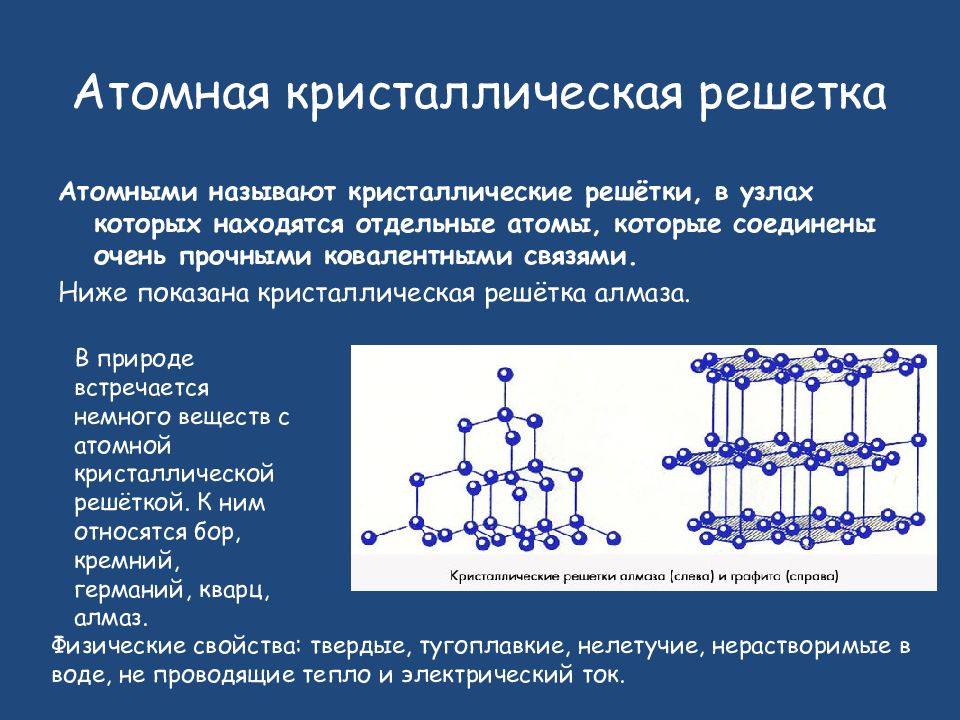
А2 Атомную кристаллическую решетку имеет
1) СН4 2) Н2 3) О2 4) Si
А3. В аммиаке (Nh4) и хлориде бария (BaCl2) химическая связь соответственно:
1) ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А4. Ионную кристаллическую решетку имеет
1) SiO2 2) Na2O 3) CO 4) P4
А5. Какие из предложенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
1) Верно только А 2) Верно только Б 3) Верны оба суждения 4) Оба суждения неверны
А6. Ионный характер связи наиболее выражен в соединении
Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaF2 4) Nh4
А7. В каком ряду все вещества имеют ковалентную полярную связь
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
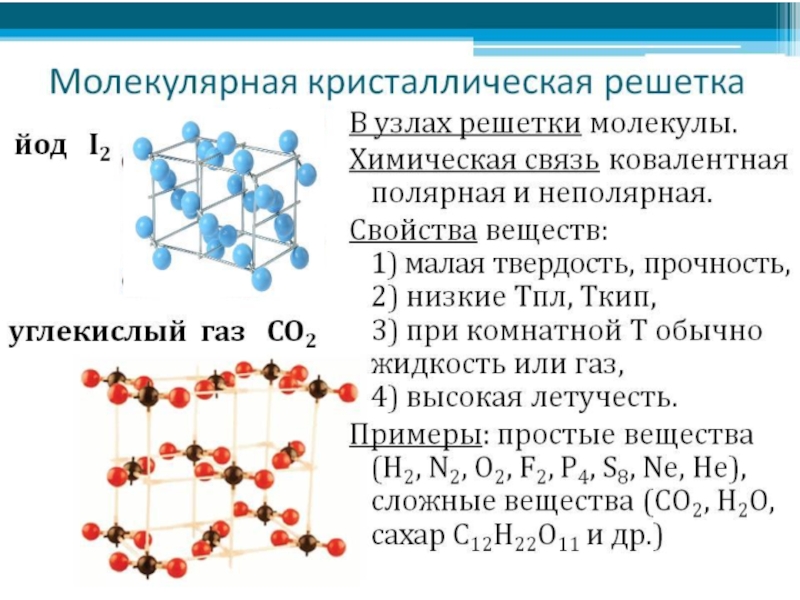
А8. Кристаллическая решетка углекислого газа (CO2)
А9. водородная связь образуется между молекулами
1) C2H6 2) C2H5OH 3) C6H5Ch4 4) NaCl
А10. Частично положительный заряд в молекуле OF2
1) у атома О 2) у атома F 3) у атомов О и F 4) Все атомы заряжены отрицательно
А11. Молекулярную кристаллическую решётку имеет
1) Nh4 2) Na2O 3) ZnCl2 4) CaF2
А12. Атомную кристаллическую решётку имеет
1) Ba(OH)2 2) алмаз 3) I2 4) Al2(SO4)2
А13. Ионную кристаллическую решётку имеет
А 14. Металлическую кристаллическую решётку имеет
1) графит 2) Cl2 3) Na 4) NaCl
А1. Вещества только с ионной связью приведены в ряду
1) F2, CCl4, KCl 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2,K2S
А2. Кристаллическая решетка графита
Кристаллическая решетка графита
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А3. Молекулярную решетку имеет
1) Na2O 2) SiO2 3) CaF2 4) Nh4
А4. Кристаллическая решетка хлорида кальция (СaCl2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А5. В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
1) CCl4 2) SiO2 3) CaF2 4) Nh5Cl
А6. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А7. При соединении атомов одного и того же химического элемента образуется связь
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
А8. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 3) проводят электрический ток в растворах
2) хрупкие и легкоплавкие 4) проводят электрический ток в расплавах
А9.
1) не существует 2) находится посередине 3) смещена к атому Н 4) смещена к атому Br
А10. Вещество молекулярного строения
1) O3 2) BaO 3) C 4) K2S
А11. Кристаллическая решётка алмаза
А12. Кристаллическая решётка гидроксида калия (KOH)
1) атомная 2) металлическая 3) ионная 4) молекулярная
А13. Кристаллическая решётка хлороводородной кислоты (НCl)
1) ионная 2) молекулярная 3) атомная 4) ионная
А14. Кристаллическая решётка железа
1) металлическая 2) молекулярная 3) ионная 4) атомная
В1. Установите соответствие между соединением и типом связи в соединении.
В2. Установите соответствие между соединением и типом кристаллической решетки
В3. Установите соответствие между соединением и типом связи в соединении.
Ход урока: (Cлайд 3)
- Объяснение темы “Основные типы химической
связи”.

- Закрепление (Тест)
- Работа в графическом редакторе “Paint” – составление графических формул веществ.
- Домашнее задание.
Ход урока
I. Химический диктант. (Cлайд 4)II. Проверка домашнего задания
(Cлайд 5)(Устный опрос)
- Что такое электроотрицательность?
- Зависимость электроотрицательности от расположения элемента в таблице Менделеева?
- Как определить принадлежность элемента к металлам или неметаллам по электроотрицательности?
III. Объяснение темы “Основные типы химической связи”. (
Cлайд 6)- Связь между элементами с одинаковой или близкой электроотрицательностью называется ковалентной. (Cлайд 7)
- Связь между металлами называется металлической.
- Связь между элементами со значительно
отличающейся электроотрицательностью
называется ионной.

- Связь между электроотрицательными элементами разных молекул при помощи водорода называется водородной.
IV. Закрепление (Тест)
(Cлайд 19)“Закрепление 3” – для тех, кто не совсем уверен в своих знаниях,
“Закрепление 4” – для тех, кто уверен в своих знаниях,“Закрепление 5” – для тех, кто абсолютно уверен в своих знаниях.
- Отвечаете на вопросы.
- Получаете оценку и ждете пока учитель не разрешит закрыть программу.
V. Работа в графическом редакторе “Paint” – составление графических формул веществ.
(Cлайд 9)1.Открываете программу “Paint”.
2. При помощи “наборов инструментов”
составляете графические формулы веществ: воды,
фторида натрия, хлороводорода, метана.
H 2 O, NaF, HCl, CH 4 .
Типы химических свиязей.
Часть А
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
1)1 2)2 3)3 4)4
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
А)железо 1)ионная
Д)азот
Часть С
Типы химических свиязей.
Часть А
1.Химическая связь в молекуле фтороводорода
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
2. ионная связь образуется между атомами
1) натрия и фтора 2)серы и водорода 3) серы и кислорода 4)хлора и водорода
3. Ионная связь образуется между ионами
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
4. Химическая связь между атомами химических элементов с порядковыми номерами 3 и 35
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
5. Химическая связь между атомами, электроотрицательности которых не отличаются друг от друга, называется
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
6. Химическая связь атома химического элемента, имеющего шесть электронов на внешнем электронном слое с водородом
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
7. Ковалентная полярная связь в каждом из двух веществ:
Ковалентная полярная связь в каждом из двух веществ:
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
8. Две общие электронные пары имеются в молекуле
1)водорода 2)бромоводорода 3)сероводорода 4) аммиака
9. Одну ковалентную связь имеет молекула
1)иодоводорода 2)азота 3)метана 4)кислорода
10. Число общих электронных пар в соединениях состава ЭО 2
1)1 2)2 3)3 4)4
11. Укажите формулу лишнего соединения
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
12. Установите соответствие между названием соединения и типом химической связи в этом соединении.
Название соединения Тип химической связи
А)железо 1)ионная
Б)кислород 2)ковалентная полярная
В)вода 3)ковалентная неполярная
Г)бромид литии 4)металлическая
Д)азот
13. Ковалентная полярная связь имеет место в соединениях:
1)сероводород 2)угарный газ 3)фтор 4)цинк 5)фторид калия 3)фтор
14. Три ковалентные полярные связи имеют молекулы
Три ковалентные полярные связи имеют молекулы
1)азота 2)фосфина 3) углекислого газа 4)аммиака 5)метана
Часть С
15. Приведите примеры четырех соединений калия, имеющих одновременно и ионную и ковалентную связь.
16. Назовите соединение, имеющее одну ковалентную неполярную связь атомов, электроны которых расположены на трех энергетических слоях.
1. Связь между ионами металла и блуждающими электронами называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
2. Химическая связь, возникающая между атомами неметаллов одного вида называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
3. Химическая связь, возникающая между атомами неметаллов обладающих разной электроотрицательностью называется ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
4. Химическая связь, возникающая между атомами типичного металла и типичного неметалла называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
5. Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью: N 2 , NH 3, CO 2, NH 3, H 2, KF H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью: N 2 , NH 3, CO 2, NH 3, H 2, KF H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
6. Выберите группу веществ, в состав которой входят только вещества с ковалентной полярной связью: N 2 , NH 3, CO 2, Na, NH 3, H 2, KF H 2 O, НCl F 2, HF, C Ca. CO 3
7. Выберите группу веществ, в состав которой входят только вещества с металлической связью: Na, CO 2, K, Al, NH 3, Fe H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
8. Выберите группу веществ, в состав которой входят только вещества с ионной связью: Nа, К, Аl, Fe CO 2, Na. Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
9. Определите вид химической связи и тип кристаллической решетки, если вещество обладает высокой температурой плавления и кипения, твердое, тугоплавкое, хорошо растворимо в воде. Раствор проводит электрический ток. Ковалентная полярная связь и атомная кристаллическая решетка Ионная связь и ионная кристаллическая решетка Ковалентная полярная связь и молекулярная кристаллическая решетка. Металлическая связь и металлическая кристаллическая решетка. Ковалентная неполярная связь и молекулярная кристаллическая решетка
Металлическая связь и металлическая кристаллическая решетка. Ковалентная неполярная связь и молекулярная кристаллическая решетка
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул.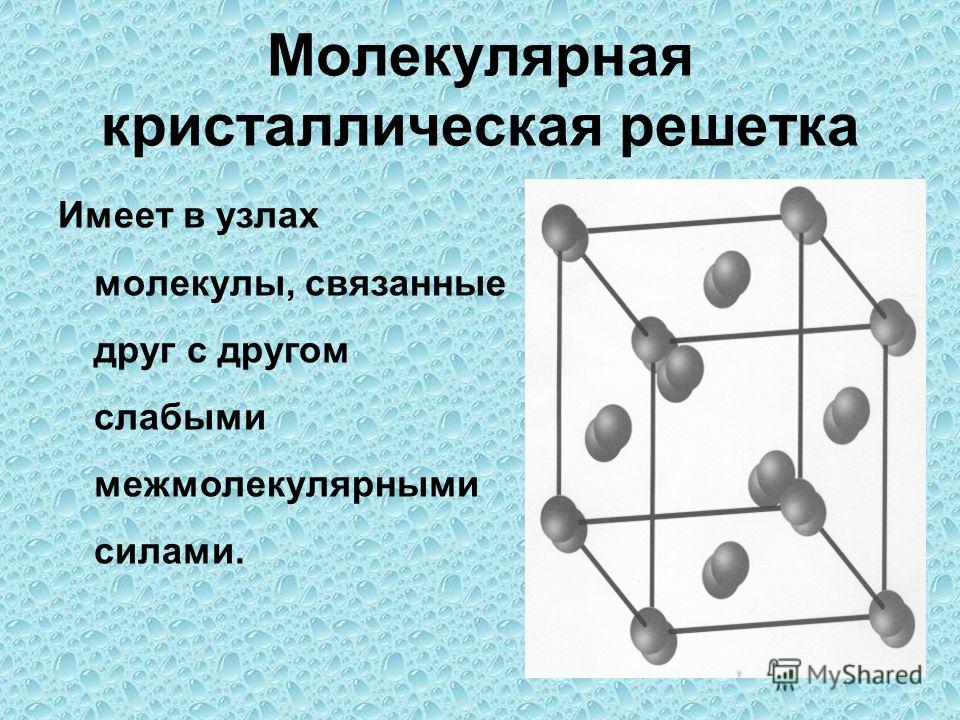 Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1.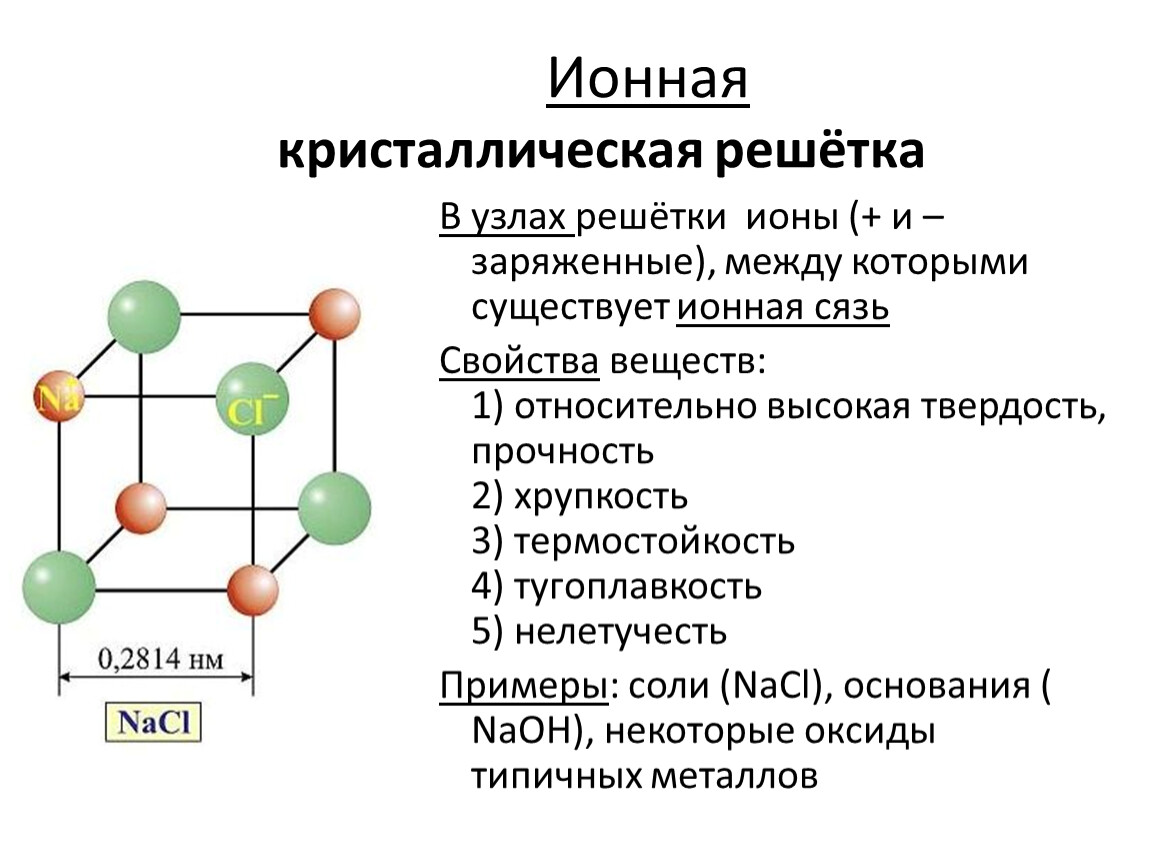 Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2O, H 2F 2, NH 3. За счет водородных связей вода характеризуется столь высокими по сравнению с H 2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Строение вещества. Химическая связь — презентация онлайн
1. Учебная дисциплина «Естествознание» Раздел II «Химия»
26.03.20202. Тема 3. Строение вещества
26.03.2020ККМИ им. И. В. Казенина
Естествознание
Тема 3.

Строение вещества
Преподаватель
Вера Дмитриевна Колобова
Киров, 2020 г
Переписать всё (если иное
не указано) с каждого
слайда и осмыслить
4. 1. Природа химической связи
Химическуюсвязь обусловливает
электростатическое взаимодействие
между отрицательно заряженными
электронами и положительно
заряженными ядрами, а также
взаимодействие электронов друг с
другом
5. Почему атомы объединяются в молекулы?
Молекулярноесостояние наиболее
устойчивое, чем атомное.
То есть оно, во-первых, энергетически
более выгодно, а во-вторых, наиболее
стабильно для существования при
обычных условиях
6. 2. Виды химической связи 1) Ковалентная связь
Онавозникает между атомами
вследствие перекрывания их
электронных оболочек и образования
общих электронных пар
7. ПРОЧИТАТЬ Характерные свойства
1. Направленность связи обусловлена молекулярным строениемвещества и геометрической формы их молекулы.

2. Насыщаемость — способность атомов образовывать
ограниченное число ковалентных связей. Количество связей,
образуемых атомом, ограничено числом его внешних атомных
орбиталей.
3. Полярность связи обусловлена неравномерным
распределением электронной плотности вследствие различий
в электроотрицательностях атомов.
4. Поляризуемость связи выражается в смещении электронов
связи под влиянием внешнего электрического поля, в том числе
и другой реагирующей частицы. Поляризуемость определяется
подвижностью электронов. Полярность и поляризуемость
ковалентных связей определяет реакционную способность
молекул по отношению к полярным реагентам.
Работу выполнила
студентка 1-ТО
Перминова Екатерина
8. Ковалентная неполярная связь
Такуюсвязь образуют атомы одного и
того же химического элемента неметалла (например, h3, O2, О3)
9. ПРОЧИТАТЬ И ПОНЯТЬ
Механизм образования ковалентнойнеполярной связи:
Каждый атом неметалла отдает в общее
пользование другому атому наружные не
спаренные электроны.
 Образуются общие
Образуются общиеэлектронные пары. Электронная пара
принадлежит в равной мере обоим атомам
10. Ковалентная полярная связь
Такуюсвязь образуют атомы разных
неметаллов, отличающихся по
значения электроотрицательности
(например, HCl, h3O)
Электроотрицательность — это свойство атомов одного
элемента притягивать к себе электроны от атомов других
элементов (значения электроотрицательности находятся в
таблице Л. Полинга)
11. ПРОЧИТАТЬ И ПОНЯТЬ
Механизм образования ковалентной полярнойсвязи:
Каждый атом неметалла отдает в общее
пользование другому атому свои наружные не
спаренные электроны. Образуются общие
электронные пары. Общая электронная пара
смещена к более электроотрицательному
элементу
Вещества
с ковалентной связью могут
быть твёрдыми, жидкими и
газообразными с атомной или
молекулярной решётками и имеют, как
правило, низкие температуры кипения и
плавления (из-за меньшей прочности
кристаллической решётки молекулярного типа)
13.
 ПРОЧИТАТЬКроме простой ковалентной связи различают также:
ПРОЧИТАТЬКроме простой ковалентной связи различают также:1. Донорно-акцепторная связь. Для образования этого вида ковалентной связи
оба электрона предоставляет один из атомов — донор. Второй из атомов,
участвующий в образовании связи, называется акцептором. В образовавшейся
молекуле формальный заряд донора увеличивается на единицу, а формальный
заряд акцептора уменьшается на единицу.
2. Семиполярная связь. Её можно рассматривать как полярную донорноакцепторную связь. Этот вид ковалентной связи образуется между атомом,
обладающим неподелённой парой электронов
(азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными
электронами (кислород, сера). Образование семиполярной связи протекает в
два этапа.
Работу выполнила
студентка 1-ТО
Перминова Екатерина
14. 2. Виды химической связи 2) Ионная связь
Этахимическая связь образуется между
ионами по электростатическому
механизму
Ионные соединения образуются атомами
элементов, резко отличающихся по
значению электроотрицательности,
например, Cs и F, Na и Cl
В ионных соединениях электрон полностью переходит к
атому неметалла.
 В результате этот атом становится
В результате этот атом становитсяотрицательно заряженным ионом (анионом).
Атом, отдавший электрон, — положительно заряженным
ионом (катионом)
Na – 1e → катион натрия Na+
Cl + 1e → анион хлора Cl–
Na+ + Cl– → хлорид натрия NaCl
Соединения
с ионным типом связи –
это твёрдые кристаллические вещества
с ионной кристаллической решёткой и
они имеют высокие температуры
кипения и плавления, в отличие от
ковалентных соединений
17. 2. Виды химической связи 3) Металлическая связь
Это связь в металлахПри сближении, а значит и при перекрывании
атомных оболочек соседних атомов электроны
свободно перемещаются от одного атома к другому,
осуществляя связь по обменному механизму
Атомы металла, катионы
и электроны
удерживаются за счёт
сил электростатического
притяжения
18. ПРОЧИТАТЬ Характеристики металлической связи
Ненаправленность (изотропность) –внутри кристалла движение электронов
происходит в любом направлении, они
могут присоединятся к любому из ионов
в узлах структуры.
Многоэлектронность – образуется при
помощи всех имеющихся валентных
электронов.
Делокализованность – при помощи этой
связи соединено сразу большое
количество атомов кристалла.
выполнила: Смолина Александра
1 курс, Ф-но
Металлическая
связь не закреплена
между отдельными атомами, как
ковалентная и ионная. Она определяет
общие свойства металлов:
электрическая проводимость,
теплопроводности, пластичность,
твёрдость, металлический блеск и т.д.
20. ПРОЧИТАТЬ Металлическая связь характерна
для чистых металлов и для смесей различных металлов —сплавов (бронза, сталь, чугун, латунь и т. д.), если они
находятся в твёрдом или жидком состоянии.
В парообразном состоянии атомы металлов связаны между
собой ковалентной связью. Например, парами натрия
заполнены лампы жёлтого цвета для уличных фонарей.
21. 2. Виды химической связи 4) Водородная связь
Далее переписать то, что выделенорамкой:
Водородная связь – это связь, образующаяся между атомом
водорода одной молекулы и другим электроотрицательным атомом
другой молекулы
Работу выполнила
Студентка 1 курса, ф-но
Шакирова Эвелина
23.
 Свойства и типы водородных связейКовалентная и водородная связь сильно различаются по силе.
Свойства и типы водородных связейКовалентная и водородная связь сильно различаются по силе.Водородная значительно слабее, однако ее энергия и стабильность
выше, чем у слабых межмолекулярных взаимодействий, таких как
силы Ван-дер-Ваальса. Образование и разрушение водородной
связи не требуют значительных затрат энергии, и она является
достаточно стабильной при нормальных условиях. Подобная
гибкость, обуславливает ее широкое распространение в
молекулах, используемых живыми организмами, – «сборка» и
«разборка» таких молекул легко осуществляется силами
естественных энзимов.
Можно выделить два подтипа водородной связи:
внутримолекулярная – образуется между атомами одной
молекулы;
межмолекулярная – между атомами двух молекул.
Работу выполнила
Студентка 1 курса, ф-но
Шакирова Эвелина
Работу выполнила
Студентка 1 курса, ф-но
Шакирова Эвелина
25. 3. Взаимодействие кристаллических решеток веществ с различными типами химической связи
Подготовлено студентом ККМИ 1ф-ноЗверевым
Денисом
2020
Строение кристаллов и типы
кристаллических решеток
Кристаллами называются твёрдые вещества, частицы которых
образуют трёхмерную периодическую пространственную структуру,
называемую кристаллической решёткой.

Грани кристаллов представляют собой правильные многоугольники.
Свойства кристаллических тел различны. Например, алмаз обладает
максимальной твёрдостью, а графит можно сломать руками, хотя эти
вещества состоят атомов углерода. Свойства веществ зависят от типа
кристаллической решетки.
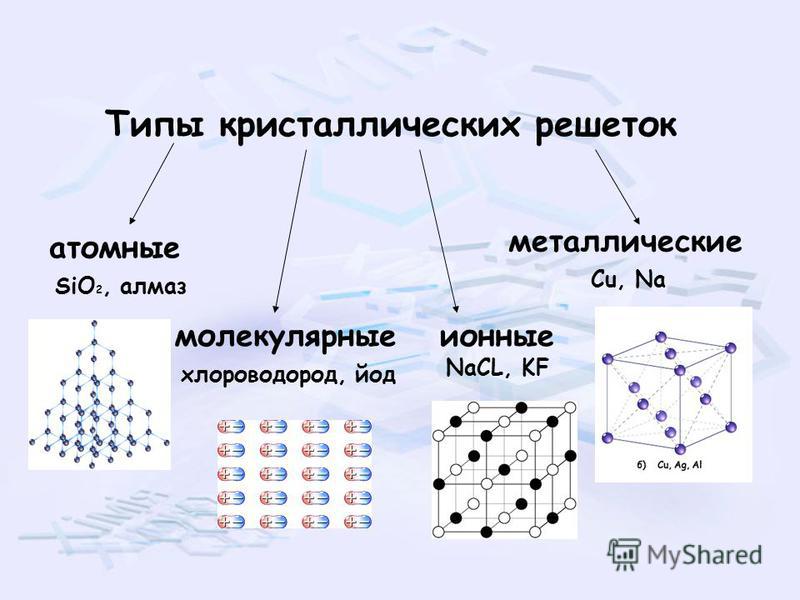
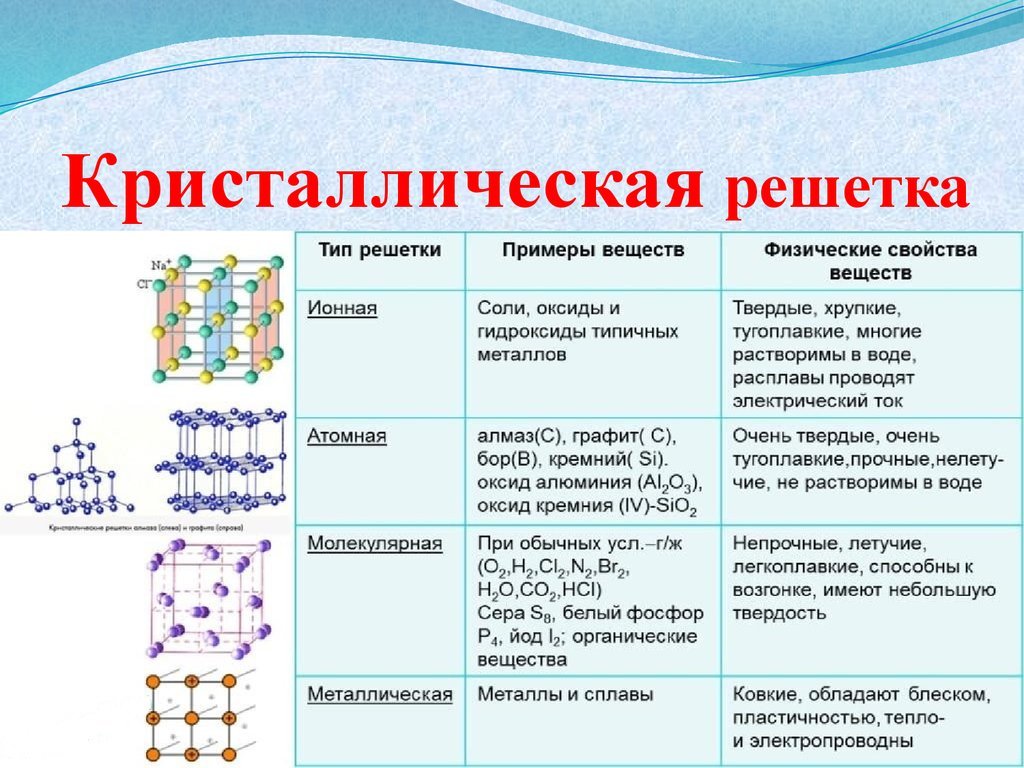
Различают четыре типа кристаллических решёток: атомную, ионную,
молекулярную и металлическую.
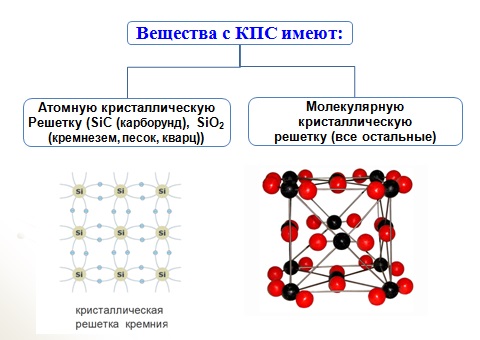
Соединения с ковалентной связью имеют два типа
кристаллических решеток: атомные и
молекулярные.
В атомной кристаллической решетке в узлах находятся атомы,
соединенные прочной ковалентной связью. Вещества с такой
кристаллической решеткой имеют высокие температуры плавления,
прочны и тверды, практически нерастворимы в жидкостях.
например, алмаз, твердый бор, кремний, германий и соединения
некоторых элементов с углеродом и кремнием.
В молекулярной кристаллической решетке в узлах находятся
молекулы, соединенные слабым межмолекулярным взаимодействием.

Вещества с такой решеткой имеют малую твердость и низкие
температуры плавления, нерастворимы или малорастворимы в воде,
из растворы практически не проводят электрический ток.
Например, лед, твердый оксид углерода (IV) твердые
галогеноводороды, твердые простые вещества, образованные одно(благородные газы), двух- (F2, Cl2, Br2, I2, h3, O2, N2), трех-(О3),
четырех- (Р4), восьми- (S8) атомными молекулами. Большинство
кристаллических органических соединений имеют молекулярную
решетку.
Соединения с ионной
связью имеют ионную
кристаллическую
решетку, в узлах
которой чередуются
положительно и
отрицательно
заряженные ионы.
Вещества с ионной
решеткой тугоплавки
и малолетучи, имеют
сравнительно
высокую твердость, но
хрупки .
Расплавы и водные
растворы солей и
щелочей проводят
электрический ток
29. Самостоятельная работа на оценку на отдельном листочке
6. Определите тип связи между атомами в соединениях: СaF2,K2SO4, Ag, Ch5, Ch4COONa, S8
12.
 2: Расположение атомов в кристаллических твердых телах
2: Расположение атомов в кристаллических твердых телах- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 6403
- Анонимный
- LibreTexts
Цели обучения
- Распознать элементарную ячейку кристаллического твердого тела.
- Для расчета плотности твердого тела по его элементарной ячейке.
Поскольку кристаллическое твердое тело состоит из повторяющихся узоров его компонентов в трех измерениях (кристаллическая решетка), мы можем представить весь кристалл, нарисовав структуру мельчайших одинаковых единиц, которые, складываясь вместе, образуют кристалл. Эта основная повторяющаяся единица называется элементарной ячейкой. Например, элементарная ячейка листа одинаковых почтовых марок представляет собой одиночную марку, а элементарная ячейка стопки кирпичей — одиночный кирпич. В этом разделе мы опишем расположение атомов в различных элементарных ячейках.
Например, элементарная ячейка листа одинаковых почтовых марок представляет собой одиночную марку, а элементарная ячейка стопки кирпичей — одиночный кирпич. В этом разделе мы опишем расположение атомов в различных элементарных ячейках.
Элементарные ячейки легче всего визуализировать в двух измерениях. Во многих случаях для представления данной структуры можно использовать более одной элементарной ячейки, как показано на рисунке Эшера во вступлении к главе и на двумерной кристаллической решетке на рис. 12.2. Обычно выбирается наименьшая элементарная ячейка, полностью описывающая порядок. Единственное требование к действительной элементарной ячейке состоит в том, что ее повторение в пространстве должно давать правильную решетку. Таким образом, элементарная ячейка в части (d) на рис. 12.2 не является правильным выбором, потому что ее повторение в пространстве не дает желаемой решетки (есть треугольные отверстия). Концепция элементарных ячеек расширена до трехмерной решетки на схематическом рисунке на рис.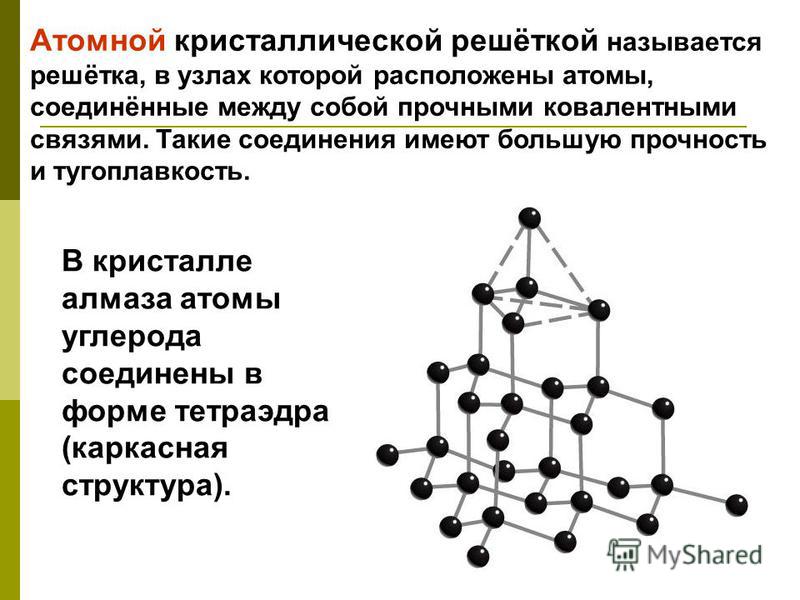 12.3.
12.3.
Элементарная ячейка
Существует семь принципиально различных типов элементарных ячеек, отличающихся относительными длинами ребер и углами между ними (рис. 12.4). Каждая элементарная ячейка имеет шесть сторон, и каждая сторона представляет собой параллелограмм.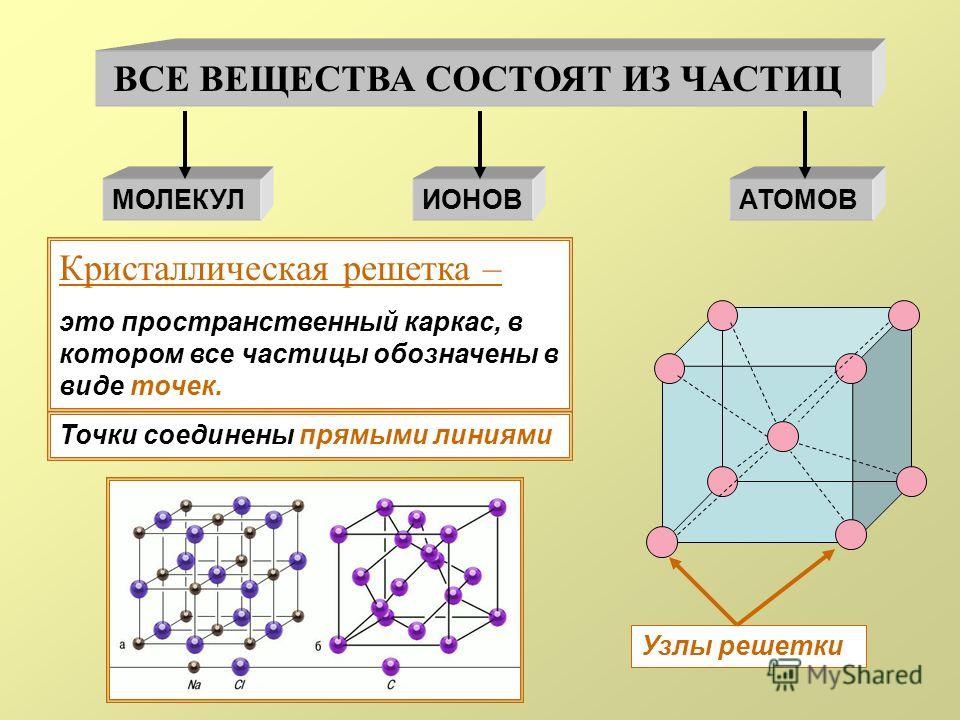 Мы сосредоточимся в первую очередь на кубических элементарных ячейках, в которых все стороны имеют одинаковую длину, а все углы равны 90°, но введенные нами понятия применимы и к веществам, элементарные ячейки которых не кубические.
Мы сосредоточимся в первую очередь на кубических элементарных ячейках, в которых все стороны имеют одинаковую длину, а все углы равны 90°, но введенные нами понятия применимы и к веществам, элементарные ячейки которых не кубические.
Если кубическая элементарная ячейка состоит из восьми составляющих атомов, молекул или ионов, расположенных в углах куба, то она называется простой кубической (часть (а) в Рисунок 12.5). Если элементарная ячейка также содержит идентичный компонент в центре куба, то она является объемно-центрированной кубической (ОЦК) (часть (б) на рис. 12.5). Если в центре каждой грани есть компоненты в дополнение к компонентам в углах куба, то элементарная ячейка является гранецентрированной кубической (ГЦК) (часть (c) на рис. 12.5).
12.5).
Как показано на рис. 12.5, твердое тело состоит из большого количества элементарных ячеек, расположенных в трех измерениях. Следовательно, любое интенсивное свойство сыпучего материала, такое как его плотность, также должно быть связано с его элементарной ячейкой. Поскольку плотность — это масса вещества на единицу объема, мы можем рассчитать плотность сыпучего материала, исходя из плотности одной элементарной ячейки. Для этого нам необходимо знать размер элементарной ячейки (для получения ее объема), молярную массу ее компонентов и количество компонентов в элементарной ячейке.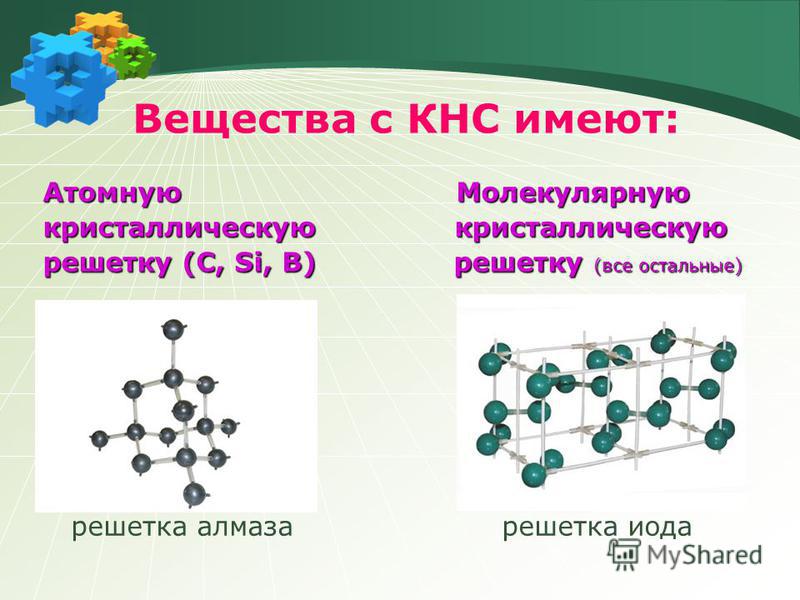 Однако, когда мы подсчитываем атомы или ионы в элементарной ячейке, те из них, которые лежат на грани, ребре или углу, вносят вклад более чем в одну элементарную ячейку, как показано на рис. 12.5. Например, атом, лежащий на поверхности элементарной ячейки, является общим для двух соседних элементарных ячеек и, следовательно, считается как 12 атомов на элементарную ячейку. Точно так же атом, который находится на краю элементарной ячейки, является общим для четырех соседних элементарных ячеек, поэтому он дает по 14 атомов каждой. Атом в углу элементарной ячейки является общим для всех восьми соседних элементарных ячеек и, следовательно, вносит по 18 атомов в каждую. Утверждение, что атомы, лежащие на краю или в углу элементарной ячейки, считаются как 14 или 18 атомов на элементарную ячейку, соответственно верно для всех элементарных ячеек, кроме гексагональной, в которой три элементарные ячейки делят каждое вертикальное ребро и шесть делят каждый угол (рис. 12.4), что приводит к значениям 13 и 16 атомов на элементарную ячейку соответственно для атомов в этих позиции.
Однако, когда мы подсчитываем атомы или ионы в элементарной ячейке, те из них, которые лежат на грани, ребре или углу, вносят вклад более чем в одну элементарную ячейку, как показано на рис. 12.5. Например, атом, лежащий на поверхности элементарной ячейки, является общим для двух соседних элементарных ячеек и, следовательно, считается как 12 атомов на элементарную ячейку. Точно так же атом, который находится на краю элементарной ячейки, является общим для четырех соседних элементарных ячеек, поэтому он дает по 14 атомов каждой. Атом в углу элементарной ячейки является общим для всех восьми соседних элементарных ячеек и, следовательно, вносит по 18 атомов в каждую. Утверждение, что атомы, лежащие на краю или в углу элементарной ячейки, считаются как 14 или 18 атомов на элементарную ячейку, соответственно верно для всех элементарных ячеек, кроме гексагональной, в которой три элементарные ячейки делят каждое вертикальное ребро и шесть делят каждый угол (рис. 12.4), что приводит к значениям 13 и 16 атомов на элементарную ячейку соответственно для атомов в этих позиции.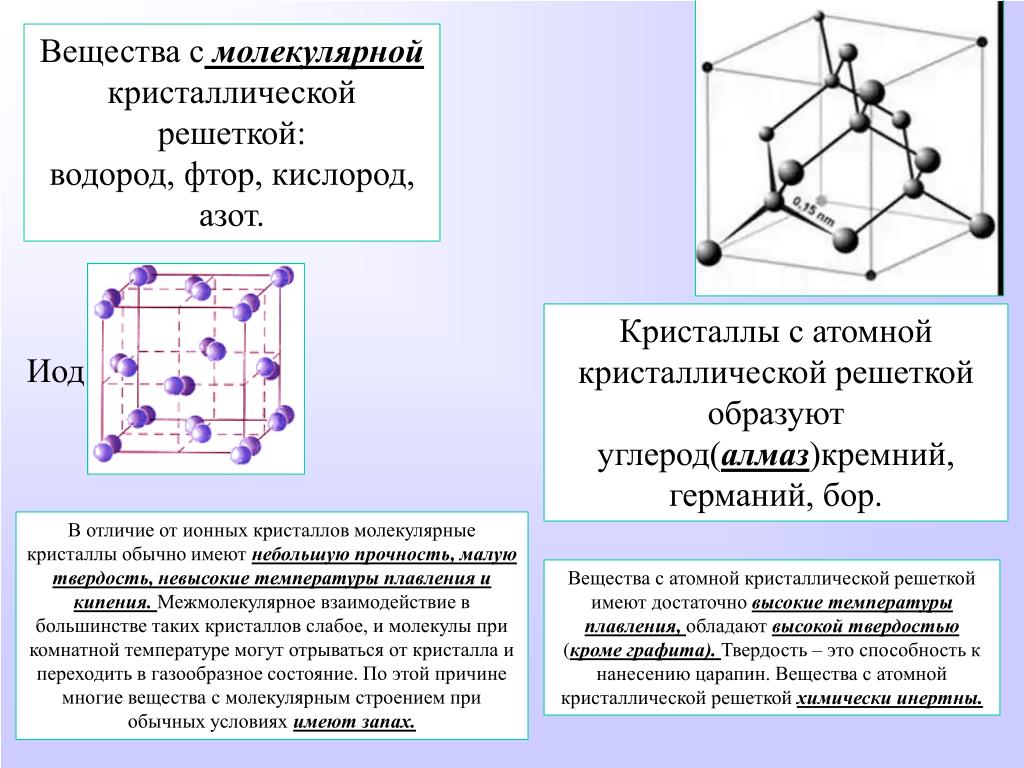 Напротив, атомы, полностью лежащие внутри элементарной ячейки, например атом в центре объемно-центрированной кубической элементарной ячейки, принадлежат только этой элементарной ячейке.
Напротив, атомы, полностью лежащие внутри элементарной ячейки, например атом в центре объемно-центрированной кубической элементарной ячейки, принадлежат только этой элементарной ячейке.
| Примечание |
|---|
| Для всех элементарных ячеек, кроме шестиугольных, атомы на гранях вносят \({1\over 2}\) атомов в каждую элементарную ячейку, атомы на ребрах вносят \({1 \over 4}\) атомов в каждую ячейку ячейки, а атомы в углах вносят \({1 \более 8}\) атомов в каждую элементарную ячейку. |
| Пример 1 |
|---|
Металлическое золото имеет гранецентрированную кубическую элементарную ячейку (часть (c) на рис. 12.5). Сколько атомов Au содержится в каждой элементарной ячейке? Дано : элементарная ячейка Запрашиваемый : число атомов в элементарной ячейке Стратегия : Используя рис. Решение : Как показано на рис. 12.5, элементарная гранецентрированная кубическая ячейка имеет восемь атомов в углах куба и шесть атомов на гранях. Поскольку атомы на грани разделены двумя элементарными ячейками, каждый из них считается как \({1 \более 2}\) атомов на элементарную ячейку, что дает 6×\({1 \более 2}\)=3 атома золота на элементарную ячейку. . Атомы в углу являются общими для восьми элементарных ячеек и, следовательно, вносят только \({1 \более 8}\) атомов на элементарную ячейку, что дает 8×\({1 \более 8}\) = 1 атом Au на элементарную ячейку. Таким образом, общее число атомов Au в каждой элементарной ячейке равно 3 + 1 = 4,9.0040 |
| Упражнение 1 |
|---|
Металлическое железо имеет объемно-центрированную кубическую элементарную ячейку (часть (b) на рис. Ответ : два |
Теперь, когда мы знаем, как считать атомы в элементарных ячейках, мы можем использовать элементарные ячейки для расчета плотности простых соединений. Заметим, однако, что мы предполагаем, что твердое тело состоит из идеального регулярного массива элементарных ячеек, тогда как реальные вещества содержат примеси и дефекты, влияющие на многие их объемные свойства, включая плотность. Следовательно, результаты наших расчетов будут близки, но не обязательно идентичны экспериментально полученным значениям.
| Пример 2 |
|---|
Рассчитайте плотность металлического железа, которое имеет объемно-центрированную кубическую элементарную ячейку (часть (b) на рис. 12.5) с длиной ребра 286,6 пм. Дано : элементарная ячейка и длина ребра Запрашиваемый : плотность Стратегия :
Решение : A Из примера 1 известно, что каждая элементарная ячейка металлического железа содержит два атома Fe. B Молярная масса железа 55,85 г/моль. Поскольку плотность представляет собой массу на единицу объема, нам нужно рассчитать массу атомов железа в элементарной ячейке из молярной массы и числа Авогадро, а затем разделить массу на объем ячейки (используя подходящие единицы измерения для получения плотности). в г/см 9{3} \] Этот результат хорошо согласуется с табличным экспериментальным значением 7,874 г/см 3 . |
| Упражнение |
|---|
Рассчитайте плотность золота, которое имеет гранецентрированную кубическую элементарную ячейку (часть (c) на рис. Ответ : 19,29 г/см 3 |
Упаковка сфер
В нашем обсуждении трехмерных структур твердых тел рассматривались только вещества, в которых все компоненты идентичны. Как мы увидим, такие вещества можно рассматривать как состоящие из одинаковых сфер, упакованных вместе в пространстве; то, как компоненты упакованы вместе, создает различные элементарные ячейки. Большинство веществ со структурами этого типа являются металлами.
Простая кубическая структура
Расположение атомов в твердом теле с простой кубической элементарной ячейкой показано в части (а) на рис. 12.5. Каждый атом в решетке имеет только шесть ближайших соседей в октаэдрическом расположении. Следовательно, простая кубическая решетка — неэффективный способ упаковки атомов в пространстве: только 52% всего пространства заполнено атомами. Единственный элемент, который кристаллизуется в простой кубической элементарной ячейке, — это полоний.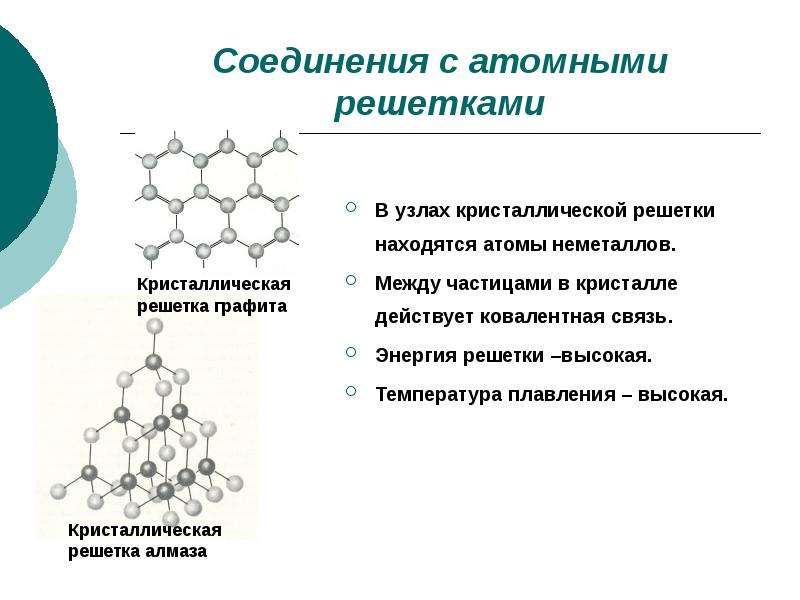 Однако простые кубические элементарные ячейки распространены среди бинарных ионных соединений, где каждый катион окружен шестью анионами, и наоборот.
Однако простые кубические элементарные ячейки распространены среди бинарных ионных соединений, где каждый катион окружен шестью анионами, и наоборот.
Расположение атомов в простой кубической элементарной ячейке . Каждый атом в решетке имеет шесть ближайших соседей в октаэдрическом расположении.
Объемно-центрированная кубическая структура
Объемно-центрированная кубическая элементарная ячейка является более эффективным способом упаковки сфер вместе и гораздо более распространена среди чистых элементов. Каждый атом имеет восемь ближайших соседей в элементарной ячейке, и 68% объема занято атомами. Как показано в части (b) на рис. 12.5, объемно-центрированная кубическая структура состоит из одного слоя сфер, соприкасающихся друг с другом и выровненных так, что их центры находятся в углах квадрата; второй слой сфер занимает квадратные «отверстия» над сферами первого слоя. Третий слой сфер занимает квадратные отверстия, образованные вторым слоем, так что каждая лежит прямо над сферой в первом слое и так далее.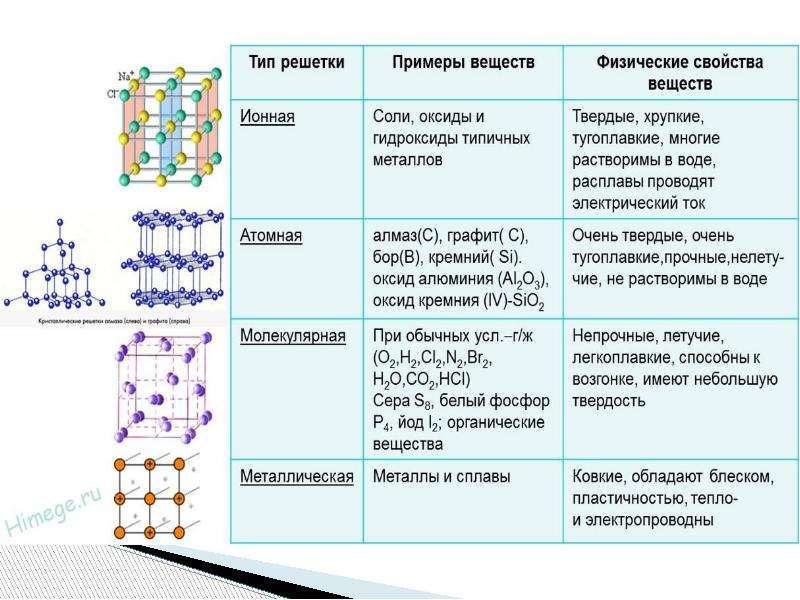 Все щелочные металлы, барий, радий и некоторые переходные металлы имеют объемно-центрированную кубическую структуру.
Все щелочные металлы, барий, радий и некоторые переходные металлы имеют объемно-центрированную кубическую структуру.
Гексагональные плотноупакованные и кубические плотноупакованные структуры
Наиболее эффективным способом упаковки сфер является плотная упаковка, которая имеет два варианта. Один слой плотноупакованных сфер показан в части (а) на рис. 12.6. Каждая сфера окружена шестью другими в той же плоскости, образуя шестиугольное расположение. Над любым набором из семи сфер находятся шесть углублений, расположенных в виде шестиугольника. В принципе, все шесть позиций одинаковы, и любая из них может быть занята атомом следующего слоя. Однако на самом деле эти шесть сайтов можно разделить на два набора, обозначенных буквами B и C в части (a) на рис. 12.6. Места B и C различаются, потому что, как только мы помещаем сферу в позицию B, мы больше не можем размещать сферу ни в одной из трех позиций C, смежных с A, и наоборот.
Рисунок 12.6: Плотно упакованные слои сфер. (а) В этом единственном слое плотно упакованных сфер каждая сфера окружена шестью другими в форме шестиугольника. (b) Размещение атома в позиции B запрещает размещение атома в любой из соседних позиций C и приводит к тому, что все атомы во втором слое занимают позиции B. (c) Размещение атомов в третьем слое над атомами в положениях A в первом слое дает гексагональную плотноупакованную структуру. Размещение атомов третьего слоя над позициями C дает кубическую плотноупакованную структуру. (CC BY-NC-SA; анонимно по запросу)
(а) В этом единственном слое плотно упакованных сфер каждая сфера окружена шестью другими в форме шестиугольника. (b) Размещение атома в позиции B запрещает размещение атома в любой из соседних позиций C и приводит к тому, что все атомы во втором слое занимают позиции B. (c) Размещение атомов в третьем слое над атомами в положениях A в первом слое дает гексагональную плотноупакованную структуру. Размещение атомов третьего слоя над позициями C дает кубическую плотноупакованную структуру. (CC BY-NC-SA; анонимно по запросу) Если мы поместим второй слой сфер в позиции B в части (a) на рис. 12.6, мы получим двухслойную структуру, показанную в части (b) на рис. 12.6. Теперь есть две альтернативы для размещения первого атома третьего слоя: мы можем поместить его непосредственно над одним из атомов в первом слое (позиция А) или в одной из позиций С, соответствующих позициям, которые мы не указали. используйте для атомов в первом или втором слоях (часть (с) на рис. 12.6). Если мы выберем первое расположение и повторим шаблон в последующих слоях, положения атомов будут меняться от слоя к слою в шаблоне ABABAB…, в результате чего получится гексагональная плотноупакованная (ГПУ) структура (часть (а) на рис. 12.7). . Если мы выберем второе расположение и будем повторять шаблон бесконечно, положения атомов будут чередоваться как ABCABC…, создавая кубическую плотноупакованную (ccp) структуру (часть (b) на рис. 12.7). Поскольку структура ccp содержит гексагонально упакованные слои, она не выглядит особенно кубической. Однако, как показано в части (b) на рис. 12.7, простое вращение структуры показывает ее кубическую природу, которая идентична ГЦК-структуре. Структуры hcp и ccp отличаются только способом укладки их слоев. Обе структуры имеют общую эффективность упаковки 74%, и в обеих у каждого атома есть 12 ближайших соседей (6 в одной плоскости плюс по 3 в каждой из плоскостей непосредственно сверху и снизу).
12.7). . Если мы выберем второе расположение и будем повторять шаблон бесконечно, положения атомов будут чередоваться как ABCABC…, создавая кубическую плотноупакованную (ccp) структуру (часть (b) на рис. 12.7). Поскольку структура ccp содержит гексагонально упакованные слои, она не выглядит особенно кубической. Однако, как показано в части (b) на рис. 12.7, простое вращение структуры показывает ее кубическую природу, которая идентична ГЦК-структуре. Структуры hcp и ccp отличаются только способом укладки их слоев. Обе структуры имеют общую эффективность упаковки 74%, и в обеих у каждого атома есть 12 ближайших соседей (6 в одной плоскости плюс по 3 в каждой из плоскостей непосредственно сверху и снизу).
 12.4. Структура ПТК на (b) показана в разобранном виде, виде сбоку и в повернутом виде. Повернутый вид подчеркивает ГЦК-природу элементарной ячейки (обведено контуром). Линия, соединяющая атомы в первом и четвертом слоях структуры ccp, является диагональю тела куба. (CC BY-NC-SA; анонимно по запросу)
12.4. Структура ПТК на (b) показана в разобранном виде, виде сбоку и в повернутом виде. Повернутый вид подчеркивает ГЦК-природу элементарной ячейки (обведено контуром). Линия, соединяющая атомы в первом и четвертом слоях структуры ccp, является диагональю тела куба. (CC BY-NC-SA; анонимно по запросу) В таблице 12.1 сравниваются эффективность упаковки и количество ближайших соседей для различных кубических и плотноупакованных структур; число ближайших соседей называется координационным числом. Большинство металлов имеют ГПУ-, ПЦК- или ОЦК-структуры, хотя некоторые металлы имеют как ГПУ-, так и ПЦК-структуры в зависимости от температуры и давления.
Таблица 12.1: Свойства общих структур металлов
| Структура | Процент пространства, занимаемого атомами | Координационный номер |
|---|---|---|
| простой кубический | 52 | 6 |
| объемно-центрированный кубический | 68 | 8 |
| шестигранник, плотно упакованный | 74 | 12 |
| кубический, плотно упакованный (идентичный гранецентрированному кубическому) | 74 | 12 |
Резюме
Наименьшей повторяющейся единицей кристаллической решетки является элементарная ячейка. Простая кубическая элементарная ячейка содержит только восемь атомов, молекул или ионов в углах куба. Объемно-центрированная кубическая (ОЦК) элементарная ячейка содержит один дополнительный компонент в центре куба. Элементарная ячейка гранецентрированного куба (ГЦК) содержит компонент в центре каждой грани в дополнение к компонентам в углах куба. Простые кубические и ОЦК-устройства заполняют только 52% и 68% доступного пространства атомами соответственно. Гексагональная плотноупакованная (ГПУ) структура имеет повторяющееся расположение ABABAB…, а кубическая плотноупакованная (ccp) структура имеет повторяющийся узор ABCABC…; последняя идентична ГЦК-решетке. Компоновки ГПУ и ППУ заполняют 74% доступного пространства и имеют координационное число 12 для каждого атома в решетке, число ближайших соседей. Простая кубическая и ОЦК решетки имеют координационные числа 6 и 8 соответственно.
Простая кубическая элементарная ячейка содержит только восемь атомов, молекул или ионов в углах куба. Объемно-центрированная кубическая (ОЦК) элементарная ячейка содержит один дополнительный компонент в центре куба. Элементарная ячейка гранецентрированного куба (ГЦК) содержит компонент в центре каждой грани в дополнение к компонентам в углах куба. Простые кубические и ОЦК-устройства заполняют только 52% и 68% доступного пространства атомами соответственно. Гексагональная плотноупакованная (ГПУ) структура имеет повторяющееся расположение ABABAB…, а кубическая плотноупакованная (ccp) структура имеет повторяющийся узор ABCABC…; последняя идентична ГЦК-решетке. Компоновки ГПУ и ППУ заполняют 74% доступного пространства и имеют координационное число 12 для каждого атома в решетке, число ближайших соседей. Простая кубическая и ОЦК решетки имеют координационные числа 6 и 8 соответственно.
Key Takeaway
Кристаллическое твердое тело может быть представлено его элементарной ячейкой, которая является наименьшей идентичной единицей, которая, будучи сложена вместе, образует характерную трехмерную структуру.
Концептуальные задачи
1. Почему правильно представлять структуру кристаллического твердого тела структурой его элементарной ячейки? Каковы наиболее важные ограничения при выборе элементарной ячейки?
2. Все структуры элементарных ячеек имеют шесть сторон. Могут ли кристаллы твердого тела иметь более шести сторон? Поясните свой ответ.
3. Объясните, как интенсивные свойства материала отражаются в элементарной ячейке. Все ли свойства сыпучего материала такие же, как у его элементарной ячейки? Поясните свой ответ.
4. Экспериментально измеренная плотность сыпучего материала несколько выше ожидаемой, исходя из структуры чистого материала. Предложите два объяснения этому наблюдению.
5. Экспериментально определенная плотность материала ниже ожидаемой, исходя из расположения атомов в элементарной ячейке, формулы массы и размера атомов. Какие выводы вы можете сделать о материале?
6. Только один элемент (полоний) кристаллизуется с простой кубической элементарной ячейкой.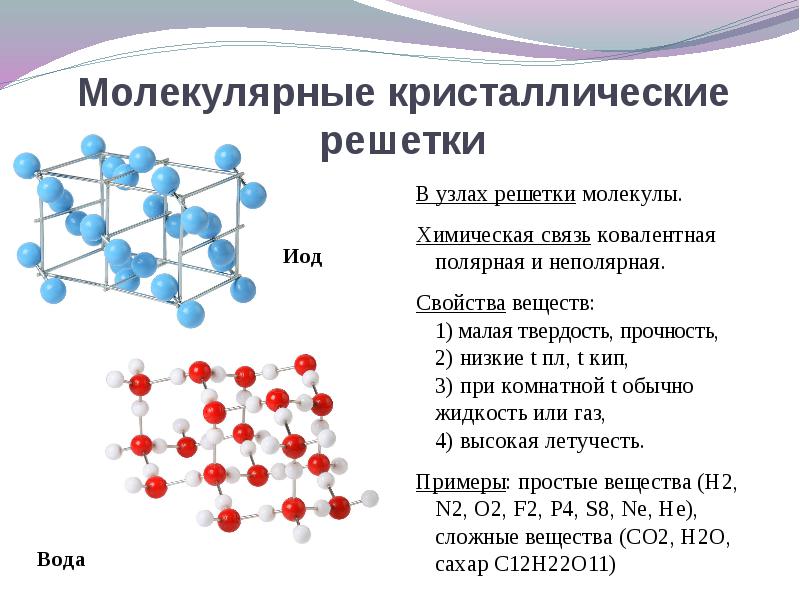 Почему полоний — единственный пример элемента с такой структурой?
Почему полоний — единственный пример элемента с такой структурой?
7. Что понимают под координационным числом в структуре твердого тела? Как зависит координационное число от строения металла?
8. Расположите три типа элементарных кубических ячеек в порядке увеличения эффективности упаковки. В чем разница в эффективности упаковки между структурой hcp и структурой ccp?
9. Структура многих металлов зависит от давления и температуры. Какая структура — ОЦК или ГПУ — более вероятна в данном металле при очень высоких давлениях? Объясните свои рассуждения.
10. Металл имеет две кристаллические фазы. Температура перехода, температура перехода одной фазы в другую, составляет 95°С при 1 атм и 135°С при 1000 атм. Нарисуйте фазовую диаграмму этого вещества. Известно, что металл имеет либо структуру ccp, либо простую кубическую структуру. Надлежащим образом обозначьте области на диаграмме и обоснуйте свой выбор структуры каждой фазы.
Численные задачи
1. Металлический родий имеет ГЦК элементарную ячейку. Сколько атомов родия содержит каждая элементарная ячейка?
Металлический родий имеет ГЦК элементарную ячейку. Сколько атомов родия содержит каждая элементарная ячейка?
2. Хром имеет структуру с двумя атомами на элементарную ячейку. Является ли структура этого металла простой кубической, ОЦК, ГЦК или ГПУ?
3. Плотность никеля 8,908 г/см 3 . Если металлический радиус никеля равен 125 пм, какова структура металлического никеля?
4. Плотность вольфрама 19,3 г/см 3 . Если металлический радиус вольфрама равен 139пм, какова структура металлического вольфрама?
5. Элемент имеет плотность 10,25 г/см 3 и металлический радиус 136,3 пм. Металл кристаллизуется в ОЦК решетке. Определите элемент.
6. Образец нереакционноспособного металла массой 21,64 г помещают в колбу, содержащую 12,00 мл воды; конечный объем 13,81 мл. Если длина ребра элементарной ячейки составляет 387 мкм, а металлический радиус равен 137 мкм, определите расположение упаковки и идентифицируйте элемент.
7. Образец щелочного металла с элементарной ячейкой ОЦК имеет массу 1,000 г и объем 1,0298 см 3 . Когда металл реагирует с избытком воды, в результате реакции образуется 539,29 мл газообразного водорода при 0,980 атм и 23°C. Определите металл, определите размеры элементарной ячейки и дайте примерный размер атома в пикометрах.
Образец щелочного металла с элементарной ячейкой ОЦК имеет массу 1,000 г и объем 1,0298 см 3 . Когда металл реагирует с избытком воды, в результате реакции образуется 539,29 мл газообразного водорода при 0,980 атм и 23°C. Определите металл, определите размеры элементарной ячейки и дайте примерный размер атома в пикометрах.
8. Образец щелочноземельного металла с элементарной ячейкой ОЦК имеет массу 5,000 г и объем 1,392 см 9 .0168 3 . Для полной реакции с газообразным хлором требуется 848,3 мл газообразного хлора при 1050 атм и 25°C. Определите металл, определите размеры элементарной ячейки и дайте примерный размер атома в пикометрах.
9. Литий кристаллизуется в ОЦК структуре с длиной ребра 3,509 Å. Вычислите его плотность. Каков приблизительный металлический радиус лития в пикометрах?
10. Ванадий используется в производстве коррозионностойкой ванадиевой стали. Образует ОЦК кристаллы плотностью 6,11 г/см 3 при 18,7°С. Какова длина ребра элементарной ячейки? Каков приблизительный металлический радиус ванадия в пикометрах?
11. Простая кубическая ячейка содержит один атом металла с металлическим радиусом 100 пм.
Простая кубическая ячейка содержит один атом металла с металлическим радиусом 100 пм.
а. Определить объем атома(ов), содержащегося в одной элементарной ячейке [объем сферы = (\({4 \over 3} \))πr 3 ].
б. Какова длина одного ребра элементарной ячейки? (Подсказка: между атомами нет пустого пространства.)
с. Вычислите объем элементарной ячейки.
д. Определить эффективность упаковки для этой структуры.
эл. Используйте шаги задачи 11, чтобы вычислить эффективность упаковки для элементарной ячейки ОЦК с металлическим радиусом 1,00 Å.
Численные ответы
1. четыре
3. ГЦК
5. молибден
7. натрий, край элементарной ячейки = 428 пм, r = 185 пм
9. d = 0,5335 г/см 3 , г = 151,9 пм
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу TOC
- № на стр.

- Теги
Определение кристаллической решетки — Химический словарь
Что такое решетка?
Решетка — это упорядоченный набор точек, описывающих расположение частиц, образующих кристалл.
Элементарная ячейка кристалла определяется точками решетки. Элементарная ячейка — это наименьшая часть кристалла, которая регулярно повторяется посредством переноса в трех измерениях, создавая весь кристалл.
Например, показанное здесь изображение представляет собой элементарную ячейку примитивной кубической структуры.
В нарисованной структуре все частицы (желтые) одинаковы. В этом частном случае точки решетки, определяющие элементарную ячейку, совпадают с центрами частиц кристалла. Это не всегда так.
Ионная решетка
Если кристалл образован ионами, соединение можно описать как ионную решетку.
Хорошо известными примерами ионных решеток являются хлорид натрия, перманганат калия, бура (борат натрия) и сульфат меди (II).
Кристаллы перманганата калия. Изображение Бена Миллса.
Элементарная ячейка перманганата калия. Изображение Бена Миллса.
Ковалентная решетка
Если кристалл состоит из ковалентно связанных атомов, его можно описать как ковалентную решетку или бесконечную ковалентную решетку.
Хорошо известными примерами ковалентных решеток являются алмаз, кварц (диоксид кремния), кремний и серое олово.
Кремний кристаллический. Изображение Энрикороса.
Небольшой фрагмент кристаллической структуры кремния.
Постоянные решетки
Постоянные решетки (или параметры решетки) — это длины и углы между ребрами элементарной ячейки.
На этой диаграмме решетки в виде параллелепипеда постоянными решетки являются a, b и c (длины) и α, β и γ (углы).
Решетчатые конструкции
Решетки Браве.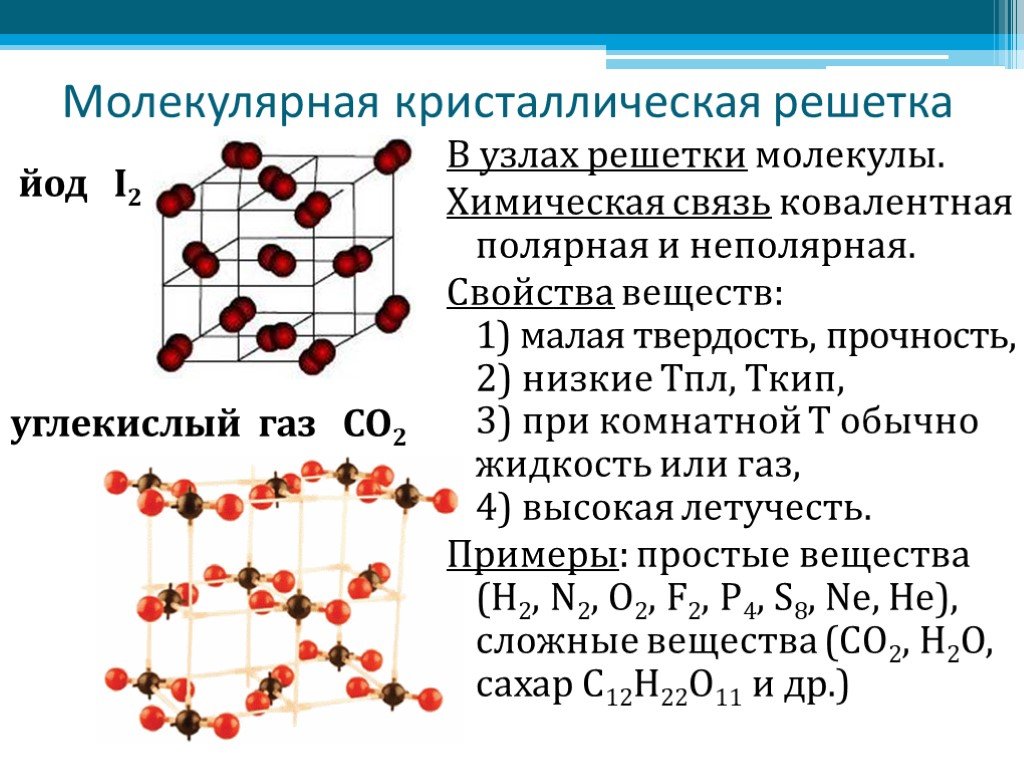 На основе изображения Napy1 Kenobi.
На основе изображения Napy1 Kenobi.
Кристаллические материалы вписываются в одну из четырнадцати известных структур решетки. Они известны как решетки Браве .
Названия систем кристаллических решеток, соответствующие номерам на схемах, следующие:
1. Примитивная кубическая
2. Объемноцентрированная кубическая
3. Гранецентрированная кубическая
4. Примитивная тетрагональная
5. Объемноцентрированная тетрагональная
6. Примитивная ромбическая
7. Орторомбическая с центром в основании
8. Орторомбическая с центром в теле
9. Ромбическая с центром в центре
10. Моноклинная примитивная
11. Моноклинная с центром в основании
12. Триклинная
13. Ромбическая боэдральный
14. Шестиугольный
Дефекты решетки
Если предположить, что кристалл основан на математически совершенной ионной решетке, его расчетная прочность на разрыв была бы намного больше, чем фактически наблюдаемая.

 12.5, определите положения атомов Au в гранецентрированной кубической элементарной ячейке, а затем определите вклад каждого атома Au в элементарную ячейку. Сложите вклады всех атомов Au, чтобы получить общее количество атомов Au в элементарной ячейке.
12.5, определите положения атомов Au в гранецентрированной кубической элементарной ячейке, а затем определите вклад каждого атома Au в элементарную ячейку. Сложите вклады всех атомов Au, чтобы получить общее количество атомов Au в элементарной ячейке. 12.5). Сколько атомов железа содержится в каждой элементарной ячейке?
12.5). Сколько атомов железа содержится в каждой элементарной ячейке?
 12.5) с длиной ребра 407,8 пм.
12.5) с длиной ребра 407,8 пм.
Leave A Comment