Лучший ответ по мнению автора
| ||||||||||||||||
Другие ответы
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Высота правильной треугольной пирамиды равна a корень из 3
,
радиус окружности, описанной около е основания, 2a.
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
3. Сокращенное ионное уравнение реакции: Ca2+ + CO32- → CaCO3↓ соответствует взаимодействию 1) нитрата кальция и карбоната натрия 2) нитрат кальция и карбонат бария 3) оксид кальция и оксид углерода 4
В каком году была сформулирована теория — предшественница кислородной теории горения.
Структурная формула всех изомеров С7Н16
Пользуйтесь нашим приложением
18. В реакциях бензоат–ион проявляет свойства: эффективного лиганда
1. Установите соответствие между анионом и реагентом, при помощи которого он может быть обнаружен
2. Белый осадок цитрата кальция –
растворяется в воде, а при кипячении растворимость уменьшается
3. Цвет продукта взаимодействия ионов
NO3– с дифениламином:
Цвет продукта взаимодействия ионов
NO3– с дифениламином:
синий, постепенно переходящий в бурый, а затем – в в желтый
4.Какие и приведенных ниже пар анионов не могут одновременно находиться в водном растворе при рН<5?
1) NO2– и
3) NO2– и AsO33–
5. Взаимодействию ионов S2O32– с раствором CuSO4 соответствуют уравнения:
Cu2S2O3 + h3O → Cu2S(черный) + h3SО4 и 2 Cu2+ + 3 S2O32– → Cu2S2O3 + S4O62–
6. В реакциях бензоат–ион проявляет свойства: эффективного лиганда
7. Осадку, образующемуся в фармакопейной реакции при обнаружении тартрат-ионов хлоридом калия, отвечает формула: KHC4h5O6
8. При постепенном прибавлении к раствору, содержащему ионы I–, хлорной воды и органического растворителя, не смешивающегося с водой, происходят следующие процессы:
сначала органический слой становится фиолетовым, а затем снова обесцвечивается
9. Белый
мелкокристаллический осадок BaSO4 частично
растворяется в конц. h3SO4 с образованием:
Белый
мелкокристаллический осадок BaSO4 частично
растворяется в конц. h3SO4 с образованием:
Ba(HSO4)2
10. Аналитическим реагентом на тартрат-ионы является: раствор аммиачного комплекса серебра
11. Цвет продукта взаимодействия ионов NO2– с реактивом Грисса-Илошвая: красный
12. Фармакопейной при обнаружении ионов СO32– является реакция:
13. Характерным аналитическим признаком фармакопейной реакции между ионами СН3СОО– с этанолом является: появление характерного запаха этилацетата
14. Очень токсичный сероводород можно обнаружить: почернением «свинцовой бумаги» – фильтровальной бумаги, пропитанной Pb(Ch4COO)2
15. Сильные окислители, такие как KMnO4 в кислой среде, PbO2 и др., окисляют хлорид-ионы до:
молекулярного Cl2
16. Фармакопейной при обнаружении цитрат–ионов является реакция: с уксусным ангидридом
17. Белый творожистый осадок АgCl растворяется в растворе Nh4
19. Черный осадок Ag2S – растворяется
в растворе азотной кислоты при нагревании
Черный осадок Ag2S – растворяется
в растворе азотной кислоты при нагревании
20. Какие из приведенных ниже анионов не могут находиться в водном растворе при рН<2?
Салицилат-ионы NO2–
21. Соотнесите значения констант нестойкости комплексных ионов с молярными концентрациями ионов металлов в растворах комплексных солей равных концентраций
22. Установите соответствие между анионом и реагентом, при помощи которого он может быть обнаружен.
23. При взаимодействии ионов NO3– с FeSO4 при нагревании в присутствии конц h3SO4 образуется:
[Fe(NO)]SO4
24. Бледно-желтый осадок AgBrO3 – растворяется в растворе Nh4
25. Ионы AsO43– от ионов AsO33– можно отличить реакцией: с магнезиальной смесью
26. Определите возможность самопроизвольного протекания реакции
KMnO4
+ 5FeCl2 + 8HCl → KСl +MnCl2 +5FeCl3 +4h3O в стандартных
условиях, если E0(Fe3+/Fe2+)=0.77 В и E0(MnO4–,
8H+/Mn2+)=1.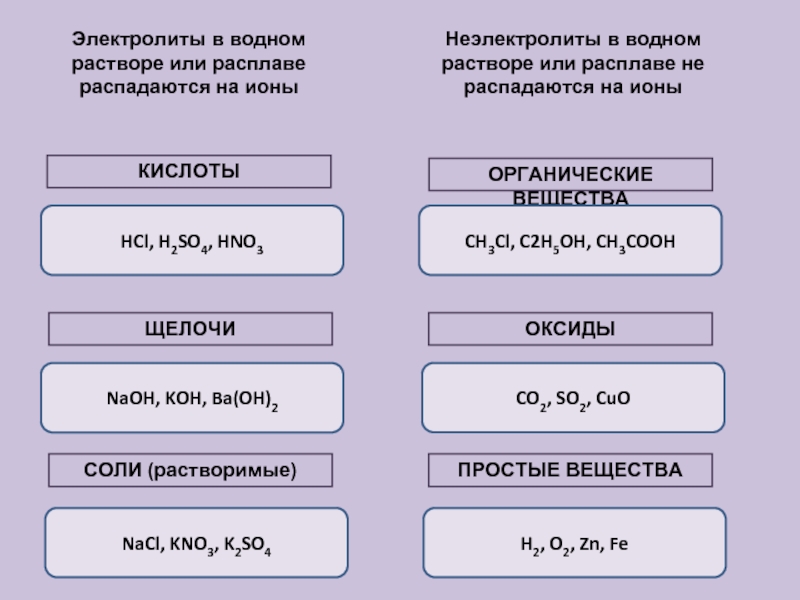 51 В возможна
51 В возможна
27. Характерным аналитическим признаком при действии на ионы S2O32– минеральных кислот является: выделение газообразного SO2 и помутнение раствора из-за выделения серы
28. Определите возможность самопроизвольного протекания реакции
SnCl4 + 2KI→ SnCl2 +I2 +2KCl в стандартных условиях, если E0(Sn4+/Sn2+)= +0.150 В и E0 (I2/2I–) = +0.536 невозможна
29. Установите соответствие между анионом и реагентом, при помощи которого он может быть обнаружен.
30. Аналитическим признаком фармакопейной реакции на тартрат–ионы с FeSO4 и h3O2 является:
образование комплекса желтого цвета, который при добавлении NaOH переходит в комплекс голубого цвета
31. Установите соответствие между анионом и реагентом
32. В реакциях цитрат-ионы проявляют свойства: эффективного лиганда
33.Фармакопейной при обнаружении цитрат–ионов является реакция: с водным раствором CaCl2
34. Какие и приведенных ниже пар анионов не могут одновременно находиться в водном растворе при рН<5? S2O32– и MnO4– ; S2O32– и AsO43–
35.
 Ионы AsO43– от ионов AsO33– можно отличить реакцией: с магнезиальной смесью
Ионы AsO43– от ионов AsO33– можно отличить реакцией: с магнезиальной смесью36. Бледно-желтый осадок AgBrO3- растворяется в разбавленных азотной и серной кислотах
37.Фармакопейной при обнаружении ионов Br– является реакция: с раствором AgNO3
38. Белый студенистый осадок BaF2 растворяется при нагревании в соляной и азотной кислотах
39.Ионы I- проявляют свойства — лиганда-комплексообразователя
40. Характерным аналитическим признаком реакции взаимодействия ионов SO3 2- c AgNO3 является:
образование белого осадка Ag2SO3
41.Аморфный, шоколадного цвета осадок Ag3AsO4- растворяется в конц. растворе аммиака
42. Белый осадок BaC2O4- растворяется в минеральных кислотах и в горячей уксусной кислоте
43. С помощью каких реагентов можно обнаружить ионы NO2 — в присутствии ионов NO3 -:
реактивом Грисса-Илошвая
44. Белый мелкокристаллический осадок KHC4h5O6: растворяется в минеральных кислотах и щелочах
45. Белый творожистый осадок AgCl —растворяется
в растворе Na2S2O3
Белый творожистый осадок AgCl —растворяется
в растворе Na2S2O3
46. Ионы NO2 — можно удалить из водных раствором действием: солей аммония 47. Характерным аналитическим признаком фармакопейной реакции между ионами Ch4COO- и ионами Fe3+ является: появление темно-красной окраски
48. Открытию ионов РО43– фармакопейной реакцией с молибдатом аммония (Nh5)2MoO4 мешают:
ионы AsO43–
49. Какие из приведенных ниже анионов не могут находиться в водном растворе при pH<2 —
бензоат -ионы, S2-
50. Групповые реагенты на ионы-восстановители: раствор I2 в KI,раствор KMnO4в сернокислой среде
7.5: Водные растворы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 58821
Результаты обучения
- Дайте определение решения и опишите части решения.

- Опишите, как образуется водный раствор из ионных соединений и молекулярных соединений.
- Знайте, что некоторые соединения нерастворимы в воде.
- Опишите различия между сильными электролитами, слабыми электролитами и неэлектролитами.
Формирование раствора
Когда одно вещество растворяется в другом, образуется раствор. Раствор представляет собой гомогенную смесь, состоящую из растворенного вещества, растворенного в растворителе. растворенное вещество представляет собой растворяемое вещество, а растворитель является растворяющей средой . Растворы могут быть образованы со многими различными типами и формами растворенных веществ и растворителей. В этой главе мы сосредоточимся на растворе, в котором растворителем является вода. Водный раствор — это вода, содержащая одно или несколько растворенных веществ. Растворенные вещества в водном растворе могут быть твердыми веществами, газами или другими жидкостями.
Чтобы раствор был верным, смесь должна быть стабильной. Когда сахар полностью растворится в воде, он может стоять неопределенное время, и сахар не осядет из раствора. Далее, если водно-сахарный раствор пропустить через фильтр, он останется с водой. Это связано с тем, что растворенные в растворе частицы очень малы, обычно меньше \(1 \: \text{нм}\) в диаметре. Частицы растворенного вещества могут быть атомами, ионами или молекулами, в зависимости от типа растворенного вещества.
Рисунок \(\PageIndex{1}\): Когда окрашенный раствор пропускают через фильтр, весь раствор, как растворенное вещество, так и растворитель, проходит без изменений.Процесс растворения
Вода обычно растворяет большинство ионных соединений и полярных молекул. Неполярные молекулы, такие как те, что содержатся в смазке или масле, не растворяются в воде. Сначала мы рассмотрим процесс, происходящий при растворении в воде ионного соединения, такого как поваренная соль (хлорид натрия).
Молекулы воды непрерывно движутся благодаря своей кинетической энергии. Когда кристалл хлорида натрия помещают в воду, молекулы воды сталкиваются с кристаллической решеткой. Напомним, что кристаллическая решетка состоит из чередующихся положительных и отрицательных ионов. Вода притягивается к кристаллу хлорида натрия, потому что вода полярна; она имеет как положительный, так и отрицательный конец. Положительно заряженные ионы натрия в кристалле притягивают кислородный конец молекул воды, потому что они частично отрицательны. Отрицательно заряженные ионы хлора в кристалле притягивают водородные концы молекул воды, потому что они частично положительны. Действие полярных молекул воды разрушает кристаллическую решетку (см. рисунок ниже). 9+}\) ионы окружены молекулами воды с атомом кислорода, ориентированным вблизи положительного иона. Точно так же ионы хлорида окружены молекулами воды с противоположной ориентацией. Гидратация — это процесс окружения частиц растворенного вещества молекулами воды, расположенными определенным образом .
Когда кристалл хлорида натрия помещают в воду, молекулы воды сталкиваются с кристаллической решеткой. Напомним, что кристаллическая решетка состоит из чередующихся положительных и отрицательных ионов. Вода притягивается к кристаллу хлорида натрия, потому что вода полярна; она имеет как положительный, так и отрицательный конец. Положительно заряженные ионы натрия в кристалле притягивают кислородный конец молекул воды, потому что они частично отрицательны. Отрицательно заряженные ионы хлора в кристалле притягивают водородные концы молекул воды, потому что они частично положительны. Действие полярных молекул воды разрушает кристаллическую решетку (см. рисунок ниже). 9+}\) ионы окружены молекулами воды с атомом кислорода, ориентированным вблизи положительного иона. Точно так же ионы хлорида окружены молекулами воды с противоположной ориентацией. Гидратация — это процесс окружения частиц растворенного вещества молекулами воды, расположенными определенным образом . Гидратация помогает стабилизировать водные растворы, предотвращая повторное соединение положительных и отрицательных ионов и образование осадка.
Гидратация помогает стабилизировать водные растворы, предотвращая повторное соединение положительных и отрицательных ионов и образование осадка.
Столовый сахар изготовлен из молекулярного соединения сахарозы \(\left( \ce{C_{12}H_{22}O_{11}} \right)\). Твердый сахар состоит из отдельных молекул сахара, удерживаемых вместе силами межмолекулярного притяжения. Когда вода растворяет сахар, она разделяет отдельные молекулы сахара, разрушая силы притяжения, но не не разрывает ковалентные связи между атомами углерода, водорода и кислорода. Молекулы растворенного сахара также гидратируются. Гидратная оболочка вокруг молекулы сахарозы устроена так, что ее частично отрицательные атомы кислорода находятся рядом с частично положительными атомами водорода в растворителе, и наоборот.
Нерастворимые соединения
Не все соединения хорошо растворяются в воде. Некоторые ионные соединения, такие как карбонат кальция \(\left( \ce{CaCO_3} \right)\) и хлорид серебра \(\left( \ce{AgCl} \right)\), практически нерастворимы. Это связано с тем, что притяжение между ионами в кристаллической решетке сильнее, чем притяжение молекул воды к ионам. В результате кристалл остается целым. Растворимость ионных соединений можно предсказать, используя правила растворимости, как показано в таблице \(\PageIndex{1}\).
Это связано с тем, что притяжение между ионами в кристаллической решетке сильнее, чем притяжение молекул воды к ионам. В результате кристалл остается целым. Растворимость ионных соединений можно предсказать, используя правила растворимости, как показано в таблице \(\PageIndex{1}\).
Таблица \(\PageIndex{1}\): Правила растворимости ионных соединений в воде.
Неполярные соединения также не растворяются в воде. Силы притяжения, действующие между частицами в неполярном соединении, представляют собой слабые дисперсионные силы. Чтобы неполярная молекула растворилась в воде, ей необходимо разрушить некоторые водородные связи между соседними молекулами воды. В случае ионного вещества эти благоприятные взаимодействия заменяются другими взаимодействиями притяжения между ионами и частичными зарядами воды. Однако взаимодействия неполярных молекул с водой менее благоприятны, чем взаимодействия воды с самой собой. Когда неполярная жидкость, такая как масло, смешивается с водой, образуются два отдельных слоя, поскольку жидкости не растворяются друг в друге (см. рисунок ниже). Когда полярная жидкость, такая как этанол, смешивается с водой, они полностью смешиваются и растворяются друг в друге. Жидкости, которые растворяются друг в друге во всех соотношениях, называются смешивающимися . Жидкости, которые не растворяются одна в другой, называются несмешивающимися . Общее правило для принятия решения о том, способно ли одно вещество растворять другое, звучит так: «подобное растворяется в подобном», где сравниваемым свойством является общая полярность вещества. Например, неполярное твердое вещество, такое как йод, растворяется в неполярной жидкости для зажигалок, но не растворяется в полярной воде.
рисунок ниже). Когда полярная жидкость, такая как этанол, смешивается с водой, они полностью смешиваются и растворяются друг в друге. Жидкости, которые растворяются друг в друге во всех соотношениях, называются смешивающимися . Жидкости, которые не растворяются одна в другой, называются несмешивающимися . Общее правило для принятия решения о том, способно ли одно вещество растворять другое, звучит так: «подобное растворяется в подобном», где сравниваемым свойством является общая полярность вещества. Например, неполярное твердое вещество, такое как йод, растворяется в неполярной жидкости для зажигалок, но не растворяется в полярной воде.
Электролиты и неэлектролиты
Электролит представляет собой соединение, которое проводит электрический ток, когда оно растворено в воде или расплавлено. Для того чтобы проводить ток, вещество должно содержать подвижные ионы, способные перемещаться от одного электрода к другому. Все ионные соединения являются электролитами. Когда ионные соединения растворяются, они распадаются на ионы, которые затем могут проводить ток. Даже нерастворимые ионные соединения, такие как \(\ce{CaCO_3}\), считаются электролитами, поскольку они могут проводить ток в расплавленном (расплавленном) состоянии.
Для того чтобы проводить ток, вещество должно содержать подвижные ионы, способные перемещаться от одного электрода к другому. Все ионные соединения являются электролитами. Когда ионные соединения растворяются, они распадаются на ионы, которые затем могут проводить ток. Даже нерастворимые ионные соединения, такие как \(\ce{CaCO_3}\), считаются электролитами, поскольку они могут проводить ток в расплавленном (расплавленном) состоянии.
Неэлектролит представляет собой соединение, которое не проводит электрический ток ни в водном растворе, ни в расплавленном состоянии. Многие молекулярные соединения, такие как сахар или этанол, являются неэлектролитами. Когда эти соединения растворяются в воде, они не образуют ионов. Ниже показано различие между электролитом и неэлектролитом.
Диссоциация
Ранее вы видели, как распадается ионная кристаллическая решетка при растворении в воде. Диссоциация — это разделение ионов, происходящее при растворении твердого ионного соединения . Просто отмените метод крест-накрест, который вы изучили при написании химических формул для ионных соединений, и у вас останутся компоненты уравнения ионной диссоциации. Нижние индексы для ионов в химических формулах становятся коэффициентами соответствующих ионов на стороне произведения уравнений. Ниже показаны уравнения диссоциации для \(\ce{NaCl}\), \(\ce{Ca(NO_3)_2}\) и \(\ce{(NH_4)_3PO_4}\). 9{3-}} \left( aq \right) \end{align}\]
Диссоциация — это разделение ионов, происходящее при растворении твердого ионного соединения . Просто отмените метод крест-накрест, который вы изучили при написании химических формул для ионных соединений, и у вас останутся компоненты уравнения ионной диссоциации. Нижние индексы для ионов в химических формулах становятся коэффициентами соответствующих ионов на стороне произведения уравнений. Ниже показаны уравнения диссоциации для \(\ce{NaCl}\), \(\ce{Ca(NO_3)_2}\) и \(\ce{(NH_4)_3PO_4}\). 9{3-}} \left( aq \right) \end{align}\]
Одна формульная единица хлорида натрия диссоциирует на один ион натрия и один ион хлорида. Формульная единица нитрата кальция диссоциирует на один ион кальция и два иона нитрата, потому что заряд \(2+\) каждого иона кальция требует двух ионов нитрата (каждый с зарядом \(1-\)) для образования электрически нейтрального сложный. Формульная единица фосфата аммония диссоциирует на три иона аммония и один ион фосфата.
Не путайте нижние индексы атомов внутри многоатомного иона с нижними индексами, полученными в результате пересечения зарядов, которые делают исходное соединение нейтральным.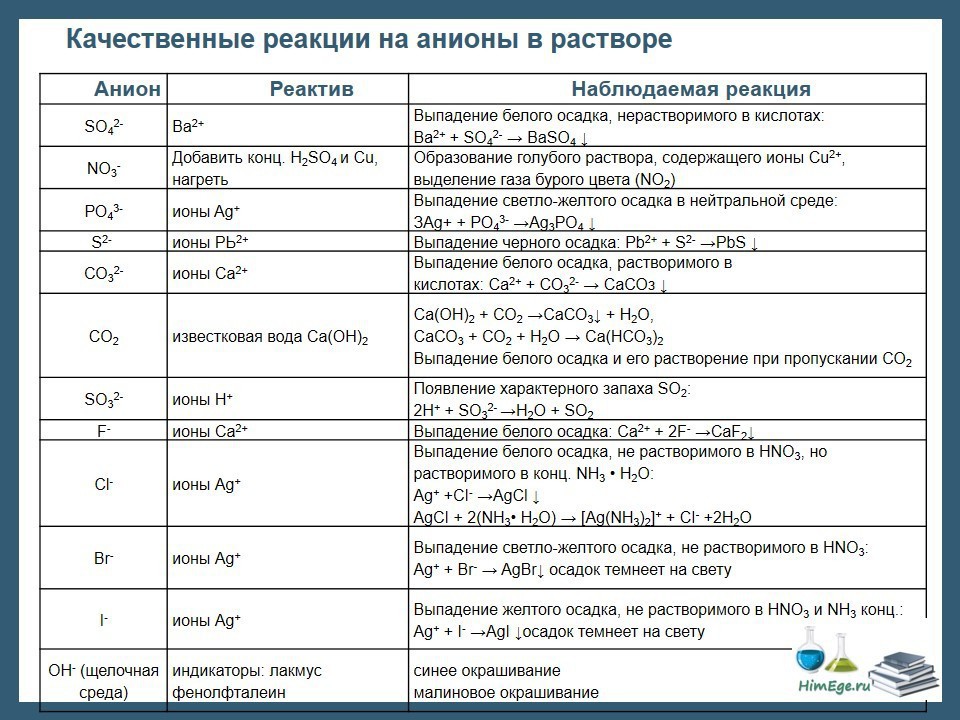 Нижний индекс 3 у нитрат-иона и индекс 4 у иона аммония являются частью многоатомного иона и остаются частью ионной формулы после диссоциации соединения. Обратите внимание, что соединения представляют собой твердые вещества \(\left( s \right)\), которые при растворении в воде превращаются в ионы, образуя водный раствор \(\left( aq \right)\).
Нижний индекс 3 у нитрат-иона и индекс 4 у иона аммония являются частью многоатомного иона и остаются частью ионной формулы после диссоциации соединения. Обратите внимание, что соединения представляют собой твердые вещества \(\left( s \right)\), которые при растворении в воде превращаются в ионы, образуя водный раствор \(\left( aq \right)\).
Неэлектролиты не диссоциируют при образовании водного раствора. Все еще можно написать уравнение, которое просто показывает, что твердое тело переходит в раствор. Например, процесс растворения сахарозы в воде можно записать следующим образом:
\[\ce{C_{12}H_{22}O_{11}} \left( s \right) \rightarrow \ce{C_{ 12}H_{22}O_{11}} \left( aq \right)\]
Сильные и слабые электролиты
Некоторые полярные молекулярные соединения являются неэлектролитами в чистом виде, но становятся электролитами при растворении в воде. -} \left( aq \right)\]
-} \left( aq \right)\]
Когда \(\ce{HCl}\) растворяется в воде, это называется соляной кислотой. Ионные соединения и некоторые полярные соединения полностью распадаются на ионы и поэтому очень хорошо проводят ток. Сильный электролит представляет собой раствор, в котором почти все растворенное вещество существует в виде ионов .
Некоторые другие полярные молекулярные соединения становятся электролитами при растворении в воде, но не ионизируются в очень большой степени. Например, азотистая кислота \(\left( \ce{HNO_2} \right)\) лишь частично ионизируется в ионы водорода и ионы нитрита при растворении в воде. Водная азотистая кислота состоит всего из примерно \(5\%\) ионов и \(9-} \left( aq \right)\]
Авторы и авторство
Эта страница под названием 7.5: Водные растворы распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- водный раствор
- несмешивающийся
- раствор
Ион гидроксония — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1290
- Стивен Лоуэр и Авнит Кахлон
- Университет Саймона Фрейзера
Из-за подавляющего избытка молекул \(\ce{h3O}\) в водных растворах голый ион водорода не имеет шансов выжить в воде. {+}}\). Он также может быть образован комбинацией H 9{+}}\). Обратимая реакция – это реакция, при которой реакция идет в обоих направлениях. Другими словами, молекулы воды диссоциируют, а ионы ОН — объединяются с ионами Н + , образуя воду. Вода обладает способностью притягивать ионы H + , потому что это полярная молекула. Это означает, что он имеет частичный заряд, в данном случае заряд отрицательный. Частичный заряд обусловлен тем, что кислород более электроотрицательный, чем водород. Это означает, что в связи между водородом и кислородом кислород сильнее «притягивает» общие электроны, тем самым вызывая частичный отрицательный заряд молекулы и заставляя ее притягиваться к положительному заряду H + с образованием гидроксония . Другой способ объяснить, почему молекула воды считается полярной, — это понятие дипольного момента. Электронная геометрия воды тетраэдрическая, а молекулярная геометрия изогнутая. Эта изогнутая геометрия является асимметричной, что делает молекулу полярной и имеет дипольный момент, что приводит к частичному заряду.
{+}}\). Он также может быть образован комбинацией H 9{+}}\). Обратимая реакция – это реакция, при которой реакция идет в обоих направлениях. Другими словами, молекулы воды диссоциируют, а ионы ОН — объединяются с ионами Н + , образуя воду. Вода обладает способностью притягивать ионы H + , потому что это полярная молекула. Это означает, что он имеет частичный заряд, в данном случае заряд отрицательный. Частичный заряд обусловлен тем, что кислород более электроотрицательный, чем водород. Это означает, что в связи между водородом и кислородом кислород сильнее «притягивает» общие электроны, тем самым вызывая частичный отрицательный заряд молекулы и заставляя ее притягиваться к положительному заряду H + с образованием гидроксония . Другой способ объяснить, почему молекула воды считается полярной, — это понятие дипольного момента. Электронная геометрия воды тетраэдрическая, а молекулярная геометрия изогнутая. Эта изогнутая геометрия является асимметричной, что делает молекулу полярной и имеет дипольный момент, что приводит к частичному заряду. -\), которые диссоциируют от оснований. Эти ионы связываются с H 9{-pH} \]
-\), которые диссоциируют от оснований. Эти ионы связываются с H 9{-pH} \]
Когда в это уравнение подставляется pH 7, мы получаем концентрацию 0,0000001 М, как и должно быть.
Обучение использованию математических формул для расчета кислотности и основности растворов может быть затруднено. Вот видеоруководство по расчету концентрации ионов гидроксония:
Конфигурация гидроксония в воде
Считается, что в среднем каждый ион гидроксония притягивается к шести молекулам воды, которые не притягиваются никаким другим гидроксонием. ионы. Эта тема все еще находится в стадии обсуждения, и реального ответа не найдено.
Проблемы
- Определение pH раствора с концентрацией гидроксония 2,6×10 -4 M.
- Определите концентрацию гидроксония в растворе с pH 1,7.
- Если раствор имеет концентрацию гидроксония 3,6×10 -8 М, будет ли этот раствор щелочным или кислым?
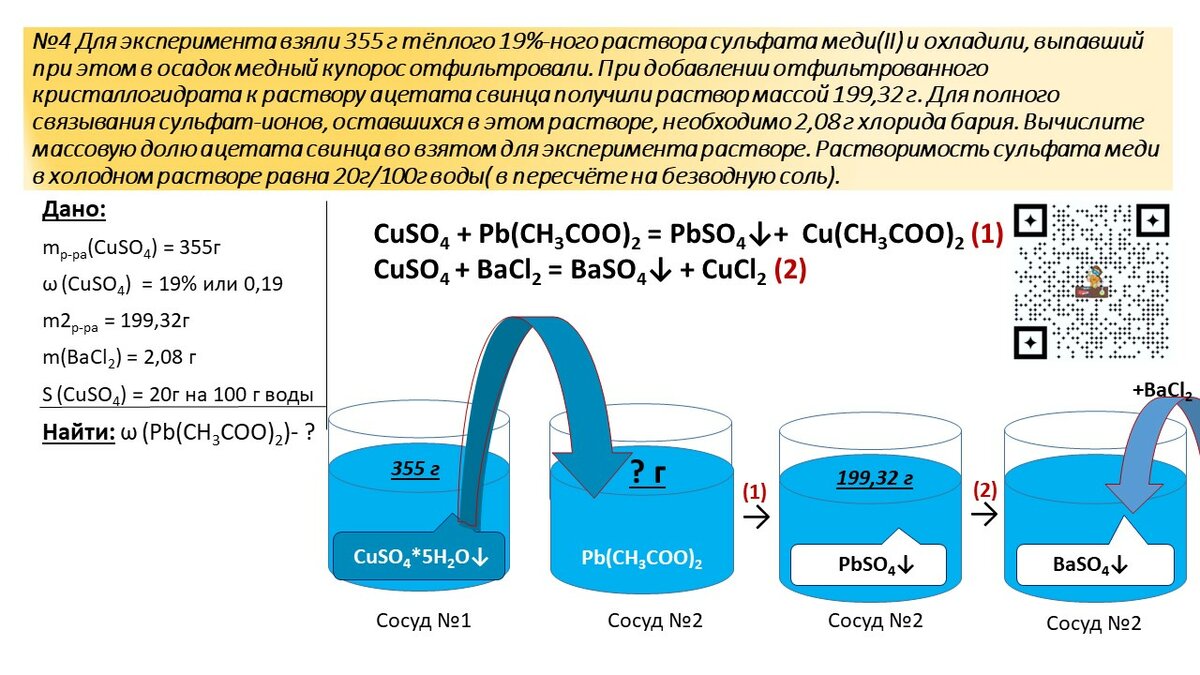
- Каково значение pH раствора, содержащего 12,2 г соляной кислоты в 500 мл воды?
- Почему кислоты вызывают ожоги? 9{-4}\;M]\)
При вводе в калькулятор: pH = 3,6
2.
 -_{(водн.)} \] 9{+}}\) получается из-за того, что все стехиометрические коэффициенты равны единице.
-_{(водн.)} \] 9{+}}\) получается из-за того, что все стехиометрические коэффициенты равны единице.Итак, если мы можем определить концентрацию HCl, мы можем определить концентрацию гидроксония.
Обратите внимание, что количество выданной нам HCl указано в граммах. Это нужно изменить на моли, чтобы найти концентрацию:
\[12,2\;г\; HCl \times \dfrac{1 \;моль\; HCl}{36,457\; г} = 0,335\; моль\; HCl\]
Концентрация определяется в молях на литр, поэтому мы переводим 500 мл воды в литры и получаем 0,5 литра.
\[\dfrac{0,335\; моль\; HCl}{0,5\; L} = 0,67\;M\]
Используя эту концентрацию, мы можем получить pH: pH = -log[0,67M]
\[pH = 0,17\]
5. Кислоты вызывают ожоги, потому что обезвоживают клетки, которыми они являются. подвергать. Это вызвано диссоциацией, происходящей в кислотах, где образуются ионы Н + . Эти ионы H + связываются с водой в клетке и, таким образом, обезвоживают их, вызывая повреждение клеток и ожоги.

Ссылки
- Петруччи, Харвуд, Херринг, Мадура. Общие принципы химии и современные приложения. Прентис Холл. Нью-Джерси, 2007.
- Маркс, Такерман, Хаттер, Дж. и Парринелло, М. (1999) Природа гидратированного избыточного протона в воде
- Петруччи, Ральф Х. Общая химия: принципы и современные приложения. Река Аппер-Сэдл, Нью-Джерси: Pearson/Prentice Hall, 2007. Печать.
Эта страница под названием The Hydronium Ion публикуется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Стивеном Лоуэром и Авнитом Кахлоном посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Стивен Лоуэр
- Лицензия
- СС BY
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.


 04.18
04.18 04.18
04.18

 -_{(водн.)} \] 9{+}}\) получается из-за того, что все стехиометрические коэффициенты равны единице.
-_{(водн.)} \] 9{+}}\) получается из-за того, что все стехиометрические коэффициенты равны единице.

Leave A Comment