Периодический закон и Периодическая система химических элементов Д.И. Менделеева – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д. И. Менделеева являются короткая и длинная формы.
И. Менделеева являются короткая и длинная формы.
Содержание
- Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
- Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
- Тренировочные задания
- Ответы
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
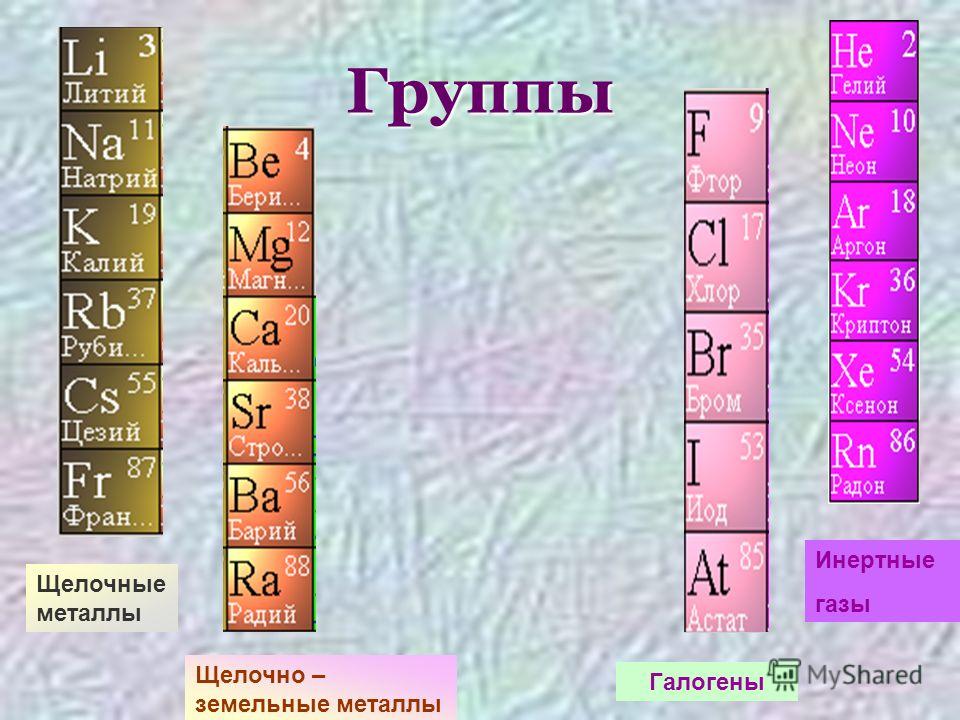
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.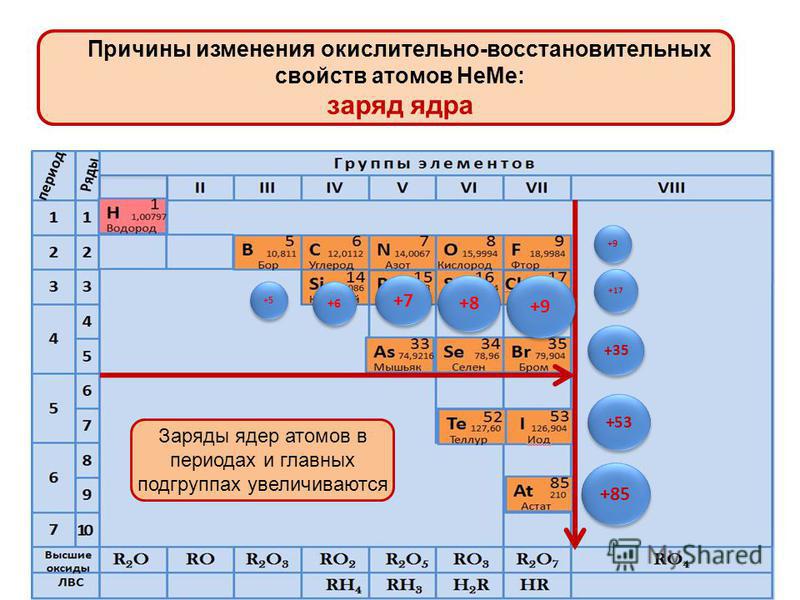 В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
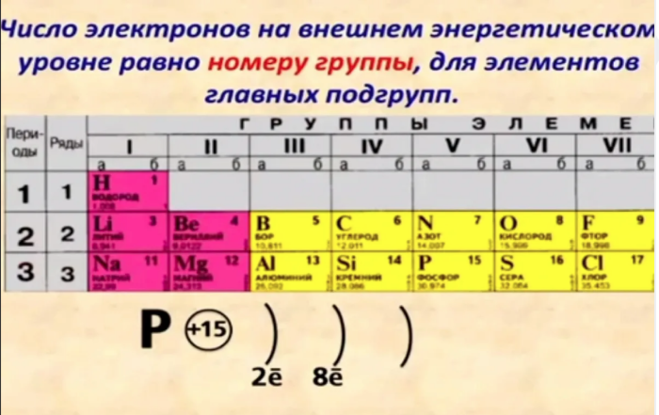
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
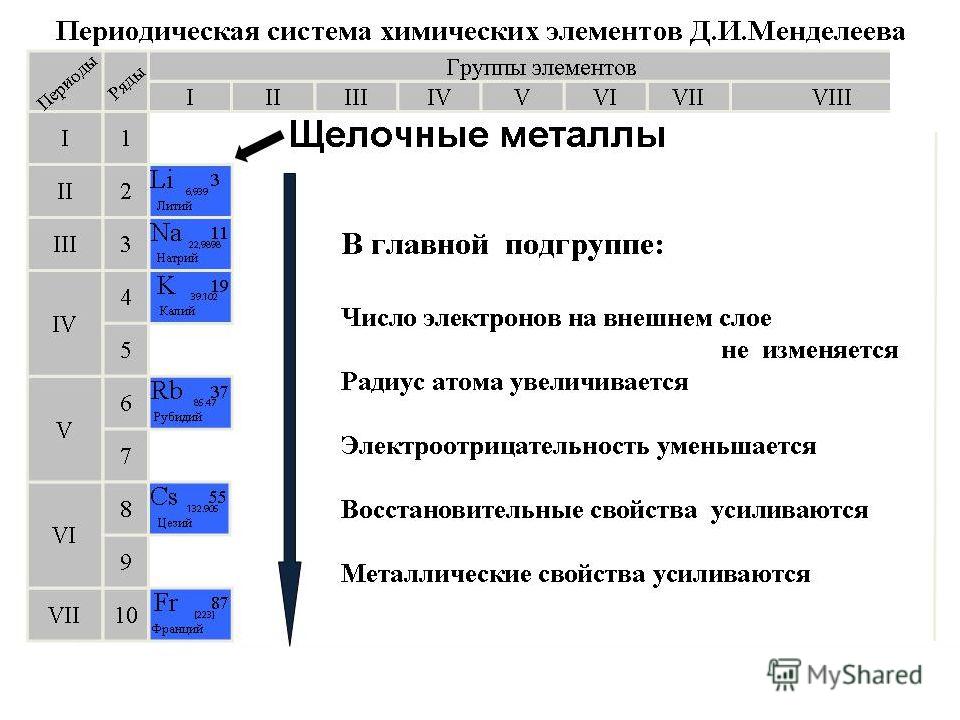
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.

Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F
2) S
3) O
4) N
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
Ответы
Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая →
← Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
Тест: Закономерности изменения свойств — Химия 10 класс
Тест: Закономерности изменения свойств — Химия 10 классАнглийский язык
Астрономия
Белорусский язык
Биология
География
ИЗО
Информатика
История
Итальянский язык
Краеведение
Литература
Математика
Музыка
Немецкий язык
ОБЖ
Обществознание
Окружающий мир
ОРКСЭ
Русский язык
Технология
Физика
Физкультура
Химия
Черчение
Для учителей
Дошкольникам
VIP — доступ
- Предметы »
- Химия »
- 10 класс »
- Закономерности изменения свойств
Закономерности изменения свойств
подборка заданий закономерности изменения свойств простых веществ
Химия 10 класс | Автор: Селиванова О.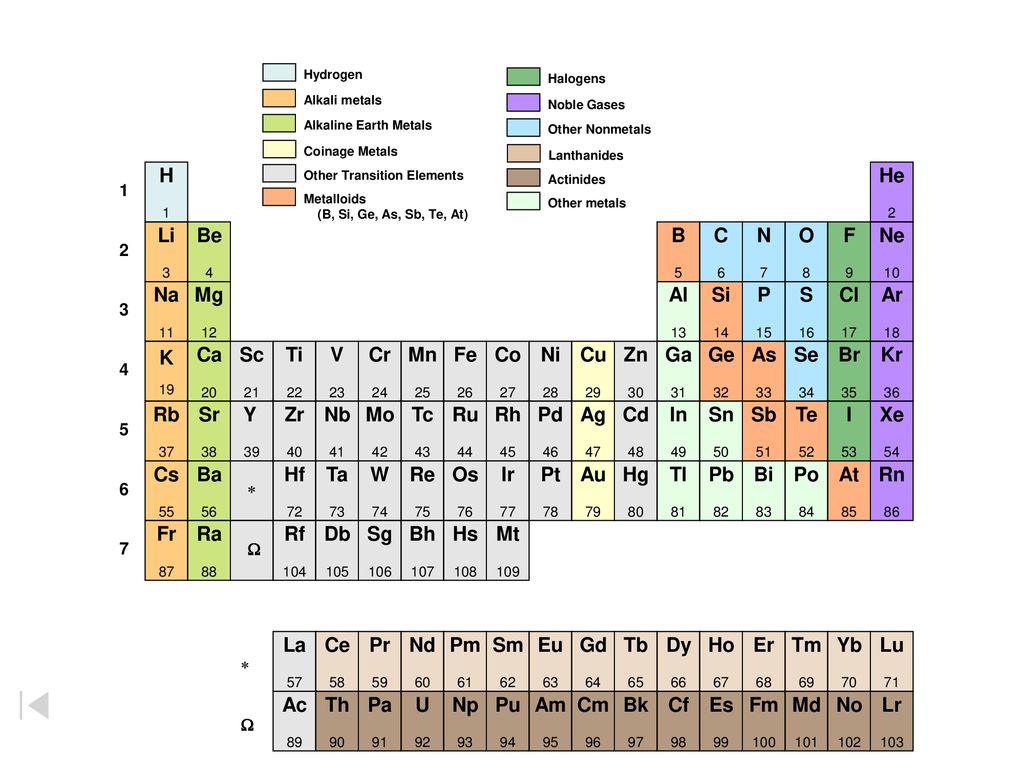
Помещать страницу в закладки могут только зарегистрированные пользователи
Зарегистрироваться
Вопрос №
1
Металлические свойства усиливаются в ряду
Сa – Mg – Be
Ca – Sr – Rb
Al – Mg – Be
Ba – Na – Li
Вопрос №
2
Неметаллические свойства наиболее выражены у вещества
Si
Ge
P
As
Вопрос № 3
Энергия ионизации атома увеличивается в ряду
O – F – Ne
O – S – Se
O – N – C
Li – Na – K
Вопрос №
4
Энергия ионизации атома уменьшается в ряду
Na – Mg – Al
Na – K – Rb
S – Cl – Ar
Br – Cl – F
Вопрос №
5
В ряду элементов Na – Mg – Al – Si уменьшается
радиус атома
электроотрицательность атома
число электронов в атоме
число заполненных энергетических уровней в атоме
Вопрос №
6
. В ряду элементов Si – P – S – Cl увеличивается
В ряду элементов Si – P – S – Cl увеличивается
радиус атома
электроотрицательность атома
число заполненных энергетических уровней в атоме
число неспаренных электронов в основном состоянии атома
Вопрос №
7
Наибольший радиус – у атома
Mg
F
Cl
Вопрос №
8
Наименьший радиус – у атома
Al
O
B
S
Вопрос №
9
В ряду элементов Ba – Sr – Ca не изменяется
восстановительная способность простых веществ
радиус атома
число валентных электронов
число энергетических уровней
Вопрос №
10
В каком ряду химические элементы расположены в порядке возрастания их
K – Na — Li
Na – Mg — AI
O – S — Se
C – N — O
Вопрос №
11
В ряду химических элементов Li – Be – B – C
уменьшается число электронных слоев в атомах
уменьшается число электронов на внешнем электронном слое атомов
возрастают радиусы атомов
возрастает электроотрицательность атомов
Вопрос №
12
Металлические свойства усиливаются в ряду:
Be – Mg – Ca
K – Ca – Sc
Ba – Sr – Ca
Вопрос №
13
Неметаллические свойства усиливаются в ряду:
Si – СI– S — P
I – Br – CI — F
CI – S – P — Si
F – CI – S — P
Вопрос №
14
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1) Na
2) K
3) Si
4) Mg
5) C
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Введите ответ:
Вопрос №
15
ля выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1) Na
2) K
3) Al
4) Mg
5) C
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Введите ответ:
Показать ответы
Получение сертификата
Доступно только зарегистрированным пользователям
© TestEdu.ru 2013-2022
E-mail администратора: [email protected]
12.2: Группа IA — Щелочные металлы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49472
- Эд Витц, Джон В.

- Цифровая библиотека химического образования (ChemEd DL)
Li, Na, K, Rb и Cs относятся к элементам группы IA, также известным как щелочные металлы. Седьмой член группы, франций (Fr), является радиоактивным и настолько редким, что в любой данный момент на Земле может существовать только 20 атомов Fr [1] . Термин щелочь происходит от арабского слова, означающего «пепел». Соединения калия, а также других щелочных металлов были получены из древесной золы ранними химиками. Все щелочные металлы мягкие и, кроме желтого Cs, имеют серебристо-серый цвет.
Литий, натрий, калий, рубидий и цезий имеют множество других общих свойств. Все они твердые при 0°C и плавятся при температуре ниже 200°C. Каждый из них обладает металлическими свойствами, такими как хорошая тепло- и электропроводность, ковкость (способность сбиваться в листы) и пластичность (способность вытягиваться в проволоку).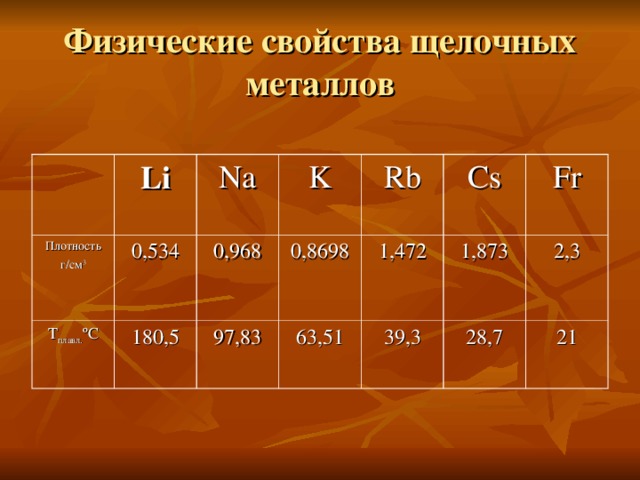
Некоторые общие свойства щелочных металлов приведены в таблице ниже. Все эти атомы металлов содержат единственный электрон вне конфигурации благородного газа, поэтому валентный электрон хорошо защищен от ядерного заряда, а атомные радиусы относительно велики. Большой объем каждого атома приводит к низкой плотности — достаточно малой, чтобы Li, Na и K плавали на поверхности воды, реагируя с ней.
| Элемент | Символ | Обычная степень окисления | Атомный радиус/пм | Ионная (M + ) Радиус/пм | |
|---|---|---|---|---|---|
| Литий | Ли | [Не]2 с 1 | +1 | 122 | 60 |
| Натрий | На | [Ne]3 с 1 | +1 | 157 | 95 |
| Калий | К | [Ar]4 с 1 | +1 | 202 | 133 |
| Рубидий | руб. | [Кр]5 с 1 | +1 | 216 | 148 |
| Цезий | Cs | [Хе]6 с 1 | +1 | 235 | 169 |
| Символ | Энергия ионизации/МДж моль –1 | Плотность/ г см –3 | Электроотрицательность | Температура плавления (в °C) | |
|---|---|---|---|---|---|
| Первый | Второй | ||||
| Ли | 0,526 | 7. 305 305 | 0,534 | 1,0 | 179 |
| Нет данных | 0,502 | 4,569 | 0,97 | 0,9 | 98 |
| К | 0,425 | 3.058 | 0,86 | 0,8 | 64 |
| Руб | 0,409 | 2,638 | 1,52 | 0,8 | 39 |
| Цз | 0,382 | 2.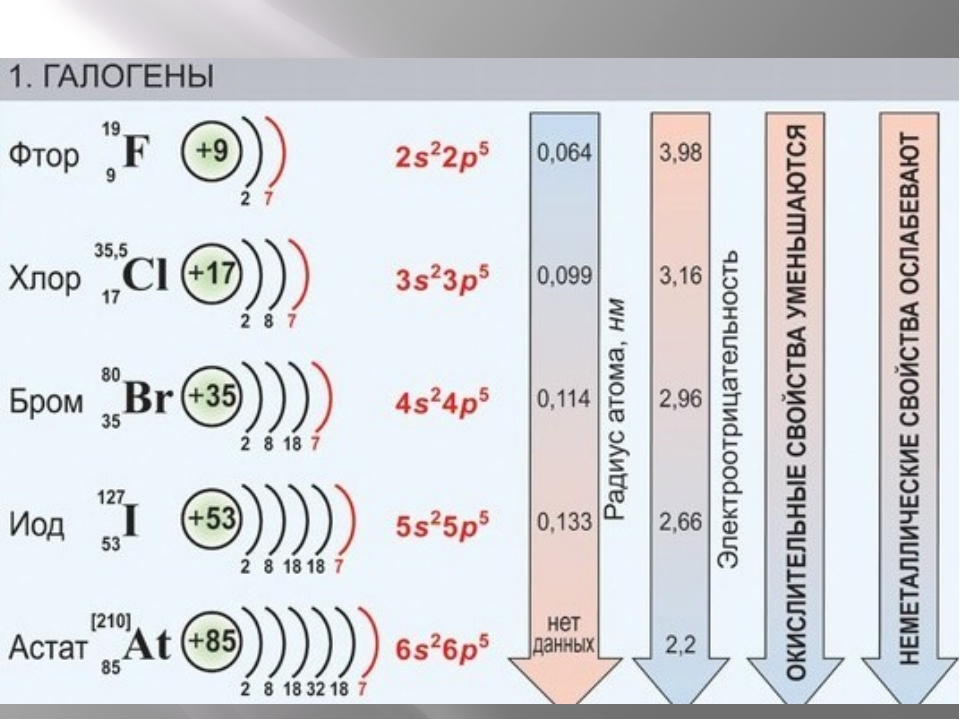 430 430 | 1,87 | 0,7 | 28 |
Атомы не имеют сильного притяжения к единственному валентному электрону, поэтому он легко теряется (малая первая энергия ионизации) из +1 иона. Поскольку они легко отдают электроны таким образом, все щелочные металлы являются сильными восстановителями. Они достаточно реакционноспособны, даже восстанавливают воду.
Слабое притяжение валентного электрона также приводит к слабой металлической связи, потому что именно притяжение между ядрами и многочисленными валентными электронами удерживает атомы металла вместе. Слабая металлическая связь приводит к низким температурам плавления, особенно для более крупных атомов в нижней части группы. Cs, например, плавится чуть выше комнатной температуры. Слабая металлическая связь также объясняет тот факт, что все эти металлы довольно мягкие.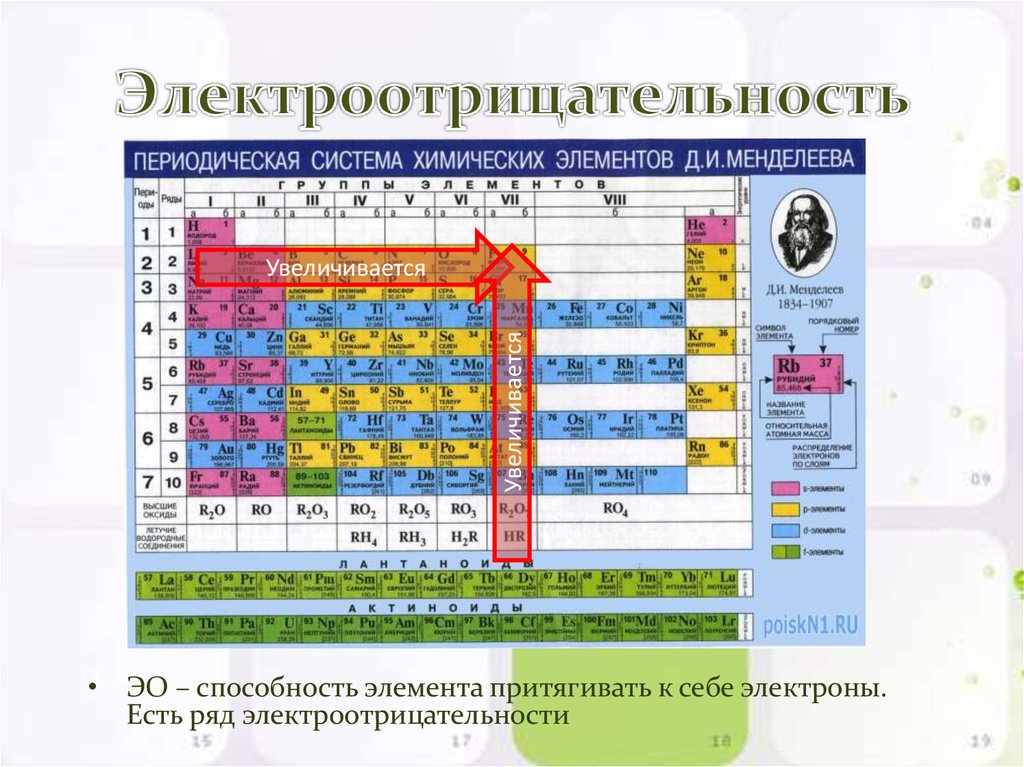
То, что химия щелочных металлов ограничивается степенью окисления +1, подтверждается большими энергиями вторичной ионизации. Удалить первый электрон с большой рассеянной орбитали легко, но удалить второй электрон из октета в M 9Ион 0032 + слишком сложен для любого окислителя.
Два других элемента находятся в группе IA. Водород, хотя многие из его соединений имеют формулы, подобные щелочным металлам, является неметаллом и почти уникален по своему химическому поведению. Поэтому его обычно не включают в эту группу. Франций (Fr) довольно радиоактивен, и для изучения доступны лишь небольшие его количества; поэтому его тоже обычно опускают. Однако его свойства подобны свойствам Cs и других щелочных металлов.
Элемент литий бурно и впечатляюще сочетается с водой. Выделяется газообразный водород, который продвигает металлический литий по воде, когда он вступает в реакцию. Если избыток воды испаряется, остается соединение гидроксида лития (LiOH). LiOH визуализируется с помощью индикатора фенолфталеина, который становится розовым при образовании основания LiOH. Таким образом, уравнение этой реакции:
Таким образом, уравнение этой реакции:
\[\text{2Li}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2LiOH}(aq) + \text{H}_\text{2}(g)\номер\]
Элементы натрий, калий, рубидий и цезий также бурно взаимодействуют с водой с образованием гидроксидов. Уравнения их реакций:
\[\text{2Na}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2NaOH}(aq) + \ text{H}_\text{2} (g)\nonumber \]
\[\text{2K}(s) + \text{2H}_\text{2}\text{O}(l) \ стрелка вправо \text{2KOH}(aq) + \text{H}_\text{2} (g)\nonumber \]
\[\text{2Rb}(s) + \text{2H}_\text{ 2}\text{O}(l) \rightarrow \text{2RbOH}(водн.) + \text{H}_\text{2} (g)\nonumber \]
\[\text{2Cs}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2CsOH}(водн.) + \text{H}_\ text{2} (g)\nonumber \]
Поскольку все щелочные металлы реагируют с водой одинаково, общее уравнение может быть записано:
\[\text{2M}(s) + \text {2H}_\text{2}\text{O}(l) \rightarrow \text{2MOH}(aq) + \text{H}_\text{2} (g)\nonumber \]
с M = K, Li, Na, Rb или Cs.
Символ M представляет любой из пяти элементов.
Помимо поведения при добавлении в воду, щелочные металлы непосредственно реагируют со многими элементами. Все быстро соединяется с кислородом воздуха, образуя белый оксид:
\[\text{4M}(s) + \text{O}_2(g) \rightarrow \text{2M}_2 \text{O}(s)\nonumber \]
с M = Li, Na , K, Rb или Cs
(Li 2 O — оксид лития, Na 2 O — оксид натрия и т. д.)
Все, кроме лития, далее реагируют с образованием желтых пероксидов, M 2 O 2 :
\[\text{2M}_2 \text{O}(s) + \text{O}_2(g) \rightarrow \text{2M}_2 \text{O}_2(s)\nonumber \ ] M = Na, K, Rb или Cs
(Na 2 O 2 — пероксид натрия и т. д.)
Калий, рубидий и цезий достаточно реакционноспособны, чтобы могли образовываться желтые супероксиды (общая формула которых MO 2 ):
\[\text{2M}_2 \text{O }_2(s) + \text{O}_2(g) \rightarrow \text{2MO}_2(s)\nonumber \]
с M = K, Rb или Cs
Если поверхность образца из если щелочной металл очистить, он будет казаться белым или серым, а не серебристым металлическим блеском.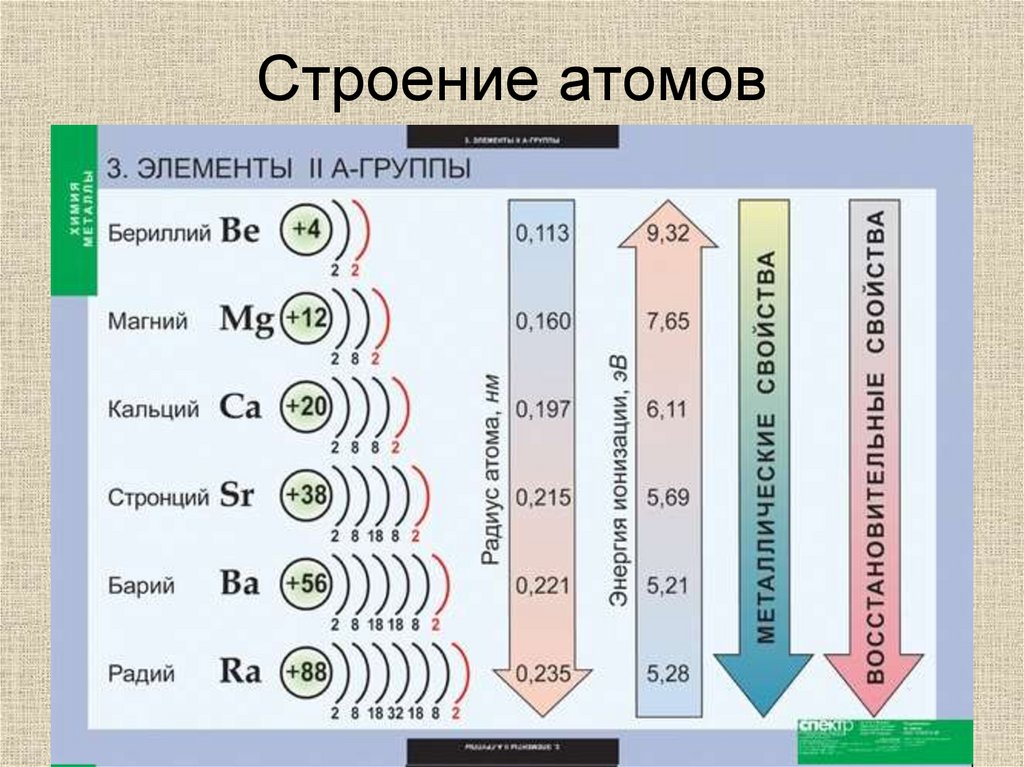 Это связано с оксидным, пероксидным или супероксидным покрытием, которое образуется после нескольких секунд пребывания на воздухе. В следующем видеоролике показано, как свежесрезанный кусок лития блестит, но тускнеет до серого при воздействии кислорода воздуха. Видео также акцентирует внимание на другом важном свойстве щелочных металлов: они мягкие и легко режутся по сравнению с другими металлами.
Это связано с оксидным, пероксидным или супероксидным покрытием, которое образуется после нескольких секунд пребывания на воздухе. В следующем видеоролике показано, как свежесрезанный кусок лития блестит, но тускнеет до серого при воздействии кислорода воздуха. Видео также акцентирует внимание на другом важном свойстве щелочных металлов: они мягкие и легко режутся по сравнению с другими металлами.
Тускло-серый окисленный цилиндр из металлического лития разрезается, обнажая блестящую серебристую поверхность. Через 1 минуту поверхность потускнела, а через 10 минут поверхность среза вернулась к тускло-серому цвету остальной части металлического лития. Поскольку щелочным металлом является литий, единственная реакция с кислородом:
\[\text{4Li}(s) + \text{O}_2(g) \rightarrow \text{2Li}_2\text{O }(s)\nonumber \]
Щелочь также напрямую соединяется с газообразным водородом с образованием соединений, известных как гидриды, MH:
\[\text{2M}(s) + \text{H}_2(g) \rightarrow \text{2MH}(s)\nonumber \]
где M = Li, Na, K, Rb или Cs
Реагируют с серой с образованием сульфидов, M 2 S:
\[\text{2M}(s) + \text{S}(g) \rightarrow \text{M}_2\text{S }(s)\nonumber \]
с M = Li, Na, K, Rb или Cs
Все эти оксиды, гидриды, гидроксиды и сульфиды растворяются в воде с образованием основных растворов, и эти соединения относятся к сильным базы.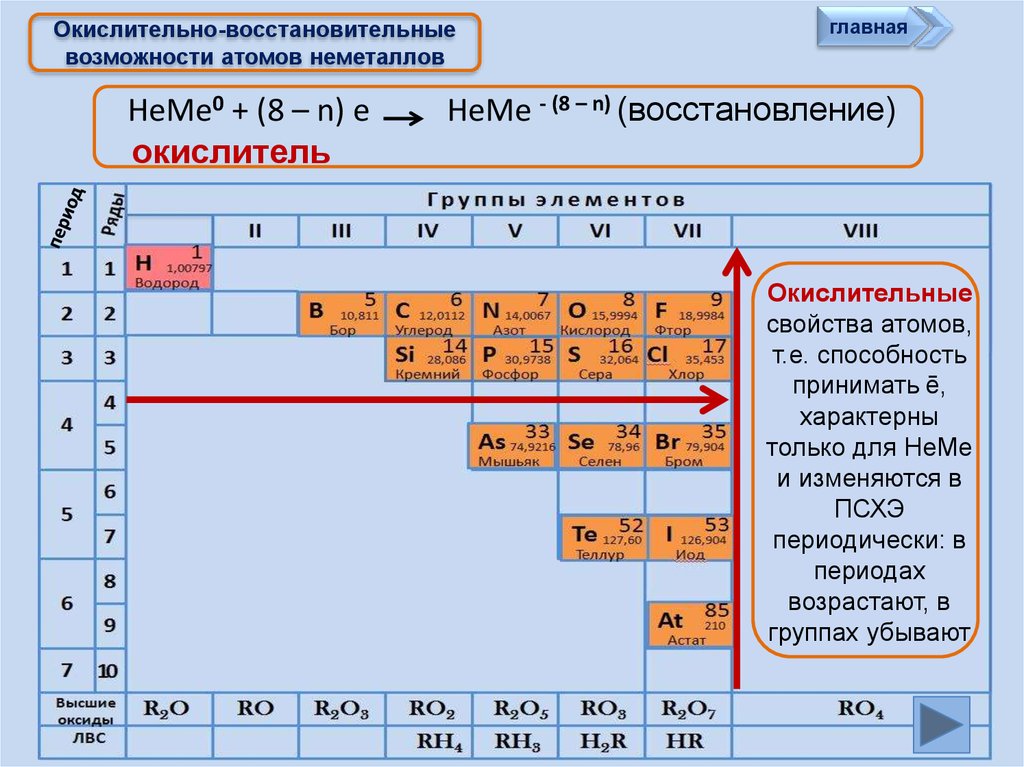
Пероксиды и супероксиды, образующиеся при взаимодействии более тяжелых щелочных металлов с O 9{-} + \text{3O}_2(g)\nonumber \]
Оба последних уравнения описывают как окислительно-восстановительные, так и кислотно-щелочные процессы, что можно подтвердить, присвоив степени окисления. Ионы пероксида и супероксида содержат атомы О в необычных (для О) –1 и –½ степенях окисления:
Следовательно диспропорционирование (одновременное окисление и восстановление) О 2 2 – или О 2 – до более распространенных степеней окисления 0 (в O 2 ) и –2 (в OH – ).
Щелочные металлы также реагируют непосредственно с галогенами, например с хлором, образуя хлориды,
\[\text{2M}(s) + \text{Cl}_2(g) \rightarrow \text{2MCl}( s)\номер\] M = Li, Na, K, Rb или Cs
Ниже приведен пример реакции Na с Cl 2
Кусочек металлического натрия добавляют в колбу с газообразным хлором. Сначала никакой реакции не происходит, но когда добавляется капля воды, натрий и хлор вступают в реакцию, бурно воспламеняясь и выделяя столько тепла, что на дне колбы необходим песок, чтобы поглотить тепло и предотвратить растрескивание стекла. Это уравнение для этой реакции:
Сначала никакой реакции не происходит, но когда добавляется капля воды, натрий и хлор вступают в реакцию, бурно воспламеняясь и выделяя столько тепла, что на дне колбы необходим песок, чтобы поглотить тепло и предотвратить растрескивание стекла. Это уравнение для этой реакции:
\[\text{2Na}(s) + \text{Cl}_2(g) \rightarrow \text{2NaCl}(s)\nonumber \]
с фтором с образованием фторидов, MF:
\[ \text{2M}(s) + \text{F}_2(g) \rightarrow \text{2MF}(s)\nonumber \] M = Li, Na, K, Rb или Cs
и с бромом до образуют бромиды, MBr:
\[\text{2M}(s) + \text{Br}_2(g) \rightarrow \text{2MBr}(s)\nonumber \] M = Li, Na, K, Rb , или Cs
Ниже приведен пример реакции K с Br 2
В этом видео калий, хранящийся в инертном минеральном масле из-за его высокой реакционной способности, помещен в стакан с жидким бромом после защитного слоя минеральное масло было удалено. Калий бурно реагирует с бромом. Контейнер накрывают в течение всего процесса, чтобы предотвратить попадание реагентов и продуктов в окружающую среду.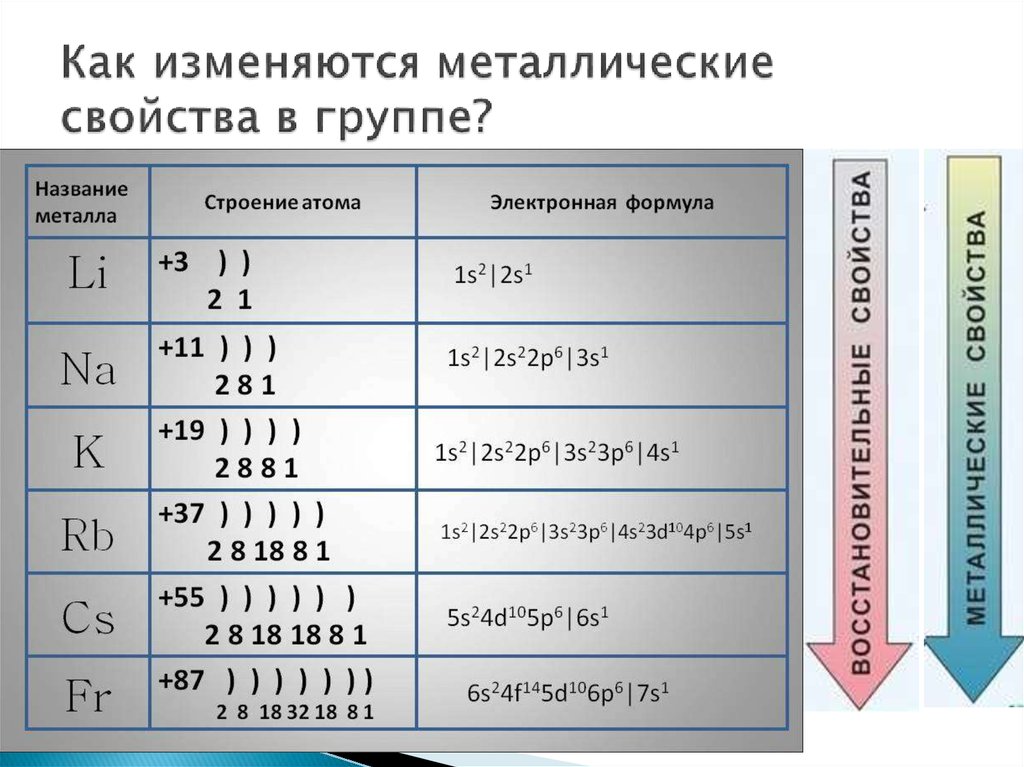 Химическое уравнение этой реакции:
Химическое уравнение этой реакции:
\[\text{2K}(s) + \text{Br}_2(g) \rightarrow \text{2KBr}(s)\nonumber \]
Натрий и калий довольно распространены, занимая шестое и седьмое место среди все элементы в земной коре, но другие щелочные металлы редки. Ионы натрия и калия являются компонентами многочисленных силикатных кристаллических решеток, наблюдаемых в земной коре, но, поскольку большинство их соединений растворимы в воде, они также являются важными составляющими морской воды и подземных отложений рассола. Хлорид натрия, получаемый из таких рассолов, является главным коммерческим источником натрия, тогда как калий можно получать из руды сильвита (KCl) или карналлита (KCl•MgCl 9).0324 2 •6H 2 O).
Ионы натрия (Na + ) и калия (K + ) необходимы для живых систем. Na + является основным катионом в жидкостях, окружающих клетки, тогда как K + наиболее важен внутри клеток. Na + играет роль в сокращении мышц, а K + и Na + играют роль в передаче нервных импульсов.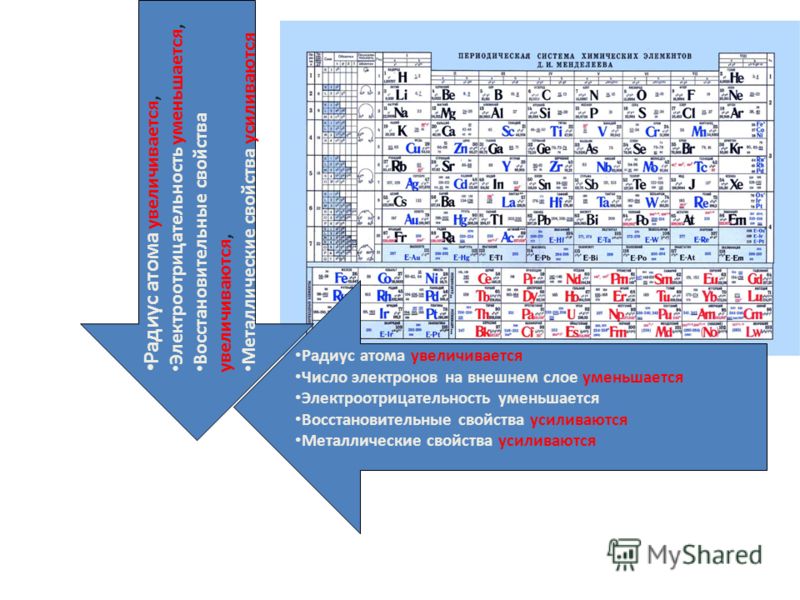 К более важен для растений, чем натрий, и это один из трех элементов (К, Р, N), которые должны входить в состав удобрений для поддержания высоких урожаев. K особенно много содержится в деревьях — древесная зола от кухонных костров (поташ) была основным источником этого элемента еще столетие назад, и она до сих пор является хорошим удобрением для вашего сада. Древесная зола содержит смесь оксида калия и карбоната калия, последний образуется при соединении K 2 O с CO 2 производится, когда C в древесине сочетается с O 2 :
К более важен для растений, чем натрий, и это один из трех элементов (К, Р, N), которые должны входить в состав удобрений для поддержания высоких урожаев. K особенно много содержится в деревьях — древесная зола от кухонных костров (поташ) была основным источником этого элемента еще столетие назад, и она до сих пор является хорошим удобрением для вашего сада. Древесная зола содержит смесь оксида калия и карбоната калия, последний образуется при соединении K 2 O с CO 2 производится, когда C в древесине сочетается с O 2 :
\[\text{K}_2\text{O} + \text{CO}_2 \rightarrow \text{K }_2\text{CO}_3\nonumber \]
Соединения Na коммерчески получают из рассола или морской воды. При пропускании электрического тока через раствор NaCl (процесс, называемый электролизом ), Cl 2 (г), H 2 (г) и концентрированный раствор NaOH (каустическая сода или щелочь) получаются:
9{-}(aq)\nonumber \] Более подробно этот процесс описан в разделе об электрохимических элементах, но из уравнения видно, что электрический ток окисляет Cl – до Cl 2 и восстанавливает H 2 О до Н 2 .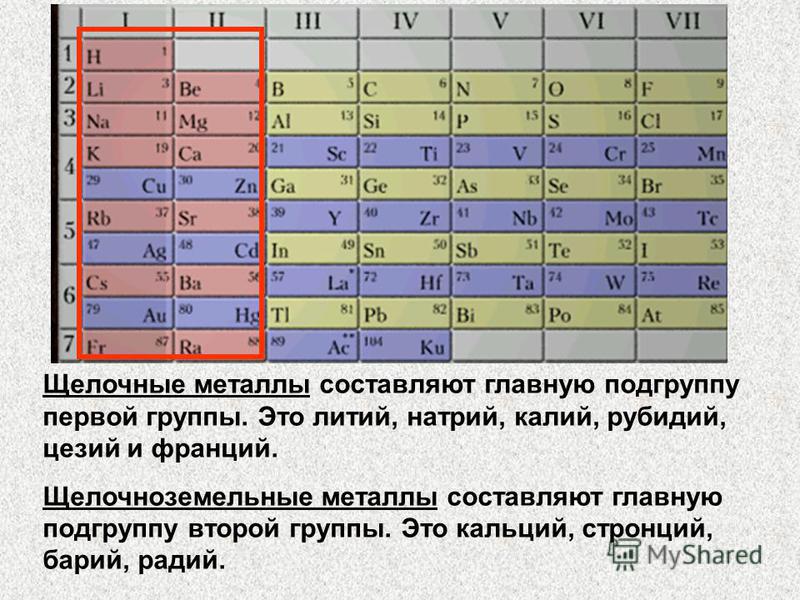 NaOH ( aq ) используется в качестве сильного основания во многих промышленных процессах для производства мыла, вискозы, целлофана, бумаги, красителей и многих других продуктов. Щелок также используется в домашних очистителях канализации. С ним нужно обращаться осторожно, потому что он сильно щелочной, очень едкий и может сильно обжечь кожу. Вторым важным промышленным применением рассола является 9{-}(aq)\nonumber \]
NaOH ( aq ) используется в качестве сильного основания во многих промышленных процессах для производства мыла, вискозы, целлофана, бумаги, красителей и многих других продуктов. Щелок также используется в домашних очистителях канализации. С ним нужно обращаться осторожно, потому что он сильно щелочной, очень едкий и может сильно обжечь кожу. Вторым важным промышленным применением рассола является 9{-}(aq)\nonumber \]
Процесс Сольве представляет собой кислотно-основную реакцию в сочетании с осаждением. Ангидрид кислоты CO 2 реагирует с H 2 O с образованием H 2 CO 3 . Эта слабая кислота отдает протон NH 3 , давая NH 4 + и HCO 3 – , а последний ион осаждается с Na + . Слабоосновной гидрокарбонат натрия, полученный по процессу Solvay, можно очистить для использования в качестве антацида (бикарбонат соды), но большая его часть превращается в карбонат натрия (кальцинированная сода) при нагревании:
\[\text{2NaHCO}_3(s) \xrightarrow{\Delta } \text{Na}_2\text{CO}_3(s) + \text{H}_2\text{O}(g) + \text{CO}_2(g)\nonumber \]
(Δ в этом уравнении указывает на нагрев реагента. ) Карбонат натрия (Na 2 CO 3 ) используется в производстве стекла и бумаги, а также в некоторые моющие средства. Однако ион карбоната является довольно сильным основанием, и моющие средства, содержащие Na 2 CO 3 (стиральная сода), вызвали серьезные химические ожоги у некоторых маленьких детей, которые из любопытства съели их.
) Карбонат натрия (Na 2 CO 3 ) используется в производстве стекла и бумаги, а также в некоторые моющие средства. Однако ион карбоната является довольно сильным основанием, и моющие средства, содержащие Na 2 CO 3 (стиральная сода), вызвали серьезные химические ожоги у некоторых маленьких детей, которые из любопытства съели их.
Эта страница под названием 12.2: Group IA — Alkali Metals распространяется в соответствии с лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина. , Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- щелочной металл
- диспропорция
- электролиз
- Процесс Сольвея
h3g2 — Химия элементов группы 1 — Li, Na, K, Rb, Cs, Fr
Водород | Группа 1 — Щелочные металлы | Группа 2 — щелочноземельные металлы | Группа 12
6.941 22.9898 39. 85.467 132.9054 (223) |
Натрий и калий являются наиболее распространенными элементами группы 1 на Земле, и их можно найти в отложениях каменной соли, образовавшихся в результате испарения соленой воды. Лития, рубидия и цезия гораздо меньше. Франций радиоактивен и имеет только короткоживущие изотопы, образующиеся при распаде других элементов.
Ионы натрия и калия очень важны в биологии для передачи нервных импульсов и поддержания осмотических процессов.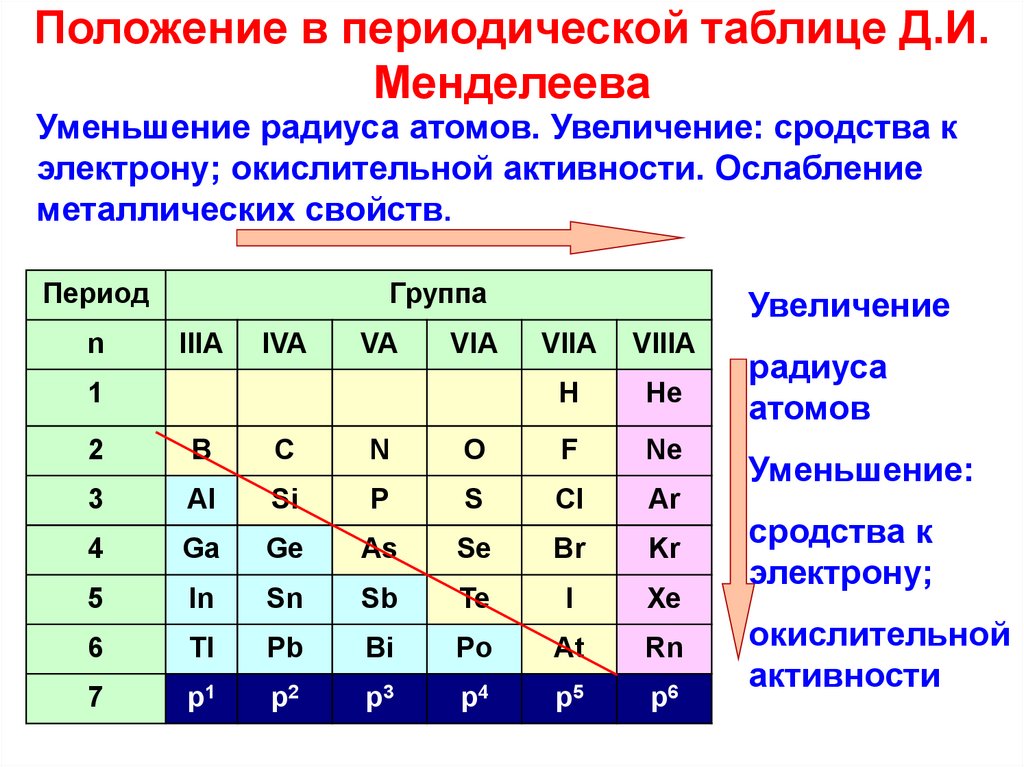 Несколько солей лития также используются в психиатрической терапии. Соединения натрия, включая гидроксид натрия, карбонат натрия, сульфаты натрия и силикаты натрия, являются очень важными промышленными химическими веществами, а сульфаты калия широко используются в удобрениях.
Несколько солей лития также используются в психиатрической терапии. Соединения натрия, включая гидроксид натрия, карбонат натрия, сульфаты натрия и силикаты натрия, являются очень важными промышленными химическими веществами, а сульфаты калия широко используются в удобрениях.
Получение элементов и их физические свойства
Металлический литий и натрий можно получить электролизом расплавленных солей этих элементов. Это не так эффективно для калия, рубидия и цезия, поэтому их выделение осуществляется путем обработки их расплавленных хлоридных солей парами натрия. Металлы имеют серебристый цвет, за исключением цезия, который имеет золотисто-желтый цвет. Поскольку все металлы имеют только один валентный электрон, связь в решетке довольно слабая, поэтому металлы мягкие — их можно легко разрезать ножом — и имеют низкие температуры плавления. Они будут реагировать со многими элементами при нагревании.
В химическом составе группы 1 преобладают ионы металла +1. Ионы +2 элементов нелегко образуются из-за их очень высоких вторых энергий ионизации.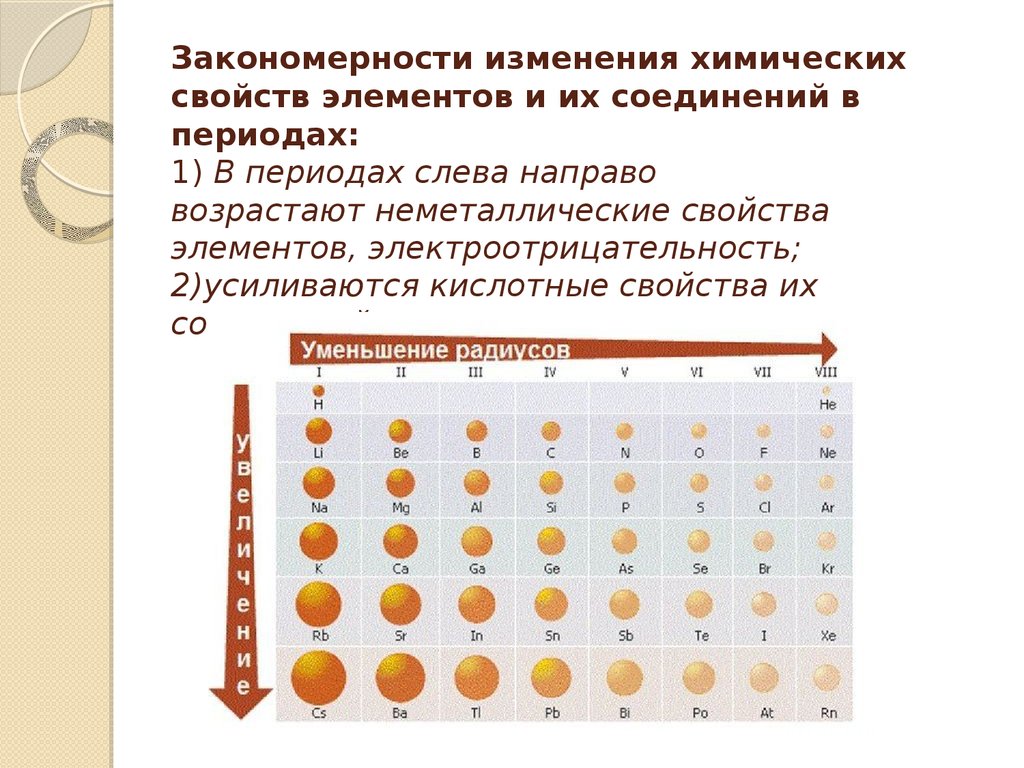 Соединения имеют в основном ионную природу, хотя для некоторых соединений Li + характерна некоторая степень ковалентности. По мере того, как размер ионов M + увеличивается, а плотность их заряда уменьшается, химический состав становится более ионным по своей природе.
Соединения имеют в основном ионную природу, хотя для некоторых соединений Li + характерна некоторая степень ковалентности. По мере того, как размер ионов M + увеличивается, а плотность их заряда уменьшается, химический состав становится более ионным по своей природе.
Все металлы реагируют с водой с образованием газообразного водорода и гидроксида металла. Литий реагирует очень медленно; натрий намного быстрее; калий при жжении; рубидий и цезий взрывчато. Поэтому натрий, а иногда и калий используются для удаления следов воды из углеводородных растворителей, таких как гексан или бензол, для использования в реакциях, чувствительных к воздуху и влаге.
M + H 2 O → MOH + ½ H 2
| Элемент | Температура плавления (°C) | Ионный радиус (Å) 1 7 Ионизация py (кДж моль -1 ) | Приблизительный радиус гидратации М + (Å) | Приблизительное число гидратации М + | ||||||
| Ли | 180 | 0,90 | 520 | 3,40 | 25 900 0763 Na | 98 | 1,16 | 496 | 2,76 | 17 |
| K | 64 | 1,52 | 419 | 2,32 | 11 | |||||
руб. 403 403 | 2,28 | 10 | ||||||||
| Cs | 29 | 1,81 | 376 | 2,28 | 10 |
Они также реагируют с кислородом с образованием оксидов. Li, Na и K обычно хранят в минеральном масле, чтобы избежать потускнения их поверхностей. Рубидий и цезий требуют хранения в инертной атмосфере аргона. Различные металлы группы 1 образуют различные типы оксидов. Литий образует оксид с оксид-ионом O 2- с образованием Li 2 O. Натрий образует оксид с пероксид-ионом O 2 2- в форму Na 2 O 2 . Однако при нагревании под давлением образуется Na 2 . Другие щелочные металлы — K, Rb и Cs — образуют оксиды с супероксид-ионом O 2 — с образованием MO 2 .
Они также реагируют со спиртами с образованием алкоксидов. Они широко используются в синтетической химии в качестве восстановителей и сильных оснований. Например, реакция Na с этанолом.
Они широко используются в синтетической химии в качестве восстановителей и сильных оснований. Например, реакция Na с этанолом.
Na + CH 3 CH 2 OH → CH 3 CH 2 O — Na + + ½ H 2
Другое распространенное применение натрия в лаборатории – амальгама натрия. Все металлы растворимы в ртути, а Na/Hg является сильным восстановителем.
Одним из наиболее интересных свойств элементов группы 1 (а также кальция, стронция, бария, европия и иттербия) является то, что они растворяются в аммиаке с образованием растворов, которые при разбавлении приобретают темно-синий цвет. Происходит следующее: когда металлы растворяются, они ионизируются, высвобождая единственный валентный электрон. Электрон сольватируется и взаимодействует с молекулами аммиака, что приводит к темно-синему цвету. Ионы металлов M + и атомы металла бесцветны.
Na → Na + + e —
По мере того, как эти растворы становятся более концентрированными, этот синий цвет сменяется жидкостью более медного цвета, почти металлической.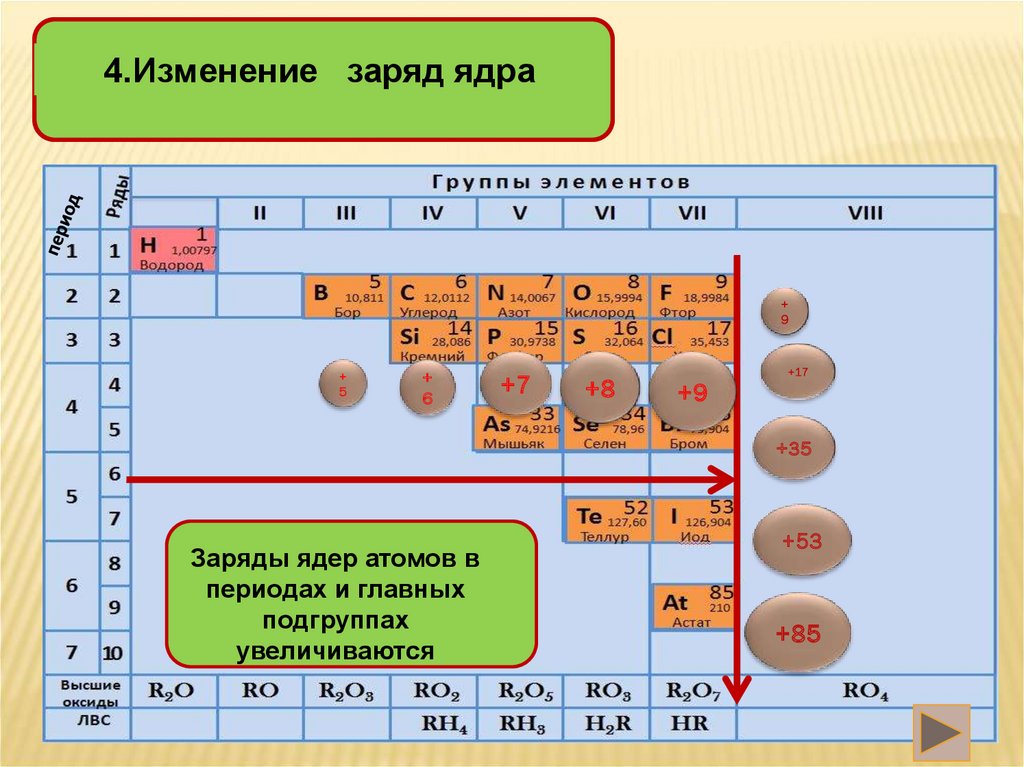 На этой стадии образуются кластеры ионов металлов, и эти растворы обладают очень высокой электропроводностью.
На этой стадии образуются кластеры ионов металлов, и эти растворы обладают очень высокой электропроводностью.
Синие растворы могут быть достаточно стабильными с течением времени, но добавление некоторых соединений переходных металлов или использование яркого света может привести к образованию амида натрия, NaNH 2 , которые можно использовать в качестве сильных восстановителей и сильных оснований.
Na + NH 3 → NaNH 2 + ½ H 2
Сольватация ионов металлов
голый ион. Ион металла имеет ряд связанных с ним молекул растворителя, которые окружают ион и на поведение которых он влияет. Это называется оболочкой растворителя , и если растворителем является вода, то гидратирующая оболочка .
Его можно разделить на две области:
Оболочка первичного растворителя — группа молекул растворителя, находящихся в непосредственном контакте и координированных с металлом.

A вторичная сольватная оболочка — молекулы, находящиеся вне первичной оболочки, но поведение и расположение которых все еще находятся под влиянием иона металла.
Общее число молекул воды под действием иона в водном растворе называется его гидратации № (таблица 1). Для Li + , Na + и K + первичная гидратная оболочка состоит из четырех молекул воды, а для Rb + и Cs + их, вероятно, шесть. Хотя размер первичной гидратной оболочки увеличивается вниз по группе из-за большего размера ионов, общее число гидратации уменьшается, а также уменьшается ее гидратный радиус — размер, включающий всю оболочку растворителя.
Это связано с тем, что по мере увеличения размера иона плотность его заряда уменьшается, что снижает его влияние на окружающий растворитель. Эта разница в размере гидратированных ионов, а также некоторые другие факторы имеют жизненно важное значение для способности клеток нашего организма различать разные ионы.
Соединения щелочных металлов
Образование оксидов этих элементов в результате реакции с избытком O 2 уже упоминалось выше. Все гидроксиды, МОН, представляют собой белые кристаллические твердые вещества, легко растворимые в воде и гигроскопичные (поглощают водяной пар из воздуха и выглядят заметно влажными). Все твердые вещества и растворы гидроксида поглощают углекислый газ, а LiOH используется в качестве очищающего агента для удаления смертельно опасного CO 2 из воздуха внутри космического корабля.
Элементы образуют ионные соли практически любой кислоты и обычно представляют собой бесцветные кристаллические вещества. Ионные пластины этих элементов обычно имеют более высокую температуру плавления и после плавления становятся электропроводными и растворимыми в воде. Многие соединения лития обладают свойствами, отличными от свойств остальных щелочных металлов; больше похоже на соединения Mg 2+ . Например, LiH стабилен примерно до 900 °C, а NaH разлагается при гораздо более низкой температуре, около 350 °C.
Соединение Li 3 N, образованное в результате реакции лития с газообразным азотом при высокой температуре, стабильно. Однако соответствующий аналог натрия, Na 3 N, не существует при комнатной температуре. LiOH гораздо менее растворим, чем любой из других гидроксидов, и также разлагается до Li 2 O при высокой температуре, тогда как другие возгоняются. Литиевые соли сильных кислот имеют тенденцию быть наиболее растворимыми из щелочных металлов в воде, тогда как соли слабых кислот имеют тенденцию быть наименее растворимыми.
Комплексы ионов щелочных металлов
Как описано, ионы щелочных металлов будут в значительной степени взаимодействовать с растворителем, в котором они находятся. Ионы щелочных металлов также могут образовывать комплексы, хотя и не совсем так, как переходные металлы.
Соединения, называемые «краун-эфирами» и «криптандами», могут инкапсулировать эти ионы металлов и позволяют им проникать в растворители, в которых они в противном случае были бы нерастворимы.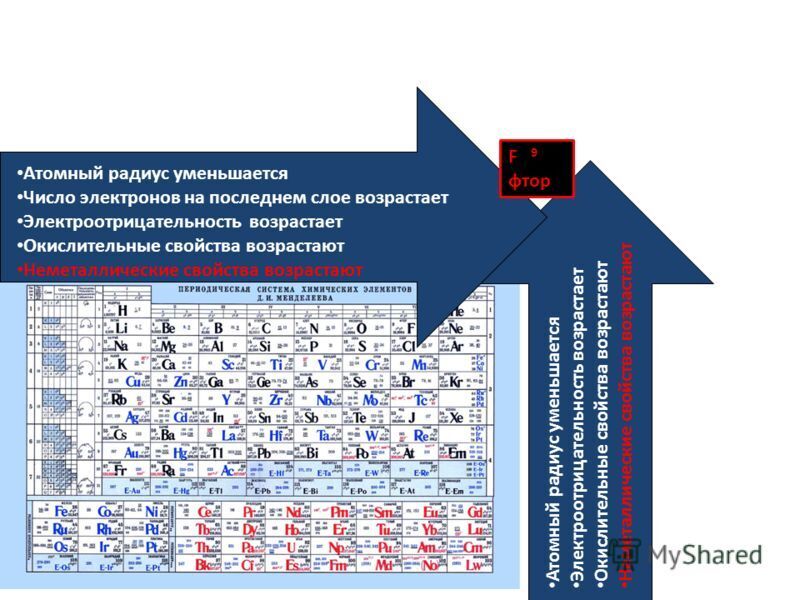 Краун-эфиры представляют собой органические молекулы и классифицируются как «циклические полиэфиры». Эти кольцевые молекулы имеют атомы кислорода, которые могут координироваться с ионом, разделенным короткими участками CH 2 звеньев и имеют общий вид (СН 2 СН 2 О) n , где n — количество этих звеньев, составляющих кольцо.
Краун-эфиры представляют собой органические молекулы и классифицируются как «циклические полиэфиры». Эти кольцевые молекулы имеют атомы кислорода, которые могут координироваться с ионом, разделенным короткими участками CH 2 звеньев и имеют общий вид (СН 2 СН 2 О) n , где n — количество этих звеньев, составляющих кольцо.
Один из наиболее распространенных краун-эфиров называется 18-краун-6 (см. рис. 1). «18» означает, что основу кольца составляют 18 атомов; слово «краун» показывает, что это краун-эфир, а число «6» говорит нам, что кольцо содержит шесть атомов кислорода: n равно 6.
Эти молекулы могут избирательно связываться с различными ионами щелочных металлов. Ионы разного размера избирательно связываются кольцами разного размера. Например, 18-краун-6 связывает Li + < Na + , Cs + < Rb + < K + поэтому в смеси различных ионов он будет селективно связывать калий.
Рисунок 1: Структура краун-эфира 18-краун-6 H 2 C-CH 2 / \ H 2 C-O O-CH 2 / \ H 2 C CH 2 | | О О | | H 2 C CH 2 \ / H 2 C-O O-CH 2 \ / H 2 C-CH 2
Криптанды сходны по своему комплексообразованию с ионами щелочных металлов, но более селективны. Они также отличаются тем, что содержат атомы азота для координации с металлом, а также с кислородом. Криптанды содержат два атома азота, которые связаны тремя эфирными цепями. Распространенным криптандом является 2,2,2-крипт, который имеет структуру N(CH 2 CH 2 OCH 2 CH 2 OCH 2 CH 2 ) 5.) ион металла координируется с ним через все шесть атомов кислорода и оба атома азота.
Использование этого лиганда привело к открытию некоторых очень странных соединений. При добавлении 2,2,2-крипта к охлажденному раствору натрия в этиламине кристаллизовалось соединение с формулой [Na(2,2,2-крипт)] + Na — . Он стабилен только при температуре ниже -10 °C. Такие соединения, содержащие отрицательно заряженных ионов натрия, называются «содидами». Есть также примеры соединений, известных как «электриды», в которых ион натрия заменен электроном, например [Cs(crypt)] + и — .
При добавлении 2,2,2-крипта к охлажденному раствору натрия в этиламине кристаллизовалось соединение с формулой [Na(2,2,2-крипт)] + Na — . Он стабилен только при температуре ниже -10 °C. Такие соединения, содержащие отрицательно заряженных ионов натрия, называются «содидами». Есть также примеры соединений, известных как «электриды», в которых ион натрия заменен электроном, например [Cs(crypt)] + и — .
Эти типы инкапсулирующего лиганда имитируют поведение циклических полипептидов, которые играют роль в транспорте ионов щелочных и щелочноземельных металлов через клеточные мембраны.
Металлоорганические соединения щелочных металлов
Литийорганические соединения имеют большое значение для органической химии в качестве источников R — , где R представляет собой органическую группу (например, алкильную группу). Соединения RLi растворимы в большинстве органических растворителей, могут быть жидкими, очень реактивными и чувствительными к влаге. Большинство из них самовозгораются при контакте с воздухом и требуют осторожного обращения. Их лучше всего получать прямой реакцией между металлическим литием и органическим галогенидом, например:
Большинство из них самовозгораются при контакте с воздухом и требуют осторожного обращения. Их лучше всего получать прямой реакцией между металлическим литием и органическим галогенидом, например:
2 Li + C 2 H 5 Cl → C 2 H 5 Li + LiCl
Большинство литийорганических соединений имеют значительный ковалентный характер. Метиллитий, CH 3 Li, в твердом состоянии состоит из тетраэдрических расположений атомов лития с четырьмя метильными группами, занимающими грани этого тетраэдра. Метильные группы образуют четыре центрально-двухэлектронные ковалентные связи с тремя атомами лития на занимаемой ими грани.
Натрий и калий также образуют металлоорганические соединения, но они в основном ионные и плохо растворимы в органических растворителях. Однако они чрезвычайно реактивны. Реакция металла может реагировать с органическими молекулами, в которых определенные атомы водорода имеют слабокислую реакцию.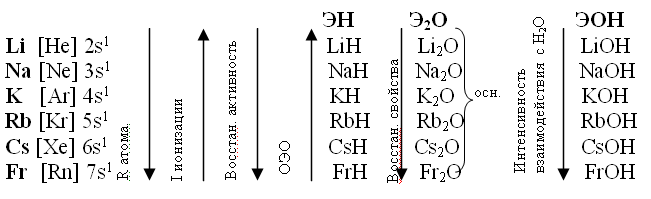




 0983
0983 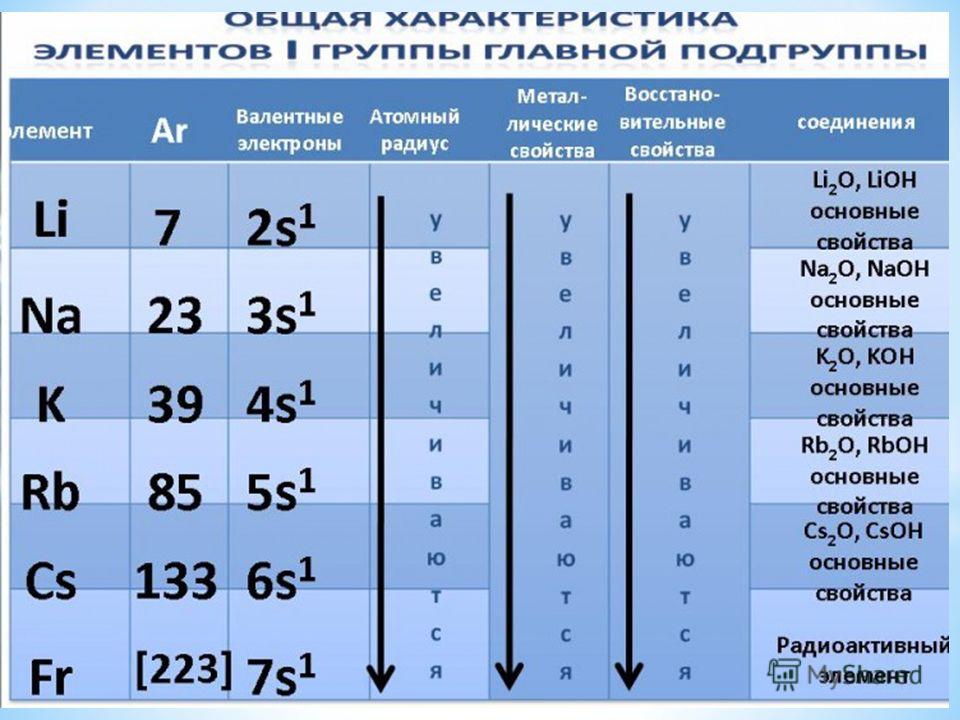
Leave A Comment