Тест 8 кл химия «Кислоты»
1. Окраска лакмуса в кислой среде:
а) красная б) малиновая в) бесцветная г) синяя
2. Двухосновной и кислородосодержащей кислотой является:
3. Укажите формулу оксида, который отвечает азотной кислоте:
4. Бескислородной кислотой является
а) с оксидом меди (II) в) с гидроксидом магния
б) с медью г) с магнием
6) Формула сероводородной кислоты:
а) H2SO4 б) H2S в) H2SO3 г) HCl
7) С раствором серной кислоты взаимодействует
а) Ag б) CuO в) P2O5 г) Na2SO4
8) В реакцию с азотной кислотой вступает
а) кремниевая кислота в) оксид углерода (IV)
б) нитрат натрия г) гидроксид бария
9) Раствор соляной кислоты реагирует с каждым из двух веществ:
а) Zn и CuO б) Mg и HCl в) Cu(OH)2 и N2 г) BaCl2 и H2
10) С раствором соляной кислоты не взаимодействует
а) оксид калия в) оксид углерода (II)
б) гидроксид цинка г) карбонат натрия
11) При взаимодействии карбоната кальция с азотной кислотой образуется .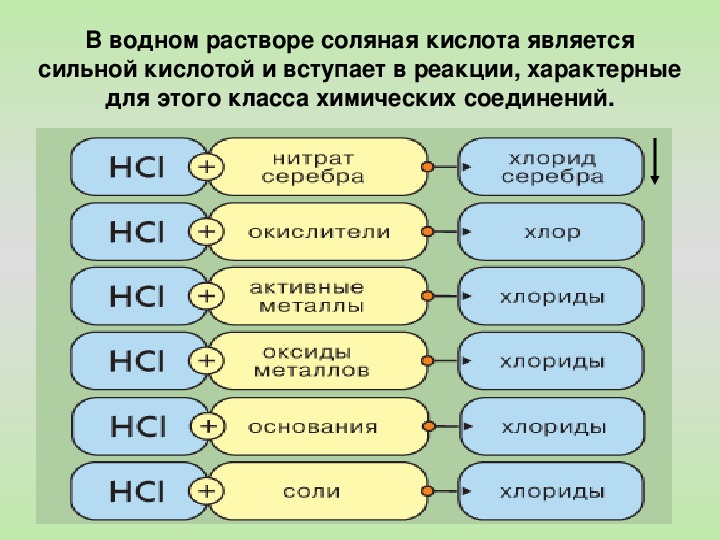 ……….
……….
12) Количество атомов водорода в кислоте называется ………
13) кислота + основание образуется ……… + ……….
14) С растворами кислот взаимодействуют металлы, находящиеся ………
15) Реакция между раствором соляной кислоты и медью невозможна, потому что ………
16) H2CO3 называется ………
17) азотная кислота диссоциирует на …….. и …………
18) ……….. +…………= соль + вода
Кислоты
2 вариант
1. Данную кислоту нельзя распознать действием лакмуса
а) HCl б) H2SO4 в) H2CO3 г) H2SiO3
2. Трёхосновной и кислородосодержащей кислотой является:
а) сероводородная б) хлороводородная
в) серная г) фосфорная
3. Укажите формулу оксида, который отвечает азотистой кислоте:
а) N2O3 б) NO2 в) NO г) N2O5
4. Кислородосодержащей и одноосновной кислотой является
Кислородосодержащей и одноосновной кислотой является
а) с оксидом меди (II) в) с сульфидом железа
б) с карбонатом натрия г) с магнием
6) Формула соляной кислоты:
а) H2SO4 б) H2S в) H2SO3 г) HCl
7) С раствором серной кислоты не взаимодействует
а) AgОН б) CuO в) P2O5 г) ВаСl2
8) В реакцию с соляной кислотой вступает
а) кремниевая кислота в) оксид углерода (IV)
б) медь г) гидроксид натрия
9) Раствор серной кислоты реагирует с каждым из двух веществ:
а) Zn и CuO б) Mg и HCl в) Cu(OH)2 и N2 г) BaCl2 и H2
10) С раствором соляной кислоты взаимодействует
а) ртуть в) оксид углерода (II)
б) гидроксид цинка г) сульфат бария
11) При взаимодействии оксида меди (II) с азотной кислотой образуется ………..
12) Реакция между кислотой и щёлочью называется . ……..
……..
13) кислота + соль образуется ……… + ……….
14) С растворами кислот взаимодействуют соли, если ………
15) Реакция между раствором соляной кислоты и нитратом натрия невозможна, потому что ………
16) H2SO3 называется …….
17) Серная кислота диссоциирует на ………. и …………
18) ……….+ ………… = соль + Н2↑
Ответы
Медь в элект.ряду стоит правее водорода
2 вариант
Нитрат меди (II) + вода
Реакцией нейтрализации
Новая кислота + новая соль
В результате реакции образуется осадок, газ, вода
Не образуется ни осадка, ни газа, ни воды
16
17
18
1 вариант
Угольной кислотой
Катион водорода и нитрат анион
Основной оксид + кислота
и др. варианты
варианты
2 вариант
Сернистой кислотой
На 2 катиона водорода и сульфат анион
Металл + кислота
36. в реакцию с раствором серной кислоты вступает 1) медь 2) вода 3) нитрат меди(ii) 4) оксид меди(ii)конец формы начало формы 37. в реакцию с раствором гидроксида бария вступает 1) сульфат натрия 2) сульфид меди(ii) 3) медь 4) азотконец формы начало формы 38. в результате взаимодействия гидроксида меди(ii) с соляной кислотой образуются 1) cuo, h3 и cl2 2) cucl2 и h3o 3) cuoh и cl2 4) cucl2 и h3конец формы начало формы 39. при добавлении по каплям раствора гидроксида натрия к раствору хлорида цинка наблюдается 1) выделение газа 2) появление студенистого осадка и растворение его 3) изменение окраски раствора 4) появление запахаконец формы начало формы 40. углекислый газ образуется при взаимодействии соляной кислоты с 1) гидроксидом кальция 2) карбонатом кальция 3) нитратом серебра 4) сульфатом натрияконец формы начало формы 41.
 реакция возможна между гидроксидом магния и 1) медью 2) кислородом 3) сульфатом натрия 4) азотной кислотойконец формы начало формы 42. в реакцию с раствором гидроксида кальция вступает каждое из двух веществ: 1) co2 и cucl2 2) cuo и hcl 3) hno3 и nacl 4) al(oh)3 и kno3конец формы начало формы 43. с раствором ортофосфорной кислоты реагирует 1) медь 2) оксид углерода(iv) 3) сульфат калия 4) гидроксид натрияконец формы начало формы 44. при взаимодействии соляной кислоты и силиката натрия образуется хлорид натрия и 1) si и h3o 2) sih5 и o2 3) sio2 и h3 4) h3sio3конец формы начало формы 45. с раствором гидроксида калия реагирует каждое из двух веществ 1) оксид магния и гидроксид цинка 2) оксид серы(vi) и азотная кислота 3) сероводород и углерод 4) хлороводородная кислота и водородконец формы начало формы 46. с раствором гидроксида бария реагирует каждое из двух веществ: 1) оксид меди(ii) и гидроксид цинка 2) оксид углерода(iv) и соляная кислота 3) сероводород и серебро 4) кремниевая кислота и водородконец формы начало формы 47.
реакция возможна между гидроксидом магния и 1) медью 2) кислородом 3) сульфатом натрия 4) азотной кислотойконец формы начало формы 42. в реакцию с раствором гидроксида кальция вступает каждое из двух веществ: 1) co2 и cucl2 2) cuo и hcl 3) hno3 и nacl 4) al(oh)3 и kno3конец формы начало формы 43. с раствором ортофосфорной кислоты реагирует 1) медь 2) оксид углерода(iv) 3) сульфат калия 4) гидроксид натрияконец формы начало формы 44. при взаимодействии соляной кислоты и силиката натрия образуется хлорид натрия и 1) si и h3o 2) sih5 и o2 3) sio2 и h3 4) h3sio3конец формы начало формы 45. с раствором гидроксида калия реагирует каждое из двух веществ 1) оксид магния и гидроксид цинка 2) оксид серы(vi) и азотная кислота 3) сероводород и углерод 4) хлороводородная кислота и водородконец формы начало формы 46. с раствором гидроксида бария реагирует каждое из двух веществ: 1) оксид меди(ii) и гидроксид цинка 2) оксид углерода(iv) и соляная кислота 3) сероводород и серебро 4) кремниевая кислота и водородконец формы начало формы 47. раствор гидроксида бария не реагирует с 1) железом 2) оксидом серы(vi) 3) сульфатом натрия 4) фосфорной кислотой конец формы начало формы 48. в реакцию с хлоровородной кислотой вступает 1) оксид кремния 2) оксид серы(iv) 3) оксид углерода(iv) 4) оксид магнияконец формы начало формы 49. водород из раствора фосфорной кислоты может вытеснить 1) железо 2) медь 3) золото 4) сереброконец формы начало формы 50. раствор азотной кислоты реагирует с каждым из двух веществ: 1) zn и cu(oh)2 2) mgo и hcl 3) no2 и so3 4) ba(no3)2 и h3конец формы
раствор гидроксида бария не реагирует с 1) железом 2) оксидом серы(vi) 3) сульфатом натрия 4) фосфорной кислотой конец формы начало формы 48. в реакцию с хлоровородной кислотой вступает 1) оксид кремния 2) оксид серы(iv) 3) оксид углерода(iv) 4) оксид магнияконец формы начало формы 49. водород из раствора фосфорной кислоты может вытеснить 1) железо 2) медь 3) золото 4) сереброконец формы начало формы 50. раствор азотной кислоты реагирует с каждым из двух веществ: 1) zn и cu(oh)2 2) mgo и hcl 3) no2 и so3 4) ba(no3)2 и h3конец формыОтвет разместил: Гость
Этиламин взаимодействует с 1) водой (h3o), 2) соляной кислотой (hcl), 5) фосфорной кислотой взаимодействие с водой: ch4nh3 + h3o = [ch4nh4](+) взаимодействие с кислотами: ch4nh3 + hcl = [ch4nh4](+) ch4nh3 + h4po4 = [ch4nh4](+)
Соляная кислота взаимодействие с металлами
Опыт 2. Соляная кислота взаимодействует с активными металлами. В пробирки полол ить в одну кусочек цинка, в другую магния, в третью ж елезный гвоздик и налить разбавленной соляной кислоты (1 1). Отметить выделение водорода и написать уравнения соответствующих реакций. [c.152]
Отметить выделение водорода и написать уравнения соответствующих реакций. [c.152]Пользуясь рядом стандартных электродных потенциалов, определите, с какими из перечисленных в скобках металлов (Zn, F , Al, Си. Со, Pi, d ) будет взаимодействовать соляная кислота. [c.171]
Почему соляная кислота взаимодействует с цинком и многими другими металлами (как ), а безводный сжиженный хлористый водород не вступает с ними в реакции [c.67]
Взаимодействие с разбавленной серной кислотой. Взаимодействие металлов с разбавленной серной кислотой осуществляется так же, как и с соляной кислотой
Эквивалент металла равен 8,99. Какой объем водорода (при —3°С и 106,6 кПа) получится при взаимодействии 0,4495 г металла с соляной кислотой [c.14]
При взаимодействии 2,25 г некоторого металла, принадлежащего к элементам второй группы Периодической системы, с соляной кислотой выделяется 5,6 л (при н у. ) водорода. Какой это металл [c.15]
) водорода. Какой это металл [c.15]
Укажите, какие хлориды цинка, меди, железа и алюминия могут быть получены при непосредственном взаимодействии простых вешеств, и какие — при действии хлороводорода (или соляной кислоты) на металл.
Решение. Из двух металлов с раствором соляной кислоты взаимодействует только магний [c.24]
Важной особенностью таких растворов является то, что химические свойства электролита в них как бы складываются из свойств соответствующих ионов в таких растворах. Логически это понятно, так как если недиссоциированных молекул в растворе практически нет, то и на свойства раствора они не влияют. Это приводит, например, к появлению у электролитов групповых химических свойств, присущих всем электролитам, содержащим ион данного вида. Так, все хлориды и соляная кислота содержат ион хлора, и поэтому им свойственна реакция-образования осадка А С1 при взаимодействии с AgNOз. Подобные групповые реакции широко используются в аналитической химии.
Важнейшее химическое свойство оснований — способность образовывать соли с кислотами. Наиример, при взаимодействии перечисленных оснований с соляной кислотой получаются хлористые соли соответствующих металлов —. хлориды натрия или меди
Наиример, при взаимодействии перечисленных оснований с соляной кислотой получаются хлористые соли соответствующих металлов —. хлориды натрия или меди
Как известно, взаимодействие металлов с серной кислотой происходит различно в зависимости от концентрации кислоты и природы металла. Разбавленная серная кислота действует на металлы подобно разбавленной соляной кислоте растворяет металлы, стоящие в ряду напряжений до олова включительно. Приэтом водородные ионы разведенной НзЗО. окисляют атомы металла, отдающие электроны. Так, например, окисление атомов двухналентного металла (Ме) может быть представлено схемой [c.95]
Слейте соляную кислоту с металла, снова промойте его водой и прилейте 5—10 капель концентрированной азотной кислоты. Осторожно нагрейте пробирку на маленьком пламени горелки и отметьте взаимодействие алюминия с азотной кислотой при нагревании. Какой газ выделяется Напишите уравнение реакции взаимодействия алюминия с концентрированной азотной кислотой при нагревании.
В конце IX в. арабский алхимик Гебер открыл способность смеси азотной и соляной кислот взаимодействовать с золотом. Смесь получила название царской водки за уникальную способность, не свойственную водкам , т. е. кислотам, растворять золото — царя всех металлов. Природа этого растворения имеет комплексный характер. Известно, что золото очень устойчиво к окислителям. Но эта устойчивость ослабляется в присутствии лигандов вследствие комплексообразования. В царской водке такими лигандами являются хлорид-ионы
В воде FeS нерастворим поэтому, накапливаясь на поверхности металла, сернистое железо играет до некоторой степени роль защитной пленки, предотвращающей дальнейшую коррозию. При взаимодействии FeS с соляной кислотой пленка превращается в хлорное железо, легко растворимое в воде. Наличие соляной кислоты способствует обнажению чистого металла, и его коррозия возрастает. Поэтому содержание солей в нефтях, выделяющих при переработке h3S, особенно опасно. Следовательно, сернистые нефти необходимо предварительно полностью обессоливать. Хлориды способствуют увеличению образования сероводорода при перегонке примерно в 2—3 раза. Сероводород (HgS) крайне ядовитый газ, вызывающий отравление обслуживающего персонала и загрязнение атмосферного воздуха.
Следовательно, сернистые нефти необходимо предварительно полностью обессоливать. Хлориды способствуют увеличению образования сероводорода при перегонке примерно в 2—3 раза. Сероводород (HgS) крайне ядовитый газ, вызывающий отравление обслуживающего персонала и загрязнение атмосферного воздуха.
Рассматриваемые металлы расположены в ряду напряжений до водорода. Галлий и индий растворяются в разбавленных кислотах. В соответствии с устойчивой степенью окисления Т1 при взаимодействии с кислотами образует производные Т1 (I). Галлий в соляной кислоте пассивируется за счет образования нерастворимого в воде Т1С1. [c.463]
Взаимодействие марганца с кислотами. Небольшие кусочки металла, полученного в предыдущем опыте (королек разбейте в стальной ступке), поместите в три пробирки. В одну пробирку добавьте 1—2 мл разбавленной соляной кислоты, во вторую — разбавленной серной, в третью — раствора щелочи. Наблюдайте растворение марганца в кислотах и отсутствие растворения в щелочи.
Хлористоводородные растворы представляют все свойства виергической кислоты. Они не только превращают синие растительные цвета в красные, вытесняют из углекислых солей углекислый газ и т. п., но и насыщают вполне основания, даже такие энергические, как, напр., кали, известь и т. п. В сухом состоянии газа, хлористый водород, однако, не изменяет растительных цветов и не производит многих двойных разложений, какие легко совершаются в присутствии воды. Это объясняется тем, что упруго-газообразное состояние хлористого водорода препятствует ему вступать во взаимодействие. Однако, накаленное железо, цинк, натрий и т. п. действуют на газообразный хлористый водород, вытесняя водород, и именно, оставляя половину объема водорода против одного объема взятого хлористого водорода, что может служить и для определения состава хлористого водорода.
Осадок растворяют в соляной кислоте при этом образуются хлорид металла и свободный оксихинолин. К раствору прибавляют бромистый калий и титруют его из бюретки раствором КВгО, известной концентрации. При взаимодействии КЕгО, и КВг в кислой среде выделяется бром, реагирующий с оксихинолином. После превращения всего оксихинолина в бромпроизводное в растворе появляется избыток брома, который легко обнаружить по обесцвечиванию им красителей.
После превращения всего оксихинолина в бромпроизводное в растворе появляется избыток брома, который легко обнаружить по обесцвечиванию им красителей.
Хлорное железо легко растворяется в воде, а выделяющийся сероводород вновь вступает во взаимодействие с металлом и т. д. Следовательно, комбинированное действие двух таких корродирующих агентов, как сероводород и соляная кислота, приводит к весьма активному разъеданию аппаратуры. [c.135]
Соли МДЭСи (красного цвета) образуются при взаимодействии соединений Рс1 (II) и Р1 (II) в соляной кислоте с соответствующими солями щелочных металлов. Наиболее важны растворимые [c.653]
Вычислите массовую долю (%) металла в смеси с его оксидом, зная объем водорода, выделившегося при взаимодействии смеси с соляной кислотой. [c.150]
Взаимодействие с кислотами. 1. К 1—2 кусочкам цинка в отдельных пробирках добавьте по 8—10 капель разбавленной и концентрированной соляной кислоты. Отметьте интенсивность взаимодействия металла с кислотой в каждом случае. Аналогичные опыты проделайте с разбавленными и концентрированными Н2804 и НЫОз (опыт проводите в вытяжном шкафу). [c.256]
Отметьте интенсивность взаимодействия металла с кислотой в каждом случае. Аналогичные опыты проделайте с разбавленными и концентрированными Н2804 и НЫОз (опыт проводите в вытяжном шкафу). [c.256]
Причини, по которым данное соединение является хорошим ингибитором для железа и плохим для цинка или наоборот, могут быть связаны также со специфическим электронным взаимодействием полярных групп с металлом (хемосорбцией). Последний фактор в определенных случаях более важен, чем стерический, определяющий возможности для плотнейшей упаковки адсорбированных молекул. Это можно проиллюстрировать очень значительным ингибирующим действием оксида углерода СО, растворенного в соляной кислоте, на коррозию в ней нержавеющей стали [36] (степень защиты 99,8%, в 6,3 М растворе НС1 при 25 °С). Об этом же свидетельствует защита железа, обеспечиваемая малым количеством иодида в разбавленных растворах Н2504 [35, 37, 38]. Как СО, так и иодид хемосорбируются на поверхности металла, препятствуя в основном протеканию анодной реакции [39]. Кеше [40] показал, что 10″ т К1 значительно лучше ингибирует железо в 0,5 т растворе N32804 с pH = 1 (степень защиты 89 %), чем в растворе с pH = 2,5 (степень защиты 17 %). Это показывает, что адсорбция иодида в этом интервале pH зависит от значения pH [c.270]
Кеше [40] показал, что 10″ т К1 значительно лучше ингибирует железо в 0,5 т растворе N32804 с pH = 1 (степень защиты 89 %), чем в растворе с pH = 2,5 (степень защиты 17 %). Это показывает, что адсорбция иодида в этом интервале pH зависит от значения pH [c.270]
Хроматы щелочно-земельных металлов. В три пробирки налейте небольшое количество растворов солей кальция, стронция, бария и добавьте к ним раствор хромата калия. Хроматы каких металлов выпадают в осадок Отметьте цвет полученных веществ и проверьте их взаимодействие с раствором уксусной и соляной кислот. [c.251]
Результат опыта. Из всех металлов только цинк бурно реагирует с раствором соляной кислоты. С поверхности цинковой пластинки интенсивно выделяются многочисленные пузырьки газа. Поверхность пластинок из меди и серебра остается неизменной — пузырьков газа не образуется, что свидетельствует об отсутствии реакции взаимодействия этих металлов с кислотой. [c.129]
Смесь, состоящая из 1 объема азотной и 3—4 обт>емов концен трнрованной соляной кислоты, называется царской водкой. Цар ская водка растворяет некоторые металлы, пе взаимодействующие с азотной кпслотой, в то.ч числе и царя металлов — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием. клороксида азо-rai ni), пл[1 хлорида нитрозила, NO I [c.414]
Цар ская водка растворяет некоторые металлы, пе взаимодействующие с азотной кпслотой, в то.ч числе и царя металлов — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием. клороксида азо-rai ni), пл[1 хлорида нитрозила, NO I [c.414]
Термохимическое воздействие иа ПЗП — процесс подачи на забой скважины соляной кислоты, нагретой в результате взаимодействия с металлом. В качестве реагирующего с НС1 металла обычно используют магний или его сплавы (МЛ-1, МА-1 и др.), кмторые в специальном наконечнике устанавливают в обрабатываемом интервале. [c.17]
Взаимодействие хрома с соляной и разбавленной серной кислотами. В две пробирки поместите по 0,1 г порошка хрома и прибавьте в первую пробирку концентрированную соляную, а во вторую — разбавленную серную кислоту. Содержимое пробирки слегка подогрейте и наблюдайте интенсивное взаимодействие металла с кислотами. Каков цвет )астворов и соответствует ли он окраске солей хрома (II) 2сли нет, то почему [c. 148]
148]
Подобные процессы происходят и прп реакциях, в ходе которых малорастворимое вещество превращаегся в растворимый, по слабо диссоциирующий продукт. К таким реакциям относится, например, растворение сульфидов некоторых металлов в соляной кислоте. Так, взаимодействие сульфида марганца с соляной кислотой выражается уравнением [c.256]
Проведен термодинамический анализ взаимодействия ксяшояен-тов флюса на основе хлористого цинка с окисной пленкой. Рассчитаны величины изобарного потенциала для взаимодействия 2% раствора соляной кислоты с металлами и их окислами. Показано, что флюсующее действие 1-2% раствора соляной кислоты при низкотемпературной пайке связано с процессом диспергирования окисной пленки в результате протекания реакции между соляной кислотой и паяемым металлом. [c.129]
Нет ни одного катализатора, который в условиях реакции не вступал б ы во взаимодействие с фенолом или альдегидом. Так, напрНмер, соляная кислота взаимодействует с формальдегидом с образованием монохлбрметилового спирта и оксихлорметило-вого эфира, щелочи с фенолами дают феноляты. Фенолы можно рассматривать как слабые кислоты, а феноляты щелочных и щелочноземельных металлов как соли сильных оснований с слабыми кислотами. Феноляты в присутствии избытка фенила, [c.27]
Фенолы можно рассматривать как слабые кислоты, а феноляты щелочных и щелочноземельных металлов как соли сильных оснований с слабыми кислотами. Феноляты в присутствии избытка фенила, [c.27]
Соли MgiB lJ (красного цвета) образуются при взаимодействии -оединений Pd (II) и Pt (II) в соляной кислоте с соответствующими олями щелочных металлов. Наиболее важны растворимые в воде KolPt lJ и NaJPt lJ (рис. 243), являющиеся исходными вещест- [c.614]
В ряду напряжений все три элемента располагаются правее водорода, причем медь стоит почти рядом с ним, а золото — дальше всех остальных металлов. Поэтому в растворах таких кислот, как НС1, h3SO4 и т. п., при отсутствии окислителей не растворяется даже медь. В кислотах, одновременно являющихся окислителями (HNO3 и т. п.), медь и серебро растворяются легко, а золото лишь в том случае, когда окислительные свойства кислоты выражены особенно сильно. Лучшим растворителем для него является насыщенная хлором соляная кислота, взаимодействую- [c. 388]
388]
Используя значения стандартных электродных потенциалов, объясните, какой из металлов (железо или олово), будет энергичнее взаимодействовать с разбавленной соляной кислотой. Определите АСгэв соответствующих процессов. [c.104]
В растворах же состав может меняться непрерывно без существенного изменения химических свойств. Так, количество H l в растворе соляной кислоты может доходить до 37%, причем все растворы соляной кислоты будут обладать химическими свойствами, характерными для данной кислоты (взаимодействие со и елочами, с металлами и пр.), при этом однородность растворов кислоты не изменится. Это свойство понятно из приведенного здесь в виде обратимой реакщ и механизма образования раствора. Уравнение обратимой реакции показывает, что в растворе все время находятся в равновесии сольваты разного состава, поэтому изменение количества растворителя в растворе приведет лишь к изменению соотношения между этими сольватами, но не нарушит однородности и не изменит в некоторых пределах химических свойств раствора. [c.29]
[c.29]
Газоанализатор хлористого водорода
Хлористый водород
Из всего ряда галогеноводородов наиболее известен хлористый водород (хлороводород), причина его популярности в широком использовании водного раствора этого соединения – соляной кислоты. В чистом виде хлороводород, при нормальных условиях, находится в газообразном состоянии, он отличается токсичностью, высокой гигроскопичностью, резким запахом и не имеет цвета.
Свойства хлороводорода и его водного раствора
Газообразный хлористый водород — пары соляной кислоты тяжелее воздуха, его плотность составляет 1,639 г/л, из-за гигроскопичности притягивает атмосферную влагу, которая формирует своеобразное облако в местах скопления этого газа. При охлаждении до -85°C, газообразный HCl переходит в жидкое состояние, твердеет при 114°C, нагревание до 1500°C приводит к распаду соединения на элементарные составляющие. Растворимость в воде очень высокая – до 450 объемных частей на одну часть воды.
Растворимость в воде очень высокая – до 450 объемных частей на одну часть воды.
Без воды хлороводород малоактивен, но при нагревании до 650°C, газ реагирует с оксидами металлов переходной группы, с солями – карбидами, боридами, сульфидами и нитридами. В присутствии соединений-акцепторов, способен взаимодействовать с некоторыми гидридами.
Водный хлороводородный раствор намного активнее, представляя собой довольно сильный окислитель, он вступает в характерные реакции: с металлами с образованием хлоридов и водорода, а также со щелочами – реакции нейтрализации, в результате которых образуются те же хлориды и вода. При реакции замещения с солями слабых кислот, хлор соединяется с металлом, вытесняя остаток слабой кислоты. При взаимодействии с органикой соляная кислота образует хлоргидраты (органические соли).
Получение и использование
Традиционно, раствор хлористого водорода получали посредством взаимодействия поваренной соли (NaCl) и серной кислоты, но из-за невысокой чистоты готового продукта и малой эффективности, этот метод не применяется в современной промышленности. Хлорид водорода получают прямой реакцией химических элементов в условиях высокой температуры.
Хлорид водорода получают прямой реакцией химических элементов в условиях высокой температуры.
Полученный таким способом газообразный хлороводород, почти весь используется для получения раствора. Соляная кислота нужна в металлургии для удаления загрязнений с металлической поверхности, с ее помощью из руд получают металлы с высокой степенью очистки. Раствор HCl активно используется в синтезе материалов органической группы (гидрогалогенирование), служит сырьем при получении хлора. В медицине, это вещество в смеси с пепсином – эффективное средство лечения некоторых желудочных патологий, а в пищевом производстве, как добавка E507, выполняет функцию регулятора кислотности.
Хлористый водород относится к веществам 3-го класса опасности, при небольшом превышении ПДК хлористого водорода для производственных зон – свыше 5 мг/м3, возникают признаки легкого отравления в виде раздражения органов дыхания, при увеличении количества до 50 мг/м3, наступает острая фаза с охриплостью голоса, кашлем и приступами удушья. Концентрация свыше 75 мг/м3 непереносима, она приводит к серьезным последствиям, вплоть до потери сознания. На тех предприятиях, где используется соляная кислота контроль за содержанием хлороводорода жизненно необходим, применение эффективных газоанализаторов соляной кислоты ХЛВ1.0 от производителя ИНКРАМ позволит обезопасить производство и сохранить здоровье людей.
Концентрация свыше 75 мг/м3 непереносима, она приводит к серьезным последствиям, вплоть до потери сознания. На тех предприятиях, где используется соляная кислота контроль за содержанием хлороводорода жизненно необходим, применение эффективных газоанализаторов соляной кислоты ХЛВ1.0 от производителя ИНКРАМ позволит обезопасить производство и сохранить здоровье людей.
Газоанализатор серии А200, А300
Газоанализатор серии В300, С300
Соляная кислота — Её свойства, воздействие на человека
Соляная кислота – вещество неорганического происхождения. Относится к списку очень сильных кислот. Имеет несколько названий: хлористый водород, хлористоводородная кислота, хлористоводородная кислота.
Свойства Соляной кислоты
Хлористый водород в чистом виде является прозрачной жидкостью без запаха и оттенков. Но чаще всего используется техническая кислота. Она имеет примеси, поэтому обладает желтоватым оттенком. Хлористоводородная кислота, на открытом воздухе вступает в реакцию с воздухом. В процессе реакции от влаги воздуха и кислоты образуется туман.
Но чаще всего используется техническая кислота. Она имеет примеси, поэтому обладает желтоватым оттенком. Хлористоводородная кислота, на открытом воздухе вступает в реакцию с воздухом. В процессе реакции от влаги воздуха и кислоты образуется туман.
Соляная кислота отлично растворяется в воде. В основном используется кислота высокой концентрации от 36.6% до 24%. Хлористый водород замечательно вступает в реакции с различными веществами:
- Металлы.
- Оксиды.
- Гидрооксиды
- Более слабые кислоты
- Аммиак.
Чем опасна соляная кислота
Хлористоводородная кислота является крайне опасным веществом. Оно едкое, способно разъесть кожу человека, органические материалы, а также металлические предметы. При взаимодействии с воздухом выделяется ядовитый пар. Он может привести к удушью, ожогам слизистой и кожи, разрушает зубы. Соляная кислота имеет 2 класс опасности.
Работы с соляной кислотой необходимо производить с особой осторожностью. При не больших объемах используют защиту органов дыхания (противогазы) и защитную одежду:
При не больших объемах используют защиту органов дыхания (противогазы) и защитную одежду:
Ликвидацию аварий, при разливе соляной кислоты производят ее нейтрализацию большим количеством воды и раствором щелочей. Пострадавших от воздействия хлористого водорода сначала выводят из опасной зоны. Потом промывают кожу и глаза большим количеством воды и госпитализируют в мед учреждение для оказания помощи.
Перевозят соляную кислоту в пластмассовой или стеклянной таре. Большие объемы могут перевозить в металлической таре. Но металлические бочки или цистерны должны быть обработаны изнутри резиновым слоем. Вся тара должна быть герметично закрыта, чтобы избежать реакцию с воздухом.
Производство кислоты
На производстве соляная кислота получается из газообразного хлороводорода. Изначальное вещество хлороводород получается двумя способами:
- При взаимодействии хлора и водорода экзотермический способ – высокая чистота вещества
- Из сопутствующих газов при производстве других веществ – техническая кислота.

Применение
Соляная кислота используется во многих отраслях:
- Фарм. производство – препараты для восстановления кислотности желудочного сока.
- Пищевая промышленность – производство пищевых добавок (регулятор кислотности Е507), фруктозы, желатина, лимонной кислоты.
- Химическая промышленность – для получения хлора, хлорида металлов, соды.
- Металлургия – обработка металла перед пайкой, гальванированием.
- Лаборатории – в процессах исследований и для очистки инвентаря.
- В производстве каучука, бумаги – для очистки котлов, труб, керамических изделий.
Интересный факт
Соляная кислота содержится в желудке человека. Конечно, ее концентрация не высока всего 0.4%. НО такого количества достаточно для растворения лезвия бритвы за неделю! Желудок самостоятельно производит раствор соляной кислоты. Сам желудок защищен слизистой оболочкой. Слизистая ежедневно обновляется, чтобы заменить поврежденные участки. Кислота необходима для переваривания пищи и защиты организма от микробов.
Сегодня сложно обойтись без соляной кислоты. Она требуется во многих производственных процессах и медицине. В тоже время, это опасное химическое вещество. Оно требует соблюдения техники безопасности. В случае утечки, разлива соляной кислоты для устранения аварии и последствий требуется специальная одежда костюмы химзащиты. Наилучший выбор изолирующие и защитные костюмы серии Стрелец.
гидроксид бария, нитрат серебра, сульфат меди 2, нитрат натрия, сульфит, химия
Ардашер1998 / 23 апр. 2013 г., 8:12:10
вещества: 1) CO2 2) Fe (сталь) 3) SiO2 (кварц) 4) Br2 5) Al 6) NO2 7)h3O
задание№2
Средство против гололёда, применяемое в Москве, реагирует с 20%-ной соляной кислотой. при реакции 10,0 г средства с кислотой выделяется 2,22 л газа (н.у.) который не обесцвечивает раствор перманганата калия. данное противогололедное средство может реагировать и с 20%-ной серной кислотой с выделением того же газа, но гораздо медленнее.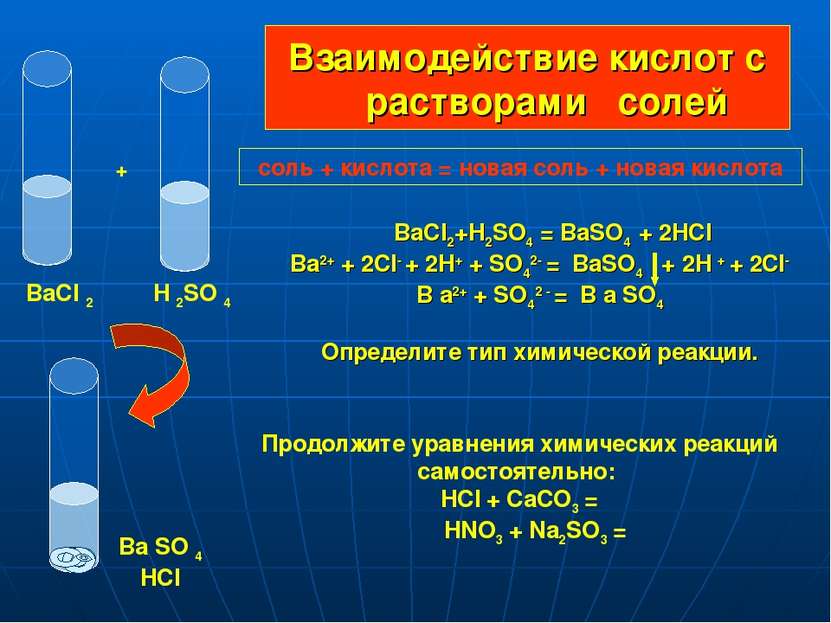 определите состав противогололедного средства, напишите уравнения перечисленных реакций. почему серная кислота реагирует медленнее? на че основано противогололедное действие данного средства?
определите состав противогололедного средства, напишите уравнения перечисленных реакций. почему серная кислота реагирует медленнее? на че основано противогололедное действие данного средства?
задание №3 напишите 2 уравнения окислительно — восстановительных реакций, в одном из которых азот в виде простого вещества проявляет свойства окислителя, а в другом — свойства восстановителя. укажите условия проведения этих реакций.
задание №4 слили попарно следующие растворы:
а) 5%-ный хлорид бария и 4%-ный сульфат натрия;
б) аммиачную воду и 10%-ную соляную кислоту ;
в)известковую воду и газированную минеральную воду;
г) 6%-ный сульфит натрия и 10%-ную соляную кислоту;
д) известковую и аммиачную воду;
для той пары равстворов, при сливании которой выделился газ, укажите молекулярную массу газа (округлите до целого).
задание №5
при сжигании простого вещества А желтого цвета. масса молекулы которого равна 5,316×10(степень -23) г, образуется газ Б, имеющий резкий запах. этот же газ образуется при обжиге минерала В, состоящего из атомов металла и простого вецетсва А. при обработке соляной кислотой вещества Г, такого же качетсвеного, но другогт процентного состава, что и мирерал В, выделяется газ Е, при взаимодействии которого с раствором сульфата меди выпадает черный осадок. при пропускании газов через воду выпадает осадок исходное вещетсво А. определите вещества А,Б, В, Г, и Е. приведите соответствующие уравнения реакций.
этот же газ образуется при обжиге минерала В, состоящего из атомов металла и простого вецетсва А. при обработке соляной кислотой вещества Г, такого же качетсвеного, но другогт процентного состава, что и мирерал В, выделяется газ Е, при взаимодействии которого с раствором сульфата меди выпадает черный осадок. при пропускании газов через воду выпадает осадок исходное вещетсво А. определите вещества А,Б, В, Г, и Е. приведите соответствующие уравнения реакций.
14.5: Реакции кислот и оснований
Цели обучения
- Запишите реакции кислотно-щелочной нейтрализации.
- Напишите реакции кислот с металлами.
- Запишите реакции оснований с металлами.
Реакция нейтрализации
Реакция, которая происходит, когда кислота, такая как \ (\ ce {HCl} \), смешивается с основанием, например \ (\ ce {NaOH} \):
\ [\ ce {HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H_2O (l)} \ nonumber \]
При объединении кислоты и основания образуются вода и соль. .{-}} \)] \) — получается нейтральный раствор с pH = 7. Кислота и основание нейтрализовали друг друга, и кислотные и основные свойства больше не присутствуют.
.{-}} \)] \) — получается нейтральный раствор с pH = 7. Кислота и основание нейтрализовали друг друга, и кислотные и основные свойства больше не присутствуют.
Однако солевые растворы не всегда имеют pH 7. Посредством процесса, известного как гидролиз , ионы, образующиеся при объединении кислоты и основания, могут реагировать с молекулами воды с образованием слабокислого или основного раствора. Как правило, если сильная кислота смешивается со слабым основанием, полученный раствор будет слегка кислым.Если сильное основание смешать со слабой кислотой, раствор будет слегка щелочным.
Видео: Эквимолярный (~ 0,01 M) и эквивалентный растворы \ (\ ce {HCl} \) и \ (\ ce {NaOH} \) объединяются для получения соленой воды. https://youtu.be/TS-I9KrUjB0Пример \ (\ PageIndex {1} \): пропионовая кислота + гидроксид кальция
Пропионат кальция используется для подавления роста плесени в пищевых продуктах, табаке и некоторых лекарствах. Напишите сбалансированное химическое уравнение реакции водного раствора пропионовой кислоты (CH 3 CH 2 CO 2 H) с водным гидроксидом кальция [Ca (OH) 2 ].
Решение
| Ступени | Реакция |
|---|---|
Напишите несбалансированное уравнение. Это реакция двойного вытеснения, когда катионы и анионы меняются местами, образуя воду и соль. | CH 3 CH 2 CO 2 H (водн.) + Ca (OH) 2 (водн.) → (CH 3 CH 2 CO 2 ) 2 Ca (водн.) + H 2 O (л) |
Сбалансируйте уравнение. Поскольку в формуле для Ca (OH) 2 присутствуют два иона OH — , нам нужны два моля пропионовой кислоты, CH 3 CH 2 CO 2 H, чтобы получить H + ионы. | 2 CH 3 CH 2 CO 2 H (водн.) + Ca (OH) 2 (водн.) → (CH 3 CH 2 CO 2 ) 2 Ca (водн.) + 2 H 2 O (л) |
Упражнение \ (\ PageIndex {1} \)
Напишите сбалансированное химическое уравнение реакции твердого гидроксида бария с разбавленной уксусной кислотой.
- Ответ
\ [\ ce {Ba (OH) 2 (s) + 2Ch4CO2H (водн.) → Ba (Ch4CO2) 2 (водн.) + 2h3O (l)} \ nonumber \ nonumber \]
Кислоты и основания реагируют с металлами
Кислоты реагируют с большинством металлов с образованием соли и газообразного водорода. Как обсуждалось ранее, металлы, которые более активны, чем кислоты, могут подвергаться реакции однократного замещения . Например, металлический цинк реагирует с соляной кислотой с образованием хлорида цинка и газообразного водорода.
Например, металлический цинк реагирует с соляной кислотой с образованием хлорида цинка и газообразного водорода.
\ [\ ce {Zn (s) + 2HCl (водный) → ZnCl2 (водный) + h3 (g)} \ nonumber \]
Основания также реагируют с некоторыми металлами, такими как цинк или алюминий, с образованием газообразного водорода. Например, гидроксид натрия реагирует с цинком и водой с образованием цинката натрия и газообразного водорода.
\ [\ ce {Zn (s) + 2NaOH (водн.) + 2h3O (l) → Na2Zn (OH) 4 (водн.) + H3 (g)}. \ Nonumber \]
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Кислотно-основные реакции | Типы реакций
13.2 Кислотно-основные реакции (ESBQY)
Реакция между кислотой и основанием известна как реакция нейтрализации . Часто при взаимодействии кислоты и основания образуются соль и вода. Мы рассмотрим несколько примеров кислотно-основных реакций.
Часто при взаимодействии кислоты и основания образуются соль и вода. Мы рассмотрим несколько примеров кислотно-основных реакций.
В химии слово соль не означает белое вещество, которым вы посыпаете пищу (это белое вещество является солью, но не единственной солью). Соль (для химиков) — это продукт кислотно-основной реакции, состоящий из катиона основания и аниона кислоты.{-} \) ионы. Соль все еще образуется как единственный продукт, но вода не образуется.
Важно понимать, насколько полезны эти реакции нейтрализации. Ниже приведены несколько примеров:
Бытовое использование
Оксид кальция (\ (\ text {CaO} \)) — это основа (все оксиды металлов являются основаниями), которую наносят на слишком кислую почву. Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества могут также использоваться в больших количествах в сельском хозяйстве и в реках.

Известняк (белый камень или карбонат кальция) используется в выгребных ямах (или длинных отстойниках). Известняк — это основа, которая помогает нейтрализовать кислотные отходы.
Биологические применения
Кислоты в желудке (например, соляная кислота) играют важную роль в переваривании пищи. Однако, когда у человека язва желудка или когда в желудке слишком много кислоты, эти кислоты могут вызвать сильную боль. Антациды используются для нейтрализации кислот, чтобы они не горели так сильно. Антациды — это основания, нейтрализующие кислоту. Примерами антацидов являются гидроксид алюминия, гидроксид магния («молоко магнезии») и бикарбонат натрия («бикарбонат соды»). Антациды также можно использовать для снятия изжоги.
Промышленное использование
Основной гидроксид кальция (известковая вода) может использоваться для поглощения вредного кислого \ (\ text {SO} _ {2} \) газа, который выделяется на электростанциях и при сжигании ископаемого топлива.

Укусы пчел являются кислыми и имеют pH от \ (\ text {5} \) до \ (\ text {5,5} \). Их можно успокоить, используя такие вещества, как бикарбонат соды и молоко магнезии. Обе основы помогают нейтрализовать кислотный укус пчелы и немного уменьшить зуд!
Кислотно-основные реакции
Цель
Для исследования кислотно-основных реакций.
Аппаратура и материалы
- Мерная колба
- колбы конические
- раствор гидроксида натрия
- раствор соляной кислоты
- пипетка
- индикатор
Метод
С помощью пипетки добавьте \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в мерную колбу.Долить до отметки водой и хорошо взболтать.
Отмерьте \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в коническую колбу. Добавьте несколько капель индикатора.
Медленно добавьте \ (\ text {10} \) \ (\ text {ml} \) соляной кислоты.
 Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета.
Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета.
Наблюдения
Раствор меняет цвет после добавления заданного количества соляной кислоты.
В приведенном выше эксперименте вы использовали индикатор, чтобы увидеть, когда кислота нейтрализует основание. Индикаторы — это химические соединения, которые меняют цвет в зависимости от того, находятся они в кислоте или в основе.
Включен рекомендуемый эксперимент для неформальной оценки по обнаружению природных индикаторов. Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекли цвет из растения путем кипячения растительного вещества, а затем сливают жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полоски бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.
Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полоски бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.
Важно, чтобы учащиеся не помещали лицо или нос прямо над стаканом или в него, когда нюхали лук и ванильную эссенцию. Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах в сторону своего лица.
Кислоты и щелочи едкие и могут вызвать серьезные ожоги, поэтому с ними нужно обращаться осторожно.
Индикаторы
Цель
Чтобы определить, какие растения и продукты питания могут выступать в качестве индикаторов.
Аппаратура и материалы
- Возможные индикаторы: краснокочанная капуста, свекла, ягоды (например, шелковица), порошок карри, красный виноград, лук, чай (ройбуш или обычный), разрыхлитель, ванильная эссенция
- кислоты (например, уксус, соляная кислота), основания (напр.грамм. аммиак (во многих бытовых чистящих средствах)) для проверки
- Стаканы
Метод
Возьмите небольшое количество первого возможного индикатора (не используйте лук, ванильную эссенцию и разрыхлитель). Варить вещество до тех пор, пока вода не изменит цвет.
Отфильтруйте полученный раствор в стакан, стараясь не попасть в стакан. (Также можно вылить воду через дуршлаг или сито.)
Половину полученного окрашенного раствора налейте во второй стакан.
Поместите один стакан на лист бумаги формата А4 с надписью «кислоты».
 Поместите другой стакан на лист бумаги с надписью «основы».
Поместите другой стакан на лист бумаги с надписью «основы».Повторите со всеми другими возможными индикаторами (кроме лука, ванильной эссенции и разрыхлителя).
Во все мензурки на листе с кислотой осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты.Запишите свои наблюдения.
Во все мензурки на листе основы осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) основы. Запишите свои наблюдения.
Если у вас более одной кислоты или основания, вам нужно будет повторить вышеуказанные шаги, чтобы получить свежие индикаторные образцы для вашей второй кислоты или основания. Или вы можете использовать меньше полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить.
Обратите внимание на запах лука и ванильной эссенции.
 Положите в стакан небольшой кусочек лука. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Положите в стакан небольшой кусочек лука. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.Поместите небольшой кусочек лука в стакан. Это для тестирования с базой. Залейте \ (\ text {5} \) \ (\ text {ml} \) основы. Помашите рукой над стаканом, чтобы выдувать воздух к носу.Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Наконец, поместите в стакан чайную ложку разрыхлителя. Осторожно налейте в стакан \ (\ text {5} \) \ (\ text {ml} \) кислоты. Запишите свои наблюдения. Повторите, используя базу.
Наблюдения
Вещество | Цвет | Результаты с кислотой | Результаты с основанием |
| 9039 | |||
Свекла | |||
Ягоды | |||
Карри порошок | |||
Чай | |||
Лук | |||
Ванильная эссенция | |||
Разрыхлитель |
Обратите внимание, что некоторые из веществ изменились в цвете. присутствие кислоты или основания.Разрыхлитель шипит, когда находится в растворе кислоты, но реакции не наблюдается, когда он находится в растворе основания. Находясь в основе, эссенция ванили и лук должны потерять свой характерный запах.
присутствие кислоты или основания.Разрыхлитель шипит, когда находится в растворе кислоты, но реакции не наблюдается, когда он находится в растворе основания. Находясь в основе, эссенция ванили и лук должны потерять свой характерный запах.
Ваниль и лук известны как индикаторы запаха. Обонятельные индикаторы теряют характерный запах при смешивании с кислотами или основаниями.
Теперь мы рассмотрим три конкретных типа кислотно-основных реакций. В каждом из этих типов кислотно-щелочной реакции кислота остается той же, но меняется тип основания.Мы посмотрим, какие продукты образуются, когда кислоты реагируют с каждым из этих оснований, и как выглядит общая реакция.
Кислота и гидроксид металла (ESBQZ)
Когда кислота реагирует с гидроксидом металла, образуются соль и вода . Мы уже вкратце объяснили это. Вот несколько примеров:
- \ (\ text {HCl (aq)} + \ text {NaOH (aq)} \ rightarrow \ text {H} _ {2} \ text {O (l)} + \ text {NaCl (aq)} \)
- \ (2 \ text {HBr (aq)} + \ text {Mg (OH)} _ {2} \ text {(aq)} \ rightarrow 2 \ text {H} _ {2} \ text {O (l) } + \ text {MgBr} _ {2} \ text {(aq)} \)
- \ (3 \ text {HCl (aq)} + \ text {Al (OH)} _ {3} \ text {(aq)} \ rightarrow 3 \ text {H} _ {2} \ text {O (l) } + \ text {AlCl} _ {3} \ text {(aq)} \)
Мы можем написать общее уравнение для этого типа реакции:
\ [n \ text {H} ^ {+} \ text {(aq)} + \ text {M (OH)} _ {n} \ text {(aq)} \ rightarrow n \ text {H} _ {2 } \ text {O (l)} + \ text {M} ^ {n +} \ text {(aq)} \] Где \ (n \) — номер группы металла, а \ (\ text {M} \) — металл.
Зарегистрируйтесь, чтобы получить стипендию и возможности карьерного роста. Используйте практику Сиявулы, чтобы получить наилучшие возможные оценки.
Зарегистрируйтесь, чтобы разблокировать свое будущее Упражнение 13.3Напишите уравнение реакции между \ (\ text {HNO} _ {3} \) и \ (\ text {KOH} \).
\ (\ text {HNO} _ {3} \ text {(aq)} + \ text {KOH (aq)} \ rightarrow \ text {KNO} _ {3} \ text {(aq)} + \ text {H } _ {2} \ text {O (l)} \)
Кислота и оксид металлов (ESBR2)
Когда кислота реагирует с оксидом металла, также образуются соль и вода .Вот несколько примеров:
- \ (2 \ text {HCl (aq)} + \ text {Na} _ {2} \ text {O (aq)} \ rightarrow \ text {H} _ {2} \ text {O (l)} + 2 \ text {NaCl} \)
- \ (2 \ text {HBr (aq)} + \ text {MgO} \ rightarrow \ text {H} _ {2} \ text {O (l)} + \ text {MgBr} _ {2} \ text {( aq)} \)
- \ (6 \ text {HCl (aq)} + \ text {Al} _ {2} \ text {O} _ {3} \ text {(aq)} \ rightarrow 3 \ text {H} _ {2} \ текст {O (l)} + 2 \ text {AlCl} _ {3} \ text {(aq)} \)
Мы можем написать общее уравнение реакции оксида металла с кислотой:
\ [2y \ text {H} ^ {+} \ text {(aq)} + \ text {M} _ {x} \ text {O} _ {y} \ text {(aq)} \ rightarrow y \ text {H} _ {2} \ text {O (l)} + x \ text {M} ^ {n +} \ text {(aq)} \] Где \ (n \) — номер группы металла. \ (X \) и \ (y \) представляют собой соотношение, в котором металл соединяется с оксидом, и зависят от валентности металла.
\ (X \) и \ (y \) представляют собой соотношение, в котором металл соединяется с оксидом, и зависят от валентности металла.
Зарегистрируйтесь, чтобы получить стипендию и возможности карьерного роста. Используйте практику Сиявулы, чтобы получить наилучшие возможные оценки.
Зарегистрируйтесь, чтобы разблокировать свое будущее Упражнение 13.4Напишите сбалансированное уравнение реакции между \ (\ text {HBr} \) и \ (\ text {K} _ {2} \ text {O} \).
\ (2 \ text {HBr (aq)} + \ text {K} _ {2} \ text {O (aq)} \ rightarrow 2 \ text {KBr (aq)} + \ text {H} _ {2} \ text {O (l)} \)
Кислота и карбонат металла (ESBR3)
Реакция кислот с карбонатами
Аппаратура и материалы
- Небольшие количества разрыхлителя (бикарбонат натрия)
- соляная кислота (разбавленная) и уксус
- стенд реторт
- две пробирки
- одна резиновая пробка для пробирки
- трубка подачи
- известковая вода (гидроксид кальция в воде)
Эксперимент следует настроить, как показано ниже.
Метод
Осторожно проденьте подающую трубку через резиновую пробку.
Налейте известковую воду в одну из пробирок.
Осторожно налейте небольшое количество соляной кислоты в другую пробирку.
Добавьте к кислоте небольшое количество карбоната натрия и закройте пробирку резиновой пробкой.Поместите другой конец трубки подачи в пробирку с известковой водой.
Посмотрите, что происходит с цветом известковой воды.
Повторите вышеуказанные шаги, на этот раз используя уксус.
Наблюдения
Прозрачная известковая вода становится молочной, что означает образование углекислого газа. Вы можете не увидеть этого для соляной кислоты, так как реакция может протекать быстро.
Когда кислота реагирует с карбонатом металла, образуются соль , диоксид углерода и вода . Взгляните на следующие примеры:
Азотная кислота реагирует с карбонатом натрия с образованием нитрата натрия, диоксида углерода и воды.
\ [2 \ text {HNO} _ {3} \ text {(aq)} + \ text {Na} _ {2} \ text {CO} _ {3} \ text {(aq)} \ rightarrow 2 \ текст {NaNO} _ {3} \ text {(aq)} + \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l)} \]
Серная кислота реагирует с карбонатом кальция с образованием сульфата кальция, диоксида углерода и воды.
\ [\ text {H} _ {2} \ text {SO} _ {4} \ text {(aq)} + \ text {CaCO} _ {3} \ text {(aq)} \ rightarrow \ text { CaSO} _ {4} \ text {(s)} + \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l)} \]
Соляная кислота реагирует с карбонатом кальция с образованием хлорида кальция, диоксида углерода и воды.

\ [2 \ text {HCl (aq)} + \ text {CaCO} _ {3} \ text {(s)} \ rightarrow \ text {CaCl} _ {2} \ text {(aq)} + \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l)} \]
Напишите сбалансированное уравнение реакции между \ (\ text {HCl} \) и \ (\ text {K} _ {2} \ text {CO} _ {3} \).
\ (2 \ text {HCl (aq)} + \ text {K} _ {2} \ text {CO} _ {3} \ text {(aq)} \ rightarrow 2 \ text {KCl (aq)} + \ текст {H} _ {2} \ text {O (l)} + \ text {CO} _ {2} \ text {(g)} \)
Используя то, что мы узнали о кислотах и основаниях, мы теперь можем взглянуть на получение некоторых солей.
Приготовление солей
Цель
Для получения солей кислотно-основными реакциями.{-3} $} \)), серная кислота (разбавленная), гидроксид натрия, оксид меди (II), карбонат кальция
мензурки, измеритель массы, воронки, фильтровальная бумага, горелка Бунзена, мерные цилиндры
Метод
При работе с серной кислотой надевайте перчатки и защитные очки.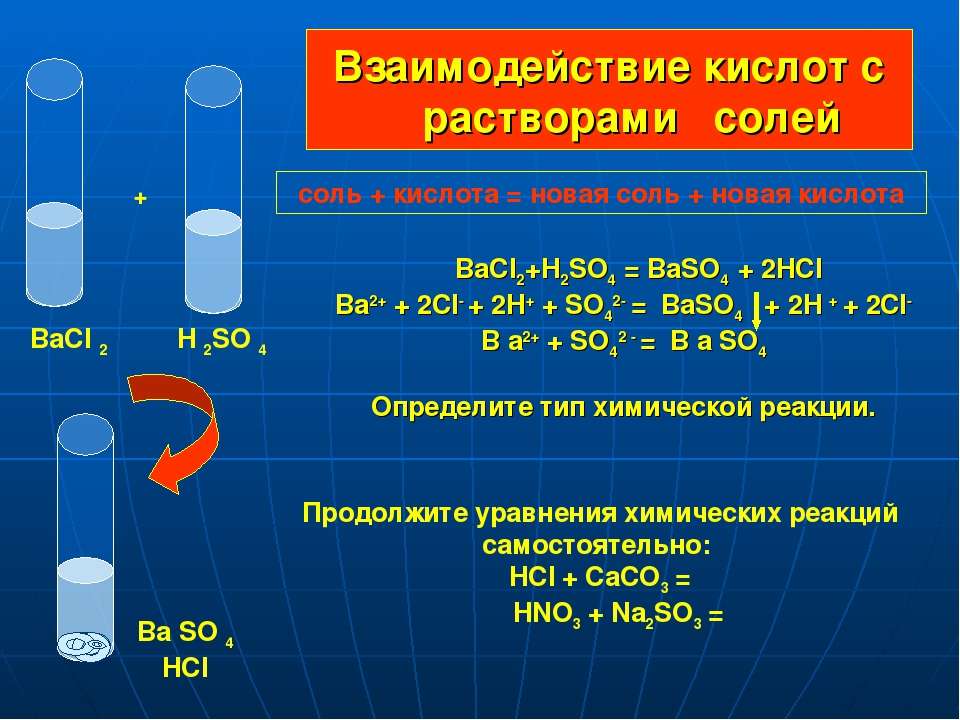 Работайте в хорошо вентилируемом помещении.
Работайте в хорошо вентилируемом помещении.
Часть 1
- Отмерьте \ (\ text {20} \) \ (\ text {ml} \) соляной кислоты в стакан.
- Отмерьте \ (\ text {20} \) \ (\ text {ml} \) гидроксида натрия и осторожно добавьте его в стакан, содержащий соляную кислоту.
- Осторожно нагрейте полученный раствор, пока вся вода не испарится. У вас должен остаться белый порошок.
Часть 2
- Осторожно добавьте \ (\ text {25} \) \ (\ text {ml} \) серной кислоты в чистый стакан.
- Добавьте примерно небольшое количество (примерно \ (\ text {0,5} \) \ (\ text {g} \)) оксида меди (II) в стакан, содержащий серную кислоту.Размешайте раствор.
- После растворения всего оксида меди (II) добавьте еще небольшое количество оксида меди (II). Повторяйте, пока твердое вещество не перестанет растворяться и не останется небольшое количество нерастворенного твердого вещества.
- Отфильтруйте этот раствор и выбросьте фильтровальную бумагу.

- Осторожно нагрейте полученную жидкость. У вас должно получиться небольшое количество твердого вещества.
Часть 3
- Отмерьте \ (\ text {20} \) \ (\ text {ml} \) соляной кислоты в новый стакан.
- Добавьте примерно небольшое количество (примерно \ (\ text {0,5} \) \ (\ text {g} \)) карбоната кальция в стакан, содержащий соляную кислоту. Размешайте раствор.
- Когда весь карбонат кальция растворится, добавьте еще небольшое количество карбоната кальция. Повторяйте, пока твердое вещество не перестанет растворяться и не останется небольшое количество нерастворенного твердого вещества.
- Отфильтруйте этот раствор и выбросьте фильтровальную бумагу.
- Осторожно нагрейте полученную жидкость. У вас должно получиться небольшое количество твердого вещества.
Наблюдения
В первой реакции (хлористоводородная кислота с гидроксидом натрия) полученный раствор был прозрачным. Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Это порошок хлорида натрия.
Это порошок хлорида натрия.
Во второй реакции (серная кислота с оксидом меди (II)) полученный раствор имел синий цвет. Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Этот порошок — медный купорос.
В третьей реакции (хлористоводородная кислота с карбонатом кальция) полученный раствор был прозрачным.Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Этот порошок — сульфат кальция.
Попробуйте написать уравнения для трех приведенных выше реакций.
Заключение
Мы использовали кислотно-основные реакции для получения различных солей.
Кислоты и основания
Упражнение 13.6\ (\ text {HNO} _ {3} \) и \ (\ text {Ca} (\ text {OH}) _ {2} \)
Кислота и гидроксид металлов
\ (2 \ text {HNO} _ {3} \ text {(aq)} + \ text {Ca (OH)} _ {2} \ text {(aq)} \ rightarrow \ text {Ca (NO} _ {3} \ text {)} _ {2} \ text {(aq)} + 2 \ text {H} _ {2} \ text {O (l)} \)
\ (\ text {HCl} \) и \ (\ text {BeO} \)
Кислота и оксид металлов
\ (2 \ text {HCl (aq)} + \ text {BeO (aq)} \ rightarrow \ text {BeCl} _ {2} \ text {(aq)} + \ text {H} _ {2} \ текст {O (l)} \)
\ (\ text {HI} \) и \ (\ text {K} _ {2} \ text {CO} _ {3} \)
Кислота и карбонат
\ (2 \ text {HI (aq)} + \ text {K} _ {2} \ text {CO} _ {3} \ text {(aq)} \ rightarrow 2 \ text {KI (aq)} + \ text {H} _ {2} \ text {O (l)} + \ text {CO} _ {2} \ text {(g)} \)
\ (\ text {H} _ {3} \ text {PO} _ {4} \) и \ (\ text {KOH} \)
Кислота и гидроксид металлов
\ (\ text {H} _ {3} \ text {PO} _ {4} \ text {(aq)} + 3 \ text {KOH (aq)} \ rightarrow \ text {K} _ {3} { PO} _ {4} \ text {(aq)} + 3 \ text {H} _ {2} \ text {O (l)} \)
\ (\ text {HCl} \) и \ (\ text {MgCO} _ {3} \)
Кислота и карбонат
\ (2 \ text {HCl (aq)} + \ text {MgCO} _ {3} \ text {(aq)} \ rightarrow \ text {MgCl} _ {2} \ text {(aq)} + \ text {H} _ {2} \ text {O (l)} + \ text {CO} _ {2} \ text {(g)} \)
\ (\ text {HNO} _ {3} \) и \ (\ text {Al} _ {2} \ text {O} _ {3} \)
Кислота и оксид металлов
\ (6 \ text {HNO} _ {3} \ text {(aq)} + \ text {Al} _ {2} \ text {O} _ {3} \ text {(aq)} \ rightarrow 2 \ текст {Al (NO} _ {3} \ text {)} _ {3} \ text {(aq)} + 3 \ text {H} _ {2} \ text {O (l)} \)
соляная кислота-HCl-кислота, многоразовая
ноябрь 2003 г.

Соляная кислота.Ваш желудок естественным образом помогает переваривать обед. Он используется в промышленности для обработки стали, материала, который выбирают для подвесных мостов, легковых и грузовых автомобилей. Соляная кислота также используется в производстве батарей, фотовспышек и фейерверков. Его даже используют для обработки сахара и изготовления желатина. Соляная кислота, как и соединение хлора в прошлом месяце, хлорид натрия — еще одно химическое вещество «рабочей лошадки», потому что оно невероятно полезно во многих отношениях.
В отличие от хлорида натрия, с соляной кислотой нелегко обращаться, и меры безопасности ОБЯЗАТЕЛЬНЫ! Эта кислота имеет резкий раздражающий запах и является очень едким веществом, то есть повреждает большинство предметов, к которым прикасается. Вам может быть интересно, как можно хранить такую реактивную жидкость, не повредив ее емкость. Металлические емкости для этой кислоты не подходят, но пластиковые емкости, например, из ПВХ (поливинилхлорида), выдерживают очень хорошо.
Металлические емкости для этой кислоты не подходят, но пластиковые емкости, например, из ПВХ (поливинилхлорида), выдерживают очень хорошо.
Огайо. При травлении стали раствор соляной кислоты используется для удаления ржавчины и Шкала
для подготовки стальной поверхности к нанесению защитного покрытия. Обратите внимание на ржавый
появление стальных валков на переднем плане и блестящих стальных валков, уже
«маринованный» на ленте конвейера.Около соляной кислоты, производимой в
U.S. используется для травления стали. (Фото любезно предоставлено Greer Steel Company)
HCl представляет собой соединение хлористого водорода. Каждая молекула HCl состоит из водорода и хлора в соотношении один к одному. (См. Схему в левом верхнем углу страницы). При комнатной температуре HCl представляет собой бесцветный ядовитый газ. Растворите его в воде, и вы получите соляную кислоту. Для справки, кислоты — это вещества, выделяющие в воду ионы водорода. Чем больше ионов водорода выделяет кислота в воде, тем сильнее кислота (см. «Что такое ион?» Ниже). Если вы пришли к выводу из приведенного выше обсуждения, что HCl выделяет много ионов водорода в воду, вы правы!
Для справки, кислоты — это вещества, выделяющие в воду ионы водорода. Чем больше ионов водорода выделяет кислота в воде, тем сильнее кислота (см. «Что такое ион?» Ниже). Если вы пришли к выводу из приведенного выше обсуждения, что HCl выделяет много ионов водорода в воду, вы правы!
Что такое ион?
Ион — это атом, который получил или потерял электроны. Электроны — это отрицательно заряженные субатомные частицы, которые уравновешивают положительно заряженные протоны в незаряженных (нейтральных) атомах.
При растворении HCl в воде образуются ионы H и Cl. Водород теряет электрон (становится ионом с зарядом +1), а хлор приобретает электрон (становится ионом с зарядом -1).
Сильные кислоты, такие как HCl, выделяют в воду намного больше ионов водорода, чем слабые кислоты, такие как уксус или лимонный сок.
Дополнительные вопросы:
- Узнайте названия и химические формулы как минимум двух встречающихся в природе кислот.
 Что общего между химическими формулами кислот?
Что общего между химическими формулами кислот? - Что означает pH кислоты? Как это связано с силой кислоты?
- Основания — это соединения, которые реагируют с кислотами с образованием воды и соли:
Кислота + Основание? Соль + вода.
Другими словами, кислоты и основания нейтрализуют друг друга. Напишите реакцию HCl с основным гидроксидом натрия (NaOH) и опишите своими словами, что происходит.(Намекать: Хлорное соединение месяца октября играет роль в этой реакции!)
Идеи научных проектов:
- Как получается, что соляная кислота не разрушает внутреннюю оболочку желудка человека? Изучите причину, а также некоторые заболевания, связанные с «кислым желудком».
- Изучите методы, используемые для очистки случайных разливов кислот.Как принципы химии используются в этих операциях?
Чтобы просмотреть список предыдущих функций «Хлорное соединение месяца», щелкните
здесь.
Как соляная кислота реагирует с алюминием. Формулы и описание процесса
Алюминий — ковкий, легкий серебристо-белый металл. Это хороший электрический проводник. Он может реагировать как с кислотами, так и с основаниями. Объединение алюминия с кислотой приводит к типичной реакции однократного вытеснения с образованием соли алюминия и газообразного водорода.Это видно на простом примере — как соляная кислота реагирует с алюминием.
Со щелочами реакция протекает иначе: помимо выделения водорода в реакции образуется алюминат MeAlO₂ (где Me представляет собой катион металла из щелочи) и комплексное соединение с формулой Me [Al (OH) ₄] в решение.
Как алюминий реагирует с соляной кислотой
Алюминий реагирует с разбавленной соляной кислотой при комнатной температуре.Металл растворяется в соляной кислоте, давая хлорид алюминия и бесцветный газообразный водород. Эта реакция необратима, так как конечные продукты не вступают в реакцию друг с другом. Реакция между металлическим алюминием и соляной кислотой известна как окислительно-восстановительная реакция. Алюминий действует как восстановитель, отдавая электроны:
Реакция между металлическим алюминием и соляной кислотой известна как окислительно-восстановительная реакция. Алюминий действует как восстановитель, отдавая электроны:
Al⁰ — 3e = Al³⁺
Катионы соляной кислоты захватывают эти электроны и восстанавливаются до молекулярного водорода:
2H⁺ + 2e = H₂
Полное уравнение ионной реакции:
2Al⁰ + 6H⁺ + 6Cl⁻ = 2Al³⁺ + 6Cl⁻ + 3H₂ ↑
Нетто-ионная форма:
2Al⁰ + 6H⁺ = 2Al³⁺ + 3H₂ ↑
В молекулярной форме реакция выглядит следующим образом:
2Al + 6HCl = 2AlCl₃ + 3H₂ ↑
Металлический алюминий — не единственное вещество, способное реагировать с соляной кислотой — этим свойством обладают многие соединения металлов.С солями происходит обменная реакция, когда ионы или реактивные группы обоих реагентов «меняются местами». Чтобы реакция с алюминием или его соединениями была необратимой, реагенты должны образовывать газ, осадок или плохо растворимое вещество. Необходимо точно рассчитать необходимое количество реагента.
Реакции гидроксидов и оксидов алюминия с соляной кислотой
Al (OH) ₃ представляет собой амфотерное основание, представляющее собой белый желеобразный осадок, плохо растворяющийся в воде.
Гидроксид алюминия вступает в реакцию нейтрализации соляной кислотой (гидроксид должен быть свежим осаждением, чтобы реакция протекала надежно):
Al (OH) ₃ + 3HCl = AlCl₃ + 3H₂O
Наблюдается растворение белого осадка гидроксида алюминия (хлорид алюминия AlCl₃ хорошо растворяется в воде). С оксидом алюминия реакция дает соль и воду в соответствии со следующим уравнением:
Al₂O₃ + 6HCl = 2AlCl₃ + 3H₂O
Реакции солей, гидридов и комплексов алюминия с соляной кислотой
Соляная кислота также реагирует со многими другими соединениями алюминия.
С карбидом алюминия
Al₄C₃ + 12HCl = 4AlCl₃ + 3CH₄ ↑
(карбид алюминия растворяется при обработке избытком соляной кислоты)
С ацетатом алюминия
(CH₃COO) ₃Al + 3HCl = AlCl₃ + 3CH₃COOH
С нитридом алюминия
AlN + 4HCl = AlCl₃ + NH₄Cl
(используется горячая концентрированная кислота; реакция идет медленно)
С сульфидом алюминия
Al₂S₃ + 6HCl = 2AlCl₃ + 3H₂S ↑
С фосфидом алюминия
AlP + 3HCl = AlCl₃ + PH₃ ↑
(Реакция предполагает обработку фосфида горячей концентрированной кислотой)
С фосфатом алюминия
AlPO₄ + 3HCl = AlCl₃ + H₃PO₄
С аланатом (тетрагидроалюминатом) лития
Li [AlH₄] + 4HCl = AlCl₃ + LiCl + 4H₂ ↑
(Реакция проводится при низкой температуре)
С алюминатом натрия
NaAlO₂ + 4HCl = NaCl + AlCl₃ + 2H₂O
С тетрагидроксоалюминатом натрия
Na [Al (OH) ₄] + 4HCl = AlCl₃ + NaCl + 4H₂O
Сульфаты и нитраты алюминия не реагируют с соляной кислотой, так как все соединения в смеси растворимы — не образуется осадка, не образуются малорастворимые вещества, не выделяется газ.
Щелкните здесь, чтобы узнать больше об алюминии и его свойствах.
Как смеси металлов реагируют с соляной кислотой
Если вы возьмете смесь нескольких металлов и обработаете их соляной кислотой, каждый металл будет реагировать отдельно. Например, если вы добавите HCl в смесь алюминиевой и железной стружки, реакция будет протекать следующим образом:
Fe + 2HCl = FeCl₂ + H₂ ↑
2Al + 6HCl = 2AlCl₃ + 3H₂ ↑
Поскольку разбавленная соляная кислота является слабым окислителем, железо восстанавливается только до степени окисления +2.
Продукты реакции алюминия с соляной кислотой и их применение
Почти все реакции соляной кислоты и алюминия (или его соединений) приводят к образованию хлорида алюминия (AlCl₃). Соль хорошо растворяется в органических растворителях (нитробензол, дихлорэтан, ацетон) и воде. В водных растворах можно наблюдать гидролиз AlCl₃, так как эта соль образована сильной кислотой HCl и слабым основанием Al (OH).
AlCl₃ используется в качестве катализатора в органическом синтезе. Например, его используют при изомеризации парафинов, инициировании реакций алкилирования, ацилировании и разложении масла на фракции. Гексагидрат хлорида алюминия AlCl₃ ・ 6H₂O используется для обработки древесины, очистки сточных вод и производства антиперспирантов.
Реакция алюминия с раствором соляной кислоты может использоваться как лабораторный метод получения водорода (но для этих целей чаще используется металлический цинк).
| До сих пор мы использовали чистые вещества и добавляли их в воду
чтобы найти решения. Смысл использования решений в том, что они
часто легче использовать в лаборатории, чем чистые вещества. Мы будем сейчас
узнайте, как провести стехиометрию с этими растворами. |
Проблема: какой объем 0,556 M HCl
имеет достаточно соляной кислоты, чтобы точно соединиться с 24. 5 мл водного раствора натрия
гидроксид с концентрацией 0,458 М? Уравнение реакции
это: 5 мл водного раствора натрия
гидроксид с концентрацией 0,458 М? Уравнение реакции
это: |
| HCl (водн.) + NaOH (водн.) ——> NaCl (водн.) +
H 2 O |
| Решение: это простой мл -> моль -> моль —>
мл раствора. |
| Шаг № 1 Начните с того, что вы знаете: у вас их 24.5 мл 0,458 М NaOH. Сколько это родинок? 0,458 моль = x x = 0,011 моль NaOH. |
| Стадия 2 HCl и NaOH реагируют в соотношении 1: 1.
Следовательно, 1 HCl = 1 NaOH x = 0,011 моль HCl. |
| Шаг № 3 Нам понадобится 0,011 моль HCl и раствор, который мы
Имеем в наличии 0,556 М. Следовательно, 0,556 моль = 0,011 моль х = 19. Если отмерить 19,78 мл раствора HCl, он будет
точно нейтрализовать NaOH. |
| Пример проблемы № 2: Как
много миллилитров раствора 0,114 M H 2 SO 4 обеспечивают
серная кислота, необходимая для реакции с гидроксидом натрия в 32,2 мл
0,122 М NaOH согласно следующему уравнению? H 2 SO 4 (водн.) + 2 NaOH (водн.) ——>
Na 2 SO 4 (водн.) + 2 H 2 O |
| Решение: снова нам нужны мл -> моль -> моль ->
мл раствора. |
| Шаг № 1 Начните с того, что вы знаете. Ты иметь 32,3 мл 0,122 NaOH. 0,122 моль = x x = 0,004 моль NaOH. |
| Шаг № 2 1 H 2 SO 4 = 2 NaOH х 0.  004
моль 004
моль x = 0,002 моль H 2 SO 4 . |
| Шаг №3 Следовательно нам нужно: 0,114 моль = 0,002 моль Следовательно, нам нужно 17,54 мл 0,114 M H 2 SO 4 для точной нейтрализации 32,3 мл 0,122 М раствора NaOH. |
| Практические проблемы |
| 1. Какой объем 0,337 М КОН обеспечивает растворенное вещество, достаточное для объединения
с серной кислотой в 18,6 мл 0,156 M H 2 SO 4 ?
Реакция: 2 КОН (водн.) + H 2 SO 4 (водн.) —-> K 2 SO 4 (водн.)
+ 2 H 2 O |
2. Соляная кислота реагирует с карбонатом натрия следующим образом: Соляная кислота реагирует с карбонатом натрия следующим образом: 2 HCl (водн.) + Na 2 CO 3 (водн.) ——-> 2 NaCl (водн.) + CO 2 (г) + H 2 O Какой объем 0,224 М HCl нейтрализуется
Na 2 CO 3 в 24,2 мл 0,284 M Na 2 CO 3 ? |
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Выщелачивание гематита в кислых растворах
I. H.Уоррен и Э. Девуйст: Выщелачивание оксида , D.J.I. Эванс и Р. С. Шумейкер, ред., Международный симпозиум по гидрометаллургии, Чикаго, Иллинойс, AIME, Нью-Йорк, Нью-Йорк, 1973, стр. 229–64.
Девуйст: Выщелачивание оксида , D.J.I. Эванс и Р. С. Шумейкер, ред., Международный симпозиум по гидрометаллургии, Чикаго, Иллинойс, AIME, Нью-Йорк, Нью-Йорк, 1973, стр. 229–64.
Google ученый
Х. Мадзима, Ю. Авакура, Т. Язаки и Ю. Чикамори: Metall. Пер. В , 1980, т. 11Б, стр. 209–14.
Google ученый
Х. Бассетт и У.G. Parker: J. Chem. Soc. (Лондон) , 1951, Часть II, стр. 1540–60.
М. Дж. Прайор и У. Р. Эванс: J. Chem. Soc. (Лондон) , 1949, Часть IV. С. 3330–36.

M. Simnad и R. Smolchowski: J. Chem. Phys. , 1955, т. 23. С. 1961–62.
Артикул CAS Google ученый
К. Адзума и Х. Каметани: Пер. Являюсь. Inst. Мин. Engrs. , 1964, т.230. С. 853–62.
Google ученый
К. Адзума и Х. Каметани: Пер. Являюсь. Inst. Мин. Engrs. , 1968, т. 242, стр. 1025–34.
Google ученый
И. Х. Уоррен: в «Единичный процесс в гидрометаллургии», М. Э. Уодсворт и Ф. Т. Уоррен. Дэвис, ред., Гордон и Брич, Нью-Йорк, Нью-Йорк, 1964, т. 1. С. 300–07.
Google ученый
I.H. Warren et al. : Пер. Inst. Мин. Встретились. , 1969, т. 78, стр. C21–27.
CAS Google ученый
В. С. Сурана и И. Х. Уоррен: Пер. Inst. Мин. Встретились. , 1969, том 78, стр. C133–39.
CAS Google ученый
I.H. Уоррен и Г.И.Д. Плотва: Пер. Inst. Мин. Встретились. , 1971, т. 80, стр. C152–55.
Google ученый
D.J.G. Айвз и Дж. Янц: Ссылка Elctrodes , Academic Press, New York, NY, 1961.
Google ученый
K.J. Vetter: Electrochemical Kinetics , Academic Press, New York, NY, 1967, p. 46.
Google ученый
C.B. Baes: J.Являюсь. Chem. Soc. , 1957, т. 79, стр. 5611.
Статья CAS Google ученый
Х. Мадзима, Ю. Авакура, Т. Сато и Т. Мичимото: Денки Кагаку , 1982, т. 50. С. 934–40.
CAS Google ученый
Ю. Авакура, Т. Мичимото, Ю. Такешима и Х. Мадзима: Denki Kagaku , 1983, vol. 51, стр. 302–09.
CAS Google ученый
H.R. Kruyt: Colloid Science , Elsevier Publishing Co., Inc., 1949, т. 1, гл. 6.
K. Mushiake и N. Masuko: Seisan Kenkyu , 1977, vol. 29. С. 2–10.
CAS Google ученый
G. A. Parks: Chem. Ред., 1965, т. 66, стр. 177–98.
Артикул Google ученый
Константы стабильности, Часть II-Неорганические лиганды , Химическое общество, Лондон, 1958, стр.82, 97.
Константы стабильности металл-ионных комплексов, Часть A — Неорганические лиганды , Серия химических данных ИЮПАК, № 21, Pergamon Press, 1982, стр.





 Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета.
Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета. Поместите другой стакан на лист бумаги с надписью «основы».
Поместите другой стакан на лист бумаги с надписью «основы». Положите в стакан небольшой кусочек лука. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Положите в стакан небольшой кусочек лука. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.

 Что общего между химическими формулами кислот?
Что общего между химическими формулами кислот? Необходимо 78 мл.
Необходимо 78 мл. 
Leave A Comment