Вопрос 7 § 3 Химия 9 класс Габриелян Расположите в порядке ослабления кислотных свойств – Рамблер/класс
Вопрос 7 § 3 Химия 9 класс Габриелян Расположите в порядке ослабления кислотных свойств – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помогите записать
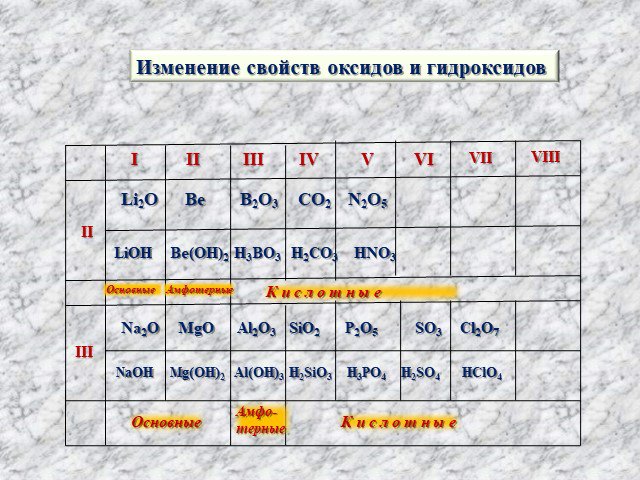
Расположите в порядке ослабления кислотных свойств
Сl2O7.
 Обоснуйте полученный ряд.
Обоснуйте полученный ряд.Запишите формулы гидроксидов, соответствующих этим
оксидам. Как изменяется их кислотный характер в пред-
ложенном вами ряду?
ответы
Сl2O7, Р2O5, SiO2, Аl2O3, MgO, Na2O— уменьшение кислотных
свойств.
Кислотные свойства в периодах увеличиваются.
НClO4, Н3РO4, H2SiO4, Аl(ОН)3, Mg(OH)2, NaOH — уменьшение ки-
слотных свойств.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Приготовление раствора сахара и расчёт его массовой доли в растворе.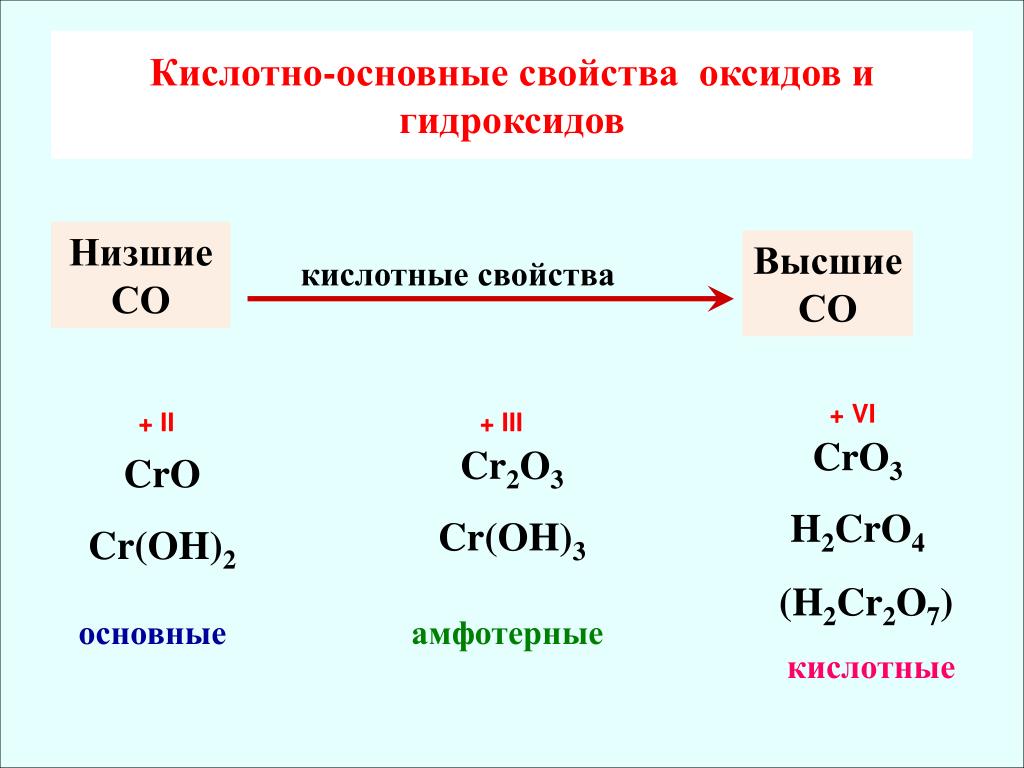 Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
(Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Тренировочный вариант №1 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
Тренировочная работа №5 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года, вариант 1, вариант ХИ2110501 с ответами и решениями. Ответы на тренировочный вариант Статград №5 ЕГЭ по химии 20.04.2022.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Cl, 2) Mn, 3) F, 4) Br, 5) Fe Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
1.
2. Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке усиления кислотных свойств водородного соединения.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +2. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
1) N2
2) H2S
3) C6H6
4) HCOOH
5) P4O10
5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) несолеобразующего оксида; Б) двухосновной кислоты; В) комплексной соли.
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. В двух колбах находился раствор сульфата железа(III). В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выпал бурый осадок, а во второй выпал такой же осадок и выделился газ.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) NH3
2) SO2
3) HNO3
4) Na2CO3
5) Br2
Запишите в поле ответа выбранные цифры в нужной последовательности.
7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) CaO Б) FeS В) CO2 Г) MgI2 | 1) C, KOH, Na2O2 2) O2, HNO3, H2SO4 3) Na2CO3, AgNO3, Br2 4) CuO, H2, KMnO4 5) H2O, HCl, SO2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
8. Установите соответствие между исходными веществами, вступающими в реакцию и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Cl2O7 + KOH Б) Cl2 + KOH(гор. р-р) В) KClO3 + HCl Г) KCl + H2O (электролиз) | 1) KClO3 + H2O 2) KClO4 + H2O 3) KCl + KClO3 + H2O 4) Cl2 + KCl + H 5) H2 + Cl2 + KOH 6) KOH + HCl |
Запишите в поле ответа выбранные цифры в нужной последовательности.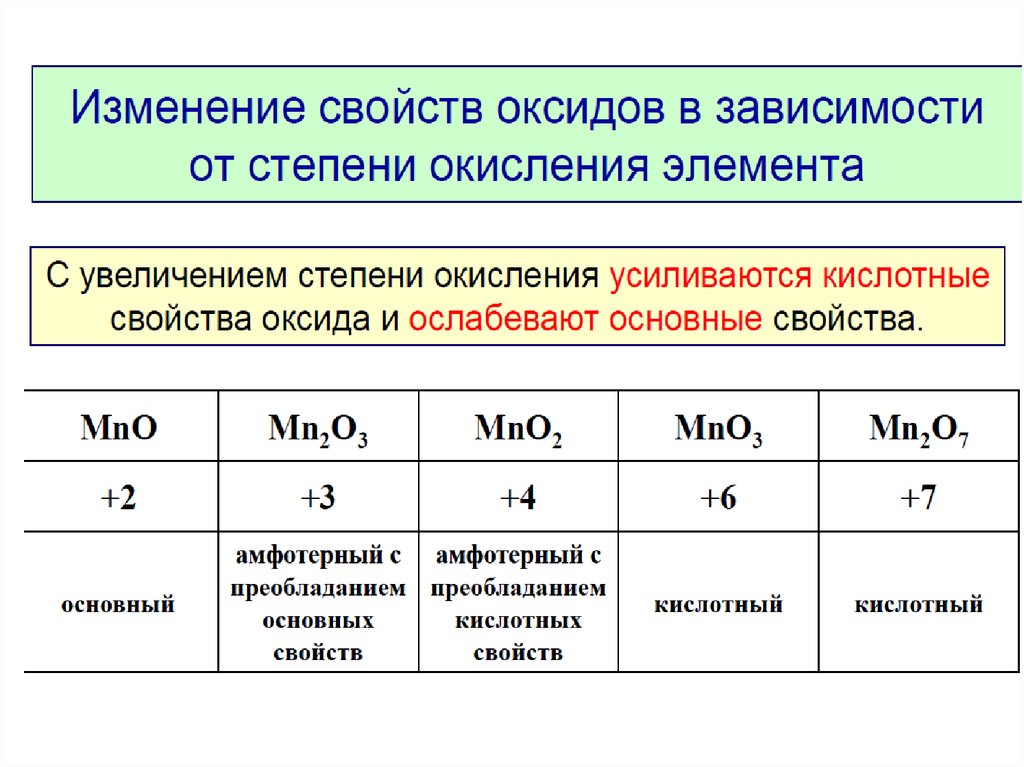
9. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NH3
2) NO
3) NO2
4) KNO3
5) NH4NO3
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
10.
| СТРУКТУРНАЯ ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| 1) нитросоединения 2) первичные амины 3) амиды кислот 4) гетероциклические соединения |
Запишите в поле ответа выбранные цифры в нужной последовательности.
11.
1) пропанол-2
2) ацетон
3) циклогексан
4) диэтиламин
5) этилацетат
12. Из предложенного перечня выберите все вещества, способные окислять алкены. Запишите номера выбранных ответов в порядке возрастания.
1) H2
2) H2O
3) KMnO4/H2O
4) O3
5) KMnO4/H2SO4
Запишите номера выбранных ответов.
13. Из предложенного перечня выберите два вещества, которые реагируют с анилином. Запишите номера выбранных ответов в порядке возрастания.
1) HNO2
2) CH3C(O)Cl
3) Na
4) NaOH
5) NH3
14. Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ |
| А) бензол и пропен в присутствии AlCl3 Б) ацетиленид натрия и избыток бромметана В) 2-метилбутан и бром при нагревании Г) 2-метилпропен и перманганат калия (подкисленный раствор) | 1) бутин-2 2) 2-бром-2-метилбутан 3) 1-бром-2-метилбутан 4) ацетон 5) 1,2,3-триметилбензол 6) изопропилбензол |
Запишите в поле ответа выбранные цифры в нужной последовательности.
15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО X |
| 1) CO2 2) CO 3) H2O 4) KOH 5) KMnO4 6) I2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
16. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) CH3CH3
2) CH3CH2CH2CH3
3) CH3CH2CH2OH
4) CH3CH2CH=O
5) CH3CH2COOCH3
Запишите в поле ответа выбранные цифры в нужной последовательности.
17. Из предложенного перечня выберите все окислительно-восстановительные реакции.
Запишите номера выбранных ответов в порядке возрастания.
1) разложение пероксида водорода
2) растворение оксида меди(I) в азотной кислоте
3) взаимодействие магния с углекислым газом
4) взаимодействие гидроксида магния с хлорной кислотой
5) взаимодействие азотного ангидрида с водой
18. Из предложенного перечня выберите все реакции, скорость которых уменьшается при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания.
Запишите номера выбранных ответов в порядке возрастания.
1) Zn + KOH + H2O → K2[Zn(OH)4] + H2
2) Zn + HCl → ZnCl2 + H2
3) NaH + HCl → NaCl + H2
4) NaH + H2O → NaOH + H2
5) CaCO3 + HNO3 → Ca(NO3)2 + CO2 + H2O
19. Установите соответствие между схемой реакции и свойством, которое проявляет элемент фосфор в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВО ФОСФОРА |
| А) POCl3 + H2O → H3PO4 + HCl Б) P2O3 + HNO3 → H3PO4 + NO + H2O В) H3PO2 → PH3 + H3PO4 | 1) является окислителем 2) является восстановителем 3) является и окислителем, и восстановителем 4) не изменяет степень окисления |
Запишите выбранные цифры в нужной последовательности.
20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ(Ы) НА ЭЛЕКТРОДАХ |
| А) NaOH (расплав) Б) Na2CO3 (раствор) В) (CH3COO)2Ca (раствор) | 1) металл и водород 2) металл, вода и кислород 3) водород и кислород 4) водород, углекислый газ и углеводород |
Запишите выбранные цифры в нужной последовательности.
| Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики |
21. Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих концентрацию 0,1 моль/л. Расположите эти вещества в порядке возрастания pH водного раствора. Запишите номера веществ в правильном порядке.
1) HI
2) KNO2
3) HNO2
4) KNO3
Запишите номера веществ в правильном порядке.
22. Установите соответствие между способом воздействия на равновесную систему
Ag2S(тв.) + H2(г) ↔ 2Ag(тв.) + H2S(г) – Q,
и направлением смещения равновесия при этом воздействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПОСОБ ВОЗДЕЙСТВИЯ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) увеличение давления Б) добавление сероводорода В) добавление твёрдого Ag2S Г) нагревание | 1) смещается в направлении прямой реакции 2) смещается в направлении обратной реакции 3) практически не смещается |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23. В реактор постоянного объёма ввели метан и сильно нагрели. В реакторе установилось равновесие:
2CH4(г) ↔ C2H2(г) + 3H2(г)
Используя данные таблицы, найдите исходную концентрацию CH4 (X) и равновесную концентрацию H2 (Y)
| Вещество | CH4 | C2H2 | H2 |
| Исходная концентрация (моль/л) | |||
| Равновесная концентрация (моль/л) | 0,01 | 0,03 |
Выберите из списка номера правильных ответов.
1) 0,01 моль/л
2) 0,03 моль/л
3) 0,05 моль/л
4) 0,07 моль/л
5) 0,09 моль/л
6) 0,15 моль/л
Запишите выбранные цифры в нужной последовательности.
24. Установите соответствие между формулой иона и качественной реакцией, с помощью которой можно обнаружить этот ион в растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ИОНА | КАЧЕСТВЕННАЯ РЕАКЦИЯ |
| А) CO32– Б) Na+ В) SO32– Г) Zn2+ | 1) при действии кислоты выделяется газ, не взаимодействующий с бромной водой 2) при действии кислоты выделяется газ, обесцвечивающий бромную воду 3) окрашивает пламя в интенсивный жёлтый цвет 4) окрашивает пламя в интенсивный красный цвет 5) при действии водного раствора аммиака образуется белый осадок, растворимый в избытке аммиака |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25. Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) уксусная кислота Б) оксид кремния В) гидроксид натрия | 1) производство пластмасс 2) металлургия 3) производство бумаги 4) производство цемента |
Запишите в поле ответа выбранные цифры в нужной последовательности.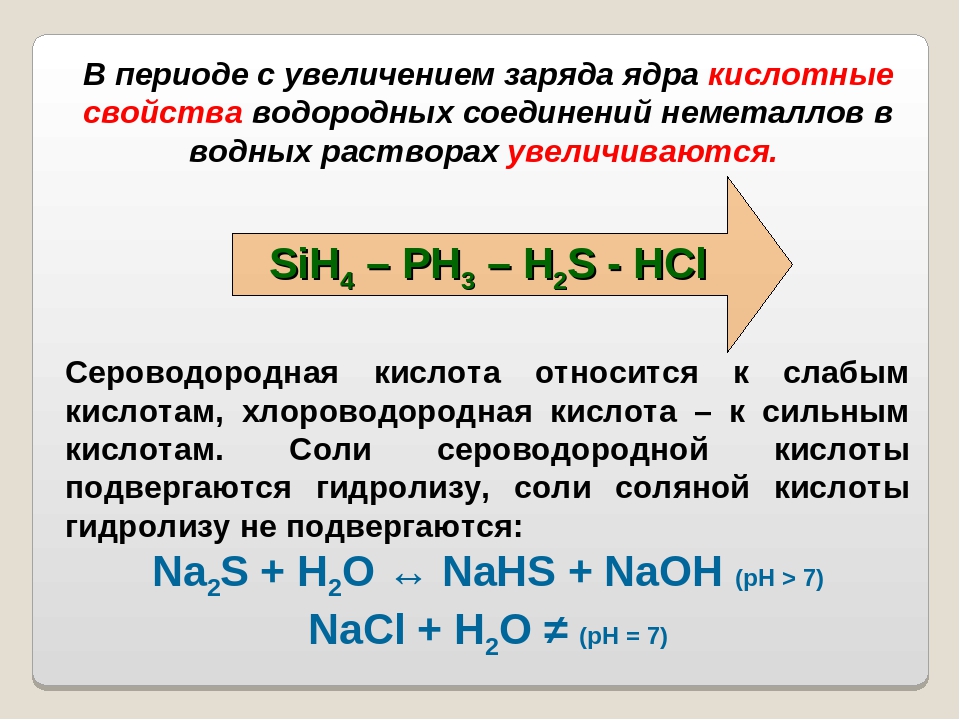
| Ответом к заданиям 26–28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин в бланке ответа указывать не нужно. При проведении расчётов для всех элементов, кроме хлора, используйте значения относительных атомных масс, выраженные целыми числами (Ar(Cl) = 35,5). |
26. В 100 г воды растворили 35 г медного купороса (пентагидрата сульфата меди(II)). Рассчитайте массовую долю (в %) сульфата меди(II) в растворе. (Запишите число с точностью до десятых.)
27. Разложение оксида серебра описывается термохимическим уравнением:
2Ag2O = 4Ag + O2 – 62 кДж
При разложении навески оксида серебра поглотилось 1,55 кДж теплоты. Сколько граммов серебра образовалось? (Запишите число с точностью до десятых.)
28. Для окисления бромоводородной кислоты потребовалось 5,01 г бромата калия.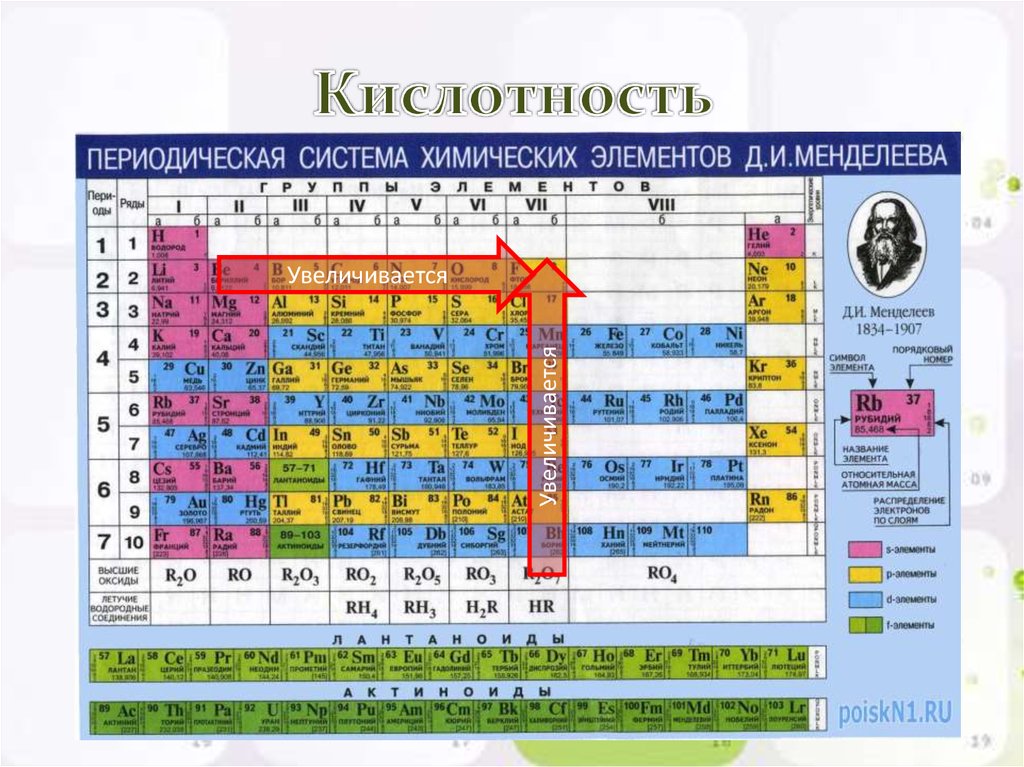 Сколько граммов HBr вступило в реакцию? (Запишите число с точностью до сотых.)
Сколько граммов HBr вступило в реакцию? (Запишите число с точностью до сотых.)
| Для записи ответов на задания 29–34 используйте чистый лист бумаги. Запишите сначала номер задания (29, 30 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво. |
| Для выполнения заданий 29 и 30 используйте следующий перечень веществ: нитрат натрия, хлорат калия, аммиак, гидросульфит натрия, разбавленная серная кислота, хлорид хрома(III). Допустимо использование водных растворов веществ и воды в качестве среды для протекания реакций. |
29. Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция, происходящая без выделения газа и без изменения цвета раствора. В ответе запишите уравнение реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из предложенного перечня выберите два вещества, которые вступают в реакцию ионного обмена с выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
31. Йод нагрели с 30 %-м раствором пероксида водорода. Полученный раствор упарили, а затем охладили. Выпал осадок, который высушили и прокалили. Над твёрдым остатком от прокаливания пропустили газ, полученный нагреванием муравьиной кислоты с концентрированной серной кислотой, и наблюдали потемнение твёрдого вещества. Напишите молекулярные уравнения четырёх описанных реакций.
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
33. Смесь аммиака с кислородом общим объёмом 11,2 л (н. у.) подожгли без катализатора, продукты охладили, а образовавшуюся смесь газов пропустили через 117,6 г 10 %-го раствора серной кислоты, в результате масса раствора увеличилась. Объём оставшегося непоглощённым газа составил 2,24 л (н. у.). Вычислите объёмные доли газов в исходной смеси и массовые доли веществ (кроме воды) в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
у.) подожгли без катализатора, продукты охладили, а образовавшуюся смесь газов пропустили через 117,6 г 10 %-го раствора серной кислоты, в результате масса раствора увеличилась. Объём оставшегося непоглощённым газа составил 2,24 л (н. у.). Вычислите объёмные доли газов в исходной смеси и массовые доли веществ (кроме воды) в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Вариант ответа:
1) Записано уравнение реакции сгорания аммиака и определены количества вещества газов:
4NH3 + 3O2 = 2N2 + 6H2O
n(смеси) = 11,2 / 22,4 = 0,5 моль.
Непоглощённый газ – N2,
n(N2) = 2,24 / 22,4 = 0,1 моль.
2) Определён состав газовой смеси.
В реакцию сгорания вступило:
n(NH3) = 2n(N2) = 0,2 моль,
n(O2) = 3/2n(N2) = 0,15 моль.
Масса раствора c H2SO4 увеличилась, следовательно, аммиак был в избытке.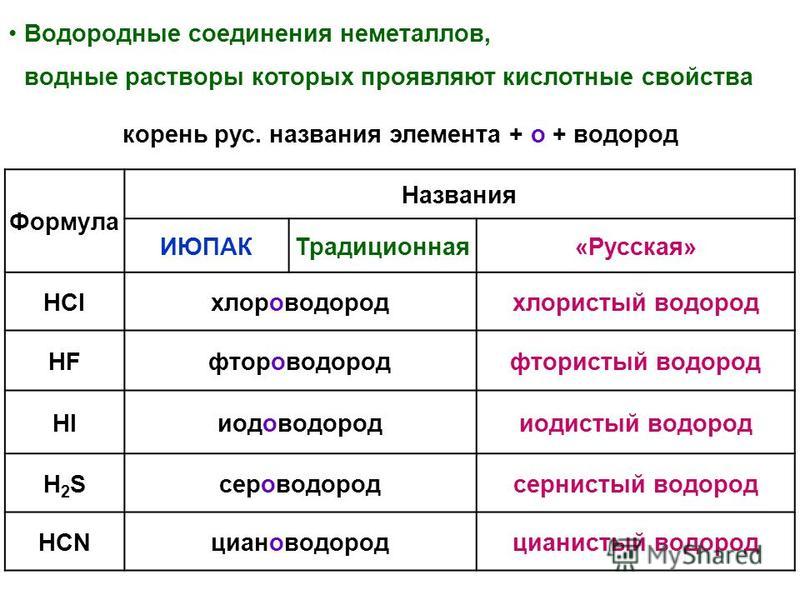
Общее количество аммиака в смеси:
n(NH3) = 0,5 – 0,15 = 0,35 моль.
Объёмные доли газов: φ(NH3) = 0,35 / 0,5 ⋅ 100 % = 70 %,
φ(O2) = 100 % – 70 % = 30 %.
3) Написаны уравнения реакций с серной кислотой и определены количества веществ в растворе:
n(H2SO4) = 117,6 ⋅ 0,1 / 98 = 0,12 моль,
nост(NH3) = 0,35 – 0,2 = 0,15 моль.
При поглощении аммиака последовательно происходят реакции:
NH3 + H2SO4 = NH4HSO4
NH3 + NH4HSO4 = (NH4)2SO4.
В первую реакцию вступит по 0,12 моль веществ, во вторую – по
0,15 – 0,12 = 0,03 моль.
n(NH4HSO4) = 0,12 – 0,03 = 0,09 моль,
n((NH4)2SO4) = 0,03 моль.
4) Определены массовые доли солей в растворе.
m(раствора) = m(раствора H2SO4) + mост(NH3) = 117,6 + 0,15 ⋅ 17 = 120,15 г.
ω(NH4HSO4) = 0,09 ⋅ 115 / 120,15 = 0,086 = 8,6 %,
ω((NH4)2SO4) = 0,03 ⋅ 132 / 120,15 = 0,033 = 3,3 %
Ответ
Свернуть
34. Неизвестное органическое вещество X содержит 72,0 % углерода, 12,0 % водорода по массе и кислород. Это легкоплавкое твёрдое вещество. Его получают гидрированием ароматического соединения. Оно реагирует с подкисленным раствором перманганата калия, а при окислении концентрированной азотной кислотой превращается в неразветвлённую
двухосновную кислоту. Определите молекулярную формулу вещества X и установите его структуру. Напишите уравнение взаимодействия X с азотной кислотой (в уравнении используйте структурные формулы органических веществ).
Понравилось это:
Нравится Загрузка…
5.2: Сила кислоты и pKa
Цели
После завершения этого раздела вы сможете
- написать выражение для K a слабой кислоты.

- преобразует данное значение K в значение в значение p K в значение , а наоборот .
- расположите ряд кислот в порядке возрастания или убывания силы, учитывая их K a или p K и значений.
- расположите ряды оснований в порядке возрастания или убывания силы, учитывая значения K a или p K a их сопряженных кислот.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте ключевые термины ниже.
- константа кислотности, K a
- константа равновесия, К экв
Учебные заметки
Вычисления и выражения с участием K a и p K a были подробно рассмотрены в вашем первом курсе общей химии. Обратите внимание, что константа кислотности также известна как константа диссоциации кислоты.
Вы, несомненно, знаете, что некоторые кислоты сильнее других. Серная кислота достаточно сильна, чтобы ее можно было использовать в качестве очистителя канализации, так как она быстро растворяет засоры из волос и других органических материалов.
Неудивительно, что концентрированная серная кислота также вызывает болезненные ожоги при попадании на кожу и необратимые повреждения при попадании в глаза (не зря вы носите защитные очки в химической лаборатории!). Уксусная кислота (уксус) также обожжет вашу кожу и глаза, но ее недостаточно, чтобы эффективно очищать канализацию. Вода, которая, как мы знаем, может служить донором протонов, очевидно, не очень сильная кислота. Даже ион гидроксида теоретически может действует как кислота — в конце концов, у него есть протон, который он может отдать, — но это не та реакция, которую мы обычно считаем уместной только в самых экстремальных условиях.
Относительная кислотность различных соединений или функциональных групп — другими словами, их относительная способность отдавать протон общему основанию в идентичных условиях — количественно определяется числом, называемым константой кислотной диссоциации , сокращенно K a .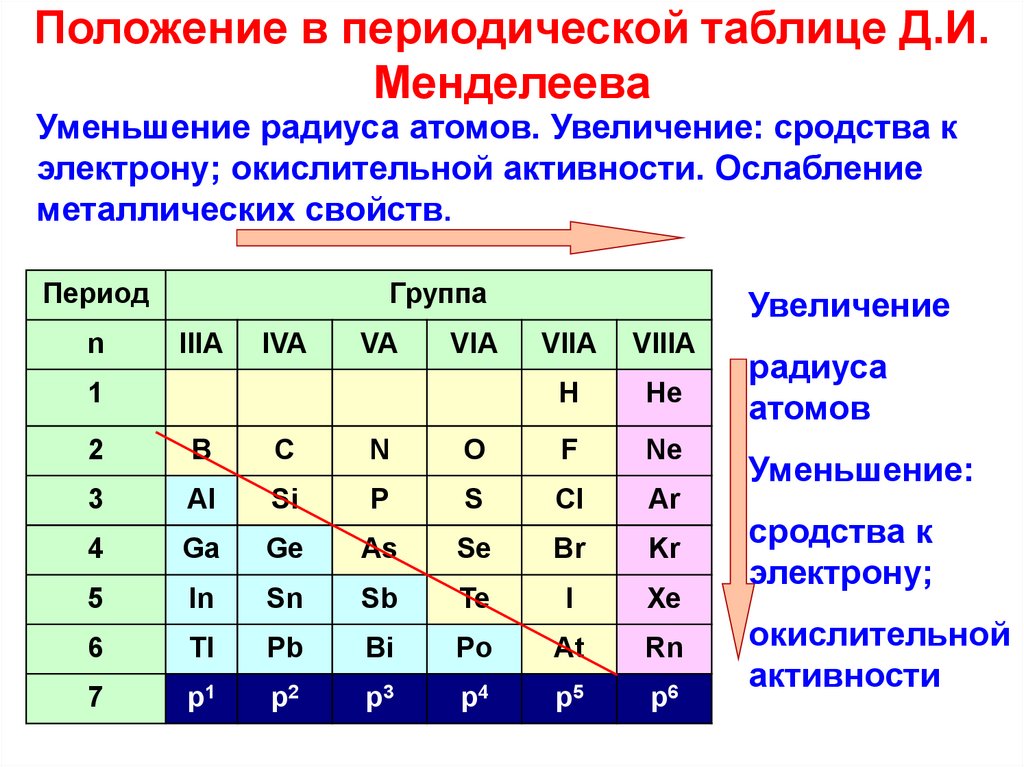 Общей основой, выбранной для сравнения, является вода.
Общей основой, выбранной для сравнения, является вода.
В качестве первого примера рассмотрим уксусную кислоту. Когда к воде добавляется небольшое количество уксусной кислоты, в некоторой степени происходит событие переноса протона (кислотно-щелочная реакция).
Обратите внимание на фразу «в некоторой степени» — эта реакция , а не , протекает до конца, при этом вся уксусная кислота превращается в ацетат, сопряженное с ней основание. Скорее, достигается динамическое равновесие с переносом протонов в обоих направлениях (таким образом, двусторонние стрелки) и конечными концентрациями всех четырех видов в игре. Природа этой равновесной ситуации, как вы помните из «Общей химии», выражается константой равновесия К.
Константа равновесия на самом деле является отношением активностей (обозначается символом \(a\)), но активности редко используются в курсах, кроме аналитической или физической химии. Для упрощения обсуждения в курсах общей и органической химии активность всех растворенных веществ заменена молярностью, а активность растворителя (обычно воды) определяется как имеющая значение 1.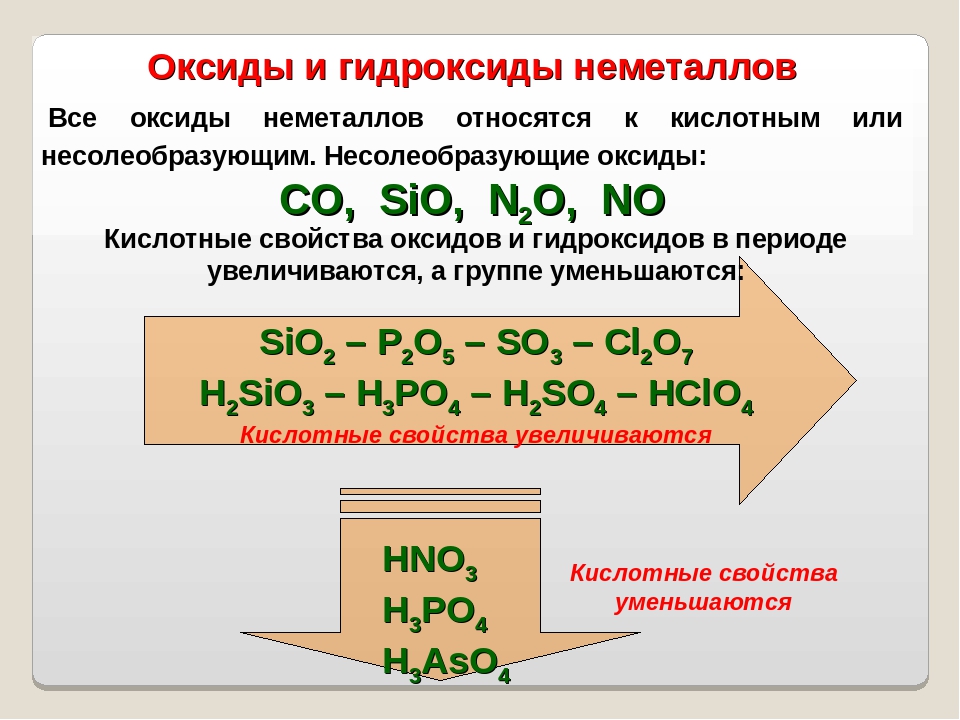
В нашем примере мы к большому количеству воды добавили небольшое количество уксусной кислоты: вода – это 9+]} \label{Second} \]
Уравнение \(\ref{First}\) применяется к нейтральной кислоте, такой как HCl или уксусная кислота, а уравнение \(\ref{Second}\) применяется к катионной кислотоподобный аммоний (NH 4 + ).
Значение K a = 1,75 x 10 -5 для уксусной кислоты очень мало — это означает, что на самом деле происходит очень небольшая диссоциация, и в равновесном растворе уксусной кислоты гораздо больше, чем ацетат-иона. . Уксусная кислота является относительно слабой кислотой, по крайней мере, по сравнению с серной кислотой (K а = 10 9 ) или соляной кислоты (К а = 10 7 ), которые претерпевают практически полную диссоциацию в воде.
Число вроде 1,75 х 10 — 5 не очень легко ни произнести, ни запомнить. Химики часто используют значения pK a как более удобный термин для выражения относительной кислотности. pK a связано с K a следующим уравнением
pK a связано с K a следующим уравнением
\[pK_a = -\log K_a \nonumber \]
Подсчитав, мы находим, что pK a уксусной кислоты составляет 4,8. Использование значений pK и позволяет нам выразить кислотность обычных соединений и функциональных групп по числовой шкале примерно от –10 (очень сильная кислота) до 50 (совсем некислая). В таблице \(\PageIndex{1}\) в конце текста перечислены точные или приблизительные значения pK и для различных типов протонов, с которыми вы, вероятно, столкнетесь при изучении органической и биологической химии. Глядя на таблицу \(\PageIndex{1}\), вы видите, что pK a карбоновых кислот находятся в диапазоне 4-5, pK a серной кислоты составляет –10, а pK a воды составляет 14. Алкены и алканы, которые вообще не являются кислотными, имеют pK a значения выше 30. Чем ниже значение pK a , тем сильнее кислота.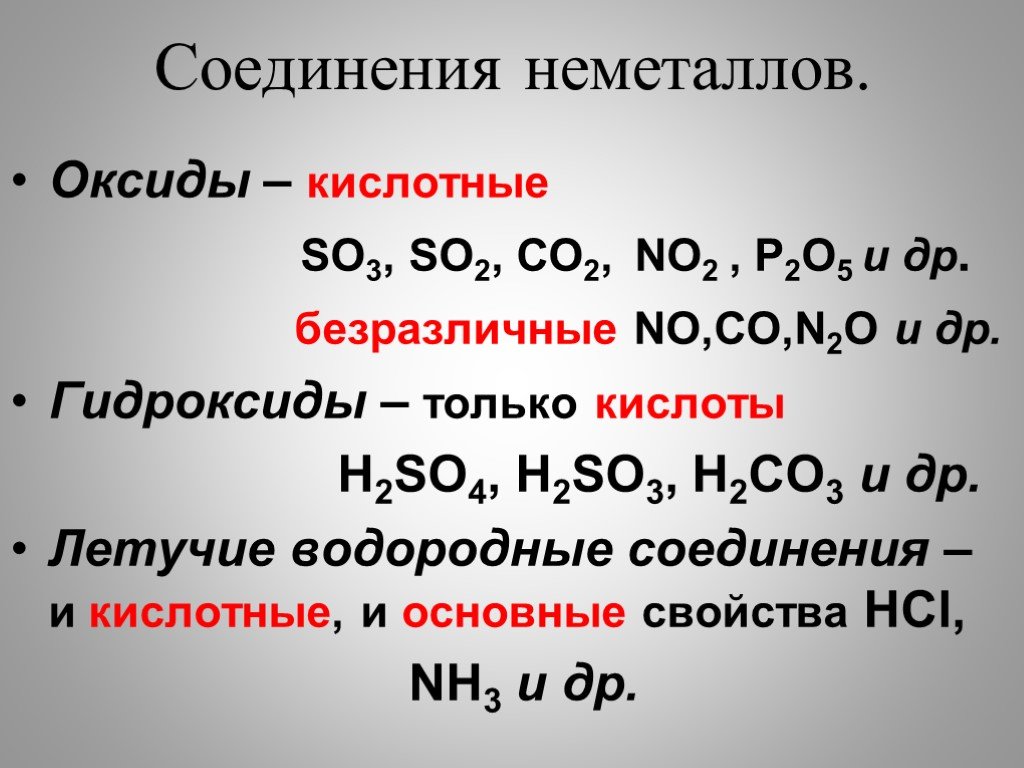
Таблица \(\PageIndex{1}\): Репрезентативные кислотные константы
| | | протонированный кетон pK a ~ −7 | |
| сложный моноэфир фосфорной кислоты ПК и ~ 1 | диэфир фосфорной кислоты pK a ~ 1,5 | фосфорная кислота pK a 2.2 | протонированный анилин pK a ~ 4,6 | карбоновая кислота pK a ~ 4-5 |
| пиридиний pK a 5.  3 3 | угольная кислота pK a 6,4 | цианистый водород pK a ~ 9,2 | аммоний pK a 9.2 | фенол рК а 9,9 |
| тиол pK a ~ 10-11 | вода pK a 14.00 | амид pK a ~ 17 | спирт pK a ~ 16-18 | альфа-протон pK a ~ 18-20 |
| концевой алкин pK a ~ 25 | концевой алкен pK a ~ 35 | аммиак pK a ~ 35 |
Важно понимать, что pK a — это , а не , то же самое, что и pH: pK 9+] \номер \]
Любая конкретная кислота всегда будет иметь один и тот же pK a (при условии, что речь идет о водном растворе при комнатной температуре), но разные водные растворы кислоты могут иметь разные значения pH, в зависимости от того, как к какому количеству воды добавляется кислота.
Наша таблица значений pK и также позволит нам сравнить силы различных оснований путем сравнения значений pK и их сопряженных кислот. Ключевая идея, которую нужно запомнить, заключается в следующем: чем сильнее сопряженная кислота, тем слабее сопряженное основание . Серная кислота является самой сильной кислотой в нашем списке со значением pK a , равным –10, поэтому HSO 4 — является самым слабым сопряженным основанием. Вы можете видеть, что ион гидроксида является более сильным основанием, чем аммиак (NH 3 ), поскольку аммоний (NH 4 + , pK a = 9,2) является более сильной кислотой, чем вода (pK a = 14,00). ).
Чем сильнее сопряженная кислота, тем слабее сопряженное основание.
Хотя в таблице \(\PageIndex{1}\) приведены значения pK a только для ограниченного числа соединений, она может быть очень полезной в качестве отправной точки для оценки кислотности или основности практически любой органической молекулы.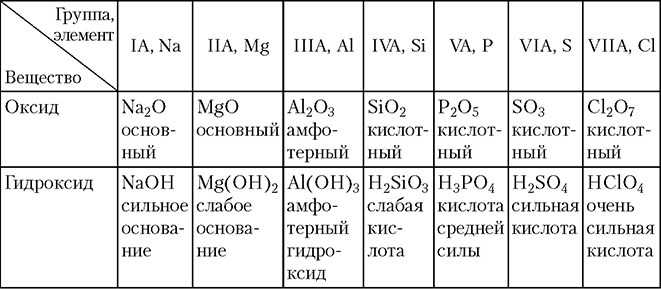 Вот где ваше знакомство с органическими функциональными группами будет очень кстати. Что такое, например, pK a циклогексанола? Его нет на столе, но, поскольку это спирт, он, вероятно, где-то рядом с этанолом (pK a = 16). Точно так же мы можем использовать таблицу \(\PageIndex{1}\), чтобы предсказать, что пара-гидроксифенилацетальдегид, промежуточное соединение в биосинтезе морфина, имеет pK a около 10, что близко к нашему эталону. соединения, фенол.
Вот где ваше знакомство с органическими функциональными группами будет очень кстати. Что такое, например, pK a циклогексанола? Его нет на столе, но, поскольку это спирт, он, вероятно, где-то рядом с этанолом (pK a = 16). Точно так же мы можем использовать таблицу \(\PageIndex{1}\), чтобы предсказать, что пара-гидроксифенилацетальдегид, промежуточное соединение в биосинтезе морфина, имеет pK a около 10, что близко к нашему эталону. соединения, фенол.
Обратите внимание, что в этом примере нам нужно оценить потенциальную кислотность в четырех различных местах молекулы.
pK a H a ~ 10
pK a H b = не табл. (не кислотный)
pK a H c ~ 19
pK a H d = не табл. (не кислотный)
не ароматические альдегиды все кислые (значения pK a выше 40 – не в нашей таблице). Два протона на углероде рядом с карбонилом слегка кислые, со значениями pK a около 19-20 в соответствии с таблицей. Наиболее кислый протон находится в фенольной группе, поэтому, если соединение должно реагировать с одним молярным эквивалентом сильного основания, этот протон будет отдан первым.
Наиболее кислый протон находится в фенольной группе, поэтому, если соединение должно реагировать с одним молярным эквивалентом сильного основания, этот протон будет отдан первым.
Продолжая изучать органическую химию, было бы неплохо запомнить примерные диапазоны pK a некоторых важных функциональных групп, включая воду, спирты, фенолы, аммоний, тиолы, фосфаты, карбоновые кислоты. и углероды рядом с карбонильными группами (так называемые а-углероды). Это группы, которые вы, скорее всего, увидите в качестве кислот или оснований в биологических органических реакциях.
Предостережение: при использовании таблицы pK a будьте абсолютно уверены, что вы рассматриваете правильную сопряженную пару кислота/основание. Если вас попросят сказать что-нибудь об основности аммиака (NH 3 ) по сравнению с этоксид-ионом (CH 3 CH 2 O — ), например, соответствующие значения pK a , которые следует учитывать, составляют 9,2 (pK a иона аммония) и 16 (рК и этанола). Из этих чисел вы знаете, что этоксид является более сильным основанием. Не делайте ошибку, используя значение pK a , равное 38: это pK a аммиака , действующего как кислота , и говорит вам, насколько основным является NH 2 — ион (очень щелочной!)
Из этих чисел вы знаете, что этоксид является более сильным основанием. Не делайте ошибку, используя значение pK a , равное 38: это pK a аммиака , действующего как кислота , и говорит вам, насколько основным является NH 2 — ион (очень щелочной!)
Пример \(\PageIndex{1}\): Кислотные группы
Используя таблицу pK a , оцените значения pK a для наиболее кислотной группы соединений. ниже и нарисуйте структуру сопряженного основания, которое получается, когда эта группа отдает протон. Используйте приведенную выше таблицу pKa и/или справочные таблицы.
- Ответить
а. Наиболее кислой группой является протонированный амин, pKa ~ 5-9.
б. Альфа-протон по группе С=О, pKa ~ 18-20
с. Тиол, pKa ~ 10
д. Карбоновая кислота, pKa ~ 5
эл. Карбоновая кислота, pKa ~ 5
Пример \(\PageIndex{2}\)
Известно, что уксусная кислота (CH 3 COOH) имеет pK a 4,76.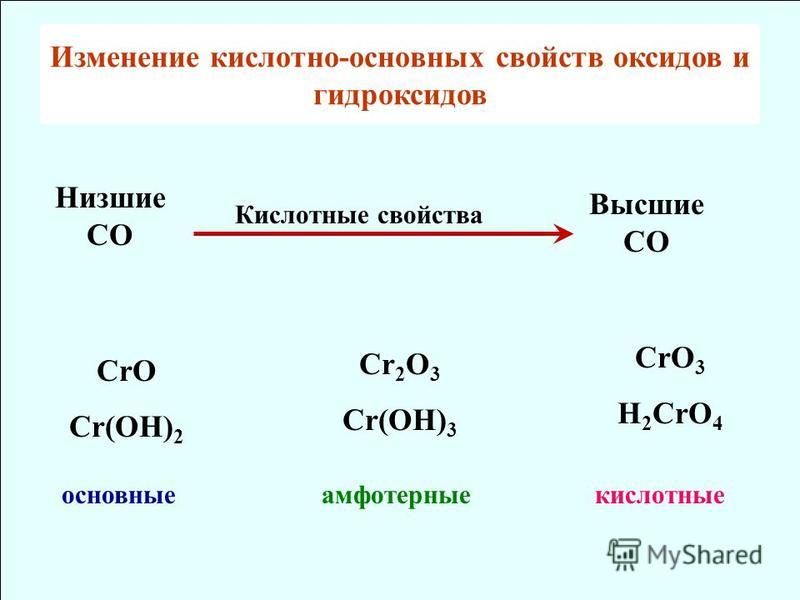 Пожалуйста, определите Ka для уксусной кислоты.
Пожалуйста, определите Ka для уксусной кислоты.
Решение
Решив K a алгебраически, вы получите следующее:
pK a = -Log(K a )
-pK a = Log(K a )
10 -pK a 9001 = K С помощью калькулятора сначала введите значение для pK a (4,76). Сделайте число отрицательным (-4,76). Затем используйте обратную логарифмическую функцию. Все калькуляторы немного отличаются друг от друга, поэтому эта функция может отображаться как: АНТИЛОГ, ИНВ ЛОГ или 10 X . Часто это вторая функция кнопки LOG. К a для уксусной кислоты = 10 -pK a = 1,74 x 10 -5 окисление спиртов См. все СМИ См. всю связанную информацию → карбоновая кислота , любое из класса органических соединений, в которых атом углерода (C) связан с атомом кислорода (O) двойной связью и с гидроксильной группой (―OH) посредством одинарная связь. Четвертая связь связывает атом углерода с атомом водорода (Н) или с какой-либо другой одновалентной связывающей группой. Карбоксильная группа (СООН) названа так из-за карбюраторная онильная группа (C=O) и гидроксильная оксильная группа . Основной химической характеристикой карбоновых кислот является их кислотность. Обычно они более кислые, чем другие органические соединения, содержащие гидроксильные группы, но обычно слабее известных минеральных кислот (например, соляной кислоты, HCl, серной кислоты, H 2 SO 4 и т. д.). Карбоновые кислоты широко распространены в природе. Жирные кислоты являются компонентами глицеридов, которые, в свою очередь, являются компонентами жира. Гидроксильные кислоты, такие как молочная кислота (содержится в кисломолочных продуктах) и лимонная кислота (содержится в цитрусовых), и многие кетокислоты являются важными продуктами метаболизма, присутствующими в большинстве живых клеток. Белки состоят из аминокислот, которые также содержат карбоксильные группы. Соединения, в которых ―ОН карбоксильной группы заменен некоторыми другими группами, называются производными карбоновых кислот, наиболее важными из которых являются ацилгалогениды, ангидриды кислот, сложные эфиры и амиды. Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас Щелкните здесь, чтобы просмотреть таблицу в полном размере. Производные карбоновых кислот находят разнообразное применение. Например, муравьиная кислота, простейшая карбоновая кислота, помимо использования в качестве дезинфицирующего средства, используется при обработке текстиля и в качестве реагента, уменьшающего кислотность. Уксусная кислота широко используется в производстве целлюлозных пластиков и сложных эфиров. Аспирин, сложный эфир салициловой кислоты, получают из уксусной кислоты. Пальмитиновая кислота и стеариновая кислота играют важную роль в производстве мыла, косметики, фармацевтических препаратов, свечей и защитных покрытий. Стеариновая кислота также используется в производстве резины. Акриловая кислота используется в виде сложного эфира при производстве полимеров (молекул с длинной цепью), известных как акрилаты. Метакриловая кислота представляет собой сложный эфир и полимеризуется с образованием Lucite. Название карбоновой кислоты по классификации ИЮПАК происходит от названия самой длинной углеродной цепи, содержащей карбоксильную группу, путем удаления конечной буквы -e из названия исходного алкана и добавления суффикса -oic, за которым следует слово «кислота». Цепь нумеруется, начиная с углерода карбоксильной группы. Поскольку карбоксильный углерод понимается как углерод 1, нет необходимости давать ему номер. Например, соединение CH 3 CH 2 COOH имеет три атома углерода и называется пропановой кислотой, от пропана, названия трехуглеродной цепи, с добавлением -ойной кислоты, суффикса для этого класса соединений. . Если карбоновая кислота содержит двойную углерод-углеродную связь, окончание -ановой кислоты изменяется на -еновую кислоту, чтобы указать на наличие двойной связи, и используется число, чтобы показать расположение двойной связи. Большинство простых карбоновых кислот вместо того, чтобы называться их именами IUPAC, чаще упоминаются общепринятыми названиями, которые старше их систематических названий. При использовании общеупотребительных названий заместители в углеводородной цепи обозначаются греческими буквами, а не цифрами, и счет начинается не с карбоксила, а с соседнего углерода. Упражнения
Карбоновая кислота | Структура, свойства, формула, использование и факты


 Олеиновая кислота используется в производстве мыла, моющих средств и текстиля.
Олеиновая кислота используется в производстве мыла, моющих средств и текстиля. Большинство простых карбоновых кислот первоначально были выделены из биологических источников; поскольку их структурные формулы часто были неизвестны во время выделения, им давали имена, которые обычно производились от названий источников. Например, CH 3 CH 2 CH 2 COOH, масляная кислота, впервые полученная из сливочного масла, получила название от латинского butyrum , что означает «масло». Кислоты, содержащие нечетное число атомов углерода больше девяти, обычно не имеют общих названий. Причина в том, что длинноцепочечные карбоновые кислоты первоначально были выделены из жиров (которые представляют собой сложные эфиры карбоновых кислот), и обычно эти жиры содержат карбоновые кислоты только с четным числом атомов углерода (поскольку процесс, посредством которого живые организмы синтезируют такие жирные кислоты, ставит молекулы объединяются в двухуглеродные фрагменты).
Большинство простых карбоновых кислот первоначально были выделены из биологических источников; поскольку их структурные формулы часто были неизвестны во время выделения, им давали имена, которые обычно производились от названий источников. Например, CH 3 CH 2 CH 2 COOH, масляная кислота, впервые полученная из сливочного масла, получила название от латинского butyrum , что означает «масло». Кислоты, содержащие нечетное число атомов углерода больше девяти, обычно не имеют общих названий. Причина в том, что длинноцепочечные карбоновые кислоты первоначально были выделены из жиров (которые представляют собой сложные эфиры карбоновых кислот), и обычно эти жиры содержат карбоновые кислоты только с четным числом атомов углерода (поскольку процесс, посредством которого живые организмы синтезируют такие жирные кислоты, ставит молекулы объединяются в двухуглеродные фрагменты).


Leave A Comment