Опровергнута самая популярная теория строения воды
Учёные СФУ совместно с коллегами из Королевского института технологий Швеции опровергли самую популярную ныне кластерную теорию строения воды. В ходе работы исследователи предложили новую теорию, согласующуюся с результатами их эксперимента. Работа опубликована в журнале Nature Communications. Исследования поддержаны грантом Российского научного фонда.
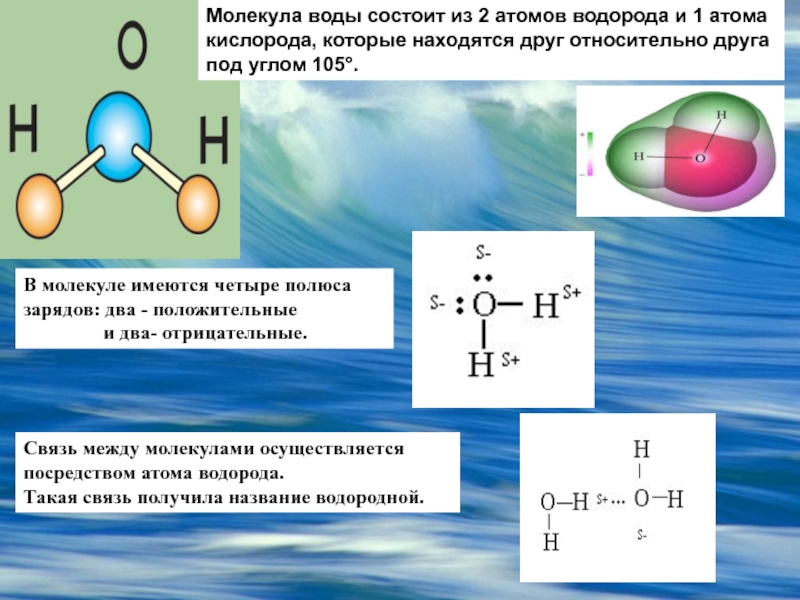
Вода — одно из самых распространённых, но в то же время необычных веществ на Земле. Она обладает рядом нетипичных свойств, объясняемых её особой структурой, например, высокой теплоёмкостью и низкой электропроводностью. Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода. Свободные, не входящие в кластеры (группы молекул, связанных водородными связями) молекулы присутствуют лишь в небольшом количестве.
 Более того, выполненные теоретические расчёты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.
Более того, выполненные теоретические расчёты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.Второй не менее важный результат этой работы — получение детальной структурной информации о том, как влияют водородные связи на силу OH-связи. Колебательная инфракрасная (ИК) спектроскопия — общепринятый инструмент для исследования водородных связей в жидкостях. Но в них ИК-спектроскопия показывает лишь наиболее интенсивный переход в состояние с минимальной энергией колебаний, которое «слабо чувствует» межмолекулярное взаимодействие. Спектроскопия резонансного неупругого рассеяния воды качественно отличается от ИК-спектроскопии тем, что, получив энергию от рентгеновского фотона, электрон кислорода переходит с самой глубокой орбитали на первую незанятую.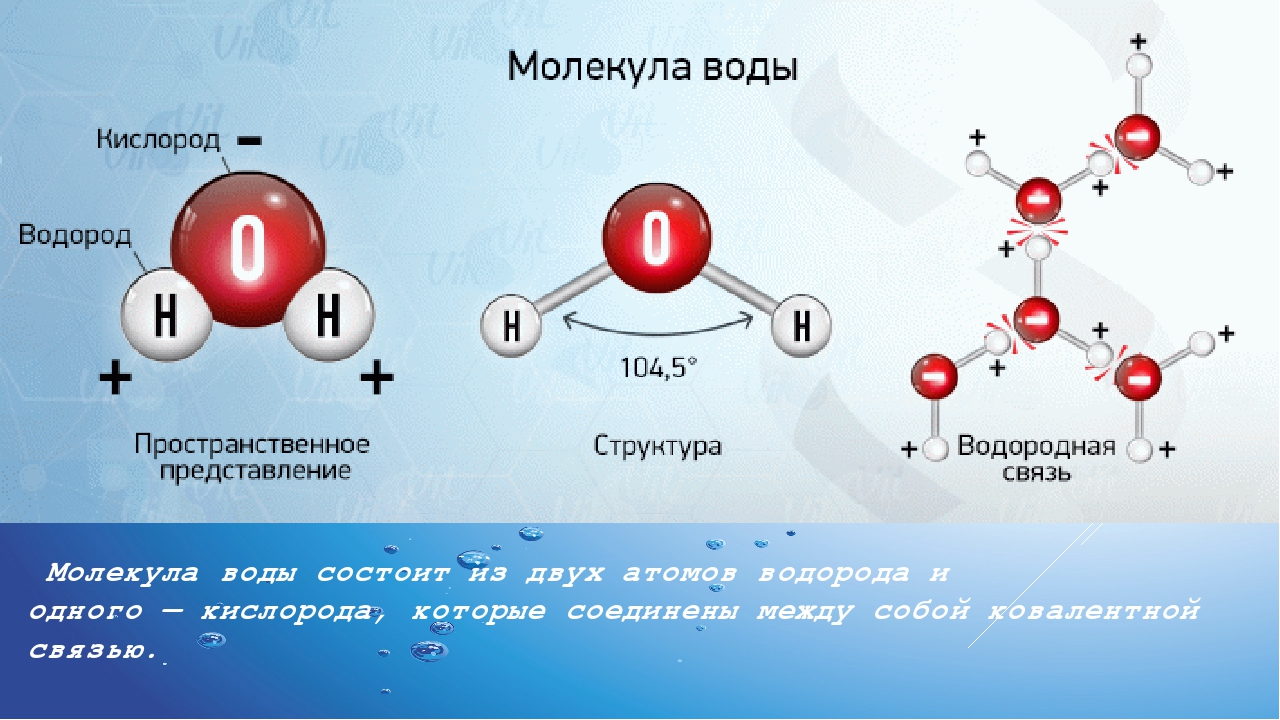
«Важно отметить, что, в отличие от изолированной молекулы воды с одной энергией взаимодействия О и Н, в жидкости имеется набор (распределение) таких энергий в силу многообразия ближайшего окружения молекулы воды.— дополняет Фарис Гельмуханов, доктор физико-математических наук, профессор Королевского технологического института (Стокгольм, Швеция), старший научный сотрудник Сибирского федерального университета.Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,
В работе также приняли участие учёные из Университета Потсдама (Германия), Университета Цюриха (Швейцария) и Университета Турку (Финляндия).
Рисунки
- A) Молекула воды, поглотив фотон, возбуждается из основного состояния (0) в высоковозбуждённое диссоциативное состояние (с), где атом водорода быстро покидает точку равновесия.
 В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно. - Б) рентгеновский спектр поглощения воды.
- B) Спектры испускания c→f и c→0 вблизи 526 эВ и 535 эВ, соответственно. Эмиссионный спектр c→f вблизи 525 эВ показывает динамическое формирование (в процессе диссоциации) дублета с расщеплением Δ (см. панель A). При возвращении молекулы в основное состояние c→0 в процессе диссоциации заселяются высокие колебательные уровни, что формирует протяжённую колебательную прогрессию в районе 535 эВ.
- Г) В работе решена обратная задача восстановления из колебательной прогрессии распределения OH-потенциалов воды в жидкой фазе.
Пресс-служба РНФ, пресс-служба СФУ,
Элементы жизни. Вода — Индикатор
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела.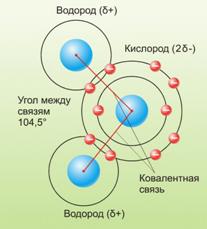 Вода как бы «выталкивает» эти вещества.
Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно. Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям прежде всего в виде углекислого газа, который мы выдыхаем, но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы. Например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых суперземлях — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (NH3). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода, ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт, или метанол (CH3OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем.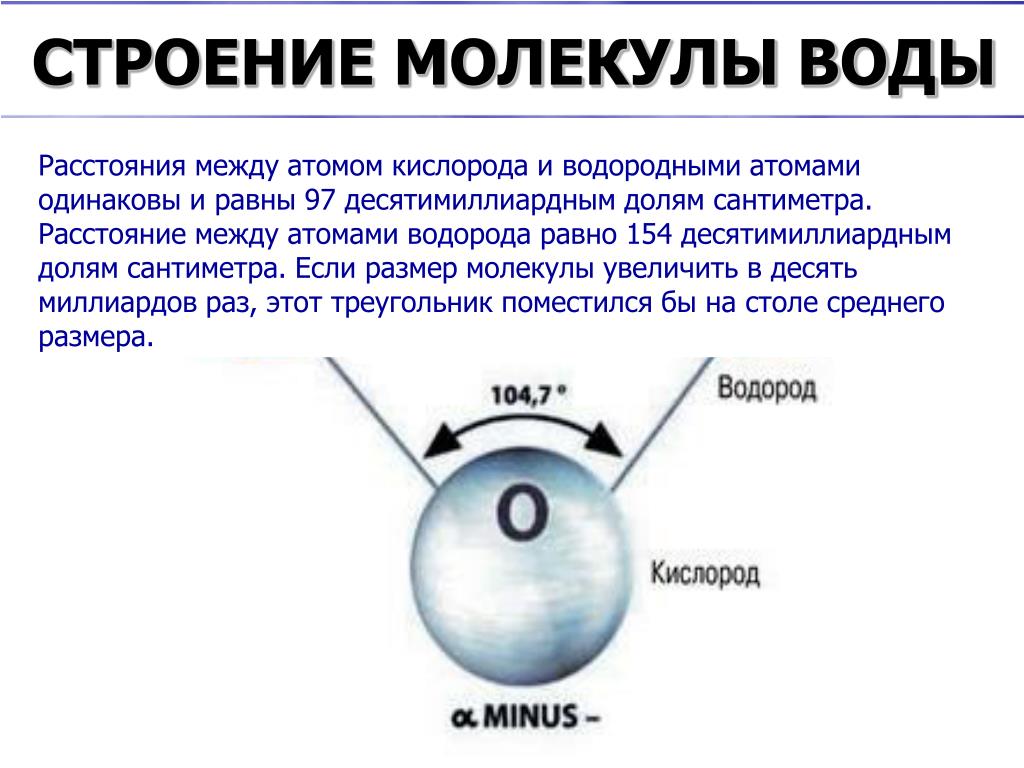 Вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Почему снежинка шестиугольная
— Я слышал этот вопрос миллион раз, и он каждый раз вызывает у меня недоумение.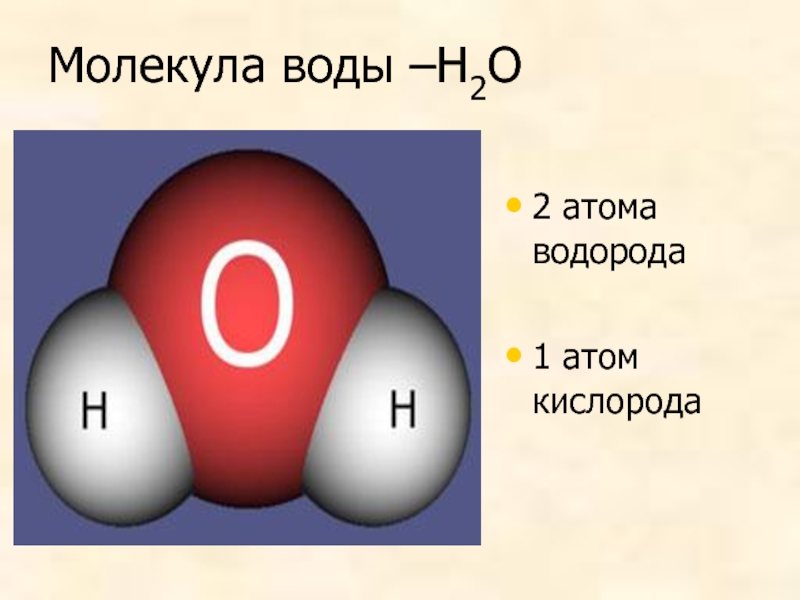
Разве что-то во Вселенной бывает абсолютно одинаковым? Не бывает двух одинаковых кристаллов соли, двух одинаковых отпечатков пальцев или двух одинаковых цветочков ромашки. Там, где растет один кристалл и где другой, могут быть разные температурные режимы, разные течения питающего раствора. Они абсолютно одинаковыми и не должны быть. Но они могут быть очень похожими.
— Что еще можно добавить о снежинках из научно-популярных фатов?
— Очень часто, даже как правило, снежинки являются так называемыми скелетными кристаллами. Это само по себе достаточно необычно. Большинство веществ образуют кристаллы, являющиеся выпуклыми многогранниками. А снежинки являются не выпуклыми многогранниками, а, наоборот, выпирают наружу ребра и вершины, а грани являются как бы вдавленными внутрь.
Обычная снежинка выглядит подобно ветке дерева: от ствола отходят ветки, а от них — еще более мелкие ветки.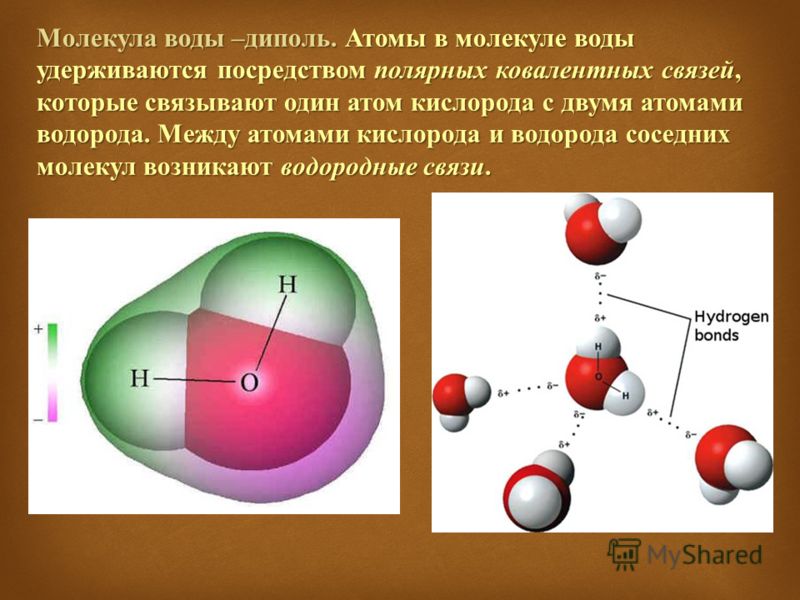 Это фрактальная структура, если хотите. Почему же так происходит в случае снежинок? Обычно скелетные кристаллы образуются при быстрой кристаллизации из сильно пересыщенных растворов или переохлажденных расплавов и газов. То есть такие скелетные формы образуются, когда кристалл растет быстро и пытается дотянуться до максимального количества питательной среды. Если бы кристаллы льда — снежинки — образовывались в более равновесных условиях, то они бы выросли как выпуклые многогранники (и такие кристаллы тоже известны). Но интересно, что в атмосфере, когда идет образование снега, условия не такие — они далеки от равновесных.
Это фрактальная структура, если хотите. Почему же так происходит в случае снежинок? Обычно скелетные кристаллы образуются при быстрой кристаллизации из сильно пересыщенных растворов или переохлажденных расплавов и газов. То есть такие скелетные формы образуются, когда кристалл растет быстро и пытается дотянуться до максимального количества питательной среды. Если бы кристаллы льда — снежинки — образовывались в более равновесных условиях, то они бы выросли как выпуклые многогранники (и такие кристаллы тоже известны). Но интересно, что в атмосфере, когда идет образование снега, условия не такие — они далеки от равновесных.
— Со снежинками современной науке все предельно ясно и понятно? Ими уже никто не занимается?
— Есть много людей, которые занимаются льдом. Лед вызывает большой интерес у людей, там интересная физика. Про лед можно долго рассказывать — у него есть много полиморфных модификаций, которые образуются, в частности, при высоких давлениях. Там много интересных явлений, таких как аморфизация, вызванная давлением.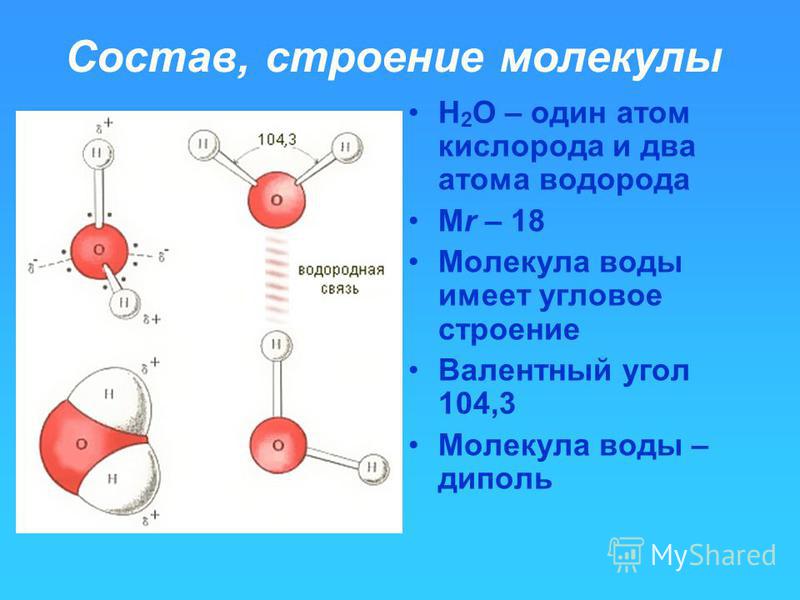
Есть люди, которые всю свою жизнь занимаются льдом и про лед знают всё. Я касался темы льда всего лишь несколько раз в своей жизни. Но мне никогда не было интересно посвящать свою жизнь одному конкретному соединению.
— В недавнем интервью вы сказали: «Я всегда делаю такие вещи, которые делать не принято, в науке занимаюсь задачами, которые считались нерешаемыми». Что вы имели в виду?
— В науке есть модные темы. И когда они возникают, в эти темы идет огромное число исследователей. Это неплохо само по себе, потому что модными темы становятся не просто так, а потому, что они интересны и многообещающи. Но я всегда сторонился модных тем, если только не видел, что могу в этой моде стать законодателем. Я люблю заниматься теми задачами, где нет толкучки и суеты, и при этом знаю, что могу сдвинуть гору и завтра эта тема станет модной. Как правило, темы, которыми я занимаюсь, вчера еще не были модными, а сегодня или завтра вдруг становятся популярными. Но мне удается избежать толкучки, потому что в этой теме я имею фору по времени.
Как правило, темы, которыми я занимаюсь, вчера еще не были модными, а сегодня или завтра вдруг становятся популярными. Но мне удается избежать толкучки, потому что в этой теме я имею фору по времени.
— Назовите, пожалуйста, сами темы, чтобы было понятно, чем занимается кристаллограф.
— Кристаллографы изучают расположение атомов в структуре вещества и то, как оно предопределяет свойства материалов. Это очень широкая и междисциплинарная область. Список тем, которыми занимаюсь я, таков: предсказание кристаллических структур, предсказание материалов с требуемыми свойствами, химия наночастиц, химия высоких давлений (новые типы соединений и высокотемпературная сверхпроводимость под давлением, химия планетных недр). В этих темах есть много задач, которые «спали», а мы их «разбудили» — и они теперь стали интересны большому кругу ученых.
Мы, ученые, все разные, и это очень хорошо. Мне кажется, что это и в науке, и в жизни очень важно — быть самим собой. Люди, как правило, сильно недооценивают и не вполне понимают этот принцип. Есть люди, которые считают, что быть собой — это ходить в трусах по улице и красить волосы в фиолетовый цвет, они так самовыражаются. А кто-то считает, что надо быть как другие и не высовываться. Я думаю, оба эти подхода неправильные. Мой принцип такой: знать себя, стараться понять себя и мир, в котором ты живешь, и следовать своим лучшим инстинктам. Развиваться, искать себя, не пытаться кого-то копировать, а стремиться найти свой путь и быть честным по отношению к себе и другим. Это применимо и к науке. Не нужно делать то, что делают все вокруг тебя. Жизнь пройдет, и ты так и не узнаешь, зачем ты ее прожил. Ученый не может себе позволить копировать других. Если ты всегда остаешься самим собой, то и научные задачи у тебя будут свои, и результаты будут свои. Когда человек остается самим собой, он незаменим. Когда же он копирует других, он по определению заменим и не уникален.
Есть люди, которые считают, что быть собой — это ходить в трусах по улице и красить волосы в фиолетовый цвет, они так самовыражаются. А кто-то считает, что надо быть как другие и не высовываться. Я думаю, оба эти подхода неправильные. Мой принцип такой: знать себя, стараться понять себя и мир, в котором ты живешь, и следовать своим лучшим инстинктам. Развиваться, искать себя, не пытаться кого-то копировать, а стремиться найти свой путь и быть честным по отношению к себе и другим. Это применимо и к науке. Не нужно делать то, что делают все вокруг тебя. Жизнь пройдет, и ты так и не узнаешь, зачем ты ее прожил. Ученый не может себе позволить копировать других. Если ты всегда остаешься самим собой, то и научные задачи у тебя будут свои, и результаты будут свои. Когда человек остается самим собой, он незаменим. Когда же он копирует других, он по определению заменим и не уникален.
Источник: naukatv.ru
Расположение атомов водорода в водородной связи
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода к атому кислорода обусловливает образование водородных связей между кислородом и водородом. Водородные связи обусловливают ассоциацию молекул воды в жидком состоянии и некоторые ее аномальные свойства, в частности, высокие температуры плавления и парообразования, высокую диэлектрическую проницаемость, максимальную плотность при 4°С, а также особую структуру льда. В кристаллах льда молекула воды образует четыре водородные связи с соседними молекулами, что приводит к возникновению тетраэдрической кристаллической структуры. Расположение молекул в таком кристалле отличается от плотной упаковки молекул, в решетке много свободных мест, поэтому лед имеет относительно невысокую плотность. [c.83]
Водородные связи обусловливают ассоциацию молекул воды в жидком состоянии и некоторые ее аномальные свойства, в частности, высокие температуры плавления и парообразования, высокую диэлектрическую проницаемость, максимальную плотность при 4°С, а также особую структуру льда. В кристаллах льда молекула воды образует четыре водородные связи с соседними молекулами, что приводит к возникновению тетраэдрической кристаллической структуры. Расположение молекул в таком кристалле отличается от плотной упаковки молекул, в решетке много свободных мест, поэтому лед имеет относительно невысокую плотность. [c.83] Однако, зная только порядок расположения аминокислот, нельзя еще представить себе совершенно отчетливо все уровни организации белковой молекулы. Даже прн осторожном нагревании белки нередко необратимо утрачивают свойства, присущие им в природном состоянии, иными словами, происходит денатурация белков. Причем обычно денатурация не сопровождается расщеплением полипептидной цепи чтобы расщепить цепь, нужны более жесткие условия.
 Следовательно, цепи образуют какую-то определенную структуру под действием слабых вторичных связей . В образовании таких вторичных связей обычно участвует атом водорода, находящийся между атомами азота и кислорода. Такая водородная связь в двадцать раз слабее обычной валентной связи. [c.130]
Следовательно, цепи образуют какую-то определенную структуру под действием слабых вторичных связей . В образовании таких вторичных связей обычно участвует атом водорода, находящийся между атомами азота и кислорода. Такая водородная связь в двадцать раз слабее обычной валентной связи. [c.130] Образование водородных связей происходит в том случае, когда молекулы растворенного вещества и растворителя содержат достаточно электроотрицательные атомы, а также соответствующим образом расположенный атом водорода. Водородная связь может образоваться между молекулой,, в -которой атом водорода присоединен к атому фтора, хлора, кислорода или азота (в виде исключения — к атому углерода), и молекулой, в которой имеется какой-либо донорный атом (в большинстве случаев это атомы кислорода или азота). Водородные связи типичны для растворителей, в молекулах которых содержатся а) как донорный атом,, так и атом водорода, способные образовать водородную связь (например, вода, спирты, фенолы, алифатические нитросоединения с группой =СН—N02) б) только донорный атом (например, кетоиы, простые эфиры, сложные эфиры, нитролы и ароматические нитросоединения) в) только атом водорода, способный образовать водородную связь. [c.111]
[c.111]
К этому типу относится очень большая группа водородных связей, начиная от ассоциированных спиртов, которые почти лишены кислотности (при ассоциации с эфиром Av составляет 10—20 м- ), до таких предельных случаев, как кислый ацетат калия, у которого атом водорода расположен симметрично между двумя атомами кислорода. Делались попытки классификации различных типов таких связей в пределах всей группы. Шигорин [57] предположил, что водородные связи бывают трех типов с атомами кислорода, не участвующими в образовании двойной связи с атомами кислорода, имеющими я-электронное облако, и с атомами кислорода с сопряженным. я-электронным облаком, допускающим резонансные эффекты. Конечно, верно, что более сильные водородные связи наблюдаются у резонансных систем, но при классификации подобного типа возникает так много трудностей, например при попытках соответствующего расположения очень сильных водородных связей нерезонансных систем между кислотами и эфирами, что мы проводим рассмотрение связей ОН- -О главным образом с точки зрения природы оснований. Впрочем, вопрос об исключительно сильных и симметричных связях ОН- -О рассматривается отдельно в разд. 8.2.6. [c.268]
Впрочем, вопрос об исключительно сильных и симметричных связях ОН- -О рассматривается отдельно в разд. 8.2.6. [c.268]
Одной из наиболее интересных разновидностей диполь-дипольного взаимодействия является водородная связь. В обычных условиях валентность водорода равна 1, и он способен обобществлять с другими атомами одну электронную пару, образуя самую обычную ковалентную связь кроме того, атом водорода может присоединять электрон, образуя гидрид-ион Н . Однако, будучи связан с каким-либо сильно электроотрицательным атомом, например с фтором, кислородом или азотом, атом водорода приобретает относительно высокий положительный заряд (естественно, не превышающий единицы ). Поскольку этот заряд сосредоточен на чрезвычайно малом атомном остове (представляющем собой в данном случае просто протон), он может сильно приближаться к какому-нибудь другому атому, несущему на себе небольшой отрицательный заряд. Это вызывает образование довольно сильной диполь-дипольной связи, хотя, конечно, она гораздо слабее нормальной ковалентной связи.
 Возникающее при образовании водородной связи расположение частиц показано на рис 8.20. [c.142]
Возникающее при образовании водородной связи расположение частиц показано на рис 8.20. [c.142] Долгое время необычные свойства воды были загадкой для ученых. Выяснилось, что они в основном обусловлены тремя причинами полярным характером молекул, наличием неподеленных пар электронов у атомов кислорода и образованием водородных связей. Молекула воды (рис. X1V.2, а) может быть представлена в виде равнобедренного треугольника, в вершине которого расположен атом кислорода, а в основании — два протона (рис. XIV.2, б). Две пары электронов обобществлены между протонами и атомом кислорода, а две пары неподеленных электронов ориентированы по другую сторону кислорода. Длина связи О—И составляет 96 нм, а угол между связями 105°. Связь О—Н имеет полярный характер, молекула воды также полярна. Благодаря полярности вода хорошо растворяет полярные жидкости и соединения с ионными связями. Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода [c. 371]
371]
Малая плотность льда связана с наличием значительных пустот в его кристаллической структуре. Последняя образована молекулами воды, соединенными друг с другом посредством водородных связей. Каждый атом кислорода связан с двумя своими атомами водорода [на расстоянии (НО) = 1,00 А] и двумя чужими [ (НО) = 1,76 А]. В свою очередь атом водорода соединен валентной связью [ (Н0)= 1,00 А] со своим атомом кислорода и водородной связью [ (Н0)= 1,76 А] с чужим . Таким образом, на каждую молекулу воды приходится четыре водородные связи (рис. IV-22), которые и обеспечивают устойчивость структуры льда. Схема расположения кислородных атомов в этой структ ре показана на рис. 1У-23, а атомы [c.140]
Цеолиты X и в аммонийной и водородной формах. Спектроскопические исследования бренстедовской и льюисовской кислотности. Прогревание цеолита V в НН -форме при 250-400° С в инертной атмосфере приводит к разложению иона аммония, потере адсорбированной воды и одновременно к появлению в ИК-спектре в области валентных колебаний ОН-групп узкой высокочастотной полосы при 3650 см и более широкой низкочастотной полосы при 3550 см . Таким образом получают водородную форму цеолита , или цеолит НУ переведение цеолита У в Н-форму путем прямого ионного обмена невозможно из-за неустойчивости каркаса фожазита в жидких неорганических кислотах. Согласно многочисленным данным, полученным методами ИК-спектроскопии [47 -52], ЯМР широкого разрешения [53] и рентгеноструктурного анализа [54], высокочастотная полоса отвечает ОН-группе с нормальным расстоянием связи О —Н, где атом водорода локализован на атоме 0(1) решетки и расположен в большой полости (структура 20). [c.21]
Таким образом получают водородную форму цеолита , или цеолит НУ переведение цеолита У в Н-форму путем прямого ионного обмена невозможно из-за неустойчивости каркаса фожазита в жидких неорганических кислотах. Согласно многочисленным данным, полученным методами ИК-спектроскопии [47 -52], ЯМР широкого разрешения [53] и рентгеноструктурного анализа [54], высокочастотная полоса отвечает ОН-группе с нормальным расстоянием связи О —Н, где атом водорода локализован на атоме 0(1) решетки и расположен в большой полости (структура 20). [c.21]
У двухатомных соединений, как, например, у окиси углерода или окиси азота, а также у льда, наблюдаются случаи беспорядочной ориентации. Молекулы СО и N0 почти симметричны (по своему внешнему виду), так что разница между энергиями двух положений, которые могут занимать такие молекулы в кристалле, очень мала. Поэтому молекулы ориентируются беспорядочно. Водородные связи, скрепляющие структуру льда (стр. 278), не симметричны, так что каждый атом кислорода имеет два атома водорода в непосредственной близости от него и два более удаленных атома, вследствие чего возникает неправильный тетраэдр ОН . Расположение коротких и длинных расстояний произвольно. Аналогично, если какое-либо соединение содержит смесь изотопов, различные молекулы можно отличить по тому, какой из изотопов входит в их состав в общем случае такие молекулы беспорядочно распределены по кристаллу. Все эти типы неупорядоченности сохраняются вплоть до самых низких достигаемых температур. [c.269]
Расположение коротких и длинных расстояний произвольно. Аналогично, если какое-либо соединение содержит смесь изотопов, различные молекулы можно отличить по тому, какой из изотопов входит в их состав в общем случае такие молекулы беспорядочно распределены по кристаллу. Все эти типы неупорядоченности сохраняются вплоть до самых низких достигаемых температур. [c.269]
Соединение РеООН — фаза неопределенного состава, которая всегда содержит хлор и свободную воду [323], и, как установлено, имеет структуру голландита. Железо-кислородные октаэдры образуют каркасную решетку, заключающую в себе ионы хлора (структура хозяин — гость ) [220]. Как предполагают, ионы хлора через атом водорода связаны с атомом кислорода, расположенным на границе туннеля. Эти туннели достаточно велики для того, чтобы в них могли разместиться также молекулы воды. Значительные колебания составов связаны с различной относительной долей воды и хлора, что, в свою очередь, влияет на число водородных связей. / [c.116]
/ [c.116]
Почему же для жидкой воды характерно столь сильное взаимное притяжение молекул Ответ на этот вопрос вытекает из самой структуры молекулы воды. Каждый из двух атомов водорода (в молекуле воды) объединяет свой электрон с одним из электронов атома кислорода. Взаимное расположение возникающих при этом двух электронных пар обусловливает У-образную форму молекулы воды (рис. 4-1). Поскольку у атома кислорода имеются еще две неподеленные электронные пары, он несет частичный отрицательный заряд (в вершине У-об-разной структуры). Более электроотрицательный атом кислорода стремится притянуть электроны атомов водорода поэтому на ядрах обоих атомов водорода (протонах) локализуются частичные положительные заряды. Хотя молекула воды в целом электрически нейтральна, ее частичные отрицательный и положительный заряды пространственно разделены, что приводит к возникновению у нее электрического дипольного момента. Благодаря такому разделению зарядов две соседние молекулы воды могут притягиваться друг к другу за счет сил электростатического взаимодействия между части ьш отрицательным зарядом, локализован ным на атоме кислорода одной молекулы воды, и частичным положительным зарядом, локализованным на атоме водорода другой молекулы (рис. 4-1). Такой тип электростатического притяжения называется водородной связью. [c.80]
4-1). Такой тип электростатического притяжения называется водородной связью. [c.80]
О … О, так что угол НОН приближается к тетраэдрическому. В-третьих, эти две водородные связи являются типичными длинными водородными связями, в которых атомы водорода расположены гораздо ближе к одному атому кислорода, чем к другому. Наконец, невозможно установить, вызвана ли анизотропия в контурах атома водорода Но, находящегося в центре симметрии, тем, что его расположение соответствует единственному широкому симметричному потенциальному минимуму, или же неупорядоченным расположением атомов водорода, каждый из которых отстоит на 1,12 А от одного из двух атомов кислорода. [c.205]
Тетраэдрическое расположение четырех электронных пар вокруг атома кислорода обусловливает кристаллическую структуру льда (рис. И 1.37). Атомы кислорода в решетке льда образуют структуру типа алмаза, а атомы водорода располагаются асимметрично на линиях, соединяющих атомы кислорода, ближе к тому атому, с которым осуществляется ковалентная связь.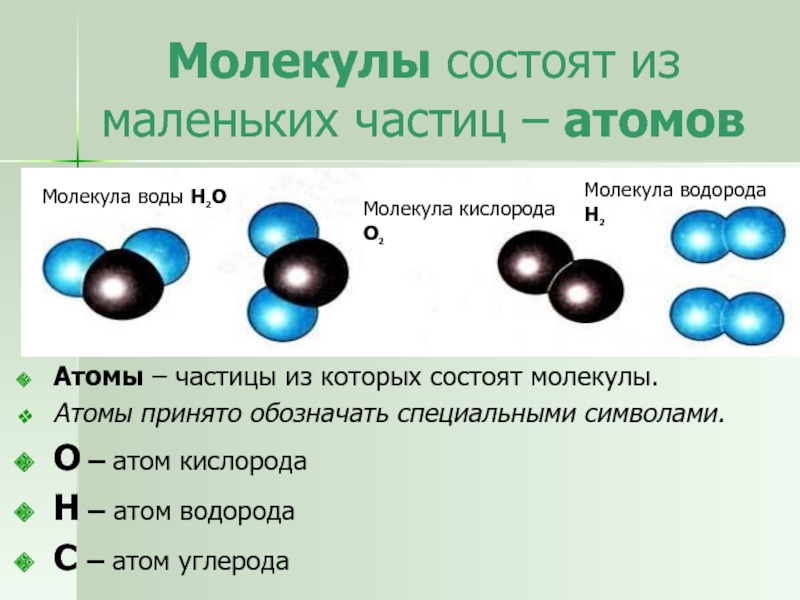 При плавлении льда не все водородные связи [c.207]
При плавлении льда не все водородные связи [c.207]
Известно более 12 кристаллических модификаций оксида алюминия. Большинство из них пригодно для хроматографии. Оксид алюминия получают частичной дегидратацией (прокаливанием при 200—600 °С) гидроксидов, получаемых, например, при обработке раствора алюмината натрия диоксидов углерода. В товарном оксиде алюминия преобладает у-форма, в кристаллической решетке которой каждый атом алюминия окружен шестью атомами кислорода, а каждый атом кислорода — тремя атомами алюминия и атомом водорода, образующим внутримолекулярную водородную связь. В оксиде алюминия имеется система правильных цилиндрических микропор диаметром 2,7 нм и беспорядочно расположенные микропоры большего диаметра. Товарные продукты различаются главным образом по степени гидратации поверхности и по типу дефектов кристаллической структуры. Краткое описание поверхностных дефектов дано Снайдером [70]. Большая часть содержащейся воды образует поверхностные гидроксильные группы или находится в адсорбированном состоянии.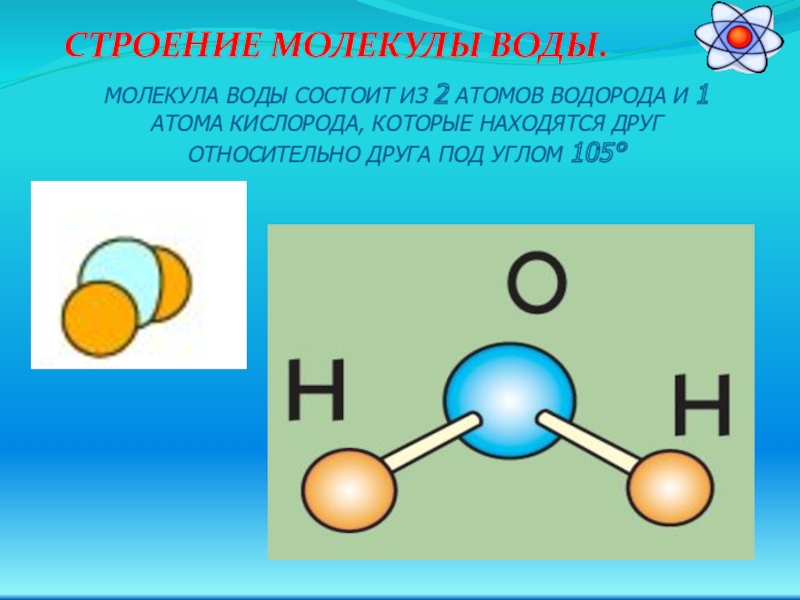 После прокаливания при 300 °С большая [c.165]
После прокаливания при 300 °С большая [c.165]
Каждая молекула В(ОН)д через два водородных мостика связана с тремя соседними молекулами, причем атом водорода находится не посредине между двумя атомами О, а расположен ближе к одному атому О (0,88 А), чем к другому (1,84 А), (что вообще характерно для мостиковых водородных связей). Причиной отклонения от полной гексагональной симметрии является слабый наклон молекулярных плоскостей по отношению к плоскостям (001) решетки. [c.241]
Поскольку при 2700—2500 см поглощают лишь немногие другие соединения, этот интервал особенно удобно использовать для идентификации карбоновых кислот, хотя характерные для них полосы бывают часто слабыми, что может вызвать затруднения при идентификации кислот С большим молекулярным весом. Расстояние между этими полосами и полосами валентных колебаний СН при использовании призмы из каменной соли достаточно велико для того, чтобы их нельзя было спутать. Таким образом, поглощение в области 2700—2500 обычно служит хорошим доказательством присутствия димеров карбоновых кислот, но их идентификацию никогда не следует проводить без учета данных по другим областям спектра, и особенно области поглощения карбонила. Поглощение в интервале 2700—2500 служит только признаком наличия группы ОН с сильной водородной связью, и хотя такие прочные водородные связи необычны для других соединений, кроме карбоновых кислот, они все-таки в некоторых случаях образуются. При исключительных обстоятельствах возможно также появление при еще более низких частотах полос поглощения ОН у кислот, образующих внутримолекулярные связи. Например, у основной калиевой соли малеиновой кислоты [64] атом водорода, по-видимому, расположен симметрично между двумя атомами кислорода. У этого соединения в,области частот выше 1600 см не наблюдается ни одной сильной полосы, которая сколько-нибудь менялась бы при дейтерировании. [c.236]
Поглощение в интервале 2700—2500 служит только признаком наличия группы ОН с сильной водородной связью, и хотя такие прочные водородные связи необычны для других соединений, кроме карбоновых кислот, они все-таки в некоторых случаях образуются. При исключительных обстоятельствах возможно также появление при еще более низких частотах полос поглощения ОН у кислот, образующих внутримолекулярные связи. Например, у основной калиевой соли малеиновой кислоты [64] атом водорода, по-видимому, расположен симметрично между двумя атомами кислорода. У этого соединения в,области частот выше 1600 см не наблюдается ни одной сильной полосы, которая сколько-нибудь менялась бы при дейтерировании. [c.236]
До недавнего времени не представлялось возможным точно установить, на каких расстояниях расположен атом водорода от двух атомов, между которыми он образует связь (мостик). Диффракционные методы хотя и указывали точно расстояние между этими двумя атомами (обычно называемое длиной водородной связи), но не давали указаний о расположении связывающего их атома водорода. Однако было принято считать, что связь эта близка к прямолинейной в той мере, в какой это допускается другими влияющими на нее факторами, т. е. что водород находится на прямой линии, соединяющей оба связываемых атома (Sidgwi k, [c.215]
Однако было принято считать, что связь эта близка к прямолинейной в той мере, в какой это допускается другими влияющими на нее факторами, т. е. что водород находится на прямой линии, соединяющей оба связываемых атома (Sidgwi k, [c.215]
В молекуле ВгНв содержатся четыре двухэлектронные концевые ВН-связи, остальные четыре электрона объединяют радикалы ВН1 с помощью водородных мостиков, лежащих в плоскости, перпендикулярной плоскости расположения радикалов ВН , причем расстояние В—Н здесь больше, чем в концевых В—Н-связях. Таким образом, вокруг каждого атома бора формируется искаженный тетраэдр (рис. 1.52й). Каждый мостиковый атом водорода образует с двумя атомами бора двухэлектронную трехцентровую связь В—Н—В. Она сходна с рассмотренными ранее трехцентровыми связями, только в молекуле ВгИб электронами заполнена лишь связывающая МО, а на несвязывающей МО электронов нет. Такая связь энергетически выгоднее обычных двухцентровых В—Н-связей (на 59 кДж/моль) она образуется в результате перекрывания двух i /-opбитaлeй атомов бора и одной -орбитали атома водорода (рис. 1.526). [c.116]
1.526). [c.116]
Таким образом, в отличие от других элемеитов периодической системы у водорода иет нстиппых элементов-аналогов вследствие исключительности строения его ато.ма. Не случайно только для соединений водорода в степени окисления +1 имеет место специфический вид связи — водородная связь Все это свидетельстЕ1уе,т о том, что в периодической системе водороду должно быть отведено необычное место (см. первый форзац книги). Водород по праву занимает одну протяженную клетку над элементами второго периода системы (исключая пеон). Такое расположение водорода в системе вгюлие логично, так как первый период содержит всего два элемента. [c.97]
Ион дифторида не типичен для соединений с водородными связями в том отношении, что атом водорода расположен посредине между двумя тяжелыми атомами. Обычно энергии водородных связей намного меньше, чем для иона ди-фторнда, а водород более тесно связан с одним из атомов, чем с другим, как в димере муравьиной кислоты (рис. 15.8). В дей-ствительиост11 геометрия двух компонентов, составляющих комплекс, нелгного отличается от их геометрии в изолированных состояниях. [c.368]
15.8). В дей-ствительиост11 геометрия двух компонентов, составляющих комплекс, нелгного отличается от их геометрии в изолированных состояниях. [c.368]
В большинстве примеров атом водорода расположен ближе к атому X, чем к У, даже если это два одинаковых атома. Но в некоторых соединениях — здесь можно указать иа твердый ЫаНРа (содержащий ионы НРг) — атом водорода расположен симметрично. Водород, образующий водородную связь, отнюдь не является двухвалентным. Для того чтобы водород был двухвалентным, необходимо, чтобы два из четырех связывающих электронов находились на орбите 25, а требуемая для этого энергия возбуждения намного превосходит дополнительную энергию связи. Во всех случаях энергия, требуемая для разрыва несимметричной водородной связи, т. е. для процесса [c.155]
Некоторые авторы анализировали нормальные моды колебаний малых групп молекул воды, имеющих такое же расположение, как и во льду, и относили полосы в решеточной области наблюдаемого спектра к этим нормальным. модам. Этот прием дает качественное представление о молекулярных движениях, которые соответствуют данным полосам в спектре 1. могут быть полезными при выборе приближенных функций потенциальной энергии системы (п, 3,7,2), В одном из таких исследований [404] рассмотрена система из пяти атомов, состоящая из центральной молекулы воды и двух соседних атомов кислорода, со-едипенных водородными связями с их атомами водорода. Кио-гоку (1960) в более тщательном исследовании проанализировал систему нз девяти атомов, содержащую центральный атом кислорода, четыре окружающих его атома водорода и четыре соседних атома кислорода. Уэлрафен [369] рассмотрел нормальные моды системы из пяти молекул (см. п. 4.7.3), В этих трех исследованиях полоса спектра л л была отнесена к заторможенным вращательным движениям, а полоса Гт — к заторможенны.м трансляционны.м движениям. [c.136]
модам. Этот прием дает качественное представление о молекулярных движениях, которые соответствуют данным полосам в спектре 1. могут быть полезными при выборе приближенных функций потенциальной энергии системы (п, 3,7,2), В одном из таких исследований [404] рассмотрена система из пяти атомов, состоящая из центральной молекулы воды и двух соседних атомов кислорода, со-едипенных водородными связями с их атомами водорода. Кио-гоку (1960) в более тщательном исследовании проанализировал систему нз девяти атомов, содержащую центральный атом кислорода, четыре окружающих его атома водорода и четыре соседних атома кислорода. Уэлрафен [369] рассмотрел нормальные моды системы из пяти молекул (см. п. 4.7.3), В этих трех исследованиях полоса спектра л л была отнесена к заторможенным вращательным движениям, а полоса Гт — к заторможенны.м трансляционны.м движениям. [c.136]
Если бы молекулы воды образовали плотно упакованную кристаллическую решетку, то с учетом указанного радиуса молекулы воды плотность твердого льда была бы почт. ч в два раза больше, чем на са.мом деле. Это означает, что мо.чекулы воды расположены довольно неплотно с промежутками (пустотами) между ними. Рентгеноструктурный анализ показывает, что в кристаллической решетке льда калатом кислорода из-за геометрической направленности водородных связей окружен в первой сфере четырьмя такими же атомами, расположенными по вершинам тетраэдра. Между каждой парой атомов кислорода располагается атом водорода, осушеств-.1ЯЮЩИЙ водородную связь. В результате образуется ажурная гексагональная кристаллическая решетка (типа тридимита), в которой имеются сравнительно большие пустоты с диаметром 0,52—0,69 нм (рис. 10.2). [c.159]
ч в два раза больше, чем на са.мом деле. Это означает, что мо.чекулы воды расположены довольно неплотно с промежутками (пустотами) между ними. Рентгеноструктурный анализ показывает, что в кристаллической решетке льда калатом кислорода из-за геометрической направленности водородных связей окружен в первой сфере четырьмя такими же атомами, расположенными по вершинам тетраэдра. Между каждой парой атомов кислорода располагается атом водорода, осушеств-.1ЯЮЩИЙ водородную связь. В результате образуется ажурная гексагональная кристаллическая решетка (типа тридимита), в которой имеются сравнительно большие пустоты с диаметром 0,52—0,69 нм (рис. 10.2). [c.159]
 Достаточно было бы показать, что молекула обладает сходством с мопозамещенным ацетиленом и имеет фактически только один атом водорода. Этот атом может взаимодействовать посредством водородной связи с гидроксильными группами поверхности, в результате чего частоты валентных колебаний групп СН или С = С заметно не меняются. [c.188]
Достаточно было бы показать, что молекула обладает сходством с мопозамещенным ацетиленом и имеет фактически только один атом водорода. Этот атом может взаимодействовать посредством водородной связи с гидроксильными группами поверхности, в результате чего частоты валентных колебаний групп СН или С = С заметно не меняются. [c.188] При разбавлении хлороформа ароматическим углеводородом происходит сдвиг сигнала протонов хлороформа в область более сильного поля [4]. При образовании водородных связей с -донорами имеет место сдвиг в область более слабого поля. Это, по-видимому, необычное влияние ароматических доноров я-типа отнесено за счет магнитной анизотропии кольца. Внешнее магнитное поле вызывает в плоскости бензольного кольца диамагнитный кольцевой ток это приводит к появлению вторичного магнитного поля, которое направлено противоположно внешнему полю и поэтому ослабляет его в точках, расположенных выше и нилСигнал протонов молекул хлороформа, расположенных в этих точках, сдвигается в область более сильных полей. Было предположено, что комплекс СНС1з—СеНб, вероятно, обладает такой структурой, что атом водорода акцептора находится в непосредственной близости к донору на оси симметрии шестого порядка бензольного кольца или около нее. Исходя из этой структуры и из найденной величины сдвига сигна.ла протона, равной 55 гц, было вычислено, что протон молекулы хлороформа находится на расстоянии 3,1 А на перпендикуляре к плоскости бензольного кольца. Как показало дальнейшее обсуждение величины расстояний между компонентами в других комплексах, такая структура вполне возможна . На основании данных, полученных методом ЯМР, было показано, что нитробензол, а также галогенбензолы по отношению к хлороформу являются п-донорами в различной степени. Как и следовало ожидать, взаимодействие хлороформа с олефинами приводит к сдвигу сигнала протонного резонанса в область [c.60]
Было предположено, что комплекс СНС1з—СеНб, вероятно, обладает такой структурой, что атом водорода акцептора находится в непосредственной близости к донору на оси симметрии шестого порядка бензольного кольца или около нее. Исходя из этой структуры и из найденной величины сдвига сигна.ла протона, равной 55 гц, было вычислено, что протон молекулы хлороформа находится на расстоянии 3,1 А на перпендикуляре к плоскости бензольного кольца. Как показало дальнейшее обсуждение величины расстояний между компонентами в других комплексах, такая структура вполне возможна . На основании данных, полученных методом ЯМР, было показано, что нитробензол, а также галогенбензолы по отношению к хлороформу являются п-донорами в различной степени. Как и следовало ожидать, взаимодействие хлороформа с олефинами приводит к сдвигу сигнала протонного резонанса в область [c.60]
Энергия центрально-симметричного и зеркально-сим-метричного расположения связей неодинакова. Бьеррум полагает, что во втором случае взаимодействие между парами молекул несколько более сильное, чем в первом.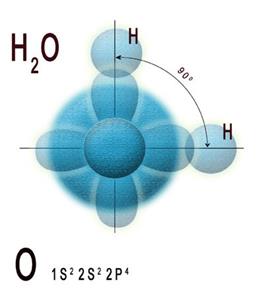 Бьеррум показал, что молекулы воды образуют тетраэдрическую структуру льда таким образом, чтобы доля зеркально-симметрично расположенных связей была максимально возможной. Разница в энергиях при двух указанных типах расположения связей приводит к тому, что при зеркальной симметрии длина связей укорачивается на 0,5% по сравнению со случаем центральной симметрии [13] Молекулы НаО в структуре льда, согласно данным работы 14], расположены довольно далеко, однако между ними су ществует водородная связь. При этом каждый ато м кислоро да связан с четырьмя атомами водорода с двумя из них расположенными на расстоянии 0,96—1,02 А, посредством ва лентных связей и с двумя другими, находящимися на рас стоянии 1,74— 1,80 А, посредством водородных связей. Уоллан Девидсон, Шалл считают, что между каждыми двумя атомами кислорода находится по одному протону, который связан валентной связью с одним из соседей и водородной связью с другим. Авторы нейтронографически показали [14], что протон не зафиксирован между двумя соседними атомами кислорода, а находится в среднем в течение одинакового времени в двух возможных положениях [c.
Бьеррум показал, что молекулы воды образуют тетраэдрическую структуру льда таким образом, чтобы доля зеркально-симметрично расположенных связей была максимально возможной. Разница в энергиях при двух указанных типах расположения связей приводит к тому, что при зеркальной симметрии длина связей укорачивается на 0,5% по сравнению со случаем центральной симметрии [13] Молекулы НаО в структуре льда, согласно данным работы 14], расположены довольно далеко, однако между ними су ществует водородная связь. При этом каждый ато м кислоро да связан с четырьмя атомами водорода с двумя из них расположенными на расстоянии 0,96—1,02 А, посредством ва лентных связей и с двумя другими, находящимися на рас стоянии 1,74— 1,80 А, посредством водородных связей. Уоллан Девидсон, Шалл считают, что между каждыми двумя атомами кислорода находится по одному протону, который связан валентной связью с одним из соседей и водородной связью с другим. Авторы нейтронографически показали [14], что протон не зафиксирован между двумя соседними атомами кислорода, а находится в среднем в течение одинакового времени в двух возможных положениях [c. 34]
34]
Размер аксиальной метильной группы в этом случае, как и в случае карбоциклических соединений, существенно влияет на отталкивающее взаимодействие, возникающее между метильной группой и сы -аксиальными атомами водорода. Случай пиперидина, однако, имеет некоторые отличия — экваториальный атом водорода при азоте находится примерно на расстоянии вандерваальсова радиуса от четырех водородных атомов при а-угле-ролных атомах в результате его конформация стабилизирована силами притяжения. В аксиальном положении водород расположен на расстоянии вандерваальсова радиуса от экваториальных атомов водорода при а-углеродных атомах и от аксиальных атомов водорода при Р-углеродных атомах. В связи с этим водород при атоме азота имеет малую конформационную предпочтительность. [c.218]
Далее предстоит выяснить величину взаимодействия между аксиальным заместителем и кислородным атомом кольца. У такого атома отсутствует аксиальный атом водорода, имеющийся в циклогексановом кольце. Известно, однако, о существовании взаимодействия, по крайней мере частичного, с парох электронов, образующей связь Н — О. Кроме того, кислородный атом кольца содержит на той же орбитали неподеленную пару электронов. Относительно взаимодействия последней имеются различные данные. Так, Арони п Лефевр [54] утверждают, что объем, занимаемый неподеленной парой электронов атома азота, превышает объем ковалентно связанного водородного атома (разд. 3-8). Аналогичной точки зрения придерживается Бартон [55], рассматривая неподеленную пару электронов карбаниона. Тем не менее имеющиеся в настоящее время сведения (разд. 3-8) указывают на то, что взаимодействие с парой электронов слабее, чем с атомом водорода. Кажется, пока нет надежных данных, касающихся неподеленных электронных пар на атоме кислорода. Химия углеводов предоставляет лишь одну относящуюся к данному вопросу цифру. Так, известно [56], что разность свободных энергий между 1-фосфатами а-в-глюкозы п сс-в-галактозы состав- ляет 0,7 ккалЬюлъ.
Известно, однако, о существовании взаимодействия, по крайней мере частичного, с парох электронов, образующей связь Н — О. Кроме того, кислородный атом кольца содержит на той же орбитали неподеленную пару электронов. Относительно взаимодействия последней имеются различные данные. Так, Арони п Лефевр [54] утверждают, что объем, занимаемый неподеленной парой электронов атома азота, превышает объем ковалентно связанного водородного атома (разд. 3-8). Аналогичной точки зрения придерживается Бартон [55], рассматривая неподеленную пару электронов карбаниона. Тем не менее имеющиеся в настоящее время сведения (разд. 3-8) указывают на то, что взаимодействие с парой электронов слабее, чем с атомом водорода. Кажется, пока нет надежных данных, касающихся неподеленных электронных пар на атоме кислорода. Химия углеводов предоставляет лишь одну относящуюся к данному вопросу цифру. Так, известно [56], что разность свободных энергий между 1-фосфатами а-в-глюкозы п сс-в-галактозы состав- ляет 0,7 ккалЬюлъ.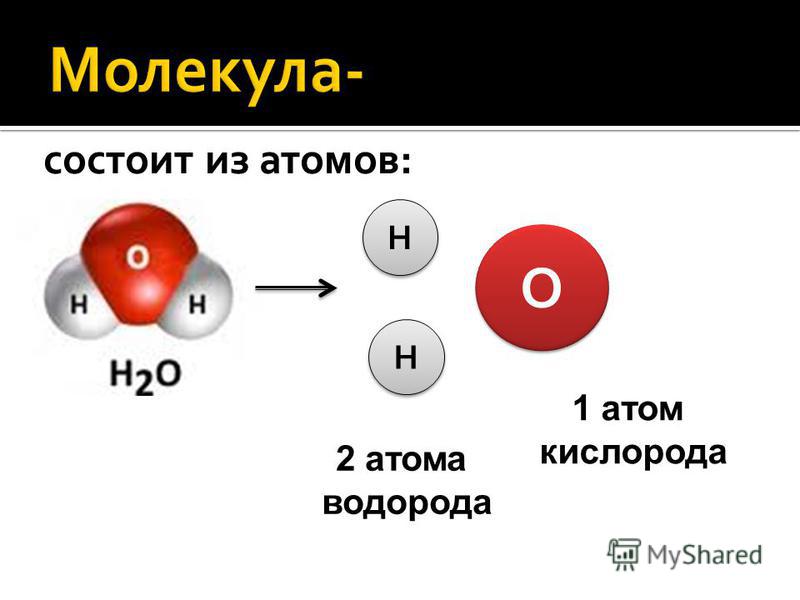 Оба эти соединения различаются лишь расположением гидроксильной группы при С-4, аксиальной в случае галактозы. Если бы указанная гидроксильная группа взаимодействовала только с одним аксиальным атомом врдорода при С-2, величина энергии взаимодействия не превышала бы 0,45 ккалЫолъ. Это означает, что в величине свободной энергии имеется вклад от взаимодействия с парой электронов кольцевого атома кислорода. [c.443]
Оба эти соединения различаются лишь расположением гидроксильной группы при С-4, аксиальной в случае галактозы. Если бы указанная гидроксильная группа взаимодействовала только с одним аксиальным атомом врдорода при С-2, величина энергии взаимодействия не превышала бы 0,45 ккалЫолъ. Это означает, что в величине свободной энергии имеется вклад от взаимодействия с парой электронов кольцевого атома кислорода. [c.443]
Водородные связи имеют энергию порядка 5 ккал1моль. Они обусловлены силами электростатического характера, действующими в системе из двух электроотрицательных атомов (например, Р, О, N или 5), между которыми находится атом водорода. Последний обычно расположен ближе к одному из двух атомов, так что можно считать, что с одним из них он соединен ковалентной связью, а с другим — водородной. Пара элек- [c.273]
Рассмотрение всей совокупности межатомных расстояний в молекуле диметилглиоксимата палладия не дает нам основания считать, что неравенство расстояний Рс1—N связано с характером водородной связи. В металлоцикле расстояния С—С и С—N имеют значения, промежуточные между значениями расстояний ординарной и двойной связей. Это указывает на большую степень делокализации в металлоцикле с атомом палладия, чем с атомом никеля. Исходя из этого, следует ожидать равенства расстояний Рс1—Ы, как это и найдено в работе [9]. Различие расстояний N—0 в комплексе палладия [9] по сравнению с соответствующими расстояниями в комплексе никеля, по-видимому, может определяться характером водородной связи атом водорода может располагаться несимметрично относительно атомов кислорода 13]. Возможно, что вследствие асимметричного расположения атома водорода хе-датное кольцо тоже приобретает несимметричное строение. Асимметрия водородной связи особенно может сказываться на расстояниях N—О. [c.11]
В металлоцикле расстояния С—С и С—N имеют значения, промежуточные между значениями расстояний ординарной и двойной связей. Это указывает на большую степень делокализации в металлоцикле с атомом палладия, чем с атомом никеля. Исходя из этого, следует ожидать равенства расстояний Рс1—Ы, как это и найдено в работе [9]. Различие расстояний N—0 в комплексе палладия [9] по сравнению с соответствующими расстояниями в комплексе никеля, по-видимому, может определяться характером водородной связи атом водорода может располагаться несимметрично относительно атомов кислорода 13]. Возможно, что вследствие асимметричного расположения атома водорода хе-датное кольцо тоже приобретает несимметричное строение. Асимметрия водородной связи особенно может сказываться на расстояниях N—О. [c.11]
В кристобалитной модификации льда атомы кислорода занимают позиции атомов кремния, а атомы водорода находятся приблизительно на линиях, соединяющих соседние атомы кислорода, однако несколько ближе к одному из двух атомов О. В итоге каждый атом кислорода в этой структуре имеет в качестве соседей два атома водорода на расстоянии 0,97 и два на расстоянии 1,78 А [41]. Такие мостиковые водородные связи связывают молекулы воды между собой, стабилизируя тетраэдрическое расположение атомов О, несмотря на весьма рыхлый характер получающейся при этом структуры. [c.167]
В итоге каждый атом кислорода в этой структуре имеет в качестве соседей два атома водорода на расстоянии 0,97 и два на расстоянии 1,78 А [41]. Такие мостиковые водородные связи связывают молекулы воды между собой, стабилизируя тетраэдрическое расположение атомов О, несмотря на весьма рыхлый характер получающейся при этом структуры. [c.167]
Метаборная кислота II, -НВО . Метастабильная моноклинная форма НВОз, называемая также р-модификацией, состоит из бороксоловых колец, в которых два атома бора связаны с тремя и один с четырьмя атомами кислорода [16]. Характер взаимной связи молекул в почти плоских цепях, параллельных кристаллографической оси Ь, показан на рис. 23.6. Атомы кислорода, не входящие в эти цепи, располагаются попеременно над к под плоскостями (201), в которых с незначительными отклонениями лежат такие цепи. На рис. 23.6 приведены межатомные расстояния и также указано положение атомов Н, которые в НВО,. можно найти рентгенографически с точностью до 0,1 А.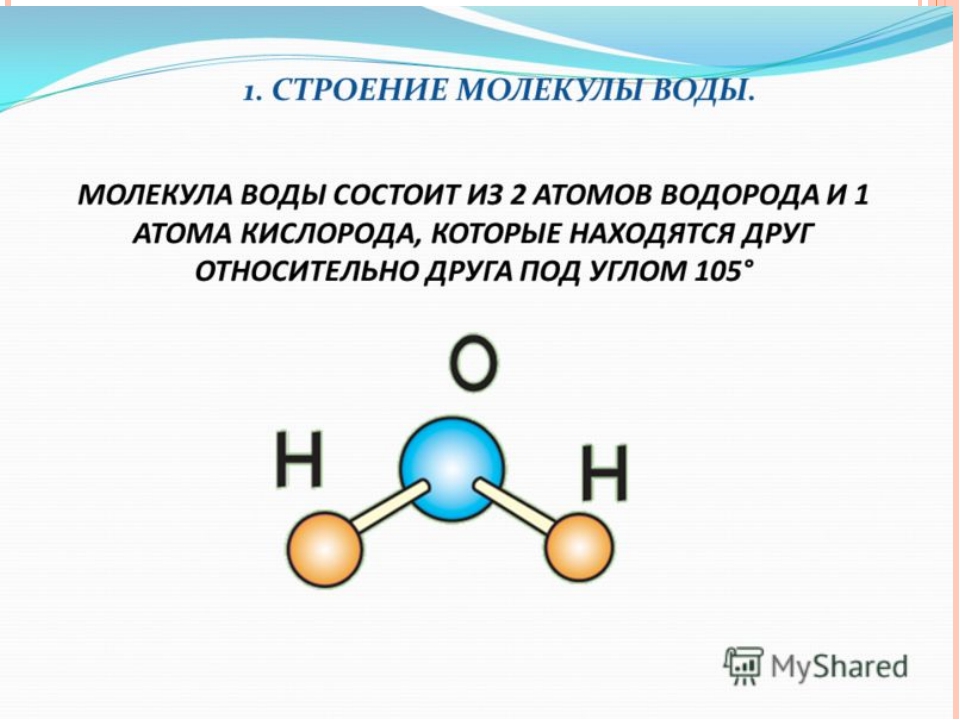 Мостиковые водородные связи в структуре НВО2 соединяют цепи, лежащие в плоскости параллельно одна другой, и цепи, расположенные одна над другой. Атом кислорода Оу имеет в качестве ближайшего соседа один атом водорода Н , так что он относится к гкду)о-ксильной группе. Атом кислорода Оу, имеет два соседних атол а водорода Н, и Н,,5 над или под плоскостью цепи тем самыл он относится к молекуле Н3О, которая занимает четвертую вер ли [c.243]
Мостиковые водородные связи в структуре НВО2 соединяют цепи, лежащие в плоскости параллельно одна другой, и цепи, расположенные одна над другой. Атом кислорода Оу имеет в качестве ближайшего соседа один атом водорода Н , так что он относится к гкду)о-ксильной группе. Атом кислорода Оу, имеет два соседних атол а водорода Н, и Н,,5 над или под плоскостью цепи тем самыл он относится к молекуле Н3О, которая занимает четвертую вер ли [c.243]
ЖИЗНЬ, МОЛЕКУЛА ВОДЫ И ЗОЛОТАЯ ПРОПОРЦИЯ
Соотношения золотой пропорции исследователи находят в морфологической структуре растений, птиц, животных, человека. Закономерности золотой пропорции обнаруживаются и в организации неживой природы. В данной статье на основании анализа молекулы воды в различных агрегатных состояниях высказана гипотеза, что ее структура в состоянии талой воды практически соответствует треугольнику золотой пропорции.Наука и жизнь // Иллюстрации
Теплоемкость воды достигает минимального значения при температуре около 37<SUP>о</SUP>С.
Наука и жизнь // Иллюстрации
Илл. 1. Плотность воды при понижении температуры сначала возрастает, достигает максимума при 4<SUP>о</SUP>С и начинает уменьшаться.
Наука и жизнь // Иллюстрации
В момент плавления объем свинца мгновенно увеличивается от 1 до 1,003, а объем воды скачком уменьшается от 1,1 до 1,0.
Наука и жизнь // Иллюстрации
Вода имеет аномально высокие температуры кипения и замерзания по сравнению с другими трехатомными соединениями водорода.
Наука и жизнь // Иллюстрации
В жидкой воде молекулы H<SUB>2</SUB>O могут объединяться в сложные образования — кластеры, по структуре напоминающие лед.
Наука и жизнь // Иллюстрации
Схематичное изображение молекулы воды на плоскости.
Деление отрезка в крайнем и среднем отношении, или золотая пропорция. Отрезок разделен на две части так, что CB:AC = AC:AB.
«Золотой треугольник». Соотношение его сторон OA:AB = OB:AB ≈ 0,618,
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
‹
›
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи
Вода — одно из самых уникальных и загадочных веществ на Земле. Природа этого вещества до конца еще не понята. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом. Лишь в 1766 году Г. Кавендиш (Англия) и затем в 1783 году А. Лавуазье (Франция) показали, что вода не простой химический элемент, а соединение водорода и кислорода в определенной пропорции. После этого открытия химический элемент, обозначаемый как Н, получил название «водород» (Hydrogen — от греч. hydro genes), которое можно истолковать как «порождающий воду».
Дальнейшие исследования показали, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами.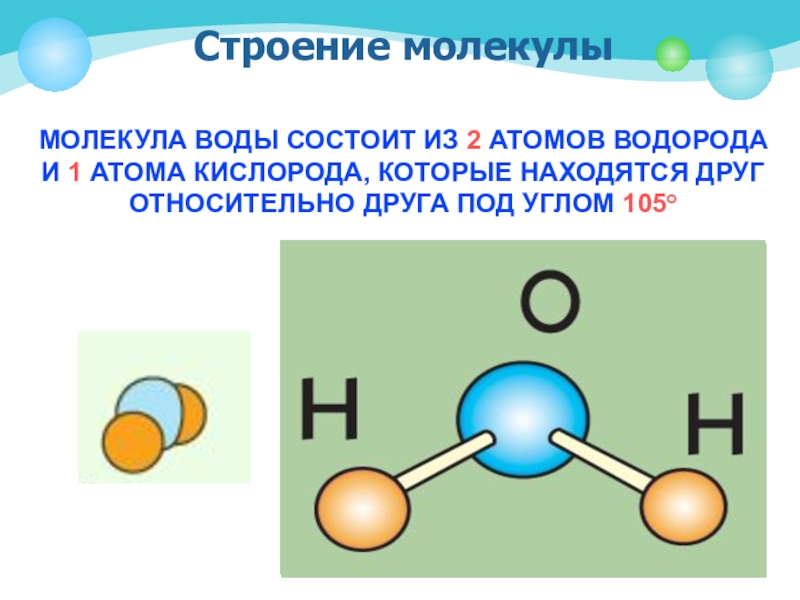 Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Загадочная магия воды. Почему жидкая вода имеет необычные свойства? Традиционный ответ может быть следующим: из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле и т.п.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами. Кратко упомянем те из них, которые обуславливают существование жизни на Земле.
Вначале о трех особенностях тепловых свойств воды.
Первая особенность: вода — единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум.
Из-за того, что удельная теплоемкость воды имеет минимум около 37оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС (внутренние органы имеют более высокую температуру, чем наружные).
Вторая особенность: теплоемкость воды аномально высока. Чтобы нагреть определенное ее количество на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, — по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Таким образом, вода играет главенствующую роль в процессах регулирования теплообмена человека и позволяет ему поддерживать комфортное состояние при минимуме энергетических затрат. При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.
При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.
Температура других теплокровных млекопитающих (32-39оС) также хорошо соотносится с температурой минимума удельной теплоемкости воды.
Третья особенность: вода обладает высокой удельной теплотой плавления, то есть воду очень трудно заморозить, а лед — растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок.
Все три особенности тепловых свойств воды позволяют человеку оптимальным образом существовать в условиях благоприятной среды.
Имеются особенности и в поведении объема воды. Плотность большинства веществ — жидкостей, кристаллов и газов — при нагревании уменьшается и при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться.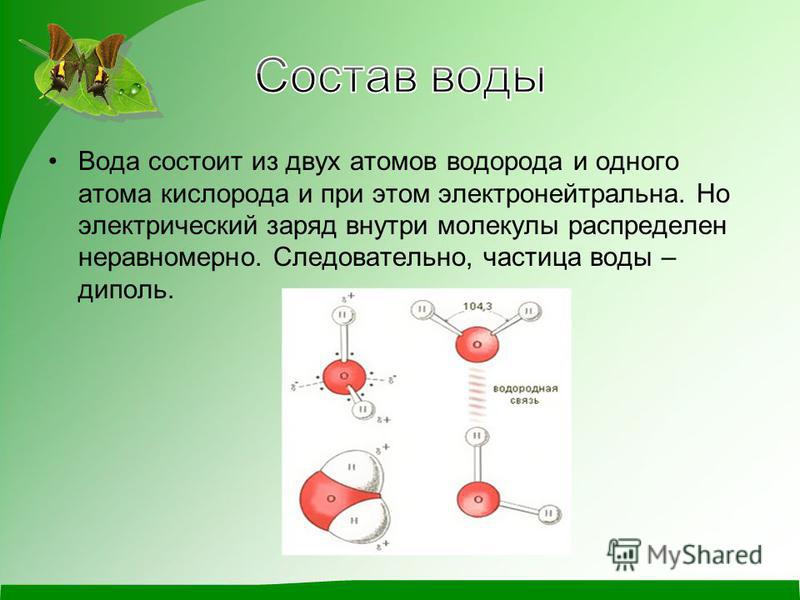 Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Замерзание воды сопровождается скачкообразным(!) уменьшением плотности более чем на 8%, тогда как у большинства других веществ процесс кристаллизации сопровождается увеличением плотности. В связи с этим лед (твердая вода) занимает больший объем, чем жидкая вода, и держится на ее поверхности.
Столь необычное поведение плотности воды крайне важно для поддержания жизни на Земле.
Покрывая воду сверху, лед играет в природе роль своего рода плавучего одеяла, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Отметим еще некоторые особенности воды.
Внешне вода подвижна и податлива, и ее можно заключить в любой сосуд. Однако, проникая в трещины горных пород и расширяясь при замерзании, вода раскалывает скальные породы любой твердости, которые постепенно распадаются на все более мелкие частицы. Так начинается возврат окаменевших пород в жизненный цикл: на полях промерзание поверхностных слоев земли с ее органическими компонентами помогает образованию плодородной почвы.
Процесс включения твердых веществ в большой круговорот живой природы ускоряется чудесным свойством воды их растворять. Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.
Вода сильнее других жидкостей проявляет свойства универсального растворителя. Если ей дать достаточно времени, она может растворить практически любое твердое вещество. Именно из-за уникальной растворяющей способности воды никому до сих пор не удалось получить химически чистую воду — она всегда содержит растворенный материал сосуда. Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу 1).
Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу 1).
Перечисленные свойства и особая роль воды в обеспечении жизни на Земле не могут оставить равнодушным ни один пытливый ум, даже если он верит в счастливые случайности. «Начало всего есть вода», — справедливо отмечал Фалес из Милета в VI веке до н.э.
Жидкое чудо. Прекратим перечисление странных, но жизненно необходимых свойств воды, которых можно набрать еще с десяток, и переключим внимание на секреты необычного строения ее молекулы. Именно анализ строения молекулы воды позволяет понять ее исключительность в живой и неживой природе. Так что дорога к истине проходит через строение одиночной молекулы воды.
Прежде всего отметим, что молекула воды самая маленькая среди подобных трехатомных молекул (по отношению к гомологам, то есть водородным соединениям типа Н2S, Н2Se, Н2Те, со свойствами которых традиционно сравнивают свойства воды). Такие молекулы при нормальных условиях образуют газы, а молекулы воды — жидкость. Почему?
Такие молекулы при нормальных условиях образуют газы, а молекулы воды — жидкость. Почему?
Хаотичное сообщество газообразных молекул воды при конденсации, то есть при образовании жидкой фазы, формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x. Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации X для воды составляет, по современным данным, от 3 до 6. Это означает, что формула воды не просто Н2О, а среднее между Н6О3 и Н12О6. Другими словами, вода — сложная жидкость, «составленная» из повторяющихся групп, содержащих от трех до шести одиночных молекул.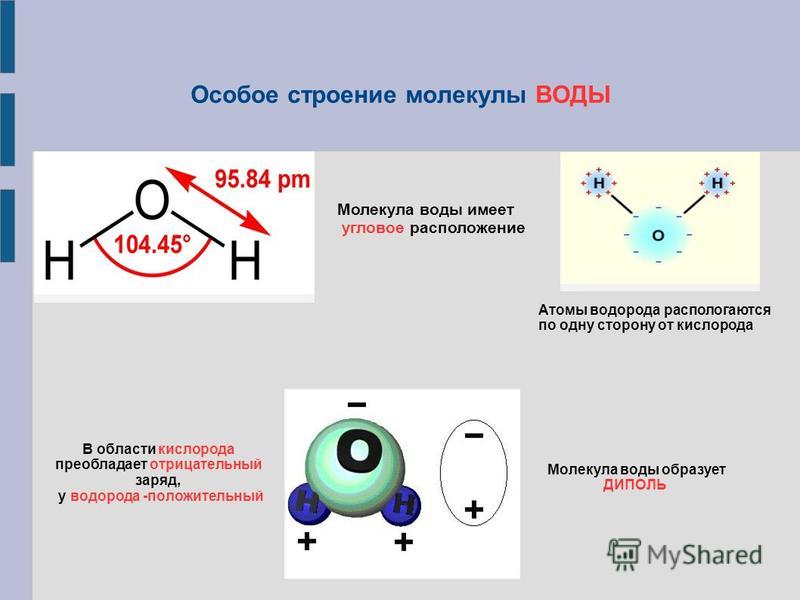 Вследствие этого вода имеет аномальные значения температуры замерзания и кипения по сравнению с гомологами. Если бы вода подчинялась общим правилам, она должна была замерзать при температуре порядка -100оС и закипать при температуре около +10оС.
Вследствие этого вода имеет аномальные значения температуры замерзания и кипения по сравнению с гомологами. Если бы вода подчинялась общим правилам, она должна была замерзать при температуре порядка -100оС и закипать при температуре около +10оС.
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к ее поверхности в виде осадков.
Восхитительная геометрия. Итак, какова же самая маленькая среди трехатомных молекул? Молекула воды имеет симметричную V-образную форму, так как два небольших атома водорода располагаются с одной стороны от сравнительно крупного атома кислорода. Это сильно отличает молекулу воды от линейных молекул, например Н2Ве, в которой все атомы располагаются цепочкой. Именно такое странное расположение атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Если внимательно рассмотреть геометрические параметры молекулы воды, то в ней обнаруживается определенная гармония. Чтобы увидеть ее, построим равнобедренный треугольник Н-О-Н с протонами в основании и кислородом в вершине.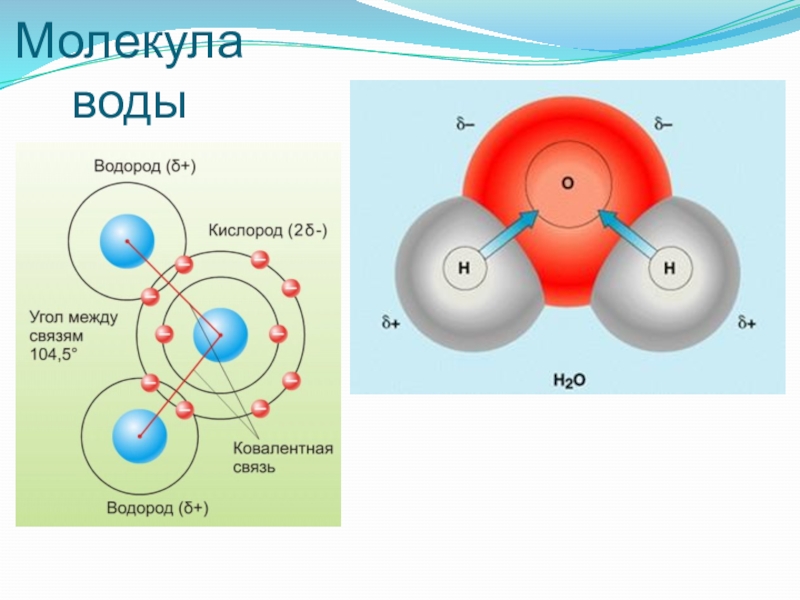 Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Длины сторон этого треугольника и валентный угол между двумя связями О-Н изменяются при изменении агрегатного состояния воды. Приведем эти параметры (см. таблицу 2).
Прокомментируем данные, характеризующие различные состояния воды.
Параметры молекулы воды в парообразном состоянии получены на основе обработки спектров ее поглощения. Результаты неоднократно уточнялись, но по существу правильно оценивают длины связей и валентный угол в молекуле воды в состоянии пара.
Кристаллическая структура льда при нормальном давлении довольно рыхлая с причудливой паутиной связей между молекулами воды. Схематично кристаллическую решетку обычного льда можно построить из атомов кислорода, каждый из которых участвует с соседними атомами в четырех водородных связях, направленных приблизительно к вершинам правильного тетраэдра.
Напомним, что водородной называется связь между атомами в одной молекуле или между соседними молекулами, которая осуществляется через атом водорода. Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул — углеводов, белков, нуклеиновых кислот и т. п.
Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул — углеводов, белков, нуклеиновых кислот и т. п.
Если кристаллический лед хорошо упорядочен по кислороду, то этого нельзя сказать про водород: в расположении ионов водорода (протонов) наблюдается сильный беспорядок. Их положение четко не определено, и поэтому лед можно считать разупорядоченным по водороду.
Лед обладает многими удивительными особенностями, из которых отметим две.
Во-первых, он всегда очень чист химически. В структуре льда практически не бывает примесей: при замерзании они вытесняются в жидкость. Именно поэтому снежинки всегда белые, а льдинки на поверхности грязной лужи практически прозрачные. Вообще говоря, любой растущий кристалл стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса — вода на Земле постоянно очищает сама себя.
Во-вторых, лед и особенно снег обладают очень высокой отражательной способностью. Благодаря этому солнечное излучение не вызывает заметного нагрева полярных областей, и, как следствие этого, наша планета избавлена от сезонных наводнений и повышений уровня Мирового океана.
Экспериментальное определение параметров одиночной молекулы воды в жидкой фазе до сих пор встречает непреодолимые трудности, поскольку жидкая вода — это смесь структурных элементов, то есть различных кластеров, находящихся в динамическом равновесии между собой. Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: «простая» жидкость Н2О не торопится раскрывать свои внутренние секреты.
Вернемся к рисунку, на котором в общих чертах представлена структура молекулы воды. В ней есть симметрия, которая играет основную роль в попытках всестороннего объяснения физического мира, и асимметрия, наделяющая эту молекулу возможностью движения и связью с золотой пропорцией. Поэтому кратко напомним о том, что в математике называют золотой пропорцией.
Поэтому кратко напомним о том, что в математике называют золотой пропорцией.
Золотая пропорция . Это понятие возникает при решении геометрической задачи о нахождении на отрезке АВ такой точки С, чтобы выполнялось соотношение СВ:АС = АС:АВ.
Решение этой задачи приводит к отношению СВ:АС = (-1+√5)/2, которое называют золотой пропорцией, а соответствующее геометрическое деление отрезка АВ точкой С называют золотым сечением. Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Время показало, что золотая пропорция воплощает совершенные и гармоничные отношения двух величин. В геометрической интерпретации она приводит к соразмерному и привлекательному соотношению между двумя неравными отрезками.
Исследователи золотой пропорции с античных времен до наших дней всегда восхищались
и продолжают восхищаться ее свойствами, которые проявляются в строении различных
элементов физического и биологического мира. Золотая пропорция обнаруживается
везде, где соблюдены принципы гармонии.
Золотая пропорция обнаруживается
везде, где соблюдены принципы гармонии.
Что же объединяет золотую пропорцию с молекулой воды? Чтобы ответить на этот вопрос, рассмотрим двумерный образ золотой пропорции в виде треугольника.
В золотом треугольнике отношение ОА:АВ = ОВ:АВ приблизительно равно 0,618, угол α = 108,0о. Для льда отношение длин связей О-Н к Н-Н равно 0,100:0,163 = 0,613 и угол α = 109,5о, для пара — соответственно 0,631 и 104,5о. Не распознать в золотом треугольнике прообраз структуры молекулы воды просто невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность подобной интерпретации ее строения.
И действительно, поместив в треугольнике АОВ в точки А и В атомы водорода, а в точку О — атом кислорода, получим в первом приближении молекулу жидкой воды, сконструированную на основе золотой пропорции. Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Исключительная гармония. Убедимся, что молекула жидкой воды — единственное трехатомное вещество, имеющее соразмерности, свойственные золотой пропорции.
В трехатомных молекулах-гомологах, близких по химическому составу к молекуле воды (Н2S, H2Se и Н2Те), валентный угол приблизительно равен 90о. Например, молекула Н2S имеет следующие геометрические параметры:
длина связи S-Н, нм ……………………. 0,1345
длина связи Н-Н, нм ……………………… 0,1938
валентный угол Н-S-Н, град ………….. 92,2
Отношение длин связей S-Н к Н-Н равно 0,694, что далеко от золотой пропорции. Квантово-химические расчеты показывают, что если бы вода была подобна родственным ей веществам, то валентный угол у ее молекулы должен был быть приблизительно таким же, как у Н2S, или больше максимум на 5о.
Но вода, как выясняется, не любит подобия, она всегда герой другого романа. Если бы валентный угол у воды был порядка 90-95о, о золотой пропорции пришлось бы забыть и вода оказалась бы в одном содружестве с другими водородными соединениями.
Но вода уникальна, ее молекула обладает практически выверенными эстетическими качествами, и поэтому ее свойства необходимо иногда интерпретировать, выходя за рамки традиционной научной парадигмы. И тогда некоторые загадки воды смогут быть объяснены таким «ненаучным» понятием, как гармония.
На приведенные рассуждения можно возразить: экспериментальные измерения геометрических параметров молекулы воды имеют определенную погрешность, и поэтому соотношение золотой пропорции может строго не выполняться. Но даже если в экспериментальные измерения внести еще большую погрешность, молекула воды все равно останется единственным из трехатомных веществ, имеющим практически «золотые» гармоничные пропорции.
В связи с этим обратим внимание на загадку талой воды, которая, по широко распространенному мнению, обладает отличным от обычной воды физиологическим воздействием.
Удивительная талая вода. Она рождается при таянии льда и сохраняет температуру 0оС, пока весь лед не растает. Специфика межмолекулярных взаимодействий, характерная для структуры льда, сохраняется и в талой воде, так как при плавлении кристалла разрушается только 15% всех водородных связей. Поэтому присущая льду связь каждой молекулы воды с четырьмя соседними («ближний порядок») в значительной степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.
Таким образом, талая вода отличается от обычной изобилием многомолекулярных кластеров, в которых в течение некоторого времени сохраняются рыхлые льдоподобные структуры. После таяния всего льда температура воды повышается и водородные связи внутри кластеров перестают противостоять возрастающим тепловым колебаниям атомов. Размеры кластеров изменяются, и поэтому начинают меняться свойства талой воды: диэлектрическая проницаемость приходит к своему равновесному состоянию через 15-20 минут, вязкость — через 3-6 суток. Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим — за сутки.
Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим — за сутки.
Итак, физико-химические свойства талой воды самопроизвольно меняются во времени, приближаясь к свойствам обычной воды: она постепенно как бы «забывает» о том, что еще недавно была льдом.
Лед и пар — различные агрегатные состояния воды, и поэтому логично предположить, что в жидкой промежуточной фазе валентный угол отдельной молекулы воды лежит в диапазоне между значениями в твердой фазе и в паре. В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
Значит, для обычной жидкой воды валентный угол вполне может иметь некоторое среднее значение между 109,5и 104,5о, то есть примерно 107,0о.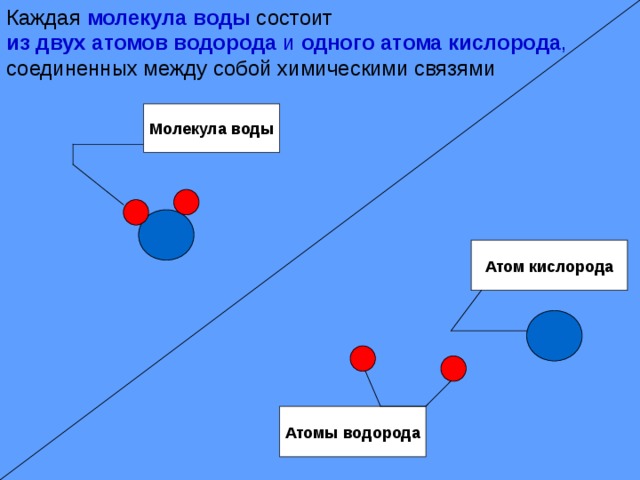 Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Сказанное выше можно сформулировать в виде гипотезы: в силу того, что талая вода значительно более структурирована, чем обычная вода, ее молекула с большой долей вероятности имеет структуру, максимально приближенную к гармоничному треугольнику золотой пропорции с валентным углом, близким к 108о, и с отношением длин связей примерно 0,618-0,619.
Экспериментального подтверждения этой гипотезы у авторов нет, как нет и какой-либо теории ее обоснования. Есть только догадка, высказанная на этих страницах, которая может, естественно, оспариваться.
Таинственная сила талой воды. Человеку с незапамятных времен известны удивительные свойства талой воды. Давно замечено, что вблизи тающих родников растительность альпийских лугов всегда пышнее, а у кромки тающего льда в арктических морях бурно цветет жизнь.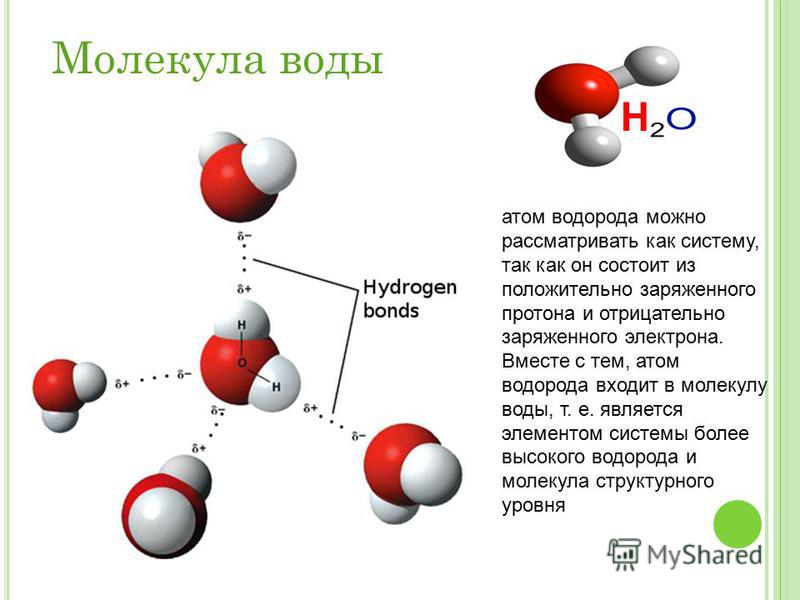 Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Талая вода, в отличие от обычной, по своей структуре очень похожа на жидкость, содержащуюся в клетках растительных и живых организмов. Именно поэтому для человека более подходит «ледяная» структура талой воды, в которой молекулы объединены в ажурные кластеры. Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты — они доставляют в организм воду, имеющую аналогичную структуру.
При питье талой воды происходит подпитка организма самым гармоничным из всех веществ на Земле. Она улучшает обмен веществ и усиливает кровообращение, снижает количество холестерина в крови и успокаивает боли в сердце, повышает адаптационные возможности организма и способствует продлению жизни. Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Один из авторов этой работы постоянно пьет талую с плавающими льдинками воду и считает, что именно поэтому за три года ни разу не простудился. Талая вода освежает и молодит кожу, которая перестает нуждаться в кремах и лосьонах.
Теоретическое изучение свойств талой воды находится пока на уровне гипотез. Нет общепринятого мнения о причинах, вызывающих необычные эффекты при ее применении. Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности — все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Подчеркнем: приведенная гипотеза не претендует на расшифровку загадки талой воды. Она лишь позволяет выйти за рамки традиционного мышления и посмотреть на взаимную любовь жизни и воды с необычной стороны — со стороны гармонии и красоты, со стороны особых свойств талой воды, добавляющих ее изящной молекуле черты, которыми не обладают другие молекулы.
ЛИТЕРАТУРА
Ауэрбах Ф. Семь аномалий воды. — СПб., 1919.
Габуда С. П. Связанная вода. Факты и гипотезы. — Новосибирск: Наука, 1982.
Зацепина Г. Н. Физические свойства и структура воды. — М.: МГУ, 1998.
Синюков В. В. Вода известная и неизвестная. — М.: Знание, 1987.
Белянин В. С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
Вода: структура, состояние, сольватизация. Достижения последних лет. — М.: Наука, 2003.
Подписи к иллюстрациям
Илл. 1. Плотность льда почти на 10% меньше, чем у воды, а удельный объем на столько же больше. Поэтому лед плавает, а вода, замерзая в трещинах горных пород, раскалывает их.
|
Вода — одно из наиболее замечательных веществ, известных человеку. Она — единственное природное вещество, встречающееся в больших количествах в трех состояниях: твердом, жидком и газообразном. Эти специфические свойства воды связаны с особым строением ее молекулы. Химическая формула воды Н20 обманчиво проста. В молекуле воды ядра атомов водорода расположены несимметрично по отношению к ядру атома кислорода и электронам. Если атом кислорода находится в центре тетраэдра, центры масс двух атомов водорода будут в углах тетраэдра, а центры зарядов двух пар электронов займут два других угла (рис. 3.1). Таким образом, четыре электрона располагаются на возможно наибольшем расстоянии как от ядра атома кислорода, так и от ядер атомов водорода, при котором они еще притягиваются ядром атома кислорода. Другие шесть электронов молекулы воды расположены так: четыре электрона находятся в положении, обеспечивающем химическую связь между ядрами атомов кислорода и водорода, а два других расположены вблизи ядра атома кислорода. Ассиметричное расположение атомов молекулы воды обусловливает неравномерное распределение электрических зарядов в ней, что делает молекулу воды полярной. Такое строение молекулы воды обусловливает притяжение молекул воды друг к другу в результате образования между ними водородных связей. Расположение атомов водорода и кислорода внутри образовавшихся агрегатов молекул воды сходно с расстановкой атомов кремния и кислорода в кварце. Это относится ко льду и в меньшей мере к жидкой воде, агрегаты молекул которой всегда находятся в стадии перераспределения. При охлаждении воды ее молекулы группируются в агрегаты, которые постепенно увеличиваются и становятся все более устойчивыми по мере приближения к температуре 4° С, когда вода достигает максимальной плотности. При этой температуре вода еще не имеет жесткой структуры и наряду с длинными цепочками ее молекул существует большое количество отдельных молекул воды. При дальнейшем охлаждении цепочки молекул воды растут за счет присоединения к ним свободных молекул, в результате чего плотность воды уменьшается. Рис. 3.1. Строение молекулы воды. Взаимное проникновение атомов водорода и кислорода. Ядра двух атомов водорода и две пары электронов находятся в углах тетраэдра: в центре расположено ядро атома кислорода. Высокие величины поверхностного натяжения и теплоты парообразования воды объясняются тем, что для отделения молекулы воды от группы молекул требуется относительно большая затрата энергии. Стремление молекул воды устанавливать водородные связи и их полярность объясняют необычно высокую растворяющую способность воды. Некоторые соединения, такие, как сахара и спирты, удерживаются в растворе благодаря водородным связям. Соединения, обладающие высокой степенью ионизации вводе, например хлористый натрий, удерживаются в растворе вследствие того, что ионы с противоположными зарядами нейтрализуются группами ориентированных молекул воды. Другая особенность молекулы воды состоит в том, что как атомы водорода, так и атомы кислорода могут иметь различные массы при одинаковом заряде ядра. Разновидности химического элемента с различными атомными весами называются изотопами этого элемента. Молекула воды обычно образуется водородом с атомным весом 1 (Н1) и кислородом с атомным весом 16 (О16). Более 99% атомов воды относится к этим изотопам. Кроме того, существуют следующие изотопы: Н2, H3, О14, О15, О17 О18, О19. Многие из них скапливаются в воде в результате ее частичного испарения и вследствие своей большой массы. Изотопы Н3, О14, О15, О19 радиоактивны. Наиболее распространен из них тритий Н3, образующийся в верхних слоях атмосферы под воздействием космических лучей. Этот изотоп накопился также в результате ядерных взрывов за последние несколько лет. Таблица 3.1 Относительная распространенность и периоды полураспада изотопов водорода и кислорода
|
контрудар-13 — Перенесенная химия
которым предстоит вступить в связь. 23 атомами бериллия и ни один атом не будет обделен. Ибо у обоих химически элементов по две “ответные части”.
23 атомами бериллия и ни один атом не будет обделен. Ибо у обоих химически элементов по две “ответные части”.
Если же предстоит соединить трехвалентный элемент с пятивалентным, надо взять пять моль первого элемента и три моль второго. Потому что у 5 моль трехвалентного элемента столько же “концов”, сколько у 3 моль пятивалентного. Нетрудно догадаться, да?
А как же узнать, сколько весит один моль того или иного вещества?
Да легко: 12 грамм углерода — это 1 моль (так решил Авогадро — должен же быть эталон). Что, по сути, означает: молярная масса углерода — 12 грамм на моль. Атом углерода имеет атомную массу 12 (смотрим ее в таблице Менделеева). Если вещество, например, вдвое тяжелее углерода, ясно, что один моль такого вещества (такое же количество атомов) будет весить ровно вдвое больше. Несложно догадаться, что любое вещество имеет молярную массу, равную его атомной массе. А атомная масса указана в таблице Менделеева.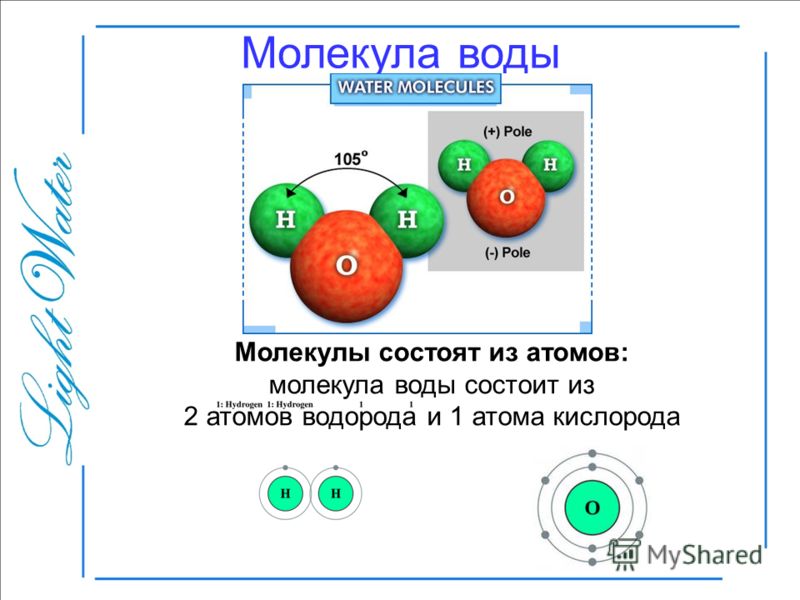 23 атомов.
23 атомов.
Взвешиваем сколько нужно моль одного вещества и другого. Производим реакцию. Вся любовь.
Если же в реакции участвуют молекулы, суммируем массы всех атомов, входящих в состав молекулы. Например, вода — h3O. Смотрим таблицу Менделеева: водород весит 1 а.е.м. (атомная единица массы), кислород — 16.
В молекуле воды два атома водорода и один атом кислорода. Суммируем:
1 а.е.м первого атома водорода +1 а.е.м. второго атома водорода +16 а.е.м. атома кислорода =18 а.е.м.
Сие означает: один моль воды весит 18 грамм. И эти 18 грамм содержат столько же “структурных единиц”, сколько эталон — 12 грамм углерода. Просто? Пожалуй. Понятно, что верно и обратное утверждение:
сколько весит (в граммах) один моль любого вещества, столько нуклонов содержится суммарно в его молекулах.
А если вещество — газ? Его как взвесить?
Никак. В этом нет необходимости. Ибо 1 моль любого газа при нормальных условиях занимает объем 22,4 литра.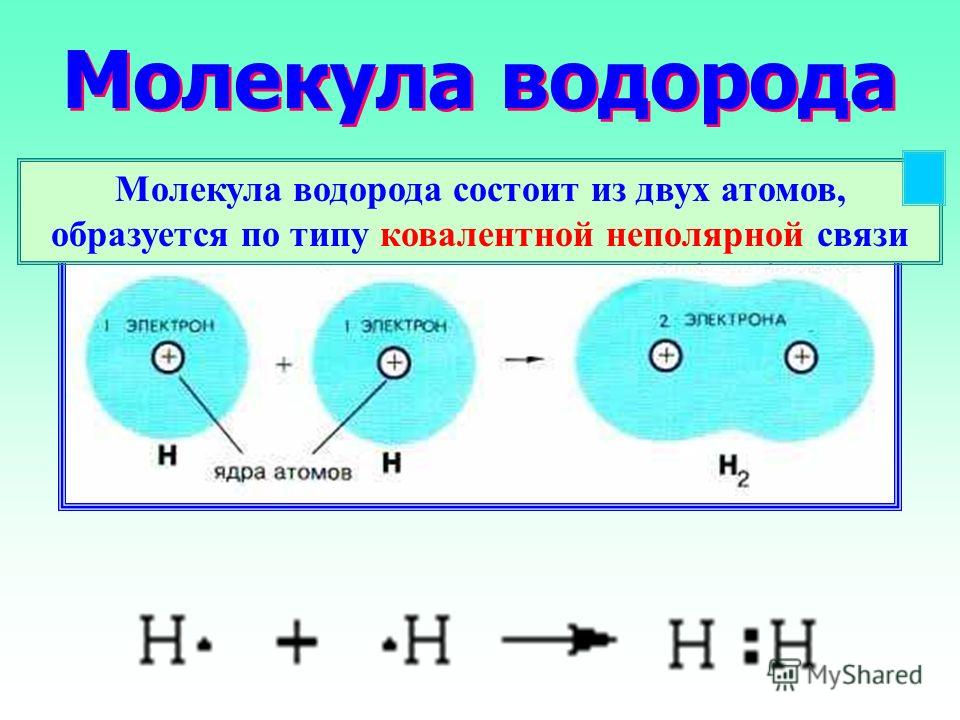 Прикольно, да? Одинаковое количество молекул любого газа в одинаковых условиях занимает одинаковый объем. А что есть “нормальные условия”? 0 градусов по Цельсию и 1 атмосфера. Или один килограмм на квадратный сантиметр, если угодно.
Прикольно, да? Одинаковое количество молекул любого газа в одинаковых условиях занимает одинаковый объем. А что есть “нормальные условия”? 0 градусов по Цельсию и 1 атмосфера. Или один килограмм на квадратный сантиметр, если угодно.
Из вышеприведенного видно, что если испарить 18 грамм (1 моль) воды, она займет объем 22,4 литра.
Если мы хотим взорвать гремучий газ — смесь кислорода с водородом — нужно 22,4 литра кислорода смешать с 44,8 литра водорода. Надеть каску и поднести спичку. Смесь сгорит (точнее, взорвется) без остатка.
В цилиндры двигателя внутреннего сгорания засасывается воздух и впрыскивается топливо. Топливо сгорает, выделяется тепло и совершается работа — перемещается поршень. Если мы хотим ехать помедленнее, подаем в цилиндры меньше топлива — убираем ногу с педали акселератора (в народе — педаль газа). В этом случае части молекул кислорода не достается топливо и эти молекулы выходят из цилиндра не среагировав с ним — в виде того же кислорода.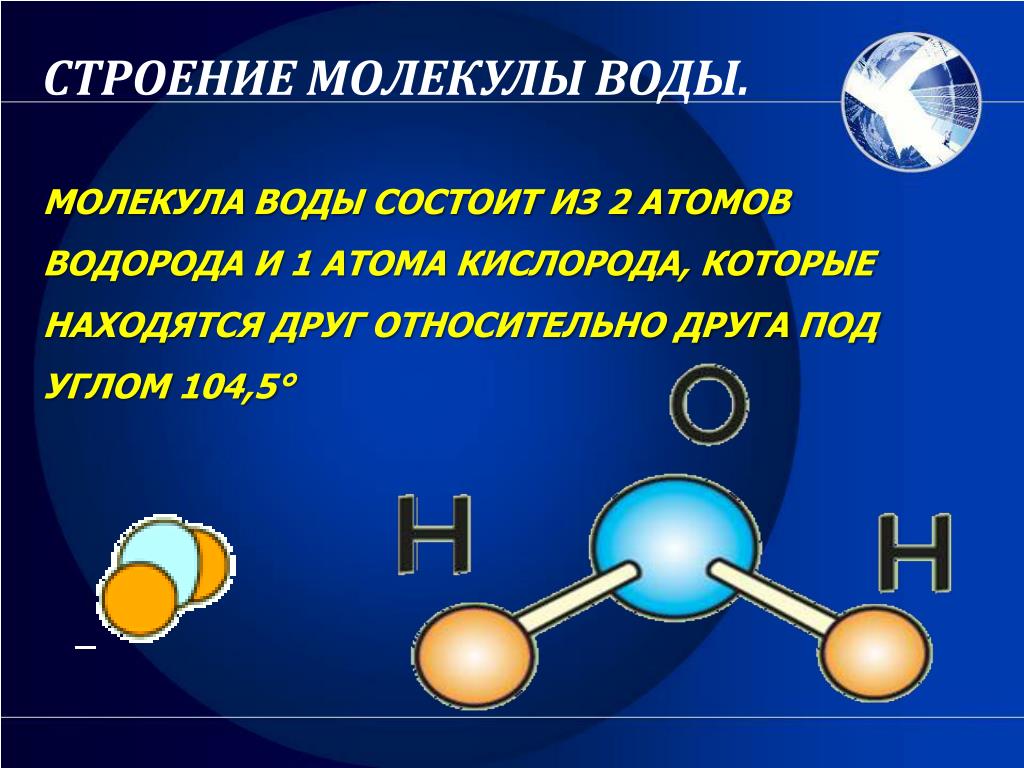
Если же нам нужно ускориться — давим на педаль — впрыскиваем больше топлива. Когда мы давим педаль «в пол», уже каждая молекула кислорода находит себе молекулы топлива для реакции, а значит газ в цилиндре нагревается (а значит — и расширяется, давя на поршень) сильнее.
Но больше определенного количества топлива в цилиндр подавать нет смысла — для его сгорания просто не хватит кислорода в цилиндре. То есть, части молекул топлива не достанется молекул кислорода, не сгоревшая часть топлива вылетит в выхлопную трубу. И никакой прибавки мощности мы не получим. Если прибавка мощности таки нужна, требуется двигатель либо с большим объемом цилиндров (чтобы больше воздуха влезало), либо в цилиндры воздух придется подавать под давлением — с турбины или компрессора. Только в этом случае каждая молекула топлива найдет себе молекулу кислорода для окисления (сгорания).
В этом смысл молярных расчетов.
Вообще, смесь горючих газов с кислородом взрывается только при определенном диапазоне их соотношений. Если одного из газов слишком много или мало, взрыва не будет. Максимальная же мощность при взрыве выделяется при правильном соотношении газов, когда на каждую молекулу одного газа приходится молекула второго газа-реагента (если их валентность одинакова). Если же валентность разная, то при правильном соотношении их объемов с учетом валентности:
Если одного из газов слишком много или мало, взрыва не будет. Максимальная же мощность при взрыве выделяется при правильном соотношении газов, когда на каждую молекулу одного газа приходится молекула второго газа-реагента (если их валентность одинакова). Если же валентность разная, то при правильном соотношении их объемов с учетом валентности:
| |
Водородная связь | Химия для неосновных
Цели обучения
- Определите водородную связь.

- Опишите молекулярные структуры, которые будут участвовать в образовании водородных связей.
В чем разница между этими двумя молекулами?
Грубое эмпирическое правило состоит в том, что материалы с более высокой молекулярной массой имеют более высокие температуры кипения, чем их аналоги с более низкой молекулярной массой. Чтобы переместить большую молекулу из жидкого состояния в парообразное, требуется больше энергии. Однако аммиак имеет точку кипения -33,34 ° C и молекулярную массу 17, в то время как азот (молекулярная масса 28) имеет точку кипения -195.8 ° С. У более легкой молекулы аммиака должны быть другие факторы, влияющие на ее физические свойства.
Водородная связь
Сила притяжения между молекулами воды — это дипольное взаимодействие. Атомы водорода связаны с сильно электроотрицательным атомом кислорода (который также имеет два набора неподеленных пар электронов, что создает очень полярную связь. Затем частично положительный атом водорода одной молекулы притягивается к атому кислорода соседней молекулы воды ( см.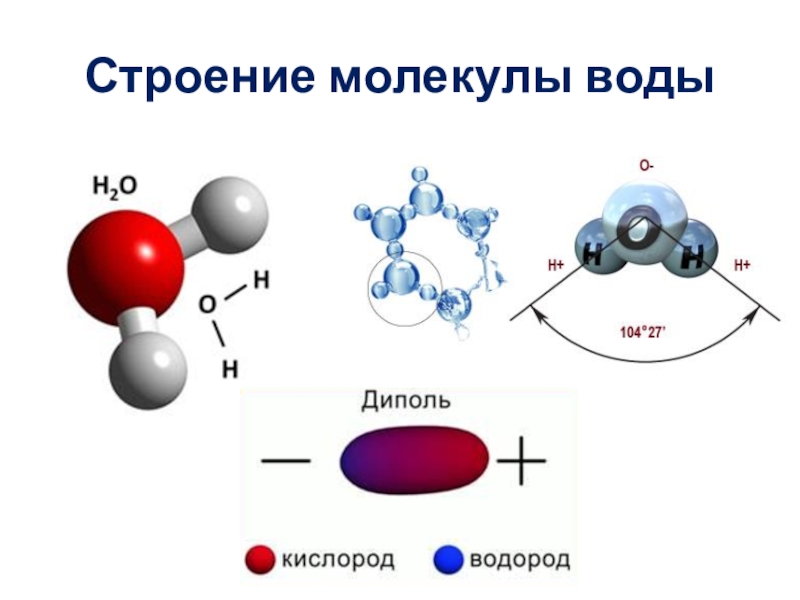 Рисунок ниже).
Рисунок ниже).
Рис. 1. Водородная связь в воде возникает между атомом водорода одной молекулы воды и неподеленной парой электронов на атоме кислорода соседней молекулы воды.
A водородная связь — это сила межмолекулярного притяжения, при которой атом водорода, ковалентно связанный с небольшим, высоко электроотрицательным атомом, притягивается к неподеленной паре электронов на атоме в соседней молекуле. Водородные связи очень сильны по сравнению с другими дипольными взаимодействиями.Прочность типичной водородной связи составляет около 5% от прочности ковалентной связи.
Водородная связь возникает только в молекулах, где водород ковалентно связан с одним из трех элементов: фтором, кислородом или азотом. Эти три элемента настолько электроотрицательны, что отбирают большую часть электронной плотности в ковалентной связи с водородом, оставляя атом H очень электронодефицитным. Атом H действует почти как голый протон, в результате чего его очень привлекают электроны неподеленной пары на соседнем атоме.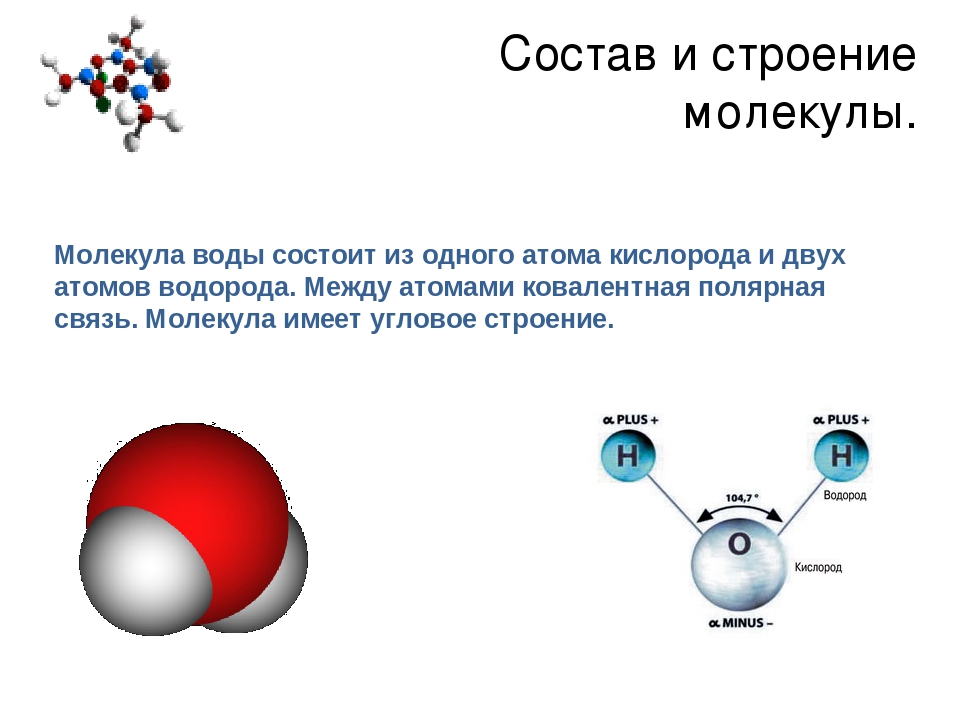
Водородная связь, возникающая в воде, приводит к некоторым необычным, но очень важным свойствам. Большинство молекулярных соединений, имеющих массу, аналогичную воде, при комнатной температуре являются газами. Благодаря сильным водородным связям молекулы воды могут оставаться в жидком состоянии в конденсированном состоянии. На рисунке ниже показано, как изогнутая форма и два атома водорода на молекулу позволяют каждой молекуле воды образовывать водородную связь с двумя другими молекулами.
Рисунок 2.Множественные водородные связи возникают одновременно в воде из-за ее изогнутой формы и наличия двух атомов водорода в молекуле.
В жидком состоянии водородные связи воды могут разрываться и преобразовываться, когда молекулы перемещаются из одного места в другое. Когда вода охлаждается, молекулы начинают замедляться. В конце концов, когда вода превращается в лед, водородные связи становятся постоянными и образуют очень специфическую сеть.
Рис. 3. Когда вода замерзает до состояния льда, сеть водородных связей становится постоянной.Каждый атом кислорода имеет приблизительно тетраэдрическую геометрию — две ковалентные связи и две водородные связи.
3. Когда вода замерзает до состояния льда, сеть водородных связей становится постоянной.Каждый атом кислорода имеет приблизительно тетраэдрическую геометрию — две ковалентные связи и две водородные связи.
Изогнутая форма молекул приводит к разрывам в сети водородных связей льда. Лед обладает очень необычным свойством: его твердое состояние менее плотное, чем жидкое. Лед плавает в жидкой воде. Практически все остальные вещества в твердом состоянии более плотные, чем в жидком. Водородные связи играют очень важную биологическую роль в физических структурах белков и нуклеиновых кислот.
Сводка
- Водородные связи образуются, когда H, присоединенный к атому N, O или F, взаимодействует с другим атомом N, O или F.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://www.elmhurst.edu/~chm/vchembook/161Ahydrogenbond.html
- Каковы особенности N и O, которые затем вызывают образование Н-связей с Н?
- Все ли атомы H образуют водородные связи?
- Какова длина Н-связи по сравнению с длиной ковалентной связи?
Обзор
- Насколько прочна водородная связь?
- Что происходит, когда H ковалентно связан с N, O или F?
- Как форма молекулы воды влияет на ее свойства?
Глоссарий
- водородная связь: Сила межмолекулярного притяжения, при которой атом водорода, ковалентно связанный с небольшим, сильно электроотрицательным атомом, притягивается к неподеленной паре электронов на атоме соседней молекулы.

Конфигурация молекулы воды
Конфигурация молекулы воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Одно-единственное электронное кольцо вокруг ядра каждого атома водорода имеет только один электрон. Отрицательный заряд электрона уравновешивается положительным зарядом одного протона в ядре водорода. Электронное кольцо водорода на самом деле предпочло бы иметь два электрона для создания стабильной конфигурации.Кислород, с другой стороны, имеет два электронных кольца, а внутреннее кольцо имеет 2 электрона, что является холодным, поскольку это стабильная конфигурация. Внешнее кольцо, с другой стороны, имеет 6 электронов, но хотелось бы иметь еще 2, потому что во втором электронном кольце 8 электронов являются стабильной конфигурацией. Чтобы уравновесить отрицательный заряд 8 (2 + 6) электронов, ядро кислорода имеет 8 протонов. Водород и кислород хотели бы иметь стабильные электронные конфигурации, но не как отдельные атомы. Они могут выйти из этого затруднительного положения, если согласятся делиться электронами (своего рода энергетический «договор»).Таким образом, кислород разделяет один из своих внешних электронов с каждым из двух атомов водорода, и каждый из двух атомов водорода имеет один и единственный электрон с кислородом. Это называется ковалентной связью. Каждый атом водорода думает, что у него два электрона, а атом кислорода думает, что у него 8 внешних электронов. Все счастливы, не так ли?
Они могут выйти из этого затруднительного положения, если согласятся делиться электронами (своего рода энергетический «договор»).Таким образом, кислород разделяет один из своих внешних электронов с каждым из двух атомов водорода, и каждый из двух атомов водорода имеет один и единственный электрон с кислородом. Это называется ковалентной связью. Каждый атом водорода думает, что у него два электрона, а атом кислорода думает, что у него 8 внешних электронов. Все счастливы, не так ли?
Рисунок 1. Молекула воды
Источник: Морин Фейнман
Однако оба атома водорода находятся с одной стороны от атома кислорода, так что положительно заряженные ядра атомов водорода остаются открытыми, так сказать, оставляя этот конец молекулы воды со слабым положительным зарядом.Между тем, на другой стороне молекулы избыточные электроны атома кислорода придают этому концу молекулы слабое отрицательное изменение. По этой причине молекула воды называется «диполярной» молекулой. Вода является примером полярного растворителя (одного из лучших), способного растворять большинство других соединений из-за неравномерного распределения заряда молекулы воды. В растворе слабая положительно заряженная сторона одной молекулы воды будет притягиваться к слабой отрицательно заряженной стороне другой молекулы воды, и две молекулы будут удерживаться вместе так называемой слабой водородной связью.В диапазоне температур морской воды слабые водородные связи постоянно разрушаются и реформируются. Это придает воде некоторую структуру, но позволяет молекулам легко скользить друг по другу, превращая ее в жидкость.
В растворе слабая положительно заряженная сторона одной молекулы воды будет притягиваться к слабой отрицательно заряженной стороне другой молекулы воды, и две молекулы будут удерживаться вместе так называемой слабой водородной связью.В диапазоне температур морской воды слабые водородные связи постоянно разрушаются и реформируются. Это придает воде некоторую структуру, но позволяет молекулам легко скользить друг по другу, превращая ее в жидкость.
Учебник по химииХимия водыПолярность воды
Многие другие уникальные свойства воды связаны с водородными связями. Кислоты и основания, ионизация воды
Мы определяем pH раствора как отрицательный логарифм концентрации ионов водорода.
Биологический проект Кафедра биохимии и молекулярной биофизики Университет Аризоны Исправлено: 28 января 2003 г.  Связаться с командой разработчиков http: // www.biology.arizona.edu | |
Информация для учителей
Молекула воды состоит из водорода и кислорода в соотношении двух объемов водорода на каждый объем кислорода, с молекулярной формулой H 2 O и молекулярным диаметром около 2,75 ангстрем.
Молекулы воды (H 2 O) симметричны (точечная группа C 2V ), с двумя зеркальными плоскостями симметрии и двойной осью вращения.Атомы водорода состоят из ядра с одним протоном, окруженного одним электроном. Центральный атом молекулы, атом кислорода, имеет ядро с восемью протонами и восемью нейтронами, окруженное восемью электронами. Ядро водорода связано с центральным атомом кислорода одной полярной ковалентной связью, в которой пара электронов является общей. Каждая связь О-Н воды состоит из молекулярной орбитали (в соответствии с теорией молекулярных орбиталей), образованной одной из орбиталей 2p атома кислорода и орбитали 1s атома водорода.
Изображение извлечено из: http://www.lsbu.ac.uk/water/h3oorb.html
Водяной пар |
Вода в газовой фазе состоит из изолированных молекул H 2 O. Каждая молекула изогнута с валентным углом 105 град. Отрицательный заряд сосредоточен вокруг атома кислорода. Протоны имеют частичный положительный заряд. Карта электронной плотности (вверху справа) показывает, что электронная плотность вокруг кислорода примерно в 10 раз больше, чем вокруг атомов водорода.
| | Водяной пар можно идентифицировать и количественно определить по его ИК-спектру и с помощью его микроволнового спектра. Водяной пар сконцентрирован вблизи поверхности Земли в тропосфере. Это изображение водяного пара в верхних слоях тропосферы и стратосферы в течение летнего сезона 2004 г. Оно было получено с помощью прибора Microwave Limb Sounder (MLS) на спутнике НАСА Aura. MLS может одновременно измерять несколько газовых примесей и озоноразрушающих химикатов в верхних слоях атмосферы. |
Молекула воды может колебаться по-разному. В газовом состоянии колебания включают комбинации симметричного растяжения (v 1 ), асимметричного растяжения (v 3 ) и изгиба (v 2 ) ковалентных связей с интенсивностью поглощения (H 2 16 O) v 1 = 0,07; v 2 = 1,47; v 3 = 1,00. Дипольные моменты изменяются в направлении движения атомов кислорода. Поскольку атомы водорода легкие, колебания имеют большие амплитуды.
Изображение извлечено из: http://www.lsbu.ac.uk/water/vibrat.html
Лед
В отличие от водяного пара, в твердой фазе атомы кислорода в воде находятся в тетраэдре атомов водорода. Справа — диаграмма, показывающая положение атомов кислорода воды в кубической плотноупакованной решетке.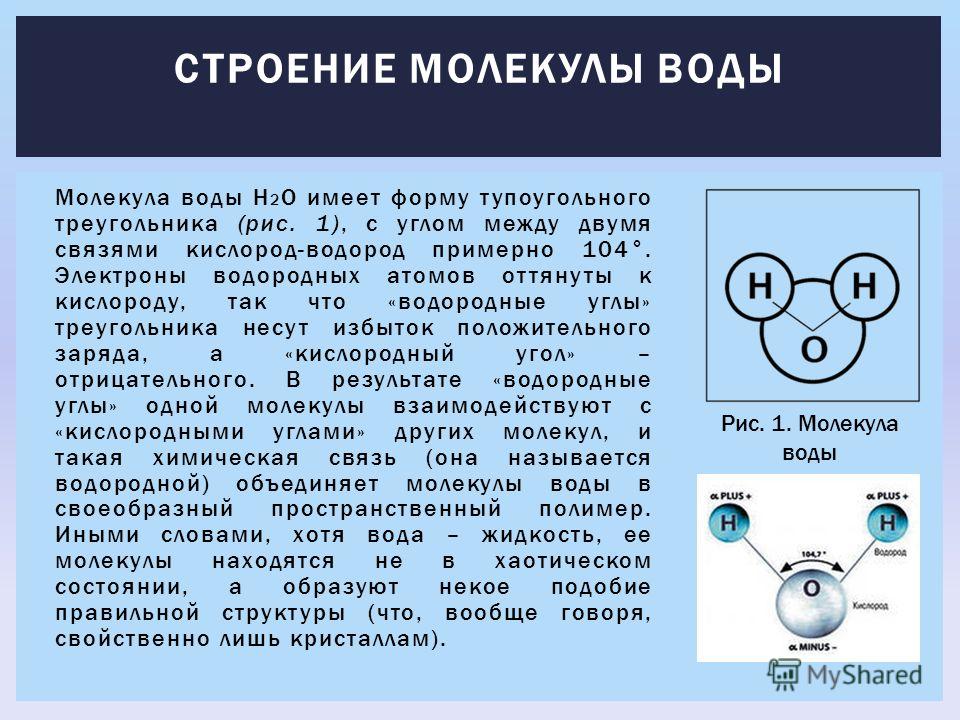
В центре линий, соединяющих каждый атом кислорода с другим, находится атом водорода.
Связи жесткие внутри ледяной конструкции.
Жидкая вода
Но, несмотря на ее распространенность и важность, жидкая вода не так хорошо изучена в других фазах.В недавнем исследовании Нильссон и его коллеги исследовали структуру жидкой воды с помощью рентгеновской эмиссионной спектроскопии и рентгеновской абсорбционной спектроскопии. Эти методы используют рентгеновские лучи, генерируемые синхротронным источником света, для возбуждения электронов в единственном атоме кислорода молекулы воды. Настройка рентгеновских лучей на определенный диапазон энергий может с точностью выявить местоположение и расположение молекул воды.
Исследователи обнаружили, что вода в основном состоит из тетраэдрических групп, как во льду, но есть также менее определенная структура, которая выглядит как искаженная форма водяного пара с водородными связями.
Атомы кислорода в искаженных молекулах воды имеют 2 сильные связи с водородом и 2 слабые. Кислороды в тетраэдрической ледяной воде имеют 4 эквивалентных связи с водородом.
Кислороды в тетраэдрической ледяной воде имеют 4 эквивалентных связи с водородом.
Даже в своей тетраэдрической форме жидкая вода отличается от льда, потому что связи постоянно разрываются, молекулы воды движутся и образуются новые связи.
Вода плотнее льда из-за того, что молекулы воды удерживаются в отверстиях кубической плотноупакованной решетки.
| Ледяная решетка | Водяная решетка |
Молекулярные орбитали H 2 O (г)
В этом разделе мы сравним связывание двух связанных молекул в газовой фазе: воды и озона. Наш первый шаг — построить структуру Льюиса для каждой из этих молекул.VSEPR дает нам структуру.
Каждая молекула имеет ось C 2 и 2 вертикальные плоскости. Это помещает их в точечную группу C 2v .
Давайте сначала посмотрим на сигма-склеивание.
- Для воды нам нужно создать 2 групповые орбитали из атомных 1s-орбиталей водорода.

- Для озона мы делаем 2 групповые орбитали из конечных кислородных 2s-орбиталей.
- В каждом случае одна орбиталь будет иметь 0 узлов, а другая, с более высокой энергией, будет иметь 1 узел.
Обратите внимание, что орбиталь с более низкой энергией (группа 1) преобразуется как A 1 в группу C 2v , а орбиталь группы с более высокой энергией (группа 2) преобразуется как B 2 . С какими кислородными орбиталями это будет взаимодействовать? Посмотрим на симметрию.
Из симметрии мы видим, что
- и 2p z , и 2s-орбитали в центральном кислороде будут взаимодействовать с группой 1 (A 1 )
- орбиталь 2p y будет взаимодействовать с группой 2 (B 2 )
- 2p x не имеет правильной симметрии для связывания сигма
Давайте объединим 2 орбитали симметрии A 1 на центральном кислороде (2s и 2p z ) с групповой орбиталью с этой симметрией. Объединение 3 орбиталей должно дать нам 3 молекулярные орбитали: 1, 2 и 3.
Объединение 3 орбиталей должно дать нам 3 молекулярные орбитали: 1, 2 и 3.
Теперь мы можем объединить орбитали с симметрией B 2 : 2p y на центральном кислороде с групповой орбиталью 2. Объединение 2 орбиталей даст нам 2 молекулярные орбитали.
В воде на кислороде остается 2p x орбитали, которая не может сочетаться с какой-либо другой орбиталью. Это становится несвязывающей молекулярной орбиталью. Мы получаем в общей сложности 6 молекулярных орбиталей.
- Две нижние орбитали прочно связаны.
- Две верхние орбитали сильно разрыхляют связь.
- Две средние орбитали в значительной степени не связаны. Они могут быть представлены неподеленными парами кислорода в структуре воды Льюиса.
А как насчет озона? Орбиталь 2p x на центральном кислороде имеет правильную симметрию для объединения с групповой орбиталью, состоящей из 2p x орбиталей на двух концевых атомах кислорода.
Эти 2 орбитали могут объединяться, образуя молекулярные орбитали симметрии 2 пи.Остальные орбитали на концевых атомах кислорода (O 1 (2p y ), O 1 (2p z , O 3 (2p y ) и O 3 (2p z ) ) не связывают.
Алмазная решетка конденсированной H 2 O
Структура как жидкой воды, так и твердой воды основана на решетке алмаза. Сначала мы должны рассмотреть более простую структуру — кубическую структуру с замкнутой упаковкой.В массиве ccp атомы кислорода воды упакованы как можно ближе, чтобы имитировать пустое пространство.Плотноупакованные структуры начинаются с гексагонально упакованного слоя. Представьте, что вокруг каждого атома упакованы 6 других атомов кислорода.
В любом плотноупакованном массиве атомов или ионов есть как октаэдрические, так и тетраэдрические дырки, в которых могут находиться более мелкие атомы или ионы.
На этом рисунке представлены три слоя атомов или ионов. Посмотрите на первый слой. Есть дыры, окруженные 3 из этих анионов.
Посмотрите на первый слой. Есть дыры, окруженные 3 из этих анионов.
Мы добавляем второй слой (красный) так, чтобы каждый атом или ион помещался в углубление в слое под ним.Некоторые дыры в первом слое закрыты другим атомом или ионом во втором слое. Это четырехгранные отверстия. Другие отверстия не закрываются таким образом. В эти октаэдрические отверстия могут поместиться атом или ион большего размера, которые окружены 3 анионами из одного слоя и 3 из другого слоя.
Третий слой покрывает эти октаэдрические отверстия в наслоении ABC кубической плотноупакованной структуры (ccp).
Наименьшей повторяющейся единицей регулярной трехмерной структуры является элементарная ячейка.Справа внизу — простой куб, разделенный на 8 кубиков меньшего размера. Если бы атомы кислорода занимали вершины большого куба и были центрированы на каждой грани, они были бы в элементарной ячейке кубического плотноупакованного массива. Этот вид насадки еще называют гранецентрированной кубической.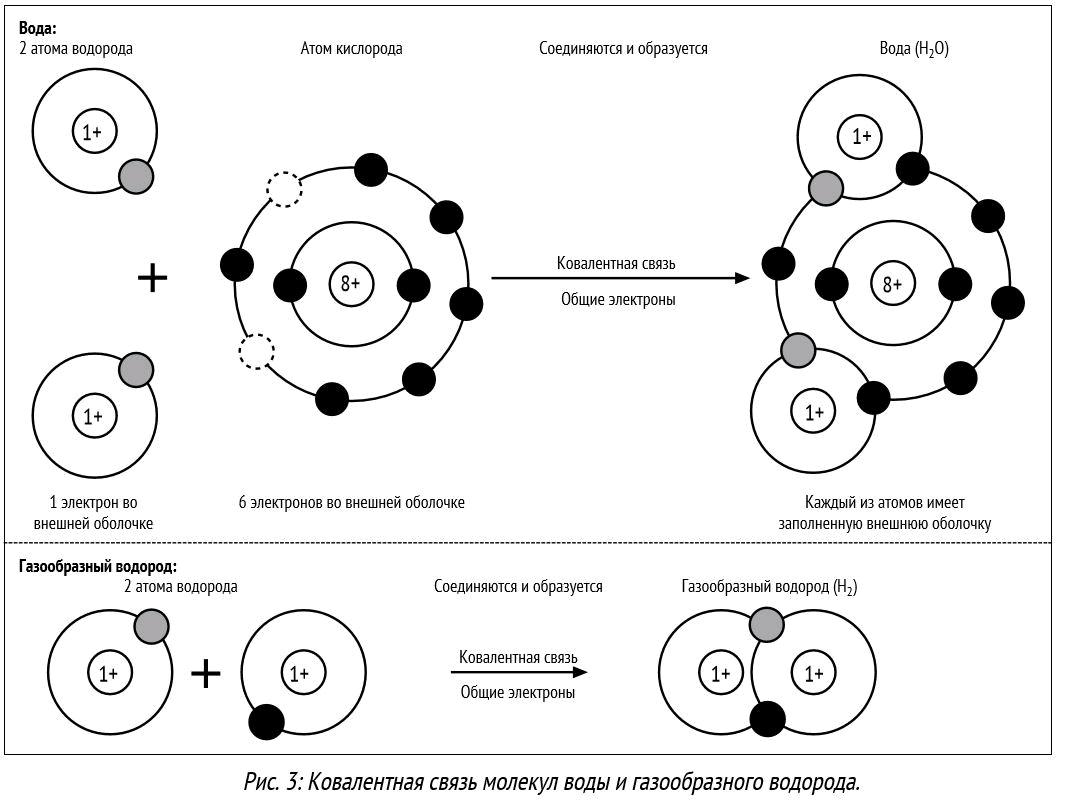
Во льду атомы кислорода также занимают центры 4 из 8 меньших кубиков. Линии, которые соединяют каждый внутренний атом кислорода с кислородом вершины и 3 атомами кислорода на гранях большого куба, на самом деле соединяют атомы водорода: единицы O-H-O.
Каждый атом кислорода находится в тетраэдре атомов водорода.
Химические модули
Химические модулиНажмите кнопку ниже, чтобы перейти в нужный раздел.
ОБЩАЯ ХИМИЯ
Атомы — основная единица химии.Они состоят из трех основных части: 1) Нейтроны : Нейтроны — это незаряженные частицы, которые находятся в
центр атома (ядро ). Нейтроны придают массу (вес)
атом, но не участвуют в химических реакциях.
2) Протоны: Протоны — это положительно заряженные частицы, которые также находится в ядре. Подобно нейтронам, протоны придают массу атому, но не участвуют в химических реакциях.Число протонов в атоме называется атомами атомным номером и определяет атомы идентичность (например, атомы углерода имеют 6 протонов, атомы кислорода имеют 8 протонов).
3) Электроны : Электроны — это отрицательно заряженные частицы, которые найдено в электронных оболочках , окружающих ядро. Они имеют практически не имеет массы, но играет важную роль в химических реакциях. Первый электронная оболочка может содержать 2 электрона.Для большинства биологически значимых атомов дополнительные электронные оболочки (если они есть) могут содержать до восьми электронов.
Каждый атом содержит равное количество протонов
и электроны. Количество нейтронов может варьироваться в пределах атомов конкретного
тип. (Например, атомы углерода могут иметь 6, 7 или 8 нейтронов). Атомы, которые
различаются только числом нейтронов, называются изотопами.
Атомы, которые
различаются только числом нейтронов, называются изотопами.
Облигации
Атомная стабильность:
Стабильность атомов зависит от того, внешняя оболочка заполнена электронами.Если внешняя оболочка заполнена, атом устойчив. Атомы с незаполненными внешними оболочками нестабильны и будут обычно образуют химических связей с другими атомами для достижения стабильности.
Пример нестабильный атом с единственным электроном во внешней оболочке. | |
Пример нестабильный атом с 7 электронами в самой внешней оболочке. | |
Примеры стабильные атомы. |
Два типа химических связей, которые атомы
могут образовываться для достижения стабильности, называются ионными связями и ковалентными
облигации . В ионных связях атомы отдают или получают электроны для достижения
стабильность.В ковалентных связях атомы разделяют электроны для достижения стабильности.
Тип (ы) связи, которую может образовать конкретный атом, зависит от количества
электроны в их внешних оболочках.
В ионных связях атомы отдают или получают электроны для достижения
стабильность.В ковалентных связях атомы разделяют электроны для достижения стабильности.
Тип (ы) связи, которую может образовать конкретный атом, зависит от количества
электроны в их внешних оболочках.
Ионные связи:
Ионные связи возникают в результате передачи электронов между атомами. Если у атома есть только мало электронов во внешней оболочке, он может добиться стабильности, пожертвовав эти электроны к атому, внешняя оболочка которого почти заполнена.
Например:
Атом натрия имеет только один электрон в его внешняя оболочка. У атома хлора семь внешних электронов (почти полная оболочка).
Если одинокий внешний электрон натрия
переносится на атом хлора, оба атома будут иметь полные внешние оболочки
и так достиг бы стабильности.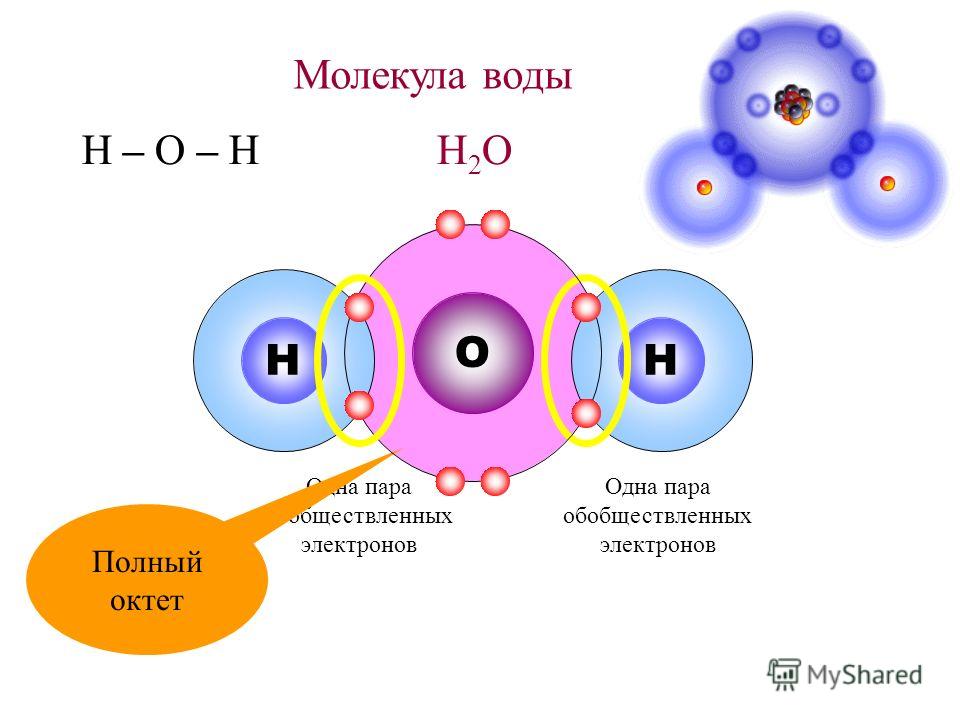
| Когда хлор получает дополнительный электрон, он называется хлоридом. |
Поскольку хлор приобрел отрицательно заряженный
электрон, теперь в нем больше электронов, чем протонов, и он имеет отрицательный
плата. Поскольку натрий потерял электрон, у него теперь больше протонов, чем
электронов и поэтому имеет чистый положительный заряд.Заряженные частицы (например, натрий
и хлор после переноса электронов) называются ионами .
(В частности, положительно заряженные ионы называются катионами , и
отрицательно заряженные ионы называются анионами ). Из-за противоположного
заряд двух ионов (отрицательный хлорид и положительный натрий), два иона
притягиваются друг к другу и образуют ионную связь . Результирующий
соединение упоминается как ионное соединение.Обратите внимание, что ионные соединения
обладают совершенно другими свойствами, чем любой из атомов, которые их делают
вверх.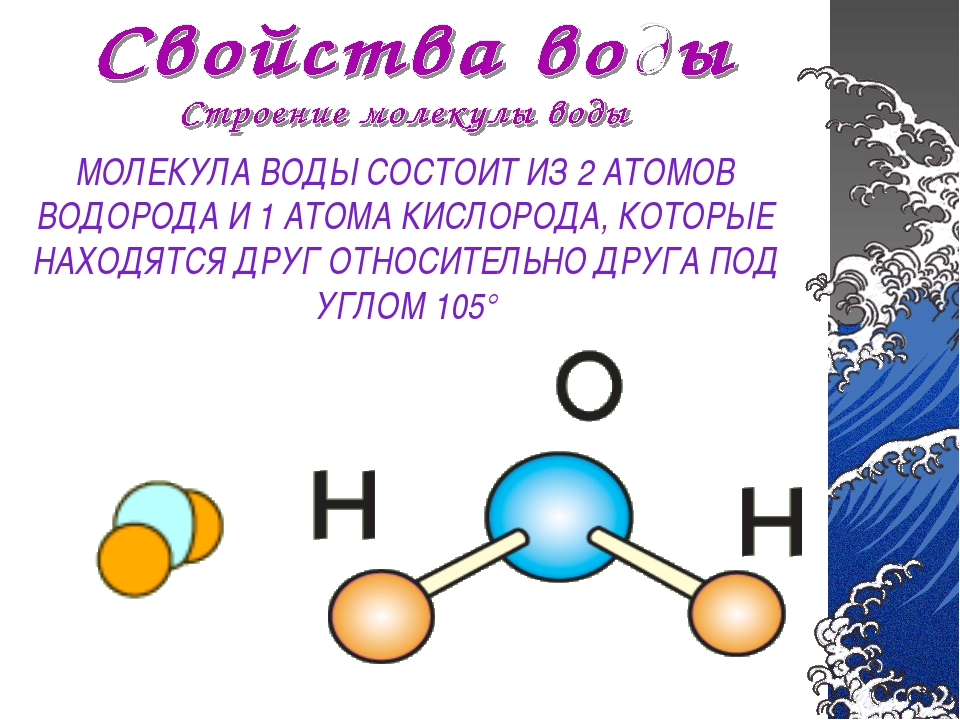 Натрий — это серебристый металл с высокой реакционной способностью. Хлор — это токсичный зеленый газ.
Хлорид натрия — это поваренная соль.
Натрий — это серебристый металл с высокой реакционной способностью. Хлор — это токсичный зеленый газ.
Хлорид натрия — это поваренная соль.
Анимация ниже дополнительно иллюстрирует образование ионного соединения хлорида натрия.
Ионные соединения могут образовывать от переноса одного или двух (иногда трех) электронов.
Обратите внимание, что в водянистой среды клеток или растворов, молекулы воды нарушают ионный связывает, разделяя разные ионы. Ионы также называют Электролиты . Натрий, хлорид, кальций и калий являются биологически важные электролиты.
Ковалентные связи:
Ковалентные связи возникают, когда атомы достигают стабильности за счет
обмен электронами.В
на рисунке ниже центральный атом углерода делит одну пару электронов
с 4 различными атомами водорода, образуя молекулу CH 4 (метан). Обратите внимание: если вы посчитаете все электроны на внешней оболочке
углерода, их 8, так что стабильно. Если посчитать все электроны в каждом
водородной внешней оболочки их 2. Поскольку первая оболочка вмещает только два
электронов, атомы водорода также стабильны.
Если посчитать все электроны в каждом
водородной внешней оболочки их 2. Поскольку первая оболочка вмещает только два
электронов, атомы водорода также стабильны.
На анимации ниже показан другой вид того, как атомы в метане делятся электроны.
Также возможно, что атомы разделяют два или три пары электронов. На картинке ниже два атома кислорода разделяют две пары электронов, образующие молекулу газообразного кислорода (O 2 ).
Ковалентные связи часто представляют в виде одинарных линий в химических формулах. Например, в ковалентных соединениях, показанных ниже, каждая линия представляет собой общую пару электронов.
Полярные соединения и водородные связи:
Иногда атомы в ковалентной связи не разделяют
электронов одинаково. Если это произойдет, атом, который захватывает электроны больше
время будет иметь частично отрицательный заряд, а атом, не имеющий
получить столько электронов будет иметь частично положительный заряд. Когда это
бывает, это называется полярной ковалентной связью, и молекулы, образованные
полярные ковалентные связи называются полярными молекулами.Азот и кислород имеют
более высокое сродство к электронам, чем водород, поэтому всякий раз, когда атомы водорода
связаны с азотом или кислородом, это полярное соединение. Вода (h3O) — это
пример полярного соединения.
Когда это
бывает, это называется полярной ковалентной связью, и молекулы, образованные
полярные ковалентные связи называются полярными молекулами.Азот и кислород имеют
более высокое сродство к электронам, чем водород, поэтому всякий раз, когда атомы водорода
связаны с азотом или кислородом, это полярное соединение. Вода (h3O) — это
пример полярного соединения.
| Поскольку часть каждой молекулы воды положительна, а часть молекула отрицательна, соседние молекулы воды будут иметь тенденцию привлечены друг к другу.Притяжение между частично положительный атом водорода одной молекулы и частично отрицательный атом кислорода (или азота) другой молекулы называется водородом. облигация. | Притяжение между негативом кислород и положительный водород другой воды молекулы является примером водородной связи. |
Водородные связи придают воде многие ее уникальные свойства. свойства. Водородные связи также важны для поддержания трех
размерная форма белков и скрепление цепей ДНК.
Водородные связи намного слабее ковалентных или ионных связей.
свойства. Водородные связи также важны для поддержания трех
размерная форма белков и скрепление цепей ДНК.
Водородные связи намного слабее ковалентных или ионных связей.
Водородные связи. Чтобы понять водородные связи, вы должны сначала понять природу особый тип ковалентной связи называется полярной ковалентной связью.
1. В полярных ковалентных связях электроны сильнее привлечены к одному из двух атомов, обычно к кислороду или азоту, чем к другой атом.
2. Потому что отрицательно заряженный электрон проводит больше времени вокруг кислорода или азота, эти атомы становятся слегка отрицательно заряженными.
3. Потому что у другого атома электрон, реже он остается с небольшим положительным зарядом.
Пример: Молекулы воды содержат полярные
ковалентные связи, потому что большое ядро кислорода создает большее притяжение к электронной паре, чем небольшое
ядро атома водорода. Это приводит к частичному отрицательному
заряд вокруг кислорода, оставляя после себя частичный положительный заряд с
атом водорода.
Это приводит к частичному отрицательному
заряд вокруг кислорода, оставляя после себя частичный положительный заряд с
атом водорода.
Водородные связи всегда образуются
между атомом водорода одной молекулы и атомом кислорода или азота
другая молекула, если кислород или азот образуют полярную ковалентную связь.В
прилипание («липкость») молекул воды друг к другу — отличное
пример водородной связи. Что касается воды, помните, что молекулы
в целом нейтральный, но кислород немного отрицательный, а водород
немного положительно. Водород
образуются связи между слегка положительным зарядом атомов водорода,
слабо притягивается к слегка отрицательному заряду атома кислорода на
другая молекула воды. Как
в результате молекулы воды прилипают друг к другу, как на иллюстрациях.
ниже.Водородные связи также встречаются в молекулах нуклеиновых кислот, ДНК и
РНК. В молекулах ДНК водородные связи между основаниями удерживают два
пряди скреплены двойной спиралью. Водородные связи также встречаются в
переносить молекулы РНК, а также между ДНК
нуклеотидов и новообразованной цепи мРНК. Структура многих белков
молекулы также зависят от образования водородных связей.
Структура многих белков
молекулы также зависят от образования водородных связей.
Примеры химических представлений водорода облигации:
| Водородные связи между гуаниновым нуклеотидом и цитозиновый нуклеотид в двух отдельных молекулах ДНК. | |
| Две молекулы воды, образующие водородные связи с молекула аденина. | |
| Пять молекул воды, образующих водородные связи. В атомы кислорода синие, а атомы водорода красные. Водородные связи представлен серией линий между атомом водорода одной молекулы и атом кислорода другой молекулы. |
Перед тем, как пройти тест по этой теме, обязательно просмотрите следующие веб-ссылка, чтобы усилить темы, рассмотренные в этом модуле: http: // www2.nl.edu/jste/bonds.htm
pH
шкала измеряет, сколько ионов водорода, H + , присутствует в
решение.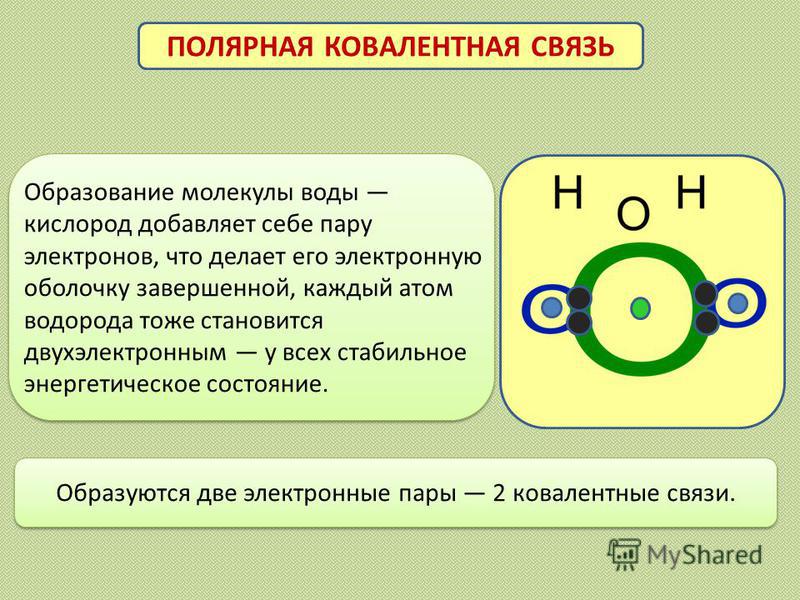 Поскольку концентрация означает, сколько вещества присутствует в
В растворе шкала pH измеряет концентрацию ионов водорода. Поскольку
диапазон концентраций ионов водорода чрезвычайно велик, логарифмический масштаб
необходим для выражения количества присутствующих ионов водорода.С помощью
логарифмическая шкала означает изменение каждого целого числа, количество водорода
ионов в растворе изменяется в 10 раз. Низкие значения pH отражают
наибольшее количество присутствующих ионов водорода и большие числа представляют
наименьшее количество присутствующих ионов водорода.
Поскольку концентрация означает, сколько вещества присутствует в
В растворе шкала pH измеряет концентрацию ионов водорода. Поскольку
диапазон концентраций ионов водорода чрезвычайно велик, логарифмический масштаб
необходим для выражения количества присутствующих ионов водорода.С помощью
логарифмическая шкала означает изменение каждого целого числа, количество водорода
ионов в растворе изменяется в 10 раз. Низкие значения pH отражают
наибольшее количество присутствующих ионов водорода и большие числа представляют
наименьшее количество присутствующих ионов водорода.
Вода
молекулы состоят из двух атомов водорода и одного атома кислорода ковалентно
связаны вместе. Но иногда один из атомов водорода покидает воду
молекула как ион водорода.(Электрон водорода остается с кислородом.)
Следовательно, вода имеет смесь H + и OH — . Когда
есть равное количество H + и OH — , значение на
шкала pH равна 7. Если H + больше, чем OH — в
раствора, значения шкалы pH меньше 7. Если H + чем OH — в растворе, значения шкалы pH больше 7.
Каким образом в растворе получается неравное количество H + и OH — ?
Если H + чем OH — в растворе, значения шкалы pH больше 7.
Каким образом в растворе получается неравное количество H + и OH — ?
ИСПОЛЬЗУЙТЕ ЭТУ АНИМАЦИЮ ПОМОЧЬ ВАМ ПОНИМАТЬ pH
ТЫ НУЖНА ВСПЫШКА 9.0 ЧТОБЫ ПРОСМОТРЕТЬ ЭТИ ПРАВИЛЬНО. ПО ССЫЛКЕ НИЖЕ ОБНОВИТЕ СВОЙ ПЛАГИН.
http://www.macromedia.com/software/flash/about/
| Кислоты — это соединения, которые отдают H + при добавлении к
воды. 1. Добавьте одну каплю HCl в вода. Как изменилось значение pH? 2.Добавьте дополнительные капли HCl. Как изменились значения pH? Основания — это соединения, пожертвовать OH — при добавлении в воду. 3. Не сбрасывая анимацию , добавить одну каплю КОН. Как изменился pH изменение стоимости? Что случилось с видимым H + ? 4. Добавьте дополнительные капли КОН. Что случилось с видимым H + ? Как изменились значения pH изменение? 5.Сбросить анимацию и добавить несколько капель HCl или KOH в раствор. Как изменяется значение pH изменение? |
Сильный
кислота, такая как HCl, полностью диссоциирует. Это означает, что вся кислота
молекулы полностью разделяются на ионы водорода и анионы (например, молекулы HCl
разделить на H + и Cl-). Слабые кислоты, такие как H 2 CO 3, do
не разъединять полностью.Некоторые молекулы H 2 CO 3 диссоциируют на H + и HCO 3 — , в то время как другие молекулы
останется как H 2 CO 3. Нажмите на капельницу HCl ниже, чтобы увидеть
как сильная кислота будет действовать в растворе. Затем нажмите H 2 CO 3 , чтобы увидеть, как эта слабая кислота диссоциирует в растворе.
Затем нажмите H 2 CO 3 , чтобы увидеть, как эта слабая кислота диссоциирует в растворе.
Common Chemicals | pH |
| натрия гидроксид NaOH (щелочь или каустическая сода) | 14.0 |
| гидроксид магния Mg (OH) 2 (Магнезийное молоко) | 10,5 |
| бикарбонат натрия NaHCO 3 (пищевая сода) | 8,3 |
| Уксусная кислота CH 3 COOH (в уксусе) | 2,2 |
| Серная кислота H 2 SO 4 (в свинцово-кислотных аккумуляторах) | 0.5 |
| Соляная кислота HCl (1M) | 0,1 |
Материал | pH | Материал | pH |
| Пиво | 4,5 | Кофе | 5,0 |
| Яблочный сок | 3. 5 5 | Молоко | 6,5 |
| Кола | 2,5 | Чистая вода | 7,0 |
| Лимонный сок | 2,4 | Кровь человека | 7,4 |
| Желудочный сок | 1,7 | Морская вода | 8,0 |
pH крови человека, цитоплазмы клеток, и других биологических жидкостей обычно находится в диапазоне 7.От 35 до 7,45. Поскольку pH 7 является нейтральным, эти жидкости можно назвать слабыми основаниями (или более щелочными). Для обзор шкалы pH см. эти изображения:
http://www.epa.gov/acidrain/site_students/images/phscale.gif
http://mddnr.chesapeakebay.net/eyesonthebay/images/ph.gif
http://teacherweb. com/NF/StPetersJuniorHigh/MrGWilliams/ph.bmp
com/NF/StPetersJuniorHigh/MrGWilliams/ph.bmp
Изменить pH в нашем кровь.Просто задержав дыхание на несколько секунд, вы можете накапливать CO 2 в организме, что приводит к увеличению количества ионов H + в крови. Как бы вы описываете pH этой крови (более кислая или более щелочная)? Ответ
Другое частое изменение pH происходит, когда мы усиленно тренируемся и чувствуем жар (ожог) в наших мышцы. Повышенная кислотность в наших мышцах вызывает ожог. Обычно это чувство жжения проходит через несколько минут.
При изменении pH от нормального диапазона 7,35-7,45, организм пытается вернуть pH в нормальный диапазон. Молекулы в организм может поглощать избыточные ионы водорода (H +) в кислой среде и выделять ионы водорода (H +) в основных ситуациях. Эти молекулы называются буферами.
В этом мультфильме буфер выглядит как
губка, которая может захватывать ионы водорода из раствора или выделять их.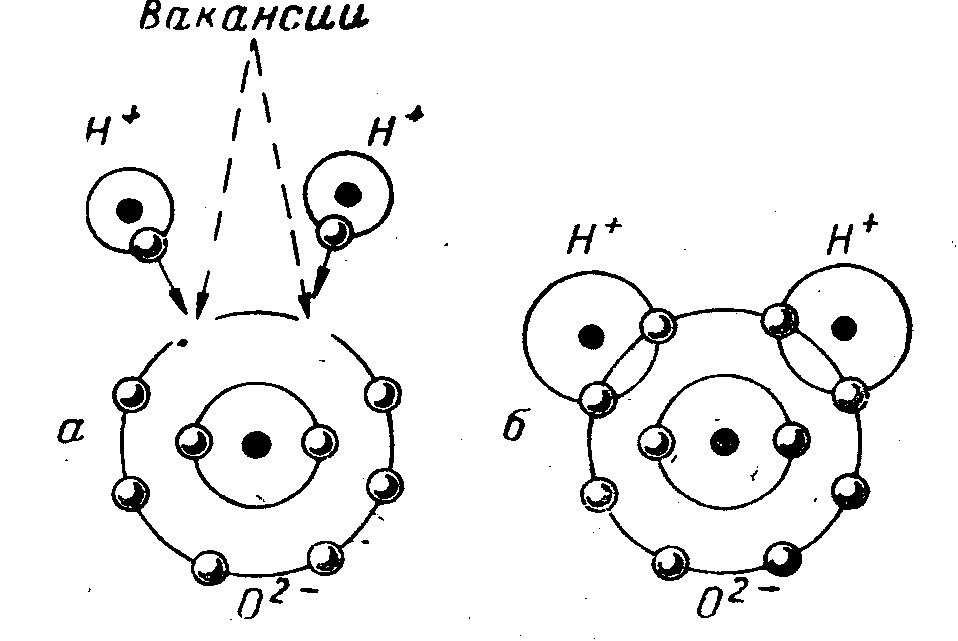 Который
В каком направлении пошла бы эта реакция, если бы pH клеток был слишком низким (кислым)?
Который
В каком направлении пошла бы эта реакция, если бы pH клеток был слишком низким (кислым)?
Ответ
В каком направлении пошла бы эта реакция, если бы pH клеток был слишком высокий (базовый)?
Ответ
Рассмотрим стакан, заполненный буфером. решение. Обратите внимание на следующую анимацию, которая позволяет вам изменить pH раствор, добавив сильную кислоту или сильное основание.PH буфера решение ненадолго изменится, а затем вернется в исходную точку.
http://www.mhhe.com/physsci/chemistry/essentialchemistry/flash/buffer12.swf
Ответьте на следующие вопросы относительно анимация:
Каков pH раствора сразу после добавления HCl? Ответ
Каков pH раствора сразу после добавления NaOH? Ответ
В любом случае, что происходит с pH буферного раствора через некоторое время? Ответ
На анимации HCl обозначен как сильный
кислота. Ожидаете ли вы, что сильная кислота будет выделять больше H + в растворе, чем
слабая кислота? Сравнить сильные кислоты с слабые кислоты в Википедии. Ответ
Ожидаете ли вы, что сильная кислота будет выделять больше H + в растворе, чем
слабая кислота? Сравнить сильные кислоты с слабые кислоты в Википедии. Ответ
На анимации NaOH обозначен как сильный база. Ожидаете ли вы, что сильная база будет принимать больше протонов, чем слабая? Ответ
Распад молекул аминокислот в наши клетки выделяют аммиак (Nh4).Аммиак может поглощать ион водорода, образуя ион аммония (Nh5 +). Просмотрите схему ниже.
Как эта реакция повлияет на pH сотовый? Ответ
В этом примере какой термин правильно описывает NH 3 ? Ответ
Почвенная вода: от молекулярной структуры к поведению
Бахманн, Дж.& van Der Ploeg, R.R. Обзор недавних
разработки в теории удержания влаги в почве: межфазное натяжение и
температурные эффекты. Дж. Плант Нутр . 165 , 468-478 (2002).
Дж. Плант Нутр . 165 , 468-478 (2002).
Brantley, S. L., Kubicki, J. D. & White, A. F. eds. in Кинетика взаимодействия воды и породы . Springer, 2008.
Brutsaert, W. Hydrology: An Introduction . 605 Cambridge University Press, 2005.
Берджесс, Дж. Ионы металлов в растворе .1-е изд. Wiley, 1978.
Кэмпбелл, Г. С. и Норман, Дж. М. Введение в биофизику окружающей среды . Vol. второй 286 Springer-Verlag, 1998.
Эйзенберг Д. и Каузманн В. Структура и свойства воды . 296 Oxford University Press, 1969.
Эссингтон М.Э. Химия почв и воды: комплексный подход . CRC Press, 2004.
Фалькенмарк, М. и Рокстрём Дж. Новая парадигма голубой и зеленой воды: ломка Новая основа для планирования и управления водными ресурсами. Журнал планирования и управления водными ресурсами 132 , 129-132 (2006).
Fortes, A.D. и др. . Нет доказательств крупномасштабного протонного упорядочения в антарктическом льду по результатам порошковой дифракции нейтронов. Журнал химической физики 120 , 11376-11379 (2004).
Журнал химической физики 120 , 11376-11379 (2004).
Фортуна А. Почвенная биота. Знания о естественном образовании 3 , 1 (2012).
Франк, Х. С. в Вода: всеобъемлющий трактат Vol.1 (под ред. Ф. Франкса) гл. 14, 515-543 Пленум, 1972 г.
Franks, F. Вода: матрица жизни . 225 Королевское химическое общество, 2000.
Hasted, J. B. в Вода: всеобъемлющий трактат Vol. 1 (под ред. Ф. Франкса) гл. 7, 255-309 Пленум, 1972 г.
Хэвлин, Дж. Л., Битон, Дж. Д., Тисдейл, С. Л. и Нельсон, У. Л. Плодородие почвы и удобрения . 7-е изд. Прентис Холл, 2005.
Гилель Д. Физика почв окружающей среды .770 Academic Press, 1998.
ИЮПАК. Сборник химической терминологии («Золотая книга») . 2-е изд. Научная публикация Блэквелла, 1997.
Айвс, Д. Дж. И Лемон, Т. Х. Структура и свойства воды Обзоры Королевского института химии 1 (1968).
Джеймс, Т. , Уэльс, Д. Дж. И Эрнандес-Рохас, Дж. Глобальные минимумы для водных кластеров (H 2 O) n , n ≤ 21, описываемые пятиузловым эмпирическим потенциалом. Chem Phys Lett 415 , 302-307 (2005).
, Уэльс, Д. Дж. И Эрнандес-Рохас, Дж. Глобальные минимумы для водных кластеров (H 2 O) n , n ≤ 21, описываемые пятиузловым эмпирическим потенциалом. Chem Phys Lett 415 , 302-307 (2005).
Джури, У. А. и Хортон, Р. Физика почвы . 6-е изд. 370 Wiley, 2004.
.Киркхэм, М. Б. Принципы водного отношения почвы и растений . Эльзевир, 2005.
Линдси, У. Л. Химическое равновесие в почвах . 449 Wiley, 1979.
Ловли, Д. Р. Микробное восстановление железа, марганца и других металлов Успехи в агрономии 28 , 175-231 (1995).
Майер Р. М., Пеппер И. Л. и Герба К. П. Экологическая микробиология . 2-е изд. Эльзевир, 2008.
Манахан С.Э. Химия окружающей среды . 8-е изд. CRC Press, 2004.
Marais, D. J. D. et al. . Дорожная карта астробиологии НАСА Astrobiology 8 , 715-730 (2008).
Макнер-младший, Д. Х. Ризосфера — корни, почва и все остальное Между Знания в области естественного образования 4 , 1 (2013).
Ризосфера — корни, почва и все остальное Между Знания в области естественного образования 4 , 1 (2013).
Мосс, Б. Экология пресных водоемов: взгляд на XXI век . 4-е изд. Wiley, 2010.
.Национальная инженерная академия. Грандиозные вызовы инженерии. (Национальная академия наук, Вашингтон, округ Колумбия, 2008 г.).
О’Джин, А. Т. Динамика почвенных вод. Знания о естественном образовании 4 , 9 (2013).
Полинг Л. Общая химия . 3-е изд. 992 Dover Publications, 1988.
Пьерзинский, Г.М., Симс, Дж. Т. и Вэнс, Г. Ф. Почвы и качество окружающей среды . 3-е изд. Тейлор и Фрэнсис, 2005.
Соломон, С. Вода: эпическая борьба за богатство, власть и цивилизацию . 624 Харпер, 2011.
Спаркс, Д. Л. Химия почв в окружающей среде . 2-е изд. Academic Press, 2003.
.Sposito, G. Химия почв . Oxford University Press, 2008.
Спозито, Г. в Почва под ногами: бесконечные возможности для конечного ресурса (ред.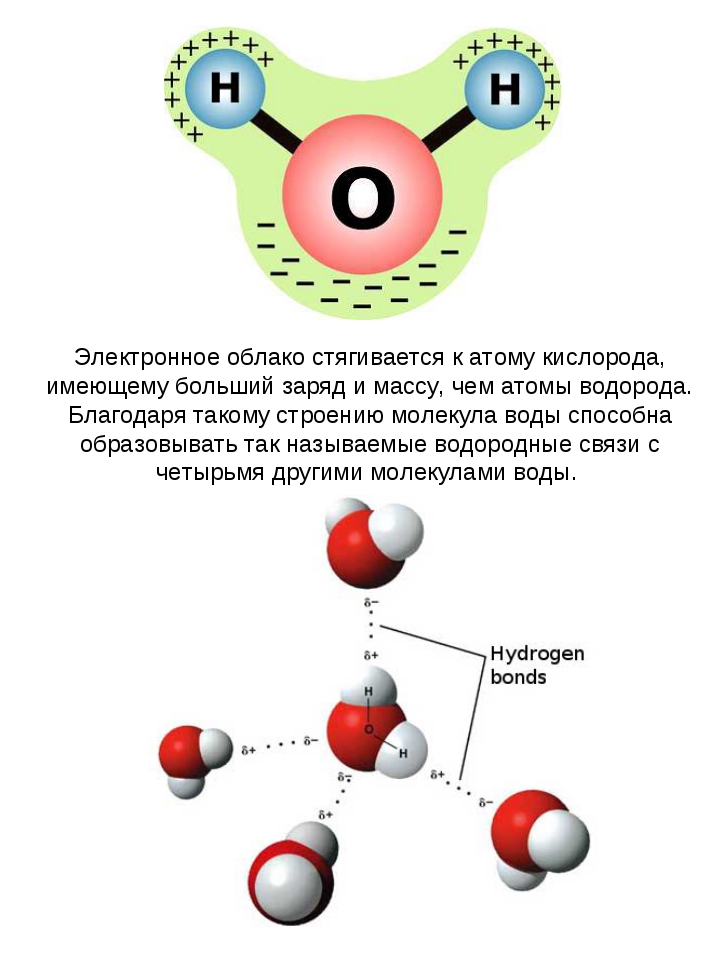


 В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.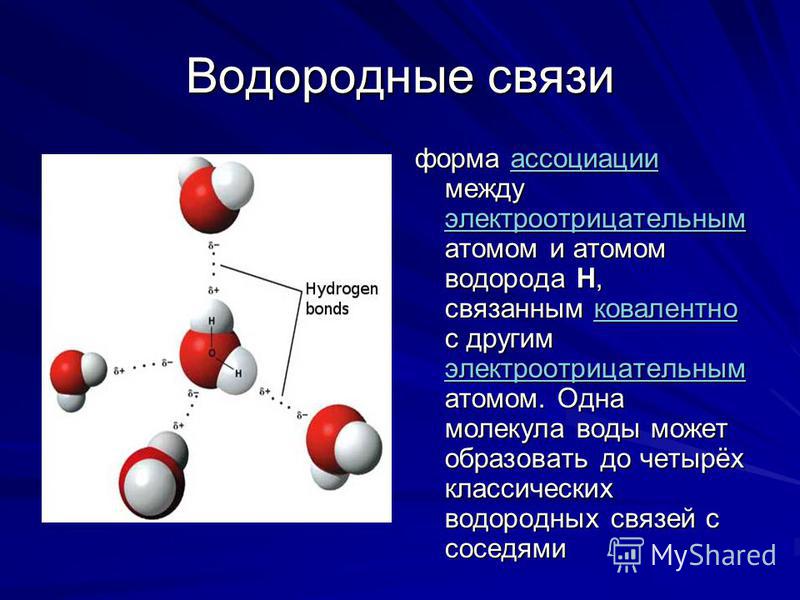 Из всех распространенных жидкостей вода — наиболее универсальный растворитель, жидкость с максимальными величинами поверхностного натяжения, диэлектрической постоянной, теплоты парообразования и наивысшей (после аммиака) теплотой плавления. В отличие от большинства веществ вода, замерзая при низком давлении, расширяется.
Из всех распространенных жидкостей вода — наиболее универсальный растворитель, жидкость с максимальными величинами поверхностного натяжения, диэлектрической постоянной, теплоты парообразования и наивысшей (после аммиака) теплотой плавления. В отличие от большинства веществ вода, замерзая при низком давлении, расширяется.
 Когда вода превратится в лед, все ее молекулы входят в более или менее жесткую структуру в виде незамкнутых цепочек, образующих кристаллы.
Когда вода превратится в лед, все ее молекулы входят в более или менее жесткую структуру в виде незамкнутых цепочек, образующих кристаллы.
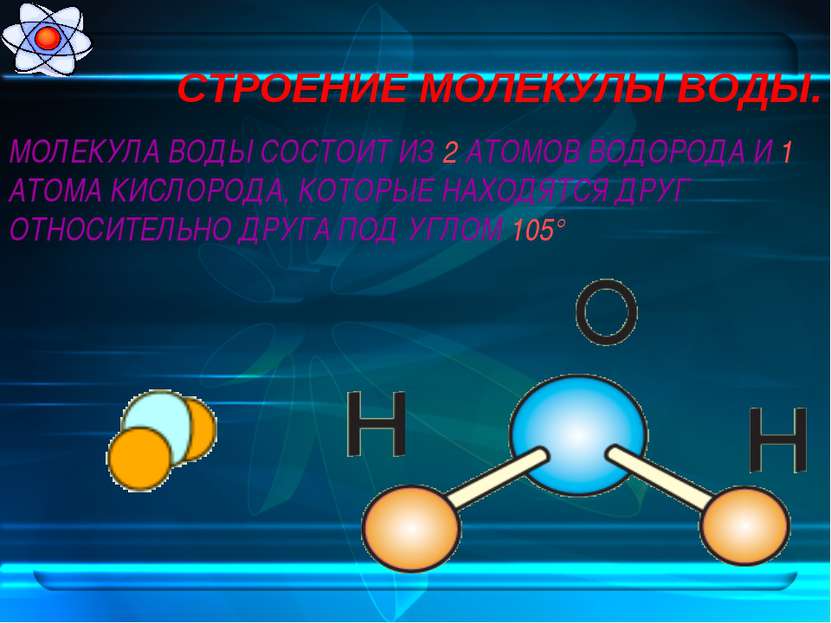 На основании этих и других фактов относительно изотопов путем анализа изотопного состава воды можно частично раскрыть историю некоторых природных вод. Так, содержание тяжелых изотопов в поверхностных водах свидетельствует о длительном испарении воды, которое происходит, например, в Мертвом море, Большом Соленом озере и в других бессточных водоемах. Повышенное содержание трития в подземных водах могло бы означать, что эти воды метеорного происхождения с большой скоростью циркуляции, потому что период полураспада этого изотопа всего лишь 12,4 лет. К сожалению, изотопный анализ слишком дорог и по этой причине не может быть широко применен в исследованиях природных вод. В табл. 3.1 приведены некоторые данные об изотопах водорода и кислорода.
На основании этих и других фактов относительно изотопов путем анализа изотопного состава воды можно частично раскрыть историю некоторых природных вод. Так, содержание тяжелых изотопов в поверхностных водах свидетельствует о длительном испарении воды, которое происходит, например, в Мертвом море, Большом Соленом озере и в других бессточных водоемах. Повышенное содержание трития в подземных водах могло бы означать, что эти воды метеорного происхождения с большой скоростью циркуляции, потому что период полураспада этого изотопа всего лишь 12,4 лет. К сожалению, изотопный анализ слишком дорог и по этой причине не может быть широко применен в исследованиях природных вод. В табл. 3.1 приведены некоторые данные об изотопах водорода и кислорода. Таким образом, ковалентные связи полярны, а атомы кислорода имеют небольшой отрицательный заряд (из-за наличия дополнительной доли электронов), в то время как атомы водорода слегка положительны (из-за дополнительных ненейтрализованных протонов).
Таким образом, ковалентные связи полярны, а атомы кислорода имеют небольшой отрицательный заряд (из-за наличия дополнительной доли электронов), в то время как атомы водорода слегка положительны (из-за дополнительных ненейтрализованных протонов). Жизнь, вероятно, зародилась в такой жидкой среде, и вода является основным компонентом живых существ (люди на 60 процентов состоят из воды). При комнатной температуре (от нуля до 100 градусов по Цельсию) вода находится в жидком состоянии.Это происходит из-за крошечных слабых водородных связей, которые в миллиардах удерживают молекулы воды вместе в течение небольших долей секунды.
Жизнь, вероятно, зародилась в такой жидкой среде, и вода является основным компонентом живых существ (люди на 60 процентов состоят из воды). При комнатной температуре (от нуля до 100 градусов по Цельсию) вода находится в жидком состоянии.Это происходит из-за крошечных слабых водородных связей, которые в миллиардах удерживают молекулы воды вместе в течение небольших долей секунды.
 Эти ковалентные связи неполярные .Электроны разделены между разными атомами
не делятся поровну, один атом получает больше обычных электронов и, таким образом, имеет слегка отрицательный заряд. Остальные атомы получают меньше, чем полную долю электронов, и поэтому заряжены слегка положительно.
Эти ковалентные связи неполярные .Электроны разделены между разными атомами
не делятся поровну, один атом получает больше обычных электронов и, таким образом, имеет слегка отрицательный заряд. Остальные атомы получают меньше, чем полную долю электронов, и поэтому заряжены слегка положительно.
 Кислород — это «электроотрицательный» или «любящий электроны» атом по сравнению с водородом.
Кислород — это «электроотрицательный» или «любящий электроны» атом по сравнению с водородом. Например, ледяные поплавки
потому что водородные связи удерживают молекулы воды
в твердом теле больше, чем в жидкости, где на молекулу приходится на одну водородную связь.
Уникальные физические свойства, включая высокую теплоту испарения, сильное поверхностное натяжение, высокую удельную теплоемкость и почти универсальные растворяющие свойства воды.
также связаны с водородными связями.Гидрофобный эффект или исключение соединений, содержащих
углерод и водород (неполярные соединения) — еще одно уникальное свойство воды, обусловленное водородными связями. Гидрофобный эффект особенно
важен в формировании клеточных мембран. Лучшее описание — сказать, что вода «сжимает» неполярные молекулы вместе.
Например, ледяные поплавки
потому что водородные связи удерживают молекулы воды
в твердом теле больше, чем в жидкости, где на молекулу приходится на одну водородную связь.
Уникальные физические свойства, включая высокую теплоту испарения, сильное поверхностное натяжение, высокую удельную теплоемкость и почти универсальные растворяющие свойства воды.
также связаны с водородными связями.Гидрофобный эффект или исключение соединений, содержащих
углерод и водород (неполярные соединения) — еще одно уникальное свойство воды, обусловленное водородными связями. Гидрофобный эффект особенно
важен в формировании клеточных мембран. Лучшее описание — сказать, что вода «сжимает» неполярные молекулы вместе.


Leave A Comment