Хай. Помогите установить соответствие Вопрос 6 § 7-10 Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
Хай. Помогите установить соответствие Вопрос 6 § 7-10 Химия 9 класс Рудзитис, Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Установите соответствие между приведенной схемой химической реакции и примером, иллюстрирующим ее.
ответы
1) — Б; 2) — В; 3) — Г.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее. ..)
..)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Контрольная работа по химии по теме «Неметаллы» 9 класс | Методическая разработка по химии (9 класс):
Вариант I
А-1. Схема строения атома химического элемента кремния
- +32 ) ) ) ) 3) +16 ) ) )
2 818 4 286
- +20 ) ) ) ) 4) +14 ) ) )
2 8 8 2 2 8 4
А-2. Положительную степень окисления хлор проявляет в соединении
Положительную степень окисления хлор проявляет в соединении
1) NaCl 2) PCl5 3) HCl 4) Cl2O7
А-3. Кислотные свойства высших оксидов химических элементов VА-группы периодической таблицы Д. И. Менделеева в ряду
N2O5→ P2O5 → As2O5 → Sb2O5
1) усиливаются 2) ослабевают 3) остаются неизменными 4) сначала усиливаются, затем ослабевают
А-4. Аммиак не вступает в химическую реакцию
1) с кислородом 3) с соляной кислотой
2) с водородом 4) с водой
А-5. Соединения серы с металлами называют
1) сульфатами 3) сульфидами
2) сульфитами 4) сернистыми металлами
А-6. В результате окисления аммиака в присутствии катализатора образуются
1) оксид азота(II) и вода 3) азот и вода
2) оксид азота(IV) и вода 4) оксид азота(II) и водород
А-7. Сокращённому ионному уравнению
Сокращённому ионному уравнению
CO2 + 2OH- = h3O + CO32-
соответствует химическая реакция
1) между соляной кислотой и карбонатом кальция
2) между гидроксидом натрия и оксидом углерода(IV)
3) между кремниевой кислотой и карбонатом калия
4) между карбонатом натрия и оксидом кремния(IV)
А-8. Реакцией ионного обмена не является реакция
1) NaBr + AgNO3 = NaNO3 + AgBr
2) (Nh5)2CO3 = 2Nh4 + CO2 + h3O
3) Nh5OH + HNO3 = Nh5NO3 + h3O
4) 2Nh5OH + CuCl2 = 2Nh5Cl + Cu(OH)2
В-1. Установите соответствие между исходными (исходным) и полученными веществами в уравнениях химических реакций, характеризующих свойства фосфорной кислоты.
1) h4PO4 + Ca → A. P2O5 + h3O
2) h4PO4 + Ca(OH)2 → Б. Ca3(PO4)2 + HCl
3) h4PO4 + CaCl2 → В. P + h3O
4) h4PO4 → Г. Ca3(PO4)2 + h3
Д. Ca3(PO4)2 + h3O
Ca3(PO4)2 + h3O
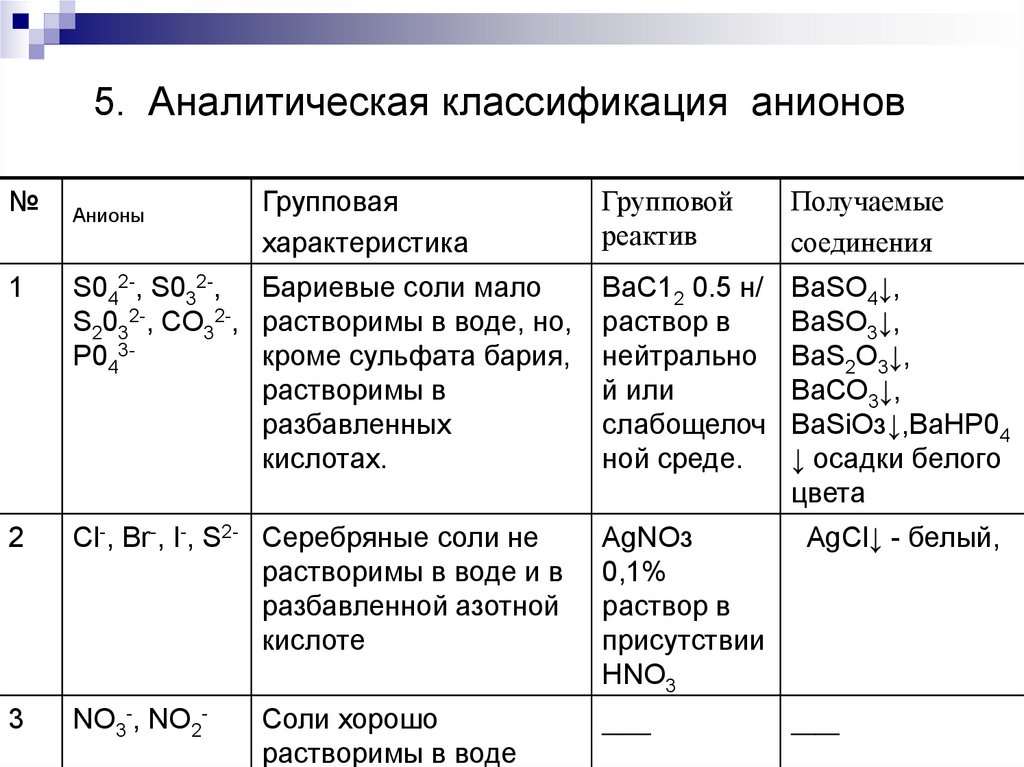
В-2. Установите соответствие между реактивом и группой веществ, которые можно обнаружить с помощью этого реактива.
1) растворимые соли бария | А. карбонат |
2) растворимые соли серебра | Б. сероводородная кислота и растворимые в воде сульфиды |
3) летучие кислоты (соляная, азотная, уксусная) | В. галогеноводородные кислоты и их соли, кроме фтористоводородной кислоты |
4) растворимые соли меди | Г. соли железа в степенях окисления +2 и +3 или соли свинца |
Д. серная кислота и её соли — сульфаты |
В-3. Установите соответствие между схемой перехода электронов в химической реакции и примером, иллюстрирующим её.
1) N0 →N+2 А. HNO3 + Cu → Cu(NO3)2 + NO + h3O
2) N-3→ N +2 Б. NO + O2 → NO2
3) N+5→N+2 В. N2 + O2→NO
4) N+5→N+4 Г. Nh4 + O2→ NO + h3O
Д. HNO3 + Cu → Cu(NO3)2 + NO2 + h3O
В-4. Концентрированная серная кислота является окислителем в химических реакциях
1) Cu + h3SO4 → CuSO4 + h3O + SO2
2) CuO + h3SO4 →CuSO4 + h3O
3) NaCl + h3SO4→ Na2SO4 + HCl
4) C + h3SO4→ CO2 + h3O + SO2
5) C12h32O11 + h3SO4→ CO2 + h3O + SO2
В-5. Напишите полные и сокращённые ионные уравнения возможных химических реакций, в которых оксид углерода(IV) будет взаимодействовать с гидроксидом лития, гидроксидом железа(III), оксидом кальция, водой, хлоридом меди(II).
С-1. Какая из приведённых схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций.
1) N0 +3е → N-3
2) N-3 -5е → N+2
С-2. В приведённой схеме напишите над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения.
В приведённой схеме напишите над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения.
NaCl → HCl →ZnCl2 → AgCl↓
Вариант II
А-1. Схема строения иона углерода со степенью окисления –4
- +14 ) ) ) 3) +6 ) )
2 8 4 2 8
- +6 ) ) 4) +14 ) ) )
2 4 2 8 8
А-2. Положительную степень окисления кислород проявляет в соединении
1) N2O 2) СO 3) OF2 4) Al2O3
А-3. В ряду SiO2 → P2O5→ SO3→ Cl2O7 с увеличением относительной молекулярной массы оксидов
1) усиливаются основные свойства веществ
2) усиливаются кислотные свойства веществ
3) усиливаются амфотерные свойства веществ
4) свойства веществ практически не изменяются
А-4. Сера не вступает в химическую реакцию
1) с водородом 3) с металлами
2) с кислородом 4) с водой
А-5.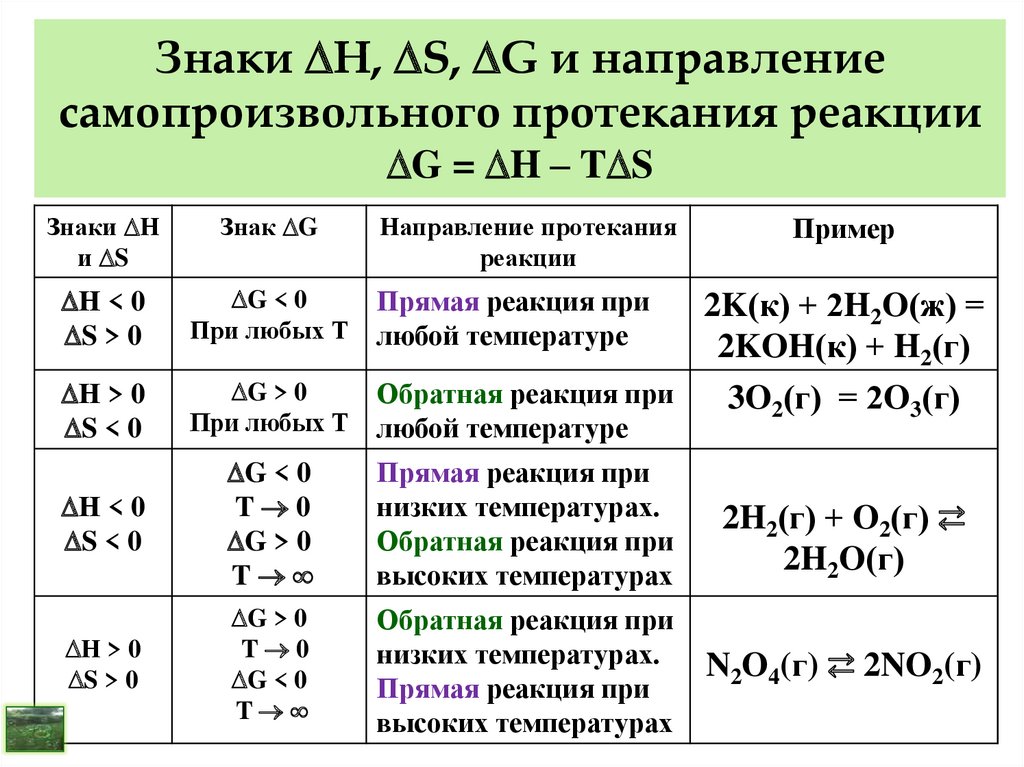 Соединения азота с металлами называют
Соединения азота с металлами называют
1) нитратами 3) нитридами
2) нитритами 4) азотистыми металлами
А-6. В результате полного сгорания метана образуются
1) углекислый газ и водород 3) углекислый газ и вода
2) углерод (сажа) и вода 4) угарный газ и вода
А-7. Сокращённому ионному уравнению
PO43- + 3Ag+ = Ag3PO4
соответствует химическая реакция
1) между фосфатом натрия и хлоридом серебра
2) между фосфатом натрия и нитратом серебра
3) между фосфатом натрия и оксидом серебра
4) между фосфатом натрия и серебром
А-8. Из приведённых уравнений химических реакций реакцией обмена является 1) (Nh5)2CO3 = 2Nh4 + CO2 + h3O
2) h4PO4 + 3NaOH = Na3PO4 + 3h3O
3) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
4) 4P + 5O2 = 2P2O5
В-1. Установите соответствие между исходными и полученными веществами в уравнениях химических реакций, характеризующих свойства аммиака.
1) Nh4 + h3O→ A. N2 + h3O
2) Nh4 + h3SO4→ Б. NO2 + h3O
3) Nh4 + O2(недостаток)→ В. Nh5HSO4
4) Nh4 + O2(избыток)→ Г. NO + h3O
Д. Nh5OH
В-2. Установите соответствие между ионом и способом его обнаружения в растворах
1) I– | А. при добавлении щёлочи образуется газ с характерным запахом |
2) SO42– | Б. при добавлении нитрата серебра образуется жёлтый творожистый осадок, нерастворимый в азотной кислоте |
3) NO3 – | В. при нагревании с медью и концентрированной серной кислотой образуется голубой раствор и выделяется бурый газ |
4) Nh5 + | Г. |
. В-3. Установите соответствие между схемой перехода электронов в химической реакции и примером, иллюстрирующим её.
1) S0 → S –2 A. SO2 + h3S→ S + h3O
2) S–2 → S+4 Б. S + O2 →SO2
3) S+4 → S 0 В. S + h3 →h3S
4) S+4 →S+6 Г. h3S + O2 →SO2 + h3O
Д. SO2 + O2 →SO3
В-4. Сероводород проявляет свойства восстановителя в химических реакциях
1) h3S + O2 → S + h3O
2) h3S + NaOH → Na2S + h3O
3) h3S + SO2 → S + h3O
4) h3S + Pb(NO3)2 → PbS + HNO3
5) h3S + O2 → SO2 + h3O
В-5. Напишите полные и сокращённые ионные уравнения химических реакций в тех случаях, где возможно взаимодействие между следующими парами веществ: 1) SiO2 + O2
2) (Nh5)2CO3 + HNO3
3) SiO2 + h3O
4) Ca(OH)2 + CO2
5) SiO2 + HCl
С-1. Какая из приведённых схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций.
Какая из приведённых схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций.
1) N+5 +e → N+4
2) N0 -2e → N+2
С-2. В приведённой схеме напишите над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения.
Na2CO3 →NaHCO3→Na2CO3→CaCO3
Вариант 1
А1 – 4
А2 – 4
А3 – 2
А4 – 2
А5 – 3
А6 – 1
А7 – 2
А8 – 2
В1 – 1-Г, 2-Д, 3-Б, 4-А
В2 – 1-Д, 2-В, 3-А, 4-Б
В3 – 3-А, 1-В, 2-Г, 4-Д
В4 – 1,4,5
В5 – CO2+2LiOH = Li2CO3+h3O
CO2+2Li + 2OH = 2Li + CO3 + h3O
CO2+2OH = CO3+h3O
CO2+Fe(OH)3 =/
CO2+CaO = CaCO3
CO2+h3O = h3CO3
CO2+CuCI2 = /
C1 – 2 . 4Nh4+5O2 = 4NO + 6h3O
C2 – NaCI → HCI → ZnCI2 → AgCI↓
h3SO4 ZnO AgNO3
Вариант 2
А1 -3
А2 – 3
А3 – 2
А4 – 4
А5 – 3
А6 – 3
А7 – 2
А8 – 2
В1 – 1-д, 2-в, 3-а, 4-г
В2 – 1-б, 2-г, 3-в, 4-а
В3 – 3-а, 1-в, 2-г, 4-д
В4 – 1,3,5
В5 – SiO2+O2 = /
(Nh5)2CO3 + 2HNO3 = 2Nh5NO3 + CO2 + h3O
2Nh5 + CO3 + 2H + 2NO3 = 2Nh5 + 2NO3 + CO2 + h3O
CO3 + 2H = CO2 + h3O
SiO2+h3O =/
Ca(OH)2 + CO2 = CаCO3 + h3O
SiO2 + HCI =/
C1 – 2. N2 + O2 = 2NO
N2 + O2 = 2NO
C2 – Na2CO3 → NaHCO3 → Na2CO3 → CaCO3
CO2+h3O NaOH CaCI2
Стехиометрия и уравновешивающие реакции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 240
Стехиометрия — это раздел химии, который включает использование соотношений между реагентами и/или продуктами в химической реакции для определения желаемых количественных данных. По-гречески стойхеин означает элемент, а метрон означает меру, поэтому стехиометрия в буквальном переводе означает меру элементов. Чтобы использовать стехиометрию для выполнения расчетов химических реакций, важно сначала понять отношения, которые существуют между продуктами и реагентами, и почему они существуют, что требует понимания того, как сбалансировать реакции.
Балансировка
В химии химические реакции часто записывают в виде уравнений с использованием химических символов. Реагенты отображаются в левой части уравнения, а продукты — в правой, с разделением одинарной или двойной стрелкой, обозначающей направление реакции. Значение одинарной и двойной стрелки важно при обсуждении констант растворимости, но мы не будем вдаваться в подробности в этом модуле. Чтобы сбалансировать уравнение, необходимо, чтобы в левой части уравнения было такое же количество атомов, как и в правой. Это можно сделать, подняв коэффициенты.
Реагенты для продуктов
Химическое уравнение похоже на рецепт реакции, поэтому оно отображает все ингредиенты или условия химической реакции. Он включает элементы, молекулы или ионы в реагентах и продуктах, а также их состояния и пропорцию того, сколько каждой частицы реагирует или образуется по отношению друг к другу через стехиометрический коэффициент. Следующее уравнение демонстрирует типичный формат химического уравнения:
\[\ce{2 Na(s) + 2HCl(aq) \rightarrow 2NaCl(aq) + h3(g)} \nonumber\]
В приведенном выше уравнении элементы, участвующие в реакции, представлены их химическими символами. Основываясь на Законе сохранения массы, который гласит, что материя не создается и не разрушается в результате химической реакции, каждая химическая реакция содержит одни и те же элементы в своих реагентах и продуктах, хотя элементы, с которыми они соединяются, часто меняются в ходе реакции. В этой реакции натрий (\(Na\)), водород (\(H\)) и хлорид (\(Cl\)) являются элементами, присутствующими в обоих реагентах, поэтому на основании закона сохранения массы они также присутствуют на стороне произведения уравнений. Отображение каждого элемента важно при использовании химического уравнения для преобразования между элементами.
Основываясь на Законе сохранения массы, который гласит, что материя не создается и не разрушается в результате химической реакции, каждая химическая реакция содержит одни и те же элементы в своих реагентах и продуктах, хотя элементы, с которыми они соединяются, часто меняются в ходе реакции. В этой реакции натрий (\(Na\)), водород (\(H\)) и хлорид (\(Cl\)) являются элементами, присутствующими в обоих реагентах, поэтому на основании закона сохранения массы они также присутствуют на стороне произведения уравнений. Отображение каждого элемента важно при использовании химического уравнения для преобразования между элементами.
Стехиометрические коэффициенты
В сбалансированной реакции обе части уравнения содержат одинаковое количество элементов. Стехиометрический коэффициент — это число, написанное перед атомами, ионами и молекулами в химической реакции, чтобы сбалансировать количество каждого элемента как в реагенте, так и в продукте уравнения. Хотя стехиометрические коэффициенты могут быть дробными, часто используются целые числа, и они часто предпочтительнее.
\[\ce{2 Na(s) + 2HCl(aq) \rightarrow 2NaCl(aq) + h3(g)} \nonumber\]
мы можем определить, что 2 моля \(HCl\) будут реагировать с 2 моля \(Na_{(s)}\) с образованием 2 молей \(NaCl_{(aq)}\) и 1 моля \(H_{2(g)}\). Если мы знаем, сколько молей \(Na\) вступило в реакцию, мы можем использовать отношение 2 молей \(NaCl\) к 2 молям Na, чтобы определить, сколько молей \(NaCl\) было произведено, либо мы можем использовать отношение 1 моля \(H_2\) к 2 молям \(Na\) для преобразования в \(NaCl\). Это известно как фактор коэффициента. Сбалансированное уравнение позволяет преобразовать информацию об изменении одного реагента или продукта в количественные данные о другом реагенте или продукте. Понимание этого важно для решения стехиометрических задач.
Пример 1
Гидроксид свинца (IV) и серная кислота реагируют, как показано ниже. Уравновесить реакцию.
Уравновесить реакцию.
\[\ce{Pb(OH)4 + h3SO4 \rightarrow Pb(SO4)2 +h3O} \номер\]
Раствор
Начните с подсчета количества атомов каждого элемента.
НЕСБАЛАНСИРОВАННЫЙ
Элемент | Реагент (число атомов) | Продукт (число атомов) |
|---|---|---|
Пб | 1 | |
О | 8 | 9 |
Х | 6 | 2 |
С | 1 | 2 |
Реакция не сбалансирована; реакция имеет 16 атомов реагентов и только 14 атомов продукта и не подчиняется принципу сохранения массы. Чтобы сделать уравнение сбалансированным, необходимо добавить стехиометрические коэффициенты. В этом примере на стороне реагента присутствует только один атом серы, поэтому перед \(H_2SO_4\) следует добавить коэффициент 2, чтобы получить одинаковое количество серы в обеих частях уравнения. Так как на стороне реагента 12 кислорода и только 9со стороны продукта следует добавить коэффициент 4 перед \(H_2O\), если имеется дефицит кислорода. Подсчитайте количество элементов, присутствующих в настоящее время по обе стороны уравнения. Поскольку числа одинаковы, уравнение теперь сбалансировано.
Чтобы сделать уравнение сбалансированным, необходимо добавить стехиометрические коэффициенты. В этом примере на стороне реагента присутствует только один атом серы, поэтому перед \(H_2SO_4\) следует добавить коэффициент 2, чтобы получить одинаковое количество серы в обеих частях уравнения. Так как на стороне реагента 12 кислорода и только 9со стороны продукта следует добавить коэффициент 4 перед \(H_2O\), если имеется дефицит кислорода. Подсчитайте количество элементов, присутствующих в настоящее время по обе стороны уравнения. Поскольку числа одинаковы, уравнение теперь сбалансировано.
\[\ce{ Pb(OH)4 + 2 h3SO4 \rightarrow Pb(SO4)2 + 4h3O} \номер\]
СБАЛАНСИРОВАННЫЙ
Элемент | Реагент (число атомов) | Продукт (число атомов) |
|---|---|---|
Пб | 1 | 1 |
О | 12 | 12 |
Х | 8 | |
С | 2 | 2 |
Уравновешивающие реакции включают нахождение наименьших общих кратных между числом элементов, присутствующих в обеих частях уравнения. Как правило, при применении коэффициентов добавляйте коэффициенты к молекулам или непарным элементам в последнюю очередь.
Как правило, при применении коэффициентов добавляйте коэффициенты к молекулам или непарным элементам в последнюю очередь.
Сбалансированное уравнение в конечном счете должно удовлетворять двум условиям.
- Номера каждого элемента в левой и правой частях уравнения должны быть равными.
- Заряды в обеих частях уравнения должны быть равными. Особенно важно обращать внимание на заряд при балансировке окислительно-восстановительных реакций.
Стехиометрия и сбалансированные уравнения
В стехиометрии сбалансированные уравнения позволяют сравнивать различные элементы с помощью стехиометрического фактора , который обсуждался ранее. Это молярное соотношение между двумя факторами в химической реакции, определяемое через соотношение стехиометрических коэффициентов. Вот реальный пример, показывающий, как полезны стехиометрические факторы.
Пример 2
Имеется 12 приглашений на вечеринку и 20 марок. Каждое приглашение на вечеринку требует отправки 2 марок. Сколько приглашений на вечеринку можно отправить?
Сколько приглашений на вечеринку можно отправить?
Решение
Уравнение для этого можно записать как
\[\ce{I + 2S \rightarrow IS2}\nonumber\]
где
- \(I\) представляет приглашения,
- \(S\) представляет марки, а
- \(IS_2\) представляет собой отправленные партийные приглашения, состоящие из одного приглашения и двух штампов.
Исходя из этого, имеем соотношение 2 штампа к 1 отправленному приглашению, основанное на сбалансированном уравнении.
Приглашения Марки Приглашения на вечеринку отправлены
В этом примере все реагенты (марки и приглашения) израсходованы? Нет, и это обычно происходит с химическими реакциями. Часто наблюдается избыток одного из реагентов. Лимитирующий реагент, тот, который заканчивается первым, препятствует продолжению реакции и определяет максимальное количество продукта, которое может образоваться.
Пример 3
Какой реагент является лимитирующим в этом примере?
Решение
Марки, потому что их хватило только на рассылку приглашений, тогда как приглашений хватило на 12 полных приглашений на вечеринку.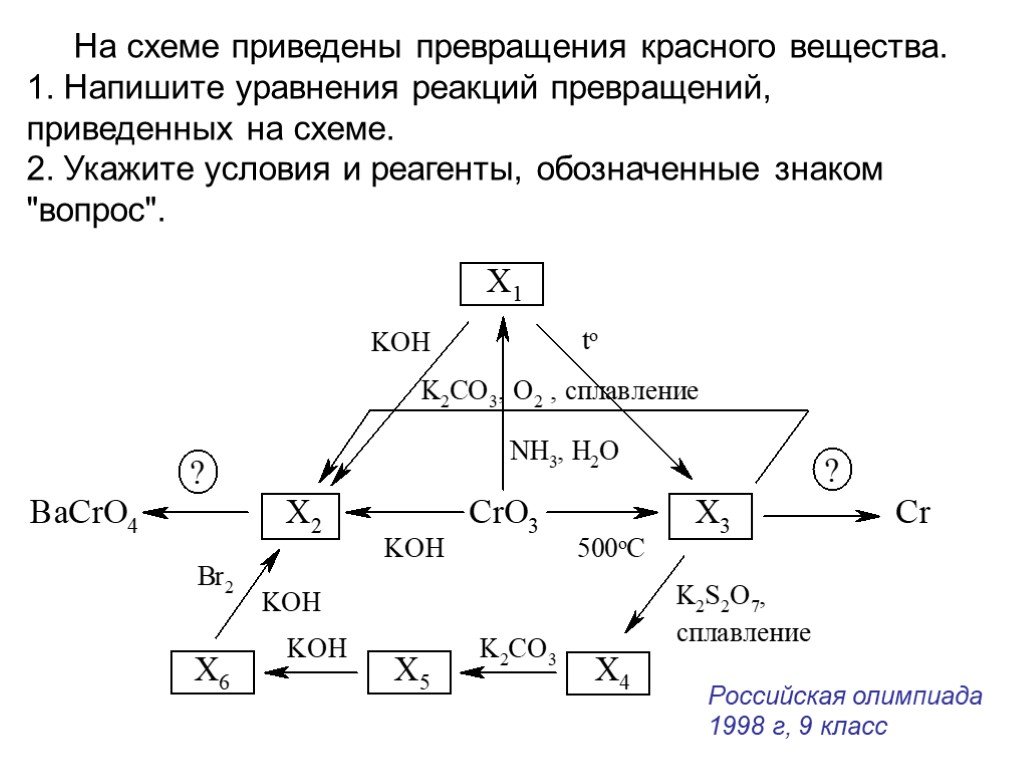 Помимо простого взгляда на проблему, ее можно решить, используя стехиометрические коэффициенты.
Помимо простого взгляда на проблему, ее можно решить, используя стехиометрические коэффициенты.
12 I x (1IS 2 /1I) = 12 IS 2 возможно
20 S x (1IS 2 /2S) = 10 IS 2 при отсутствии ограничения возможно
8 90 соотношение всех реагентов, вызывающее их одновременное исчерпание, известно как стехиометрические пропорции .
Типы реакций
Существует 6 основных типов реакций.
- Горение : Горение – это образование CO 2 и H 2 O в результате реакции химического вещества и O 2
- Комбинация (синтез) : Комбинация представляет собой добавление 2 или более простых реагентов с образованием сложного продукта.
- Разложение: Разложение — это разложение сложных реагентов на более простые продукты.
- Одиночное смещение : Однократное смещение — это когда элемент одного реагента переключается с элементом другого с образованием двух новых реагентов.

- Двойное смещение: Двойное смещение — это когда два элемента одного реагента меняются местами с двумя элементами другого, образуя два новых реагента.
- Кислотно-основные: Кислотно-основные реакции – это когда два реагента образуют соли и воду.
Молярная масса
Прежде чем применять стехиометрические коэффициенты к химическим уравнениям, вам необходимо понять молекулярную массу. Молярная масса — это полезное химическое соотношение между массой и молями. Атомная масса каждого отдельного элемента, указанная в периодической таблице, установила это соотношение для атомов или ионов. Для соединений или молекул необходимо взять сумму атомной массы, умноженной на число каждого атома, чтобы определить молярную массу
Пример 4
Какова молярная масса H 2 О?
Раствор
\[\text{Молярная масса} = 2 \times (1,00794\; г/моль) + 1 \times (15,9994\; г/моль) = 18,01528\; г/моль]
Используя молярную массу и коэффициенты, можно преобразовать массу реагентов в массу продуктов или наоборот.
Пример 5: Горение пропана
Пропан (\(\ce{C_3H_8}\)) горит в этой реакции:
\[\ce{C_3H_8 + 5O_2 \rightarrow 4H_2O + 3CO_2} \nonumber\]
Если Сгорело 200 г пропана, сколько г \(H_2O\) образовалось?
Решение
Шаги для получения этого ответа: Так как вы не можете вычислить из граммов реагента в граммы продуктов, вы должны преобразовать граммы \(C_3H_8\) в моли \(C_3H_8\), а затем из молей \( C_3H_8\) в моли \(H_2O\). Затем переведите моли \(H_2O\) в граммы \(H_2O\).
- Этап 1: 200 г \(C_3H_8\) равно 4,54 моль \(C_3H_8\) .
- Шаг 2: Поскольку соотношение \(H_2O\) к \(C_3H_8\) составляет 4:1, на каждые 4,54 моль \(C_3H_8\) приходится 18,18 моль \(H_2O\).
- Шаг 3: Переведите 18,18 моль \(H_2O\) в г \(H_2O\). 18,18 моль \(H_2O\) равно 327,27 г \(H_2O\).
Варианты стехиометрических уравнений
Почти каждое количественное отношение можно преобразовать в отношение, которое может быть полезно при анализе данных.
Плотность
Плотность (\(\rho\)) рассчитывается как масса/объем. Это соотношение может быть полезно при определении объема раствора по заданной массе или при нахождении массы по заданному объему. В последнем случае будет использоваться обратная зависимость.
Объем x (масса/объем) = масса
Масса x (объем/масса) = объем
Масса в процентах
Проценты также устанавливают взаимосвязь. Процент массы показывает, сколько граммов смеси приходится на определенный элемент или молекулу. Процент X% означает, что из каждых 100 граммов смеси X граммов приходится на указанный элемент или соединение. Это полезно при определении массы желаемого вещества в молекуле.
Пример 6
Вещество содержит 5% углерода по массе. Если общая масса вещества 10 граммов, какова масса углерода в пробе? Сколько молей углерода?
Раствор
10 г образца x (5 г углерода/100 г образца) = 0,5 г углерода
0,5 г углерода x (1 моль углерода/12,011 г углерода) = 0,0416 моль углерода моль/л) устанавливает связь между молями и литрами. Зная объем и молярность, можно рассчитать моль или использовать моли и молярность для расчета объема. Это полезно в химических уравнениях и разбавлениях.
Зная объем и молярность, можно рассчитать моль или использовать моли и молярность для расчета объема. Это полезно в химических уравнениях и разбавлениях.
Пример 7
Сколько 5 М исходного раствора необходимо для приготовления 100 мл 2 М раствора?
Раствор
100 мл разбавленного раствора (1 л/1000 мл)(2 моль/1 л раствора)(1 л исходного раствора/5 моль раствора)(1000 мл исходного раствора/1 л исходного раствора) = 40 мл исходного раствора решение.
Эти отношения молярности, плотности и массовых процентов полезны в следующих сложных примерах.
Определение эмпирических формул
Эмпирическую формулу можно определить с помощью химической стехиометрии, определяя, какие элементы присутствуют в молекуле и в каком соотношении. Соотношение элементов определяется путем сравнения количества молей каждого присутствующего элемента.
Пример 8: Горение органических молекул
1000 г органической молекулы полностью сгорает в присутствии избытка кислорода. Получается 0,0333 моль СО 2 и 0,599 г Н 2 О. Какова эмпирическая формула органической молекулы?
Получается 0,0333 моль СО 2 и 0,599 г Н 2 О. Какова эмпирическая формула органической молекулы?
Раствор
Это реакция горения. Задача требует, чтобы вы знали, что органические молекулы состоят из некоторой комбинации элементов углерода, водорода и кислорода. Имея это в виду, напишите химическое уравнение, заменив неизвестные числа переменными. Не беспокойтесь о коэффициентах здесь.
\[ \ce{C_xH_yO_z(g) + O_2(g) \rightarrow CO_2(g) + H_2O(g)} \nonumber\]
Так как все моли C и H в CO 2 и H 2 O соответственно должны быть получены из 1-граммового образца неизвестного вещества, начните с подсчета количества молей каждого элемента, присутствующего в неизвестном образце.
0,0333 моль CO 2 (1 моль C/ 1 моль CO 2 ) = 0,0333 моль C в неизвестном0294 2 O)(2 моль H/ 1 моль H 2 O) = 0,0665 моль H в неизвестном
Рассчитайте количество молей кислорода, взяв сумму молей кислорода в CO 2 и H 2 O Это даст вам количество молей как от неизвестной органической молекулы, так и от O 2 , поэтому вы должны вычесть моли кислорода, перенесенного из O 2 .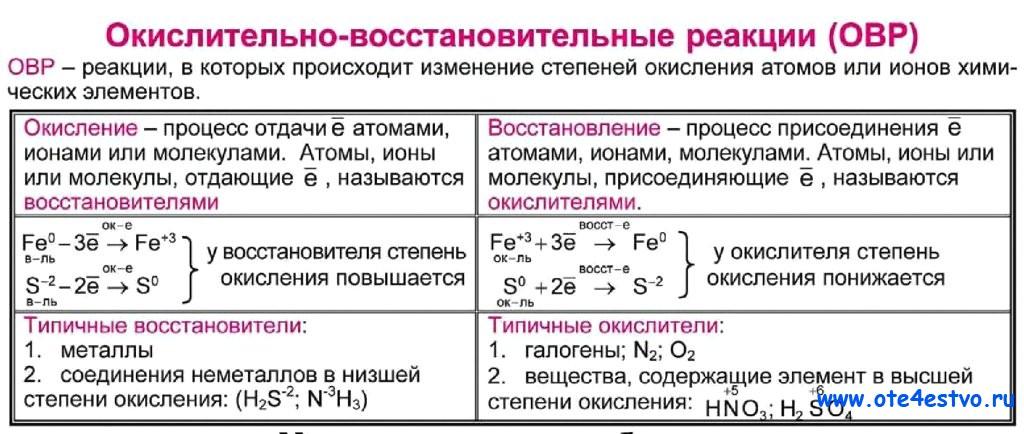
Моль кислорода в CO 2 :
0,0333 моль CO 2 (2 моль O/1 моль CO 2 ) = 0,0666 моль O
Моль кислорода в H 2 O:
0,599 г H 2 O (1 моль H 2 H 902 г 902 г 908,95 O/ O/ 2 О) (1 моль О /1моль H 2 O) = 0,0332 моль O
Используя закон сохранения, мы знаем, что масса до реакции должна равняться массе после реакции. При этом мы можем использовать разницу конечной массы продуктов и начальной массы неизвестной органической молекулы для определения массы O 2 реагент.
0,333 моль CO 2 (44,0098 г CO 2 / 1 моль CO 2 ) = 1,466 г CO 2
9 9 + 9029,466 г CO 29029. H 2 O — 1000 г неизвестного органического вещества = 1,065 г O 2
Моль кислорода в O 2
1,065 г O 2 (1 моль O 2 909 5 2 / 8 31,998 )(2моль О/1моль О 2 ) = 0,0666 моль O
Моль кислорода в неизвестном
(0,0666 моль O + 0,0332 моль O) — 0,0666 моль O = 0,0332 моль O
Рассчитайте молярное соотношение C, H и O в неизвестном веществе и разделите на наименьшее число.
(1/0,0332)(0,0333 моль C : 0,0665 моль H : 0,0332 моль O) => 1 моль C: 2 моль H: 1 моль O
Определение молекулярных формул
Чтобы определить молекулярную формулу, сначала определите эмпирическую формулу соединения, как показано в разделе выше, а затем экспериментально определите молекулярную массу. Далее разделите молекулярную массу на молярную массу эмпирической формулы (рассчитывается путем нахождения суммы полных атомных масс всех элементов в эмпирической формуле). Умножьте индексы молекулярной формулы на этот ответ, чтобы получить молекулярную формулу.
Пример 9
В приведенном выше примере было определено, что неизвестная молекула имеет эмпирическую формулу CH 2 O.
1. Найдите молярную массу эмпирической формулы CH 2 O.
12,011 г C + (1,008 г H) * (2 H) + 15,999 г O = 30,026 г/моль CH 2 O
2. Экспериментально определить молекулярную массу. Для нашего соединения она составляет 120,056 г/моль.
3. Разделите экспериментально определенную молекулярную массу на массу эмпирической формулы.
(120,056 г/моль) / (30,026 г/моль) = 3,9984
4. Поскольку 3,9984 очень близко к четырем, можно безопасно округлить и предположить, что в экспериментально определенной молекулярной массе была небольшая ошибка . Если ответ не близок к целому числу, то имела место либо ошибка в расчете эмпирической формулы, либо большая ошибка в определении молекулярной массы.
5. Умножьте соотношение из шага 4 на нижние индексы эмпирической формулы, чтобы получить молекулярную формулу.
СН 2 О * 4 = ? 1 * 4 = 8 0028
6. Проверьте свой результат, рассчитав молярную массу молекулярной формулы и сравнив ее с экспериментально определенной массой.
молярная масса C 4 H 8 O 4 = 120,104 г/моль
экспериментально определенная масса = 120,056 г/моль
% ошибка = | теоретический — экспериментальный | / теоретическое * 100%
% ошибка = | 120,104 г/моль — 120,056 г/моль | / 120,104 г/моль * 100 %
% погрешность = 0,040 %
Пример 10: Комплексная стехиометрическая задача
Сварщик-любитель плавит два металла, чтобы получить сплав, состоящий из 45 % меди и 55 % железа (II). по массе. Плотность сплава 3,15 г/л. Один литр сплава полностью заполняет форму объемом 1000 см 3 . Он случайно ломает 1,203 см 3 часть однородной смеси и выметает ее наружу, где она годами вступает в реакцию с кислотными дождями. Если предположить, что кислота реагирует со всем железом(II), а не с медью, сколько граммов H 2 (g) выбрасывается в атмосферу из-за невнимательности любителя? (Обратите внимание, что ситуация вымышленная.)
по массе. Плотность сплава 3,15 г/л. Один литр сплава полностью заполняет форму объемом 1000 см 3 . Он случайно ломает 1,203 см 3 часть однородной смеси и выметает ее наружу, где она годами вступает в реакцию с кислотными дождями. Если предположить, что кислота реагирует со всем железом(II), а не с медью, сколько граммов H 2 (g) выбрасывается в атмосферу из-за невнимательности любителя? (Обратите внимание, что ситуация вымышленная.)
Решение
Шаг 1 : Напишите сбалансированное уравнение после определения продуктов и реагентов. В этой ситуации, поскольку мы предполагаем, что медь не вступает в реакцию, реагентами являются только H 9{2+}(aq)} \nonumber\]
Шаг 2: Запишите всю предоставленную информацию
Плотность сплава = (3,15 г сплава/1 л сплава)
x грамм сплава = 45% меди = ( 45 г Cu(s)/100 г сплава)
x грамм сплава = 55% железа(II) = (55 г Fe(s)/100 г сплава)
1 литр сплава = 1000 см см 3 сплав
Шаг 3: Ответьте на заданный вопрос. Вопрос спрашивает, сколько h3(g) было произведено. Ожидается, что вы определите количество образовавшегося продукта.
Вопрос спрашивает, сколько h3(g) было произведено. Ожидается, что вы определите количество образовавшегося продукта.
Шаг 4: Начните с соединения, о котором вы знаете больше всего, и используйте заданные соотношения, чтобы преобразовать его в желаемое соединение.
Преобразуйте заданное количество реагента сплава в число молей прореагировавшего Fe(s).
1,203 см 3 сплав (1 л сплава/1000 см 3 сплав) (3,15 г сплава/1 л сплава) (55 г Fe(s)/100 г сплава) (1 моль Fe(s)/55,8 г Fe(s)) =3,74 x 10 -5 моль Fe(s)
Убедитесь, что все единицы сокращаются, чтобы получить моли \(\ce{Fe(s)}\). Приведенное выше преобразование включает использование нескольких стехиометрических соотношений плотности, процентной массы и молярной массы.
Теперь необходимо использовать сбалансированное уравнение для преобразования молей Fe(s) в моли H 2 (г). Помните, что коэффициенты сбалансированного уравнения определяют стехиометрический коэффициент или молярное соотношение реагентов и продуктов.
3,74 x 10 -5 моль Fe (т) (1 моль H 2 (г)/1 моль Fe(s)) = 3,74 x 10 -5 моль H 2 (г)
3 9 Стадия 5: Проверить единицыВопрос спрашивает, сколько граммов H 2 (г), поэтому моли H 2 (г) все еще должны быть преобразованы в граммы с использованием молярной массы H 2 (г). Поскольку в каждом H 2 содержится два H, его молярная масса в два раза больше, чем у одного атома H.
молярная масса = 2(1,00794 г/моль) = 2,01588 г/моль (г)) = 7,53 x 10 -5 г H 2 (г) освобожден
{2+}_{(водн.)} + Ag_{(s)}\)
2) Соляная кислота реагирует с твердым куском алюминия с образованием газообразного водорода и ионов алюминия. Напишите сбалансированное химическое уравнение этой реакции.
3) Учитывая исходный раствор 10,1 М, сколько мл необходимо добавить к воде, чтобы получить 200 мл раствора 5 М?
4) Если 0,502 г газообразного метана реагируют с 0,27 г кислорода с образованием углекислого газа и воды, какой реагент является лимитирующим и сколько молей воды образуется? Ниже приведено несбалансированное уравнение.
\[\ce{Ch5(г) + O2(г) \rightarrow CO2(г) + h3O(ж)} \номер\]
5) Образец органического соединения массой 0,777 г полностью сгорает. Он производит 1,42 г CO 2 и 0,388 г H 2 O. Зная, что все атомы углерода и водорода в CO 2 и H 2 O происходят из образца 0,777 г, какова эмпирическая формула органическое соединение?
Веб-ссылки для получения дополнительной информации
- 1. См. http://chemistry.about.com/cs/stoich…/aa042903a.htm как внешний ресурс о том, как сбалансировать химические реакции.
- 2. Обратитесь к http://www.learnchem.net/tutorials/stoich.shtml как к внешнему ресурсу по стехиометрии.
Ссылки
- Т. Э. Браун, Х. Э. ЛеМэй, Б. Берстен, К. Мерфи. Химия: Центральная наука. Прентис Холл, 8 января 2008 г.
- Дж. К. Коц П.М. Трейчел, Дж. Таунсенд. Химия и химическая реактивность. Брукс Коул, 7 февраля 2008 г.
- Петруччи, Харвуд, Сельдь, Мадура.
 Общие принципы химии и современные приложения. Прентис Холл. Нью-Джерси, 2007.
Общие принципы химии и современные приложения. Прентис Холл. Нью-Джерси, 2007.
Авторы и ссылки
- Джозеф Неймех (UCD), Марк Тай (DVC)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Кислотно-щелочной
- Балансировка
- Уравновешивающие реакции
- химическая реакция
- химических символов
- Комбинация
- сжигание
- разложение
- плотность
- Двойной рабочий объем
- элемента
- Эмпирические формулы
- закон сохранения массы
- масса
- метрон
- Молекулярная формула
- Массовые проценты
- Продукты
- Реагенты
- Одинарный рабочий объем
- стехиометрический коэффициент
- стехиометрия
- стойкихейн
- синтез
- том
14.
 6: Механизмы реакции — Химия LibreTexts
6: Механизмы реакции — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25180
- Анонимный
- LibreTexts
Цели обучения
- Определить отдельные этапы простой реакции.
Одной из основных причин изучения химической кинетики является использование измерений макроскопических свойств системы, таких как скорость изменения концентрации реагентов или продуктов во времени, для обнаружения последовательности событий, происходящих на молекулярном уровне. во время реакции. Это молекулярное описание является механизмом реакции; он описывает, как отдельные атомы, ионы или молекулы взаимодействуют с образованием конкретных продуктов. Ступенчатые изменения в совокупности называются механизмом реакции.
Ступенчатые изменения в совокупности называются механизмом реакции.
Например, в двигателе внутреннего сгорания изооктан реагирует с кислородом с образованием углекислого газа и воды:
\[\ce{2C8h28(л) + 25O2(г) -> 16CO2(г) + 18h3O(г)} \label{14.6.1} \]
Чтобы эта реакция протекала в одну стадию, 25 молекул дикислорода и 2 молекулы изооктана должны столкнуться одновременно и превратиться в 34 молекулы продукта, что очень маловероятно. Более вероятно, что сложная серия реакций протекает поэтапно. Каждая отдельная реакция, называемая Элементарная реакция включает один, два или (реже) три атома, молекулы или ионы. Общая последовательность элементарных реакций есть механизм реакции. Сумма отдельных стадий или элементарных реакций в механизме должна давать сбалансированное химическое уравнение для общей реакции.
Общая последовательность элементарных реакций есть механизм реакции.
Молекулярность и этап определения скорости
Чтобы продемонстрировать, как анализ элементарных реакций помогает нам определить общий механизм реакции, мы рассмотрим гораздо более простую реакцию монооксида углерода с диоксидом азота.
\[\ce{NO2(г) + CO(г) -> NO(г) + CO2(г)} \label{14.6.2} \]
Из сбалансированного химического уравнения можно ожидать реакции происходить при столкновении одной молекулы \(\ce{NO2}\) с молекулой \(\ce{CO}\), что приводит к переносу атома кислорода от азота к углероду. Однако экспериментально установленный закон скорости реакции таков: 92 \label{14.6.3} \]
Тот факт, что реакция имеет второй порядок по \([\ce{NO2}]\) и не зависит от \([\ce{CO}]\), говорит нам, что она не происходит с помощью простой модели столкновения, описанной ранее. Если бы это было так, его предсказанный закон скорости был бы
\[скорость = k[\ce{NO2}][\ce{CO}]. \nonumber \]
Следующий двухшаговый механизм согласуется с законом скорости, если шаг 1 намного медленнее, чем шаг 2:
| \(\textrm{шаг 1}\) | \(\ mathrm {NO_2} + \ mathrm {NO_2} \ xrightarrow {\ textrm {медленно}} \ mathrm {NO_3} + \ textrm {NO} \) | \(\textrm{элементарная реакция}\) |
|---|---|---|
| \(\textrm{шаг 2}\) | \(\ underline{\mathrm{NO_3}+\mathrm{CO}\стрелка вправо\mathrm{NO_2}+\mathrm{CO_2}}\) | \(\textrm{элементарная реакция}\) |
| \(\textrm{сумма}\) | \(\mathrm{NO_2}+\mathrm{CO}\rightarrow\mathrm{NO}+\mathrm{CO_2}\) | \(\textrm{общая реакция}\) |
Согласно этому механизму, общая реакция протекает в две стадии, или элементарные реакции. Суммируя шаги 1 и 2 и исключая обе части уравнения, мы получаем общее сбалансированное химическое уравнение реакции. Молекула \(\ce{NO3}\) представляет собой промежуточное соединение в реакции, вещество, которое не фигурирует в сбалансированном химическом уравнении для общей реакции. Он образуется как продукт первой стадии, но расходуется на второй стадии.
Суммируя шаги 1 и 2 и исключая обе части уравнения, мы получаем общее сбалансированное химическое уравнение реакции. Молекула \(\ce{NO3}\) представляет собой промежуточное соединение в реакции, вещество, которое не фигурирует в сбалансированном химическом уравнении для общей реакции. Он образуется как продукт первой стадии, но расходуется на второй стадии.
Сумма элементарных реакций в механизме реакции должна давать общее сбалансированное химическое уравнение реакции.
Использование молекулярности для описания закона скоростей
Молекулярность элементарной реакции — это число молекул, которые сталкиваются на этом этапе механизма. Если в элементарной реакции присутствует только одна молекула реагента, эта стадия обозначается как мономолекулярная ; если есть две молекулы реагента, это бимолекулярный ; а если молекул реагента три (относительно редкая ситуация), то термолекулярный . Элементарные реакции, связанные с одновременным столкновением более трех молекул, крайне маловероятны и никогда не наблюдались экспериментально. (Чтобы понять почему, попробуйте сделать так, чтобы три или более шариков или шаров для бильярда столкнулись друг с другом одновременно!)
Элементарные реакции, связанные с одновременным столкновением более трех молекул, крайне маловероятны и никогда не наблюдались экспериментально. (Чтобы понять почему, попробуйте сделать так, чтобы три или более шариков или шаров для бильярда столкнулись друг с другом одновременно!)
Записать закон скорости для элементарной реакции несложно, потому что мы знаем, сколько молекул должно столкнуться одновременно, чтобы произошла элементарная реакция; следовательно, порядок элементарной реакции такой же, как и ее молекулярность (таблица \(\PageIndex{1}\)). Напротив, закон скорости реакции не может быть определен из сбалансированного химического уравнения для общей реакции. Общий закон скорости мономолекулярной элементарной реакции (А → продукты) имеет вид
Напротив, закон скорости реакции не может быть определен из сбалансированного химического уравнения для общей реакции. Общий закон скорости мономолекулярной элементарной реакции (А → продукты) имеет вид
\[скорость = k[А]. \номер\]
Для бимолекулярных реакций скорость реакции зависит от количества столкновений в единицу времени, которое пропорционально произведению концентраций реагентов, как показано на рисунке \(\PageIndex{1}\). Для бимолекулярной элементарной реакции вида А + В → продукты общий закон скорости имеет вид
\[скорость = k[A][B]. \nonumber \]
| Элементарная реакция | Молекулярность | Закон о тарифах | Приказ о реакции |
|---|---|---|---|
| А → продукты | мономолекулярный | Скорость= к [А] | первый |
| 2А → продукты | бимолекулярный | Скорость= к [A] 2 | второй |
| А + В → продукты | бимолекулярный | скорость = к [A][B] | второй |
| 2А+В → продукты | термолекулярный | ставка = k[A] 2 [B] | третий |
| А + В + С → продукты | термолекулярный | скорость = k[A][B][C] | третий |
Для элементарных реакций порядок элементарной реакции такой же, как и ее молекулярность.
Напротив, закон скорости не может быть определен из сбалансированного химического уравнения для общей реакции (если только это не одностадийный механизм и, следовательно, не является также элементарной стадией).
Определение шага, определяющего скорость
Обратите внимание на важную разницу между написанием законов скорости для элементарных реакций и сбалансированным химическим уравнением общей реакции. Поскольку сбалансированное химическое уравнение не обязательно раскрывает отдельные элементарные реакции, в которых протекает реакция, мы не можем получить закон скорости реакции только из общего сбалансированного химического уравнения. Фактически, это закон скорости самой медленной общей реакции, который совпадает с законом скорости самой медленной стадии в механизме реакции, определяющая скорость стадия , которая должна дать экспериментально определенный закон скорости всей реакции. Это утверждение верно, если одна стадия существенно медленнее всех остальных, обычно в 10 раз или более. Если два или более медленных шага имеют сравнимые скорости, экспериментально определенные законы скорости могут стать сложными. Наше обсуждение ограничено реакциями, в которых одна стадия может быть идентифицирована как существенно более медленная, чем любая другая. Причина этого в том, что любой процесс, протекающий через последовательность шагов, не может происходить быстрее, чем самый медленный шаг в последовательности. Например, на автомобильной сборочной линии компонент не может быть использован быстрее, чем он произведен. Точно так же кровяное давление регулируется потоком крови через мельчайшие каналы, капилляры. Поскольку движение через капилляры представляет собой шаг, определяющий скорость кровотока, артериальное давление можно регулировать с помощью лекарств, которые вызывают сужение или расширение капилляров. Химическая реакция, протекающая через ряд элементарных реакций, не может протекать быстрее, чем самый медленный шаг в ряду реакций.
Если два или более медленных шага имеют сравнимые скорости, экспериментально определенные законы скорости могут стать сложными. Наше обсуждение ограничено реакциями, в которых одна стадия может быть идентифицирована как существенно более медленная, чем любая другая. Причина этого в том, что любой процесс, протекающий через последовательность шагов, не может происходить быстрее, чем самый медленный шаг в последовательности. Например, на автомобильной сборочной линии компонент не может быть использован быстрее, чем он произведен. Точно так же кровяное давление регулируется потоком крови через мельчайшие каналы, капилляры. Поскольку движение через капилляры представляет собой шаг, определяющий скорость кровотока, артериальное давление можно регулировать с помощью лекарств, которые вызывают сужение или расширение капилляров. Химическая реакция, протекающая через ряд элементарных реакций, не может протекать быстрее, чем самый медленный шаг в ряду реакций.
 2\textrm{(наблюдается)}\)
2\textrm{(наблюдается)}\)Экспериментально определенный закон скорости реакции \(NO_2\) с \(CO\) совпадает с предсказанным законом скорости для стадии 1. Это говорит нам о том, что первая элементарная реакция является определяющей стадией , поэтому \(k\) для общей реакции должно быть равно \(k_1\). То есть NO 3 медленно образуется на этапе 1, но после образования очень быстро реагирует с CO на этапе 2.
Иногда химики могут предложить два или более механизмов, которые согласуются с имеющимися данными. Однако, если предложенный механизм предсказывает неправильный экспериментальный закон скорости, этот механизм должен быть неверным.
Пример \(\PageIndex{1}\): реакция с промежуточным звеном
В альтернативном механизме реакции \(\ce{NO2}\) с \(\ce{CO}\) с \( \ce{N2O4}\) в качестве промежуточного продукта.
| \(\textrm{шаг 1}\) | \(\mathrm{NO_2}+\mathrm{NO_2}\xrightarrow{k_1}\mathrm{N_2O_4}\) |
|---|---|
| \(\textrm{шаг 2}\) | \(\ underline{\mathrm{N_2O_4}+\mathrm{CO}\xrightarrow{k_2}\mathrm{NO}+\mathrm{NO_2}+\mathrm{CO_2}}\) |
| \(\textrm{сумма}\) | \(\mathrm{NO_2}+\mathrm{CO}\rightarrow\mathrm{NO}+\mathrm{CO_2}\) |
Напишите закон скорости для каждой элементарной реакции. Соответствует ли этот механизм экспериментально установленному закону скорости (скорость = k [НО 2 ] 2 )?
Дано: элементарных реакций
Запрошено: закон скорости для каждой элементарной реакции и общий закон скорости
Стратегия:
- Определить закон скорости для каждой элементарной реакции в реакции.

- Определите, какой закон скорости соответствует экспериментально установленному закону скорости реакции. Этот закон скорости является законом для шага, определяющего скорость.
Решение
A Закон скорости для шага 1: rate = k 1 [NO 2 ] 2 ; для шага 2 это скорость = k 2 [N 2 O 4 ][CO].
B Если стадия 1 медленная (и, следовательно, скорость определяющая стадия), то общий закон скорости реакции будет таким же: скорость = k 1 [NO 2 ] 2 . Это то же самое, что и экспериментально установленный закон скорости. Следовательно, этот механизм с N 2 O 4 в качестве промежуточного соединения и ранее описанный с NO 3 в качестве промежуточного соединения кинетически неразличимы. В этом случае необходимы дальнейшие эксперименты, чтобы различить их.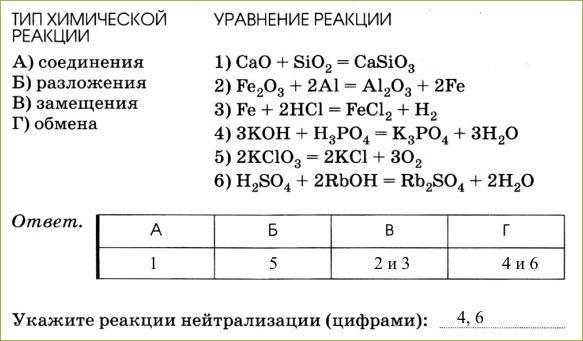 Например, исследователь мог бы попытаться обнаружить предполагаемые промежуточные соединения NO 3 и N 2 O 4 напрямую.
Например, исследователь мог бы попытаться обнаружить предполагаемые промежуточные соединения NO 3 и N 2 O 4 напрямую.
Упражнение \(\PageIndex{1}\)
Монохлорид йода (\(\ce{ICl}\)) реагирует с \(\ce{h3}\) следующим образом:
\[\ce{2ICl(l) + H_2(g) \rightarrow 2HCl(g) + I_2(s)} \nonumber \]
Экспериментально установленный закон скорости \(rate = k[\ce{ICl }][\ce{h3}]\). Напишите двухстадийный механизм этой реакции, используя только бимолекулярные элементарные реакции, и покажите, что он согласуется с экспериментальным законом скорости. (Подсказка: \(\ce{HI}\) является промежуточным.)
Ответ
| \(\textrm{шаг 1}\) | \(\mathrm{ICl}+\mathrm{H_2}\xrightarrow{k_1}\mathrm{HCl}+\mathrm{HI}\) | \(\mathrm{rate}=k_1[\mathrm{ICl}][\mathrm{H_2}]\,(\textrm{slow})\) |
|---|---|---|
| \(\textrm{шаг 2}\) | \(\ underline{\mathrm{HI}+\mathrm{ICl}\xrightarrow{k_2}\mathrm{HCl}+\mathrm{I_2}}\) | \(\mathrm{rate}=k_2[\mathrm{HI}][\mathrm{ICl}]\,(\textrm{fast})\) |
| \(\textrm{сумма}\) | \(\mathrm{2ICl}+\mathrm{H_2}\rightarrow\mathrm{2HCl}+\mathrm{I_2}\) |
Этот механизм согласуется с экспериментальным законом скорости, если первый этап является этапом, определяющим скорость.
Пример \(\PageIndex{2}\) : Реакция оксида азота с молекулярным водородом
Предположим, что реакция между \(\ce{NO}\) и \(\ce{H_2}\) протекает в процесс:

 при добавлении нитрата бария выпадает мелкокристаллический осадок, нерастворимый в азотной кислоте
при добавлении нитрата бария выпадает мелкокристаллический осадок, нерастворимый в азотной кислоте
 Общие принципы химии и современные приложения. Прентис Холл. Нью-Джерси, 2007.
Общие принципы химии и современные приложения. Прентис Холл. Нью-Джерси, 2007. Напротив, закон скорости не может быть определен из сбалансированного химического уравнения для общей реакции (если только это не одностадийный механизм и, следовательно, не является также элементарной стадией).
Напротив, закон скорости не может быть определен из сбалансированного химического уравнения для общей реакции (если только это не одностадийный механизм и, следовательно, не является также элементарной стадией).

Leave A Comment