Напишите уравнения реакций взаимодействия уксусной кислоты с 1)натрием, 2)оксидом натрия,
Вычислить Т и Сэ, М,% концентрацию раствора щавелевой кислоты, если на титрование 10мл ее пошло 10,5мл NаОН с титром 0,004900г/мл
Аммиак объемом 11,2 л пропустили через 100 г 20%-ной серной кислоты. Определить массу образовавшегося сульфата аммония
В результате полного сгорания 5 г углеводорода образовалось 16,18 г карбон (IV) оксида и вода. Установите формулу углеводорода, если относительная пл … отность его паров по водороду составляет 34. В ответе укажите сумму индексов формулы углеводорода.
Напишите полуструктурные формулы изомеров вещества, формула которой С6Н12. (7 формул).Назовите их по систематической номенклатуре. Укажите виды изом … ерии.
ПОЖАЛУЙСТА ПОМОГИТЕ РЕШИТЬ ЗАДАЧУ ПО ХИМИИ!!! Сколько воды надо добавить к 100мл 40%го раствора серной кислоты с плотностью 1,3г/мл для получения 5%-г … о раствора этой кислоты?
люди помогите!!! пожалуйста!!
c8 h24 с тройной связью
При добавлении в систему паров воды снизится скорость прямой реакции в системах: CO(T) + h3O(1) + CO2(1) + h3T) Ch5(T) +h3O(1) → CO(T) + 3h3(1) Fe3O4 … (TB) + 4h3(r) Fe(TB) + 4h3O(1) 2h3(r)+02 (1) = 2h3O(1) CO2(T) +h3O(T) h3CO3(T)
1 назвать формулы по июпак 2 составить формулы
Я не понимаю как это делать, сделайте пожалуйста, пример есть, а всё равно не понятно. Умоляю
ПРАКТИЧЕСКАЯ РАБОТА
Выбор конструкционных материалов по
… их назначению и эксплуатации.
Цель: формирование знаний о свойствах, составе и маркировке сталей и чугунов.
Задание. Приведите химический состав, определите группу по назначению ниже перечисленных черных металлов:
1) Ст 2пс;
2) КЧ60-3;
3) У12А;
4) 12ГН2МФАЮ;
5) 08Х23Н18М;
6) Р14АФ;
7) Ст45;
8) 50Г;
9) ШХ15;
10) 60Г.
Пример выполнения задания
Используя любые информационные источники, ответьте на вопрос задания.
Задание. Приведите химический состав, определите группу по назначению марки стали
12Х18Н10Т.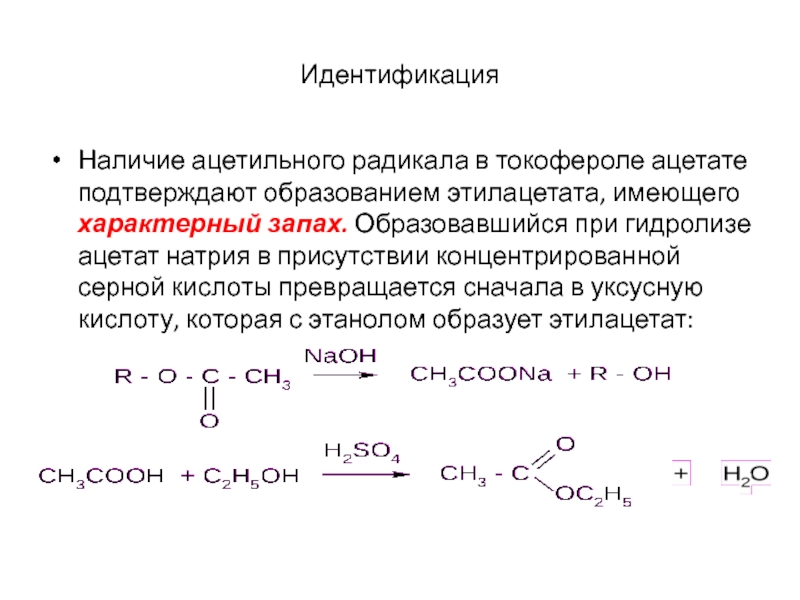
Натрий взаимодействие с уксусной кислотой
С гидроксидом натрия взаимодействует уксусная кислота [c.243]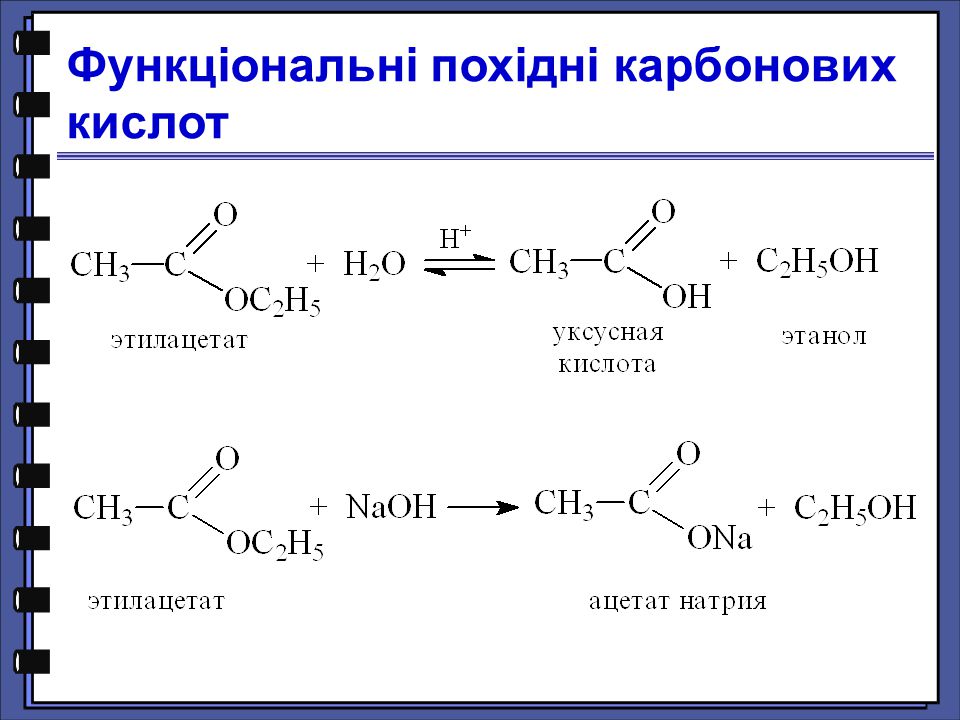 [c.68]
[c.68]Опыт 332. Взаимодействие пероксида натрия с уксусной кислотой [c.180]
Взаимодействие между солями диазония и аминами или фенолами может происходить в щелочной или слабокислой среде. Поэтому эту реакцию проводят в присутствии едкого натра, соды или уксуснокислого натрия. Едкий натр и сода нейтрализуют образующуюся соляную кислоту. При взаимодействии уксуснокислого натрия с соляной кислотой получается хлористый натрий и уксусная кислота. Таким образом, в результате прибавления уксуснокислого натрия в растворе образуется вместо сильной соляной кислоты слабая уксусная кислота.
Какая масса ацетата натрия образуется при взаимодействии уксусной кислоты и 60 мл 10%-ного раствора гидроксида натрия Плотность раствора [c.44]
Символ (водн) обозначает неопределенное, но большое количество воды как растворителя, т. е. реакция взаимодействия гидроксида натрия с уксусной кислотой протекает в водном растворе. Слово эфир над знаком стрелки говорит о том, что реакция протекает в эфирном растворе.
Какие соединения образуются при взаимодействии этилового спирта с а) металлическим натрием б) уксусной кислотой в) НВг. [c.82]
Чем отличается реакция между уксусной кислотой и этиловым спиртом ог реакции взаимодействия уксусной кислоты с едким натром [c.159]
Напишите уравнения реакций взаимодействия уксусной кислоты со следующими веществами а) гидроксидом магния, б) карбонатом магния, в) оксидом кальция, г) гидроксидом натрия, д) хлором, е) хлоридом фосфора (V).
В качестве порообразующего материала для технических изделий из губчатой резины применяют двууглекислый натрий, углекислый аммоний, смесь азотистокислого натрия и хлористого аммония. Успешно также применяются углекислый натрий и уксусная кислота. В этом случае в смесь вводится лигнин в качестве адсорбента уксусной кислоты. В процессе вулканизации уксусная кислота десорбирует и тогда она вступает во взаимодействие с углекислым натрием. [c.228]
В этом случае в смесь вводится лигнин в качестве адсорбента уксусной кислоты. В процессе вулканизации уксусная кислота десорбирует и тогда она вступает во взаимодействие с углекислым натрием. [c.228]
Важнейшие представители. Уксусный ангидрид (ацетангидрид) — бесцветная подвижная жидкость, с острым, раздражающим запахом, кипящая при 140° С. Получается в промышленности в больших количествах из хлористого ацетила и ацетата натрия, а также в результате взаимодействия уксусной кислоты и кетена
Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей. Например, при взаимодействии ацетата натрия с соляной кислотой реакция практически нацело протекает с образованием уксусной кислоты [c.254]
Несколько менее многочисленны соединения, в которых кобальт входит в состав комплексного аниона. Из них наиболее важными являются гексани-трокобальтаты. Они получаются при взаимодействии раствора смеси нитрата кобальта Со (N03)2, нитрита натрия и уксусной кислоты. В этих условиях образуется растворимая в воде соль, отвечающая формуле Ыаз [Со (N02)6] В присутствии солей калия выпадает Кз [Со (N02)] (соль Фишера) в виде блестящего ярко-желтого осадка, не растворимого в воде, спирте и эфире. Образование соли Фишера или гексанитро-(П1) кобальтата калия может быть представлено следующими уравнениями
Наиболее простым способом синтеза 3, 6-дизамещенных 1, 2, 4, 5-тетразина является взаимодействие гидразина с нитрилами. Непосредственный продукт этой реакции, протекающей через стадию образования амидразонов,— 3, 6-дизамещенный 1, 4-дигидротетра-зин (превращению амидразонов в дигидротетразины способствует сера). При окислении 1,4-дигидротетразинов с помощью таких окислителей, как нитрит натрия в уксусной кислоте, хлорное железо или пероксид водорода, образуется соответствующий тетразин (см. обзор [125, с. 88]).
Некоторые циклические перекиси (например, тримерная перекись ацетона) не выделяют иод нз иодистых солей даже при нагревании. Изучение реакционной способности перекисей различных типов при взаимодействии с раствором иодистого натрия в уксусной кислоте при 20°С показало, что реакционная способность перекисей уменьшается в ряду надкислоты, гидроперекиси, пероксиэфиры, диалкилперекиси и димерные кетопере-киси, тримерные кетоперекиси и ди-трет-бутилперекись Такой же порядок наблюдается для скоростей гидрирования этих перекисей над палладиевым катализатором.
Изучение реакционной способности перекисей различных типов при взаимодействии с раствором иодистого натрия в уксусной кислоте при 20°С показало, что реакционная способность перекисей уменьшается в ряду надкислоты, гидроперекиси, пероксиэфиры, диалкилперекиси и димерные кетопере-киси, тримерные кетоперекиси и ди-трет-бутилперекись Такой же порядок наблюдается для скоростей гидрирования этих перекисей над палладиевым катализатором.
Соли ксантилия, алкилированные в положении 9, при взаимодействии с веществами основного характера теряют элементы НХ с легкостью, зависящей от имеющихся в молекуле заместителей. Так, например, соли 9-(Р,Р-дифенил-винил)ксантилия (XII) превращаются в аллен (ХШ) уже в присутствии воды [116]. Для отщепления же НХ от перхлората 9-стирилксантилия требуется применение ацетата натрия в уксусной кислоте, а от перхлората 9-(Р,р-дианизил- [c.358]
Ионообменная хроматография карбоновых кислот в растворах ацетата натрия и уксусной кислоты имеет широкое использование. Этим методом оказывается возм[ожным разделять даже очень сложные смеси оксикислот, что особенно важно для химии сахаров. Раствор ацетата натрия является подходящим элюентом для разделения ионов различных монокарбоновых кислот. Альдоновые и уроновые кислоты элюируются в порядке увеличения молекулярной массы. Если сравнить поведение при элюировании кислот с равным числом углеродных атомов, но с различным числом гидроксильных групп, то оказывается, что силы взаимодействия со смолой увеличиваются с уменьшением числа таких групп. Это дает возможность разделять ряд стереоизомеров, различающихся по степени гидратации и по силе ионного взаимодействия. Однако некоторые изомеры кислот не разделяются путем элюирования раствором ацетата натрия, и в таком случае более выгодно использовать уксусную кислоту. При элюировании уксусной кислотой наиболее важным фактором является кислотность разделяемых кислот. Слабые кислоты элюируются легче, чем сильные кислоты.
Производные индола. Индол и его производные со свободным [З-положением взаимодействуют с азотистой кислотой (нитритом натрия и уксусной кислотой или, лучше, с амилнитритом и этилатом натрия), давая 3-нитрозоандолы. Аналогичным образом из индолов, этилнитрата и этилата натрия получаются 3-нитроиндолы. Последние обладают, вероятно, строением изонитрозо- и а1 м-нитросоединсний, производных индолениновой формы (см. ниже) [c.640]
Взаимодействием я-бензохинонов (17) с тиосульфатом натрия в уксусной кислоте получают соединения (18), которые далее восстанавливают в 2-меркаптогидрохиноны (19) [424] Окислением я-фенилендиамина в я-хинондиимин в присутствии тиосульфата натрия с последующим восстановительным расщеплением тиосульфатной группы можно-получить меркапто-я-фени-леидиамины [519]. [c.382]
Метод основан на взаимодействии бутоксильных групп дибутилфталата с иодистоводородной кислотой с образованием иодистого бутила, который под действием брома в присутствии уксуснокислого натрия в уксусной кислоте переходит в иодбром и бромистый бутил. Иодбром окисляется бромом в йодноватую кислоту, а последняя восстанавливается иодистым водородом до иода, который оттитровывается серноватистокислым натрием. Поливинилацетат и мономерный винилацетат с иодистоводородной кислотой не реагируют. [c.438]
Тетрабеизантрахинон IV получается при окислении III бихроматом натрия в уксусной кислоте и нитробензоле. Он образует желтые кристаллы (т. пл. 404—405° С), не растворяется в серной кислоте и не дает лейкооснования кубового красителя при взаимодействии со щелочным раствором гидросульфита натрия [c.332]
Он образует желтые кристаллы (т. пл. 404—405° С), не растворяется в серной кислоте и не дает лейкооснования кубового красителя при взаимодействии со щелочным раствором гидросульфита натрия [c.332]
Крупные кристаллы двузамещенного пирофосфата легко получаются при взаимодействии концентрированного раствора четырехзамещенного пирофосфата натрия с уксусной кислотой. [c.149]
Существует, например, несколько реагентов типа гипоиодита [29] и подкисленного раствора хлорита [За], которые не взаимодействуют (или взаимодействуют незначительно) со спиртовыми гидроксильными группами, а только окисляют концевые полуацетальные гидроксильные группы до карбоксильных. Пирановое кольцо раскрывается и образуется остаток глюконовой кислоты или ее лактона. Это окисление протекает настолько избирательно, что служит методом количественного определения содержания концевых гидроксильных или альдегидных групп в молекуле целлюлозы. В первом случае измельченную целлюлозу обрабатывают 0,05 н. раствором иода в 4%-ном иодистом калии при pH 10,6 и 10° [265а]-. Во втором случае целлюлозу обрабатывают 0,4Л/ раствором хлорита натрия, подкисленным уксусной кислотой до pH 2,5 [338а]. [c.289]
Изучение литературы, посвященной галоидированию углеводородов, начиная с пропана, у которого могут появиться два изомерных продукта монозамещения, показывает значительные отклонения от состояния современных знаний. Еще в 1869 г. Шорлеммер оспаривал образование хлористого пропила при прямом хлорировании пропана [5], так как получил при взаимодействии продукта реакции (моно-хлорпропана) с ацетатом натрия и ледяной уксусной кислотой при 200 лишь н-пропилацетат, который омылил в н-пропиловый спирт. Последний был идентифицирован окислением в пропионовую кислоту. [c.533]
В качестве присадки к смазочным маслам, предохраняющей металл от ржавления,, исследована также дисперсия нитрата натрия в продукте конденсации имидазолина с уксусной кислотой. Находит применение противокоррозионная добавка к пластичным смазкам, представляющая собой нитрит натрия (активный компонент) на носителе. Носителями служат мыла щелочноземельных металлов позволяющие получать однородные смазки активный компонент является смесью нитрита натрия и имида, образующегося в результате взаимодействия сополимера стирола и малеинового ангидрида с аминами. [c.184]
Находит применение противокоррозионная добавка к пластичным смазкам, представляющая собой нитрит натрия (активный компонент) на носителе. Носителями служат мыла щелочноземельных металлов позволяющие получать однородные смазки активный компонент является смесью нитрита натрия и имида, образующегося в результате взаимодействия сополимера стирола и малеинового ангидрида с аминами. [c.184]
Чем можно нейтрализовать уксусную кислоту в случае разлива или аварии
Химическая реакция нейтрализации представляет собой реакцию между щелочью и кислотой в результате которой образуется какая-то соль и вода. Примером таких процессов может быть реакция нейтрализации между уксусной кислотой и гидроксидом натрия или соляной кислотой и едким натрием.
Наблюдать реакцию нейтрализации кислоты щелочью можно только в том случае, если самого начала к раствору кислоты добавить индикатор, чтобы изменить окраску раствора. А как только к такому цветному раствору добавить щелочь, окраска сразу же исчезнет – будет выглядеть как фокус.
Как нейтрализовать уксусную кислоту гидроксидом натрия?
Для любой кислоты обязательно характерна реакция полной нейтрализации. В качестве доказательства этого можно провести эксперимент нейтрализации гидроксидом натрия уксусной кислоты. Для этого необходимо взять специальные химические колбы и наполнить их разбавленными растворами гидроксида натрия (NaОН) и уксусной кислоты (СН3 СООН). В ту колбу где будет раствор гидроксида натрия (NaОН) необходимо добавить несколько капель индикатора, а именно фенолфталеина, также можно добавить катализатор.
После этого в бюретку необходимо аккуратно налить раствор уксусной кислоты. Затем в раствор щелочи по одной капле добавляется кислота. Это продолжается до того момента, пока весь гидроксид натрия не перейдет в соль. Полный переход будет виден по окраске ранее добавленного индикатора – фенолфталеина. Как только вся щелочь полностью прореагирует с образовавшейся солью ацетата натрия – малиновый цвет раствора исчезнет и жидкость будет прозрачной.
Современный способ нейтрализации уксусной кислоты.
На сегодняшний день в случае аварий и проливов на производствах используется способ нейтрализации уксусной кислоты на фасовочно-укупорочной автоматизированной машине. Осуществляется обработка поверхности, где была разлита уксусная кислота, безводным порошкообразным карбонатом натрия. Обработка кислоты ведется до образования густой пасты и паста не убирается. При последующих разливах уксусной кислоты на поддоне при появлении жидкой фазы поверхность места разлива обрабатывают карбонатом натрия до появления пасты, которая связывает жидкую фазу. В случае попадания кислоты на поверхность, расположенную вне поддона, нейтрализация проводится водой до получения раствора с концентрацией 25-30%.
Если остается открытый вопрос чем можно нейтрализовать уксусную кислоту, то это может быть либо карбонат натрия, либо гидроксид натрия.
Обработка поверхности карбонатом натрия в случае первого разлива выполняется при таком соотношении компонентов по общей массе: Na2CO3:Ch4COOH=1,6÷4,0:1. Такой способ нейтрализации обеспечивает значительное сокращение отходов всего технологического процесса, позволяет уменьшить выделение СО2 и позволяет снизить токсичность технологического процесса.
Также существуют способы нейтрализации кислоты и ее растворов водными растворами гидрокарбоната натрия с концентрацией 1-4%, или водными растворами гидроксида натрия с концентрацией 2,5-10%. Недостатком данных способов является очень большой расход раствора, и как следствие, большое количество сточной воды, которая содержит ацетат натрия. А такую воду обязательно нужно очистить перед сбросом. Кроме этого, недостатком является еще и выделение в атмосферу и рабочую зону диоксида углерода.
Максимально близким по технической сущности и полученному результату является метод нейтрализации уксусной кислоты на фасовочно-укупорочной машине.
Место разлива вещества на поверхностях выше поддона и на самом поддоне нейтрализуется с помощью раствора карбоната натрия. В растворе образуется большое количество ацетата натрия. Процесс нейтрализации контролируется при помощи устройства, определяющего уровень рН. Недостатком такого способа является также большое количество сточных вод с повышенной концентрацией ацетата натрия. Это приводит к тому, что для реализации выделения ацетата натрия нужна сложная технология, которая включает в себя кристаллизацию, выпаривание и фильтрование. Еще один недостаток – это большой расход карбоната натрий (порошкообразного), что связанно с избыточным его использованием. Кроме этого в ходе нейтрализации уксусной кислоты образуется очень большое количество углекислого газа. Негативной стороной способа является большая площадь нейтрализуемой смеси, а также несущественное повышение температуры, а это приводит к выделению паров уксусной кислоты.
В растворе образуется большое количество ацетата натрия. Процесс нейтрализации контролируется при помощи устройства, определяющего уровень рН. Недостатком такого способа является также большое количество сточных вод с повышенной концентрацией ацетата натрия. Это приводит к тому, что для реализации выделения ацетата натрия нужна сложная технология, которая включает в себя кристаллизацию, выпаривание и фильтрование. Еще один недостаток – это большой расход карбоната натрий (порошкообразного), что связанно с избыточным его использованием. Кроме этого в ходе нейтрализации уксусной кислоты образуется очень большое количество углекислого газа. Негативной стороной способа является большая площадь нейтрализуемой смеси, а также несущественное повышение температуры, а это приводит к выделению паров уксусной кислоты.
Задача этого устройства – сокращение отходов всего технологического процесса, сокращение расхода нейтрализующего агента, сокращение уровня выделения СО2, а также уменьшение токсичности.
Эта задача достигается тем, что в методе нейтрализации водных горючих растворов кислоты на фасовочно-укупорочной автоматизированной линии, включающем дополнительную обработку поверхности, на которую была разлита кислота, порошкообразным карбонатом натрия до образования пасты и ее не убирают.
Автоматизированная фасовка и укупоривание выполняется на модифицированной фасовочно-укупорочной машине Б3-ОД-2-К/3-02/03/ по ТУ 3-1768. Данная машина предназначена для реализации фасовки 70-80%-ной уксусной кислоты в вакууме. Машина представляет собой автоматизированную систему ротационного типа с электроприводом, включающую специальный бункер полиэтиленовых пробок, карусели для укупоривания и фасовки. Максимальная мощность электропривода – 2,6 кВт. Основная часть уксусной кислоты выливается на поверхность поддона из нержавеющей стали, некоторая часть может попасть на поверхность вне поддона.
Поэтому если на своем предприятии вы не знаете, чем нейтрализовать уксусную кислоту, тогда данная система будет идеальным вариантом. На сегодняшний день это наиболее современный способ, который активно набирает популярность на различных предприятиях, занимающихся производством уксусной кислоты.
На сегодняшний день это наиболее современный способ, который активно набирает популярность на различных предприятиях, занимающихся производством уксусной кислоты.
Krisanalyt — Натрий уксуснокислый
Натрий уксуснокислыйCh4COONa – это натриевая соль уксусной кислоты или ацетат натрия. Вещество представляет собой кристаллы, оттенки цветов которых могут находиться в диапазоне от бесцветного до насыщенного коричневого. Вещество ацетат натрия — негорючее, по классификации безопасности отнесено к четвертому классу.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок или химических обогревателей, применяется как составная часть смеси «горячего льда».
|
№ п/п |
Наименование показателей |
Требования ГОСТ |
Фактически по анализу |
|
1. |
Массовая доля 3-водного уксуснокислого натрия (СН3СООNa*3Н2О), %, не менее |
99,0 |
99,2 |
|
2. |
Массовая доля нерастворимых в воде веществ, %, не более |
0,005 |
0,005 |
|
3. |
Массовая доля кислот в пересчете на уксусную кислоту (СН3СООН), %, не более |
0,02 |
0,02 |
|
4. |
Массовая доля щелочей в пересчете на гидроокись натрия (NаОН), %, не более |
0,02 |
0,02 |
|
5. |
Массовая доля сульфатов (SO4), %, не более |
0,002 |
0,002 |
|
6. |
Массовая доля фосфатов (РО4) %, не более |
0,001 |
0,001 |
|
7. |
Массовая доля хлоридов (CI), %, не более |
0,001 |
0,001 |
|
8. |
Массовая доля алюминия (AI), %, не более |
0,001 |
0,001 |
|
9. |
Массовая доля железа (Fе), %, не более |
0,0005 |
0,0005 |
|
10. |
Массовая доля кальция(Са), %, не более |
0,0025 |
0,0025 |
|
11. |
Массовая доля магния (Мg), %, не более |
0,0005 |
0,0005 |
|
12. |
Массовая доля мышьяка (As), %, не более |
не норм |
не нормируется |
|
13. |
Массовая доля тяжелых металлов (РЬ), %, не более |
0,001 |
0,001 |
Гарантийный срок хранения — 3 года.
Ацетат натрия оптом от 25 кг от 1.6 долл/кг
Ацетат натрия известен по несколькими названиями – натриевая соль уксусной кислоты, натрий уксуснокислый, натрия этаонат. Также это вещество широко известно в качестве пищевой добавки E262. Если перейти на бытовой уровень, этот продукт знаком каждому человеку, которому приходилось гасить соду уксусом для приготовления оладий или пирогов.
Получение ацетата натрия
У каждого дома есть пищевая сода и уксусная кислота. Многие знают, что натриевая соль, добавленная в тесто, помогает выпечке становиться воздушной и упругой. В промышленных условиях ацетат натрия также получают соединением уксусной кислоты с различными солями натрия. Химическая формула продукта – C2H3O2Na.
Чтобы получить вещество в чистом кристаллическом виде, необходимо из полученной смеси выпарить жидкость. Полученный бесцветный или беловатый порошок будет иметь солоноватый вкус и легкий уксусный запах. Из-за способности выделять много тепла в процессе кристаллизации вещество получило название «горячий лед».
Полученный бесцветный или беловатый порошок будет иметь солоноватый вкус и легкий уксусный запах. Из-за способности выделять много тепла в процессе кристаллизации вещество получило название «горячий лед».
Кристаллы ацетата натрия можно употреблять в пищу, они безвредны, нетоксичны и известны под названием пищевой добавки E 262. Ее отличительная особенность заключается в том, что этаонат встречается в природе в естественном виде. Он входит в состав растительных и животных клеток, формируется при ферментации молочнокислых бактерий.
Сферы применения
Основное применение продукт нашел в производстве продуктов питания. Вещество имеет низкую стоимость, признано не токсичным, его суточное потребление не ограничено никакими нормами. Пищевая добавка E-262 признана абсолютно безвредной и применяется почти во всех странах.
Ацетаты натрия нашел применение в следующих отраслях:
- В пищевой промышленности для консервирования и регулировании кислотности маринадов; в хлебных изделиях для борьбы с «картофельной болезнью»; для придания пикантного вкуса чипсам, сухарикам, прочим сухим закускам.
- В медицине и фармакологии для приготовления инъекционных растворов обезболивающих и противовоспалительных препаратов; добавляется в лечебные кремы и мази; содержится в составе мочегонных средств; добавляют в соляные грелки.
- В косметологии добавляется в косметические средства для умывания, вводится в состав мыла.
- В текстильной промышленности и кожевенном производстве улучшает процессы окрашивания и дубления.
- В животноводстве и птицеводстве добавка E-262 продлевает срок хранения кормов.
Технический ацетат натрия добавляют в бетонные смеси для сохранения свойств при низких температурах. Фотографы используют натриевую соль в качестве надежного закрепителя. Велико значение этого вещества для охраны окружающей среды: добавление его в сточные воды нейтрализует отработанную серную кислоту.
Негативные свойства
Как и большинство пищевых добавок, ацетата натрия имеет некоторые ограничения для употребления. Хотя вещество признано совершенно безопасным, не токсичным, злоупотреблять им не рекомендуется. Ограничения касаются людей, страдающих повышенным давлением, дисбактериозом, имеющих проблемы с сосудами. Также не следует злоупотреблять чипсами и сухариками с добавкой E-262 детям в возрасте до 12 лет.
Хотя вещество признано совершенно безопасным, не токсичным, злоупотреблять им не рекомендуется. Ограничения касаются людей, страдающих повышенным давлением, дисбактериозом, имеющих проблемы с сосудами. Также не следует злоупотреблять чипсами и сухариками с добавкой E-262 детям в возрасте до 12 лет.
Купить Ацетат натрия оптом можно в компании «Формула еды», в мешках по 25 кг по низкой цене. Отгрузка со склада в Москве или Санкт-Петербурге, возможна доставка до терминала ТК.
Нингидрин; Реагент на основе изопропанола; Натрий гидроокись; Кислота трихлоруксусная; Натрия гидрокарбонат; Спирт изопропиловый; Уксусная кислота ; Ацетон
227 014,32 ₽
Обеспечение заявки2 270,14
Обеспечение договора2 270,14
Место поставки: Российская Федерация, Санкт-Петербург,191124, г. Санкт-Петербург, Суворовский пр., д. 63
Санкт-Петербург, Суворовский пр., д. 63
Подача заявок завершена
Взять в работу
Вискозиметрические свойства растворов хитозана в уксусной кислоте и натрий-ацетатном буфере Текст научной статьи по специальности «Химические науки»
ХИМИЯ
УДК 547.458:544
ВИСКОЗИМЕТРИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ ХИТОЗАНА В УКСУСНОЙ КИСЛОТЕ И НАТРИЙ-АЦЕТАТНОМ БУФЕРЕ
Е. В. Колсанова1, Э. Э. Орозалиев2, А. Б. Шиповская1
1Саратовский государственный университет E-mail: kozyreva-ev@yandex. within 25-70°C were studied. Concentration dependences of the viscosity number were plotted. Intrinsic viscosities, Huggins’ constants and the temperature coefficients of viscosity were estimated. The intrinsic viscosity of solutions of this aminopolysaccharide in acetic acid has been found to be significantly higher than that in acetate buffer. Compaction of the macromolecular coils of the polymer and a change in the thermodynamic quality of the low-molecular-weight liquid used as a solvent for chitosan with increasing ionic strength are hypothesized. The increased skeletal rigidity of chitosan macro-molecules was confirmed.
within 25-70°C were studied. Concentration dependences of the viscosity number were plotted. Intrinsic viscosities, Huggins’ constants and the temperature coefficients of viscosity were estimated. The intrinsic viscosity of solutions of this aminopolysaccharide in acetic acid has been found to be significantly higher than that in acetate buffer. Compaction of the macromolecular coils of the polymer and a change in the thermodynamic quality of the low-molecular-weight liquid used as a solvent for chitosan with increasing ionic strength are hypothesized. The increased skeletal rigidity of chitosan macro-molecules was confirmed.
Key words: chitosan solutions, intrinsic viscosity, Huggins’ constant, temperature coefficient of viscosity, conformational properties.
Одной из важных характеристик растворов высокомолекулярных соединений является вязкость. Известно, что значение вязкости зависит от молекулярной массы полимера, его концентрации в растворе, природы растворителя, температуры и др. Изучение вязкостных свойств разбавленных растворов полимеров позволяет оценить гидродинамические параметры и конформационное поведение макромолекул в присутствии низкомолекулярной жидкости, что чрезвычайно важно для понимания характера взаимодействия поли-
© Колсанова Е. В., Орозалиев Э. Э., Шиповская А. Б., 2014
Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2014. Т. 14, вып. 2
мера с растворителем, оценки конформационных параметров макромолекул и т.п. [1].
Свойства хитозана (ХТЗ) в растворе определяются, прежде всего, двумя факторами: повышенной жёсткостью цепи, обусловленной Р-(1,4)-гликозидными связями, и наличием свободных аминогрупп, способных или протонироваться, или (наряду с гидроксогруппами) образовывать внутри- и межмолекулярные водородные связи, приводя к возможной ассоциации макромолекул. Это приводит к тому, что макромолекулы ХТЗ характеризуются весьма сложным поведением в растворах [2-9], связанным в первую очередь с полиэлектролитным набуханием данного полимера. Ситуация осложняется и тем, что в качестве растворителя необходимо использовать водные растворы органических и одноосновных неорганических кислот. Природа выбранной кислоты, добавка в некоторых случаях индифферентного электролита для подавления полиэлектролитного эффекта вносят дополнительный вклад в поведение макромолекул ХТЗ в растворе [2-4, 9]. В этой связи представляет интерес исследование влияния природы растворителя на вискозиметрические свойства растворов ХТЗ.
Это приводит к тому, что макромолекулы ХТЗ характеризуются весьма сложным поведением в растворах [2-9], связанным в первую очередь с полиэлектролитным набуханием данного полимера. Ситуация осложняется и тем, что в качестве растворителя необходимо использовать водные растворы органических и одноосновных неорганических кислот. Природа выбранной кислоты, добавка в некоторых случаях индифферентного электролита для подавления полиэлектролитного эффекта вносят дополнительный вклад в поведение макромолекул ХТЗ в растворе [2-4, 9]. В этой связи представляет интерес исследование влияния природы растворителя на вискозиметрические свойства растворов ХТЗ.
Для изучения вязкостных характеристик ХТЗ в растворе были выбраны три растворителя с предположительно разным характером взаимодействия с макромолекулами полимера: 2% и 70%-ная уксусная кислота, натрий-ацетатный буфер. Выбор уксусной кислоты данных концентраций (Сук) обусловлен, во-первых, широким применением в научных исследованиях и практических приложениях для приготовления растворов, формования плёнок (Сук = 2%) [8, 10], электроформования нановолокона (Сук = 70%) [11, 12] и т.п.; во-вторых, существенным различием в значениях водородного показателя, ионной силы и других физико-химических характеристик. Для сравнения и с целью анализа влияния ионной силы на вязкостные свойства ХТЗ для приготовления растворов использовали натрий-ацетатный буфер, обычно применяемый в экспериментах по вискозиметрии с целью определения средневязкостной молекулярной массы этого полимера.
Цель работы — исследование вискозиметри-ческих свойств разбавленных растворов хитозана в уксусной кислоте и натрий-ацетатном буфере в интервале температур Т = 25-70°С.
Материалы и методы
Для исследования выбран образец ХТЗ с молекулярной массой 200 кДа, степенью дез-ацетилирования 82 моль.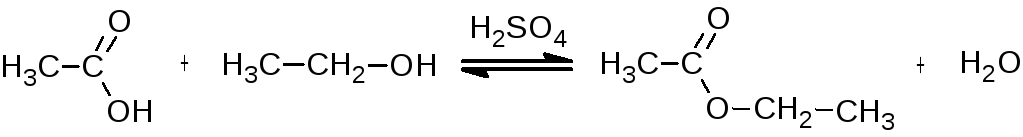 % производства ЗАО «Биопрогресс» (г. Щелково). В качестве раст-
% производства ЗАО «Биопрогресс» (г. Щелково). В качестве раст-
ворителей использовали водные растворы уксусной кислоты СУК = 2% и 70%, которые готовили с использованием ледяной уксусной кислоты квалификации х.ч. и дистиллированной воды, а также натрий-ацетатный буфер состава 1.9% СН3СООН + 1.6% СНзСООЖ
Растворы полимера концентрации Сп = 0.25 г/дл готовили растворением навески воздушно-сухого порошка ХТЗ при комнатной температуре и нормальном атмосферном давлении в течение 1 сут. Растворы меньшей концентрации получали разбавлением исходной системы растворителем в резервуаре вискозиметра.
Водородный показатель определяли на рН-метре «рН-150 МИ» производства НПО «Измерительная техника ИТ» с использованием комбинированного стеклянного электрода ЭКС-10603 в качестве измерительного. Ионную силу рассчитывали по формуле: I = 1/2££Д2, где С — молярная концентрация отдельных ионов, — заряды ионов. Физико-химические параметры растворителей (уксусной кислоты, натрий-ацетатного буфера) приведены в табл. 1.
Таблица 1
Физико-химические параметры уксусной кислоты и натрий-ацетатного буфера
Концентрация компонентов, % Водородный показатель рН Ионная сила I, ммоль/л
СН3СООН СН3СООЫа
2 — 3.1 2.4
70 — 1.5 14.7
1.9 1.6 4.4 200
Вискозиметрические измерения проводили в вискозиметре Уббелоде с диаметром капилляра 0.56 мм в диапазоне Т = 25-70° С по общепринятой методике. Перед измерениями каждый раствор и растворитель фильтровали через фильтр Шотте № 160. ХСП[п]2. Температурный коэффициент предельного числа вязкости 5т = йЯп[п]/йТ рассчитывали по зависимости 1п[п] = XТ).
ХСП[п]2. Температурный коэффициент предельного числа вязкости 5т = йЯп[п]/йТ рассчитывали по зависимости 1п[п] = XТ).
Удельный парциальный объём растворенного полимера (V, мл/г) определяли пикнометрически
и рассчитывали по формуле:
( \
т
Пуд/Сп, дл/г
V = V
т
С V
П 0
т
1 т
где v0 — объём пикнометра, мл; т0 и т — масса растворителя и раствора в пикнометре, г.
Результаты и их обсуждение
На рисунке приведены концентрационные зависимости числа вязкости для растворов ХТЗ в натрий-ацетатном буфере, 2% и 70%-ной уксусной кислоте при разных температурах. Для всех систем зависимости числа вязкости от концентрации ХТЗ в растворе имеют прямолинейный характер. Следовательно, размеры макромолекул аминопо-лисахарида не изменяются в процессе разбавления раствора. Величина [г|] закономерно уменьшается с ростом температуры (табл. 2), что типично для ХТЗ [2-6] и других полужесткоцепных природных полисахаридов и их производных, например, целлюлозы и её эфиров [1, 13, 14]. Величина [п] растворов ХТЗ достаточно высока по сравнению, например, с таковой для гибкоцепных полимеров [1, 15], что также может быть обусловлено повышенной жесткостью макроцепей ХТЗ.
Таблица 2
Вискозиметрические параметры растворов ХТЗ
Растворитель Параметры Температура Т, °С
25 35 45 60 70
Натрий- ацетатный буфер [п], дл/г 3.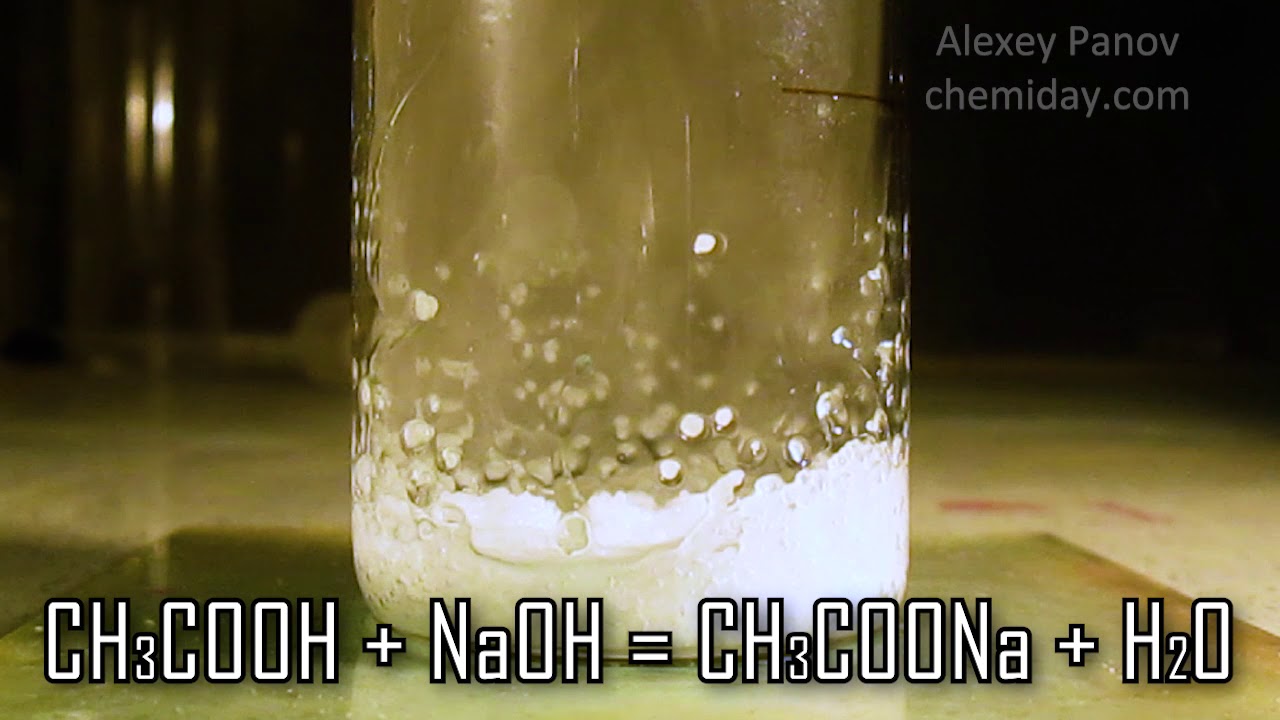 200 ммоль/л (см. табл. 1).
200 ммоль/л (см. табл. 1).
Известно, что величина [п] определяется гидродинамическим объемом макромолекуляр-ного клубка и зависит от термодинамического качества растворителя [1, 2, 7]. Наблюдаемое различие в значениях предельного числа вязкости рассматриваемых систем, очевидно, свидетельствует о реализации различной кон-формации макромолекул ХТЗ в использованных растворителях. В растворах уксусной кислоты без добавления соли реализуются заметно более разбухшие макромолекулярные клубки, что говорит о хорошем термодинамическом качестве данного растворителя для ХТЗ. Это согласуется с отрицательным значением удельного парциального объема ХТЗ, растворенного в уксусной кислоте. Так, для ХТЗ в 2%-ной уксусной кислоте V = -0.38 мл/г, в 70%-ной V = -1.02 мл/г, т.е. взаимодействие между растворителем и полимером настолько сильное, что приводит к образованию более плотной упаковки молекул с уменьшением объёма. В случае ацетатного буфера наблюдается положительное значение V = 0.97 мл/г, что несколько отличается от значения (V = 0.687 см3/г), приведенного в работе [2], но также являющегося положительным. Различие в значении V для растворов хитозана в натрий-ацетатном буфере, полученном в настоящей работе и в [2], может быть обусловлено разными физико-химическими характеристиками (молекулярная масса, степень деацетилирования) используемых образцов полимера.
Более высокие значения [п] растворов ХТЗ в уксусной кислоте, по сравнению с натрий-ацетатным буфером, вероятно, объясняются существованием специфического гидродинамического взаимодействия макромолекул полимера с растворителем, обусловленного сольватацией их в растворах уксусной кислоты. Очевидно, в результате разрыва внутримолекулярных водородных связей в полимере, имеет место увеличение размеров клубка, при котором иммобилизация ХТЗ уксусной кислотой в виде прочной сольватной оболочки (за счет водородных связей) протекает более предпочтительно, чем в случае кислотно-солевого раствора. натрий-ацетатный буфер.
натрий-ацетатный буфер.
Ухудшение термодинамического качества в данном ряду жидкостей подтверждают и заметно меньшие значения константы Хаггинса Кх (см. табл. 2), являющейся мерой взаимодействия полимера с растворителем, для растворов ХТЗ в уксусной кислоте по сравнению с кислотно-солевым раствором, по крайне мере, в диапазоне температур 25-35°С. Так, при Т = 25°С для растворов ХТЗ в уксусной кислоте Кх = 0.09, в ацетатном буфере = 0.20; при Т = 35°С — в уксусной кислоте Кх = 0.18, в ацетатном буфере = 0.20.
Обращает на себя внимание и то обстоятельство, что с повышением температуры увеличение Кх наблюдается для всех исследуемых систем (см. табл. 2). Такой характер Кх = /(Т) может свидетельствовать об ухудшении термодинамического качества всех использованных растворителей ХТЗ с повышением температуры.
Из температурной зависимости 1п[п] растворов ХТЗ в натрий-ацетатном буфере, 2% и 70%-ной уксусной кислоте были рассчитаны
температурные коэффициенты предельного числа вязкости 5Г = dln[n]/dT (см. табл. 2). Для всех растворов получены отрицательные и большие по модулю величины &т = —1.610-2 К-1, что в целом подтверждает имеющиеся литературные данные [5, 15, 16] и является характерным свойством полимеров с повышенной жёсткостью цепи. Рассчитанные нами значения ST по модулю оказались заметно выше литературных: ST = = (—0.53±0.06)10-2 К-1 [5], 5Т=(—0.9±0.3)10-2 К-1 [15, 16]. Однако в цитированных работах использовался другой растворитель — ацетатный буфер состава 1.9% СН3СООН + 1.7% NaCl, где NaCl — соль нейтрального типа, а используемая в настоящей работе СН3СОО№ — соль основного типа.
Согласно имеющимся представлениям, отрицательные величины температурного коэффициента предельного числа вязкости обусловлены уменьшением размеров макромолекулярных клубков при повышении температуры. Таким образом, зависимость ln[n] = f(Т) растворов ХТЗ, как и зависимость Kx = f (Т), свидетельствует об ухудшении взаимодействия полимер-растворитель с увеличением температуры.
Итак, характер изменения гидродинамических параметров растворов ХТЗ с повышением температуры (см. рисунок, табл. 2) позволяет констатировать, что, независимо от природы растворителя, макромолекулярные размеры полимера в исследуемом диапазоне температур определяются в наибольшей степени скелетной жёсткостью цепи (близкодействие). С другой стороны, сравнение величин [n], Kx и 5т и их температурных зависимостей в разных растворителях свидетельствует о решающей роли объемных эффектов (дальнодействия) в формировании конформационных свойств макроцепей в ацетатном буфере, 2% и 70%-ной уксусной кислоте.
Таким образом, проведённые эксперименты подтвердили повышенную скелетную жёсткость макромолекул ХТЗ. Существенное значение для гидродинамических свойств разбавленных растворов ХТЗ имеет природа растворителя, в частности ионная сила среды.
Список литературы
1. Цветков В. Н. Жесткоцепные полимерные молекулы.
М. : Наука, 1986. 380 с.
2. Гамзазаде А. И., Шлимак В. М., Скляр А. М. и др.
Исследование гидродинамических свойств растворов хитозана // Acta Polymerica. 1985. Т. 36, № 8.
С. 420-424.
3. Гамзазаде А. И., Скляр А. М., Павлова С. А., Рогожин С. В. О вязкостных свойствах растворов хитозана // Высокомолек. соед. 1981. Т. 23 A, № 3. С. 594-597.
4. Скляр А. М., Гамзазаде А. И., Роговина Л. З. и др. Исследование реологических свойств разбавленных и умеренно концентрированных растворов хитозана // Высокомолек. соед. 1981. Т. 23 A, № 6. С. 1396-1403.
5. Погодина Н. В., Павлов Г. М., Бушин С. В. и др. Кон-формационные характеристики молекул хитозана по данным диффузионно-седиментационного анализа и вискозиметрии // Высокомолек. соед. 1986. Т. 28 А, № 2. С. 232-239
6. Pa J. H., Yu T. L. Light scattering study of chitosan in acetic acid aqueous solutions // Macromolec. Chem. and Phys. 2001. Vol. 202, № 7. P. 985-991.
7. Singh J., Dutta P. K. Preparation, circular dichroism induced helical conformation and optical property of chitosan acid complexes for biomedical applications // Intern. J. Biol. Macromol. 2009. Vol. 45, № 4. P. 384-392.
8. Вихорева Г. А., Роговина С. З., Пчелко О. М., Галь-брайх Л. С. Фазовое состояние и реологические свойства системы хитозан-уксусная кислота-вода // Высокомолек. тоед. 2001. Т. 43 Б, № 6. С. 1079-1084.
9. Шиповская А. Б., Фомина В. И., Солонина Н. А. и др. Особенности структурообразования в растворах хитозана // Структура и динамика молекулярных систем : сб. науч. тр. Йошкар-Ола : Изд-во МарГТУ, 2001. Вып. VIII, ч. 2. С. 147-151.
10. Бузинова Д. А., Шиповская А. Б. Сорбционные и бактерицидные свойства пленок хитозана // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2008. Т. 8, вып. 2. С. 42-46.
11. Козырева Е. В., Дмитриев Ю. А., Шиповская А. Б., Коссович Л. Ю. Оценка волокнообразующей способности хитозана по физико-химическим параметрам раствора полимера // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2011. Т. 11, вып. 1. С. 22-25.
12. Дмитриев Ю. А., Шиповская А. Б., Коссович Л. Ю. Электроформование нановолокон из растворов хитозана // Изв. вузов. Химия и хим. технология. 2011. Т. 54, № 6. С. 90-93.
13. Бушин С. В., Астапенко Э. П., Беляева Е. В. и др. Гидродинамические и конформационные свойства молекул ацетомиристината целлюлозы // Высоко-молек. соед. 1999. Т. 41 А, № 6. С. 1021-1026.
14. Бушин С. В., Хрипунов А. К., Безрукова М. А., Астапенко Э. П. Гидродинамические и конформаци-онные свойства молекул миристината целлюлозы в растворе // Высокомолек. соед. 2007. Т. 49 А, № 1. С. 88-95.
15. Паламарчук И. А. Полиэлектролитные взаимодействия лигносульфонатов с полиаминами : автореф. дис. … канд. хим. наук. Архангельск : Архангельск. гос. техн. ун-т, 2009. 20 с.
16. Бровко О. С., Паламарчук И. А., Макаревич Н. А., Бойцова Т. А. Полимолекулярные характеристики лигносульфонатов натрия, хитозана и полиэтилен-полиамина // Химия растительного сырья. 2009. № 1. С. 29-36.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
буферов | Химия
Смесь слабой кислоты и сопряженного с ней основания (или смесь слабого основания и сопряженной с ним кислоты) называется буферным раствором или буфером. Буферные растворы сопротивляются изменению pH при добавлении небольших количеств сильной кислоты или сильного основания (рис. 1). Раствор уксусной кислоты и ацетата натрия (CH 3 COOH + CH 3 COONa) является примером буфера, который состоит из слабой кислоты и ее соли. Примером буфера, который состоит из слабого основания и его соли, является раствор аммиака и хлорида аммония (NH 3 ( водн. ) + NH 4 Cl ( водн. )).
Как работают буферы
Смесь уксусной кислоты и ацетата натрия является кислой, потому что K a уксусной кислоты больше, чем K b ее сопряженного ацетата основания. Это буфер, потому что он содержит как слабую кислоту, так и ее соль. Следовательно, он поддерживает почти постоянную концентрацию иона гидроксония (и pH) путем добавления небольшого количества сильной кислоты или сильного основания. Если мы добавим основание, такое как гидроксид натрия, ионы гидроксида вступят в реакцию с небольшим количеством присутствующих ионов гидроксония.{\ text {-}} \ left (aq \ right) \ longrightarrow {\ text {CH}} _ {3} {\ text {CO}} _ {2} \ text {H} \ left (aq \ right) + {\ text {H}} _ {2} \ text {O} \ left (l \ right) [/ latex]
Таким образом, концентрация иона гидроксония увеличивается очень незначительно, а pH остается практически неизменным (рис. 2).
Рис. 2. На этой диаграмме показано буферное действие этих реакций.
Смесь аммиака и хлорида аммония является основной, потому что K b для аммиака больше, чем K a для иона аммония.{\ text {+}} \ left (aq \ right) + {\ text {H}} _ {2} \ text {O} \ left (l \ right) [/ latex]
Три части следующего примера иллюстрируют изменение pH, которое сопровождает добавление основания к забуференному раствору слабой кислоты и небуферизованному раствору сильной кислоты.
Пример 1
Изменение pH в буферных и небуферизированных растворах
Ацетатные буферы используются в биохимических исследованиях ферментов и других химических компонентов клеток для предотвращения изменений pH, которые могут изменить биохимическую активность этих соединений.{-5} \ right) [/ латекс]
[латекс] = 4,74 [/ латекс]
(b) Рассчитайте pH после добавления 1,0 мл 0,10 M NaOH к 100 мл этого буфера с получением раствора объемом 101 мл.
Во-первых, мы рассчитываем концентрации промежуточной смеси в результате полной реакции между кислотой в буфере и добавленным основанием.{-2} \ text {mol}} {0.101 \ text {L}} = 0,100M [/ латекс]
Теперь мы вычисляем pH после того, как промежуточный раствор, который составляет 0,098 M в CH 3 CO 2 H и 0,100 M в NaCH 3 CO 2 , приходит в равновесие. Расчет очень похож на расчет в части (а) этого примера:
Эта серия расчетов дает pH = 4,75. Таким образом, добавление основания практически не меняет pH раствора (F).
(c) Для сравнения рассчитайте pH после 1.0 мл 0,10 M NaOH добавляют к 100 мл раствора небуферизованного раствора с pH 4,74 (1,8 [латекс] \ раз [/ латекс] 10 −5 — M раствор HCl). . Объем конечного раствора 101 мл.
Решение
Этот 1,8 [латекс] \ times [/ latex] 10 −5 — M раствор HCl имеет ту же концентрацию иона гидроксония, что и раствор 0,10- M буфера уксусной кислоты и ацетата натрия, описанный в части (a ) этого примера.{-4} \ right) = 3,01 [/ латекс]
pH:
[латекс] \ text {pH} = 14,00- \ text {pOH} = 10,99 [/ латекс]
В этом небуферированном растворе pH изменяется от 4,74 до 10,99. Это можно сравнить с изменением с 4,74 до 4,75, которое произошло, когда такое же количество NaOH было добавлено к буферному раствору, описанному в части (b). {\ text {-}} \ right]} {\ left [{\ text {CH}} _ {3} {\ text {CO}} _ {2} \ text {H} \ right]} = \ frac {\ left (x \ right) \ left (0.{\ text {-}} [/ latex], образуя при этом равное количество CH 3 CO 2 H. Сумма молей H + равна 0,034 M [латекс] \ раз [/ латекс] 0,00300 L = 1,02 [латекс] \ раз [/ латекс] 10 -4 моль. Для уксусной кислоты начальные моли составляют 0,2000 M [латекс] \ раз [/ латекс] 0,500 л = 0,1000 моль, а для ацетат-иона 0,600 M [латекс] \ раз [/ латекс] 0,500 л = 0,3000 моль. Таким образом:
моль CH 3 CO 2 H = 0.{\ text {-}} \ right]} {{K} _ {\ text {b}}} = 1 [/ латекс]
K b = [OH — ] = 4,47 [латекс] \ раз [/ латекс] 10 −4
В таблице 2 относительной силы кислот и оснований основание с ближайшим значением K b до 4,47 [латекс] \ раз [/ латекс] 10 -4 представляет собой CH 3 NH 2 , с a K b = 4,4 [латекс] \ раз [/ латекс] 10 -4 .
22. Молярная масса сахарида натрия 205.{-11} M = \ left [\ text {Na} \ left ({\ text {C}} _ {7} {\ text {H}} _ {4} {\ text {NSO}} _ {3} \ right) \ right] [/ латекс]
Уксусная кислота + хлорид натрия — Sandvik Materials Technology
Эти данные о коррозии в основном основаны на результатах общих лабораторных испытаний на коррозию, проводимых с чистыми химическими веществами и водными растворами, почти насыщенными воздухом (скорость коррозии может быть совершенно иной, если раствор не содержит кислорода).
Все концентрации даны в% по массе, а растворителем является вода, если не указано иное.Данные по коррозии относятся ко всем отожженным материалам с нормальной микроструктурой и чистыми поверхностями.
Разъяснение символов
| Конц. CH 3 COOH,% | 1 | 1 | 3 | 4 | 7 | 7-10 | 10 | 10 | 25 |
|---|---|---|---|---|---|---|---|---|---|
| Конц. NaCL,% | 1 | 5 | 4 | 1 | 5 | 8.5 | 5 | 26 | 26 |
| Темп. ° С | 70 | 50 | Б.П. | 70-ВР | 70 | 80 | Б.П. | Б.П. | Б.П. |
| Марка или тип сплава: | |||||||||
| Углеродистая сталь | 2 | ||||||||
| 13 Cr | 2 | ||||||||
| Sandvik 3R12 | 0ps | 0ps | 1 шт. | 1 шт. | 1 шт. | ||||
| Sandvik 3R60 | 0ps | 0п | 0ps | 0ps | 0ps | 0ps | 0ps | 1 шт. | 1 шт. |
18Cr13Ni3Mo 1) | 0ps | 0п | 0ps | 0ps | 0ps | 0ps | 0ps | 1 шт. | 1 шт. |
17Cr14Ni4Mo 2) | 0ps | 0п | 0ps | 0ps | 0ps | 0ps | 0ps | 1 шт. | 1 шт. |
| Sandvik 2RK65 (‘904L’) | 0ps | 0п | 0ps | 0ps | 0ps | 0ps | 0ps | 1 шт. | 1 шт. |
| Sanicro 28 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0п | 0п |
| 254 СМО | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 654 СМО | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Sandvik SAF 2304 | 0 | 0 | 0 | 0п | 0 | 0 | 0 | 2 | |
| Sandvik SAF 2205 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1п | |
| Sandvik SAF 2507 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Титан (CP Ti) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
1) ASTM 317L, e.грамм. Sandvik 3R64
2) EN 1.4439, например Sandvik 3R68
Разъяснение символов
В этих таблицах коррозии используется ряд символов, имеющих следующие значения:
| Символ | Описание |
|---|---|
| 0 | Скорость коррозии менее 0,1 мм / год. Материал устойчив к коррозии. |
| 1 | Скорость коррозии 0,1… 1,0 мм / год.Материал не устойчив к коррозии, но в определенных случаях может пригодиться. |
| 2 | Скорость коррозии более 1,0 мм / год. Серьезная коррозия. Материал непригоден для использования. |
| п, п.н. | Риск (серьезный риск) точечной и щелевой коррозии. |
| c, C | Риск (высокий риск) щелевой коррозии. Используется, когда есть риск локальной коррозии, только при наличии щелей. В более тяжелых условиях, когда также существует риск точечной коррозии, вместо этого используются символы p или P. |
| с, S | Риск (высокий риск) коррозионного растрескивания под напряжением. |
| иг | Риск межкристаллитной коррозии. |
| БП | Кипящий раствор. |
| ND | Нет данных. (Используется только при отсутствии фактических данных для оценки риска локальной коррозии вместо p или s). |
Заявление об ограничении ответственности: Лабораторные испытания не могут быть полностью сопоставимы с фактическими условиями эксплуатации.Соответственно, Sandvik не дает никаких гарантий, явных или подразумеваемых, и не принимает на себя никаких обязательств, компенсационных или косвенных, за работу различных материалов в отдельных приложениях, которые могут быть основаны на информации, представленной в этой публикации.
Какое сбалансированное уравнение реакции уксусной кислоты и NaOH?
Уксусная кислота # «CH» _3 «COOH» # будет реагировать с гидроксидом натрия # «NaOH» # с образованием ацетата натрия # «CH» _3 «COONa» # и воды.
несбалансированное химическое уравнение , описывающее эту реакцию нейтрализации выглядит так:
# «CH» _ 3 «COOH» _ ((вод.)) + «NaOH» _ ((вод.)) -> «CH» _ 3 «COONa» _ ((вод.)) + «H» _ 2 «O «_ ((l)) #
Теперь вы можете проверить, сбалансировано ли это химическое уравнение, подсчитав количество атомов каждого элемента, присутствующего на обеих сторонах уравнения, или вы можете проверить, используя тот факт, что гидроксид натрия представляет собой сильное основание .(-) + цвет (красный) («H» _ 2 «O» _ ((l))) #
Обратите внимание, что на стороне реагентов есть недиссоциированный ацетат-анион, а на стороне продуктов — диссоциированный ацетат-анион, поэтому здесь нечего балансировать.
Точно так же на стороне реагентов есть недиссоциированный протон и диссоциированный гидроксид-анион, а на стороне продуктов есть молекула воды, так что здесь снова нечего балансировать.
Следовательно, вы можете сказать, что сбалансированное химическое уравнение , которое описывает это соотношение, выглядит так:
# «CH» _ 3 «COOH» _ ((вод.)) + «NaOH» _ ((вод.)) -> «CH» _ 3 «COONa» _ ((вод.)) + «H» _ 2 «O «_ ((l)) #
Моногидрат натриевой соли (2,4-дихлорфенокси) уксусной кислоты
Обзор
Название продукта
Моногидрат натриевой соли (2,4-дихлорфенокси) уксусной кислоты, синтетический ауксин
Описание
Синтетический ауксин (растительный гормон), используемый в средах для культивирования клеток растений
Альтернативные названия
- Моногидрат натриевой соли 2,4-Д
- Моногидрат натриевой соли 2,4-дихлорфеноксиуксусной кислоты
- Моногидрат 2,4-дихлорфеноксиацетата натрия
Биологическое описание
Синтетический ауксин (растительный гормон), используемый в средах для культивирования растительных клеток.Широко используемый гербицид.
Чистота
> 98%
Номер CAS
7084-86-8
Химическая структура
Недвижимость
Химическое название
Моногидрат натриевой соли (2,4-дихлорфенокси) уксусной кислоты
Молекулярный вес
261.03
Химическая формула
C 8 H 5 Cl 2 NaO 3 .H 2 O
Инструкции по хранению
Хранить при -20 ° C. Хранить при обезвоживании. Срок хранения до 12 месяцев.
Обзор растворимости
Растворим в воде до 100 мМ
Погрузочно-разгрузочные работы
По возможности, вы должны готовить и использовать растворы в тот же день.Однако, если вам необходимо заранее приготовить исходный раствор, мы рекомендуем хранить раствор в виде аликвот в плотно закрытых флаконах при -20 ° C. Как правило, их можно использовать до одного месяца. Перед использованием и перед открытием флакона мы рекомендуем дать вашему продукту уравновеситься до комнатной температуры в течение как минимум 1 часа.
Нужна дополнительная информация о растворимости, использовании и обращении? Посетите нашу страницу часто задаваемых вопросов (FAQ) для получения более подробной информации.
Источник
Изображения
Химическая структура — моногидрат натриевой соли (2,4-дихлорфенокси) уксусной кислоты, синтетический ауксин (ab146010)
2D изображение химической структуры ab146010, моногидрат натриевой соли (2,4-дихлорфенокси) уксусной кислоты, синтетический ауксин
Протоколы
Насколько нам известно, для этого продукта не требуются индивидуальные протоколы.Пожалуйста, попробуйте стандартные протоколы, перечисленные ниже, и сообщите нам, как у вас дела.
Щелкните здесь, чтобы просмотреть общие протоколы
Листы данных и документы
SDS скачать
Страна / регион Выберите страну / регион
Язык Выбор языка
Скачать брошюру
Список литературы (0)
ab146010 еще не упоминался в каких-либо публикациях.
Мнения клиентов, вопросы и ответы
Ацетат натрия Формула
Ацетат натрия, также известный как этаноат натрия (сокращенно NaOAc), представляет собой натриевую соль уксусной кислоты, которая широко используется в пищевой, текстильной, фармацевтической и химической промышленности.
Формула и структура: Химическая формула ацетата натрия — CH 3 COONa. Его молекулярная формула C 2 H 3 NaO 2 , а его молярная масса составляет 82.03 г моль -1 . Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Встречаемость: Ацетат натрия естественным образом встречается в тканях растений и животных. Эта соль может быть в безводной или тригидратированной форме. Оба иона, Na + и CH 3 COO — , присутствуют в организмах и выполняют жизненно важные роли: ион натрия как регулятор общей воды в организме и ион ацетата как акцептор водорода.
Получение: Ацетат натрия можно получить с помощью очень простой и дешевой реакции, состоящей в нейтрализации уксусной кислоты. Для синтеза используют уксус (уксусная кислота 5-8%) или ледяная уксусная кислота, стиральная сода (карбонат натрия) или пищевая сода (бикарбонат натрия) или гидроксид натрия. Когда реакция включает карбонат или бикарбонаты натрия, она дает угольную кислоту и ацетат натрия. Угольная кислота при нормальных условиях легко разлагается на диоксид углерода и воду.Если реакцию готовят с гидроксидом натрия, единственными продуктами будут ацетат натрия и вода.
CH 3 COOH + NaHCO 3 → CH 3 COONa + H 2 CO 3
H 2 CO 3 → CO 2 + H 2 O
CH 3 COOH + NaOH → CH 3 COONa + H 2 O
Физические свойства: Ацетат натрия представляет собой гигроскопичный белый кристаллический порошок с запахом винегра (уксусной кислоты).Его температура плавления составляет 324 ºC. Его плотность 1,5 г / мл -1 . Ацетат натрия хорошо растворяется в воде (растворимость составляет 46,5 г ацетата натрия в 100 мл воды).
Химические свойства: Ацетат натрия представляет собой конъюгированное основание с уксусной кислотой, поэтому раствор уксусной кислоты / ацетата натрия можно использовать для приготовления буферных растворов для контроля pH. Раствор ацетата натрия в воде слабощелочной. Когда температура превышает 324 ºC, эта соль разлагается с образованием паров уксусной кислоты.
Применение: Ацетат натрия широко используется в пищевой, фармацевтической и химической промышленности. В пищевой промышленности ацетат натрия добавляют в качестве приправы из-за его уксусного вкуса. Например, в картофельных чипсах фри используется как соль и уксусный ароматизатор. Раствор ацетата натрия используется как лекарственная альтернатива хлориду натрия для обеспечения организма ионами натрия (Na + ).
Как указано в химических свойствах, ацетат натрия используется в буферных растворах, особенно в биохимических и фармацевтических целях.Кроме того, ацетат натрия используется для нейтрализации отходов серной кислоты в текстильной промышленности.
Воздействие на здоровье / опасность для здоровья: Ацетат натрия стабилен. Несовместим с сильными окислителями. Эта соль слегка раздражает глаза, кожу и дыхательные пути.
Натриевая соль индол-3-уксусной кислоты | CAS 6505-45-9 | SCBT
Натриевая соль индол-3-уксусной кислоты | CAS 6505-45-9 | SCBT — Santa Cruz Biotechnology Натриевая соль индол-3-уксусной кислоты CAS: 6505-45-9MF: C10H8NNaO2
MW: 197.17
- Дом
- Химические вещества
- Общие лабораторные реактивы
- Аналитические стандарты
- Натриевая соль индол-3-уксусной кислоты
Альтернативные имена: Натриевая соль индол-3-уксусной кислоты также известна как гетероауксин.
Количество CAS: 6505-45-9
Чистота: > 98%
Молекулярный вес: 197,17
Молекулярная формула: С 10 H 8 NNaO 2
Только для исследовательского использования.Не предназначено для диагностического или терапевтического использования.
* См. Сертификат анализа для получения данных по партии (включая содержание воды).Натриевая соль индол-3-уксусной кислоты является регулятором роста растений и представляет собой полезный стандарт для анализа этих путей роста.Натриевая соль индол-3-уксусной кислоты вызывает деление и удлинение клеток, что способствует росту растений. Индол-3-уксусная кислота, также известная как гетероауксин, относится к классу ауксинов естественных растительных гормонов. Индол-3-уксусная кислота в высоких концентрациях оказывает ингибирующее действие на рост, включая эпинастию. Высококонцентрированная индол-3-уксусная кислота также может предотвращать рост «побегов и корней», эффекты которого легли в основу создания синтетических ауксинов в качестве гербицидов.
Ссылки
1.Сомеи М., Кизу К., Кунимото М. и др. Химия индолов. XXIV. Синтезы 3-индолуксусной кислоты и 3-индолацетонитрила, имеющих галогеногруппу и углеродную функциональную группу в 4-положении. Chemical & Pharmaceutical Bulletin 33, 3696-3708 (1985).
2. Хансен, Х. и Гроссманн, К. Этилен, индуцированный ауксином, запускает биосинтез абсцизовой кислоты и ингибирует рост. Физиология растений 124 (3), 1437-1448 (2000).
Растворимость :
Растворим в воде
Только для исследовательского использования.Не предназначено для диагностического или терапевтического использования.
Улыбки :
C1 = CC = C2C (= C1) C (= CN2) CC (= O) O.Na
Adobe Acrobat Reader требуется для надежного просмотра, печати
и комментирования PDF-документов.
Натриевая соль индол-3-уксусной кислоты (CAS 6505-45-9) Цитаты на продукцию
Посмотрите, как другие использовали натриевую соль индол-3-уксусной кислоты (CAS 6505-45-9).Щелкните запись, чтобы просмотреть запись в PubMed. .
Цитирования с 1 на 7 из 7 всегоPMID: # 33481779 Prasanna, X. | Salo, VT. | Li, S. | Ven, K. | Vihinen, H. | Jokitalo, E. | Vattulainen, I. | Ikonen, E. | et al. 2021. PLoS Biol. 19: e3000998.
PMID: # 31178403 Сало, ВТ.| Ли, С. | Вихинен, Х. | Хёлття-Вуори, М. | Скалисити, А. | Хорват, П. | Белевич, И. | Перянен, Дж. | Тиле, К. | Сомерхарью, П. | Чжао, Х. | Сантиньо, А. | Тиам, АР. | Йокитало, Э. | Иконен, Э. | et al. 2019. Dev Cell. 50: 478-493.e9.
Цитирования с 1 на 7 из 7 всегоКак долго химикат (6505-45-9) может быть доставлен в Филадельфию?
Спросил: Ичэнь Ли
Спасибо Вам за Ваш вопрос.Пожалуйста, свяжитесь с нашим отделом обслуживания клиентов, чтобы узнать о наличии продукта.Отвечено: Техническая поддержка
Дата публикации: 2019-01-26
Оценка 5 из 5 по SH из Бейлби MJ; и другие Бейлби MJ; и другие. (PubMed ID: 26382914) использовали натриевую соль индол-3-уксусной кислоты в качестве маркера для измерения циркадного ритма у Characeae australis Brown. -SCBT Обзор публикацииДата публикации: 16.01.2015
Santa Cruz Biotechnology, Inc.является мировым лидером в разработке продуктов для рынка биомедицинских исследований. Позвоните нам по бесплатному телефону 1-800-457-3801 .
Copyright © 2007-2021 Santa Cruz Biotechnology, Inc. Все права защищены. «Santa Cruz Biotechnology» и логотип Santa Cruz Biotechnology, Inc., «Здоровье животных Санта-Крус», «San Juan Ranch», «Дополнение чемпионов», логотип San Juan Ranch, «Ultracruz», «Chemcruz», » Immunocruz «,» Exactacruz «и» EZ Touch «являются зарегистрированными товарными знаками Santa Cruz Biotechnology, Inc.
Все товарные знаки являются собственностью соответствующих владельцев.
Получена ваша подписка на рассылку новостей и объявлений по электронной почте. Регистрируясь, вы подтверждаете, что прочитали и согласны с условиями нашей политики конфиденциальности. Вы имеете право отказаться от подписки в любое время, щелкнув ссылку «отказаться от подписки» в любом полученном вами электронном письме с новостями и объявлениями.
Чтобы разместить заказ с использованием юаней или отправить товар в континентальный Китай, посетите сайт www.


Leave A Comment