Что такое овоцит 1 и 2 порядка
Призвание женщины – стать матерью. Но, к сожалению, иногда случаются сбои в репродуктивной функции. Яйцеклетка не формируется, не созревает и, следовательно, беременность невозможна. Такая причина бесплодия были поводом отчаяния для многих женщин. Но современная медицина предлагает надёжный и безопасный способ решить эту проблему. Донацию ооцитов бесплодным женщинам применяют по всему миру. Эта процедура абсолютно безопасна для донора и даёт женщине – реципиенту все шансы на успешное оплодотворение.
Российский центр доноров ооцитов предлагает широкий выбор доноров женщинам, нуждающимся в лечении бесплодия с применением донорских яйцеклеток. Обращайтесь к вам — и мы обязательно вам поможем!
Что такое ооциты?
Огромное количество ооцитов девочка получает уже при рождении. Это — те же самые яйцеклетки, но только незрелые. До полового созревания они находятся в «состоянии сна». Частично ооциты атрофируются и погибают. Однако при достижении девушкой детородного возраста остаются достаточно полноценные, способные к дальнейшему развитию яйцеклеток.
Женский организм так устроен, что в естественных условиях ежемесячно начинают развиваться несколько ооцитов. Но созревает лишь одна полноценная яйцеклетка, способная к оплодотворению. Если зачатия не происходит, то клетка становится ненужной и удаляется из организма с другими атрофированными ооцитами с менструацией. Примерно один овоцит из тысячи созревает полностью и способен быть оплодотворённым. Теоретически в детородный период женщина может стать матерью 300-400 раз. Именно такое количество полноценных ооцитов вырабатывают яичники женщины с момента полового созревания и до климакса в период овуляции.
Существуют причины, которые могут нарушить эту природную функцию:
При некоторых наследственных заболеваниях рекомендуется донорство яйцеклетки во избежание передачи заболевания плоду.
Ооциты 1 порядка и ооциты 2 порядка
Стадии развития яйцеклетки разделяют на первый и второй порядок. Овоцит 1 порядка – это незрелая яйцеклетка, которая неспособна к быстрому развитию и оплодотворению вплоть до детородного возраста девочки, фактически до первой менструации. Большое количество ооцитов первого порядка деградируют и становятся бесполезными. Выжившая яйцеклетка под действием половых гормонов периодически совершает первое деление мейоза и превращается в овоцит 2 порядка. При первом делении яйцеклетке достаются все питательные вещества, а отделившаяся часть погибает. При повторном делении овоцит превращается в самую большую клетку организма – зрелую яйцеклетку. Это самый удачный момент для зачатия. Клетка начинает двигаться в сторону матки по маточным трубам. Достигнув «пункта назначения», она либо закрепится во внутреннем слизистом слое (в случае успешного оплодотворения) и начнет своё развитие на ближайшее 9 месяцев, либо погибнет (если оплодотворения не произойдет) и будет выведена с менструацией.
Если женский организм по каким-то причинам не доводит этот биологический процесс до логического завершения, целесообразно прибегнуть к донорству яйцеклетки. Это безопасная процедура и она даёт возможность женщине-реципиенту почувствовать все радости материнства, начиная от зачатия. Беременность, полученная после оплодотворения донорской яйцеклетки, ничем не отличается от естественной и протекает без каких-либо отклонений.
Важный этап в процессе донорства яйцеклетки – выбор клиники. От профессионализма врачей зависит здоровье матери и будущего ребёнка. Весь процесс должен происходить под бдительным контролем.
Специалисты «Российского центра доноров» помогут выбрать авторитетную, проверенную клинику в любом городе России.
Ооциты и оогенез — что это? Этапы оогенеза
Ооциты: что это такое
Ооциты – это основные элементы репродуктивной женской системы, которые дают возможность зарождения новой жизни. Можно сказать, что они являются одной из стадий развития яйцеклеток. Выделяют ооциты первого и второго порядка.
Ооциты первого порядка – это клетки, которые образовались в результате митотического деления первичных половых клеток (оогоний) и накопили достаточное количество питательных веществ, они появляются во внутриутробном периоде и остаются неизменными вплоть до полового созревания (12-15 лет). К моменту рождения в яичниках содержится порядка 2 миллионов ооцитов, большинство из которых никогда не продолжат дальнейшее развитие до полноценной яйцеклетки и погибнут. Все процессы деления пройдут лишь 400-500 ооцитов. Для чего необходима столь избыточная продукция половых клеток и почему значительное их количество погибает, до сих пор неизвестно.
Ооциты второго порядка – это клетки, которые образовались в результате завершения 1 профазы мейоза ооцитов первого порядка. Мейоз – это процесс деления половых клеток, который делает их гаплоидными (они содержат только 1 набор хромосом). 1 профаза мейоза начинается после полового созревания и стимулируется различными факторами, в частности половыми гормонами.
В 1 профазу мейоза одновременно вступает порядка 15000-20000 ооцитов первого порядка, но завершает процесс только 1 клетка. Все остальные редуцируются и погибают. Затем ооциты второго порядка вступают во 2 профазу мейоза и формируют зрелую яйцеклетку, готовую к оплодотворению.
Ооциты второго порядка, которые формируются в конце репродуктивного периода, могут быть неполноценными и дефектными. Ведь они образуются из ооцитов первого порядка, живущих примерно 40-50 лет, а в процессе их существования могут происходить разнообразные генетические сбои и другие неблагоприятные явления. Поэтому число случаев аномалий развития у детей, рожденных после 40 лет, значительно увеличивается.
Оогенез
Оогенез – процесс развития женских половых клеток. Он принципиально отличается от сперматогенеза — процесса формирования мужских половых клеток. Конечно, сперматозоиды и ооциты (яйцеклетки) образуются в результате митоза и мейоза первичных зародышевых клеток, но при этом сперматозоиды являются высокодифференцированными клетками, которые в основном содержат лишь генетический материал, а яйцеклетки, помимо генов, включают все необходимые элементы для эмбрионального роста. Таким образом, ооциты – это большие малодифференцированные клетки, состоящие из множества структурных белков, ферментов и питательных веществ.
Помимо этого, есть количественные различия между процессами гаметогенеза, ведь мужчина продуцирует порядка 30 миллионов сперматозоидов в сутки, а ооциты закладываются еще до рождения, при этом зрелыми яйцеклетками становятся только ~500 из них.
Первичные половые клетки – оогонии — попав в яичники, начинают активно размножаться путем митоза и формируют примордиальные фолликулы и ооциты первого порядка. Затем они подвергаются процессу мейоза: в первой фазе образуются ооциты второго порядка, в конце 2 – зрелые и полноценные яйцеклетки, которые выходят из фолликула и происходит овуляция.
Зрелая клетка содержит большой запас питательных веществ и микроэлементов, необходимых для развития эмбриона в первое время. Размеры яйцеклеток отличатся от других клеток организма, у людей они достигают 60-2000 мкм, у рыб – 6-9 мм, у страуса – несколько сантиметров.
Этапы оогенеза
Оогенез делится на несколько последовательных этапов.
Первый этап – это перемещение первичных половых клеток в гонады и их размножение. Первоначально образуется несколько десятков половых клеток, но по мере их продвижения в яичники они активно делятся и их число возрастает до нескольких тысяч. В гонадах они также продолжают размножаться путем митоза, в результате к 7 месяцу внутриутробного развития насчитывается порядка 7 млн. оогоний. Но большая часть погибает еще до рождения, поэтому их остается лишь 2 млн.
Клетки, которые завершили деление путем митоза, вступают в новый этап оогенеза. Теперь они называются – ооциты первого порядка. С момента рождения девочки они остаются без изменений вплоть до полового созревания. Стоит отметить, что большая часть ооцитов никогда не вступают в дальнейший этап и только 400-500 завершают свое развитие. Еще во время эмбрионального развития некоторые ооциты первого порядка вступают в первую профазу мейоза, но не завершают ее до полового созревания. Они накапливают питательные вещества и увеличиваются в размерах. При этом они покрываются слоем фолликулярных клеток, образуя примордиальные фолликулы.
Второй этап – первая профаза мейоза, в результате которой формируется ооцит второго порядка и редукционное тельце. Под действием половых гормонов завершается процесс, который начался еще до рождения. В результате деления происходит неравномерное разделение цитоплазмы, большая ее часть остается в ооците, а редукционное тельце содержит в основном только ядро. Ооциты второго порядка обладают гаплоидным набором хромосом.
Третий этап – вторая профаза мейоза, которая приводит к формированию полноценной яйцеклетки, готовой к оплодотворению. Ооциты второго порядка вновь неравномерно делятся, образуется яйцеклетка и редукционное тельце, первое тельце также разделяется. В итоге после завершения процесса оогенеза формируется 3 редукционных тельца и яйцеклетка.
Качество ооцитов и как его улучшить
Ооциты должны содержать большое количество питательных веществ и гаплоидный набор хромосом для осуществления зачатия. Часто женское бесплодие связано с низким качеством ооцитов. На сегодняшний момент времени не разработано эффективного лечения по устранению этого фактора. Хотя женщинам в период планирования беременности рекомендуется принимать мультивитамины, в частности фолиевую кислоту и витамин Е, морепродукты, рыбий жир, которые необходимы для полноценного эмбрионального развития. Также следует отказаться от алкоголя и курения, кофе, жареного, черного чая, наладить ритм жизни, соблюдать режим труда и отдыха.
Многие специалисты считают, что окислители и свободные радикалы могут существенно снизить качество ооцитов. С целью предотвращения негативного воздействия назначают мелатонин, который противодействует окислительному процессу.
Ооциты и их доноры
В наше время для многих последняя надежда на долгожданную беременность – вспомогательные репродуктивные технологии: ЭКО, ИКСИ и другие. Но иногда возникают ситуации, когда у женщины невозможно получить полноценные яйцеклетки:
- Менопауза или раннее ее наступление;
- Неразвитые гонады и их отсутствие;
- Химиорадиотерапия;
- Наследственные заболевания, передающиеся по женской линии;
- Множественные неудачные попытки ЭКО.
Единственной возможностью для женщины самостоятельно выносить ребенка – обратиться к донору ооцитов. К донорам предъявляются довольно жесткие требования: они должны быть соматически, физически и психически здоровы. В некоторых европейских странах такой метод лечения запрещен в силу этических и религиозных соображений.
Иногда женщина, согласившись передать свои ооциты, не знает – теряет ли она что-то безвозвратно. Но в случае донорства используются клетки, которые никогда не будут использованы во время жизни, следовательно, процедура не приводит к уменьшению собственных запасов. Часто бесплодные пары приводят своих доноров ооцитов: ими могут быть близкие родственники, друзья или знакомые. Но у всех есть возможность обратиться в банк доноров, в них включаются женщины в возрасте от 18 до 35 лет, у которых уже есть ребенок, они полностью дееспособны и прошли полное медицинское обследование. Также в этом банке можно подобрать донора с определенными внешними признаками: цвет глаз, рост, телосложение и другие.
Следует отметить, что многие женщины, воспользовавшись донорскими ооцитами, после приживления эмбрионов и наступления беременности забывают, что генетически ребенок имеет родство только с мужчиной. Но к этому решению следует приходить обдуманно, взвесив все достоинства, недостатки и обсудив с супругом.
Пройти полное обследование, сдать необходимые анализы и получить ответы на интересующие вас вопросы вы можете в клинике «Центр ЭКО» в Смоленске.
Образование половых клеток — урок. Биология, Общие биологические закономерности (9–11 класс).
Гаметогенез — процесс образования и развития половых клеток.
У многоклеточных водорослей, многих грибов и споровых растений гаметы образуются в специальных органах полового размножения: женские — в архегониях, мужские — в антеридиях.
У большинства животных образование гамет происходит в половых железах: сперматозоиды формируются в семенниках, а яйцеклетки — в яичниках.
Существуют раздельнополые и обоеполые виды. Раздельнополые организмы продуцируют только один вид гамет, обоеполые — оба вида.
Гермафродиты — обоеполые организмы, способные образовывать и мужские, и женские половые клетки.
Гермафродитизм возник как приспособление к сидячему, малоподвижному или паразитическому образу жизни. Он встречается у кишечнополостных, плоских и кольчатых червей, моллюсков и у большинства растений.
Преимуществом гермафродитизма является возможность самооплодотворения при наличии только одной особи. Но у большинства гермафродитных организмов происходит перекрёстное оплодотворение между разными особями.
Гаметогенез у высших животных
Сперматогенез происходит в семенниках. В них имеются семенные канальцы, в которых образуются и развиваются сперматозоиды.
В процессе образования сперматозоидов выделяют четыре периода (стадии): размножение, рост, созревание и формирование.
В период размножения первичные половые клетки (сперматогонии) многократно делятся митозом. При этом сохраняется диплоидный набор хромосом \(2n2c\).
Затем наступает период роста: образовавшиеся клетки несколько увеличиваются в размерах, в них удваиваются молекулы ДНК. Сперматогонии превращаются в сперматоциты первого порядка с хромосомным набором \(2n4c\).
В период созревания происходят два деления мейоза. После первого деления из одного сперматоцита первого порядка образуются два сперматоцита второго порядка (\(1n2c\)), а после второго — четыре сперматида (\(1n1c\)).
В период формирования сперматиды преобразуются в сперматозоиды.
Обрати внимание!
При сперматогенезе из одной первичной половой клетки образуются четыре сперматозоида.
Оогенез (овогенез) происходит в яичниках и в отличие от сперматогенеза начинается ещё до рождения женского организма.
В процессе образования яйцеклеток выделяют три периода (стадии): размножение, рост и созревание.
В период размножения первичные половые клетки (оогонии) делятся митозом. При этом диплоидный набор хромосом \(2n2c\) сохраняется, но клеток образуется значительно меньше, чем при сперматогенезе. Период размножения заканчивается до рождения женской особи. К этому времени образуется около \(30\) тысяч первичных половых клеток.
У половозрелой женской особи периодически начинается дальнейшее развитие отдельных оогоний. В период роста объём клетки значительно увеличивается за счёт синтеза и накопления веществ. Происходит удвоение ДНК. Образуется ооцит первого порядка (\(2n4c\)).
В период созревания происходит два деления мейоза. После первого деления из одного ооцита первого порядка образуются одна крупная гаплоидная клетка (ооцит второго порядка (\(1n2c\))) и одна маленькая (полярное, или направительное, тельце).
Образовавшийся ооцит выходит из яичника в брюшную полость и попадает в маточную трубу — происходит овуляция.
В маточной трубе клетка совершает второе мейотическое деление, в результате которого ооцит образует яйцеклетку (\(1n1c\)) и ещё одно полярное тельце. Первое полярное тельце, как правило, тоже делится.
Обрати внимание!
При оогенезе из одной первичной половой клетки образуются одна яйцеклетка и три полярные тельца, которые вскоре разрушаются.
Источники:
Иллюстрации:
900igr.net
Яйцеклетка | Info-Farm.RU
Ооцит (также овоцит, от греч. Ōón — яйцо, греч. Kýtos — клетка), яйцеклетка — большая неподвижная женская половая клетка (гамета) оогамных видов. Сливаясь со сперматозоидом, яйцеклетка образует зиготу, из которой формируется новый организм.
Характерными особенностями яйцеклеток являются большие размеры (не только по сравнению со сперматозоидом, но и с другими клетками организма), а также неспособность активно двигаться.
Ооцит — это высокоспециализированная клетка: его строение, состав и оболочки направлены на оплодотворение и образование зиготы. Во время оплодотворения оболочки яйцеклетки приводят к тому, что только один из многих сперматозоидов попадает внутрь ооцита, а содержание яйцеклетки и накопленные питательные вещества в виде желтка формируют полярность будущего зародыша.
Формирование яйцеклетки проходит много стадий, мейотическое деление и созревание, на разных стадиях ооцит имеет свою характерную название, термин «яйцеклетка» употребляется начиная с первичного ооцита и к оплодотворению.
Не все виды могут размножаться половым путем (некоторые размножаются только бесполым), а также не все организмы, способные к размножению половым путем, образуют ооциты и сперматозоиды. Так, в изогамный видов (например, в пивных дрожжей) гаметы одинаковы по форме и подвижностью и в них не различают ооциты и сперматозоиды. Таким образом, только оогамных виды могут формировать яйцеклетки.
История открытия
Оплодотворение и развитие нового организма были темой для размышлений задолго до того, как человечество начало познавать процесс зарождения жизни с помощью научных методов. Было понятно, что новый организм формируется после полового акта, но вклад женского и мужского родительских организмов в течение истории человечества считался разным. Например, Гиппократ (V-IV вв. До н. Э.) Считал, что оба родителя вкладывают равноценные доли, которые формируют эмбрион в матке матери, тогда как Аристотель полагал, что мать только предоставляет место для развития эмбриона, тогда как весь материал зародыша идет от отца. Взгляд Аристотеля доминировал вплоть до XVII века н. е. Тогда большой вклад в развитие медицины, в частности, эмбриологии, сделали выдающиеся ученые Гарвей, Ян ван Горн (нидерл. Jan van Horne), Сваммердам, Николас Стено, Ренье де Грааф и Франческо Реди. Результатом их работы стала теория, что все самки в том числе и человека, производят яйцеклетки. Именно Уильяму Гарвею приписывают авторство известной фразы «все от яйца» (лат. Ex ovo omnia).
1677 Левенгук сконструировал микроскоп, с помощью которого изучал, в частности, мужскую сперму и впервые увидел сперматозоиды. Таким образом было установлено наличие как мужских, так и женских половых клеток, но роль каждой из них в образовании зародыша была предметом дискуссий примерно 200 лет. И только в начале XIX века Маттиас Шлейден и Шванн выяснили, что как сперматозоид, так и яйцеклетка одинаково необходимы для формирования зародыша. Этому утверждению способствовала установлена под микроскопом наличие яйцеклетки млекопитающих, сделанная Карлом фон Бером. 1876 Оскар Гертвиг впервые наблюдал оплодотворения морских ежей и установил, что ядра сперматозоида и яйцеклетки сливаются во время оплодотворения. Эдуард ван Бенеден конце 19 века описал созревания яйца до стадии бластоцисты, а Иоганнес Соботта опубликовал детальную работу о создании ооцита, оплодотворение и деление мышиного эмбриона.
Строение
Строение яйцеклетки у разных организмов очень разная. Различия могут быть на уровне от классов к видовых особенностей. На строительство яйцеклетки значительно влияют характерные черты среды, где она будет ожидать оплодотворения, и стратегия размножения вида в целом. От этих факторов зависит размер яйцеклетки, строение оболочки, размещенные в цитоплазме различных факторов и тому подобное. Ниже приведены обобщенные особенности строения яйцеклетки с некоторыми конкретными примерами.
Ооцит во время оплодотворения предоставляет половину генетического материала зародыша, другую половину приносит сперматозоид. Но яйцеклетка содержит почти всю цитоплазму будущей зиготы — сперматозоид обеспечивает лишь ЦЕНТРОС или ее части. Поэтому состав ооцита и размещения в его цитоплазме различных РНК и белков имеют большое значение для эмбриогенеза.
Цитоплазма яйцеклетки, ооплазмы, содержит большое количество:
- РНК, как мРНК и различных видов нкРНК;
- белков с различными функциями: питательных, защитных, тех, что могут влиять на дальнейшую дифференциацию клеток зародыша во время дробления и гаструляции;
- питательных веществ: желток;
- защитных веществ:
- антител (у птиц)
- веществ, защищают от ультрафиолетового излучения, такие, как микоспорин-образные аминокислоты;
- белки, репарують ДНК, у организмов с внешним оплодотворением (таких как амфибии) специфический фермент фотолиаза, что репаруе ДНК после воздействия ультрафиолета;
- веществ, защищающих от хищников. Их разделяют на физические — оболочки яйцеклетки, такие как скорлупа, и химические вещества, такие как пиролизидиновий алкалоид в моли Utetheisa ornatrix;
- веществ, защищающих яйцеклетку от необычных неблагоприятных условий. Так, у некоторых видов лягушек (Rheobatrachus) созревание яйца происходит в желудочно-кишечном тракте. Для предотвращения деградации клетки под действием пищеварительных ферментов и кислого pH, яйцо выделяет ингибиторы высвобождения кислот из желудка. Природа этих ингибиторов точно не известна, однако их компонентом является простагландин E2;
- факторов транскрипции;
- специфических везикул: базальных, апикальных, кортикальных и ехинонектинових (англ. echinonectin), назначение которых заключается в защите яйцеклетки от полиспермии — попадание в клетки больше, чем одного сперматозоида.
У некоторых видов размещения этих факторов четко определены и они занимают определенную часть ооплазмы
Ядро яйцеклетки у большинства животных диплоидное, завершение мейоза происходит после оплодотворения, однако у некоторых видов, таких как морские ежи, мейоз завершается к оплодотворению и формируется гаплоидны ядро - пронуклеусов, тогда как в большинстве видов женский и мужской пронуклеусы формируются уже после оплодотворения.
Размеры яйцеклеток очень сильно варьируют в зависимости от класса животных. В плацентарных млекопитающих размеры яйцеклетки на стадии Граафивського пузырька, когда рост уже завершился и яйцеклетка готова к овуляции, скала от 60-130 мкм в диаметре тогда как у птиц размеры яиц очень большие — у страуса яйцо весит в среднем 1,45-1,65 кг .. Поэтому именно эти птицы имеют наибольшие абсолютные размеры яйцеклеток всех живых организмов. У морского ежа размеры женских гамет средние, объем яйцеклетки составляет 2 × 10 -4 мм 3, что превышает объем сперматозоида на 4 порядка.
Цитоплазму окружают несколько оболочек яйцеклетки.
Оболочки яйцеклетки
Кортикальный слой
Кортикальный слой не является отдельной оболочкой, а является структурой внутри ооплазмы яйцеклетки. Он состоит из большого количества кортикальных гранул, прилегающих к плазмалеммы. Когда сперматозоид попадает в яйцеклетку, содержание кортикальных гранул секретируется в перивителиновий пространство, разделяющее яйцеклетку и вителинову оболочку (блестящую оболочку млекопитающих) и делает яйцеклетку непроницаемой для других сперматозоидов.
Вителинова оболочка
Вителинова оболочка, или первичная оболочка состоит из белков, которые помогают сперматозоида попасть к яйцеклетке и выполняют Видоспецифические барьерную функцию, обеспечивая попадание сперматозоида только соответствующего вида. Вителинова оболочка присуща беспозвоночным и позвоночным, однако у млекопитающих она специфическая и называется zona pellucida. Как у млекопитающих, так и у других организмов в белков вителиновои оболочки (zona pellucida) имеющийся домен ZP, с помощью которого происходит полимеризация белков и уплотнения оболочки.
Вителинова оболочка птиц
Вителинова оболочка птиц состоит из двух слоев: внутреннего и внешнего. Внутренний слой, перивителиновий, толщиной 1-3,5 мкм, сформированный фибриллярного белка. Этот слой отвечает за Видоспецифические соединение сперматозоидов и формируется за неделю до овуляции. У птиц после оплодотворения яйцеклетки в яйцевод образуется внешний слой, который блокирует полиспермии. В дальнейшем во время движения яйцевода вокруг зиготы формируется твердая оболочка — скорлупа.
Вителинова оболочка амфибий
Лучше всего изучены яйцеклетки следующих бесхвостых земноводных Xenopus laevis, Xenopus tropicalis, Discoglossus pictus и Bufo arenarum.
После овуляции яйцеклетка бесхвостых покрыта целомического оболочкой (англ. Coelomic envelope). В этом состоянии клетка не способна к слиянию со сперматозоидом, — такая способность приобретается только после преобразования целомического оболочки в вителинову. Уже в яйцеводе ооцит окружает желеобразный слой (англ. Jelly coat) толщиной 1 мм и вителинова оболочка толщиной 1 мкм. Вителинова оболочка состоит из фибриллярных белковых структур диаметром 12 и 19 нм, которые соединены между собой и формируют сетку. При оплодотворении для предотвращения полиспермии вителинова оболочка становится непроницаемой, так называемой оболочкой оплодотворения (англ. Fertilization envelope).
Яйцеклетки бесхвостых мало изучены. Известно, что у бесхвостых возможна полиспермия, потому что в них отсутствуют кортикальные гранулы, которые обычно уплотняют вителинову оболочку, поэтому в таких организмов не формируется оболочки оплодотворения.
Zona pellucida
Zona pellucida, блестящая оболочка, представляет собой специфическую внеклеточного оболочку ооцита, присущую млекопитающим. Толщина блестящей оболочки может изменяться от 1 до около 25 мкм в зависимости от вида животного. Zona pellucida состоит из гликопротеинов (ZP1-3 в мыши, у человека, свиньи и других видов имеется дополнительный ZP4), которые формируют сеть микрофибрилл, плотно упакованных у мембраны ооцита (оолемы) и более разреженно — на периферии. Ооциты, созревающие, а не сразу начинают секретировать ZP-гликопротеины. Когда ооцит переходит в своем развитии к диплотеновои стадии первого деления мейоза начинается образование zona pellucida. Белки блестящей оболочки мышей формируются исключительно ооцитом течение 3-4 недель.
Блестящая оболочка у мышей состоит из трех белков: ZP1 (623 аминокислотных остатка (АКЗ) длиной, 68,7 кДа), ZP2 (713 АКЗ, 80,2 КДА) и ZP3 (424 АКЗ, 46,3 КДА). Эти белки гликозилюються как по аминогруппе аспарагина так и по гидроксильной группе серин-треонина (N- и O-связанное гликозилирование, соответственно).
Через блестящую оболочку проходят так называемые трансзональни проекции от окружающих гранулёзных клеток, через которые к ооцита поступают белки и другие вещества.
Лучистый венец
Лучистый венец технически не является производным яйцеклетки, а состоит из отдельных клеток, которые называются кучевых (лат. Cumulus oophorus). Они окружают ооцит как в фолликуле, так и после овуляции. До овуляции кучевые клетки является ближайшим к ооцита слоем гранулёзных клеток, функция которых заключается в питании ооцита через специальные образования, трансзональни проекции, которые соединяют эти клетки.
Полярность яйцеклетки
Яйцеклетка — это достаточно большая клетка организма и размещения как питательных веществ, так и регуляторных элементов, мРНК и белков в ней может быть неравномерным.
У нематод Caenorhabditis elegans за один час после оплодотворения зигота приобретает очень поляризованного вида, начинает неравномерно делиться, в результате чего дочерние клетки имеют разный размер и разную дальнейшую судьбу. Но неоплодотворенная яйцеклетка никакой полярности не проявляет. Место попадания сперматозоида является начальной точкой образования полярности — в этом месте уменьшается концентрация актин-миозиновых комплекса и белка цитоскелета NMY-2 (англ. Nonmuscle myosin), формируя заднюю часть передне-задней оси зародыша. Однако неравномерное расположение белков PAR и атипичной протеинкиназы C (aPKC, англ. Atypical protein kinase C) также важны для формирования полярности — в случае их потери дочерние клетки становятся одинакового размера.
Неравномерном распределении в цитоплазме ооцита (ооплазме) плодовой мухи Drosophila melanogaster начинается к оплодотворению и зависит от размещения таких мРНК как bicoid и oskar вместе с действием PAR-белков. Поэтому, в отличие от круглых червей, неравномерность цитоплазмы зиготы у мух не зависит от точки попадания сперматозоида в яйцеклетку.
У млекопитающих такая определенность дальнейшей судьбы клеток зародыша отсутствует — еще на стадии восьми бластомер мышиного зародыша каждый из них может дать начало целому организму.
Виды яйцеклеток
Яйцеклетки разных организмов имеют неодинаковое количество желтка. Эта разница зависит от того, какой способ размножения присущ этим животным. Так, у животных, откладывают яйца (птицы, рептилии, рыбы) желтка много — весь он пойдет на нужды зародыша, и во время эмбриогенеза постепенно будет использован новым организмом. Такие яйцеклетки является полилецитальнимы.
Мезолецитальни яйцеклетки амфибий имеют среднее количество желтка, который концентрируется на одном полюсе, вегетативном. На противоположном полюсе, анимальном, содержится ядро яйцеклетки и большинство органелл.
У млекопитающих формируется плацента, которая кормит зародыш, поэтому потребности в большом количестве запасных веществ нет, и яйцеклетки содержат мало желтка. Такие ооциты называются олиголецитальних. К олиголецитальних яйцеклеток также принадлежат яйцеклетки морского ежа, морской звезды, ланцетника.
Также яйцеклетки разделяют по распределению желтка. У млекопитающих, улиток, морских ежей желток распределен равномерно — они изолецитальни яйцеклетки. У насекомых центролецитальни ооциты — желток расположен посередине. Телолецитальни яйцеклетки присущи рыбам, птицам — в них лишь небольшое количество клетки свободная от желтка. В зависимости от типа яйцеклетки после оплодотворения дробления протекать по-разному.
Оогенез
Яйцеклетка формируется в результате процесса, который называется оогенез. В отличие от сперматогенеза (образования сперматозоидов), оогенез в большинстве видов приводит к образованию достаточно большой клетки, которая будет малоподвижным, но содержит большое количество цитоплазмы и запасных веществ. Для уменьшения количества хромосом яйцеклетка в процессе оогенеза проходит все стадии мейоза, однако выдающейся чертой мейотического деления ооцита является неравномерность дочерних клеток: одна из четырех образованных клеток содержит большинство материнской цитоплазмы — эта клетка и становится яйцеклеткой, тогда как остальные дочерних клеток (полярные тельца) цитоплазмы почти не содержат.
Оогенез лучше изучен у беспозвоночных, которые имеют ооциты больших размеров (морские ежи, морские звезды) и позвоночных, которым присуще внешнее оплодотворение (амфибии, рыбы). Оогенез млекопитающих изучено плохо, что связано как с небольшим количеством яйцеклеток, образующиеся при жизни животного, так и с техническими трудностями их изучения. Например, оогенез у морского ежа легко стимулировать инъекцией 0,5 M KCl и получить миллионы яйцеклеток, которые можно изучать в растворе соленой воды, тогда как с одной грызуна можно получить примерно 30 ооцитов, каждый из которых требует сложного питательной среды и определенных температурных условий.
В зависимости от способа размножения, оогенез у животного протекает по-разному. У животных, продуцируют большое количество ооцитов (рыбы или амфибии, в виде икры) стадии оогенеза могут повторяться в течение жизни. У животных, которые на протяжении жизни формируют сравнительно небольшое количество ооцитов (большинство млекопитающих, включая человека) оогенез происходит только один раз, без повторения стадий, и те первичные ооциты, что поспорили в эмбриональный период, в течение жизни постепенно созревают и овулирующих, а их Запасы обновляются.
Яйцеклетки начинают образовываться в эмбриональный период. На начальных стадиях развития гамет будущие ооциты не отличаются от будущих сперматозоидов. Такие клетки называются Примордиальная или первичными гоноциты (англ. Primordial germ cells, PCG).
Примордиальные клетки могут образовываться двумя путями:
- у некоторых животных примордиальные гоноциты формируются от неравномерного распределения факторов, которые влияют на дифференциацию клеток, еще в цитоплазме ооцита. Такой путь иногда называется преформизмом — судьба клеток определяется еще в яйцеклетке.
- у других животных, включая млекопитающих, гоноциты формируются заново. Такой путь образования примордиальных гоноцитов называется индукцией — эти клетки должны выделиться других клеток уже в период после имплантации.
Примордиальные гоноциты митотически делятся и мигрируют во время гаструляции к месту, где будет создан гонады. Примерно к середине эмбриогенеза у мышей и до 6 недели эмбриогенеза у человека формируются бипотенцийни гонады, которые могут развиться в мужские или женские половые органы. Половая дифференциация гонад зависит от наличия или отсутствия гена SRY (англ. Sex-determining region Y), который вызывает развитие гонад в семенники. Ген SRY закодированный в Y-хромосоме, которую может принести сперматозоид (во время оплодотворения). Если же сперматозоид несет X-хромосому, то из-за отсутствия гена SRY будут образованы яичники.
У человека оогенез производит около 7000000 предшественников ооцитов, оогоний, до 7 месяца эмбриогенеза. Но дальше большинство из них погибает запрограммированной клеточной гибелью и только небольшое их количество, 6-7%, начинает мейотическом делиться. Такие клетки называются первичными ооцитами. Первичные ооциты доходят до диплотеновои стадии мейотического деления (примерно середина кроссинговера) и на этой стадии наступает пауза. У млекопитающих уже после рождения, во время так называемого пубертатного периода (полового созревания) первичные ооциты продолжают мейотическое деление, становятся вторичными ооцитами, и начинают выходить один за другим в процессе овуляции. Но завершение мейоза у мышей и человека происходит уже после оплодотворения.
Начало пубертатного периода и последующие периоды овуляции, менструальный цикл, контролируются уровнем не только половых гормонов, таких как ФСГ, но и достаточностью питания, например, через гормон грелин.
У дрозофилы при оогенеза отделяется специализированная плазма зародыша (англ. Germ plasm), с которой уже после оплодотворения сформируются зачатки гонад, которые войдут в мейоз после вылупления зрелой особи.
Генетика оогенеза
Одной из главных задач формирования как мужских, так и женских половых клеток является достижение гаплоидного набора хромосом (n), который становится диплоидным (2n) после оплодотворения, когда две половые клетки, каждая из которых имеет n хромосом, сливаются. Но поведение половых хромосом во время оогенеза отличается от сперматогенеза. Первичная яйцеклетка имеет кариотип XX. В отличие от сперматогенеза, где хромосомы X и Y отделены в так называемые половые или XY-тельца, во время оогенеза обе X-хромосомы активные и только после оплодотворения, если сперматозоид принесет второй X-хромосому, одна из них будет инактивированная.
Хроматин ооцитов также имеет свои особенности. Оба вида гамет имеют нестандартные варианты гистонов, которые формируют нуклеосомы, на которые накручивается молекула ДНК. В то время как у сперматозоидов есть варианты гистонов h3A (макроh3A (mh3A), h3A.X и фосфорилированный γh3A.X) и h4 (h4.3), которые могут запаковать ДНК очень плотно, яйцеклетка имеет только один специфический гистона h2oo. Но интересной особенностью h2-гистонов является то, что он не формирует нуклеосому, а есть линкерных (соединительным), то есть объединяет нуклеосомы между собой, чтобы создать плотную хромосомную структуру. Роль варианта h2oo еще не до конца выяснена, но он высоко консервативным у животных. Также ооциты имеют h4.3 и mh3A течение мейоза.
Транскрипционных активность яйцеклетки
Репрессия транскрипции
Во время оогенеза прекурсоры гамет транскрипционно неактивные определенное время, пока они мигрируют к гонад. В этот период гоноциты должны быть защищены от воздействия, которое может привести к их дифференциации в клетки зародышевых листков. В это время активную роль играет реорганизация хроматина, а в червей и мух также происходит подавление активности РНК-полимеразы из фосфорилирования ее C-концевого домена киназы P-TEFb (англ. Positive transcription elongation factor b). Поддержка неактивной РНК-полимеразы происходит с помощью белка Nanos.
Экспрессия генов
У большинства животных (за исключением насекомых) яйцеклетка все же продуцирует определенные мРНК. С ее ДНК считываются гены, которые необходимы для метаболизма клетки и для проведения специфических для ооцоиту процессов. Также ооцит имеет накопить в своей цитоплазме РНК, которые будут необходимы эмбриона во время первых делений бластуляция, пока не будут активированы собственные гены зиготы. Так, в мыши во время оогенеза только яйцеклетка считывает мРНК гликопротеинов блестящей оболочки ZP1, ZP2, и ZP3 (англ. Zona pellucida glycoprotein 1-3).
Мейотическое разделение ооцита
Главной особенностью мейотического деления ооцита, в отличие от сперматозоида, большая асимметричность разделов и неодинакова судьба дочерних клеток. Мейоз яйцеклетки млекопитающих начинается в эмбриогенезе, когда организм самки еще не родился. Но мейотическое деление не происходит сразу с начала до конца — есть два периода покоя: длиннее и короче. До рождения мейоз проходит в стадии Диплотена 1 разделения и в таком виде ооцит находится много времени — от месяцев до лет в зависимости от вида млекопитающих — до половой зрелости. Тогда, после овуляции яйцеклетка завершает первый деление мейоза и останавливается на стадии G2 клеточного цикла.
Также особенность мейотического деления ооцитов первого порядка млекопитающих состоит в том, что суммарным выходом мейоза могут быть три клетки, а не четыре, как при делении сперматоцитов первого порядка. После первого раздела первого дочернее полярное тельце может потом не завершить разделение, в результате чего из одного первичного ооцита образуется одна яйцеклетка, первое полярное тельце и второе полярное тельце.
У некоторых видов саламандр и рыб (Poecilia formosa) генетический материал сперматозоида не участвует в оплодотворении, хотя мужская гамета нужна для стимуляции формирования зиготы. Такой вид размножения называется гиногенез. Диплоиднисть яйцеклетки достигается или мейотическом гиногенез — при повторном привлечении генетического материала второго полярного тельца, или митотическим гиногенез — нерасхождением материала после первого деления митозом.
Редукция центросомы
Центросомы в гаметах наблюдали уже 100 лет назад, однако поведение их в половых клетках поняла гораздо меньше, чем в соматических. В некоторых организмов наблюдается редукция центросом в гамет.
Расхождения хромосом при метотичного разделения в неполовых (соматических) клетках происходит благодаря образованию веретена деления — скопление микротрубочек и специальных белков, которые размещены на полюсах клетки, делится. В основе этой структуры лежит главный центр организации микротрубочек (ЦОМТ, англ. Major microtubule-organizing centre, MTOC) — центросома, состоящий из центриолей и дополнительных прицентриольних белков. Еще одной особенностью мейотического деления яйцеклетки является отсутствие канонической центросомы.
Организация веретена деления мышиного ооцита происходит благодаря скоплению нескольких ацентриольних центров организации микротрубочек (англ. Acentriolar microtubules-organizing centres, aMTOC). Такие аЦОМТ насыщенные белками γ-тубулин и pericentrin.
Переход от ацентросомного разделения к нормальной метотичного разделения со стандартной Центросома происходит не сразу после оплодотворения и наступает на стадии бластоцисты.
Стадии оогенеза
| Название стадии | Описание |
| Гоноциты или первичные половые клетки (PGC, англ. Primordial germ cells) | Не дифференцированы на мужские или женские предшественники половых клеток. Мигрируют в первичных гонад (гонадного валике), в процессе чего делятся митотически. Там дифференцируются или на женские оогонии или на мужские сперматогоний. |
| Оогоний | Клетки, находящиеся в гонадних валиках и делятся митотически. Интенсивность деления в них увеличивается, по сравнению с гоноциты при иммиграции |
| Ооцит первого порядка (или первичный ооцит) | Клетка, которая вошла в мейоз и прошла в нем до Диплотена первого раздела (млекопитающие и мухи) или к диакинеза первого раздела (C. elegans). Обычно именно в этой стадии находятся половые клетки в гонадах млекопитающих большинство времени — мейоз начинается еще до рождения, а выход из паузы происходит сразу перед овуляцией. У человека ооцит первого порядка переходит к следующей фазе под действием ФСГ, завершает первый деление мейоза и формирует две дочерние клетки: ооцит второго порядке и полярное тельце с небольшим количеством цитоплазмы. |
| Ооцит второго порядка (или вторичный ооцит) | Клетка, которая вышла из паузы первого деления мейоза, в связи с овуляцией (млекопитающие) или под действием мужских половых гормонов MSP (англ. Major sperm protein) у нематод (факторы, влияющие на продолжение мейоза у мух, не выяснены ). Мейоз продолжается до следующей паузы: метафаза 2 деления (млекопитающие), метафаза 1 разделения (мухи) или анафаза 1 разделения (нематоды). Ооцит второго порядка при переходе к следующей фазе завершает мейотическое деление и делится на две клетки: зрелую яйцеклетку и полярное тельце. |
| Зрелый ооцит или яйцеклетка | Клетка, которая завершает мейоз. У млекопитающих и нематод происходит во время оплодотворения сперматозоидом, тогда как у мух все эти стадии завершаются до овуляции, а выход из паузы во время метафазы 1 деления происходит благодаря воздействию давления и влажности. С одной первичного ооцита формируется одна яйцеклетка, в которую переходит почти вся ооплазмы, и полярные тельца (два или три, в зависимости от того, завершит разделение первой полярное тельце). |
Оплодотворение
Высокодифференцированные половые клетки, которые настроены под одну функцию, а именно оплодотворения, должны при слиянии создать зиготу — тотипотентных клетку, которая даст основу всем видам клеток зародыша и с которой сформируется целый организм. Поэтому во время оплодотворения с яйцеклеткой, которая представляет собой большую часть объема будущей зиготы, происходит серия изменений.
Характерным свойством яйцеклетки является блокирование проницаемости оболочек после контакта с акросомой первого сперматозоида и его активация — переход из состояния покоя к развитию. Яйцеклетки определенных видов организмов могут быть также самодостаточными звеньями полового размножения (не требуют сперматозоидов для активации) — такое размножение называется партеногенезом.
Акросомная реакция
Для оплодотворения сперматозоид должен пройти слой гранулёзных клеток и блестящую оболочку яйцеклетки. Для этого на апикальной части сперматозоида формируется особая везикула — акросома, которая содержит вещества, способные расщепить zona pellucida и позволить попадание сперматозоида внутрь яйцеклетки. Акросомная реакция начинается при контакте акросомы с ZP3-белками блестящей оболочки и содержание акросомы высвобождается в Ca 2+ зависимые Экзоцитоз
Использование яйцеклеток в клинике и лабораторных исследованиях
Индукция плюрипотентности
В ходе онтогенеза клетки-предшественники делятся и дифференцируются в специализированные клетки. Способность одной клетки-предшественника дать зачаток клеткам разных зародышевых слоев и затем превратиться в специализированную клетку называется потентнистю. Оплодотворенная яйцеклетка, зигота — это тотипотентных клетка, которая дает зачаток всем клеткам организма. Во время эмбриогенеза определенные клетки делятся и дифференцируются в плюрипотентные стволовые клетки — такие, что при деленные дают зачаток многим различным клеткам, но в рамках различных зародышевых слоев (например, мезодермы). В ходе дальнейшей дифференциации клетки становятся унипотентнимы — способными к делению предшественниками только одного вида клеток. Большинство соматических клеток взрослого организма находятся в дифференцированной стадии и приспособлены для выполнения специальных функций.
Соматические клетки в лабораторных условиях могут быть перепрограммированы в плюрипотентные стволовые клетки. Эта процедура имеет очень широкое применение in vitro — от моделирования болезней к тестированию лекарств.
Одним из видов индукции плюрипотентности есть пересадки ядер соматических клеток. При такой процедуре ядро яйцеклетки удаляется, а на замену подсаживается ядро соматической клетки. Таким образом была клонирована овца Долли.
Митохондриальная ДНК
ДНК в клетке организма содержится не только в ядре. Митохондрии — специализированные органеллы, которые производят молекулы АТФ — имеют свою собственную ДНК (мтДНК). Во время оплодотворения в большинстве организмов (но не у всех) эмбрион получает митохондрии только от яйцеклетки и, соответственно, митохондриальную ДНК только от матери. Исключение составляют некоторые виды моллюсков. Этот результат обеспечивается с помощью двух процессов: автофагии митохондрий, которые оплодотворенная яйцеклетка получила от сперматозоида, и деградации родительской мтДНК при сперматогенеза.
Поэтому митохондриальная ДНК организма наследуется от матери (только самки передают мтДНК к следующему поколению). Этот факт используется в генетических анализах для построения генеалогических деревьев, установления эволюционного происхождения видов, и тому подобное.
Яйцеклетка растений
Растения способны к размножению вегетативным (бесполым) и генеративных путем, или половым — из сливом мужской и женской гамет. При размножении половым путем необходим переход растения из вегетативного состояния к генеративному.
Покрытосеменные
Образование цветка начинается процессом эвокация — физиологической, биохимической и генетической перестройки верхней части стебля (апекса) и происходит флоральный детерминация.
В пестику цветка в семенном зачатке содержится нуцелуса, покрытый специальным покровами — интегументом. В нуцелуса находиться археспориальна клетка с диплоидным набором хромосом, 2n. Археспориальна клетка делится мейотическом, образуя четыре макроспоры с гаплоидным набором хромосом, 1n. Из этих четырех клеток трех разрушаются и лишь одна макроспоры остается, делится уже митотическим путем трижды и образует зародышевый мешок (женский гаметофит), который состоит из семи клеток, которые содержат в общем восемь ядер, поскольку одна из клеток имеет два ядра. Каждое ядро содержит гаплоидинй набор хромосом, 1n.
Во время образования зародышевого мешке после первого митотического деления макроспоры, две дочерние клетки расходятся к разным полюсам гаметофита. Таким образом гаметофит приобретает свою полярности — разницы в структуре от одного края к другому. На полюсе, где находится микропиле («A» на рисунке) содержит яйцеклетку, (на рисунке желтая, обозначенная «C») и две вспомогательные клетки синергиды («D» на рисунке). Другой полюс формирует базальную часть зачатке, халазу («B» на рисунке). Там три гаплоидных ядра формируют три клетки-антиподы («F» на рисунке). В зародышевом мешке по центру содержится клетка вторично диплоидная — эндосперм («E»).
Синергиды выполняют важную роль при оплодотворении. Их клеточная стенка формирует большое количество впьячувань внутрь цитоплазмы клетки, увеличивая площадь поверхности плазматической мембраны, нитевидные структурой (англ. Filiform apparatus). Вместе с развитым эндоплазматическим Ретикуло это позволяет синергиды выделять хемотропни вещества для прорастания пыльцевых зерен до яйцеклетки и эндосперма, где один из спермиев оплодотворяет яйцеклетку, другой, с диплоидным ядром центральной клетки, формирует эндосперм. Это явление было открыто в Киеве в 1898 году Сергеем Навашиным и получило название двойного оплодотворения. Во время прорастания пыльцевых зерен клетки-синергиды разрушаются.
Яйцеклетка покрытосеменных растений поляризована. Вакуоль сравнительно больших размеров размещается ближе к микропиле, в то время, как ядро клетки расположены ближе к основанию.
Яйцеклетки других организмов
Многие организмы могут размножаться как поло, так и бесполым (высшие растения, водоросли). Причем во время полового размножения гаметы могут отличаться или не отличаться по размеру, морфологии и подвижностью. В зависимости от этого различают:
- изогамию — гаметы одинаковы по размеру и подвижностью.
- гетерогамию — гаметы отличаются по размеру и подвижностью. Это называют еще анизогамия.
- отличают отдельный вид гетерогамии — оогамию, когда яйцеклетка большая и неподвижная, а мужская половая клетка маленькая и подвижная (присуща млекопитающим и другим позвоночным).
Говорить о яйцеклетку имеет смысл только в случае гетерогамии.
Водоросли
Водоросли — это очень разнородная нетаксономична группа организмов, которым присуще как бесполое, так и половое размножение различных типов.
Зеленые водоросли
Могут размножаться изогамный или анизогамно.
Особи рода Eudorina имеют яйцеклетки с двумя жгутиками. Колонии Volvox имеют специализированные клетки, способные продуцировать гаметы — яйцеклетки и мужские гаметы. При этом большинство других клеток колонии способна лишь к вегетативного размножения. После слияния гамет формируется зигоспора. Представители рода Oedogonium способны к половому размножению и производят оогонии с одной большой яйцеклеткой без жгутиков, которую оплодотворяет мужская гамета с большим количеством жгутиков. Организмы рода Oedogonium имеют как представителей, которые могут продуцировать мужские и женские половые клетки в одном гаметофитом, так и представителей, которые производят только один вид гамет.
Красные водоросли
Красным водорослям присуще бесполое или половое размножение оогамия. Гаметофиты производят женские и мужские гаметангии. Женская гаметангий называется карпогона, он формируется на специальные выросты (англ. Carpogonial branche). Яйцеклетка большая и не имеет жгутиков. Мужские половые клетки сперматии также не жгутиков, поэтому оплодотворение происходит благодаря переносу мужских гамет течением воды.
Бурые водоросли
Имеют как изогамный, так и гетерогамни гаметы. При оогамии яйцеклетки не имеют жгутика, а мужские гаметы — нет.
Грибы
Грибы, как и водоросли, является большой разнообразной группой организмов, которым присуще как половое, так и бесполое размножение.
Оомицеты
Оомицеты присуще половое размножение с гетерогаметного половыми клетками. Яйцеклетка называется оосфера — ее производит оогоний. Мужская половая клетка не активно подвижная — она формируется в антеридии и попадает в оосферы благодаря процессу, который называется копуляция гаметангии — гаметангии разных полов тесно контактируют друг с другом и ядро с антеридиев попадает в оосферы. Кариотип гамет гаплоидный, 1n, который формируется в результате мейоза. После оплодотворения формируется зигота — ооспора.
Видео по теме
Изображения по теме
границ | Влияние возраста матери на компетентность ооцитов и эмбрионов
Введение
Успех воспроизводства человека во многом зависит от возраста, в котором женщины пытаются зачать ребенка, и этот показатель во всем мире прогрессивно растет (1, 2). Фертильность снижается с возрастом женщины, в то время как частота выкидышей и распространенность жизненно важных хромосомных аномалий имеют противоположную тенденцию (2–4) (рис. 1). При ЭКО возраст матери является одним из самых сильных предикторов успеха (5).В частности, пожилой возраст матери (AMA; определяется как ≥35 лет) оказывает лишь незначительное влияние на скорость оплодотворения (6, 7) и незначительное влияние на развитие эмбриона до стадии бластоцисты (8, 9), но приводит к драматическим последствиям. на частоту анеуплоидии бластоцисты (10, 11) (рисунок 1). Однако молекулярные и биохимические механизмы, участвующие в возрастном бесплодии и их влияние на качество ооцитов и эмбрионов, еще предстоит выяснить. На сегодняшний день несколько дисфункций связаны с нарушением фертильности у пожилых женщин.Наряду с прогрессирующим сокращением овариального резерва старение женщины включает в себя также нарушение компетентности ооцитов / эмбрионов из-за дефектных физиологических путей, таких как выработка и баланс энергии, метаболизм, эпигенетическая регуляция, контрольные точки клеточного цикла и усиление мейотической несегрегации (11). , 12). В этом обзоре мы кратко излагаем основные предполагаемые причины возрастного снижения компетентности ооцитов / эмбрионов, а также механизмы, лежащие в основе старения, и основные клинические стратегии, предлагаемые для предотвращения / ограничения влияния AMA на успех ЭКО.
Рисунок 1 . Влияние пожилого возраста матери на компетентность ооцитов / эмбрионов и предполагаемые механизмы, нарушенные старением. Старение у женщин вызывает уменьшение резерва яичников и компетентности ооцитов. Нарушение всех процессов может привести к более низкому производству / балансу энергии, включая небольшое снижение скорости развития эмбриона до стадии бластоцисты, а также к более высокой частоте неправильной сегрегации хромосом во время материнского мейоза, что приводит к высокому увеличению скорости анеуплоидии бластоцисты (особенно в женщины старше 35 лет) [ данные адаптированы из Franasiak et al., .(10) и Capalbo et al . (11)]. В конечном итоге эти механизмы сводятся к снижению фертильности, увеличению числа жизненно важных хромосомных аномалий, увеличению частоты выкидышей, а также увеличению распространенности числовых хромосомных аномалий у новорожденных [данные адаптированы из Hassold and Hunt (13) и ]. Heffner (4)]. Частота анеуплоидии оценивается на бластоцисты, подвергнутые биопсии; фертильность оценивается как количество новорожденных на 1000 замужних женщин; общая распространенность витальных анеуплоидий оценивается на каждую клинически признанную беременность; частота выкидышей оценивается на одну клиническую беременность; наконец, общая распространенность числовых хромосомных аномалий оценивается на количество новорожденных .
Старение матери и анеуплоидии
Ооцит должен поддерживать развитие эмбриона до активации эмбрионального генома (EGA) (14). Для эффективного достижения EGA требуется синхронное ядерное и цитоплазматическое созревание. Любой сбой в этих процессах может вызвать неправильный переход от материнского к эмбриональному контролю при развитии эмбриона. Однако после рождения и до набора фолликулов и овуляции ооциты вступают в длительную остановку в профазе мейоза I, во время которой они подвергаются пагубным последствиям старения, особенно нарушая генетическую стабильность (15) и, в конечном итоге, влияя на вероятность успеха в воспроизводстве человека.Действительно, ооциты обладают большей частью репродуктивного потенциала человека, о чем свидетельствует восстановление фертильности у женщин, перенесших донорство яйцеклеток (16).
Материнский возраст — основная причина эмбриональных анеуплоидий (4, 13, 17). Более чем 90% этих дисбалансов действительно имеют материнское происхождение, вызванное неправильной сегрегацией хромосом во время оогенеза (15). В основном могут возникать ошибки мейоза I (> 70% случаев), которые, хотя и могут быть «исправлены» в мейозе II, тем самым устраняя исходную ошибку (11).
Если конститутивные анеуплоидии полных хромосом в основном вызваны дефектным материнским мейозом, структурные хромосомные аномалии (например, сбалансированные транслокации) вместо этого кажутся независимыми от возраста матери и могут в равной степени влиять на обоих партнеров вместе с сегментарными анеуплоидиями, вариациями числа копий, микроделециями / микродупликациями. и постзиготические митотические ошибки. В самом деле, они, вероятно, возникают из событий de novo во время оогенеза и сперматогенеза или митоза (18, 19).
Поддержание бивалентной структуры является критической проблемой в материнском мейозе. У людей гомологичные хромосомы рекомбинируют в первичных ооцитах во время внутриутробного развития с образованием бивалентной конфигурации в профазе мейоза I. Эта конфигурация должна сохраняться в течение многих лет, в течение которых ооциты остаются заблокированными на переходе G2 / M (стадия диктиата) до наступления менархе. На этом этапе происходит возобновление мейоза и сегрегация хромосом. Однако в течение этого длительного периода покоя двухвалентная структура может ослабнуть, что приведет к образованию унивалентов или к расщеплению сестринских хроматид в мейозе I.Частота обоих этих событий действительно коррелирует с увеличением возраста матери и снижением частоты рекомбинации (20-25), но связанные причинные механизмы все еще неясны. Были предложены две гипотезы: (i) униваленты возникают из-за ухудшения бивалентов во время ареста диктиата или (ii) ооциты, подвергшиеся недостаточной рекомбинации, овулируют последними из яичника.
Удивительно, но Оттолини и его коллеги недавно сообщили, что с по метод кариоматизации (метод, который с помощью определенных родительских гаплотипов позволяет определять карту каждой хроматиды на основе SNP) применяется к искусственно активированным человеческим ооцитам и их полярным телам, что наиболее распространенным неканоническим паттерном сегрегации является обратная сегрегация (26).В соответствии с этой новой схемой сегрегации, которую невозможно идентифицировать с помощью обычного анализа числа копий, несестринские хроматиды вместо гомологичных разделяются вместе в мейозе I. Этот образец, даже если он необычный, не приводит к несбалансированному хромосомному строению per se , если только не последует дальнейшая ошибка во время мейоза II. Следовательно, наиболее частая ошибка сегрегации материнского мейоза, о которой сообщается в большинстве активированных / оплодотворенных ооцитов, все еще является преждевременным разделением сестринских хроматид (PSSC) в мейозе I (27-30).Наконец, нерасчленения мейоза I или мейоза II следует рассматривать как причины нарушений мейоза у матери, хотя они, вероятно, менее часты, чем сообщалось ранее (31, 32).
Далее мы суммируем молекулярные и клеточные процессы, на которые может повлиять старение в ооцитах (33, 34): митохондриальная дисфункция, укорочение теломер, дисфункция когезинов и аномалии мейотического веретена, вызванные нарушением контрольной точки сборки веретена (SAC). , Их предполагаемыми последствиями являются замедленное развитие до стадии бластоцисты и / или хромосомные аномалии (Рисунок 1).
Предполагаемые механизмы, нарушенные старением и ведущие к снижению компетентности ооцитов / эмбрионов
Дисфункция митохондрий
Митохондрии — самые многочисленные органеллы в ооците, представляющие его источник. Они характеризуются собственным геномом (мтДНК) и составляют основной материнский вклад в эмбриогенез (35). Действительно, сперматозоид не обеспечивает потомство митохондрий. Они считаются ключевыми, особенно в деликатных первых фазах доимплантационного развития, когда сбалансированное потребление энергии имеет решающее значение для эффективного цитоплазматического и ядерного созревания ооцитов, на протяжении таких процессов, как разрушение зародышевых пузырьков или сборка и разборка микротрубочек во время формирования мейотического веретена (36, 37).Более того, митохондрии играют важную роль в различных сигнальных путях, таких как передача сигналов Ca 2+ и регуляция внутриклеточного окислительно-восстановительного потенциала, что особенно важно для оплодотворения и раннего развития (36, 38).
О неблагоприятном влиянии старения на митохондрии внутри ооцита широко сообщалось: набухание митохондрий, вакуолизация и изменение крист были описаны как общие структурные особенности ооцитов от пациентов с AMA (39, 40).Например, потенциал митохондриальной мембраны, который отражает активность митохондрий, постепенно изменяется (41). Точно так же было подчеркнуто снижение продукции АТФ и снижение метаболической активности в старых ооцитах, что, в свою очередь, может способствовать нарушениям сборки мейотического веретена, регуляции клеточного цикла, сегрегации хромосом, развитию эмбриона и, наконец, имплантации (40, 42).
В митохондриальной ДНК отсутствуют защитные гистоны и эффективные механизмы репарации ДНК. Таким образом, частота мутаций мтДНК примерно в 25 раз выше, чем мутаций ядерной ДНК (43).Очевидно, что чем дольше период покоя, тем выше риск ошибок мтДНК. Более того, общая концентрация мтДНК, по-видимому, снижается в ооцитах от пожилых пациентов (44, 45), тем самым согласуясь с более низкой компетентностью ооцитов / эмбрионов (46–48). Следует отметить, что у человека митохондриальный биогенез физиологически активируется только на стадии бластоцисты (40, 49), чтобы ограничить стресс, вызванный окислительным фосфорилированием, на первых фазах развития эмбриона. У пожилых пациентов пониженное количество и / или неправильная активность ранее существовавших митохондрий внутри ооцита может вызвать компенсаторное преждевременное инициирование митохондриального биогенеза (50), что, в свою очередь, может способствовать раннему нарушению развития эмбриона (48).
Недавно, содержание мтДНК в биоптатах трофэктодермы на стадии бластоцисты было предложено в качестве предполагаемого биомаркера имплантационного потенциала. Однако клинические исследования, проведенные на сегодняшний день, показали противоречивые результаты (48, 51–54). Действительно, недавно Хумайдан и его коллеги предупредили, что по-прежнему трудно отличить «факт от вымысла» в текущем сценарии, и мтДНК не может рассматриваться как новый биомаркер потенциала эмбриональной имплантации (55): обширная проверка, а также более предварительная проверка. клинические данные и данные, возможно, не связанные с отбором, пока не требуются.До тех пор количественное определение мтДНК из биоптатов трофэктодермы следует рассматривать как экспериментальную процедуру.
Митохондрии также присутствуют в клетках гранулезы (GC), окружающих ооцит, уже на ранних этапах оогенеза. GCs непосредственно участвуют в установлении компетентности ооцитов во время оогенеза благодаря хорошо известному двунаправленному диалогу между этими двумя участками фолликула (56, 57). Что касается ооцитов, то также GCs от женщин AMA показали более высокий уровень делеций мтДНК (58) и поврежденных митохондрий (59).Также сообщалось, что количество мтДНК в GC коррелирует с качеством эмбриона (60) и плохим резервом яичников. Текущая гипотеза состоит в том, что поскольку мтДНК в ооците поддерживает раннее эмбриональное развитие, сходным образом мтДНК на связанных с ней GC поддерживает созревание ооцита, возможно, модулируя компетентность эмбриона. Такая гипотеза подтверждается высокой корреляцией между уровнями мтДНК в двух компартментах фолликула (61).
Таким образом, старение может поставить под угрозу целостность мтДНК и / или морфологию митохондрий или изменить микроокружение внутри фолликула и нарушить взаимные перекрестные помехи между ооцитом и его GCs (39, 40, 62).
Укорочение теломер
Теломеры представляют собой короткие тандемные повторы специализированных последовательностей ДНК, которые защищают концы хромосом (63). Их функция важна для мейоза, так как на ранней профазе теломеры привязывают хромосомы к ядерной мембране, чтобы облегчить гомологичное спаривание и инициировать синапс с образованием хиазм, физических сайтов рекомбинации, ответственных за нормальную сегрегацию, тем самым предотвращая неразрывность (64 , 65). Связанное с возрастом укорочение теломер происходит либо в делящихся, либо в неделящихся клетках и было связано с несколькими возрастными заболеваниями (например,ж., диабет, сердечно-сосудистые заболевания и рак) (66, 67). Однако динамика теломер сильно различается в зависимости от типа клеток и пола. Например, в мужской зародышевой линии длина теломер сохраняется с возрастом, вероятно, из-за постоянной активности теломеразы (обратной транскриптазы, участвующей в удлинении теломер), которая экспрессируется на высоком уровне в сперматогониях (68). Интересно, что даже увеличенная средняя длина теломер, а также более высокая неоднородность длины были недавно зарегистрированы у пожилых мужчин по сравнению с более молодыми пациентами (69).И наоборот, теломеры в ооцитах начинают укорачиваться во время оогенеза плода, и этот процесс продолжается во взрослом яичнике, вероятно, из-за хронических эффектов окислительного и генотоксического стресса, а также позднего выхода женских гамет из остановки их клеточного цикла. относительно пониженной активности теломеразы (68, 70, 71). Кроме того, было продемонстрировано, что теломеры короче в ооцитах женщин, перенесших неудачный исход ЭКО или повторный выкидыш (72), а также в ооцитах, приводящих к фрагментированным (73) или анеуплоидным эмбрионам (74).В связи с этим Киф и его коллеги постулировали эволюционную теорию «теломер-опосредованного старения ооцитов»: предотвращение зачатия женщин с AMA, в свою очередь, предотвратит их смерть из-за родов, тем самым влияя на репродуктивную пригодность их потомства (70, 75). ,
Дисфункции Когезина
Потеря сцепления между сестринскими хроматидами, близкими к центромерам, — еще одна возрастная дисфункция, которая может вызывать нарушение расхождения хромосом. Когезины представляют собой комплекс белков, который удерживает сестринские хроматиды вместе после репликации ДНК и отвечает за поддержание двухвалентной структуры в течение длительного периода покоя.Только в анафазе когезины удаляются, чтобы вызвать разделение сестринских хроматид. Сбор данных указывает на возрастное нарушение функции когезина, ведущее к неправильной сегрегации в ооците, особенно при низкой скорости рекомбинации (76). Например, цитогенетические исследования ооцитов и эмбрионов человека показали, что PSSC часто ассоциируется с возрастным снижением когезинов (например, Rec8, SA3 и SMC1b) (77, 78). Кроме того, активность регуляторных белков, предотвращающих преждевременное удаление когезинов, по-видимому, снижается в зависимости от возраста (79), независимо от их расположения в ядре, что теоретически должно защищать их от воздействия механического стресса и / или реактивного воздействия. Кислородно-виды.Наконец, существует структурное и функциональное взаимодействие между когезинами и теломерами у мышей (80). Следовательно, у пациентов с AMA возрастные проблемы, влияющие на теломеры, могут вызывать аналогичные нарушения в активности когезинов (76).
Нестабильность шпинделя
Мейотическое веретено отвечает за разделение как гомологичных хромосом, так и сестринских хроматид, поэтому важно для обеспечения точной сегрегации (81). Аберрации в его сборке, по-видимому, способствуют более высокой распространенности анеуплоидий у пожилых женщин (82).Эти аберрации также могут быть приписаны снижению метаболической активности митохондрий, что приводит к уменьшению количества АТФ из-за AMA. Веретено молодых ооцитов компактно, ортогонально ориентировано по отношению к оолемме, и каждый полюс связан с кольцом белков центросомы. Напротив, почти 80% ооцитов у пациентов с AMA могут иметь аномальные веретена с удлиненным и / или меньшим профилем и небольшим количеством микротрубочек в коре головного мозга (81, 82). В этом отношении также SAC, повсеместно распространенный безопасный белковый комплекс, который обеспечивает правильное формирование веретена (83), демонстрирует пониженную строгость в отношении AMA (84–86).Различные белковые компоненты SAC (например, Mad2 и Bub1) действительно показали более низкие концентрации в ооцитах пожилых женщин (84, 87).
Другие предполагаемые механизмы, нарушенные старением
Исследования экспрессии генов в ооцитах нескольких видов показывают, что активность генных продуктов, участвующих в регуляции клеточного цикла, формировании веретена и целостности органелл, может изменяться в ооцитах пожилых людей. Например, как в мышиных, так и в человеческих ооцитах ~ 5% всех транскриптов, обнаруженных на стадии MII, оказались подвержены старению (88, 89).Возможно, расходящиеся сигнатуры происходят из измененных паттернов эпигенетических модификаций (напр., Метилирования и ацетилирования), о которых действительно сообщалось у обоих видов (90-94). Эта область репродуктивной генетики требует обширных исследований в ближайшие годы, чтобы лучше раскрыть эти механизмы.
Клинические аспекты
Существует четкая корреляция между увеличением возраста матери и снижением успешности зачатия как при спонтанном, так и после ЭКО (4, 5).Этому сценарию способствуют как снижение резерва яичников, так и качество ооцитов. В настоящее время не существует терапии для противодействия бесплодию у пациентов с AMA, и мы можем только попытаться ограничить эту биологическую и социальную проблему.
Во-первых, сохранение фертильности посредством криоконсервации ооцитов (95, 96) предоставляет ценный вариант для всех женщин (не только онкологических пациентов), направленный на предотвращение естественного снижения компетентности ооцитов. Тем не менее, возраст, в котором выполняется сохранение фертильности, является важным фактором, влияющим на конечный результат (предпочтительно <35 лет), и, очевидно, беременность не может быть гарантирована с помощью банка ооцитов (97).
Во-вторых, максимальное использование резерва яичников за счет индивидуализированной контролируемой стимуляции яичников (COS) имеет решающее значение для увеличения количества собранных ооцитов, что также увеличивает шансы на успех после ЭКО (98, 99). Более высокое количество ооцитов, собранных за цикл яичников, действительно может компенсировать снижение как количества ооцитов (т. Е. Резерва яичников), так и качества (т. Е. Компетентности). Следовательно, новые стратегии COS, такие как накопление ооцитов / эмбрионов в последовательных циклах (100) или двойная стимуляция яичников в одном и том же яичниковом цикле [i.например, протокол Shanghai (101) или протокол DuoStim (102)] были недавно предложены для сокращения времени, затрачиваемого пациентами с плохим прогнозом на их стремление к рождению живого ребенка. В этом отношении были получены многообещающие данные, особенно с точки зрения экономической эффективности и безопасности.
В-третьих, усиление отбора эмбрионов с помощью доимплантационного генетического тестирования представляет собой еще один важный вариант для пациентов с AMA. Фактически, цель АРТ — добиться рождения здорового ребенка с минимальным риском для пациента, и это особенно верно при АМА, когда частота анеуплоидий резко возрастает (10).Такой подход, позволяющий избежать переноса анеуплоидных бластоцист и связанных с ними рисков (например, неудач имплантации, выкидышей и пораженного ребенка), может привести к повышению эффективности каждого лечения ЭКО (103, 104). Важно отметить, что после идентификации эуплоидной бластоцисты ее имплантационный потенциал не зависит от возраста матери (45–50%), что позволяет применять политику переноса одного эмбриона также и у пациентов с AMA, одновременно снижая риск многоплодной беременности и их сопутствующие акушерские / перинатальные риски (105, 106).Вскоре внедрение -атомических наук и стремление к неинвазивности и повышению рентабельности в этой области могут объединиться и привести к появлению интригующих авангардных идей для дальнейшего улучшения отбора эмбрионов.
Наконец, донорство ооцитов представляет собой эффективный подход к предотвращению возрастного снижения фертильности. Недавно оптимизация методов криоконсервации и создание хранилищ и программ для хранения ооцитов позволили нам избежать синхронизации между донорами и реципиентами.Действительно, аналогичные показатели успеха наблюдаются как в свежих, так и в замороженных ооцитах (107). Тем не менее, в некоторых странах донорство ооцитов все еще запрещено, и этические / психологические соображения ограничивают его широкое распространение.
Заключение
В настоящее время в ЭКО группа экспертов, специализирующаяся на ведении пациентов с плохим прогнозом, известная как группа POSEIDON (ориентированные на пациента стратегии, охватывающие индивидуальное количество ооцитов), пересмотрела цель стимуляции яичников (108). В частности, они утверждали, что COS должен быть адаптирован «для извлечения количества ооцитов, необходимого конкретному пациенту, чтобы получить хотя бы один эуплоидный эмбрион для переноса.Такое утверждение основано на двух важных предположениях: (i) частота анеуплоидии в бластоцистах человека увеличивается с 30% исходного уровня у женщин моложе 35 лет до> 90% у женщин старше 44 лет (10, 11) и (ii) количество собранные яйца и эмбрионы, полученные во время ЭКО, не изменяют этот показатель (109). Другими словами, определение количества требуемых (количества) ооцитов от каждого пациента должно включать оценку их компетентности (качества) с целью получения по крайней мере одной эуплоидной бластоцисты. Затем, при выполнении переноса эуплоидной бластоцисты, примерно в 50% случаев, независимо от возраста женщины, рождаются здоровые живые существа (103).
В заключение, основанные на фактах данные всегда должны служить ориентиром для консультирования, и пациенты должны быть скрупулезно проинформированы об их предполагаемых шансах на зачатие, особенно если они старше 35 лет. Действительно, 35 лет должны быть минимальным возрастным порогом для определения AMA, а 45 лет следует считать наивысшим возрастным порогом для прохождения ЭКО с использованием собственных яйцеклеток, по крайней мере, согласно последнему опубликованному отчету (9).
Авторские взносы
DC и GF подготовили рукопись. Все авторы участвовали в поиске литературы и обсуждении опубликованных доказательств.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Миллс М., Риндфус Р.Р., Макдональд П., Те Велде Э; Рабочая группа ESHRE по репродукции и обществу. Почему люди откладывают отцовство? Причины и стимулы социальной политики. Обновление репродукции человека (2011) 17: 848–60. DOI: 10.1093 / humupd / dmr026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Шмидт Л., Соботка Т., Бенцен Дж. Г., Нибое Андерсен А.; Рабочая группа ESHRE по репродукции и обществу. Демографические и медицинские последствия отсрочки отцовства. Обновление Hum Reprod (2012) 18: 29–43. DOI: 10.1093 / humupd / dmr040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Нельсон С.М., Лоулор Д.А. Прогнозирование живорождения, преждевременных родов и низкой массы тела при рождении у младенцев, рожденных в результате экстракорпорального оплодотворения: проспективное исследование 144 018 циклов лечения. PLoS Med (2011) 8: e1000386. DOI: 10.1371 / journal.pmed.1000386
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Grondahl ML, Christiansen SL, Kesmodel US I, Agerholm E, Lemmen JG, Lundstrom P, et al. Влияние возраста женщины на морфологию эмбриона, скорость дробления и компетентность — многоцентровое когортное исследование. PLoS One (2017) 12: e0172456. DOI: 10.1371 / journal.pone.0172456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Stensen MH, Tanbo T, Storeng R, Byholm T., Fedorcsak P. Обычные морфологические системы оценки при лечении вспомогательной репродукции не отражают возрастное ухудшение качества ооцитов и эмбрионов. Reprod Biomed Online (2010) 21: 118–25. DOI: 10.1016 / j.rbmo.2010.03.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Маццилли Р., Чимадомо Д., Вайарелли А., Капалбо А., Довере Л., Альвигги Е. и др. Влияние мужского фактора на клинический результат интрацитоплазматической инъекции сперматозоидов в сочетании с доимплантационным тестированием на анеуплоидию: наблюдательное продольное когортное исследование из 1219 последовательных циклов. Fertil Steril (2017) 108 (6): 961–72.e3. DOI: 10.1016 / j.fertnstert.2017.08.033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Убальди FM, Чимадомо Д., Капалбо А., Вайарелли А., Буффо Л., Трабукко Э и др. Преимплантационная генетическая диагностика для тестирования анеуплоидии у женщин старше 44 лет: многоцентровый опыт. Fertil Steril (2017) 107: 1173–80. DOI: 10.1016 / j.fertnstert.2017.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10.Franasiak JM, Forman EJ, Hong KH, Werner MD, Upham KM, Treff NR, et al. Природа анеуплоидии с увеличением возраста партнерши: обзор 15 169 последовательных биопсий трофэктодермы, оцененных с помощью комплексного хромосомного скрининга. Fertil Steril (2014) 101: 656–63.e1. DOI: 10.1016 / j.fertnstert.2013.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Капальбо А., Хоффманн Э. Р., Чимадомо Д., Мария Убальди Ф, Риенци Л. Пересмотр женского мейоза человека: новое понимание механизмов хромосомной сегрегации и анеуплоидий на основе передовой геномики и покадровой визуализации.Обновление Hum Reprod (2017) 23 (6): 706–22. DOI: 10.1093 / humupd / dmx026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Сантоночито М., Гульельмино М.Р., Венто М., Рагуза М., Барбагалло Д., Борзи П. и др. Апоптотический транскриптом ооцита MII человека: характеристика и возрастные изменения. Апоптоз (2013) 18: 201–11. DOI: 10.1007 / s10495-012-0783-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Брауде П., Болтон В., Мур С. Экспрессия генов человека сначала происходит между четырех- и восьмиклеточными стадиями доимплантационного развития. Nature (1988) 332: 459–61. DOI: 10.1038 / 332459a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Европейский консорциум по мониторингу I.V.F. для Европейского общества репродукции человека, эмбриологии, Calhaz-Jorge C., de Geyter C, Kupka MS, de Mouzon J, Erb K, et al. Вспомогательные репродуктивные технологии в Европе, 2012: результаты, полученные ESHRE на основе европейских регистров. Репродукция человека (2016) 31: 1638–52. DOI: 10.1093 / humrep / dew151
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Капалбо А., Убальди Ф.М., Риенци Л., Скотт Р., Трефф Н. Обнаружение мозаицизма в биоптатах трофэктодермы: текущие проблемы и будущие возможности. Hum Reprod (2016) 32 (3): 492–8. DOI: 10.1093 / humrep / dew250
CrossRef Полный текст | Google Scholar
21. Дункан Ф. Е., Хорник Дж. Э., Лэмпсон М. А., Шульц Р. М., Ши Л. Д., Вудрафф Т. К..Сплоченность хромосом в яйцеклетках человека снижается с возрастом матери. Ячейка старения (2012) 11: 1121–4. DOI: 10.1111 / j.1474-9726.2012.00866.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Патель Дж., Тан С.Л., Хартсхорн Г.М., МакАинш А.Д. Уникальная геометрия сестринских кинетохоров в ооцитах человека во время мейоза. Я могу объяснить возрастное увеличение хромосомных аномалий у матери. Biol Open (2015) 5: 178–84. DOI: 10.1242 / bio.016394
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Зелинска А.П., Голубцова З., Блейни М., Старейшина К., Шу М. Расщепление кинетохор сестры и преждевременный распад бивалентов могут объяснить эффект материнского возраста. Элиф (2015) 4: e11389. DOI: 10.7554 / eLife.11389
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Lagirand-Cantaloube J, Ciabrini C, Charrasse S, Ferrieres A., Castro A, Anahory T. и др. Потеря сцепления центромер в анеуплоидных человеческих ооцитах коррелирует со снижением локализации кинетохор белков мешочка Bub1 и Bubr1. Научный журнал (2017) 7: 44001. DOI: 10.1038 / srep44001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Kong A., Barnard J, Gudbjartsson DF, Thorleifsson G, Jonsdottir G, Sigurdardottir S, et al. Скорость рекомбинации и репродуктивный успех у людей. Нат Генет (2004) 36: 1203–6. DOI: 10,1038 / ng1445
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Ottolini CS, Newnham LJ, Capalbo A, Natesan SA, Joshi HA, Cimadomo D, et al.Полногеномные карты рекомбинации и сегрегации хромосом в человеческих ооцитах и эмбрионах показывают отбор по показателям материнской рекомбинации. Нат Генет (2015) 47: 727–35. DOI: 10,1038 / нг. 3306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Капалбо А., Боно С., Спиццичино Л., Биричик А., Балди М., Коламария С. и др. Последовательный комплексный анализ хромосом на полярных тельцах, бластомерах и трофобластах: понимание женских мейотических ошибок и хромосомной сегрегации в доимплантационном окне развития эмбриона. Репродукция человека (2013) 28: 509–18. DOI: 10.1093 / humrep / des394
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Handyside AH, Montag M, Magli MC, Repping S, Harper J, Schmutzler A. и др. Множественные мейотические ошибки, вызванные преждевременным делением хроматид у женщин пожилого материнского возраста, подвергшихся экстракорпоральному оплодотворению. евро J Hum Genet (2012) 20: 742–7. DOI: 10.1038 / ejhg.2011.272
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Оттолини С.С., Капалбо А., Ньюнхэм Л., Чимадомо Д., Натесан С.А., Хоффманн Э.Р. и др. Создание мейокарт полногеномной рекомбинации и сегрегации хромосом в ооцитах человека. Nat Protoc (2016) 11: 1229–43. DOI: 10.1038 / nprot.2016.075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Пелестор Ф., Андрео Б., Арнал Ф., Юмо С., Демайл Дж. Механизмы неразрывной связи в мейозе самок человека: сосуществование двух способов мальсегрегации, подтвержденное кариотипированием 1397 неоплодотворенных ооцитов in vitro. Репродукция человека (2002) 17: 2134–45. DOI: 10.1093 / humrep / 17.8.2134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Miao YL, Kikuchi K, Sun QY, Schatten H. Старение ооцитов: клеточные и молекулярные изменения, потенциал развития и возможность обращения. Обновление репродукции человека (2009) 15: 573–85. DOI: 10.1093 / humupd / dmp014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Хатчисон, Калифорния III, Ньюболд Дж. Э., Поттер С. С., Эджелл М. Х.Материнская наследование митохондриальной ДНК млекопитающих. Nature (1974) 251: 536–8. DOI: 10.1038 / 251536a0
CrossRef Полный текст | Google Scholar
36. Думоллард Р., Дюшен М., Кэрролл Дж. Роль митохондриальной функции в ооците и эмбрионе. Curr Top Dev Biol (2007) 77: 21–49. DOI: 10.1016 / S0070-2153 (06) 77002-8
CrossRef Полный текст | Google Scholar
37. Ван Блерком Дж. Митохондрии в оогенезе человека и преимплантационном эмбриогенезе: двигатели метаболизма, ионная регуляция и компетентность в развитии. Репродукция. (2004) 128: 269–80. DOI: 10.1530 / rep.1.00240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Думоллард Р., Уорд З., Кэрролл Дж., Дюшен М.Р. Регуляция окислительно-восстановительного метаболизма в ооците и эмбрионе мыши. Разработка (2007) 134: 455–65. DOI: 10.1242 / dev.02744
CrossRef Полный текст | Google Scholar
39. Мюллер-Хокер Дж., Шафер С., Вайс С., Мюншер С., Стровицки Т. Морфолого-цитохимический и молекулярно-генетический анализ митохондрий в изолированных ооцитах человека в репродуктивном возрасте. Mol Hum Reprod (1996) 2: 951–8. DOI: 10,1093 / мольчр / 2.12.951
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Ван Блерком Дж. Функция митохондрий в человеческих ооцитах и эмбрионах и их роль в развитии компетентности. Митохондрия (2011) 11: 797–813. DOI: 10.1016 / j.mito.2010.09.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Уилдинг М., Дейл Б., Марино М., ди Маттео Л., Альвигги С., Писатуро М.Л. и др.Паттерны и активность митохондриальной агрегации в человеческих ооцитах и доимплантационных эмбрионах. Репродукция человека (2001) 16: 909–17. DOI: 10.1093 / humrep / 16.5.909
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Duran HE, Simsek-Duran F, Oehninger SC, Jones HW Jr, Castora FJ. Связь репродуктивного старения с количеством, функцией и целостностью митохондрий в человеческих ооцитах на разных стадиях созревания. Fertil Steril (2011) 96: 384–8.DOI: 10.1016 / j.fertnstert.2011.05.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Муракоши Ю., Суэока К., Такахаши К., Сато С., Сакураи Т., Тадзима Х. и др. Способность эмбриона к развитию и исход беременности связаны с количеством копий митохондриальной ДНК и объемом ооплазмы. J Assist Reprod Genet (2013) 30: 1367–75. DOI: 10.1007 / s10815-013-0062-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Reynier P, May-Panloup P, Chretien MF, Morgan CJ, Jean M, Savagner F, et al.Содержание митохондриальной ДНК влияет на оплодотворяемость ооцитов человека. Mol Hum Reprod (2001) 7: 425–9. DOI: 10,1093 / моль · ч / 7,5,425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Santos TA, El Shourbagy S, St John JC. Содержание митохондрий отражает изменчивость ооцитов и результат оплодотворения. Fertil Steril (2006) 85: 584–91. DOI: 10.1016 / j.fertnstert.2005.09.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Диез-Хуан А., Рубио С., Марин С., Мартинес С., Аль-Асмар Н., Рибольди М. и др. Содержание митохондриальной ДНК как показатель жизнеспособности эуплоидных эмбрионов человека: чем меньше, тем лучше. Fertil Steril (2015) 104: 534–41.e1. DOI: 10.1016 / j.fertnstert.2015.05.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
,Минутку …
Включите файлы cookie и перезагрузите страницу.
Этот процесс автоматический. Ваш браузер в ближайшее время перенаправит вас на запрошенный контент.
Подождите до 5 секунд…
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [ ] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [+ !! [] + !!] [] ) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + ( !! []) + !! [])) / + ((+ !! [] + []) + (+ [] — (!! [])) + (+ [] + (!! [! ]) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [ ] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! []) + !! [] + !! []) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [ ] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! []) + (+ [] -! (!! [])) + (+ [] + ( !! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (+ !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + !! [] () + !! []) + (! + [] + (!! []) + !! [] + !! [ ] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []) (! + [] + (!! [])) + + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ]) + (! + [] + (!! []) + !! [] + !! []) + (+ !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ [] — (!! []!)) + (+ [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + !! [] + !! []) + (+ [] + (!! []) — (! + [] + (!! []) []) + + !! [] + !! [] + !! [] + !! []) + (+ !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + ( ! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — ( !! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! [] ) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [])) / + ((+ !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! []) + (+ !! []) + (+ [] — (!! []!)) + (+ [] + (!! [ ]) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []))
+ ((! + [] + (!! [] ) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) +! ! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + ( ! + [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (+ [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [ ]) + (+ !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [ ] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] — (!! [])) + (! + [] + (!! []) + !! [ ] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] +! ! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — ( !! [])) + (+ [] + (!! []) + !! [])) / + ((+ [] + (!! []) -! [] + []) + ( ! + [] + (!! []) + !! [] + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) +! ! [] + !! []) + (! + [] + (!! []) + !! [ ]) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (! ! []) + !! [] + !! [] + !! []) + (+ [] + (!! []) -! []) + (+ [] + (!! []) + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] +! ! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [+ !! [] + !!] [] ) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [ ] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [ ] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [+ !! [] + !!] [] ) + (+ [] — (!! []) (! + [] + (!! [])) + + !! [])) / + (! (+ [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! [ ]) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [ ] + !! [] + !! []) + (! + [] + (!! []) + !! [+ !! [] + !! [] + !! [] + !!] [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (+ !! []) + (+ !! []) + (+! ! []) + (! + [] + (!! []) — []))
+ ((! + [] + (!! []) + !! [] + !! [] +! ! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] +! ! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + ( ! + [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] )) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + [] ) + (! + [] + (!! []) + !! [] + !! [] +! ! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (+ !! [] ) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [ ] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) +! ! [] + !! []) + (+ !! []) + (+ [] — (!! []) (! + [] + (!! [])) + + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ !! [])) / + (( ! + [] + (!! []) + !! [] + !! [] + []) + (+ !! []) + (! + []
,3 Потенциальные риски, связанные с извлечением яиц | Оценка медицинских рисков донорства человеческих ооцитов для исследования стволовых клеток: отчет семинара
хирургия. Тем не менее, данных достаточно, чтобы понять, что происходит.
Доктор Мерфи описал результаты исследования, проведенного в Германии, в ходе которого изучались результаты примерно 380 000 операций по извлечению ооцитов в течение 2000–2004 годов. Для 28 процентов из них не было информации об осложнениях, но для процедур, о которых была информация, частота осложнений была очень низкой.Влагалищное кровотечение наблюдалось у 0,07 процента женщин, внутрибрюшное кровотечение у 0,05 процента, кишечные травмы у 0,001 процента и перитонит или воспаление брюшины (слизистой оболочки брюшной полости) у 0,005 процента. Из всех женщин, перенесших эту процедуру, только 0,002 процента — 2 из 100 000 — имели осложнения, для исправления которых потребовалось хирургическое вмешательство.
Возможно, сказал доктор Мерфи, эти цифры слишком оптимистичны. «Есть те, кто говорит, что здесь должно быть занижение, и это было предложено в литературе.Я не знаю.» Но если цифры верны, ясно, что частота осложнений была очень низкой.
Проспективное исследование, опубликованное в 2006 году, показало явно более высокий уровень осложнений, но, опять же, частота серьезных осложнений была очень низкой. В исследуемой популяции из более чем 1000 пациенток у 2,8% наблюдалось вагинальное кровотечение, но ни одна из них не потребовала наложения швов. Действительно, для всех пациентов, кроме одного, все, что требовалось для остановки кровотечения, — это давление; одному пациенту потребовалась тампонада, наложенная на рану впитывающую повязку.Сильная боль, потребовавшая госпитализации, возникла у 0,7% из 1035 обследованных женщин, перенесших извлечение ооцитов, и в одном случае имело место повреждение другого органа (мочеточника), и пациентка быстро выздоровела после установки стента в мочеточник.
Имеется меньше исследований, изучающих вопрос об инфекционных осложнениях, и доктор Мерфи описал два. В одном из них, опубликованном в 1993 году, у 9 пациентов из 1000 после операции были тазовые абсцессы, которые требовали лечения.Во втором, опубликованном в 2006 году, абсцессов вообще не было. «Мне было любопытно, как может быть такая огромная разница, — сказал доктор Мерфи, — поэтому я посмотрел на материалы и методы [в предыдущем исследовании]. И я обнаружил, что асептическая техника не была нормой, по крайней мере, в этом учреждении, и что они чистили ее физиологическим раствором. Они ничего не делали, кроме как держали конец иглы стерильным. Так что отчасти это может происходить, когда вы втягиваете инфекционные агенты с помощью иглы.Казалось бы, подразумевается, что инфекционные осложнения редки, если используются асептические методы.
,2 Потенциальные риски, связанные с лечением гормонами | Оценка медицинских рисков донорства человеческих ооцитов для исследования стволовых клеток: отчет семинара
По словам доктора Седарс,потенциальных осложнений, таких как респираторный дистресс у взрослых, настолько редки, что она не смогла найти данных, позволяющих оценить частоту возникновения.
Трудно также оценить уровень смертности, но, консервативно говоря, смерть наступает с частотой от одного раза в 450 000 до одного раза каждые 50 000 циклов донорства яйцеклеток (среди женщин с тяжелым СГЯ).Однако цифры вводят в заблуждение, потому что они включают пациенток, которые забеременели яйцеклетками, извлеченными из их яичников, и позже образовали тромбы во время беременности.
Вообще говоря, предупреждает доктор Седарс, данные о возникновении синдрома гиперстимуляции яичников не очень хороши. Например, существует очень мало проспективных исследований, в которых исследователь наблюдает за большой группой женщин с момента, когда они прошли стимуляцию яичников, до достаточно долгого времени после этого, чтобы узнать окончательный результат.Три проспективных исследования с разумными размерами выборки показали, что риск СГЯ составляет от 2,1 до 4,7 процента.
Без контроля, который исходит из проспективного исследования, трудно получить точную оценку частоты возникновения, и трудно узнать, каковы были факторы риска для каждого пациента. А не зная, каковы факторы риска, трудно определить группы женщин, которые особенно подвержены гиперстимуляции яичников.
Наконец, очень немногие исследования делят случаи синдрома на ранние и поздние классификации.Ранние случаи гиперстимуляции яичников возникают в течение трех-семи дней после инъекции ХГЧ, вводимой для запуска процесса овуляции, и эти ранние случаи вызваны этим триггером ХГЧ. Поздняя форма гиперстимуляции яичников, напротив, происходит через 12-17 дней после триггера ХГЧ и случается у женщин, которые забеременели, когда их собственные оплодотворенные яйцеклетки были возвращены в матку после процесса извлечения яйцеклеток. В этом случае синдром гиперстимуляции запускается ХГЧ из плаценты, выделяющейся на ранних сроках беременности женщины.
По словам доктора Седарса, различие между ранним и поздним этапом важно, поскольку риск тяжелых осложнений примерно в 4–12 раз выше среди женщин с синдромом гиперстимуляции с поздним началом. Это особенно важно для вопроса о донорстве яйцеклеток в исследовательских целях, поскольку эти доноры не забеременеют сразу после сдачи яйцеклеток и, следовательно, не будут затронуты синдромом гиперстимуляции с поздним началом.
Врачи могут использовать ряд стратегий, чтобы помочь донорам яйцеклеток избежать гиперстимуляции (см. Вставку 2-3).Седрс сказал. Первый — это просто
,
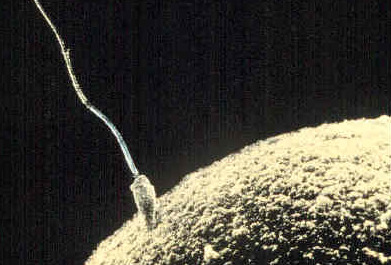
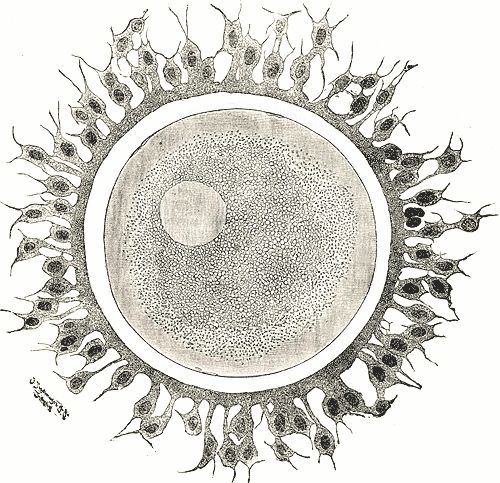
Leave A Comment