10.Регуляция слюноотделения. Морфофункциональная организация рефлекса слюноотделения.
Регуляция слюноотделения. Вне приема пищи небольшое количество слюны выделяют подъязычные, щечные и поднижнечелюстные железы человека. Прием пищи и связанные с ним факторы условно- и безусловнорефлекторно возбуждают слюноотделение. Латентный период слюноотделения зависит от силы пищевого раздражителя и возбудимости пищевого центра и составляет 1—30 с. Слюноотделение продолжается весь период еды и почти полностью прекращается вскоре после ее окончания. На стороне жевания слюны выделяется больше и с более высокой активностью амилазы, чем на противоположной стороне.
Блок-схема рефлекса слюноотделения.
Возбуждение от рецепторов полости рта передается в ЦНС по афферентным волокнам тройничного, лицевого, языкоглоточного и блуждающего нервов. Импульсы достигают продолговатого мозга, других отделов мозга, включая кору большого мозга. Основной центр слюноотделения расположен в продолговатом мозге, сюда и в боковые рога верхних грудных сегментов спинного мозга поступают
импульсы
из вышерасположенных отделов мозга. К
слюнным железам импульсы следуют по
эфферентным парасимпатическим и
симпатическим нервным волокнам.
К
слюнным железам импульсы следуют по
эфферентным парасимпатическим и
симпатическим нервным волокнам.
Парасимпатическая иннервация поднижнечелюстной и подъязычной слюнных желез начинается от верхнего слюноотделительного ядра продолговатого мозга. Волокна преганглионарных нейронов в составе барабанной струны доходят до ганглиев этих желез, где переключаются на постганглионарные нейроны и по их аксонам достигают гландулоцитов. Преганглионарные волокна околоушных желез берут начало из нижнего слюноотделительного ядра продолговатого мозга, проходят в составе языкоглоточного нерва до ушного узла. Здесь расположены вторые нейроны, по аксонам которых в состав ушно-височного нерва импульсы достигают слюнных желез.
Под влиянием ацетилхолина, высвобождаемого окончаниями постганглионарных нейронов, выделяется большое количество жидкой слюны с высокой концентрацией электролитов и низкой концентрацией муцина.
Симпатическая
иннервация слюнных желез осуществляется
из боковых рогов II—IV грудных сегментов
спинного мозга; отсюда волокна
преганглионарных нейронов следуют в
верхний шейный узел, где образуется
контакт с постганглионарными нейронами.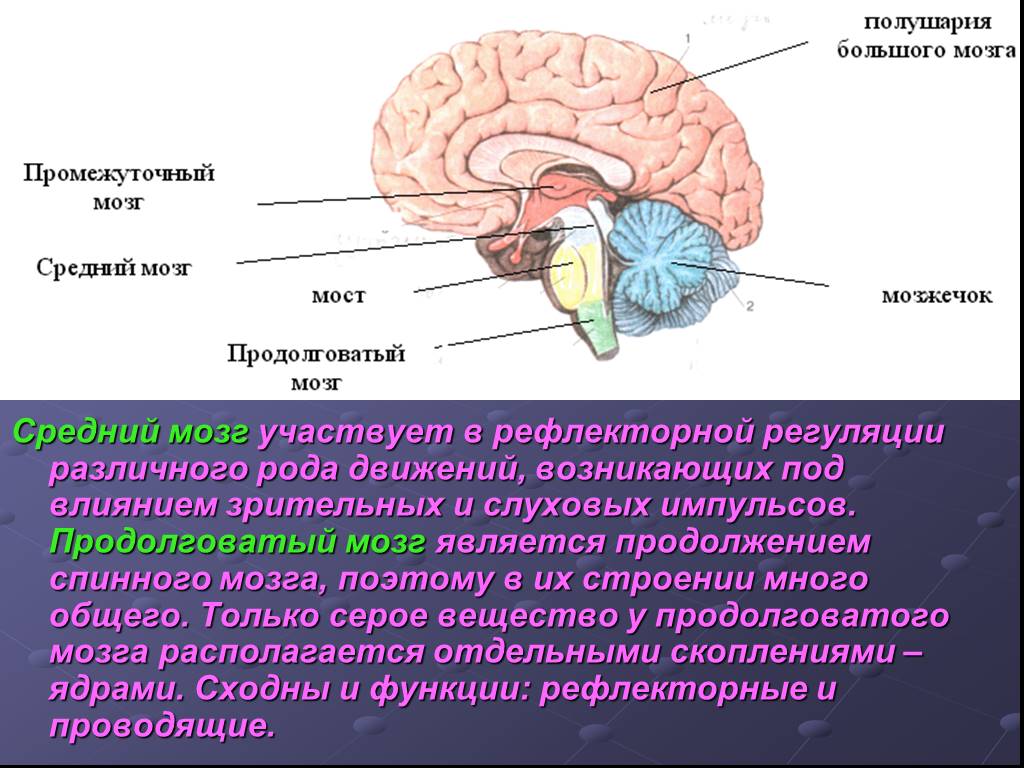 Их аксоны достигают слюнных желез.
Их аксоны достигают слюнных желез.
Норадреналин, высвобождаемый окончаниями постганглионарных нейронов, вызывает выделение небольшого количества густой слюны, усиливает образование в железах ферментов и муцина. Одновременное раздражение парасимпатических нервов усиливает секреторный эффект. У человека симпатические нервы в наибольшей мере усиливают секрецию поднижнечелюстных слюнных желез.
Различия в секреции слюнных желез в ответ на прием различной пищи объясняются изменениями частот импульсов по парасимпатическим и симпатическим нервным волокнам, которые могут быть одно- и разнонаправленными. Слюноотделение относится к числу легкотормозимых процессов. Секрецию слюны тормозят болевые раздражения, отрицательные эмоции, умственное напряжение и др.
Парасимпатическая денервация слюнных желез вызывает их гиперсекрецию, это так называемая паралитическая секреция (максимум ее обычно отмечается на 7—8-й день после операции).
Снижение
секреции слюнных желез называется
гипосаливацией (гипосиалия).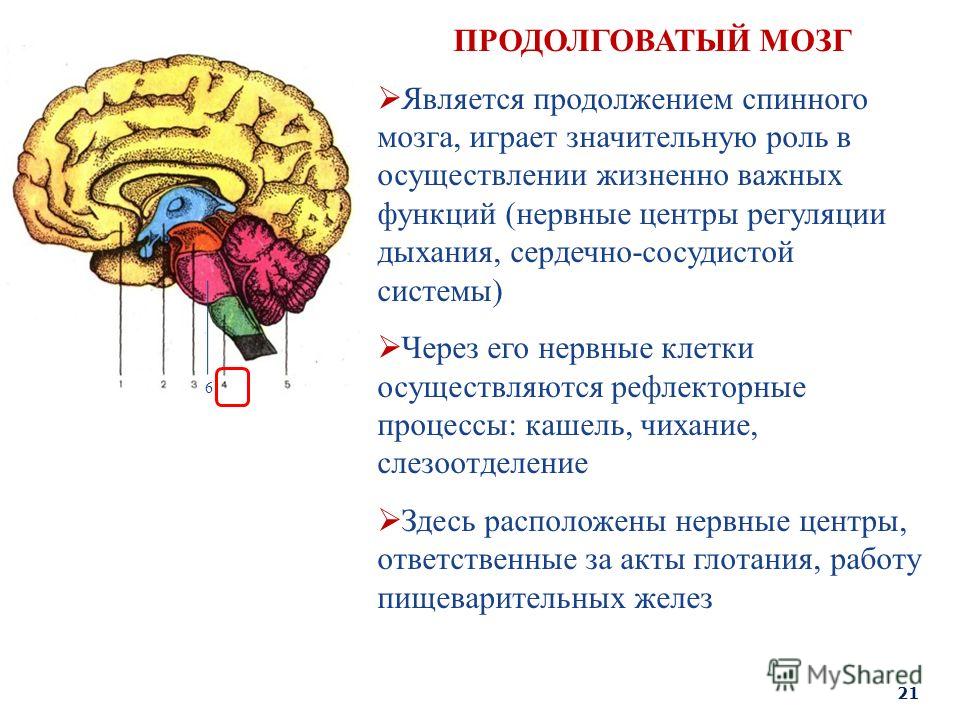 Она может
вызвать многие нарушения, способствовать
развитию микрофлоры во рту и быть
причиной скверного запаха изо рта (есть
и другие причины этого явления). Длительное
снижение слюноотделения может быть
причиной трофических нарушений слизистой
оболочки рта, десен, зубов. Избыточное
слюноотделение — гиперсаливация
(сиалорея, птиализм) — сопровождает
многие патологические состояния.
Она может
вызвать многие нарушения, способствовать
развитию микрофлоры во рту и быть
причиной скверного запаха изо рта (есть
и другие причины этого явления). Длительное
снижение слюноотделения может быть
причиной трофических нарушений слизистой
оболочки рта, десен, зубов. Избыточное
слюноотделение — гиперсаливация
(сиалорея, птиализм) — сопровождает
многие патологические состояния.
Опухоли центральной нервной системы Реабилитационный центр
Центральная нервная система (ЦНС) включает части нервной системы, которые локализуются внутри черепа или позвоночного столба. Нервы, лежащие за пределами черепа и позвоночника, составляют периферическую нервную систему. Головной мозг состоит из следующих отделов: парные большие полушария, промежуточный мозг, мозжечок и ствол. Каждый отдел имеет свои функции.
Полушарии головного мозга отвечают за мышление, эмоции, речь, мышечные движения, зрение, слух, тактильную и болевую чувствительность. Промежуточный мозг – за двигательную и чувствительную активность, терморегуляцию, водно-солевой баланс, чувство жажды и голода, выработку гипофизарных гормонов. Мозжечок контролирует движения тела, равновесие и осанку. К стволу головного мозга относятся: продолговатый мозг, варолиев мост и средний мозг. В продолговатом мозге находятся важные центры рефлекторной регуляции вегетативных функций, в том числе регуляции кровообращения, дыхания, глотания, слюноотделения, чихания, рвоты, кашля. В составе варолиева моста проходят восходящие и нисходящие нервные пути, а также ядра, переключающие импульсы на мозжечок. В среднем мозге располагаются центры зрительных и слуховых рефлексов. Спинной мозг является проводником четырех видов чувствительности: тактильной, температурной, болевой и проприоцептивной.
Мозжечок контролирует движения тела, равновесие и осанку. К стволу головного мозга относятся: продолговатый мозг, варолиев мост и средний мозг. В продолговатом мозге находятся важные центры рефлекторной регуляции вегетативных функций, в том числе регуляции кровообращения, дыхания, глотания, слюноотделения, чихания, рвоты, кашля. В составе варолиева моста проходят восходящие и нисходящие нервные пути, а также ядра, переключающие импульсы на мозжечок. В среднем мозге располагаются центры зрительных и слуховых рефлексов. Спинной мозг является проводником четырех видов чувствительности: тактильной, температурной, болевой и проприоцептивной.
В этом разделе размещена информация по опухолям головного и спинного мозга:
- Классификация
- Причины возникновения опухолей центральной нервной системы
- Симптомы опухолей ЦНС
- Прогноз
Причины возникновения опухолей центральной нервной системы
В основе опухолевого роста лежит повреждение генетического материала клетки, приводящее к нарушению контроля ее роста.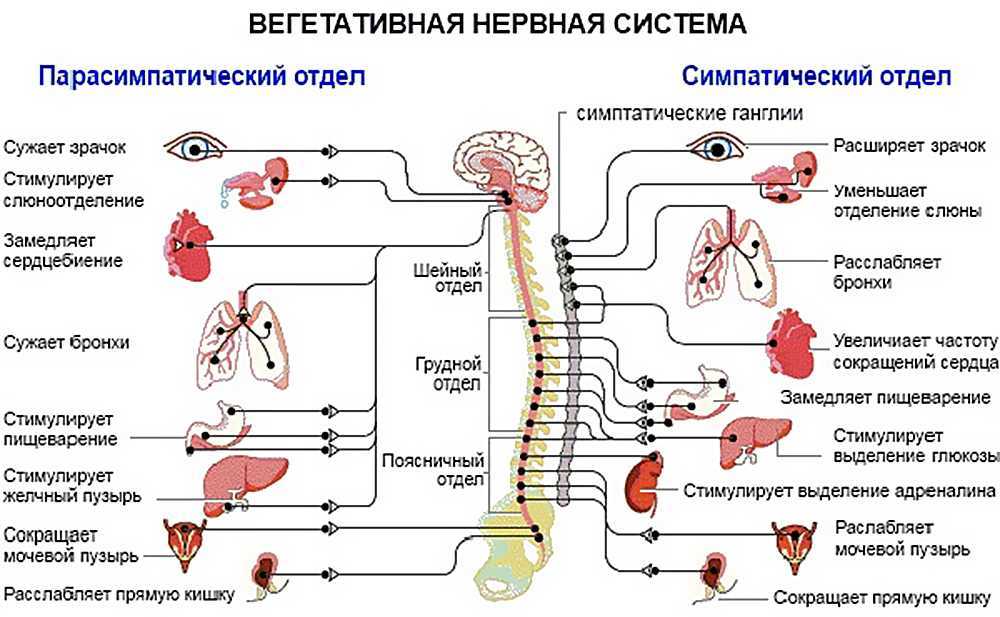 Характер генетического дефекта (или дефектов) определяет вид опухоли. Опухолевый рост может начаться в любой части головного или спинного мозга.
Характер генетического дефекта (или дефектов) определяет вид опухоли. Опухолевый рост может начаться в любой части головного или спинного мозга.
Подробнее
Симптомы опухоли мозга
Клинические проявления опухолей ЦНС зависят от их локализации и размера. Основные симптомы, настораживающие в отношении опухоли головного мозга: Головная боль, возникающая утром или головная боль, которая проходит после рвоты. Частая тошнота и рвота. Нарушение зрения, слуха, проблемы с речью. Потеря равновесия и нарушение походки. Слабость на одной стороне тела. Необычная сонливость или изменение уровня повседневной активности. Необычные изменения личности или поведения.
Подробнее
Прогноз при опухолях головного мозга
Прогноз (шанс на выздоровление) и варианты лечения первичных опухолей головного мозга зависит от следующего: Тип и степень опухоли. Возможность удаления хирургическим путем. Остались ли раковые клетки после операции. Есть ли определенные изменения в хромосомах. Первичный или рецидивирующий рак. Общего состояние здоровье пациента.
Первичный или рецидивирующий рак. Общего состояние здоровье пациента.
Подробнее
Классификация опухолей мозга (ЦНС)
Современная классификация опухолей ЦНС использует двойную систему градации степени злокачественности. Первая кодирует по системе МКБ/О, где степень злокачественности обозначена цифрами через дробь:
Подробнее
Взаимодействия между развивающимися нервами и слюнными железами
1. Proctor GB, Carpenter GH. Регуляция функции слюнных желез вегетативными нервами. Автон Нейроски. 2007; 133:3–18. doi: 10.1016/j.autneu.2006.10.006. [PubMed] [CrossRef] [Google Scholar]
2. Knox SM, Lombaert IM, Reed X, Vitale-Cross L, Gutkind JS, Hoffman MP. Парасимпатическая иннервация поддерживает эпителиальные клетки-предшественники во время органогенеза слюны. Наука. 2010;329:1645–7. doi: 10.1126/science.1192046. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Knox SM, Lombaert IM, Haddox CL, Abrams SR, Cotrim A, Wilson AJ, et al. Парасимпатическая стимуляция улучшает регенерацию эпителиальных органов. Нац коммун. 2013;4:1494. doi: 10.1038/ncomms2493. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Парасимпатическая стимуляция улучшает регенерацию эпителиальных органов. Нац коммун. 2013;4:1494. doi: 10.1038/ncomms2493. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Knosp WM, Knox SM, Hoffman MP. Органогенез слюнных желез. ПРОВОДА. Дев биол. 2012; 1:69–82. [PubMed] [Google Scholar]
5. Фроммер Дж. Добавочная околоушная железа человека: ее частота, природа и значение. Oral Surg Oral Med Oral Pathol. 1977;43:671–6. doi: 10.1016/0030-4220(77)
-4. [PubMed] [CrossRef] [Google Scholar]6. Дэвис Р.А., Энсон Б.Дж., Будингер Дж.М., Курт Л.Р. Хирургическая анатомия лицевого нерва и околоушной железы на основе исследования 350 шейно-лицевых половин. Хирургический гинекологический акушер. 1956; 102: 385–412. [PubMed] [Google Scholar]
7. Kahle W, Frotscher M. Цветной атлас анатомии человека. , Satoh Y, Murakami T. Входы из нескольких источников сходятся на нейронах верхнего слюноотделительного ядра у крыс под наркозом. Автон Нейроски. 2010; 156:104–10.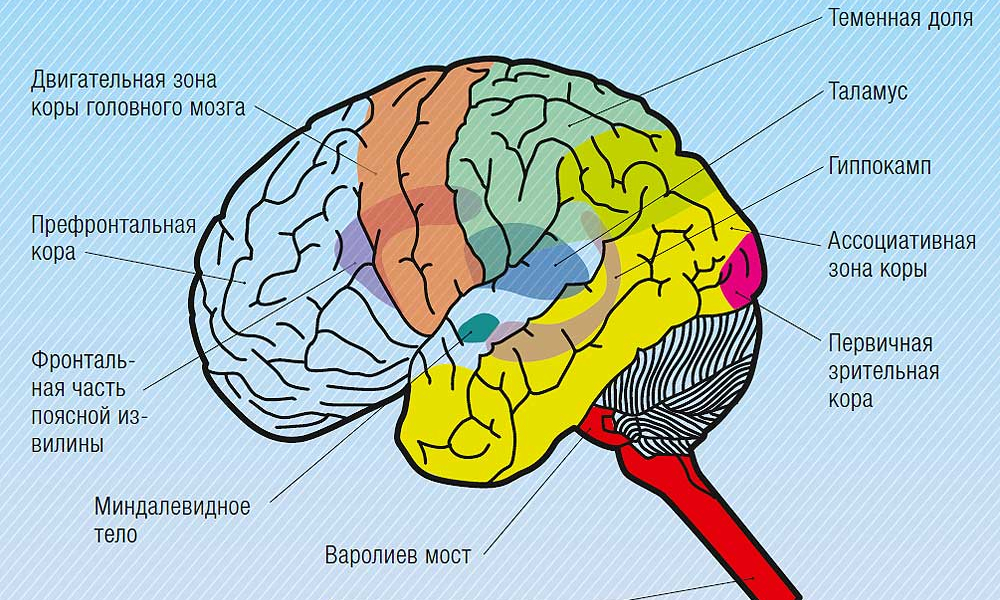 doi: 10.1016/j.autneu.2010.03.014. [PubMed] [CrossRef] [Академия Google]
doi: 10.1016/j.autneu.2010.03.014. [PubMed] [CrossRef] [Академия Google]
9. Мэтисон Р., Дэвисон Дж.С., Бефус А.Д. Нейроэндокринная регуляция воспаления и репарации тканей факторами поднижнечелюстной железы. Иммунол сегодня. 1994; 15: 527–32. doi: 10.1016/0167-5699(94)
10. Savastano LE, Castro AE, Fitt MR, Rath MF, Romeo HE, Muñoz EM. Стандартизированная хирургическая техника верхней шейной ганглионэктомии у крыс. J Neurosci Методы. 2010; 192:22–33. doi: 10.1016/j.jneumeth.2010.07.007. [PubMed] [CrossRef] [Академия Google]
11. Ekström J, Garrett JR, Månsson B, Rowley PS, Tobin G. Истощение крупных везикул с плотным ядром из окончаний парасимпатических нервов в околоушных железах крыс после длительной стимуляции ушно-височного нерва. Регул Пепт. 1989; 25: 61–7. doi: 10.1016/0167-0115(89)90248-6. [PubMed] [CrossRef] [Google Scholar]
12. Экстром Дж. Роль неадренергических, нехолинергических вегетативных трансмиттеров в деятельности слюнных желез in vivo.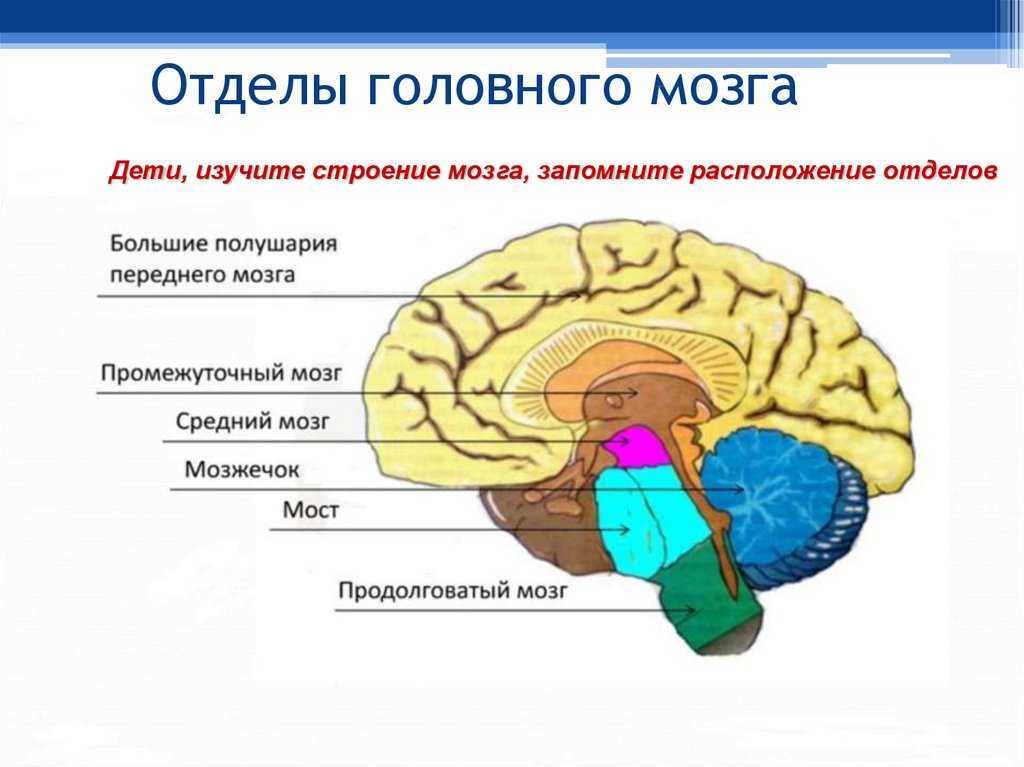 В: Garrett JR, Ekstrom J, Anderson LC, eds. Нейронные механизмы секреции слюны. Базель: Каргер, 19 лет99:94-130. [Google Scholar]
В: Garrett JR, Ekstrom J, Anderson LC, eds. Нейронные механизмы секреции слюны. Базель: Каргер, 19 лет99:94-130. [Google Scholar]
13. Лундберг Дж.М., Ангард А., Фаренкруг Дж. Дополнительная роль вазоактивного кишечного полипептида (ВИП) и ацетилхолина для кровотока и секреции поднижнечелюстной железы кошки. II. Эффекты холинергических антагонистов и антисыворотки ВИП. Acta Physiol Scand. 1981; 113: 329–36. doi: 10.1111/j.1748-1716.1981.tb06903.x. [PubMed] [CrossRef] [Google Scholar]
14. Лундберг Дж. М., Ангард А., Фаренкруг Дж. Дополнительная роль вазоактивного кишечного полипептида (ВИП) и ацетилхолина для кровотока и секреции поднижнечелюстной железы кошки. I. VIP-релиз. Acta Physiol Scand. 1981;113:317–27. doi: 10.1111/j.1748-1716.1981.tb06902.x. [PubMed] [CrossRef] [Google Scholar]
15. Lundberg JM, Terenius L, Hökfelt T, Martling CR, Tatemoto K, Mutt V, et al. Иммунореактивность, подобная нейропептиду Y (NPY), в периферических норадренергических нейронах и влияние NPY на симпатическую функцию. Acta Physiol Scand. 1982; 116: 477–80. doi: 10.1111/j.1748-1716.1982.tb07171.x. [PubMed] [CrossRef] [Google Scholar]
Acta Physiol Scand. 1982; 116: 477–80. doi: 10.1111/j.1748-1716.1982.tb07171.x. [PubMed] [CrossRef] [Google Scholar]
16. Konishi S, Tsunoo A, Otsuka M. Энкефалин как передатчик пресинаптического торможения в симпатических ганглиях. Природа. 1981;294:80–2. дои: 10.1038/294080a0. [PubMed] [CrossRef] [Google Scholar]
17. Кобаши М., Итикава Х., Кобаши М., Фунахаши М., Митох Ю., Мацуо Р. Происхождение чувствительных нервных волокон, иннервирующих поднижнечелюстную слюнную железу у крыс. Мозг Res. 2005; 1060: 184–7. doi: 10.1016/j.brainres.2005.08.012. [PubMed] [CrossRef] [Google Scholar]
18. von Bültzingslöwen I, Sollecito TP, Fox PC, Daniels T, Jonsson R, Lockhart PB, et al. Слюнная дисфункция, связанная с системными заболеваниями: систематический обзор и рекомендации по клиническому ведению. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 103 (Приложение): e1–15. [PubMed] [Академия Google]
19. Fauchais AL, Magy L, Vidal E. Центральные и периферические неврологические осложнения первичного синдрома Шегрена.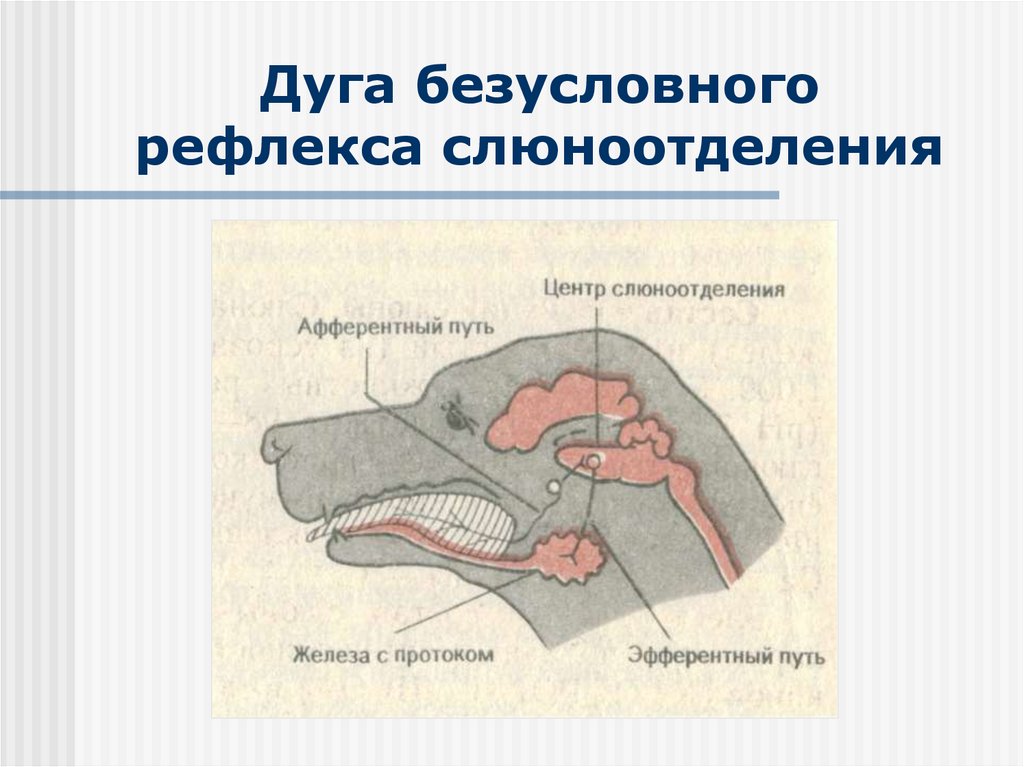 Пресс Мед. 2012;41:e485–93. doi: 10.1016/j.lpm.2012.06.002. [PubMed] [CrossRef] [Google Scholar]
Пресс Мед. 2012;41:e485–93. doi: 10.1016/j.lpm.2012.06.002. [PubMed] [CrossRef] [Google Scholar]
20. Sumida T, Iizuka M, Asashima H, Tsuboi H, Matsumoto I. Патогенная роль иммунного ответа против M3 мускариновых рецепторов ацетилхолина при синдроме Шегрена. Пресс Мед. 2012;41:e461–6. doi: 10.1016/j.lpm.2012.05.019. [PubMed] [CrossRef] [Академия Google]
21. Sumida T, Tsuboi H, Iizuka M, Asashima H, Matsumoto I. Антитела к мускариновому рецептору ацетилхолина M3 у пациентов с синдромом Шегрена. Мод Ревматол. 2012 г.: 10.1007/s10165-012-0788-5. [PubMed] [CrossRef] [Google Scholar]
22. Vissink A, Mitchell JB, Baum BJ, Limesand KH, Jensen SB, Fox PC, et al. Клиническое лечение гипофункции слюнных желез и ксеростомии у больных раком головы и шеи: успехи и препятствия. Int J Radiat Oncol Biol Phys. 2010;78:983–91. doi: 10.1016/j.ijrobp.2010.06.052. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Грундманн О., Митчелл Г.К., Лаймсанд К.Х. Чувствительность слюнных желез к радиации: от животных моделей к терапии.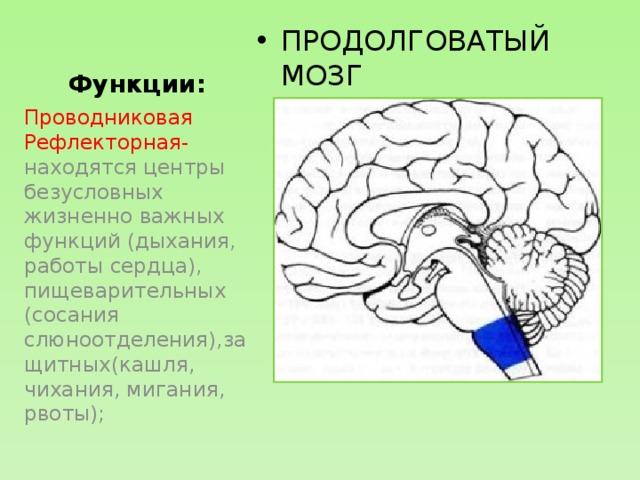 Джей Дент Рез. 2009; 88: 894–903. doi: 10.1177/0022034509343143. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Джей Дент Рез. 2009; 88: 894–903. doi: 10.1177/0022034509343143. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Baum BJ. Принципы слюноотделения. Энн Н.Ю. Академия наук. 1993; 694: 17–23. doi: 10.1111/j.1749-6632.1993.tb18338.x. [PubMed] [CrossRef] [Google Scholar]
25. Baum BJ, Zheng C, Alevizos I, Cotrim AP, Liu S, McCullagh L, et al. Разработка основанного на переносе генов лечения радиационно-индуцированной гипофункции слюнных желез. Оральный онкол. 2010;46:4–8. doi: 10.1016/j.oraloncology.2009.09.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Карпентер Г.Х., Осайлан С.М., Коррейя П., Патерсон К.П., Проктор Г.Б. Перевязка слюнных желез крыс вызывает обратимую секреторную гипофункцию. Acta Physiol (Oxf) 2007; 189: 241–9. doi: 10.1111/j.1365-201X.2006.01662.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Мураками М., Нагато Т., Таниока Х. Влияние парасимпатэктомии на гистохимическое созревание миоэпителиальных клеток подъязычной слюнной железы крысы.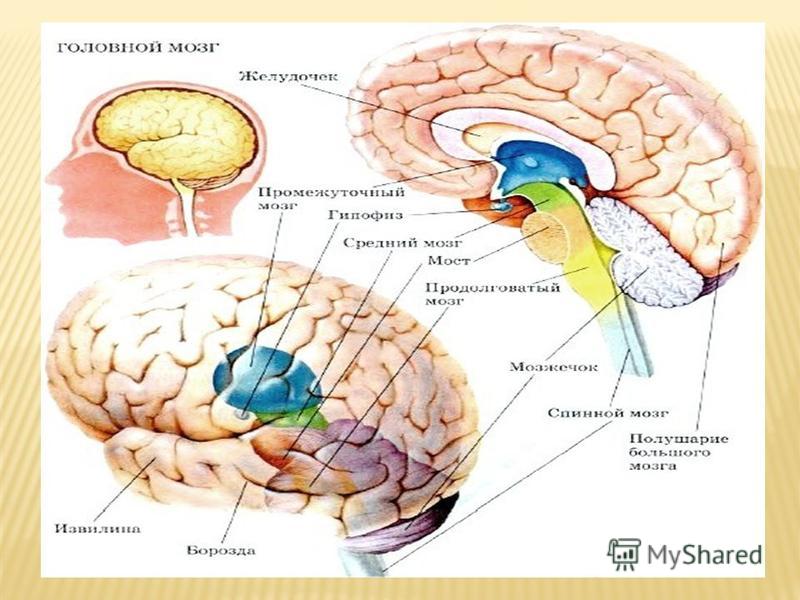 Arch Oral Biol. 1991;36:511–7. doi: 10.1016/0003-9969(91)-J. [PubMed] [CrossRef] [Google Scholar]
Arch Oral Biol. 1991;36:511–7. doi: 10.1016/0003-9969(91)-J. [PubMed] [CrossRef] [Google Scholar]
28. Henriksson R, Carlsöö B, Danielsson A, Sundström S, Jönsson G. Влияние симпатической нервной системы на развитие околоушной железы крысы. J Neurol Sci. 1985; 71: 183–91. doi: 10.1016/0022-510X(85)
-9. [PubMed] [CrossRef] [Google Scholar]
29. D’Amico-Martel A, Noden DM. Вклад клеток плакоды и нервного гребня в периферические краниальные ганглии птиц. Ам Дж Анат. 1983; 166: 445–68. doi: 10.1002/aja.1001660406. [PubMed] [CrossRef] [Академия Google]
30. Ле Дуарен Н.М., Тейе М.А. Экспериментальный анализ миграции и дифференцировки нейробластов вегетативной нервной системы и нейроэктодермальных мезенхимальных производных с использованием метода биологической маркировки клеток. Дев биол. 1974; 41: 162–84. doi: 10.1016/0012-1606(74)90291-7. [PubMed] [CrossRef] [Google Scholar]
31. Coughlin MD. Раннее развитие парасимпатических нервов в поднижнечелюстной железе мыши.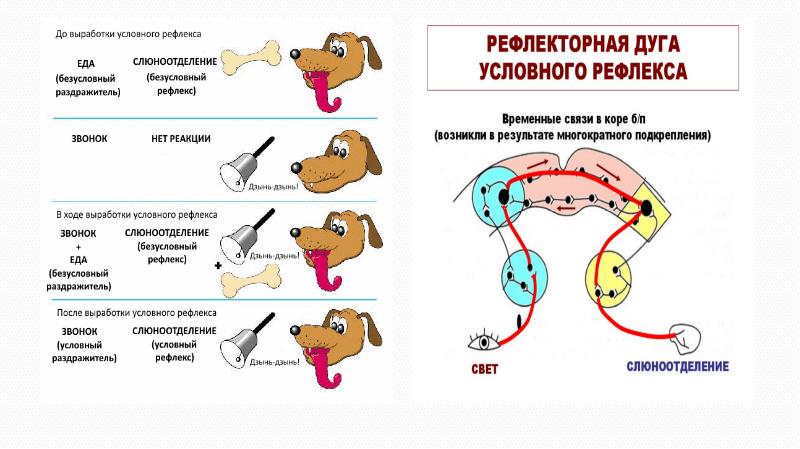 Дев биол. 1975; 43: 123–39. doi: 10.1016/0012-1606(75)
Дев биол. 1975; 43: 123–39. doi: 10.1016/0012-1606(75)
-0. [PubMed] [CrossRef] [Академия Google]
32. Кафлин, доктор медицины. Стимуляция органа-мишени роста парасимпатического нерва в развивающейся поднижнечелюстной железе мыши. Дев биол. 1975; 43: 140–58. doi: 10.1016/0012-1606(75)-2. [PubMed] [CrossRef] [Google Scholar]
33. Nishi R. Способность развивающегося эпителия привлекать отростки нейритов в культуре не коррелирует с появлением ламинина. J Neurosci Res. 1988; 21: 307–14. doi: 10.1002/jnr.4
34. Heuckeroth RO, Enomoto H, Grider JR, Golden JP, Hanke JA, Jackman A, et al. Нацеливание на гены показывает критическую роль нейтурина в развитии и поддержании кишечных, сенсорных и парасимпатических нейронов. Нейрон. 1999;22:253–63. doi: 10.1016/S0896-6273(00)81087-9. [PubMed] [CrossRef] [Google Scholar]
35. Росси Дж., Томак А., Саарма М., Айраксинен М.С. Различная роль передачи сигналов GFRalpha1 и GFRalpha2 в различных краниальных парасимпатических ганглиях in vivo.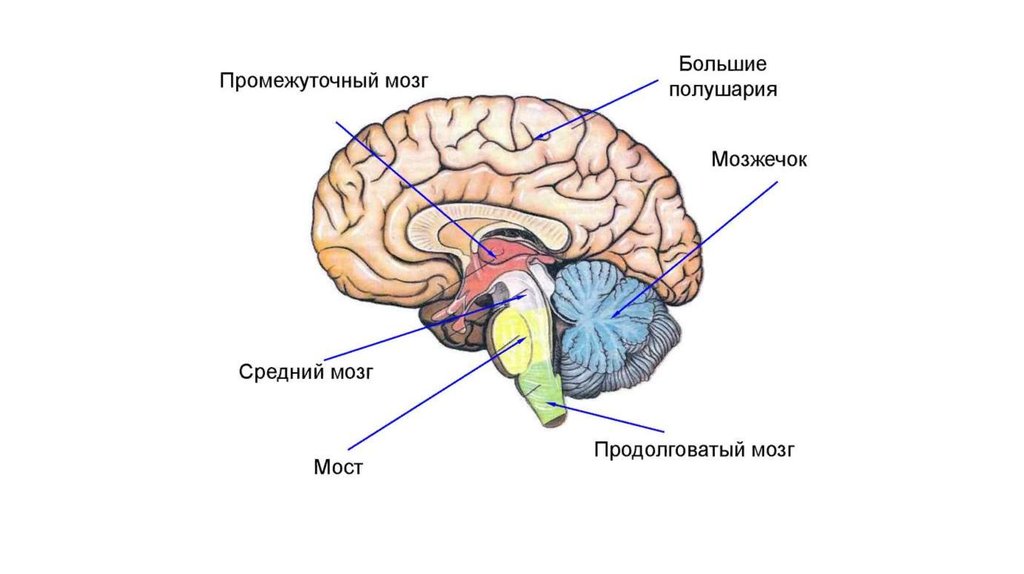 Евр Джей Нейроски. 2000;12:3944–52. doi: 10.1046/j.1460-9568.2000.00292.x. [PubMed] [CrossRef] [Google Scholar]
Евр Джей Нейроски. 2000;12:3944–52. doi: 10.1046/j.1460-9568.2000.00292.x. [PubMed] [CrossRef] [Google Scholar]
36. Rossi J, Herzig KH, Võikar V, Hiltunen PH, Segerstråle M, Airaksinen MS. Дефицит и дисфункция иннервации пищеварительного тракта у мышей, лишенных рецептора семейства GDNF альфа2. Джей Клин Инвест. 2003; 112: 707–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Росси Дж., Луукко К., Потеряев Д., Лаурикайнен А., Сунь Ю.Ф., Лааксо Т. и соавт. Задержка роста и нарушения в энтеральной и парасимпатической нервной системе у мышей с отсутствием GFR альфа2, функционального рецептора нейтурина. Нейрон. 1999; 22: 243–52. doi: 10.1016/S0896-6273(00)81086-7. [PubMed] [CrossRef] [Google Scholar]
38. Paratcha G, Ledda F. GDNF и GFRalpha: универсальный молекулярный комплекс для развития нейронов. Тренды Нейроси. 2008; 31: 384–91. doi: 10.1016/j.tins.2008.05.003. [PubMed] [CrossRef] [Академия Google]
39. Буж-Белло А., Бухман В.Л., Хортон А., Розенталь А. , Дэвис А.М. GDNF является возрастным фактором выживания сенсорных и вегетативных нейронов. Нейрон. 1995; 15:821–8. doi: 10.1016/0896-6273(95)
, Дэвис А.М. GDNF является возрастным фактором выживания сенсорных и вегетативных нейронов. Нейрон. 1995; 15:821–8. doi: 10.1016/0896-6273(95)
40. Росси Дж., Айраксинен М.С. Передача сигналов семейства GDNF в экзокринных тканях: различные роли GDNF и нейтурина в развитии парасимпатических нейронов. Adv Exp Med Biol. 2002; 506 (часть А): 19–26. [PubMed] [Google Scholar]
41. Enomoto H, Heuckeroth RO, Golden JP, Johnson EM, Milbrandt J. Развитие краниальных парасимпатических ганглиев требует последовательного действия GDNF и нейтурина. Разработка. 2000; 127:4877–89.. [PubMed] [Google Scholar]
42. Musselmann K, Green JA, Sone K, Hsu JC, Bothwell IR, Johnson SA, et al. Атлас экспрессии генов слюнных желез идентифицирует новый регулятор морфогенеза ветвления. Джей Дент Рез. 2011;90:1078–84. doi: 10.1177/0022034511413131. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Proctor GB, Asking B. Сравнение изменений в составе белков околоушной железы крыс через 1 и 12 недель после хирургической симпатэктомии. Q J Exp Physiol. 1989; 74: 835–40. [PubMed] [Академия Google]
Q J Exp Physiol. 1989; 74: 835–40. [PubMed] [Академия Google]
44. Боттаро Б., Катлер Л.С. Электрофизиологическое исследование постнатального развития вегетативной иннервации поднижнечелюстной слюнной железы крысы. Arch Oral Biol. 1984; 29: 237–42. doi: 10.1016/0003-9969(84)
-X. [PubMed] [CrossRef] [Google Scholar]45. Schuchardt A, D’Agati V, Larsson-Blomberg L, Costantini F, Pachnis V. Дефекты почек и кишечной нервной системы мышей, лишенных рецептора тирозинкиназы Ret. Природа. 1994; 367: 380–3. doi: 10.1038/367380a0. [PubMed] [CrossRef] [Академия Google]
46. Moore MW, Klein RD, Fariñas I, Sauer H, Armanini M, Phillips H, et al. Аномалии почек и нейронов у мышей с отсутствием GDNF. Природа. 1996; 382:76–79. doi: 10.1038/382076a0. [PubMed] [CrossRef] [Google Scholar]
47. Enomoto H, Araki T, Jackman A, Heuckeroth RO, Snider WD, Johnson EM, Jr., et al. Мыши с дефицитом СКФ альфа1 имеют нарушения в энтеральной нервной системе и почках. Нейрон. 1998; 21: 317–24.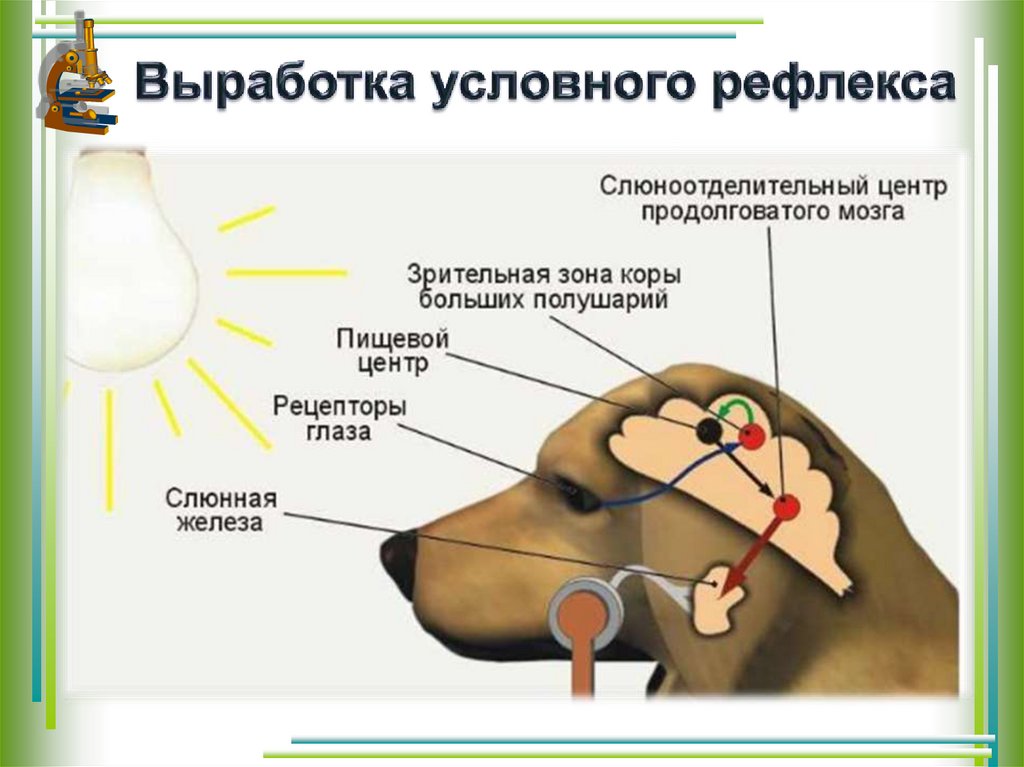 doi: 10.1016/S0896-6273(00)80541-3. [PubMed] [CrossRef] [Академия Google]
doi: 10.1016/S0896-6273(00)80541-3. [PubMed] [CrossRef] [Академия Google]
48. Cacalano G, Fariñas I, Wang LC, Hagler K, Forgie A, Moore M, et al. GFRalpha1 является важным компонентом рецептора для GDNF в развивающейся нервной системе и почках. Нейрон. 1998; 21:53–62. doi: 10.1016/S0896-6273(00)80514-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Worby CA, Vega QC, Chao HH, Seasholtz AF, Thompson RC, Dixon JE. Идентификация и характеристика GFRalpha-3, нового корецептора, принадлежащего к семейству нейротрофических рецепторов, полученных из линии глиальных клеток. Дж. Биол. Хим. 1998;273:3502–8. doi: 10.1074/jbc.273.6.3502. [PubMed] [CrossRef] [Google Scholar]
50. Kamiji MM, Inui A. Селективные лиганды нейропептидных γ-рецепторов в лечении ожирения. Endocr Rev. 2007; 28:664–84. doi: 10.1210/er.2007-0003. [PubMed] [CrossRef] [Google Scholar]
51. Movafagh S, Hobson JP, Spiegel S, Kleinman HK, Zukowska Z. Нейропептид Y индуцирует миграцию, пролиферацию и образование трубок эндотелиальных клеток бимодально через Y1, Y2 и Y5.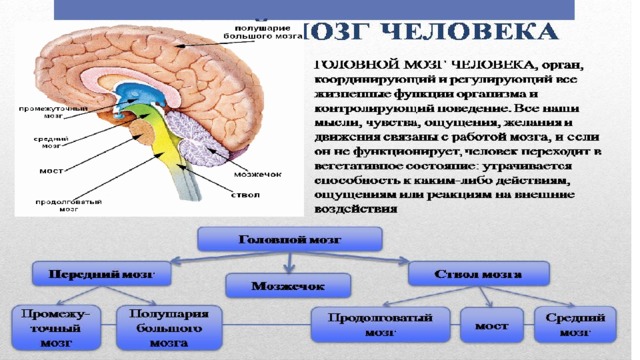 рецепторы. ФАСЭБ Дж. 2006; 20:1924–6. doi: 10.1096/fj.05-4770fje. [PubMed] [CrossRef] [Google Scholar]
рецепторы. ФАСЭБ Дж. 2006; 20:1924–6. doi: 10.1096/fj.05-4770fje. [PubMed] [CrossRef] [Google Scholar]
52. Decressac M, Pain S, Chabeauti PY, Frangeul L, Thiriet N, Herzog H, et al. Нейропротекция нейропептидом Y в клеточных и животных моделях болезни Паркинсона. Нейробиол Старение. 2012;33:2125–37. doi: 10.1016/j.neurobiolaging.2011.06.018. [PubMed] [CrossRef] [Google Scholar]
53. Lähteenmäki M, Kupari J, Airaksinen MS. Повышенный апоптоз парасимпатических, но не кишечных нейронов у мышей с отсутствием GFRalpha2. Дев биол. 2007; 305:325–32. doi: 10.1016/j.ydbio.2007.02.016. [PubMed] [CrossRef] [Академия Google]
54. Вейерс О.Б., Левендаг П.С., Брааксма М.М., Бунзаайер М., Виш Л.Л., Шмитц П.И. Пациенты с раком головы и шеи, излеченные лучевой терапией: обзор синдрома сухости во рту у выживших в течение длительного времени. Шея головы. 2002; 24: 737–47. doi: 10.1002/hed.10129. [PubMed] [CrossRef] [Google Scholar]
55. Soltoff SP, Hedden L. Изопротеренол и цАМФ блокируют фосфорилирование ERK и усиливают увеличение [Ca2+]i и потребление кислорода путем стимуляции мускариновых рецепторов в околоушных и поднижнечелюстных ацинарных клетках крыс.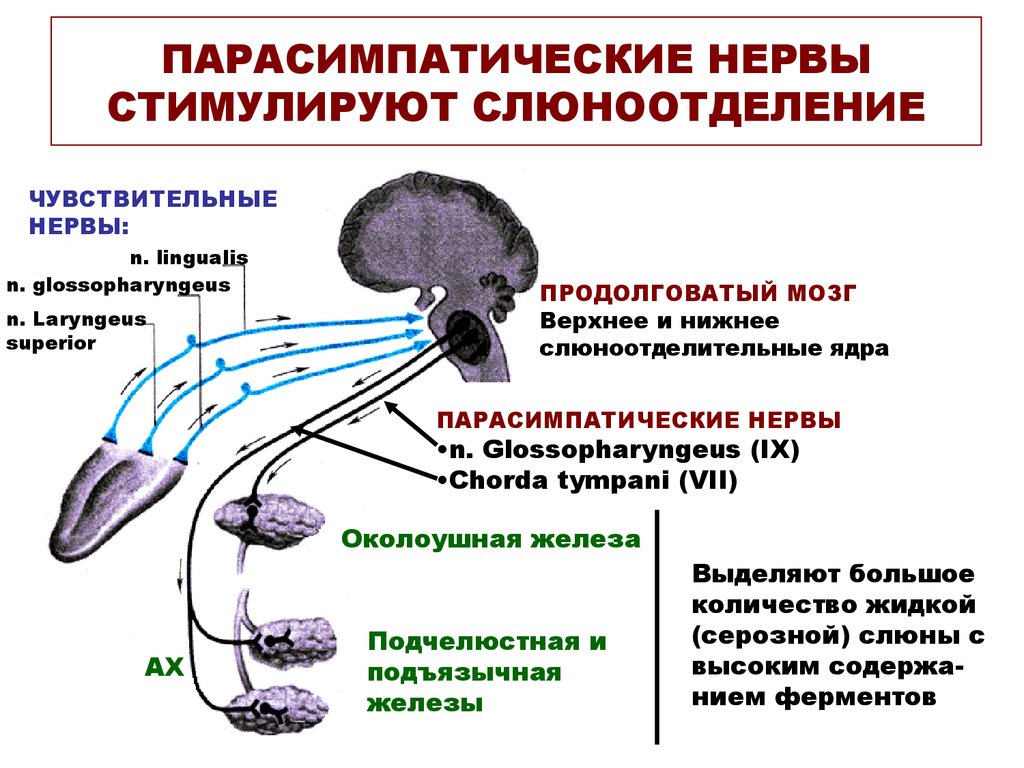 Дж. Биол. Хим. 2010; 285:13337–48. doi: 10.1074/jbc.M110.112094. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Биол. Хим. 2010; 285:13337–48. doi: 10.1074/jbc.M110.112094. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Oben JA, Roskams T, Yang S, Lin H, Sinelli N, Li Z, et al. Ингибирование симпатической нервной системы увеличивает количество печеночных клеток-предшественников и уменьшает повреждение печени. Гепатология. 2003; 38: 664–73. doi: 10.1053/jhep.2003.50371. [PubMed] [CrossRef] [Google Scholar]
57. Бочкарева Н.В., Бочкарев В.А., Велкер П., Айраксинен М., Рот В., Суванто П. и соавт. Новые роли нейротрофического фактора глиальной клеточной линии и нейтурина: участие в контроле цикла роста волос. Ам Джей Патол. 2000; 156:1041–53. дои: 10.1016/S0002-9440(10)64972-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Marks WJ, Jr., Bartus RT, Siffert J, Davis CS, Lozano A, Boulis N, et al. Доставка гена AAV2-нейтурина при болезни Паркинсона: двойное слепое рандомизированное контролируемое исследование. Ланцет Нейрол. 2010;9:1164–72.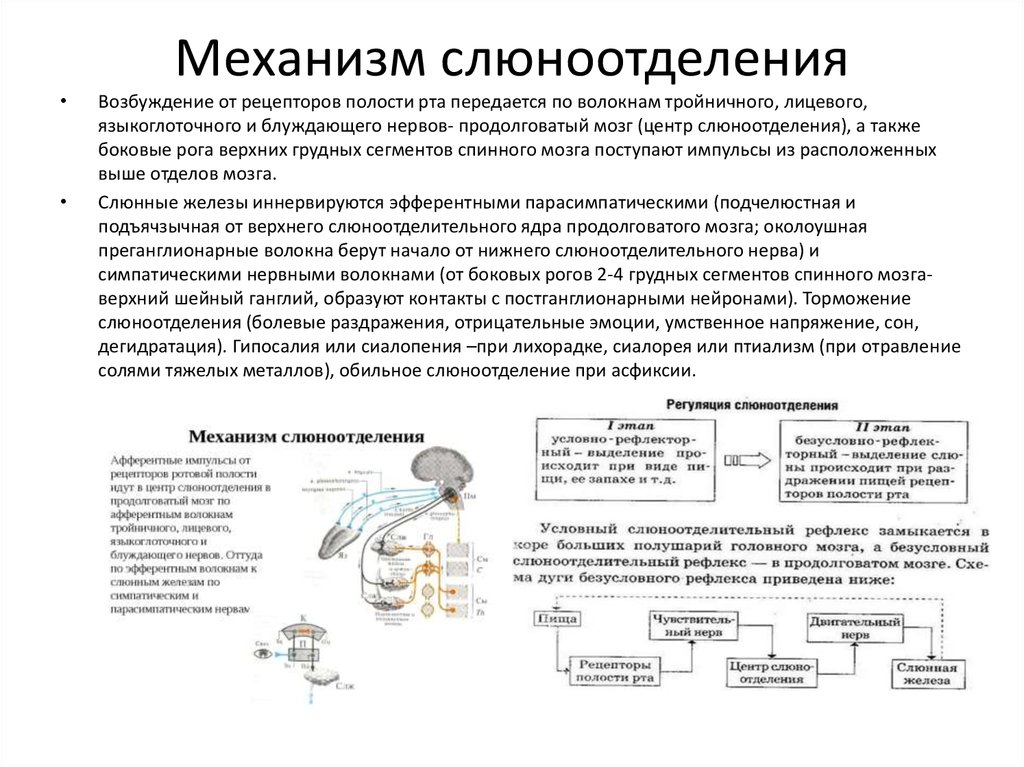 doi: 10.1016/S1474-4422(10)70254-4. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/S1474-4422(10)70254-4. [PubMed] [CrossRef] [Google Scholar]
59. Bartus RT, Brown L, Wilson A, Kruegel B, Siffert J, Johnson EM, Jr., et al. Правильно масштабированный и направленный AAV2-NRTN (нейртурин) на черную субстанцию безопасен, эффективен и не вызывает потери веса: поддержка нацеливания на ниграл при болезни Паркинсона. Нейробиол Дис. 2011;44:38–52. doi: 10.1016/j.nbd.2011.05.026. [PubMed] [CrossRef] [Академия Google]
Регуляция слюны — симпатическая — парасимпатическая
1,5 литра слюны ежедневно вырабатывается человеческим организмом, что необходимо для выполнения жизненно важной роли в смазывании пищи, пищеварении и защите полости рта.
Производство и состав слюны находятся под нервным контролем – через парасимпатическую и симпатическую нервную систему.
В этой статье мы рассмотрим регуляцию слюноотделения и ее клинические корреляции.
Производство слюны
Слюна вырабатывается слюнными железами тела – околоушными , поднижнечелюстными и подъязычными .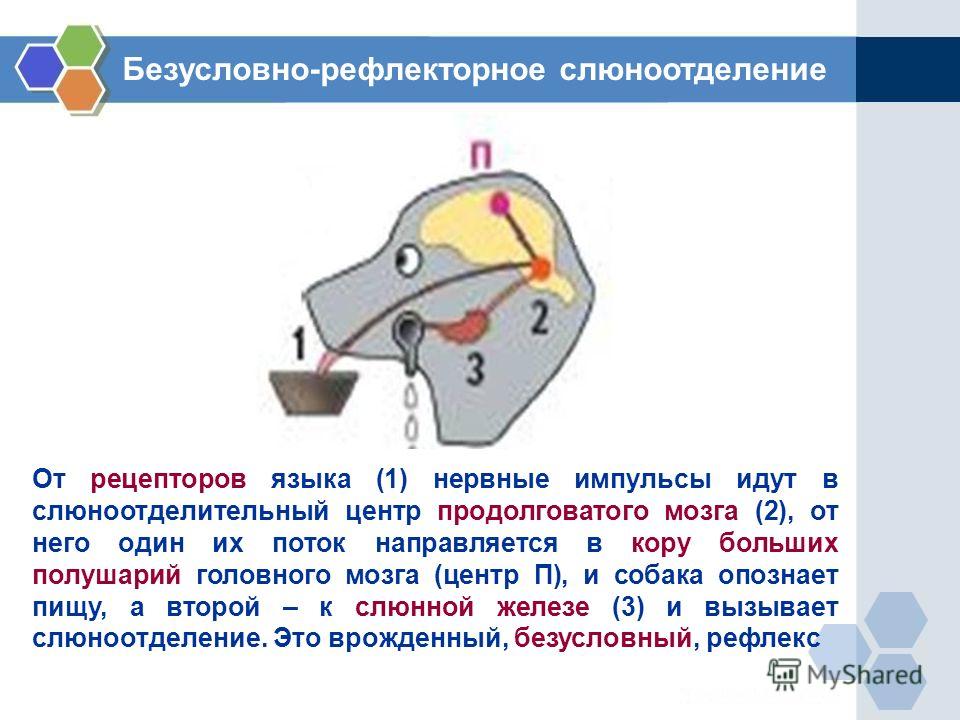 Внутри желез ацинарных клеток отвечают за объем секретируемой слюны, а протоковых клеток отвечают за состав слюны.
Внутри желез ацинарных клеток отвечают за объем секретируемой слюны, а протоковых клеток отвечают за состав слюны.
Информацию о выделении слюны можно найти здесь.
By Boumphreyfr (Собственная работа) [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0) или GFDL (http://www.gnu.org/copyleft/fdl.html) ], через Викисклад
Рис. 1.0. Диаграмма, показывающая модификацию слюны.
Автономный контроль
Слюна вырабатывается и секретируется слюнными железами организма. Эти железы находятся под контролем вегетативной нервной системы , состоящей из симпатических и парасимпатических нервных волокон.
Симпатическая иннервация
Симпатический контроль продукции слюны осуществляется через верхний шейный ганглий. Симпатическая стимуляция приводит к высвобождению норадреналин , который действует на альфа- и бета-адренергические рецепторы.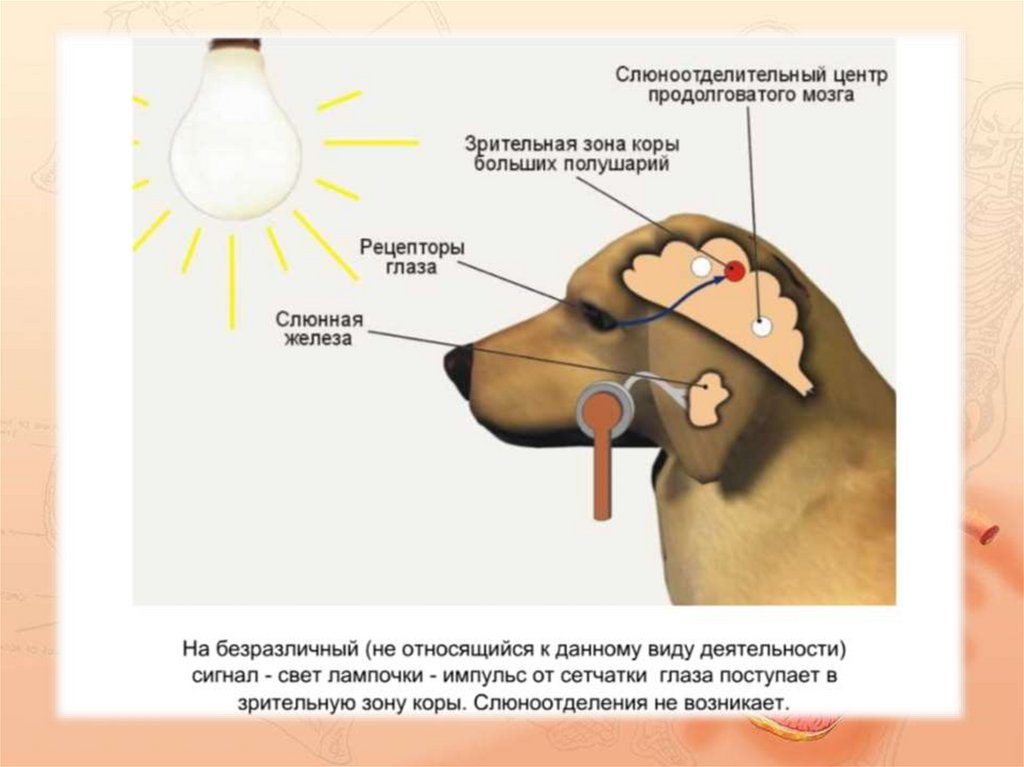
Это приводит к следующим эффектам:
- Снижение продукции слюны ацинарными клетками
- Повышенная секреция белка
- Снижение притока крови к железам
Между слюнными железами имеется вариабельная симпатическая иннервация. В целом эта система имеет гораздо меньшее значение, чем парасимпатическая иннервация, в регуляции продукции слюны.
Парасимпатическая иннервация
Парасимпатический отток координируется через центры продолговатого мозга , а иннервация осуществляется через лицевой и языкоглоточный нервы. Афферентная информация изо рта, языка, носа и условные рефлексы интегрируются в головной мозг, а в присутствии пищи возникает парасимпатическая стимуляция.
Парасимпатический отток приводит к высвобождению ацетилхолина (АХ) на М 3 мускариновых рецепторов . Это приводит к следующим эффектам:
- Ацинарные клетки увеличивают секрецию слюны
- Клетки протоков увеличивают секрецию HCO
- Котрансмиттеры приводят к увеличению притока крови к слюнным железам
- Сокращение миоэпителия для увеличения скорости выброса слюны
В целом усиление парасимпатической стимуляции приводит к увеличению потока слюны, которая имеет более водянистый состав.
TeachMeSeries Ltd (2023)
Рис. 2. Путь парасимпатических волокон к околоушной железе.
Клиническая значимость — Сиалорея
Сиалорея — это слюнотечение или избыток слюны, которые невозможно контролировать. Это может произойти по двум причинам:
- Отсутствие глотания
- Повышенная секреция слюны , которая обычно связана с приемом лекарств. Его часто отмечают при лечении болезни Альцгеймера или миастении, так как лечение обоих состояний включает использование антихолинэстераз .
Лечение зависит от причины, но обычно включает лечение любых обратимых факторов. Например, в зависимости от степени тяжести может потребоваться изменение или даже прекращение приема лекарств. Модификация поведения может быть необходима с точки зрения методов обучения, чтобы помочь очистить скопившуюся слюну.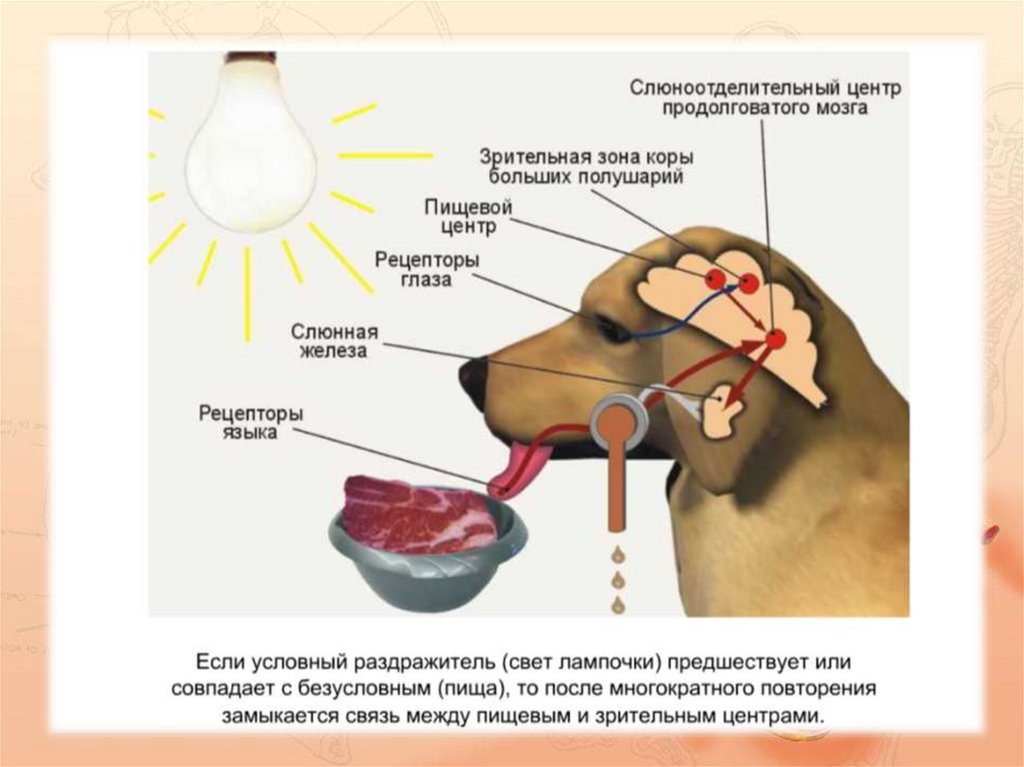

Leave A Comment