общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс.
Щелочноземельными металлами называют \(4\) химических элемента \(I\)\(I\)\(A\) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций \(Ca\), стронций \(Sr\), барий \(Ba\), радий \(Ra\).
Электронное строение атомов
На внешнем энергетическом уровне атомы металлов \(IIA\) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления \(+2\).
Этим объясняется сходство их свойств.
Для металлов \(I\)\(I\)\(A\) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Тем не менее, металлы \(I\)\(I\)\(A\) группы имеют разные значения температуры плавления, плотности и других физических свойств.
Химические свойства
Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
Они являются сильными восстановителями.
Щелочноземельные металлы активно реагируют с:
водой, образуя соответствующие гидроксиды и выделяя водород:
Ba+2h3O=Ba(OH)2+h3↑;
кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
Ba+2HCl=BaCl2+h3↑;
с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
Bа+Cl2=BаCl2,
Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=эл. токCa+Cl2↑.
ГДЗ (ответы) Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §49 Классификация химических элементов » Крутые решение для вас от GDZ.cool
ГДЗ (ответы) Химия 8 класc Рудзитис Г.Е., Фельдман Ф.Г., 2019, §49 Классификация химических элементов
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 2 На основании каких признаков вещество можно отнести к металлам?
Вещество можно отнести к металлам на основании таких физических свойств: оно твердое, имеет металлический блеск, хорошую электро- и теплопроводность, ковкое.
Задание 3 Вспомните, какими химическими свойствами обладают оксиды и гидроксиды элементов цинка и алюминия. Напишите соответствующие уравнения химических реакций.
Оксиды и гидроксиды цинка и алюминия являются амфотерными, поэтому взаимодействуют как с кислотами, так и основаниями.
1. Взаимодействуют с кислотами:
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2. Взаимодействуют с основаниями:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] ― тетрагидроксоцинкат натрия.
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] ― тетрагидроксоалюминат натрия.
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH
Al(OH)3 + NaOH = NaAlO2 + H2O ― алюминат натрия и вода.
Al(OH)3 + NaOH (сплавл.) = Na[Al(OH)4]
Задание 4 Приведите примеры, подтверждающие, что химические элементы можно распределить по отдельным группам.
Металлы литий, натрий, калий, цезий, рубидий в соединениях имеют валентность I, активно реагируют с водой с образованием гидроксидов и водорода. Гидроксиды этих металлов представляют собой щёлочи, по этим признакам эти металлы были объединены в семейство щелочных металлов. Общую формулу их гидроксидов можно записать как ROH, где R — щелочной металл.
Типичные неметаллы фтор, хлор, бром, иод были объединены в естественное семейство галогенов (в переводе с греческого означает «рождающие соли»). Все галогены в соединениях с водородом одновалентны. Общая формула их водородных соединений HR (R – галоген).
Каждое семейство характеризуется общими свойствами как элементов, так и образуемых ими соединений.

Задание 5 Химический элемент галлий Ga сходен с элементом алюминием Al, а селен Se – с серой S. Напишите формулы оксидов, гидроксидов и солей, в состав которых входят эти элементы.
Ga2O3― оксид галлия (III), Ga(OH)3― гидроксид галлия (III), GaCl3― хлорид галлия (III).
SeO2― оксид селена (IV), H2SeO3― селенистая кислота, CaSeO3― хлорид селена (IV).
SeO3― оксид селена (VI), H2SeO4― селеновая кислота, CaSeO4― хлорид селена (VI).
Составьте уравнения реакций, характеризующих химические свойства соответствующих соединений.
Ga2O3 + 6HCl = 2GaCl3 + 3H2O
Ga2O3 + 2NaOH + 3H2O = 2Na[Ga(OH)4]
Ga(OH)3 + 3HCl = GaCl3 + 3H2O
Ga(OH)3 + NaOH (сплавл.) = Na[Ga(OH)4]
Ga(OH)3 + NaOH = NaGaO2 + H2O
Оксиды селена SeO2 и SeO3 ― кислотные, поэтому взаимодействуют с водой, с основаниями, с основными оксидами:
SeO3 + H2O = H2SeO4
SeO2 + 2NaOH = Na2SeO3 + H2O
SeO3 + 2NaOH = Na2SeO4 + H2O
SeO2 + Na2O = Na2SeO3
SeO3 + Na2O = Na2SeO4
Селенистая H2SeO3 и селеновая H2SeO4 кислоты ваимодействуют с основными оксидами и щелочами:
H2SeO3 + Na2O = Na2SeO3 + H2O
H2SeO4 + Na2O = Na
H2SeO3 + 2NaOH = Na2SeO3 + 2H2O
H2SeO4 + 2NaOH = Na2SeO4 + 2H2O
Задание 6 В некоторых ядерных реакторах жидкий натрий используют в качестве теплоносителя ― вещества, переносящего тепло, вырабатываемое реактором.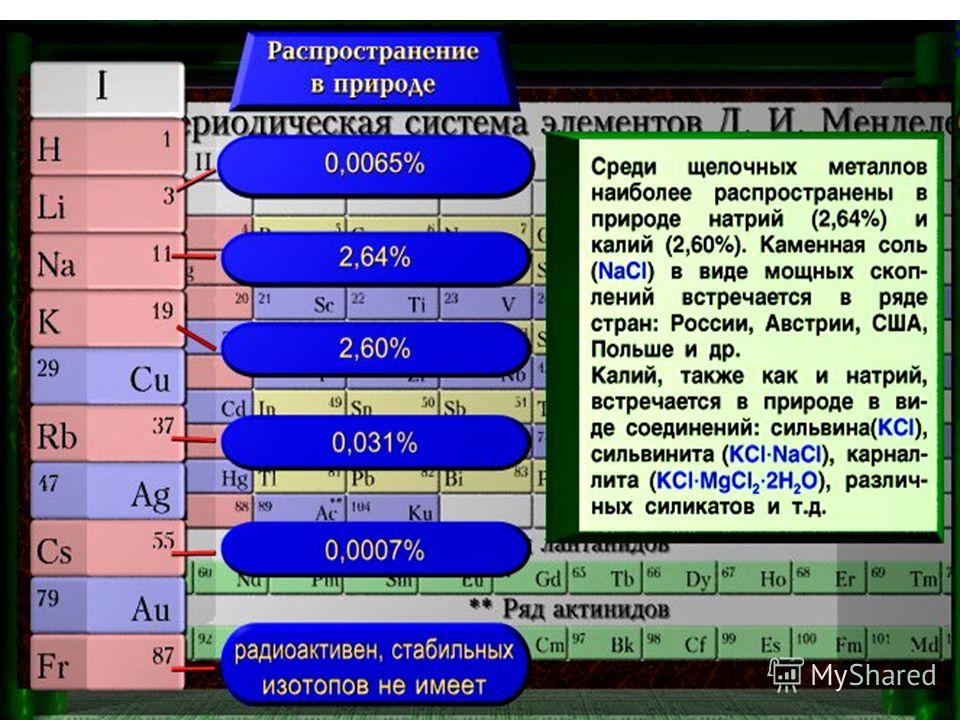 В чём опасность для окружающей среды такого использования натрия? Для ответа на этот вопрос воспользуйтесь Интернетом или дополнительной литературой.
В чём опасность для окружающей среды такого использования натрия? Для ответа на этот вопрос воспользуйтесь Интернетом или дополнительной литературой.
Опасность для окружающей среды при использования жидкого натрия в качестве теплоносителя в ядерных реакторах состоит в том, что натрий обладает большой химической активностью и при контакте с водой реакция может протекать со взрывом, что может перевести к разрушению реактора и выбросу радиоактивных изотопов в окружающую среду.
ТЕСТ 1
К металлическим свойствам не относят
1) твёрдость
2) ковкость
3) металлический блеск
4) газообразное состояние при нормальных условиях
Ответ: 4)
ТЕСТ 2
Только щелочные металлы указаны в ряду
1) Li, Ba, Na, K
2) Li, Na, K, Rb
3) K, Ca, Ba, Rb
4) Li, Na, Sr, Ca
Ответ: 2)
Общая формула их гидроксидов ROH, где R — щелочной металл.
ТЕСТ 3
Установите соответствие между общей формулой высших оксидов и молекулярной формулой вещества.
| 1) R2O 2) RO 3) RO2 4) RO3 | А. SO3 Б. K2O В. CaO Г. SiO2 |
Классификация химических элементов — параграф 49 ГДЗ химия 8 Рудзитис
1. Что такое классификация?
Классификация — это система группировки объектов наблюдения (например, химических элементов) или явлений (например, химических реакций) по наличию общих признаков.
В случае химических элементов, общими признаками могут являться:
— валентность
— способность вступать в химические реакции с теми или иными веществами
и проч.
2. На основании каких признаков вещество можно отнести к металлам?
1. Твердое вещество (за исключением ртути).
2. Обладает металлическим блеском (за исключением йода).
3. Хорошая электро- и теплопроводность.
4. Ковкость.
3. Вспомните, какими химическими свойствами обладают оксиды и гидроксиды элементов цинка и алюминия. Напишите уравнения соответствующих химических реакций.
Напомню, этот вопрос рассматривался в § 43. Амфотерные оксиды и гидроксиды.
Оксиды и гидроксиды цинка и алюминия обладают амфотерными свойствами. Они могут вступать в реакции как с кислотами, кислотными оксидами, так и с основаниями, основными оксидами.
Химические реакции, подтверждающие амфотерность оксида цинка:
ZnO + SO3 = ZnSO4
ZnO + 2HCl = ZnCl2 + H2O
ZnO + Na2O (сплавление) = Na2ZnO2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Химические реакции, подтверждающие амфотерность гидроксида цинка:
Zn(OH)2 + SO3 = ZnSO4 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Химические реакции, подтверждающие амфотерность оксида алюминия:
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + Na2O (сплавление) = 2NaAlO2
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Химические реакции, подтверждающие амфотерность гидроксида алюминия:
2Al(OH)3 + 3SO3 = Al2(SO
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2Al(OH)3 + Na2O (сплавление) = 2NaAlO2 + 3H2O
Al(OH)3 + NaOH = Na[Al(OH)4]
4. Приведите примеры, подтверждающие, что химические элементы можно распределить по отдельным группам.
Приведите примеры, подтверждающие, что химические элементы можно распределить по отдельным группам.
Пример 1: щелочные металлы.
Твердые вещества, обладают металлическим блеском, ковкостью, тепло- и электропроводны.
Химически активны, одновалентны. Бурно реагируют с водой с образованием щелочи и водорода:
2M + H2O = 2MOH + H2↑
например
2Na + H2O = 2NaOH + H2↑
С кислородом образуют основные оксиды вида M2O, которые при взаимодействии с водой образуют щелочи (основания) MOH.
4M + O2 = 2M2O
например
4K + O2 = 2K2O
M2O + H2O = 2MOH
например
K2O + H2O = 2KOH
Пример 2: галогены.
Агрегатное состояние: от газообразного (фтор, хлор) и жидкого (бром) до твердого (йод, астат). За исключением йода и астата не обладают металлическим блезком.
С водородом образуют кислоты (хотя, строго говоря, кислотами будут лишь их водные растворы):
Hal + H2 = 2HHal
например
Cl2 + H2 = 2HCl
С металлами образуют соли. Например:
2Na + Cl2 = 2NaCl
5. Химический элемент галлий Ga сходен с элементом алюминием Al, а селен Se — с серой S. Напишите формулы оксидов, гидроксидов и солей, в состав которых входят эти элементы. Составьте уравнения реакций, характеризующих химические свойства соответствующих соединений.
Примеры соединений:
Ga2O3, Ga(OH)3, Ga2(SO4)3, Na2[Ga(OH)4], Na2GaO2
SeO2, SeO3, H2SeO3, H2SeO4, Na2SeO3, Na2SeO4
Уравнения реакций для соединений галлия
Ga2O3 + 3SO3 = Ga2(SO4)3
Ga2O3 + 6HCl = 2GaCl3 + 3H2O
Ga2O3 + Na2O (сплавление) = 2NaGaO2
Ga2O3 + 2NaOH + 3H2O = 2Na[Ga(OH)4]
2Ga(OH)3 + 3SO3 = Ga2(SO4)3 + 3H2O
Ga(OH)3 + 3HCl = GaCl3 + 3H2O
2Ga(OH)3 + Na2O (сплавление) = 2NaGaO2 + 3H2O
Ga(OH)3 + NaOH = Na[Ga(OH)4]
GaCl3 + 3AgNO3 = Ga(NO3)3 + 3AgCl↓
Na[Ga(OH)4] + 4HCl = NaCl + GaCl3 + 4H2O
NaGaO2 + 4HCl = NaCl + GaCl3 + 4H2O
Уравнения реакций для соединений селена
SeO2 + H2O = H2SeO3 — селенистая кислота
SeO3 + H2O = H2SeO4 — селеновая кислота
H2SeO3 + 2NaOH = 2H2O + Na2SeO3 — селенит натрия
H2SeO4 + 2KOH = 2H2O + K2SeO4 — селенат калия
K2SeO4 + BaCl2 = BaSeO4↓ + 2KCl
6. В некоторых ядерных реакторах жидкий натрий используют в качестве теплоносителя — вещества, переносящего тепло, вырабатываемое реактором. В чем опасность для окружающей среды такого использования натрия? Для ответа на этот вопрос воспользуйтесь Интернетом или дополнительной литературой.
В некоторых ядерных реакторах жидкий натрий используют в качестве теплоносителя — вещества, переносящего тепло, вырабатываемое реактором. В чем опасность для окружающей среды такого использования натрия? Для ответа на этот вопрос воспользуйтесь Интернетом или дополнительной литературой.
Натрий — химический активный металл, при О.У. (обычные условия — атмосферное давление, 20° C) реагирующий с водой и кислородом воздуха:
4Na + O2 = 2Na2O
2Na + H2O = 2NaOH + H2↑
Na2O + H2O = 2NaOH
Жидкий, расплавленный натрий, будет вступать в реакцию в разы интенсивнее, т.е. будет иметь место возгорание (а с учетом выделяющегося водорода — это будет больше похоже на фонтан огня). Потушить такое возгорание будет весьма непросто (вода, пенные огнетушители в таком случае неприемлемы — подумайте почему). Кроме того, образующаяся в результате реакции щелочь (гидроксид натрия) весьма едкая.
Тестовые задания
1. К металлическим свойствам не относят
1) твердость
2) ковкость
3) металлический блеск
4) газообразное состояние при нормальных условиях
Ответ: 4
2. Только щелочные металлы указаны в ряду
1) Li, Ba, Na, K
2) Li, Na, K, Rb
3) K, Ca, Ba, Rb
4) Li, Na, Sr, Ca
Ответ: 2
3. Установите соответствие между общей формулой высших оксидов и молекулярной формулой вещества.
| 1) R2O | А. SO3 |
| 2) RO | Б. K2O |
| 3) RO2 | В. CaO |
| 4) RO3 | Г. SiO2 |
Ответы: 1 — Б, 2 — В, 3 — Г, 4 — А
Chem4Kids.com: Элементы и периодическая таблица: Щелочные металлы
Перейдем к левой части таблицы Менделеева.
 При поиске семейств в первую очередь вы найдете семейство элементов из щелочных металлов. Они также известны как щелочных металлов . Вы должны помнить, что во второй группе есть отдельная группа, называемая щелочноземельными металлами. Это совсем другая семья, хотя у них похожее имя. Крайний левый столбец — это Группа 1 (Группа I).Когда мы говорим о группах периодической таблицы, ученые используют римские цифры при их написании. «Единица» в этом случае означает наличие одного электрона на самой внешней орбитали.
При поиске семейств в первую очередь вы найдете семейство элементов из щелочных металлов. Они также известны как щелочных металлов . Вы должны помнить, что во второй группе есть отдельная группа, называемая щелочноземельными металлами. Это совсем другая семья, хотя у них похожее имя. Крайний левый столбец — это Группа 1 (Группа I).Когда мы говорим о группах периодической таблицы, ученые используют римские цифры при их написании. «Единица» в этом случае означает наличие одного электрона на самой внешней орбитали. Кто в семье? Начиная сверху, мы находим водород (H). Но ждать. Этого элемента нет в семье. Когда мы рассказывали вам о семьях, мы говорили, что это группы элементов, которые реагируют аналогичным образом. Водород — особый элемент периодической таблицы Менделеева и не принадлежит ни к какой семье.Хотя водород входит в группу I, он НЕ является щелочным металлом.
Теперь, когда мы рассмотрели это исключение, членами семейства являются: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Как и во всех семьях, эти элементы имеют общие черты. Они очень реактивные . Почему? Все они имеют по одному электрону на внешней оболочке. Это один электрон от счастья (полная оболочка). Когда вы так близки к полной оболочке, вы хотите соединиться с другими элементами и потерять этот электрон.Повышенное желание привязаться означает, что вы более активны. Фактически, когда вы помещаете некоторые из этих чистых элементов в воду (H 2 O), они могут вызвать огромные взрывы.
Щелочные металлы также являются металлами. Это очевидно из названия. Часто в химии характеристики присваиваются по внешнему виду элементов. Вы обнаружите, что щелочная группа блестящая и легкая. Их легкий вес и физические свойства отличают их от других металлов. Они податливые, (гибкие) и иногда достаточно мягкие, чтобы их можно было разрезать тупым ножом.Щелочные металлы — это не те металлы, которые вы бы использовали для изготовления монет или домов.
Нация инноваций: крошечные батарейки (видео США-NSF)
Щелочные металлы (группа 1)
21.3 Щелочные металлы (группа 1)
Цели обучения
- Чтобы описать, как выделяются щелочные металлы.
- Для ознакомления с реакциями, соединениями и комплексами щелочных металлов.
Щелочные металлы настолько реактивны, что никогда не встречаются в природе в элементарной форме. Хотя некоторые из их руд богаты, изолировать их от руд довольно сложно. По этим причинам элементы группы 1 были неизвестны до начала 19 века, когда сэр Хэмфри Дэви впервые получил натрий (Na) и калий (K), пропуская электрический ток через расплавленные щелочи. (Зола, образующаяся при сгорании древесины, в основном состоит из карбоната калия и натрия.Литий (Li) был открыт 10 лет спустя, когда шведский химик Йохан Арфведсон изучал состав нового бразильского минерала. Цезий (Cs) и рубидий (Rb) не были открыты до 1860-х годов, когда Роберт Бунзен провел систематический поиск новых элементов. Известный студентам-химикам как изобретатель горелки Бунзена, спектроскопические исследования руд Бунзена показали голубые и темно-красные эмиссионные линии, которые он приписал двум новым элементам, Cs и Rb, соответственно. Франций (Fr) содержится в природе только в следовых количествах, поэтому наши знания о его химии ограничены.Все изотопы Fr имеют очень короткие периоды полураспада, в отличие от других элементов группы 1.
Сэр Хэмфри Дэви (1778–1829)
Дэви родился в Пензансе, Корнуолл, Англия. В лаборатории он был немного диким человеком, часто нюхал и пробовал на вкус продукты своих экспериментов, что почти наверняка сократило его жизнь. Он обнаружил физиологические эффекты, которые заставляют закись азота назвать «веселящий газ» (и стал зависимым от него!), И он почти потерял зрение в результате взрыва трихлорида азота (NCl 3 ), который он первым применил. подготовить.Дэви был одним из первых, кто осознал полезность «электрических свай» (батарей) Алессандро Вольта. Последовательно соединив несколько «стопок» и вставив электроды в расплавленные соли щелочных и щелочноземельных металлов, он смог выделить шесть ранее неизвестных элементов как чистые металлы: натрий, калий, кальций, стронций, барий и магний. Он также открыл бор и первым получил фосфин (PH 3 ) и теллурид водорода (H 2 Te), оба из которых очень токсичны.
подготовить.Дэви был одним из первых, кто осознал полезность «электрических свай» (батарей) Алессандро Вольта. Последовательно соединив несколько «стопок» и вставив электроды в расплавленные соли щелочных и щелочноземельных металлов, он смог выделить шесть ранее неизвестных элементов как чистые металлы: натрий, калий, кальций, стронций, барий и магний. Он также открыл бор и первым получил фосфин (PH 3 ) и теллурид водорода (H 2 Te), оба из которых очень токсичны.
Роберт Вильгельм Бунзен (1811–1899)
Бунзен родился и получил образование в Геттингене, Германия. Его ранние работы касались органических соединений мышьяка, чья высокотоксичная природа и склонность к взрывоопасности чуть не убили его и стоили ему глаза. Он разработал горелку Бунзена, надежную газовую горелку, и использовал ее и спектры излучения для обнаружения цезия (названного по синей линии) и рубидия (названного по красной линии).
Получение щелочных металлов
Поскольку щелочные металлы являются одними из самых сильнодействующих известных восстановителей, их получение в чистом виде требует значительных затрат энергии.Например, чистый литий и натрий обычно получают электролитическим восстановлением расплавленных хлоридов:
Уравнение 21,5
LiCl (л) → Li (л) + 12Cl2 (г) На практике CaCl 2 смешивают с LiCl для понижения точки плавления литиевой соли. Электролиз проводят в атмосфере аргона, а не в атмосфере азота, обычно используемой для веществ, которые обладают высокой реакционной способностью с O 2 и водой, поскольку Li реагирует с газообразным азотом с образованием нитрида лития (Li 3 N).Металлический натрий получают электролизом расплавленной смеси NaCl и CaCl 2 . Напротив, калий производят в промышленных масштабах путем восстановления KCl Na с последующей фракционной перегонкой K (г). Хотя рубидий и цезий также могут быть получены электролизом, их обычно получают реакцией их гидроксидных солей с восстановителем, таким как Mg:
Хотя рубидий и цезий также могут быть получены электролизом, их обычно получают реакцией их гидроксидных солей с восстановителем, таким как Mg:
Уравнение 21.6
2RbOH (т) + Mg (т) → 2Rb (л) + Mg (OH) 2 (т)В природе встречаются массивные отложения по существу чистых NaCl и KCl, которые являются основными источниками натрия и калия.Другие щелочные металлы обнаруживаются в низких концентрациях в большом количестве минералов, но руды, содержащие высокие концентрации этих элементов, относительно редки. Например, неизвестны концентрированные источники рубидия, хотя он является 16-м по численности элементом на Земле. Рубидий получают в промышленных масштабах путем выделения 2–4% Rb, присутствующего в качестве примеси в слюдах, минералах, которые состоят из пластин сложных гидратированных силикатов калия и алюминия.
Щелочные металлы извлекаются из силикатных руд в многостадийном процессе, в котором используется преимущество растворимости выбранных солей каждого иона металла, зависящей от pH.Этапы этого процесса: выщелачивание , при котором серная кислота растворяет требуемый ион щелочного металла и Al 3+ из руды; основное осаждение для удаления Al 3+ из смеси в виде Al (OH) 3 ; селективное осаждение нерастворимого карбоната щелочного металла; растворение соли снова в соляной кислоте; и выделение металла испарением и электролизом . Рисунок 21.7 «Выделение лития из сподумена, литиево-силикатной руды» иллюстрирует выделение жидкого лития из литий-силикатной руды с помощью этого процесса.
Рисунок 21.7 Выделение лития из сподумена, литий-силикатной руды
Ключевые этапы: кислотное выщелачивание, осаждение гидроксида алюминия щелочью, селективное осаждение нерастворимого карбоната лития, преобразование в хлорид лития, выпаривание и электролиз. Другие щелочные металлы и щелочноземельные металлы извлекаются из руд аналогичными способами.
Другие щелочные металлы и щелочноземельные металлы извлекаются из руд аналогичными способами.
Общие свойства щелочных металлов
Различные свойства элементов группы 1 сведены в Таблицу 21.3 «Выбранные свойства элементов группы 1». В соответствии с общими периодическими тенденциями атомные и ионные радиусы плавно увеличиваются от Li до Cs, а энергии первой ионизации уменьшаются по мере увеличения размеров атомов. В результате их низких энергий первой ионизации щелочные металлы имеют подавляющую тенденцию к образованию ионных соединений с зарядом +1.Все щелочные металлы имеют относительно высокое сродство к электрону, потому что добавление электрона дает анион (M — ) с электронной конфигурацией нс 2 . Плотность элементов обычно увеличивается от Li до Cs, что отражает другую общую тенденцию: поскольку атомные массы элементов растут быстрее, чем атомные объемы, по мере того, как вы спускаетесь по группе, самые плотные элементы находятся в нижней части периодической таблицы. Необычной тенденцией в элементах группы 1 является плавное снижение температур плавления и кипения от Li до Cs.В результате Cs (точка плавления = 28,5 ° C) является одним из трех металлов (остальные — Ga и Hg), которые являются жидкостями при температуре тела (37 ° C).
Таблица 21.3 Выбранные свойства элементов группы 1
| Литий | Натрий | Калий | Рубидий | Цезий | Франций | |
|---|---|---|---|---|---|---|
| атомный символ | Li | Na | К | руб. | CS | Fr |
| атомный номер | 3 | 11 | 19 | 37 | 55 | 87 |
| атомная масса | 6.94 | 22,99 | 39,10 | 85,47 | 132,91 | 223 |
| конфигурация валентных электронов | 2 с 1 | 3 с 1 | 4 с 1 | 5 с 1 | 6 с 1 | 7 с 1 |
| точка плавления / температура кипения (° C) | 180.5/1342 | 97,8 / 883 | 63,5 / 759 | 39,3 / 688 | 28,5 / 671 | 27 / — |
| плотность (г / см 3 ) при 25 ° C | 0,534 | 0,97 | 0,89 | 1,53 | 1. 93 93 | – |
| атомный радиус (пм) | 167 | 190 | 243 | 265 | 298 | – |
| первая энергия ионизации (кДж / моль) | 520 | 496 | 419 | 403 | 376 | 393 |
| наиболее частая степень окисления | +1 | +1 | +1 | +1 | +1 | +1 |
| ионный радиус (пм) * | 76 | 102 | 138 | 152 | 167 | – |
| сродство к электрону (кДж / моль) | −60 | −53 | −48 | −47 | −46 | – |
| электроотрицательность | 1. 0 0 | 0,9 | 0,8 | 0,8 | 0,8 | 0,7 |
| стандартный потенциал электрода ( E °, В) | −3,04 | -2,71 | -2,93 | -2,98 | −3.03 | – |
| продукт реакции с O 2 | Li 2 O | Na 2 O 2 | КО 2 | РБО 2 | CSO 2 | – |
| тип оксида | базовый | базовый | базовый | базовый | базовый | – |
| продукт реакции с N 2 | Li 3 N | нет | нет | нет | нет | – |
| продукт реакции с X 2 | LiX | NaX | KX | RbX | CSX | – |
| продукт реакции с H 2 | LiH | NaH | КН | RbH | CSH | – |
* Приведены значения для четырехкоординатных ионов, за исключением Rb + и Cs + , значения которых даны для шестикоординатного иона. | ||||||
Стандартные потенциалы восстановления ( E °) щелочных металлов не соответствуют тенденции, основанной на энергии ионизации. (Для получения дополнительной информации о восстановительных потенциалах см. Главу 19 «Электрохимия»). Неожиданно оказалось, что литий является самым сильным восстановителем, а натрий — самым слабым (Таблица 21.3 «Избранные свойства элементов группы 1»). Поскольку Li + намного меньше катионов других щелочных металлов, его энергия гидратации самая высокая.Высокая энергия гидратации Li + более чем компенсирует его более высокую энергию ионизации, делая металлический литий самым сильным восстановителем в водном растворе. Эта очевидная аномалия является примером того, как физическое или химическое поведение элементов в группе часто определяется тонким взаимодействием противоположных периодических тенденций.
Реакции и соединения щелочных металлов
Все щелочные металлы представляют собой электроположительные элементы с конфигурацией валентных электронов нс. 1 . Они образуют монокатион (M + ), теряя единственный валентный электрон.Поскольку удаление второго электрона потребовало бы прорыва в замкнутую оболочку ( n -1), что является энергетически недопустимым, химический состав щелочных металлов в значительной степени аналогичен химическому составу ионных соединений, содержащих ионы M + . Однако, как мы обсудим позже, более легкие элементы группы 1 также образуют серию металлоорганических соединений, которые содержат полярные ковалентные связи M – C.
Все щелочные металлы активно взаимодействуют с галогенами (группа 17) с образованием соответствующих ионных галогенидов, где X — галоген:
Уравнение 21.7
2M (s) + X 2 (s, l, g) → 2M + X — (s)Аналогичным образом щелочные металлы реагируют с более тяжелыми халькогенами (сера, селен и теллур в группе 16) с образованием халькогенидов металлов, где Y представляет собой S, Se или Te:
Уравнение 21. 8
8
Однако при использовании избытка халькогена можно получить различные продукты, содержащие цепочки атомов халькогена, например полисульфиды натрия (Na 2 S n , где n = 2–6).Например, Na 2 S 3 содержит ион S 3 2-, который имеет V-образную форму с углом S – S – S около 103 °. Продукт одноэлектронного окисления трисульфид-иона (S 3 — ) отвечает за интенсивный синий цвет драгоценных камней лазурит и синий ультрамарин (рис. 21.8 «Трисульфид-анион отвечает за темно-синий цвет некоторых Драгоценные камни »).
Рисунок 21.8 Трисульфид-анион отвечает за глубокий синий цвет некоторых драгоценных камней
(a) Насыщенный синий цвет лазурита обусловлен небольшим количеством обычно нестабильного аниона S 3 –.(b) алюмосиликатные клетки минералов (цеолитов), которые составляют матрицу синего ультрамарина, стабилизируют реактивный анион; избыток ионов Na + в структуре уравновешивает отрицательные заряды на каркасе цеолита и анион S 3 —.
Взаимодействие щелочных металлов с кислородом, самым легким элементом в группе 16, является более сложным, и стехиометрия продукта зависит как от соотношения металл: кислород, так и от размера атома металла.Например, при горении щелочных металлов на воздухе наблюдаемые продукты: Li 2 O (белый), Na 2 O 2 (бледно-желтый), KO 2 (оранжевый), RbO 2 (коричневый). ) и CsO 2 (оранжевый). Только Li 2 O имеет стехиометрию, ожидаемую для вещества, содержащего два катиона M + и один ион O 2-. Напротив, Na 2 O 2 содержит анион O 2 2- (пероксид) плюс два катиона Na + . Остальные три соли со стехиометрией MO 2 содержат катион M + и ион O 2 — (супероксид). Поскольку O 2− является наименьшим из трех анионов кислорода, он образует стабильную ионную решетку с наименьшим катионом щелочного металла (Li + ). Напротив, более крупные щелочные металлы — калий, рубидий и цезий — реагируют с кислородом воздуха с образованием супероксидов металлов. Поскольку катион Na + имеет промежуточный размер, натрий реагирует с кислородом с образованием соединения с промежуточной стехиометрией: пероксида натрия.Однако при определенных условиях реакции можно получить оксидные, пероксидные и супероксидные соли всех пяти щелочных металлов, за исключением супероксида лития (LiO 2 ).
Остальные три соли со стехиометрией MO 2 содержат катион M + и ион O 2 — (супероксид). Поскольку O 2− является наименьшим из трех анионов кислорода, он образует стабильную ионную решетку с наименьшим катионом щелочного металла (Li + ). Напротив, более крупные щелочные металлы — калий, рубидий и цезий — реагируют с кислородом воздуха с образованием супероксидов металлов. Поскольку катион Na + имеет промежуточный размер, натрий реагирует с кислородом с образованием соединения с промежуточной стехиометрией: пероксида натрия.Однако при определенных условиях реакции можно получить оксидные, пероксидные и супероксидные соли всех пяти щелочных металлов, за исключением супероксида лития (LiO 2 ).
Кристалл сподумена (LiAlSi 2 O 6 ). Этот минерал — одна из важнейших литиевых руд.
Обратите внимание на шаблон
Химия щелочных металлов в основном состоит из ионных соединений, содержащих ионы M + .
Пероксиды и супероксиды щелочных металлов являются сильнодействующими окислителями, которые часто активно реагируют с широким спектром восстановителей, такими как древесный уголь или металлический алюминий. Например, Na 2 O 2 используется в промышленности для отбеливания бумаги, древесной массы и таких тканей, как лен и хлопок. На подводных лодках Na 2 O 2 и KO 2 используются для очистки и регенерации воздуха путем удаления CO 2 , образующегося при дыхании, и его замены на O 2 .Оба соединения реагируют с CO 2 в окислительно-восстановительной реакции, в которой O 2 2- или O 2 — одновременно окисляется и восстанавливается с образованием карбоната металла и O 2 :
Уравнение 21. 9
9
Уравнение 21.10
4KO 2 (s) + 2CO 2 (g) → 2K 2 CO 3 (s) + 3O 2 (g)Присутствие водяного пара, другого продукта дыхания, делает KO 2 еще более эффективным при удалении CO 2 , поскольку образуется бикарбонат калия, а не карбонат калия:
Уравнение 21.11
4KO 2 (s) + 4CO 2 (g) + 2H 2 O (g) → 4KHCO 3 (s) + 3O 2 (g)Обратите внимание, что в этой реакции удаляется 4 моля CO 2 , а не 2 моль в уравнении 21.10.
Литий, самый легкий щелочной металл, единственный, который реагирует с атмосферным азотом, образуя нитрид лития (Li 3 N). Энергия решетки снова объясняет, почему более крупные щелочные металлы, такие как калий, не образуют нитридов: упаковка трех больших катионов K + вокруг одного относительно небольшого аниона энергетически невыгодна. Напротив, все щелочные металлы реагируют с фосфором и мышьяком более крупной группы 15 с образованием фосфидов и арсенидов металлов (где Z представляет собой P или As):
Уравнение 21.12
12M (с) + Z 4 (с) → 4M 3 Z (с)Обратите внимание на шаблон
Из-за энергии решетки только литий образует стабильный оксид и нитрид.
Щелочные металлы реагируют со всеми элементами 14 группы, но состав и свойства продуктов значительно различаются. Например, реакция с более тяжелыми элементами группы 14 дает материалы, которые содержат многоатомные анионы и трехмерные каркасные структуры, такие как K 4 Si 4 , структура которого показана здесь. Напротив, литий и натрий окисляются углеродом с образованием соединения со стехиометрией M 2 C 2 (где M представляет собой Li или Na):
Напротив, литий и натрий окисляются углеродом с образованием соединения со стехиометрией M 2 C 2 (где M представляет собой Li или Na):
Уравнение 21,13
2M (с) + 2C (с) → M 2 C 2 (с)Трехмерная клеточная структура иона Si 4 4- в ионном соединении K 4 S 4 . Ион Si 4 4− изоэлектронен и изоструктурен молекуле P 4 .
Такие же соединения можно получить реакцией металла с ацетиленом (C 2 H 2 ). В этой реакции металл снова окисляется, а водород восстанавливается:
Уравнение 21,14
2M (с) + C 2 H 2 (г) → M 2 C 2 (с) + H 2 (г)Ацетилид-ион (C 2 2-), формально производный от ацетилена в результате потери обоих атомов водорода в виде протонов, является очень сильным основанием.Взаимодействие солей ацетилида с водой дает ацетилен и MOH (водн.).
Более тяжелые щелочные металлы (K, Rb и Cs) также реагируют с углеродом в форме графита. Однако вместо того, чтобы разрушать гексагональные слои атомов углерода, металлы вставляют себя между листами атомов углерода, чтобы дать новые вещества, называемые соединениями интеркаляции графита — соединение, которое образуется, когда более тяжелые щелочные металлы реагируют с углеродом в форме графита и вставляются сами. между листами атомов углерода.(часть (а) на рисунке 21.9 «Соединения интеркаляции графита»). Стехиометрия этих соединений включает MC 60 и MC 48 , которые являются черными / серыми; MC 36 и MC 24 , синие; и MC 8 , который выполнен из бронзы (часть (b) на Рисунке 21. 9 «Соединения интеркаляции графита»). Замечательно высокая электропроводность этих соединений (примерно в 200 раз больше, чем у графита) объясняется общим переносом валентного электрона щелочного металла на слои графита с образованием, например, K + C 8 — .
9 «Соединения интеркаляции графита»). Замечательно высокая электропроводность этих соединений (примерно в 200 раз больше, чем у графита) объясняется общим переносом валентного электрона щелочного металла на слои графита с образованием, например, K + C 8 — .
Рисунок 21.9 Соединения интеркаляции графита
Взаимодействие графита с щелочными металлами, такими как K, Rb и Cs, приводит к частичному восстановлению графита и внедрению слоев катионов щелочных металлов между наборами из n слоев атомов углерода. (a) В KC 8 слои ионов K + вставлены между каждой парой углеродных слоев, что дает n = 1. (b) Стехиометрия и цвет интеркаляционных соединений зависят от количества слоев углерода. атомов ( n ) между каждым слоем интеркалированных атомов металла.На этой схематической диаграмме показаны наиболее распространенные наблюдаемые структуры.
Все щелочные металлы непосредственно реагируют с газообразным водородом при повышенных температурах с образованием ионных гидридов (M + H — ):
Уравнение 21.15
2M (т) + H 2 (г) → 2MH (т)Все также способны восстанавливать воду с образованием газообразного водорода:
Уравнение 21.16
M (т) + h3O (л) → 12h3 (г) + MOH (водн.) Хотя литий довольно медленно реагирует с водой, натрий реагирует довольно активно (рис. 21.10 «Взаимодействие натрия с водой»), а более тяжелые щелочные металлы (K, Rb и Cs) реагируют так бурно, что они неизменно взрываются. Эта тенденция, которая не согласуется с относительными величинами потенциалов восстановления элементов, служит еще одним примером сложного взаимодействия различных сил и явлений — в данном случае кинетики и термодинамики.Хотя движущая сила реакции является наибольшей для лития, более тяжелые металлы имеют более низкие температуры плавления. Тепло, выделяемое в результате реакции, заставляет их плавиться, а большая площадь поверхности жидкого металла, контактирующего с водой, значительно ускоряет скорость реакции.
Тепло, выделяемое в результате реакции, заставляет их плавиться, а большая площадь поверхности жидкого металла, контактирующего с водой, значительно ускоряет скорость реакции.
Рисунок 21.10 Реакция натрия с водой
Как и большинство элементов в группах 1 и 2, натрий бурно реагирует с водой. Эти продукты представляют собой ион Na + (водный) и газообразный водород, который потенциально взрывоопасен при смешивании с воздухом.
Катионы щелочных металлов присутствуют в большом количестве ионных соединений. Как правило, любую соль щелочного металла можно получить реакцией гидроксида щелочного металла с кислотой и последующим испарением воды:
Уравнение 21,17
2MOH (водн.) + H 2 SO 4 (водн.) → M 2 SO 4 (водн.) + 2H 2 O (л)Уравнение 21.18
MOH (водн.) + HNO 3 (водн.) → MNO 3 (водн.) + H 2 O (л)Гидроксиды щелочных металлов также могут реагировать с органическими соединениями, содержащими кислый водород, с образованием соли. Примером является получение ацетата натрия (CH 3 CO 2 Na) реакцией гидроксида натрия и уксусной кислоты:
Уравнение 21.19
CH 3 CO 2 H (водн.) + NaOH (т.) → CH 3 CO 2 Na (водн.) + H 2 O (л) Мыло представляет собой смесь натриевых и калиевых солей встречающихся в природе карбоновых кислот, таких как пальмитиновая кислота [CH 3 (CH 2 ) 14 CO 2 H] и стеариновая кислота [CH 3 ( CH 2 ) 16 CO 2 H].Соли лития, такие как стеарат лития [CH 3 (CH 2 ) 14 CO 2 Li], используются в качестве присадок к моторным маслам и консистентным смазкам.
Комплексы щелочных металлов
Из-за своего низкого положительного заряда (+1) и относительно большого ионного радиуса катионы щелочных металлов имеют лишь слабую тенденцию реагировать с простыми основаниями Льюиса с образованием комплексов металлов, подобных тем, которые обсуждались в главе 17 «Равновесия растворимости и комплексообразования».Образование комплексов наиболее существенно для мельчайших катионов (Li + ) и уменьшается с увеличением радиуса. В водном растворе, например, Li + образует тетраэдрический комплекс [Li (H 2 O) 4 ] + . Напротив, более крупные катионы щелочных металлов образуют октаэдрические комплексы [M (H 2 O) 6 ] + . Образование комплекса в первую очередь связано с электростатическим взаимодействием катиона металла с полярными молекулами воды. Из-за их высокого сродства к воде безводные соли, содержащие ионы Li + и Na + (такие как Na 2 SO 4 ), часто используются в качестве осушающих агентов .Эти соединения поглощают следы воды из неводных растворов с образованием гидратированных солей, которые затем легко удаляются из раствора фильтрацией.
Тетраэдрический [Li (H 2 O) 4 ] + и октаэдрический [Rb (H 2 ) 6 ] + комплексов. Ион Li + настолько мал, что вмещает только четыре молекулы воды вокруг себя, но более крупные катионы щелочных металлов имеют тенденцию связывать шесть молекул воды.
Обратите внимание на шаблон
Из-за своего низкого положительного заряда (+1) и относительно большого ионного радиуса катионы щелочных металлов имеют лишь слабую тенденцию к образованию комплексов с простыми основаниями Льюиса.
Электростатические взаимодействия также позволяют ионам щелочных металлов образовывать комплексы с определенными циклическими полиэфирами и родственными соединениями, такими как краун-эфиры и криптанды.Как обсуждалось в главе 13 «Решения», краун-эфиры — это циклический полиэфир, который имеет четыре или более атомов кислорода, разделенных двумя или тремя атомами углерода. В центральной полости может находиться ион металла, координированный с кольцом атомов кислорода. представляют собой циклические полиэфиры, которые содержат четыре или более атомов кислорода, разделенных двумя или тремя атомами углерода. Все краун-эфиры имеют центральную полость, в которой может размещаться ион металла, координированный с кольцом атомов кислорода, а краун-эфиры с кольцами разного размера предпочитают связывать ионы металлов, которые помещаются в полость.Например, 14-краун-4 с наименьшей полостью, которая может вместить ион металла, имеет самое высокое сродство к Li + , тогда как 18-краун-6 образует самые сильные комплексы с K + (часть (а) на рисунке 13.7 «Краун-эфиры и криптанды»).
Криптанды Состоящее из трех цепочек (-OCh3Ch3O-) n, соединенных двумя атомами азота, это соединение может полностью инкапсулировать ион металла соответствующего размера, координируясь с металлом неподеленными парами электронов на каждом атоме кислорода и двух атомах азота.являются более близкими к сферическим аналогами краун-эфиров и даже более мощными и селективными комплексообразующими агентами. Криптанды состоят из трех цепочек, содержащих кислород, которые связаны двумя атомами азота (часть (b) на рисунке 13.7 «Краун-эфиры и криптанды»). Они могут полностью окружать (инкапсулировать) ион металла подходящего размера, координируя его с металлом неподеленной парой электронов на каждом атоме O и двух атомах N. Как и краун-эфиры, криптанды с полостями разного размера обладают высокой селективностью по отношению к ионам металлов определенных размеров.Краун-эфиры и криптанды часто используются для растворения простых неорганических солей, таких как KMnO 4 , в неполярных органических растворителях (рис. 13.8 «Влияние краун-эфира на растворимость KMnO»).
Растворы жидкого аммиака
Замечательная особенность щелочных металлов — их способность обратимо растворяться в жидком аммиаке. Так же, как и в их реакциях с водой, при взаимодействии щелочных металлов с жидким аммиаком в конечном итоге образуется газообразный водород и металлическая соль сопряженного основания растворителя — в данном случае ион амида (NH 2 —), а не гидроксид:
Уравнение 21.20
M (s) + Nh4 (l) → 12h3 (g) + M + (am) + Nh3− (am)Сольватированные электроны. На присутствие сольватированных электронов (e — , NH 3 ) в растворах щелочных металлов в жидком аммиаке указывает интенсивный цвет раствора и его электропроводность.
, где обозначение (am) относится к раствору аммиака, аналогично (aq), используемому для обозначения водных растворов. Без катализатора реакция по уравнению 21.20 имеет тенденцию быть довольно медленным. Во многих случаях соль амида щелочного металла (MNH 2 ) не очень хорошо растворяется в жидком аммиаке и выпадает в осадок, но при растворении образуются очень концентрированные растворы щелочного металла. Например, один моль металлического Cs растворяется всего в 53 мл (40 г) жидкого аммиака. Чистый металл легко восстанавливается при испарении аммиака.
Растворы щелочных металлов в жидком аммиаке сильно окрашены и хорошо проводят электричество из-за присутствия сольватированных электронов (e — , NH 3 ), которые не присоединены к отдельным атомам.Сольватированный электрон слабо связан с полостью в аммиачном растворителе, которая стабилизируется водородными связями. Растворы щелочной металл – жидкий аммиак с концентрацией около 3 М или менее имеют темно-синий цвет (рис. 21.11 «Растворы щелочной металл – жидкий аммиак») и проводят электричество примерно в 10 раз лучше, чем водный раствор NaCl, из-за высокой подвижности сольватированных электронов. Когда концентрация металла увеличивается выше 3 M, цвет меняется на металлическую бронзу или золото, а проводимость увеличивается до значения, сравнимого с проводимостью чистых жидких металлов.
Рисунок 21.11 Растворы щелочной металл – жидкий аммиак
Большинство металлов нерастворимы практически во всех растворителях, но щелочные металлы (и более тяжелые щелочноземельные металлы) легко растворяются в жидком аммиаке с образованием сольватированных катионов металлов и сольватированных электронов, которые придают раствору темно-синий цвет.
Помимо сольватированных электронов, растворы щелочных металлов в жидком аммиаке содержат катион металла (M + ), нейтральный атом металла (M), димеры металла (M 2 ) и анион металла (M — ).Анион образуется добавлением электрона к однократно занятой валентной орбитали нс атома металла. Даже в отсутствие катализатора эти растворы не очень стабильны и в конечном итоге разлагаются на термодинамически предпочтительные продукты: M + NH 2 — и газообразный водород (уравнение 21.20). Тем не менее сольватированный электрон является мощным восстановителем, который часто используется в синтетической химии.
Металлоорганические соединения элементов 1 группы
Соединения, которые содержат металл, ковалентно связанный с атомом углерода органического соединения, называются металлоорганическими соединениями. Соединение, которое содержит металл, ковалентно связанный с атомом углерода органического соединения.. Свойства и реакционная способность металлоорганических соединений сильно отличаются от металлических или органических компонентов. Из-за своего небольшого размера литий, например, образует обширный ряд ковалентных литийорганических соединений, таких как метиллитий (LiCH 3 ), которые на сегодняшний день являются наиболее стабильными и наиболее известными металлоорганическими соединениями группы 1. Эти летучие твердые вещества или жидкости с низкой температурой плавления можно сублимировать или перегонять при относительно низких температурах, и они растворимы в неполярных растворителях.Как и органические соединения, расплавленные твердые частицы не проводят электричество в значительной степени. Литийорганические соединения имеют тенденцию к образованию олигомеров с формулой (RLi) n , где R представляет собой органический компонент. Например, как в твердом состоянии, так и в растворе, метиллитий существует в виде тетрамера со структурой, показанной на рисунке 21.12 «Тетрамерная структура метиллития», где каждая треугольная грань тетраэдра Li 4 соединена мостиком с атомом углерода метильная группа.Фактически, атом углерода каждой группы CH 3 использует одну пару электронов в гибридной доле sp 3 для соединения трех атомов лития, что делает это примером двухэлектронного, четырехцентрового склеивание. Ясно, что такая структура, в которой каждый атом углерода, очевидно, связан с шестью другими атомами, не может быть объяснена с помощью какой-либо схемы парных электронных связей, обсуждаемых в главе 8 «Ионная связь в сравнении с ковалентной связью» и главе 9 «Молекулярная геометрия и Модели ковалентного связывания ».Теория молекулярных орбиталей может объяснить связь в метиллитии, но описание выходит за рамки этого текста.
Рисунок 21.12 Тетрамерная структура метиллития
Метиллитий не является ионным соединением; он существует в виде тетрамерных (CH 3 Li) 4 молекул. Структура состоит из тетраэдрического расположения четырех атомов лития, с атомом углерода метильной группы, расположенным над серединой каждой треугольной грани тетраэдра.Таким образом, атомы углерода соединяют три атома лития, образуя четырехцентровые двухэлектронные связи.
Обратите внимание на шаблон
Свойства и реакционная способность металлоорганических соединений сильно отличаются от металлических или органических компонентов.
Натрийорганические и калийорганические соединения более ионны, чем литийорганические соединения. Они содержат дискретные ионы M + и R — и нерастворимы или плохо растворяются в неполярных растворителях.
Использование щелочных металлов
Поскольку натрий остается жидким в широком диапазоне температур (97,8–883 ° C), он используется в качестве охлаждающей жидкости в специализированных высокотемпературных устройствах, таких как ядерные реакторы и выпускные клапаны в двигателях высокопроизводительных спортивных автомобилей. Цезий из-за его низкой энергии ионизации используется в фотодатчиках автоматических дверей, туалетов, охранных сигнализаций и других электронных устройств. В этих устройствах цезий ионизируется лучом видимого света, в результате чего создается небольшой электрический ток; блокировка света прерывает электрический ток и вызывает реакцию.
Соединения натрия и калия производятся в промышленных масштабах в огромных масштабах. Ежегодно в список 50 лучших промышленных соединений входят NaOH, используемый в самых разных промышленных процессах; Na 2 CO 3 , используется при производстве стекла; K 2 O, используется в фарфоровой глазури; и Na 4 SiO 4 , используемый в моющих средствах.
Важное значение имеют также несколько других соединений щелочных металлов. Например, Li 2 CO 3 — одно из наиболее эффективных средств лечения маниакальной депрессии или биполярного расстройства.Похоже, что он модулирует или ослабляет влияние на мозг изменений уровня нейромедиаторов, которые являются биохимическими веществами, ответственными за передачу нервных импульсов между нейронами. Следовательно, пациенты, принимающие «литий», не демонстрируют резких перепадов настроения, характерных для этого расстройства.
Пример 2
Для каждого применения выберите наиболее подходящее вещество в зависимости от свойств и реакционной способности щелочных металлов и их соединений.В каждом конкретном случае объясните свой выбор.
- Для реакции, которая требует сильного основания в растворе тетрагидрофурана (ТГФ), вы бы использовали LiOH или CsOH?
- Используете ли вы воду, газ CO 2 , N 2 , или песок (SiO 2 ) для тушения пожара, вызванного горением металлического лития?
- Как LiNO 3 , так и CsNO 3 хорошо растворимы в ацетоне (2-пропаноне). Какие из этих солей щелочных металлов вы бы использовали для осаждения I — из раствора ацетона?
Дано: Применение и избранные щелочные металлы
Запрошено: подходящего металла для каждого приложения
Стратегия:
Используйте свойства и химическую активность, обсуждаемые в этом разделе, чтобы определить, какой щелочной металл наиболее подходит для указанного применения.
Решение:
- И LiOH, и CsOH являются ионными соединениями, содержащими гидроксид-анион. Однако Li + намного меньше, чем Cs + , поэтому катион Li + будет более эффективно сольватироваться кислородом ТГФ с его неподеленными парами электронов. Это различие будет иметь два эффекта: (1) LiOH, вероятно, будет намного более растворимым, чем CsOH в неполярном растворителе, что может быть значительным преимуществом, и (2) сольватированные ионы Li + с меньшей вероятностью будут образовывать плотный ион. пары с ионами OH — в относительно неполярном растворе, что делает OH — более основным и, следовательно, более реактивным.Таким образом, LiOH — лучший выбор.
- Литий — мощный восстановитель, который реагирует с водой с образованием газа LiOH и H 2 , поэтому добавление источника водорода, такого как вода, к литиевому огню может вызвать взрыв. Литий также реагирует с кислородом и азотом в воздухе с образованием Li 2 O и Li 3 N соответственно, поэтому мы не ожидаем, что азот потушит литиевый пожар. Поскольку CO 2 представляет собой газообразную молекулу, которая содержит углерод в его наивысшей доступной степени окисления (+4), добавление CO 2 к сильному восстановителю, такому как Li, должно привести к интенсивной окислительно-восстановительной реакции.Таким образом, вода, N 2 и CO 2 не подходят для тушения литиевого пожара. Напротив, песок в основном представляет собой SiO 2 , который представляет собой сетчатое твердое вещество, которое трудно восстановить. Поэтому лучший выбор — тушить литиевый огонь песком.
- Соль с меньшим катионом имеет более высокую энергию решетки, а высокая энергия решетки имеет тенденцию к снижению растворимости соли. (Для получения дополнительной информации об энергиях решетки см. Главу 8 «Ионная и ковалентная связь».) Однако энергия сольватации катиона также важна для определения растворимости, и небольшие катионы, как правило, имеют более высокие энергии сольватации. Вспомните из главы 13 «Растворы», что высокая энергия сольватации увеличивает растворимость ионных веществ. Таким образом, CsI должен быть наименее растворимым из иодидов щелочных металлов, а LiI — наиболее растворимым. Следовательно, CsNO 3 — лучший выбор.
Упражнение
Укажите, какой из приведенных альтернативных щелочных металлов или их соединений более подходит для каждого применения.
- осушитель для органического растворителя — Li 2 SO 4 или Rb 2 SO 4
- удаление следовых количеств N 2 из высокоочищенного газа Ar — Li, K или Cs
- взаимодействие с алкилгалогенидом (формула RX) с получением металлоорганического соединения (формула MR) -Li или K
Ответ:
- Li 2 SO 4
- Li
- Li
Пример 3
Предскажите продукты каждой реакции, а затем уравновесите каждое химическое уравнение.
- Na (т) + O 2 (г) →
- Li 2 O (т) + H 2 O (л) →
- K (с) + CH 3 OH (л) →
- Li (т) + CH 3 Cl (л) →
- Li 3 Н (т) + KCl (т) →
Дано: реактивы
Запрошено: продукты и вычисленное химическое уравнение
Стратегия:
A Определите, является ли один из реагентов окислителем или восстановителем, сильной кислотой или сильным основанием.Если это так, вероятно, произойдет окислительно-восстановительная реакция или кислотно-щелочная реакция. Определите продукты реакции.
B Если ожидается реакция, сбалансируйте химическое уравнение.
Решение:
A Натрий является восстановителем, а кислород — окислителем, поэтому наиболее вероятна окислительно-восстановительная реакция. Мы ожидаем, что электрон переместится из Na (таким образом, образуя Na + ) в O 2 .Теперь нам нужно определить, является ли восстановленный продукт супероксидом (O 2 –), пероксидом (O 2 2–) или оксидом (O 2–). В нормальных условиях реакции продукт реакции щелочного металла с кислородом зависит от идентичности металла. Из-за различий в энергии решетки Li производит оксид (Li 2 O), более тяжелые металлы (K, Rb, Cs) производят супероксид (MO 2 ), а Na производит пероксид (Na 2 O 2 ).
B Вычисленное химическое уравнение: 2Na (s) + O 2 (g) → Na 2 O 2 (s).
A Li 2 O представляет собой ионную соль, которая содержит ион оксида (O 2−), который является полностью депротонированной формой воды и, таким образом, считается сильным основанием. Другой реагент, вода, является одновременно слабой кислотой и слабым основанием, поэтому мы можем предсказать, что произойдет кислотно-основная реакция.
B Вычисленное химическое уравнение: Li 2 O (s) + H 2 O (l) → 2LiOH (aq).
A Калий является восстановителем, тогда как метанол является одновременно слабой кислотой и слабым основанием (подобно воде). Слабая кислота производит H + , который может действовать как окислитель, принимая электрон с образованием 12h3. Следовательно, эта реакция представляет собой кислотную диссоциацию, которая завершается за счет восстановления протонов по мере их высвобождения.
B Рассчитанное химическое уравнение имеет следующий вид: K (s) + Ch4OH (l) → 12h3 (g) + Ch4OK (soln).
A Один из реагентов представляет собой щелочной металл, сильный восстановитель, а другой — галогенид алкила. Любое соединение, которое содержит связь углерод-галоген, в принципе может быть восстановлено, высвобождая галогенид-ион и образуя металлоорганическое соединение. В данном случае такой результат кажется вероятным, поскольку литийорганические соединения относятся к наиболее стабильным из известных металлоорганических соединений.
B Два моля лития необходимы для уравновешивания уравнения: 2Li (s) + CH 3 Cl (l) → LiCl (s) + CH 3 Li (soln).
A Нитрид лития и хлорид калия в основном являются ионными соединениями. Ион нитрида (N 3-) является очень сильным основанием, потому что это полностью депротонированная форма аммиака, слабой кислоты. Однако для кислотно-основной реакции требуется не только основание, но и кислота, а KCl не является кислотным.А как насчет окислительно-восстановительной реакции? Оба вещества содержат ионы с закрытой валентной электронной конфигурацией. Ион нитрида может действовать как восстановитель, отдавая электроны окислителю и образуя N 2 . Однако KCl не является окислителем, и для окислительно-восстановительной реакции требуется не только восстановитель, но и окислитель.
B Мы пришли к выводу, что два вещества не будут реагировать друг с другом.
Упражнение
Предскажите продукты каждой реакции и уравновесите каждое химическое уравнение.
- К (с) + N 2 (г) →
- Li 3 Н (т) + H 2 О (л) →
- Na (с) + (CH 3 ) 2 NH (раствор) →
- C 6 H 5 Li (soln) + D 2 O (l) → C 6 H 5 D (l) + LiOD (soln)
- CH 3 CH 2 Cl (soln) + 2Li →
Ответ:
- реакции нет
- Li 3 Н (с) + 3H 2 O (л) → NH 3 (водн.) + 3LiOH (водн.)
- Na (s) + (Ch4) 2NH (soln) → 12h3 (g) + Na [(Ch4) 2N] (soln)
- C 6 H 5 Li (soln) + D 2 O (l) → C 6 H 5 D (l) + LiOD (soln)
- CH 3 CH 2 Cl (soln) + 2Li → CH 3 CH 2 Li (soln) + LiCl (soln)
Сводка
Первые выделенные щелочные металлы (Na и K) были получены путем пропускания электрического тока через расплавленные карбонаты калия и натрия.Щелочные металлы являются одними из самых сильных известных восстановителей; большинство из них можно выделить электролизом их расплавленных солей или, в случае рубидия и цезия, реакцией их гидроксидных солей с восстановителем. Их также можно извлекать из силикатных руд с использованием многоступенчатого процесса. Литий, самый сильный восстановитель, и натрий, самый слабый, являются примерами физических и химических эффектов противоположных периодических тенденций. Щелочные металлы реагируют с галогенами (группа 17) с образованием ионных галогенидов; более тяжелые халькогены (группа 16) для получения халькогенидов металлов; и кислород с образованием соединений, стехиометрия которых зависит от размера атома металла.Пероксиды и супероксиды являются сильными окислителями. Единственный щелочной металл, который реагирует с атмосферным азотом, — это литий. Более тяжелые щелочные металлы реагируют с графитом с образованием интеркаляционных соединений графита , веществ, в которых атомы металлов вставлены между слоями атомов углерода. С более тяжелыми элементами 14 группы щелочные металлы реагируют с образованием многоатомных анионов с трехмерной каркасной структурой. Все щелочные металлы реагируют с водородом при высоких температурах с образованием соответствующих гидридов, и все восстанавливают воду с образованием газообразного водорода.Соли щелочных металлов получают реакцией гидроксида металла с кислотой с последующим испарением воды. И Li, и Na соли используются как осушители , соединения, которые используются для поглощения воды. Комплексообразующие агенты, такие как краун-эфиры и криптанды , могут вмещать ионы щелочных металлов подходящего размера. Щелочные металлы также могут реагировать с жидким аммиаком с образованием растворов, которые медленно разлагаются с образованием газообразного водорода и металлической соли иона амида (NH 2 —).Эти растворы, которые содержат нестабильные сольватированные электроны, слабо связанные с полостью в растворителе, имеют интенсивную окраску, хорошие проводники электричества и отличные восстановители. Щелочные металлы могут реагировать с органическими соединениями, содержащими кислотные протоны, с образованием солей. Они также могут образовывать металлоорганических соединений , свойства которых отличаются от свойств их металлических и органических компонентов.
Основные выводы
- Щелочные металлы являются сильнодействующими восстановителями, химический состав которых в основном аналогичен ионным соединениям, содержащим ион M + .
- Щелочные металлы имеют лишь слабую тенденцию к образованию комплексов с простыми основаниями Льюиса.
Концептуальные проблемы
Какой из элементов группы 1 наименее реагирует с кислородом? Что, скорее всего, образует гидратированную кристаллическую соль? Объясни свои ответы.
Щелочные металлы обладают значительным сродством к электрону, что соответствует присоединению электрона с образованием аниона M —.Почему же тогда они обычно теряют электрон нс 1 с образованием катиона M + , а не приобретают электрон с образованием M —?
Литий — гораздо более сильный восстановитель, чем натрий; цезий почти так же силен, как литий, что не соответствует ожидаемой периодической тенденции. Какие два противоположных свойства объясняют эту очевидную аномалию? Обнаружена ли такая же аномалия среди щелочноземельных металлов?
Объясните, почему ионный характер LiCl меньше, чем у NaCl.Исходя из периодических тенденций, ожидаете ли вы, что ионный характер BeCl 2 будет больше или меньше, чем у LiCl? Почему?
Щелочные металлы и углерод образуют интеркалированные соединения с чрезвычайно высокой электропроводностью. Это проводимость по слоям или по слоям? Поясните свой ответ.
Электролиз часто используется для отделения более легких щелочных металлов от их расплавленных галогенидов.Почему используются галогениды, а не оксиды или карбонаты, которые легче выделить? Имея это в виду, какова цель добавления хлорида кальция к галогениду щелочного металла?
Единственный щелочной металл, который реагирует с кислородом с образованием соединения с ожидаемой стехиометрией, — это литий, который дает Li 2 O. Напротив, натрий реагирует с кислородом с образованием Na 2 O 2 и более тяжелой щелочи. металлы образуют супероксиды.Объясните разницу в стехиометрии этих продуктов.
Классифицируют водные растворы Li 2 O, Na 2 O и CsO 2 как кислые, основные или амфотерные.
Хотя метанол относительно инертен, его можно превратить в синтетически более полезную форму путем реакции с LiH.Предскажите продукты реакции метанола с LiH. Опишите визуальные изменения, которые вы ожидаете увидеть во время этой реакции.
Литий реагирует с атмосферным азотом с образованием нитрида лития (Li 3 N). Почему другие щелочные металлы не образуют аналогичные нитриды? Объясните, почему все щелочные металлы реагируют с мышьяком с образованием соответствующих арсенидов (M 3 As).
Структура и реакционная способность
Напишите сбалансированное химическое уравнение для описания каждой реакции.
- Электролиз плавленого (плавленого) натрия хлорида
- Реакция термического разложения KClO 3
- Получение фтороводорода из фторида кальция и серной кислоты
- Окисление металлического натрия кислородом
Какие продукты образуются на аноде и катоде при электролизе
- расплав гидрида лития?
- расплав хлорида лития?
- водный фторид натрия?
Напишите соответствующие полуреакции для каждой реакции.
Натрий металлический получают электролизом расплавленного NaCl. Если при электролизе расплавленной соли с использованием тока 9,6 А (Кл / с) образуется 25,0 г газообразного хлора, сколько часов потребовалось для реакции? Какая масса натрия была произведена?
Перекись натрия может удалить CO 2 из воздуха и заменить его кислородом в соответствии со следующим несбалансированным химическим уравнением:
Na 2 O 2 (с) + CO 2 (г) → Na 2 CO 3 (с) + O 2 (г)- Выровняйте химическое уравнение.
- Укажите каждую полуреакцию окисления и восстановления.
- Предполагая, что реакция завершилась, какое будет давление внутри герметичного контейнера объемом 1,50 л после реакции избытка пероксида натрия с диоксидом углерода, которое первоначально было при 0,133 атм и температуре 37 ° C?
Предскажите продукты каждой химической реакции, а затем уравновесите каждое химическое уравнение.
- K (с) + CH 3 CH 2 OH (л) →
- Na (с) + CH 3 CO 2 H (л) →
- NH 4 Cl (тв) + Li (тв) →
- (CH 3 ) 2 NH (л) + K (т) →
Предскажите продукты каждой реакции.
- алкилхлорид с металлическим литием
- рубидий с кислородом
Образцу графита 655 мг дали возможность прореагировать с металлическим калием, и было выделено 744 мг продукта. Какая стехиометрия продукта?
Хлорная кислота, которая используется в качестве реагента в ряде химических реакций, обычно нейтрализуется перед утилизацией.Когда начинающий химик случайно использовал K 2 CO 3 для нейтрализации хлорной кислоты, из раствора выпала большая масса KClO 4 ( K sp = 1,05 × 10 -2 ). Какая масса иона калия содержится в 1,00 л насыщенного раствора KClO 4 ?
Ключевым этапом выделения щелочных металлов из их руд является селективное осаждение.Например, литий отделяется от натрия и калия путем осаждения Li 2 CO 3 ( K sp = 8,15 × 10 −4 ). Если 500,0 мл 0,275 М раствора Na 2 CO 3 добавить к 500,0 мл 0,536 М раствора гидроксида лития, какая масса Li 2 CO 3 выпадет в осадок (при условии отсутствия дальнейших реакций) ? Какая масса лития останется в растворе?
Ответ
5.54 г Li 2 CO 3 ; 0,82 г Li +
Понимание таблицы Менделеева через призму летучих металлов I группы
Поступила новость о том, что железнодорожный вагон, груженый чистым натрием, только что сошел с рельсов и разлил его содержимое. Репортер с телевидения позвонил мне, чтобы объяснить, почему пожарным не разрешалось использовать воду для тушения пламени, выходящего из искореженной машины.Находясь в воздухе, я добавил немного натрия в немного воды в чашке Петри, и мы наблюдали ужасную реакцию. Для дальнейшего драматического эффекта я также добавил немного калия в воду и поразил всех взрывным голубоватым пламенем.
Поскольку металлы группы I, также известные как щелочные металлы, очень реактивны, как натрий из железнодорожного вагона или калий, они не встречаются в природе в чистом виде, а только в виде солей. Они не только очень реактивны, они мягкие и блестящие, их можно легко разрезать даже тупым ножом, и они являются наиболее металлическими из всех известных элементов.
Я химик, который всю свою карьеру построил новые молекулы, иногда используя элементы группы I. Изучая поведение и тенденции элементов Группы I, мы можем получить представление о том, как устроена таблица Менделеева и как ее интерпретировать.
Периодическая таблица элементов. Металлы группы I окрашены в красный цвет слева. Хумдан / Shutterstock.comОсновы
Структура периодической таблицы и свойства каждого элемента в ней основаны на атомном номере и расположении электронов, вращающихся вокруг ядра.Атомный номер описывает количество протонов в ядре элемента. Атомный номер водорода 1, гелия 2, лития 3 и так далее.
Каждый из 18 столбцов в таблице называется группой или семейством. Элементы в одной группе обладают схожими свойствами. И свойства можно предполагать в зависимости от местоположения в группе. Например, переходя от вершины группы I к низу, атомные радиусы — расстояние от ядра до внешних электронов — увеличиваются.Но количество энергии, необходимое для отрыва внешнего электрона, уменьшается при движении сверху вниз, потому что электроны находятся дальше от ядра и не удерживаются так сильно.
Это важно, потому что то, как элементы взаимодействуют и реагируют друг с другом, зависит от их способности терять и приобретать электроны для создания новых соединений.
Горизонтальные строки таблицы называются периодами. Двигаясь от левой части периода к правой, атомный радиус становится меньше, потому что каждый элемент имеет один дополнительный протон и один дополнительный электрон.Больше протонов означает, что электроны сильнее притягиваются к ядру. По той же причине электроотрицательность — степень, в которой элемент имеет тенденцию получать электроны — увеличивается слева направо.
Сила, необходимая для удаления самого удаленного электрона, известная как потенциал ионизации, также увеличивается от левой части таблицы, в которой есть элементы с металлическим характером, к правой стороне, которые являются неметаллами.
Электроотрицательность уменьшается от верха столбца к низу.Точка плавления элементов в группе также уменьшается сверху вниз по группе.
Тенденции периодической таблицы. Sandbh / Википедия, CC BY-SAПрименение основ к элементам группы I
Крайний электрон, окружающий атом цезия, находится далеко от ядра и поэтому его легко удалить. Это делает цезий очень реактивным. gstraub / Shutterstock.comКак следует из названия, элементы Группы I занимают первый столбец в периодической таблице.Каждый элемент начинает новый период. Литий находится в верхней части группы, за ним следует натрий, Na; калий, К; рубидий, Rb; цезий, Cs и оканчивается радиоактивным францием, о. Поскольку он очень радиоактивен, с этим элементом практически не ведется химия.
Поскольку каждый элемент в этом столбце имеет единственный внешний электрон в новой оболочке, объемы этих элементов велики и резко увеличиваются при перемещении сверху вниз по группе.
Из всех элементов группы I цезий имеет наибольшие объемы, потому что крайний одиночный электрон удерживается слабо.
Несмотря на эти тенденции, свойства элементов Группы I более похожи друг на друга, чем свойства элементов любой другой группы.
История щелочных металлов
Используя химические свойства в качестве ориентира, русский химик Дмитрий Менделеев правильно упорядочил первые элементы группы I в своей периодической таблице 1869 года. Он называется периодическим, потому что каждый восьмой элемент повторяет свойства элемента, расположенного над ним в таблице. Расставив все известные тогда элементы, Менделеев предпринял смелый шаг, оставив пробелы там, где его экстраполяция химических свойств показала, что элемент должен существовать.Последующее открытие этих новых элементов подтвердило его предсказание.
Яркие цвета Fireworks обязаны металлам I группы. elena_prosvirova / Shutterstock.comНекоторые щелочные металлы были известны и нашли хорошее применение задолго до того, как Менделеев создал таблицу Менделеева. Например, Ветхий Завет упоминает соль — комбинацию щелочного металла натрия с хлором — 31 раз. В Новом Завете он упоминается 10 раз и называет карбонат натрия «нетер», а нитрат калия — «селитрой».”
С древних времен люди знали, что из древесной золы образуется калиевая соль, которая в сочетании с животным жиром дает мыло. Сэмюэл Хопкинс получил первый патент США на мыло 31 июля 1790 года в соответствии с новым законом о патентах, подписанным президентом Джорджем Вашингтоном за несколько месяцев до этого.
Пиротехническая промышленность любит эти элементы Группы I за их яркие цвета и взрывной характер. Горящий литий дает ярко-малиновый красный цвет; натрий желтый; калиевая сирень; рубидий красный; и цезий фиолетовый.Эти цвета появляются, когда электроны выпрыгивают из своей домашней среды, вращаясь вокруг ядра, и возвращаются обратно.
Атомные часы цезия, самые точные часы из когда-либо разработанных, работают, измеряя частоту электронов цезия, прыгающих вперед и назад между энергетическими состояниями. Часы, основанные на прыжках электронов, обеспечивают чрезвычайно точный способ отсчета секунд.
Металлический натрий реагирует с водой с образованием гидроксида натрия, газообразного водорода и энергии.Другие области применения включают натриевые лампы и литиевые батареи.
В моем собственном исследовании я использовал металлы группы I в качестве инструментов для других химических процессов. Однажды мне понадобился абсолютно сухой спирт, и самый сухой, который я мог купить, все еще содержал мельчайшие следы воды. Единственный способ избавиться от последних остатков воды — это обработать водосодержащий спирт натрием — довольно радикальный способ удалить воду.
Щелочные элементы не только занимают первый столбец в периодической таблице, но они также демонстрируют наибольшую реакционную способность из всех групп во всей таблице и имеют самые драматические тенденции в объеме и потенциале ионизации, сохраняя при этом большое сходство между собой.
Группировка периодической таблицы — MCAT Physical
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту. Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как как ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права. Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; и Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Семейство элементов Периодической таблицы
Элементы можно классифицировать по семействам элементов. Знание того, как определять семейства, какие элементы входят в состав, и их свойства, помогает предсказать поведение неизвестных элементов и их химические реакции.
Семейства элементов
Семейства элементов обозначены числами, расположенными вверху таблицы Менделеева.Тодд Хелменстайн
Семейство элементов — это набор элементов, обладающих общими свойствами. Элементы классифицируются по семействам, потому что три основные категории элементов (металлы, неметаллы и полуметаллы) очень широки. Характеристики элементов этих семейств определяются в первую очередь количеством электронов во внешней энергетической оболочке.С другой стороны, группы элементов — это совокупности элементов, категоризированных по схожим свойствам. Поскольку свойства элементов в значительной степени определяются поведением валентных электронов, семейства и группы могут быть одинаковыми. Однако есть разные способы разбивки элементов на семейства. Во многих учебниках химии и химии выделяются пять основных семейств:
5-элементные семейства
- Щелочные металлы
- Щелочноземельные металлы
- Переходные металлы
- Галогены
- Благородные газы
9-элементные семейства
Другой распространенный метод категоризации распознает девять семейств элементов:
- Щелочные металлы: Группа 1 (IA) — 1 валентный электрон
- Щелочноземельные металлы: Группа 2 (IIA) — 2 валентных электрона
- Переходные металлы: Группы 3-12 — металлы блока d и f имеют 2 валентных электрона
- Группа бора или земные металлы: Группа 13 (IIIA) — 3 валентных электрона
- Группа углерода или тетрелы: — Группа 14 (IVA) — 4 валентных электрона
- Группа азота или пниктогены: — Группа 15 (VA) — 5 валентных электронов
- Кислородная группа или халькогены: — Группа 16 (VIA) — 6 валентных электронов
- Галогены: — Группа 17 (VIIA) — 7 валентных электронов
- Благородные газы: — Группа 18 (VIIIA) — 8 валентных электронов
Распознавание семей по таблице Менделеева
Столбцы периодической таблицы обычно отмечают группы или семьи.Для нумерации семейств и групп использовались три системы:
- В более старой системе ИЮПАК использовались римские цифры вместе с буквами, чтобы различать левую (A) и правую (B) стороны периодической таблицы.
- В системе CAS использовались буквы для различения элементов основной группы (A) и переходных (B) элементов.
- В современной системе ИЮПАК используются арабские числа 1-18, просто пронумерованные столбцы периодической таблицы слева направо.
Многие периодические таблицы содержат как римские, так и арабские числа.Арабская система нумерации сегодня является наиболее широко принятой.
Группы IIA, IIIA и IVA
Группы IIA, IIIA и IVA
Группа IIA: Щелочно-земельные металлы
Все элементы группы IIA (Be, Mg, Ca, Sr, Ba и Ra) металлы, и все, кроме Be и Mg, являются активными металлами. Эти элементы часто называют щелочноземельных металлов. Термин щелочной отражает тот факт, что многие соединения этих металлов являются основными или щелочной.Термин земля исторически использовался для обозначения описывают тот факт, что многие из этих соединений нерастворимы в вода. Большая часть химии щелочноземельных металлов (группа IIA) можно предсказать по поведению щелочных металлов (Группа IA). Три точки должны быть иметь в виду, однако.
- Щелочноземельные металлы имеют тенденцию терять два электрона на образуют M 2+ иона (Be 2+ , Mg 2+ , Ca 2+ и т. Д.).
- Эти металлы менее реактивны, чем соседние щелочной металл. Магний менее активен, чем натрий; кальций менее активен, чем калий; и так далее.
- Эти металлы становятся более активными по мере того, как мы спускаемся по колонке. Магний более активен, чем бериллий; кальций больше активнее магния; и так далее.
Щелочноземельные металлы реагируют с неметаллами с образованием продукты, ожидаемые от электронных конфигураций элементы.
Mg ( s ) + Cl 2 ( г ) MgCl 2 ( с )
3 мг ( с ) + N 2 ( г ) Mg 3 N 2 ( s )
Ca ( с ) + H 2 ( г ) CaH 2 ( с )
Поскольку они не так активны, как щелочные металлы, большинство эти элементы образуют оксиды.
2 мг ( с ) + O 2 ( г ) 2 MgO ( с )
Кальций, стронций и барий также могут образовывать пероксиды.
Ba ( с ) + O 2 ( г ) BaO 2 ( с )
Более активные члены группы IIA (Ca, Sr и Ba) реагируют с водой комнатной температуры. Продукты этих реакций то, что мы могли ожидать. Кальций, например, теряет два электроны с образованием ионов Ca 2+ , когда он реагирует с водой.
Ca Ca 2+ + 2 e —
Эти электроны улавливаются молекулами воды с образованием H 2 газа и ионов OH — .
2 H 2 O + 2 e — H 2 + 2 OH —
Объединение двух половин реакции так, чтобы электроны conserved дает следующий результат.
Ca ( с ) + 2 H 2 O ( л ) Ca 2+ ( водн. ) + 2 OH — ( водн. ) + H 2 ( г )
Хотя Mg не реагирует с водой при комнатной температуре, он вступит в реакцию с паром.Продукция этого реакция не может быть водной ионы Mg 2+ и OH — потому что вокруг нет жидкой воды, которая могла бы стабилизировать эти ионы. Продуктами реакции являются газ H 2 и магний. оксид, MgO.
Mg ( s ) + H 2 O ( г ) MgO ( с ) + H 2 ( г )
| Практическая задача 2: Магний реагирует с водородом с образованием соединения A , которое представляет собой белое твердое вещество при комнатной температуре.Он также реагирует с соляной кислоты с образованием газа B и водного раствор соединения C . Определите продукты эти реакции и написать сбалансированные уравнения для каждого реакция. Нажмите здесь, чтобы проверить свой ответ на практическую задачу 2 |
Группа IIIA: Химия Алюминий
Элементы группы IIIA (B, Al, Ga, In и Tl) могут быть разделены на три класса.
- Бор — единственный элемент в этой группе, не являющийся металл. Он ведет себя как полуметалл или даже неметалл.
- Алюминий — третий по содержанию элемент в земной коры. Он просто немного менее реактивен, чем активные металлы.
- Остальные три элемента в этой группе являются активными металлами, но они настолько редки, что представляют ограниченный интерес. Общее количество галлия, индия и таллия менее 10 -10 % земной коры.
Таким образом, обсуждение металлов группы IIIA вращается вокруг химический состав алюминия, который можно понять, предположив что металл реагирует с образованием соединений, в которых он степень окисления +3.
2 Al ( s ) + 3 Br 2 ( l ) Al 2 Br 6 ( s )
4 Al ( с ) + 3 O 2 ( г ) 2 Al 2 O 3 ( с )
16 Al ( с ) + 3 S 8 ( с ) 8 Al 2 S 3 ( s )
Алюминий реагирует с концентрированными кислотами с образованием Al 3+ ионы и газ H 2 .
2 Al ( s ) + 6 H + ( водн. ) 2 Al 3+ ( водн. ) + 3 H 2 ( г )
Он также реагирует с концентрированными основаниями с образованием H 2 газ и алюминат-ион, Al (OH) 4 — , в который алюминий находится в степени окисления +3.
2 Al ( s ) + 2 OH — ( водн. ) + 6 H 2 O ( л ) 2 Al (OH) 4 — ( водн. ) + 3 H 2 ( г )
Группа IVA: олово и свинец
Элементы группы IVA можно разделить на три класса:
- углерод, являющийся неметаллом;
- кремний и германий — полуметаллы; и
- олово и свинец, металлы.Олово и свинец входят в число самые старые известные металлы.
Олово и свинец обладают гораздо меньшей реакционной способностью, чем любая из групп IA, Металлы IIA или IIIA. Согласно аргументу, что элементы стать более металлическим и поэтому более активный по мере того, как мы спускаемся по столбцу периодической таблицы, свинца должно быть больше реактивен, чем олово.
Свинец реагирует с воздухом с образованием тонкого покрытия из PbO и / или PbCO 3 , который защищает металл от дальнейшей реакции.
2 Pb ( с ) + O 2 ( г ) 2 ПБО ( с )
PbO ( с ) + CO 2 ( г ) PbCO 3 ( с )
В тонком виде свинец пирофорный он воспламеняется в присутствии кислорода.
Олово не реагирует ни с воздухом, ни с водой в помещении температура. При нагревании до белого цвета олово реагирует с воздухом, образуя форма SnO 2 .
Sn ( с ) + O 2 ( г ) SnO 2 ( с )
При высоких температурах он также реагирует с паром с образованием SnO 2 .
Sn ( с ) + 2 H 2 O ( г ) SnO 2 ( с ) + 2 H 2 ( г )
Олово и свинец менее активны, чем алюминий. Ни металла реагирует либо с разбавленной соляной кислотой, либо с разбавленной серной кислотой. кислота при комнатной температуре.Олово при нагревании реагирует с концентрированная соляная кислота или концентрированная серная кислота.
Sn ( с ) + 2 H + ( водн. ) Sn 2+ ( водн. ) + H 2 ( г )
Свинец медленно реагирует с соляной кислотой при комнатной температуре. и концентрированной серной кислотой при температуре выше 200 ° C.
Pb ( s ) + 2 H + ( водн. ) Pb 2+ ( водн. ) + H 2 ( г )
Олово и свинец являются металлами основной группы, которые образуют соединения в более чем одна степень окисления.Как правило, нижняя степень окисления становится более стабильным, когда мы спускаемся вниз по столбцу периодической таблицы. Свинец, например, чаще встречается при окислении +2. состояние чем жесть. Таким образом, пока олово реагирует с кислородом при высоких температуры с образованием SnO 2 , свинец образует PbO. (Пбо 2 не может образоваться в результате прямой реакции между свинцом и кислородом.)
Периодическая таблица элементов
Обзор
Периодическая диаграмма элементов — это просто способ упорядочить элементы, чтобы показать большой объем информации и организацию.Если читать по диаграмме справа налево, линия элементов представляет собой точку. Если вы читаете таблицу сверху вниз, линия элементов — это группа или семья. Пронумеруем элементы, начиная с водорода, номер один, целыми числами до наибольшего числа. Целое число в поле с символом элемента — это атомный номер элемента, а также количество протонов в каждом атоме элемента.
История Периодической таблицы
Таблица Менделеева — это способ организовать элементы на основе их сходства.Первая версия была построена Дмитрием Менделеевым в 1869 году. Он поместил элементы в сетку с возрастающими атомными весами и заметил, что элементы в каждой колонке имеют схожие химические свойства. Менделеев мог предсказать существование элементов до того, как они были обнаружены или синтезированы, глядя на пробелы в своей таблице. Однако он также обнаружил несоответствия. Например, согласно таблице Менделеева, аргон должен был стоять перед калием. Решение этой проблемы пришло в 1913 году, когда Генри Мозли упорядочил элементы по атомным номерам (числу протонов в атоме).Он делал это, стреляя электронами в атомы и анализируя эмиссионные рентгеновские лучи. Эта новая организация устранила все противоречия, порожденные организацией атомного веса. Ниже представлена фотография окончательного результата.
Структура периодической таблицы
Таблица Менделеева построена таким образом, чтобы это было очень полезно для химиков. Горизонтальные ряды называются периодами. Обычно отображаются символ элемента, атомный номер и атомный вес.Период элемента говорит нам о самом высоком невозбужденный уровень энергии электрона. Мы можем определить количество валентных (внешних) электронов, а также другие полезные свойства элемента из номера его группы. Подробнее об этом мы поговорим в следующем разделе. Таблица Менделеева также организован в четыре блока в соответствии с подоболочкой, в которой находится последний электрон. Блок s содержит первые две группы, блок p содержит последние шесть групп, блок d содержит группы с 3 по 12, а блок f лантаноиды и актиниды обычно расположены в двух строках внизу таблицы периодов.Блоки помогают при написании из электронной конфигурации элемента.
Группы
В периодической таблице есть десять названных групп. Все элементы в группе имеют похожие свойства. Также возможно чтобы сказать, сколько валентных электронов имеют элементы в определенных группах. Общие названия групп и валансных электронов: изложены ниже:
| Номер группы | Название группы | Валентные электроны |
| 1 | Щелочные металлы | 1 |
| 2 | Щелочноземельные металлы | 2 |
| 3-12 | переходные металлы | варьируется |
| 13 | 3 | |
| 14 | 4 | |
| 15 | 5 | |
| 16 | 6 | |
| 17 | Галогены | 7 |
| 18 | Благородные газы | 8 |
Следует отметить несколько моментов.Хотя гелий находится в группе 18, он имеет только два валентных электрона . Также водорода неметалл . Чтобы предсказать количество валентных электронов переходных металлов, используются другие методы. должны быть использованы.
Тенденции Периодической таблицы
Есть также определенные тенденции, которым следует таблица Менделеева. Они касаются размера, энергии ионизации, электроотрицательность и сродство элемента к электрону.Размер (атомный радиус) электрона уменьшается слева направо. Это потому, что каждый раз, когда добавляется протон, электроны притягиваются ближе к центр. Атомный радиус увеличивается сверху вниз. Энергия ионизации элемента или количество энергии необходимое для удаления электрона увеличивается слева направо и уменьшается сверху вниз. Электроотрицательность, тенденция элемента к притягиванию электронов следует той же схеме, что и энергия ионизации.Сродство к электрону также показывает тенденции, но они менее последовательны, чем другие. Сродство к электрону — это количество энергии, высвобождаемой, когда электрон добавляется к нейтральному атому с образованием отрицательного иона. Обычно он увеличивается слева направо и уменьшается сверху вниз. Последняя важная тенденция таблицы периодов связана с металлическим характером элемента. Элементы с пониженной ионизацией энергии, сродство к электрону и электроотрицательность имеют более сильные металлические характеристики.Это означает, что он уменьшается слева вправо и увеличивается сверху вниз, что помогает объяснить форму лестницы во многих периодических таблицах, созданных металлоидами.
Будущие изменения в Периодической таблице
Периодическая таблица Менделеева не высечена на камне. Будут открыты новые элементы, и ученые не уверены, таблица Менделеева будет продолжать с текущими тенденциями. Может потребоваться корректировка. Также количество возможных элементов обсуждается.Текущие прогнозы варьируются от 126 до 155 элементов.
СВОЙСТВА ВЕЩЕСТВА
Физические свойства материи
Материя — это все, что имеет массу и занимает место. Он включает в себя все окружающее нас физическое «вещество» — камни, дома, воду, воздух, людей, муравьев, деревья и т. Д. Вся материя может существовать в виде твердого тела, жидкости или газа. Материя включает в себя все, что мы можем взвесить (чтобы найти массу) и измерить, чтобы найти объем (потому что они занимают место).
Различные вещества — разные типы материи — обладают разными свойствами, которые можно использовать, чтобы отличить их друг от друга.Эти свойства — это то, что вы можете наблюдать или измерять в веществе. Например, вода и изопропиловый спирт (медицинский спирт) являются прозрачными бесцветными жидкостями при комнатной температуре. Однако их можно отличить друг от друга, потому что у них есть другие свойства. Вода без запаха, а изопропиловый спирт имеет резкий запах. Спирт испаряется очень быстро, а вода испаряется медленно. Кроме того, алкоголь легко воспламеняется — его можно поджечь спичкой (но не пытайтесь делать это дома!).С другой стороны, вода не только легко воспламеняется; его используют для тушения пожаров.
Свойства вещества можно разделить на две категории: физические свойства и химические свойства. Физические свойства можно наблюдать или измерять без изменения состава вещества. Пример — запах. Когда вы чувствуете запах воды или изопропилового спирта, ни одно из этих веществ не превращается во что-то другое. Они остаются водой и изопропиловым спиртом. Точно так же, когда вода и изопропиловый спирт испаряются, они не превращаются во что-то другое.Они переходят из жидкости в газ, но вода остается водой, а спирт остается спиртом. Поскольку эти вещества не превращаются в разные вещества, свойства запаха и скорость испарения являются физическими свойствами.
Вот еще несколько примеров физических свойств. Медь представляет собой твердый металл при комнатной температуре с температурой плавления 1083 ° C. Он блестящий, гибкий, оранжево-коричневого цвета. Его можно сплющить в очень тонкий лист металла или растянуть в тонкую проволоку.Он может быстро проводить тепло и проводить электричество, поэтому медь используется в шнурах питания и других проводах.
Все эти свойства меди являются физическими, потому что медь не превращается ни во что другое, когда эти свойства наблюдаются. Вы можете видеть, что он твердый и блестящий, ничего не делая с ним. Вы можете согнуть, сплющить или растянуть его. Эти действия изменят форму и внешний вид, но он останется медным. Даже нагревание до растворения в жидкости или пропускание электричества не превратят медь в другое вещество.
Как упоминалось выше, некоторые свойства являются химическими, а не физическими. В этом типе субстанция фактически превращается в субстанцию другого типа. Воспламеняемость изопропилового спирта является примером его химического свойства. Когда алкоголь горит, он фактически превращается во что-то другое. В конце изменения спирт уходит и заменяется диоксидом углерода (бесцветный газ) и водяным паром (вода в газообразном состоянии). Это не физическое свойство, потому что изопропиловый спирт превращается во что-то другое.
Химические свойства вещества
Химические свойства — это наблюдаемые характеристики состава вещества. Наблюдаемое не обязательно означает, что его можно увидеть визуально; скорее это означает, что мы можем отметить результат. Мы можем наблюдать запах, напряжение или даже время.
Химические свойства — это наблюдаемые характеристики состава вещества.
Мы обнаружили, что серебро (Ag) реагирует с элементарным кислородом (O2) с образованием оксида серебра Ag2O.Если бы это ожерелье было действительно покрыто серебром, а не сделанным из серебра, мы бы ожидали другого результата, чем тот, который мы наблюдаем с чистым серебром. Одним из элементов, которых у нас много в атмосфере, является кислород (O2), поэтому мы могли бы провести его множество тестов. Оставляем колье в бутылке и наполняем ее чистым О2. Через некоторое время мы видим, что ожерелье отреагировало. Достаем колье и анализируем химический состав результата; мы обнаруживаем, что у нас присутствует хорошее количество оксида серебра (Ag2O).Великолепные химические свойства помогли нам разгадать загадку блестящего ожерелья, но, к сожалению, у нас больше нет ожерелья. Это главный момент, о котором я должен вам сказать: в процессе наблюдения за химическими свойствами нам часто приходится изменять химический состав исходного вещества, чтобы получить это свойство. С учетом сказанного, не идите и не реагируйте на ожерелье своей мамы, не сообщая ей об этом, потому что реакция часто необратима!
Теперь, когда мы узнали, что такое химические свойства, давайте вернемся к основам «Периодической таблицы элементов.«Конечно, есть много способов, которыми мы можем классифицировать эти элементы, мы можем классифицировать их по размеру, цвету, запаху, поведению или даже по тому, как они реагируют с водой.
Химики определили, что лучший способ организовать элементы — это выровнять их в вертикальные столбцы («группы» или «семейства»), а затем классифицировать их по регионам в зависимости от их поведения.
Давайте начнем с изучения семейств периодической таблицы Менделеева:
Группа 1A: Щелочные металлы (Li, Na, K, Rb, Cs, Fr)
Все эти элементы являются металлами и существуют в твердом теле при комнатной температуре.Эти элементы чрезвычайно реактивны из-за их валентной оболочки, содержащей только 1 электрон. Все они реагируют с водой с образованием водорода и щелочных растворов. Если вам интересно, щелочные растворы — это смеси основного твердого вещества, растворенного в воде. Поскольку эти элементы абсолютно ненавидят одиночество, мы всегда обнаруживаем, что эти элементы вступают в реакцию с другим элементом в природе. Примером этого является хлорид натрия (NaCl).
Группа 2A: Щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra)
Как и металлы группы 1A, эти элементы (за исключением Be) реагируют с водой с образованием щелочных растворов.Часто эти элементы встречаются в виде оксидов своих родственников, таких как оксид кальция (CaO), и в этом случае они все еще реагируют с водой с образованием щелочных растворов. Магний и кальций являются седьмым и пятым по содержанию компонентами земной коры. Не зря их называют «земными металлами».
Группа 3A: (B, Al, Ga, In, Tl)
Основное сходство этих элементов в том, что все они образуют соединения с аналогичными формулами. Что это обозначает? Хорошо, если мы возьмем бор (B) и смешаем его в большом количестве с хлоридом (Cl), мы получим BCl3.Хорошо, согласен, не очень интересно; но что, если мы возьмем другой элемент группы 3A … как насчет алюминия (Al). Если смешать алюминий с большим количеством хлорида, мы получим (пожалуйста, барабанную дробь) AlCl3. Это довольно необычно, поэтому мы можем утверждать, что все они — семья, и реагировать одинаково.
Группа 4A: (C, Si, Ge, Sn, Pb)
Начиная с этой группы и двигаясь вправо, мы начинаем видеть все больше и больше неметаллов, присутствующих в каждой семье. В этом семействе углерод (C) — неметалл, кремний (Si) и германий (Ge) — металлоиды, олово (Sn) и свинец (Pb) — металлы.Становится очевидным, что при движении вправо семьи становятся более разнообразными. Поскольку это семейство, 4A, очень разнообразно, свойства этой группы больше меняются. Как и в группе 3A, все эти элементы образуют аналогичные соединения, такие как CO2, SiO2, GeO2, SnO2 и PbO2.
Группа 5A: (N, P, As, Sb, Bi)
И снова мы видим металл, смешанный с неметаллом и металлоидом в этом семействе … похоже, что, вероятно, не будет так много общих свойств, которые имеют эти элементы.Оказывается, эти элементы сгруппированы вместе, потому что все они образуют похожие соединения. Примером могут служить оксиды, N2O5, P2O5 и As2O5.
Группа 6A: (O, S, Se, Te, Po)
Как и наши домашние семьи, группа 6А представляет собой очень разнообразное семейство элементов. У этих элементов не так много общего, но опять же, что у вас на самом деле общего с вашими родителями? Все элементы группы 6А образуют аналогичные кислородсодержащие соединения SO2, SeO2 и TeO2.Интересно, что все они также образуют аналогичные натрийсодержащие соединения: Na2O, Na2S, Na2Se и Na2Te.
Группа 7A: галогены (F, Cl, Br, I, At)
Вся эта группа состоит из неметаллов, что указывает на то, что мы, вероятно, найдем много общего в этом семействе. Все галогены существуют в природе в виде двухатомных молекул, чрезвычайно реактивны (фактически, наиболее реакционноспособны из всех элементов), и все они чрезвычайно бурно реагируют с щелочными металлами с образованием солей.Наслаждайтесь своей поваренной солью (NaCl), потому что натрий довольно бурно реагировал с хлоридом, образуя его.
Группа 8A: благородные газы (He, Ne, Ar, Kr, Xe, Rn)
Старые добрые благородные газы! Где бы мы были сегодня без гелиевых шаров на день рождения или без неоновых вывесок? Все эти газы чрезвычайно редки на Земле и поэтому не были открыты до конца 19 века. Эти элементы абсолютно не любят реагировать с другими элементами. Они предпочитают быть максимально изолированными, потому что в конце концов они благородны.
Группы 1B-8B: переходные металлы
Все эти элементы являются металлами, отсюда и название переходные металлы. В этих группах сложно найти похожие объекты, поэтому мы пока оставим их в покое. Основная классификация всех этих элементов — это их незаполненная d-подоболочка. Мы не слишком много говорили о квантовых числах, но вы скоро увидите, как валентные оболочки могут влиять на поведение элементов и как они реагируют.
Итак, давайте все поаплодируем Дмитрию Ивановичу Менделееву и его организации современной Периодической таблицы элементов.Менделеев видел, что элементы обладают схожими характеристиками (свойствами), если смотреть на них в зависимости от их атомного номера. Это стало известно как «закон химической периодичности», и довольно очевидно, почему. Этот закон гласит, что свойства элементов являются функциями атомного номера элемента, ВАУ! Что еще более интересно, многие элементы даже не были обнаружены, когда он составил первую периодическую таблицу элементов, поэтому он фактически оставил в своей исходной таблице места для «возможных элементов», которые, по его мнению, будут обнаружены в будущем.Вот это круто!
Еще несколько интересных химических свойств
Оказывается, химия наполнена тоннами химических свойств. Некоторые свойства являются общими для веществ, а некоторые — нет. Оказывается, в нашей Вселенной так много разных химических составов, что невозможно подойти к каждому в отдельности. К счастью для нас, химики взяли отдельные соединения и сгруппировали их в разные классы, каждый из которых имеет схожие химические свойства.
Давайте поговорим о некоторых.
Спирт — это любое органическое соединение, которое содержит гидроксильную группу, присоединенную к углероду. Как вы понимаете, существует огромное количество способов присоединить гидроксильную группу к атому углерода. Химики поняли, что существует так много способов, что, вероятно, разумнее просто классифицировать их все как разновидности спиртов.
Все спирты обладают некоторыми общими химическими свойствами, например, при реакции спирта с O2 (также известной как реакция горения) мы всегда будем получать углекислый газ (CO2) и воду (h3O).
Еще одно интересное свойство — способность алкоголя окисляться. Спирты могут быть окислены до карбоновых кислот с использованием окислителей, таких как дихромат калия (VI) или манганит калия (VII). Кстати, по этой причине вино становится кислым, если его оставить в присутствии кислорода.
Мы можем продолжать и продолжать о химических свойствах различных классов, но основная цель этой статьи — познакомить вас с тем, что такое химическое свойство.
В чем главная идея?
И что? Я знаю, что такое химическое свойство, как оно мне помогает? Ну, точно так же, как идентифицировать своих друзей по их соответствующим именам, точно так же, как способность различать день и ночь, и точно так же, как способность различать горячее и холодное, как взрослеющие химики нам нужна способность идентифицировать вещество и устанавливать это отдельно от любого другого вещества во Вселенной! Мы не можем утверждать, что этанол — это то же самое, что вода, только потому, что они обладают одним и тем же свойством цвета.Мы не можем дышать угарным газом (CO) вместо кислорода (O2), потому что они оба не имеют запаха. Чем больше химических свойств мы знаем об определенном типе материи, тем лучше мы можем отличить это вещество от любого другого вещества в нашей Вселенной!
Тест на свойства материи
Что из этого , а не является физическим свойством воды?
Правильный ответ здесь: C .
Вода превращается в кислород и водород; следовательно, химический состав меняется из-за его разрушения.После описанного процесса это уже не вода.
Что из этого является физическим свойством металлического алюминия, из которого сделана алюминиевая фольга?
Правильный ответ здесь: A .
Алюминий только меняет форму; в других вариантах алюминий превращается в другие вещества.
Правда или ложь? Когда вода нагревается до температуры кипения 100 ° C, она пузырится и исчезает в воздухе.Это пример физического свойства.
Правильный ответ здесь: A .
Вода меняет фазы с жидкости на газ, но это все еще вода.
Что из следующего является химическим свойством?
Правильный ответ здесь: C .
Почему мы идентифицируем вещества по их свойствам?
Правильный ответ здесь: D .
Как мы можем отличить воду от этанола?
Правильный ответ здесь: C .
Какое определение для химической периодичности?
Правильный ответ здесь: C .
Что из следующего реагирует с водой с образованием водорода и щелочного раствора?
Правильный ответ здесь: A .
Периодические свойства
Периодическая диаграмма возникла из идеи, что мы можем расположить элементы, изначально по атомному весу, по схеме, которая показывала бы сходство между группами.
Первоначальная идея возникла из наблюдения за тем, как другие элементы соединяются с кислородом. Кислород каким-то образом соединяется со всеми элементами, кроме инертных газов. Каждый атом кислорода объединяется с двумя атомами любого элемента Группы 1, элементов в строке ниже лития. Каждый атом кислорода взаимно однозначно соединяется с любым элементом группы 2, элементами в строке ниже бериллия. Группа переходных элементов (номера 21-30 и 39-48 и 71-80 и 103 вверх) никогда не была должным образом помещена в исходную схему, относящуюся к кислороду.Переходные элементы различаются способами, которыми они могут присоединяться к кислороду, но способом, который не так очевиден на простой схеме. Группа 3 — это группа ниже бора. Все эти элементы соединяются с кислородом в соотношении от трех до двух атомов кислорода. Группа 4, начинающаяся с углерода, объединяет два к одному с кислородом и т. Д. Галлий, элемент номер тридцать один, является венцом Периодической таблицы, впервые предложенной Менделеевым.
Дмитрий Иванович Менделеев впервые высказал идею о периодическом расположении элементов.Он оставил место для галлия под алюминием, назвав его эка-алюминием и довольно точно предсказав свойства галлия. Элемент был обнаружен несколько лет спустя, как и предсказывал Менделеев. Менделеев также точно предсказал свойства других элементов.
Большинство периодических диаграмм имеют две строки по четырнадцать элементов под основной частью диаграммы. Эти две строки, лантаноиды и актиниды, действительно должны быть в таблице под номерами 57-70 и 89-102. Чтобы показать это, должна быть пропасть из четырнадцати пространств элементов между номерами 20-21 и номерами 38-39. .Это сделало бы график почти вдвое длиннее, чем сейчас. Лантаниды принадлежат к периоду 6, а актиниды относятся к периоду 7. В базовых курсах химии вы редко найдете много применения для каких-либо лантаноидов или актинидов, за возможным исключением элемента № 92, урана. В природе не встречается элементов выше 92. Все они — искусственные элементы, если вы хотите их так называть. Ни один из элементов выше # 83 не имеет полностью стабильного изотопа. Это означает, что все элементы крупнее висмута естественно радиоактивны.Элементы лантаноидов настолько редки, что вы вряд ли встретите их на большинстве начальных уроков химии. Еще одна странность периодической диаграммы заключается в том, что водород на самом деле не принадлежит ни к Группе I, ни к какой-либо другой группе. Несмотря на то, что водород составляет более семидесяти процентов атомов известной вселенной, он является уникальным элементом.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ
Символы элементов, ионов и соединений
Обзор
Атомы и их субатомные частицы измеряются в a.м.у. , или атомной массы ед.. Атомная единица массы эквивалентна 1/12 массы углерода-12. атом. Элементы чаще всего измеряются в а.е.м., граммах или молях. Каждый из них измерения будут дополнительно объяснены на следующих страницах по мере необходимости.
Периодическая таблица
Если вы посмотрите элемент в периодической таблице, вы увидите следующее:
Или это может быть просто отображено так:
Следующая полезная информация представлена в большинстве периодических таблиц:
Символ : часто это сокращение элемента из одной или двух букв; для Например, символ углерода — C.При написании символа первая буква всегда заглавными буквами, а если в нем вторая буква — строчными.
Имя элемента : так называется элемент. В некоторых периодических таблицах есть и символ, и имя, в то время как у других есть только символ, поэтому это важно знать и то, и другое.
Атомный номер : это количество протонов, содержащихся в элементе.Например, атомный номер углерода 6, потому что в атоме углерода 6 протонов.
Атомный вес : Часто это десятичное число, обычно в единицах грамм / моль. Это число будет широко использоваться при преобразовании граммов в моль. позже. Например, атомная масса углерода составляет 12,011 г / моль.
Атомное массовое число : это целое число, которое обычно очень близко к атомный вес.Атомное массовое число — это число протонов плюс число нейтронов в атоме. Например, массовое атомное число углерода равно 12, что означает в нем 6 протонов и 6 нейтронов. Это полезно при расчете массовых соотношений.
Для каждого элемента есть одна и только одна заглавная буква. В нем может быть или не быть строчной буквы. При записи в химических уравнениях мы представляем элементы только символом без привязки к заряду. Семь исключений из этого — семь элементов, которые находятся в газообразной форме в виде двухатомной молекулы, то есть два атома одного и того же элемента, прикрепленные друг к другу.Список этих элементов лучше всего запомнить. Это водород, азот, кислород, фтор, хлор, бром и йод. Химические символы этих двухатомных газов: h3, N2, O2, F2, Cl2, Br2 и I2. При определенных условиях кислород образует трехатомную молекулу, озон, O3. Озон нестабилен, поэтому атомы кислорода перестраиваются в более стабильную двухатомную форму.
Двухатомные газы (водород, азот, кислород, фтор, хлор, бром и йод), элементы первой группы (литий, натрий, калий, рубидий, цезий и франций), элементы второй группы (бериллий, магний, кальций). , стронций, барий и радий), элементы седьмой группы, галогены (фтор, хлор, бром, йод и астат) и благородные газы (гелий, неон, аргон, криптон, ксенон и радон).По крайней мере, изучение их в виде ектении поможет вам отличить радий, элемент группы 1, и радон, инертный газ.
Группы из двух или более символов элементов, прикрепленных друг к другу без какого-либо заряда, указывают на соединение. CaCl2 представляет собой соединение с двумя атомами хлора на каждый атом кальция. CuSO4 · 5h3O, пентагидрат сульфата меди, также является соединением. Он имеет один атом меди и один сульфат-ион, состоящий из атома серы и четырех атомов кислорода, связанных с пятью молекулами воды.
Заряженные частицы, называемые ионами, при написании символов будут иметь заряд, положительный (+) или отрицательный (-), записанный справа и надстрочный к химическому символу. Например, Na + является символом иона натрия. Атомы или многоатомные ионы с зарядом более одного, положительным или отрицательным, имеют номер с зарядом. Например, (CO3) 2- это символ карбонат-иона. Карбонат-ион имеет один атом углерода, три атома кислорода и два отрицательных заряда.Обратите внимание, что заряд находится вне скобок, что указывает на то, что заряд исходит от многоатомного иона в целом.
Ионы и изотопы
Все встречающиеся в природе атомы (из элементов, перечисленных в периодической таблице) являются состоят из нейтральных атомов, что означает, что они имеют одинаковое количество протонов и электронов. Дисбаланс протонов и электронов создает ион , атом, содержащий больше протонов, чем электронов, или наоборот.Ионы создаются за счет выигрыша или потери электронов. Получение электрона даст иону отрицательный заряд, потому что электроны сделать атом более отрицательным. Потеря электрона даст иону положительный заряд, потому что удаление электрона (который является отрицательным) сделало бы атом более положительным. Положительный ион называется катионом, и он может иметь заряд +1, +2 или +3. Отрицательный ион называется анионом, и он может иметь заряд -1, -2 или -3.Иногда обвинения может быть больше положительного или отрицательного 3, но обычно они либо +, либо — 1, 2 или 3.
Изотопы также важны при определении массы и заряда. Некоторые элементы есть изотопы, что означает, что они имеют разные типы атомов, некоторые из которых иметь больше нейтронов, чем другие. Теперь помните, нейтроны не имеют заряда, поэтому заряд изотопа не отличается от заряда исходного элементаля атом, у него просто другое количество нейтронов, что меняет атомную массу немного.Например, наиболее часто встречающейся формой углерода является углерод-12, который означает, что эта форма углерода имеет 6 протонов, 6 электронов и 6 нейтронов. Тем не мение, некоторые общие изотопы углерода — это углерод-13 и углерод-14, что можно интерпретировать следующим образом: углерод-13 будет иметь 6 протонов и 6 электронов (как обычно), но этот изотоп будет иметь 7 нейтронов, так как 13-6 = 7. Углерод-14 будет иметь 6 протонов и 6 электронов, как обычно, но у этого изотопа будет 8 нейтронов, так как 14-6 = 8.
Иногда соединения также могут быть ионами. Помните, мы говорили, что ионы — это элементы с положительный или отрицательный заряд. Что ж, ионы тоже могут состоять из соединений. Для Например, NO 3 — — это отрицательный ион нитрата, который связывается с водород с образованием HNO 3 . Ионы, которые являются соединениями, называются многоатомными . ионы, потому что они состоят из более чем одного атома элементарного материала.
Категории элементов
То, что Визант называет «категориями элементов», включает; металлы, неметаллы, полуметаллы, благородные газы и водород.
Рассмотрим, что линия в форме лестницы на Периодической таблице, начинающаяся между бором и алюминием, превращается между алюминием и кремнием, затем вниз между кремнием и германием, между германием и мышьяком, между мышьяком и сурьмой, между сурьмой и теллуром, между теллуром и полонием, и между полонием и астатом.Это грань между металлическими и неметаллическими элементами. Металлические элементы находятся слева и снизу от линии, а неметаллические элементы — справа и вверх от линии. Что ж, это не совсем так. Существует ряд неметаллических элементов, Группа 8, Группа 18 или Группа 0, как бы вы их ни считали, благородные или инертные газы, которые на самом деле представляют собой целую Группу и категорию. Водород — уникальный элемент, единственный член своей группы и категории.
Благородные газы
Благородные газы или инертные газы обладают следующими свойствами: По большей части они не образуют химических соединений с какими-либо элементами.Были сделаны некоторые соединения с благородными газами, но с трудом. Естественных соединений с этой группой, конечно же, нет. Все они газы при комнатной температуре. Все они имеют очень низкие температуры кипения и плавления. Все они излучают цвет в видимом диапазоне длин волн, когда газ под низким давлением подается в трубку и через трубку пропускается ток высокого напряжения. Этот тип трубки называется неоновым светом, независимо от того, есть ли в ней неон или нет. Инертные газы не являются металлами, потому что они не металлы, но они значительно отличаются от других неметаллов.Насколько близки друг другу все благородные газы, их, безусловно, следует рассматривать в качестве отдельной группы.
Металлы
Безусловно, самая большая категория элементов в Периодической таблице — это металлические элементы. Металлы обладают набором свойств, которые не так универсальны для них, как инертные газы. Металлические элементы обычно обладают следующими свойствами: они имеют один, два или три электрона на внешней электронной оболочке.
Внешние электроны повышают вероятность того, что металл потеряет электроны, образуя положительные ионы.Ионы металлов обычно имеют заряд плюс один, плюс два или плюс три. Металлы, как правило, теряют электроны, чтобы стать стабильными. Они будут прикрепляться к другим элементам почти исключительно ионными связями.
Когда атомы металла находятся вместе в группе, вокруг атомов образуется рой полураскладных электронов. Эти электроны свободно перемещаются между атомами металла, образуя так называемый электронный газ. Электронный газ определяет блеск металлов. Когда на металле есть гладкая поверхность, он будет организованно отражать электромагнитные волны (включая видимый свет).Блеск также называют металлическим блеском. Тот же электронный газ объясняет когезионные тенденции металлов. Связный означает, что материал цепляется сам за себя. Это свойство легко увидеть у ртути. Атомы ртути цепляются за другие атомы ртути или других металлов с невероятной стойкостью.
Такое же сцепление металлов происходит в твердом состоянии. Серебро очень пластично. Это означает, что если вы ударите по нему, материал с большей вероятностью изменит форму, чем расколется. Когда-то монеты в полдоллара были сделаны из серебра на девяносто процентов.Уничтожать деньги — незаконно, но школьники брали ложку и били серебряные полдоллары по бокам, пока края не загибались внутрь. Когда центр стал нужного размера, его вынули, чтобы сделать серебряное кольцо, подогнанное под ваш палец. Проволока изготавливается путем протягивания металла через матрицу. Металл настолько сцепляется с собой, что принимает форму штампа, проходя через отверстие в штампе. Это свойство протягиваться через матрицу для изготовления проволоки называется пластичностью (от латинского ducere, тянуть или вести).Наличие электронного газа делает металлы хорошими проводниками электричества. Опять же из-за когезионных свойств металлы имеют высокие температуры плавления и кипения. Почти все металлы находятся в твердом состоянии при комнатной температуре. Металлы обычно хорошо проводят тепло. Активные металлы реагируют с кислотами. Некоторые очень активные металлы вступают в реакцию с водой. Металлические элементы обычно более плотные, чем неметаллы.
Неметаллы
Свойства неметаллов не так универсальны для них, как свойства металлов; среди этой группы есть много различий.Неметаллы обладают следующими свойствами:
- Неметаллы обычно имеют четыре, пять, шесть или семь электронов на внешней оболочке. Когда они соединяются с другими элементами, неметаллы могут либо делить электроны ковалентной связью, либо получать электроны, чтобы стать отрицательным ионом и образовать ионную связь.
- Когда неметаллические элементы соединяются ковалентными связями, это обычно происходит с другими неметаллами. Неметаллы могут соединяться ковалентными связями, образуя группу (обычно неметаллических) элементов с общим зарядом, называемых радикалом или многоатомным ионом.
- Элементарные неметаллы часто имеют тусклый вид. Они с большей вероятностью станут хрупкими или расколются при ударе. Хотя это и не является постоянным правилом, неметаллы имеют более низкие температуры плавления и кипения, чем металлы, а твердые вещества имеют тенденцию быть менее плотными.
- Неметаллы не так когезионны, как металлы, и уж точно не пластичны. Неметаллы обычно не являются хорошими проводниками тепла или электричества. Многие неметаллы образуют двухатомные или многоатомные молекулы с другими атомами того же элемента.
- Многие неметаллы имеют несколько форм свободного элемента, называемых аллотропами, которые появляются в разных условиях. (Слово «свободный» здесь означает, что элемент не привязан к другим типам атомов, а не то, что его денежная ценность равна нулю.)
полуметаллы
Мы сделали вид, что есть резкая грань между металлами и неметаллами. Это не тот случай. Линия в форме лестницы между металлами и неметаллами имеет несколько элементов на ней или рядом с ними, которые имеют свойства где-то между этими двумя категориями.Имея три электрона во внешней оболочке, бор должен быть металлическим элементом. Это не. Бор с большей вероятностью образует ковалентные связи, как неметалл, чем отдает электроны, как алюминий, следующий элемент в таблице в той же группе.
Алюминий определенно является металлом по большинству свойств, но у него есть своя особенность. Алюминий амфотерный; он реагирует как с кислотами, так и с основаниями. Кремний, германий, мышьяк, сурьма и теллур находятся на грани между металлами и неметаллами и обладают некоторыми качествами обоих.Эти элементы на самом деле не составляют четко определенной категории, но из-за совокупности свойств, которые они демонстрируют, их часто объединяют в классификацию, называемую полуметаллами.
Многие элементы на линии являются полупроводниками электричества, а это означает, что они обладают способностью проводить электричество где-то между почти нулевой и полной проводимостью. Это свойство полезно в электронной промышленности.
Водород
Мы не смогли включить водород ни в одну из категорий по уважительным причинам.Водород просто ничем не соответствует. Более девяноста девяти целых девяти десятых процента водорода составляют всего один протон и один электрон.
Очень небольшая часть (один атом из нескольких тысяч) водорода составляет дейтерий, один протон, один нейтрон и один электрон. Еще меньшая часть (сто атомов на миллион миллиардов) водорода — это тритий, один протон, два нейтрона и один электрон. Когда атом водорода получает электрон, он становится отрицательным ионом. Отрицательный ион водорода, называемый гидрид-ионом, может быть присоединен к металлам, но в природе он не встречается, потому что он нестабилен в воде.Положительный ион водорода — это то, что отвечает за кислоты. На самом деле не существует (положительного) иона водорода. Имея только протон и электрон, водород становится протоном, только если он теряет свой электрон. Свободные протоны присоединяются к молекуле воды, образуя ион h4O +, ион гидроксония. Этот гидроксоний — настоящее химическое вещество, которое производит свойства кислот. Элементарный водород — двухатомный газ. За исключением того, что он имеет валентность +1, водород имеет несколько других сходств с элементами Группы 1.Водород создает ковалентные связи между другими атомами водорода или другими неметаллами.
Группы или семейства периодической таблицы
Элементы группы I (1), литий, натрий, калий, рубидий, цезий и франций, также называются элементами щелочных металлов. Все они очень мягкие металлы, которые не встречаются в природе свободными, потому что они вступают в реакцию с водой. В форме элемента они должны храниться под керосином, чтобы они не вступали в реакцию с влажностью воздуха.Все они имеют валентность плюс один, потому что у них один и только один электрон во внешней оболочке. Все щелочные металлы приобретают характерный цвет, когда их соединения помещаются в огонь. Спектроскопия (разделение спектра, чтобы вы могли видеть отдельные частоты) цветного света от испытания пламенем показывает сильные эмиссионные линии от элементов. Самые легкие из них наименее реактивны. Активность увеличивается по мере того, как элемент перемещается вниз по Периодической диаграмме. Литий медленно вступает в реакцию с водой.Цезий очень бурно реагирует. Очень немногие из солей элементов Группы 1 не растворяются в воде. Легчайшие из щелочных металлов очень распространены в земной коре. Франций редок и радиоактивен.
Элементы группы II (2), бериллий, магний, кальций, стронций, барий и радий, все имеют два электрона во внешнем кольце и, следовательно, имеют валентность, равную двум. Элементы группы 2, также называемые щелочноземельными металлами, в свободной форме являются слегка мягкими металлами. Магний и кальций распространены в земной коре.
Элементы группы 3, бор, алюминий, галлий, индий и таллий, представляют собой смешанную группу. Бор в основном имеет неметаллические свойства. Предпочтительно бор будет связываться ковалентно. Остальная часть группы — металлы. Алюминий — единственный распространенный в земной коре. Элементы группы 3 имеют три электрона на внешней оболочке, но три больших элемента имеют валентность как один, так и три.
Элементы группы 4, углерод, кремний, германий, олово и свинец, также не являются связной группой.Углерод и кремний связываются почти исключительно четырьмя ковалентными связями. Оба они обычны в земной коре. Германий — редкий полуметалл. Олово и свинец определенно являются металлами, хотя у них есть четыре электрона во внешней оболочке. Олово и свинец имеют некоторые отличия в своих свойствах от металлических элементов, что предполагает небольшое расстояние от линии между металлами и неметаллами (полуметаллическая странность). У них обоих более одной валентности, и оба они в некоторой степени распространены в земной коре.
Группа 5 также делится на металлы и неметаллы. Азот и фосфор определенно неметаллы. Элемент азот в виде двухатомной молекулы составляет около восьмидесяти процентов атмосферы. В тех редких случаях, когда азот и фосфор образуют ионы, они образуют тройные отрицательные ионы. Ионы нитрида (N-3) и фосфида (P-3) нестабильны в воде и поэтому не встречаются в природе. Все элементы Группы 5 имеют пять электронов на внешней оболочке. Для более мелких элементов легче завершить оболочку, чтобы они стали стабильными, поэтому они не являются металлами и с большей вероятностью образуют ковалентные связи, чем ионные.Более крупные элементы в группе, сурьма и висмут, как правило, являются металлами, потому что им легче отдать пять электронов, чем привлечь еще три. Мышьяк, сурьма и висмут имеют валентности +3 или +5. Мышьяк — это во многом полуметалл, но все три из них демонстрируют некоторые полуметаллические причуды, такие как хрупкость как свободный элемент.
Элементы VII группы (6 или 16), кислород, сера, селен и теллур, имеют шесть электронов во внешней оболочке. Нас не интересует полоний как элемент шестой группы.Это слишком редко, слишком радиоактивно и слишком опасно для нас, чтобы даже рассматривать его в базовом курсе.
Теллур — единственный элемент в группе 6, который является полуметаллом. Есть положительные и отрицательные ионы теллура. Кислород, сера и селен — настоящие неметаллы. У них валентность отрицательных двух как иона, но они также связаны ковалентно. Газообразный кислород образует ковалентные молекулы двухатомного газа с двойной связью, которые составляют около двадцати процентов земной атмосферы. Кислород и сера являются общими элементами.Селен обладает свойством, которое может быть связано с полуметаллическими причудами; он намного лучше проводит электричество, когда на него светит свет. Селен используется в фотоэлементах для этого свойства.
На некоторых диаграммах вы увидите водород над фтором в группе VII (7 или 17). Водород не принадлежит к этой группе более, чем к группе 1. Фтор, хлор, бром и йод составляют группу 7, галогены. Об астатине можно забыть. Он слишком редок и радиоактивен, чтобы его здесь рассматривать.Галогены имеют отрицательную валентность, когда они образуют ионы, потому что у них семь электронов на внешней оболочке. Все они представляют собой двухатомные газы как свободные элементы при температуре около комнатной. Они задыхаются от ядовитых газов. Фтор и хлор желто-зеленые, бром красноватый, а йод пурпурный как газ. Все можно найти прикрепленными к органическим молекулам. Хлор обычен в земной коре, большая его часть в виде отрицательного иона соли NaCl в океанах. Фтор является наиболее активным из них, и его активность уменьшается с увеличением размера галогена.
Все инертные или благородные газы имеют полную внешнюю оболочку из электронов. Гелий — единственный, у которого заполнена только подоболочка «s», а во внешней и единственной оболочке только два электрона. Все остальные, неон, аргон, криптон, ксенон и радон, имеют восемь электронов на внешней оболочке. Поскольку электронная конфигурация в этой форме наиболее устойчива, инертные газы не образуют природных соединений с другими элементами. Группа имеет различные номера: группа VIIIA, 8, 8A, 0 или 18.«Группа ноль», кажется, хорошо им подходит, поскольку легко представить себе, что они имеют нулевую валентность, что не является вероятным зарядом.
Переходные элементы составляют группу между тем, что Chemtutor назвал Группой 2 и Группой 3. Все переходные элементы — это металлы. Очень немногие переходные элементы обладают неметаллическими свойствами. Внутри переходных элементов многие диаграммы подразделяют элементы на группы, но, кроме трех горизонтальных групп, трудно провести значимые различия между ними.Горизонтальные группы: железо, кобальт и никель; рутений, родий и палладий; и осмий, иридий и платина. Считается, что в центре Земли есть расплавленная масса железа.
Лантаноиды и актиниды называются внутренними переходными элементами. Лантаноиды, элементы с 57 по 70, также называют редкоземельными элементами. Все они являются металлическими элементами, очень похожими друг на друга, но их можно разделить на цериевую и иттриевую группы. Часто они встречаются в тех же рудах с другими элементами группы.Их нет в земной коре в больших количествах. Из актинидов, элементов с 89 по 102, только первые три встречаются в природе, а остальные являются элементами промышленного производства. Из трех встречающихся в природе только уран, вероятно, так или иначе будет упоминаться в базовом курсе химии. Были изготовлены элементы с 103 по 109, и они были названы IUPAC (Международный союз теоретической и прикладной химии), но они не имеют большого значения для этого курса.
Знакомая периодическая таблица с атомными номерами, символами и массами
| Число Авогадро | N = 6.022 E23 |
| Газовая постоянная | R = 0,08206 литр атм / моль — K = 8,3145 Дж / моль — K |
| Постоянная Планка | h = 6,626 E-34 Дж — с |
| Скорость света | c = 2,998 E8 м / с |
| Постоянная Фарадея | F = 96 485 кул / моль е |
| Электрический ток | Ампер = кулон / секунда |
| Электроэнергия кулонов | |
| рабочая ценность тепла | 1 калория = 4.184 Дж |
| Удельная теплоемкость жидкой воды | c h3O = 4,18 Дж / г — C ° = 1,00 кал / г — C ° |
| Группа 1 I-A | Группа 18 VIII-A | ||||||||||||||||
| 1 H 1,0079 | Группа 2 II-A | Группа 13 III-A | Группа 14 IV-A | Группа 15 V-A | Группа 16 VI-A | Группа 17 VII-A | 2 He 4.003 | ||||||||||
| 3 Ли 6,941 | 4 Be 9.012 | ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ | 5 Б 10,811 | 6 К 12.011 | 7 № 14.007 | 8 О 15,999 | 9 Факс 18,998 | 10 Ne 20.180 | |||||||||
| 11 Na 22.990 | 12 мг 24.305 | Группа 3III-Б | Группа 4 IV-B | Группа 5 V-B | Группа 6 VI-B | Группа 7 VII-B | Группа 8 Группа 9 Группа 10 VIII-B | Группа 11 I-B | Группа 12 II-B | 13 Al 26.982 | 14 Si 28.086 | 15 П 30,974 | 16 ю 32,066 | 17 Класс 35,453 | 18 Ар 39.948 | ||
| 19 К 39.098 | 20 Ca 40.078 | 21 SC 44,956 | 22 Ti 47,867 | 23 В 50.942 | 24 Кр 51,996 | 25 млн 54,938 | 26 Fe 55,845 | 27 Co 58,933 | 28 Ni 58.693 | 29 Cu 63,546 | 30 Zn 65,39 | 31 Ga 69,723 | 32 Ge 72,61 | 33 Как 74.922 | 34 SE 78,96 | 35 руб. 79,904 | 36 Кр 83,80 |
| 37 руб. 85,468 | 38 Sr 87.62 | 39 Я 88,906 | 40 Zr 91,224 | 41 Nb 92,906 | 42 Пн 95,94 | 43 Тс (98) | 44 Ру 101.07 | 45 правый 102,906 | 46 Pd 106,42 | 47 Ag 107,868 | 48 Кд 112.411 | 49 В 114.818 | 50 Sn 118,710 | 51 Сб 121,760 | 52 Te 127,60 | 53 Я 126,904 | 54 Xe 131.29 |
| 55 CS 132,905 | 56 Ba 137,327 | 57 La 138,90 | 72 Hf 178,49 | 73 Ta 180.948 | 74 Вт 183,84 | 75 Re 186.207 | 76 Ос 190,23 | 77 Ir 192,217 | 78 Пт 195.08 | 79 Au 196.966 | 80 рт. Ст. 200,59 | 81 Тл 204,383 | 82 Пб 207,2 | 83 Би 208.980 | 84 Po (209) | 85 по адресу (210) | 86 Rn (222) |
| 87 Пт (223) | 88 Ra (226) | 89 Ас (227) | 104 Rf (261) | 105 ДБ (262) | 106 Sg (263) | 107 Bh (262) | 108 HS (265) | 109 млн тонн (266) | 110 (269) | 111 (272) | 112 (277) | 114 (289) (287) | 116 (289) | 118 (293) | |||
| Лантаноиды Актиниды | 58 CE 140.116 | 59 Пр 140,908 | 60 Nd 144,24 | 61 пм (145) | 62 См 150,36 | 63 ЕС 151.964 | 64 Gd 157,25 | 65 Тб 158,925 | 66 Dy 162,50 | 67 Ho 164,930 | 68 Er 167.26 | 69 Тм 168,934 | 70 Яб 173,04 | 71 Лю 174,967 |
| 90 Чт 232.038 | 91 Па 231.036 | 92 U 238.029 | 93 НП (237) | 94 Pu (244) | 95 Am (243) | 96 см (247) | 97 Бк (247) | 98 Cf (251) | 99 Es (252) | 100 FM (257) | 101 Md (258) | 102 № (259) | 103 Лр (262) |

Leave A Comment