Задание 4 из ЕГЭ по химии
Все для самостоятельной подготовки к ЕГЭ
Зарегистрироваться
Русский язык Математика (профильная) Математика (базовая) Обществознание Физика История Биология Химия Английский язык Литература Информатика География
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание вы можете получить 1 балл на ЕГЭ в 2023 году
Посмотреть
Задача 1
Из предложенного перечня выберите два соединения, в которых присутствует донорно-акцепторная связь.
- $Al_2(SO_4)_3$
- $KClO_4$
- $Na_3[Fe(CN)_6]$
- $SrCl_2$
- $РH_4Cl$
Запишите в поле ответа номера…
Задача 2
Из предложенного перечня выберите два соединения, в которых присутствует ионная связь.
- $NF_3$
- $NaNO_2$
- $CH_3NO_2$
- $CH_3Cl$
- $HCOONH_4$
Запишите в поле ответа номера выбранных соединений.
Задача 3
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная связь.
- $K_2O$
- $CrO_3$
- $BaO_2$
- $SiO_2$
- $MnO_2$
Запишите в поле ответа номера выбранных соединений.
Задача 4
Из предложенного перечня выберите два соединения, в которых отсутствует ионная связь.
- $NaHCO_3$
- $NH_4H_2PO_4$
- $NH_3$
- $Ca_3(PO_4)_2$
- $PCl_5$
Запишите в поле ответа номера выбранных соединен…
Задача 5
Из предложенного перечня выберите два вещества, которые имеют немолекулярное строение.
- $H_2$
- $H_2S$
- $SiO_2$
- $HBr$
- $C_6H_5OK$
Запишите в поле ответа номера выбранных веществ.
Задача 6
Из предложенного перечня выберите два вещества, имеющих немолекулярное строение, в которых присутствует ионная связь.
- фосфид натрия
- хлорбензол
- кварц
- ацетальдегид
- медный купорос
З…
Задача 7
Из предложенного перечня выберите два вещества, имеющих немолекулярное строение, в которых присутствует несколько типов химической связи.
- SiO2
- N2O4
- LiOH
- KCl
- CH3ONa
Запишите в пол…
Задача 8
Из предложенного перечня выберите два соединения, в которых присутствует донорно-акцепторная связь.
- $NaHSO_4$
- $H_2SO_4$
- $PH_4Br$
- $NH_3$
- $NaAl(OH)_4$
Запишите в поле ответа номера выбранных…
Задача 9
Из предложенного перечня выберите два вещества, которые имеют молекулярное строение.
- этилацетат
- фенолят натрия
- поташ
- кремниевая кислота
- хлорная кислота
Запишите в поле ответа ном…
Задача 10
Из предложенного перечня выберите два соединения, в которых присутствует только ковалентная полярная связь.
- $KCNS$
- $NaСN$
- $H_2$
- $HI$
- $CS_2$
Запишите в поле ответа номера выбранных соединен…
Задача 11
Из предложенного перечня выберите два вещества, которые имеют молекулярное строение.
- $СH_3COONH_4$
- $СH_3ONa$
- $С_2H_5COONa$
- $СH_3COH$
- $СH_3OCH_3$
Запишите в поле ответа номера выбранных вещ…
Задача 12
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная связь.
- аммиак
- метан
- йод
- вода
- алмаз
Запишите в поле ответа номера выбранных соедине…
Задача 13
Из предложенного перечня выберите два вещества, которые имеют атомную кристаллическую решётку.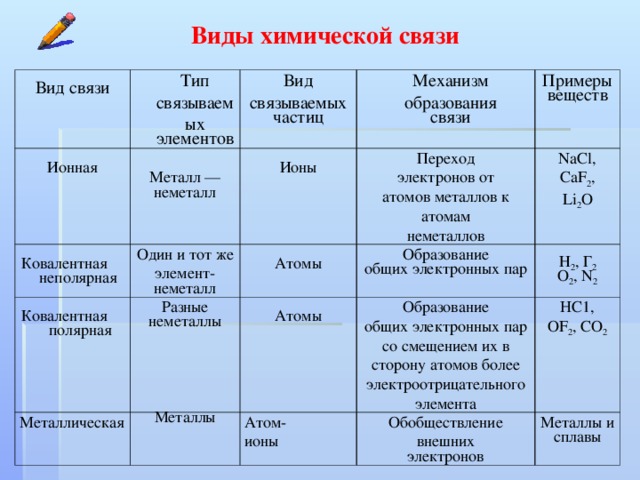
- H2O
- SiC
- NH4Cl
- C (графит)
- C (фуллерен)
Запишите в поле ответа номера выбранных вещес…
Задача 14
Из предложенного перечня выберите два вещества, которые имеют молекулярное строение.
- хлорид кальция
- нитрат калия
- хлороводород
- метанол
- этилат натрия
Запишите в поле ответа номера …
Задача 15
Из предложенного перечня выберите два вещества, имеющих немолекулярное строение, в молекулах которых присутствует ионная связь.
- $H_2NCH_2COOH$
- $SiO_2$
- $H_2O$
- $Ca(HCO_3)_2$
- $HBr$
Запишите в…
Из предложенного перечня выберите два вещества, которые имеют немолекулярное строение.
- фуллерен
- поваренная соль
- HBr
- NaOH
- C2H6
Запишите в поле ответа номера выбранных веществ.
Задача 17
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная связь.
- пероксид водорода
- формиат свинца
- теллуроводород
- сульфат калия
- фуллерен
Запи…
Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку.
- $NH_4Cl$
- $CO_2$
- $K_2SO_4$
- $Mg(NО_3)_2$
- $H_2S$
Запишите в поле ответа номера выбранных ве…
Задача 19
Из предложенного перечня выберите два вещества, которые имеют молекулярное строение.
- $O_3$
- $Mg(NO_3)_2$
- $K_2CO_3$
- $H_2Se$
- $NaNO_2$
Запишите в поле ответа номера выбранных веществ.
Задача 20
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
- $Fe_2(SO_4)_3$
- $HCN$
- $SO_2$
- $K_2O$
- $C_3H_7OH$
Запишите в поле ответа номера выбранных соед…
1 2 3 4 5 … 6
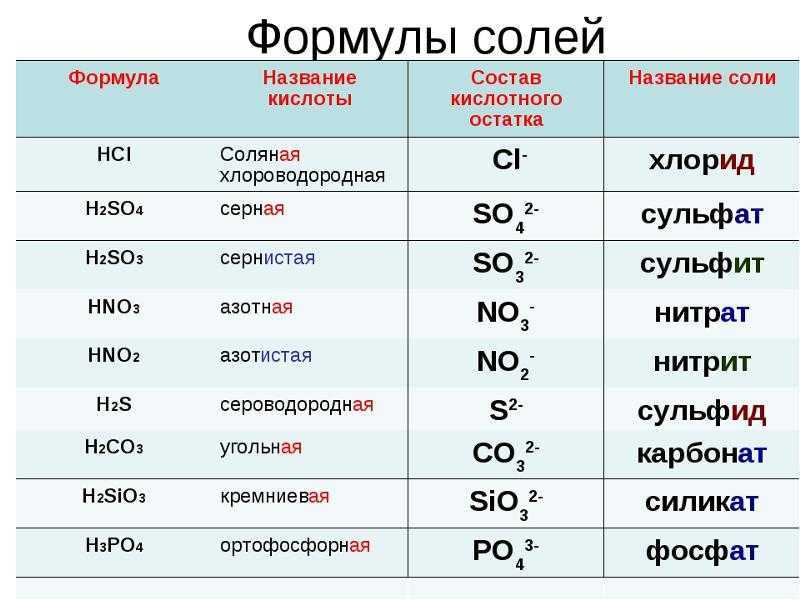
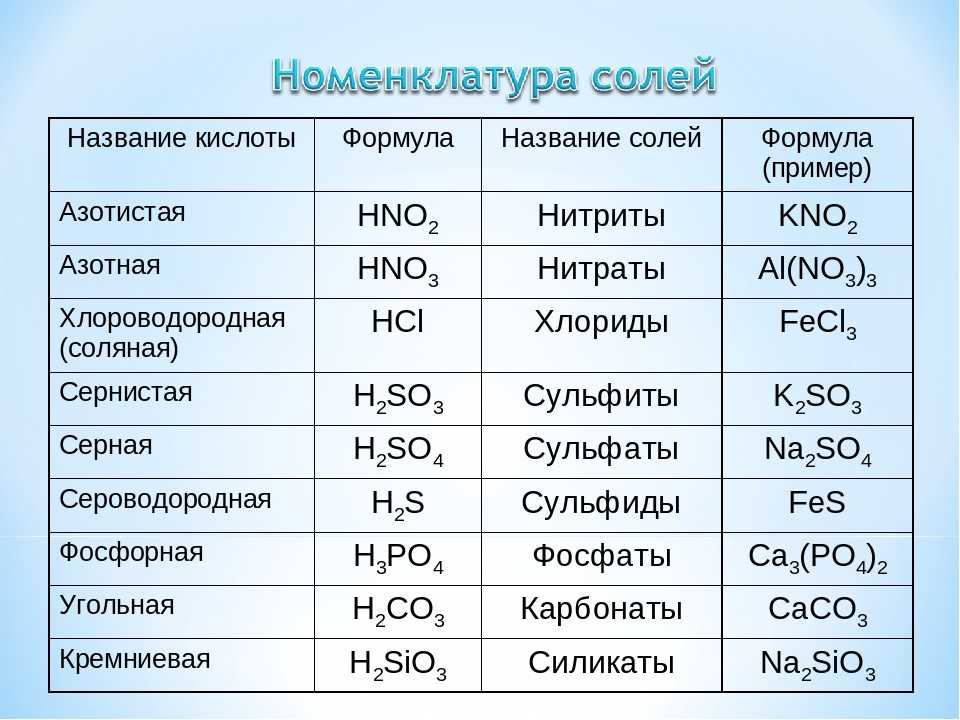
Тема задания 4 ЕГЭ по химии — характеристики химических связей, зависимость свойств веществ от их состава и строения. Это учебный материал средней школы, потому при подготовке к экзамену не забудьте пролистать и учебники по химии за 8-9 класс, а если в вашем учебном заведении такая дисциплина изучалась с седьмого класса, то добавьте в программу подготовки еще и материалы за 7 класс.
Строение всех вариантов задания № 4 ЕГЭ по химии одинаково. Вам будет предложен ряд некоторых данных. Это могут быть химические элементы или соединения, выраженные словами или в виде формулы, а также виды химических связей (ковалентная полярная/неполярная, металлическая, ионная, водородная). Химические элементы и соединения могут быть приведены в задании по одному или парами, к примеру, водород и хлор, вода и алмаз, некоторые варианты задания имеют в условии перечисление трех позиций, например, оксид бария, азот, сернистый газ. Задача ученика – ответить на приведенный в тесте вопрос, который может звучать как «Выберете два вещества, молекулы которых полярны» или «Выберите два вещества с одинаковым типом кристаллической решетки».
Задание 4 ЕГЭ по химии относится к одним из самых легких в экзаменационном билете. Справляются ученики с этим вопросов в среднем за 1-2 минуты.
Теория к заданию 4 по химии: Строение вещества
<< Задание 3
Задание 5 >>
Популярные материалы
Составим твой персональный план подготовки к ЕГЭ
Фосфид алюминия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
T3DB: фосфид натрия
| Информация о записи | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 2.0 | ||||||||||||||||||||||||||||||||||||||||||
| Дата создания 9000 6 | 2009-07-02 16:02:15 UTC | ||||||||||||||||||||||||||||||||||||||||||
| Дата обновления | 2014-12 -24 20:25:28 UTC | ||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер | T3D2413 | ||||||||||||||||||||||||||||||||||||||||||
| Идентификация | |||||||||||||||||||||||||||||||||||||||||||
| Общее название | 90 011 Фосфид натрия|||||||||||||||||||||||||||||||||||||||||||
| Класс | Малая молекула | ||||||||||||||||||||||||||||||||||||||||||
| Описание | Фосфид натрия представляет собой фосфид натрия. Он используется в качестве реагента в производстве других химических веществ и в качестве катализатора при образовании полимеров. Фосфиды металлов гидролизуются до фосфина при контакте с водой или желудочной кислотой. Фосфин — бесцветный, легковоспламеняющийся, взрывоопасный и ядовитый газ. (3, 5) | ||||||||||||||||||||||||||||||||||||||||||
| Тип соединения |
| ||||||||||||||||||||||||||||||||||||||||||
| Химическая структура | |||||||||||||||||||||||||||||||||||||||||||
| Синонимы |
| ||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | Na 3 P | 90 007||||||||||||||||||||||||||||||||||||||||||
| Средняя молекулярная масса | 99,943 г/моль | ||||||||||||||||||||||||||||||||||||||||||
| Масса моноизотопа | 99,943 г/моль | ||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | 12058-85-4 | ||||||||||||||||||||||||||||||||||||||||||
| Название IUPAC | Тринатрий фосфан триид | ||||||||||||||||||||||||||||||||||||||||||
| Традиционное название | тринатрийфосфантриид | ||||||||||||||||||||||||||||||||||||||||||
| SMILES | [Na+] . [Na+].[Na+].[P-3] [Na+].[Na+].[P-3] | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор ИнЧИ | ИнЧИ=1S/3Na.P/q3*+1;-3 | ||||||||||||||||||||||||||||||||||||||||||
| Ключ ИнЧИ | ИнЧИ IKey=FHHBFSHDCCEUKM-UHFFFAOYSA -Н | ||||||||||||||||||||||||||||||||||||||||||
| Химическая таксономия | |||||||||||||||||||||||||||||||||||||||||||
| Описание | принадлежит к классу неорганических соединений, известных как разные смешанные металлы/неметаллы. Это неорганические соединения, содержащие атомы как неметаллов, так и металлов, но не принадлежащие к вышеупомянутым классам. | ||||||||||||||||||||||||||||||||||||||||||
| Королевство | Неорганические соединения | ||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Смешанные соединения металлов и неметаллов | ||||||||||||||||||||||||||||||||||||||||||
| Класс | 900 11 Разное смешанное металл/неметаллы|||||||||||||||||||||||||||||||||||||||||||
| Подкласс | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Прямой родитель | Разное смешанный металл/неметаллы | ||||||||||||||||||||||||||||||||||||||||||
| Альтернативные родители 90 006 |
| ||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||
| Молекулярный каркас | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Внешние дескрипторы | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Биологические свойства | |||||||||||||||||||||||||||||||||||||||||||
| Статус | Обнаружено и не определено количественно | ||||||||||||||||||||||||||||||||||||||||||
| Происхождение | Экзогенное | ||||||||||||||||||||||||||||||||||||||||||
| Расположение клеток |
| ||||||||||||||||||||||||||||||||||||||||||
| Расположение биожидкостей | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Расположение тканей | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Проводящие пути | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Приложения | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Биологические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Химические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||
| Состояние | Твердое тело | ||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | Черный сплошной. | ||||||||||||||||||||||||||||||||||||||||||
| Экспериментальные свойства |
| ||||||||||||||||||||||||||||||||||||||||||
| Прогнозируемые свойства |
| ||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||
| Spectra | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||
| Профиль токсичности | |||||||||||||||||||||||||||||||||||||||||||
| Путь воздействия | Пероральный (4) ; ингаляция (4) | ||||||||||||||||||||||||||||||||||||||||||
| Механизм токсичности | Фосфин ингибирует цитохром с-оксидазу, предотвращая митохондриальное окислительное фосфорилирование. Это неконкурентное ингибирование препятствует клеточному дыханию и приводит к полиорганной дисфункции. Фосфин также может реагировать с перекисью водорода с образованием высокореакционноспособного гидроксильного радикала, который может вызывать перекисное окисление липидов. (1, 2) Это неконкурентное ингибирование препятствует клеточному дыханию и приводит к полиорганной дисфункции. Фосфин также может реагировать с перекисью водорода с образованием высокореакционноспособного гидроксильного радикала, который может вызывать перекисное окисление липидов. (1, 2) | ||||||||||||||||||||||||||||||||||||||||||
| Метаболизм | Фосфин и фосфиды металлов могут всасываться при приеме внутрь или вдыхании, а затем распределяться в нервной системе, печени и почках. В организме фосфиды металлов гидролизуются до фосфина, а фосфин окисляется до гипофосфита и фосфита. Метаболиты выводятся с мочой, а неизмененный фосфин выделяется с выдохом. (4) | ||||||||||||||||||||||||||||||||||||||||||
| Значения токсичности | Нет данных | ||||||||||||||||||||||||||||||||||||||||||
| Смертельная доза | Нет данных | ||||||||||||||||||||||||||||||||||||||||||
| Канцерогенность (классификация IARC) 90 006 | Нет признаков канцерогенности для человека (не входит в список IARC). | ||||||||||||||||||||||||||||||||||||||||||
| Использование/Источники | Фосфид натрия используется в качестве реагента в производстве других химических веществ и в качестве катализатора при образовании полимеров. (5) (5) | ||||||||||||||||||||||||||||||||||||||||||
| Минимальный уровень риска | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||
| Воздействие на здоровье | Вдыхание фосфина может вызвать серьезное раздражение легких, ведущее к острому отеку легких, сердечно-сосудистой дисфункции, возбуждению ЦНС, коме и смерти. Также могут возникать желудочно-кишечные расстройства, поражение почек и лейкопения. Хроническое воздействие фосфина может привести к анемии, бронхиту, желудочно-кишечным расстройствам, проблемам со зрением, речью и моторикой. (3, 4) | ||||||||||||||||||||||||||||||||||||||||||
| Симптомы | Ранние симптомы острой интоксикации фосфином включают боль в диафрагме, тошноту, рвоту, возбуждение и запах фосфора при дыхании. Более высокие уровни могут вызвать слабость, бронхит, отек легких, одышку, судороги и смерть. Некоторые эффекты, такие как отек легких, судороги и повреждение печени, могут проявляться или сохраняться через несколько дней после воздействия. Проглатывание фосфидов металлов приводит к выделению фосфина в желудке, что может вызвать тошноту, рвоту, боль в животе и диарею. (3) (3) | ||||||||||||||||||||||||||||||||||||||||||
| Лечение | Поскольку противоядия от отравления фосфином не существует, лечение в основном симптоматическое. Может потребоваться искусственное дыхание, промывание желудка и/или прием активированного угля. (4) | ||||||||||||||||||||||||||||||||||||||||||
| Нормальные концентрации | |||||||||||||||||||||||||||||||||||||||||||
| Недоступно | |||||||||||||||||||||||||||||||||||||||||||
| Аномальные концентрации | |||||||||||||||||||||||||||||||||||||||||||
| Недоступно | |||||||||||||||||||||||||||||||||||||||||||
| Внешние ссылки | |||||||||||||||||||||||||||||||||||||||||||
| Идентификатор DrugBank | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор HMDB | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор соединения PubChem | 61547 | ||||||||||||||||||||||||||||||||||||||||||
| CHEMBL ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | 55463 | ||||||||||||||||||||||||||||||||||||||||||
| KEGG ID | недоступен | ||||||||||||||||||||||||||||||||||||||||||
| Uniprot ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| OMIM ID | |||||||||||||||||||||||||||||||||||||||||||
| CHEBI ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| CTD ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| St зуд ID | Фосфид натрия | ||||||||||||||||||||||||||||||||||||||||||
| PDB ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| ACToR ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Ссылка на Википедию | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Ссылки | |||||||||||||||||||||||||||||||||||||||||||
| Синтез Справочник | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||
| MSDS | T3D2413. pdf pdf | ||||||||||||||||||||||||||||||||||||||||||
| Общие ссылки |
| ||||||||||||||||||||||||||||||||||||||||||
| Генная регуляция | |||||||||||||||||||||||||||||||||||||||||||
| Гены с повышенной регуляцией | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Недоступно | |||||||||||||||||||||||||||||||||||||||||||
Сведения о мишени
1. Субъединица цитохром с оксидазы 1
Субъединица цитохром с оксидазы 1
- Общая функция:
- Связывание ионов железа
- Конкретная функция:
- Цитохром с-оксидаза является компонентом дыхательной цепи, катализирующим восстановление кислорода до воды. Субъединицы 1-3 образуют функциональное ядро ферментного комплекса. СО I является каталитической субъединицей фермента. Электроны, исходящие от цитохрома с, переносятся через медный центр А субъединицы 2 и гем А субъединицы 1 на биметаллический центр, образованный гемом А3 и медью В.
- Имя гена:
- MT-CO1
- Идентификатор Uniprot:
- P00395
- Молекулярный вес:
- 57040.91 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл K: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
2. Субъединица цитохром с-оксидазы 2
Субъединица цитохром с-оксидазы 2
- Общая функция:
- Активность цитохром-с-оксидазы
- Специфическая функция:
- Цитохром-с-оксидаза является компонентом дыхательной цепи, катализирующим восстановление кислорода до воды. Субъединицы 1-3 образуют функциональное ядро ферментного комплекса. Субъединица 2 переносит электроны от цитохрома с через свой биядерный центр меди А к биметаллическому центру каталитической субъединицы 1.0741 P00403
- Молекулярный вес:
- 25564,73 Da
- Singh S, Bhalla A, Verma SK, Ka ur A, Gill K: Ингибирование цитохром-c-оксидазы у 26 пациентов, отравленных фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
3. Субъединица цитохром-с-оксидазы 3
- Общая функция:
- Цитохром-с-оксидазная активность
- Конкретная функция:
- Субъединицы I, II и III образуют функциональное ядро ферментного комплекса.

- Имя гена:
- MT-CO3
- Идентификатор Uniprot:
- P00414
- Молекулярный вес:
- 29950,6 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл K: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
4. Субъединица 4 цитохром-с-оксидазы, изоформа 1, митохондриальная
- Общая функция:
- Активность цитохром-с-оксидазы 90 742
- Специфическая функция:
- Этот белок является одним из ядерно-кодируемых полипептидные цепи цитохром-с-оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX4I1
- Uniprot ID:
- P13073
- Молекулярная масса:
- 19576,6 Da
- Singh S, Bhalla A, Verma SK, Kaur A, Gill K: Ингибирование цитохром-c оксидазы в 26 алюминий pho пациентов с отравлением сфидом.
Клин Токсикол (Фила). 2006;44(2):155-8. 5. Субъединица 4 цитохром с-оксидазы, изоформа 2, митохондриальная Цитохром-с оксидазная активность
- Специфическая функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей цитохром-с-оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX4I2
- ID Uniprot:
- Q96KJ9
- Молекулярный вес:
- 20010.02 Da
90 760 Ссылки
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
6. Субъединица 5А цитохром-с-оксидазы, митохондриальная
Ссылки
- Общие функции:
- Связывание ионов металлов
- Специфическая функция:
- Это гем А-содержащая цепь цитохром с оксидазы, терминальная оксидаза в митохондриальном транспорте электронов.
- Имя гена:
- COX5A
- ID Uniprot:
- P20674
- Молекулярный вес:
- 16761,985 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К. Ингибирование цитохром-с-оксидазы у 26 пациентов, отравленных фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671]
Детали мишени
7. Субъединица 5B цитохром-с-оксидазы, митохондриальная
9076 0 Ссылки
- Общая функция:
- Связывание ионов металлов
- Специфическая функция:
- Этот белок является одним из ядерно-кодируемых полипептидов. цепи цитохром с оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX5B
- Идентификатор Uniprot:
- P10606
- Молекулярный вес:
- 13695,57 Da
- Сингх С.
, Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Сведения о мишени
8. Субъединица цитохром с-оксидазы 6A1, митохондриальная
907 60 Ссылки
- Общая функция:
- Активность цитохром-с-оксидазы
- Специфическая функция:
- Этот белок является одной из кодируемых ядром полипептидных цепей цитохром-с-оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX6A1
- Идентификатор Uniprot:
- P12074
- Молекулярный вес:
- 12154,8 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
9.
Субъединица 6А2 цитохром-с-оксидазы, митохондриальная
Ссылки
- Общая функция:
- Активность цитохром-с-оксидазы
- Специфическая функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей. цитохром с оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX6A2
- ID в Uniprot:
- Q02221
- Молекулярный вес:
- 10815.32 Da
- Singh S, Bhalla A, Verma SK, Kaur A, Gill K: Ингибирование цитохром-c оксидазы при отравлении 26 фосфидом алюминия пациенты. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
10. Субъединица цитохром-с-оксидазы 6B1
90 760 Ссылки
- Общая функция:
- Цитохром-с-оксидазная активность
- Конкретная функция:
- Соединяет два мономера ЦОГ в физиологическую димерную форму.
.
- Имя гена:
- COX6B1
- Идентификатор Uniprot:
- P14854
- Молекулярный вес:
- 10192.345 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Сведения о мишени
11. Субъединица цитохром-с-оксидазы 6B2
9 0760 Ссылки
- Общее назначение:
- Активность цитохром-с-оксидазы
- Специфическое назначение:
- Соединяет два мономера ЦОГ в физиологическую димерную форму.
- Имя гена:
- COX6B2
- ID в Uniprot:
- Q6YFQ2
- Молекулярный вес:
- 10528,905 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия.
Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
12. Субъединица цитохром-с-оксидазы 6C
Ссылки
- Общая функция:
- Цитохром-с-оксидазная активность
- Специфическая Функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей цитохрома. c-оксидаза, терминальная оксидаза в митохондриальном транспорте электронов.
- Название гена:
- COX6C
- ID в Uniprot:
- P09669
- Молекулярный вес:
- 8781.36 Da
- Singh S, Bhalla A, Verma SK, Kaur A, Gill K: Ингибирование цитохром-c оксидазы у 26 пациентов, отравленных фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
активность хром-с-оксидазы
- Специфическая функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей цитохром-с-оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX7A1
- Идентификатор Uniprot:
- P24310
- Молекулярный вес:
- 9117,44 Da
907 60 Ссылки
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
14. Субъединица 7А2 цитохром-с-оксидазы, митохондриальная
Ссылки
- Общая функция:
- Активность цитохром-с-оксидазы 9074 2
- Специфическая функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей. цитохром с оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX7A2
- ID Uniprot:
- P14406
- Молекулярный вес:
- 9395.89 Da
- Singh S, Bhalla A, Verma SK, Kaur A, Gill K: Ингибирование цитохром-c-оксидазы у 26 пациентов, отравленных фосфидом алюминия .
Клин Токсикол (Фила). 2006;44(2):155-8. [16615671]
Детали мишени
15. Субъединица 7B цитохром-с-оксидазы, митохондриальная
907 60 Ссылки
- Общая функция:
- Цитохром -c оксидазная активность
- Конкретная функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей цитохром-с-оксидазы, терминальной оксидазы в митохондриальном транспорте электронов. Играет роль в правильном развитии центральной нервной системы (ЦНС) у позвоночных.
- Имя гена:
- COX7B
- Идентификатор Uniprot:
- P24311
- Молекулярный вес:
- 9160,485 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
16.
Субъединица 7B2 цитохром-с-оксидазы, митохондриальная
Ссылки
- Общая функция:
- Активность цитохром-с-оксидазы 9074 2
- Специфическая функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей. цитохром с оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX7B2
- ID в Uniprot:
- Q8TF08
- Молекулярный вес:
- 9077.43 Da
- Singh S, Bhalla A, Verma SK, Kaur A, Gill K: Ингибирование цитохром-c-оксидазы у 26 пациентов, отравленных фосфидом алюминия . Клин Токсикол (Фила). 2006;44(2):155-8. [16615671]
Детали мишени
17. Субъединица 7C цитохром-с-оксидазы, митохондриальная
9076 0 Ссылки
- Общая функция:
- Цитохром -c оксидазная активность
- Конкретная функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей цитохром-с-оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX7C
- Идентификатор Uniprot:
- P15954
- Молекулярный вес:
- 7245,45 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
18. Субъединица 8А цитохром-с-оксидазы, митохондриальная
Ссылки
- Общая функция:
- Активность цитохром-с-оксидазы
- Специфическая функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей. цитохром с оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX8A
- Идентификатор Uniprot:
- P10176
- Молекулярный вес:
- 7579.0 DA
- Singh S, Bhalla A, Verma SK, Kaur A, Gill K: Ингирование цитохром-C оксидазы у 26 алюмилированных Posossed Poonsed.
Клин Токсикол (Фила). 2006;44(2):155-8. [16615671]
Детали мишени
19. Субъединица 8C цитохром-с-оксидазы, митохондриальная
907 60 Ссылки
- Общая функция:
- Цитохром -c оксидазная активность
- Конкретная функция:
- Этот белок является одной из ядерно-кодируемых полипептидных цепей цитохром-с-оксидазы, терминальной оксидазы в митохондриальном транспорте электронов.
- Имя гена:
- COX8C
- Идентификатор Uniprot:
- Q7Z4L0
- Молекулярный вес:
- 8128,575 Da
- Сингх С., Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Детали мишени
20. Предполагаемая субъединица цитохром-с-оксидазы 7A3, митохондриальная
Ссылки
- Общая функция:
- Активность цитохром-с-оксидазы 907 42
- Конкретная функция:
- Недоступно
- Имя гена:
- COX7A2P2
- Uniprot ID:
- O60397
- Молекулярный вес:
- 11840,715 Da
9 0700- Сингх С.
, Бхалла А., Верма С.К., Каур А., Гилл К. Ингибирование цитохром-с-оксидазы в алюминии 26 пациентов с отравлением фосфидами. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Фосфат натрия – формула, структура, виды и применение
Дата последнего обновления: 24 апреля 2023 г. 0732 Просмотров сегодня: 3.80k
Фосфат натрия является ионным соединение, состоящее из катиона натрия и аниона фосфата. Это соль, встречающаяся как в гидратированных, так и в безводных солях, среди которых в природе чаще встречается безводный (безводный) фосфат натрия. Химическая формула фосфата натрия: Na 3 9.0101 PO 4 и имеет молекулярную массу 163,94 г/моль. Помимо монофосфата натрия, в природе встречаются дифосфат натрия, трифосфат, тетрафосфат и полифосфаты. Поскольку это ионное соединение, оно образует кристаллические структуры. Он выглядит как белые или не совсем белые кристаллы, гранулы или, возможно, в виде порошка. Его плотность составляет 2,536 г/куб. см. Его температура кипения 373 К, как у воды, а температура плавления 1856 К.
см. Его температура кипения 373 К, как у воды, а температура плавления 1856 К.
Структура фосфата натрия
Фосфат натрия представляет собой ионное соединение и поэтому имеет электровалентную химическую структуру. Сам анион фосфата имеет ковалентную структуру. Атомы натрия имеют в общей сложности 11 электронов, один из которых находится на внешней оболочке, поскольку натрий является щелочным металлом. Натрий легко вытесняет крайний электрон с образованием катиона натрия. Три На + и один PO 4 3- притягиваются друг к другу с помощью электростатической силы притяжения, и образуется молекула фосфата натрия.
Различные типы фосфатов натрия
Хотя тринатриймонофосфат (Na 3 PO 4 ) встречается гораздо чаще, кроме этого, встречаются многие виды фосфатов натрия. Это динатрийфосфат или динатрийгидрофосфат, мононатрийфосфат или дигидрофосфат натрия, динатрийпирофосфат и тетранатрийпирофосфат, которые имеют молекулярную формулу Na 2 HPO 4 , NaH 2 PO 4 , Na 2 H 2 P 2 O 7 90 101 и Na 4 P 2 O 7 соответственно.
Тринатрийфосфат получают в лаборатории простой реакцией гидроксида натрия или едкого натра с фосфорной кислотой. Три молекулы гидроксида натрия нейтрализуют трехосновной ортофосфорной кислотой (H 3 PO 4 ) с получением соли тринатрийфосфата и воды.
H 3 PO 4 + 3NaOH → Na 3 PO 4 + 3H 2 O
Динатрийфосфат промышленно получают действием дикальцийфосфата на гидросульфате натрия. Пирофосфат натрия получают термическим разложением монофосфата натрия.
Использование фосфата натрия в промышленности
Наиболее распространенный фосфат натрия, монофосфат натрия, в основном используется в качестве моющих средств, мыла и удобрений. Он действует как консервант при переработке продуктов животного происхождения. Тринатрийфосфат, наряду с динатрийфосфатом и мононатрием, используется в основном в качестве пищевых добавок. Они используются в качестве эмульгаторов в плавленых сырах в молочной промышленности.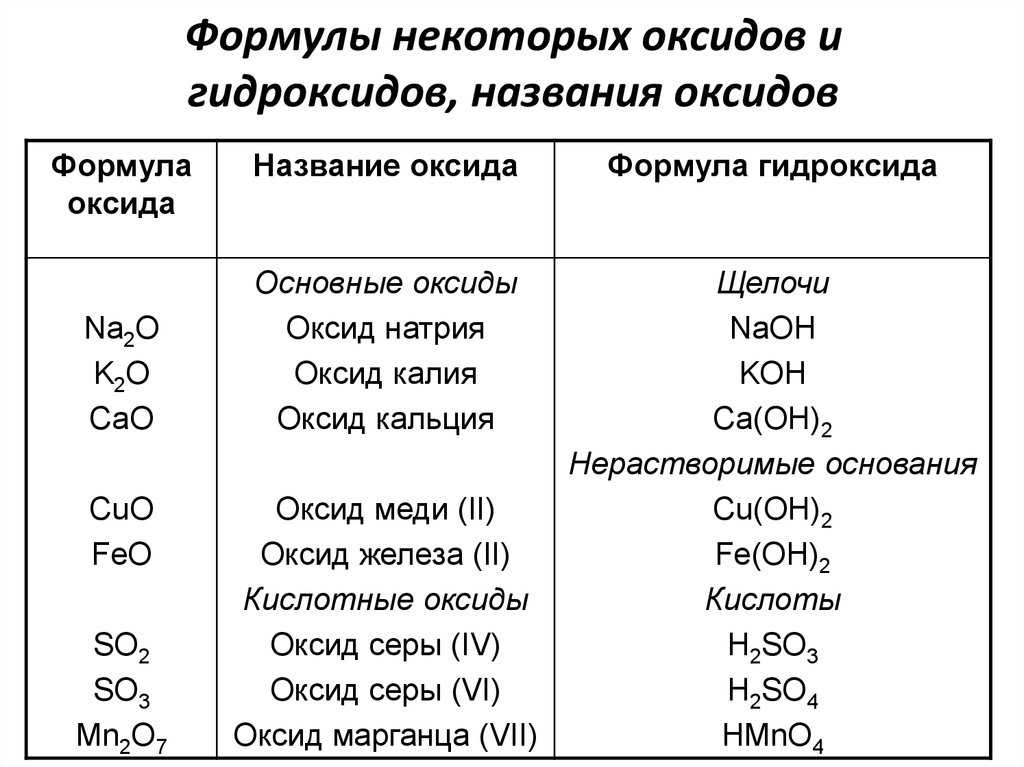 Он также используется в качестве загустителя в хлебопекарной промышленности. Пирофосфат динатрия используется в качестве буфера. Кроме того, его используют при обработке консервированных морепродуктов для сохранения их вкуса и цвета. Он также используется в кожевенной промышленности для удаления пятен со шкур. Пирофосфат тетранатрия также используется при переработке консервов в качестве пищевой добавки и консерванта. Пирофосфат тетранатрия обладает уникальным свойством удалять магний из слюны, что может уменьшить накопление зубных бляшек и кариеса. Таким образом, это соединение уникально используется среди фосфатов в зубной пасте.
Он также используется в качестве загустителя в хлебопекарной промышленности. Пирофосфат динатрия используется в качестве буфера. Кроме того, его используют при обработке консервированных морепродуктов для сохранения их вкуса и цвета. Он также используется в кожевенной промышленности для удаления пятен со шкур. Пирофосфат тетранатрия также используется при переработке консервов в качестве пищевой добавки и консерванта. Пирофосфат тетранатрия обладает уникальным свойством удалять магний из слюны, что может уменьшить накопление зубных бляшек и кариеса. Таким образом, это соединение уникально используется среди фосфатов в зубной пасте.
Неблагоприятные последствия использования фосфатов в промышленности
Фосфаты в основном ответственны за эвтрофикацию воды. Это процесс, при котором водоемы получают избыток фосфатов, которые стимулируют усиленный рост водорослей, называемый цветением водорослей. В конечном итоге это приводит к разложению водорослей, в результате чего содержание кислорода в воде снижается. Фосфаты, используемые в качестве моющих средств и мыла, в основном ответственны за эвтрофикацию, поскольку они смываются и смешиваются в прудах, реках или озерах. По этой причине использование фосфатов в качестве моющих средств или удобрений становится ограниченным.
Фосфаты, используемые в качестве моющих средств и мыла, в основном ответственны за эвтрофикацию, поскольку они смываются и смешиваются в прудах, реках или озерах. По этой причине использование фосфатов в качестве моющих средств или удобрений становится ограниченным.
Медицинское использование фосфатов
Иногда фосфаты используются при приготовлении лекарств от запоров, используемых для опорожнения кишечника, но использование фосфатов в медицине небезопасно. Фосфаты могут увеличить риск проблем с почками в случае применения высоких доз. Этот симптом обозначается в медицинской терминологии как фосфатная нефропатия. Так что их использование в больших дозах совсем не безопасно.
Триполифосфат натрия
Полифосфат натрия имеет молекулярную формулу Na 5 Р 3 О 10 . Он имеет молекулярную массу 367,86 г/моль. Его получают путем нагревания смеси дигидрофосфата натрия и гидрофосфата динатрия. Эти два вещества конденсируются, удаляют воду и производят триполифосфат натрия.
Эти два вещества конденсируются, удаляют воду и производят триполифосфат натрия.
Знаете ли вы?
Фосфат натрия в основном производится из фосфоритов шахты.
Регулярное и длительное употребление фосфата натрия становится вредным для здоровья.
Хотя FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) считает фосфат натрия безопасным в обработанных пищевых продуктах, где он используется в качестве консервантов, пациентам с заболеваниями почек следует избегать продуктов, содержащих фосфат натрия.
Потребление больших доз фосфата натрия вызывает снижение плотности костей, проблемы с почками, болезни сердца и даже раннюю смерть.
При употреблении фосфата натрия в смеси с другими фосфатами это способствует обогащению организма фосфором.



 Клин Токсикол (Фила). 2006;44(2):155-8. 5. Субъединица 4 цитохром с-оксидазы, изоформа 2, митохондриальная Цитохром-с оксидазная активность
Клин Токсикол (Фила). 2006;44(2):155-8. 5. Субъединица 4 цитохром с-оксидазы, изоформа 2, митохондриальная Цитохром-с оксидазная активность
 , Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
, Бхалла А., Верма С.К., Каур А., Гилл К.: Ингибирование цитохром-с-оксидазы у 26 пациентов с отравлением фосфидом алюминия. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ] Субъединица 6А2 цитохром-с-оксидазы, митохондриальная
Субъединица 6А2 цитохром-с-оксидазы, митохондриальная  .
. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
 Клин Токсикол (Фила). 2006;44(2):155-8. [16615671]
Клин Токсикол (Фила). 2006;44(2):155-8. [16615671] Субъединица 7B2 цитохром-с-оксидазы, митохондриальная
Субъединица 7B2 цитохром-с-оксидазы, митохондриальная 
 Клин Токсикол (Фила). 2006;44(2):155-8. [16615671]
Клин Токсикол (Фила). 2006;44(2):155-8. [16615671] , Бхалла А., Верма С.К., Каур А., Гилл К. Ингибирование цитохром-с-оксидазы в алюминии 26 пациентов с отравлением фосфидами. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
, Бхалла А., Верма С.К., Каур А., Гилл К. Ингибирование цитохром-с-оксидазы в алюминии 26 пациентов с отравлением фосфидами. Клин Токсикол (Фила). 2006;44(2):155-8. [16615671 ]
Leave A Comment