Белки — химический состав, структура, общая формула
Поможем понять и полюбить химию
Начать учиться
Белки — основной строительный материал клеток, они составляют 15–20% общей массы человека. Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Что такое белок. Химический состав и образование белков
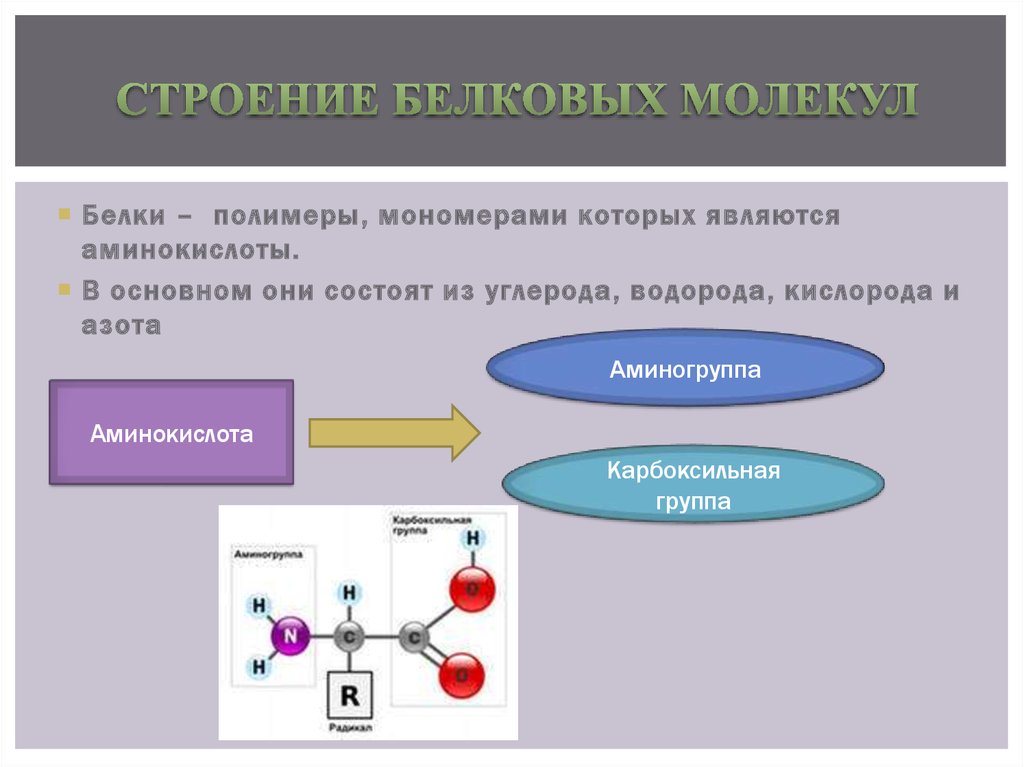
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом.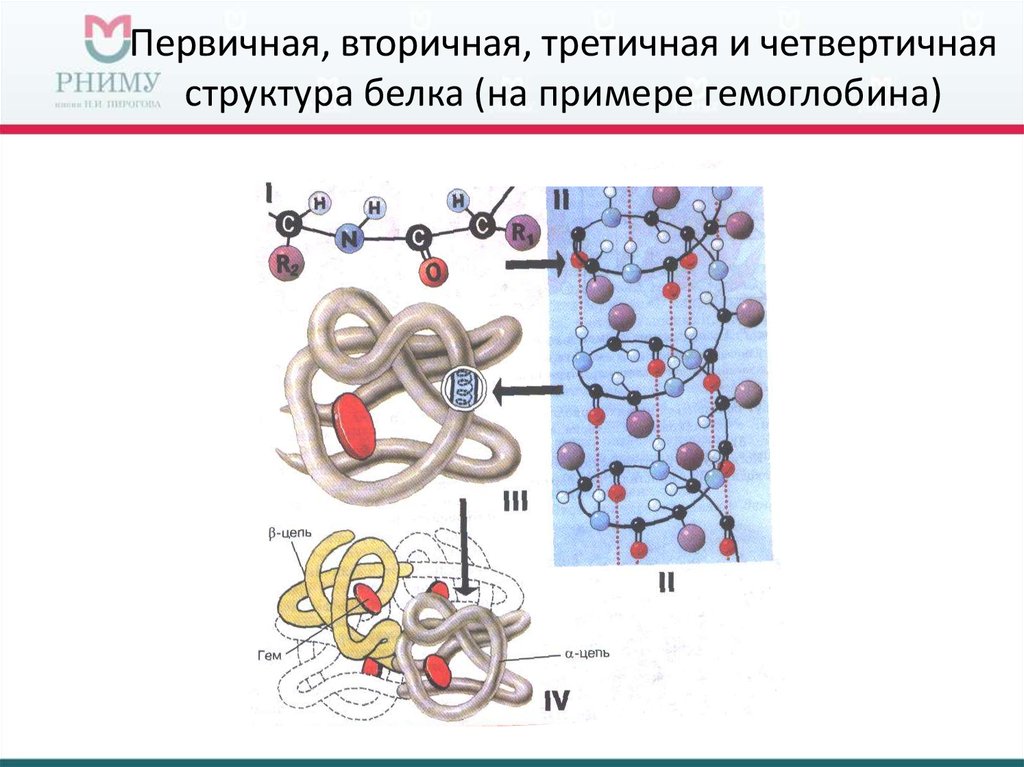 Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.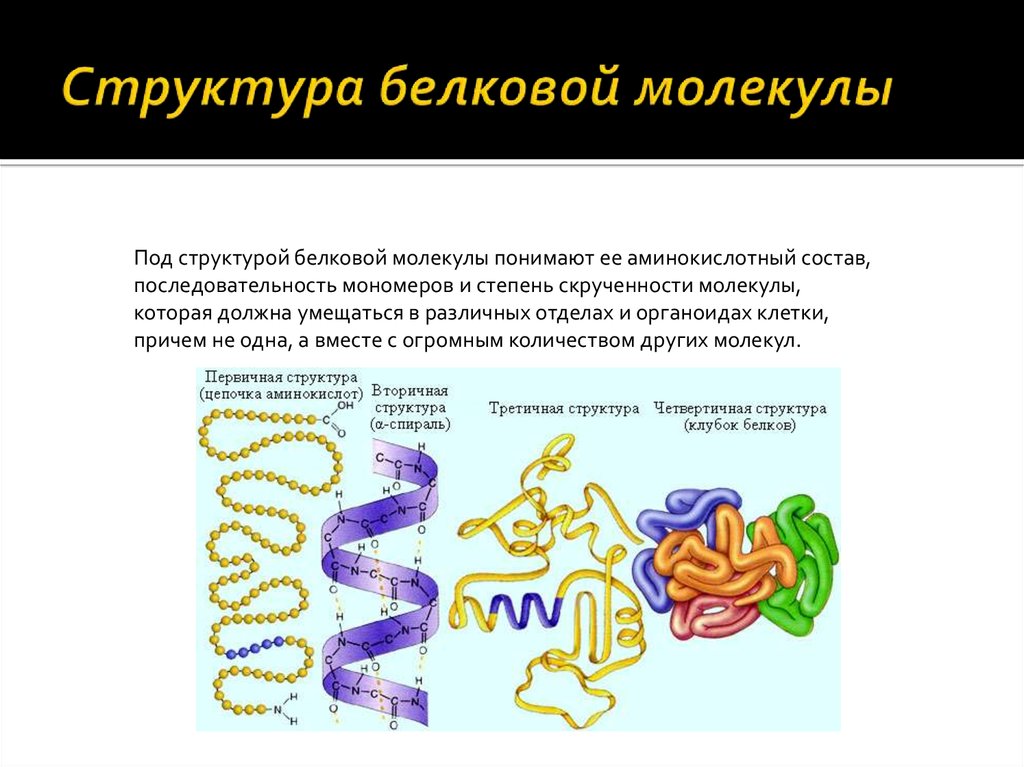
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты
| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
аспартат используется для процессов регенерации;
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях.

тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
Основные различия — это структура и размер.
 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
сложные белки
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
форма молекулы глобулярных белков — глобула (сфера или эллипс).
 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.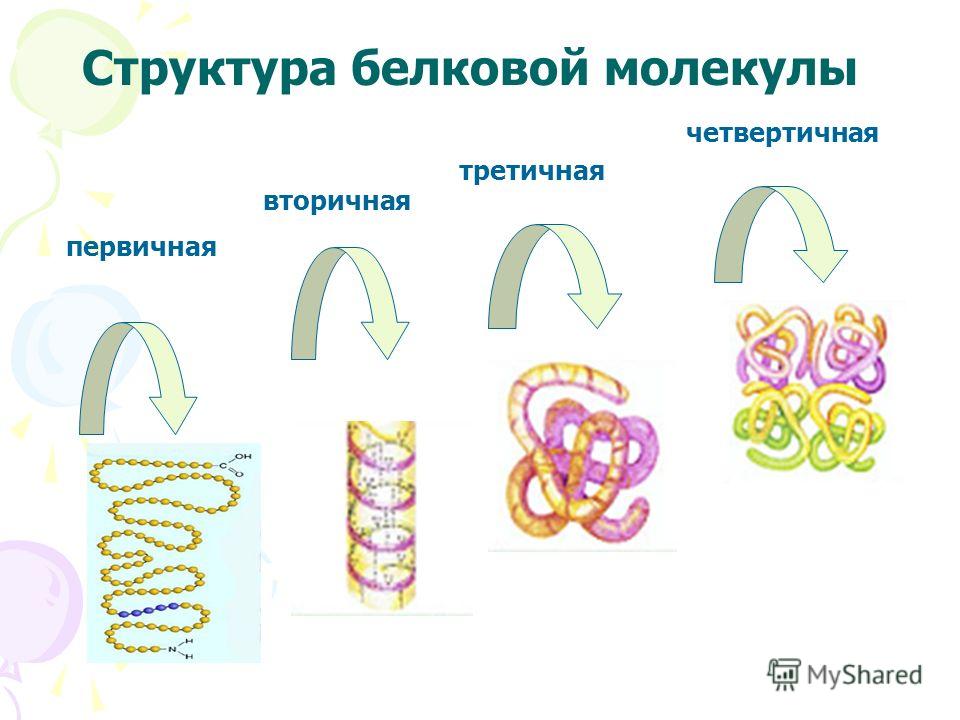
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
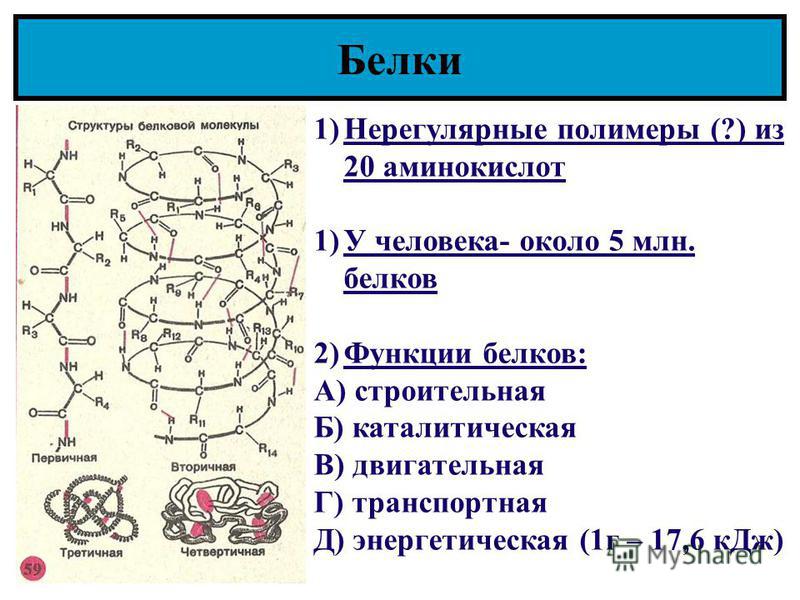
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок.

Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
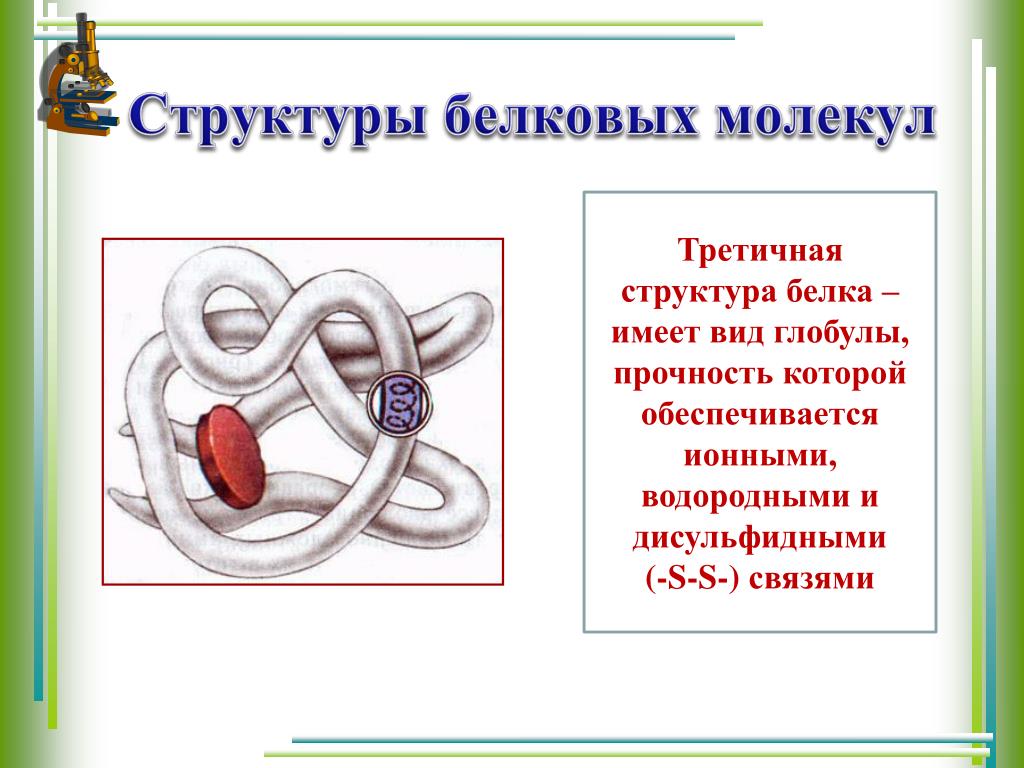
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи.
 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Ксения Боброва
К предыдущей статье
Тепловой эффект
К следующей статье
Моносахариды
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Минеральные вещества | Tervisliku toitumise informatsioon
В человеческом организме установлено наличие более 70 химических элементов.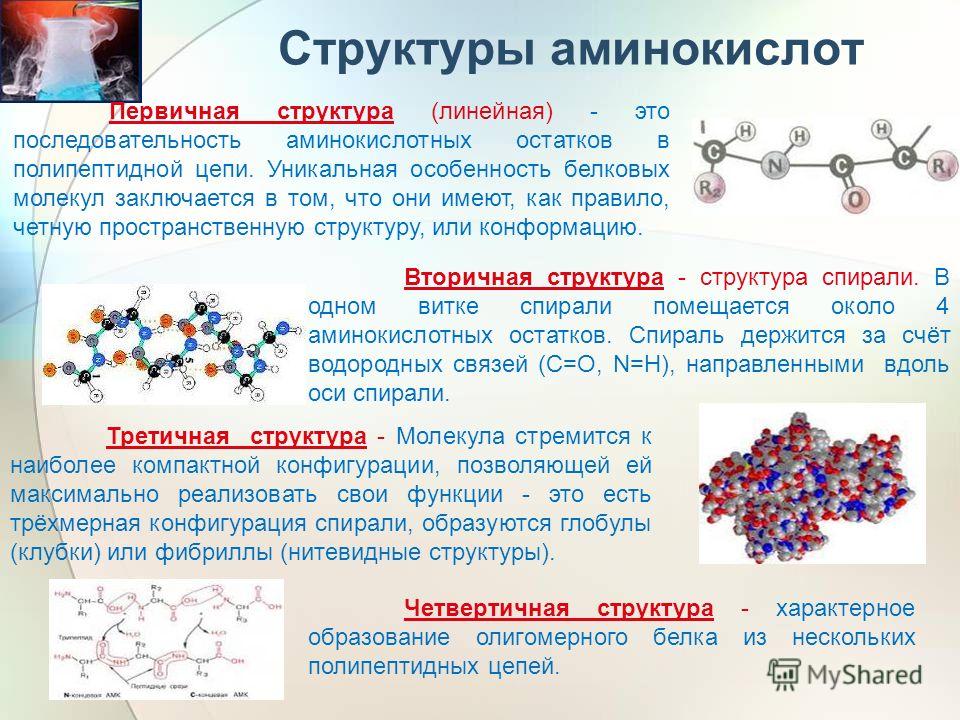 Достоверно установлена потребность в более чем 20 биоэлементах. Для обеспечения достаточного количества этих элементов крайне важно, чтобы питание было разнообразным.
Достоверно установлена потребность в более чем 20 биоэлементах. Для обеспечения достаточного количества этих элементов крайне важно, чтобы питание было разнообразным.
Встречающиеся в организме минеральные вещества можно условно разделить на две группы:
- Содержание макроэлементов в организме составляет более 0,01%. Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).
- Содержание микроэлементов – менее 0,01%, у некоторых даже 0,00001.
Потребность в некоторых микроэлементах установлена, это железо (Fe), цинк (Zn), медь (Cu), йод (I), селен (Se) , марганец (Mn), молибден (Mo), фтор (F), хром (Cr), кобальт (Co), кремний (Si), ванадий (V), бор (B), никель (Ni), мышьяк (As) и олово (Sn).
Помимо них в организме обнаружен целый ряд элементов, функция которых пока не ясна, их появление в организме может быть обусловлено загрязнением окружающей среды и частым соприкосновением с ними.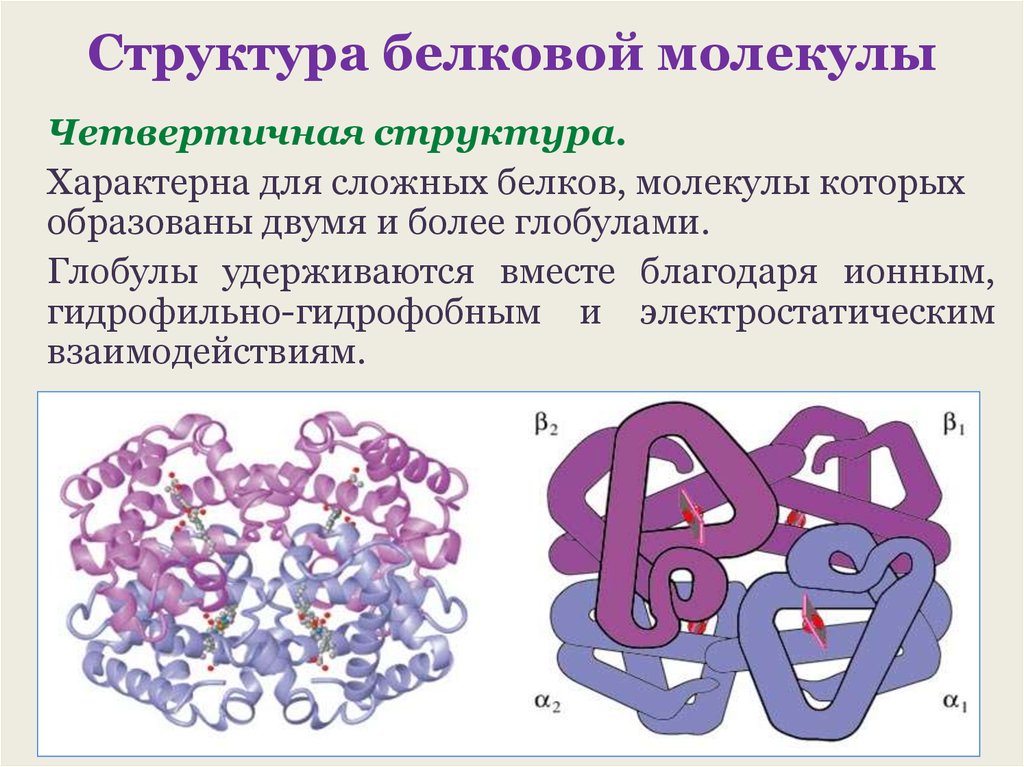 Например, люди, работающие в теплицах, постоянно контактируют с химическими веществами, различные элементы могут быть признаком разного рода заболеваний. В числе таких элементов алюминий (Al), стронций (Sr), барий (Ba), рубидий (Rb), палладий (Pd), бром (Br).
Например, люди, работающие в теплицах, постоянно контактируют с химическими веществами, различные элементы могут быть признаком разного рода заболеваний. В числе таких элементов алюминий (Al), стронций (Sr), барий (Ba), рубидий (Rb), палладий (Pd), бром (Br).
В организм могут попадать и тяжелые, т.е. ядовитые металлы, такие как кадмий (Cd), ртуть (Hg) или свинец (Pb).
Минеральные вещества в нашем организме являются важными компонентами скелета, биологических жидкостей и энзимов и способствуют передаче нервных импульсов.
Люди и животные получают различные биологические элементы из пищи, воды и окружающего воздуха, самостоятельно синтезировать минеральные вещества живые организмы не могут. В растениях минеральные вещества накапливаются из почвы, и их количество зависит от места произрастания и наличия удобрений. В питьевой воде также имеются минеральные вещества, и их содержание зависит от места, откуда получают воду.
Несмотря на то, что человек нуждается в небольших количествах минеральных веществ (макроэлементов в миллиграммах и граммах, микроэлементов – в милли- и микрограммах), в его организме, тем не менее, отсутствуют достаточные запасы минеральных веществ, чтобы нормально перенести их долговременный дефицит. Потребность в минеральных веществах зависит также от возраста, пола и прочих обстоятельств (см Таблица 2). Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Потребность в минеральных веществах зависит также от возраста, пола и прочих обстоятельств (см Таблица 2). Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Чрезмерные количества минеральных веществ могут привести к сбоям в работе организма, потому что, будучи компонентами биоактивных соединений, они оказывают влияние на регуляторные функции. Получать чрезмерные количества минеральных веществ (за исключением натрия) с пищей практически невозможно, однако это может произойти при чрезмерном употреблении биологически активных добавок и обогащенных минеральными веществами продуктов.
Усвоению минеральных веществ могут препятствовать:
- злоупотребление кофе,
- употребление алкоголя,
- курение,
- некоторые лекарства,
- некоторые противозачаточные таблетки,
- определенные вещества, встречающиеся в некоторых продуктах, например, в ревене и шпинате.

Потери минеральных веществ при тепловой обработке продуктов питания значительно меньше, чем потери витаминов. Однако при рафинировании или очистке часть минеральных веществ удаляется. Поэтому важно есть больше цельнозерновых и нерафинированных продуктов. Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Таблица 1
Названия и источники важнейших минеральных веществ
Обозначение | Название | Лучшие источники * |
Макроэлементы | ||
Na | натрий | поваренная соль (NaCl), готовая еда, сыр, ржаной хлеб, консервы, мясные продукты, оливки, картофельные чипсы |
K | калий | растительные продукты: сушеные фрукты и ягоды, орехи, семена, топинамбур, картофель, редис, капуста, зеленые овощи, мука «Кама», свёкла, банан, ржаной хлеб, смородина, томаты |
Ca | кальций | молоко и молочные продукты (особенно сыр), миндаль, орехи, семена, рыба (с костями), шпинат |
Mg | магний | орехи, семена, мука «Кама», ржаной хлеб, шпинат, бобовые, греча, цельнозерновые продукты, свинина, говядина и курятина, банан, брокколи |
P | фосфор | семена, орехи, молочные продукты (особенно сыр), печень, птица, говядина, ржаной хлеб, рыба, цельнозерновые продукты, бобовые |
S | сера | продукты с белками, содержащими аминокислоты метионин (зерновые, орехи) и цистеин (мясо, рыба, соевые бобы, зерновые) |
Cl | хлор | поваренная соль |
Микроэлементы | ||
Fe | железо | печень, кровяная колбаса, семечки, яйца, изюм, ржаной хлеб, нежирная говядина и свинина, цельнозерновые продукты, греча, клубника |
Zn | цинк | печень, мясо, мука «Кама», семена, орехи, сыр, ржаной хлеб, бобовые, дары моря (крабы, салака), цельнозерновые продукты, яйца |
Cu | медь | печень, какао-порошок, мясо, бобовые, цельнозерновые продукты, семена, орехи, греча, ржаной хлеб, лосось, авокадо, свёкла, дары моря |
I | йод | йодированная соль, рыба и другие дары моря, сыр, яйца, некоторые виды ржаного хлеба и йогурта |
Se | селен | арахис, печень, рыба и дары моря, семена подсолнечника, мясо |
* Количество, содержащееся в 100 г продукта, покрывает не менее 10% суточной потребности взрослой женщины
Таблица 2
Рекомендуемые в зависимости от возраста суточные нормы потребления важнейших минеральных веществ
Возраст | Натрий, мг | Кальций, мг | Калий, г | Магний, мг | Железо, мг | Цинк, мг | Медь, мг | Йод, мкг | Селен, мкг |
Дети |
|
|
|
|
|
|
|
|
|
6–11 месяцев | до 650 | 550 | 1,1 | 80 | 8 | 5 | 0,3 | 60 | 15 |
12–23 месяца | до 830 | 600 | 1,4 | 85 | 8 | 6 | 0,3 | 90 | 25 |
2–5 лет | до 1580 | 600 | 1,8 | 120 | 8 | 6 | 0,4 | 90 | 30 |
6–9 лет | до 1580 | 700 | 2 | 200 | 9 | 7 | 0,5 | 120 | 30 |
Женщины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 2,9 | 300 | 11 | 8 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
18–30 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
31–60 лет | до 2400 | 800 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
61–74 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
> 75 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
Беременные | до 2400 | 900 | 3,1 | 360 | 15 | 10 | 1 | 175 | 60 |
Кормящие матери | до 2400 | 900 | 3,1 | 360 | 15 | 11 | 1,3 | 200 | 60 |
Мужчины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 3,3 | 300 | 11 | 11 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,5 | 380 | 11 | 12 | 0,9 | 150 | 60 |
18–30 лет | до 2400 | 900 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
31–60 лет | до 2400 | 800 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
61–74 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
> 75 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
* Для 18–20-летних рекомендуемая суточная доза составляет 900 мг кальция и 700 мг фосфора.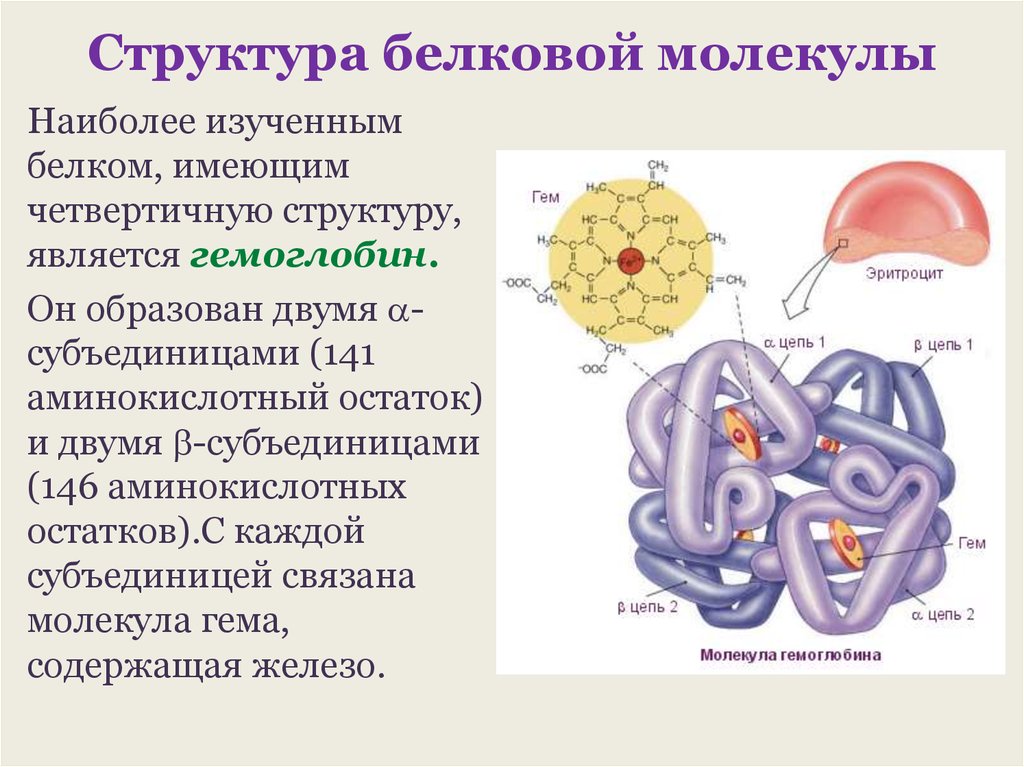
** Потребность в железе зависит от потери железа при менструациях. Для женщин в постменопаузе рекомендуемая дневная доза железа составляет 10 мг.
*** Для достижения сбалансированного содержания железа во время беременности в организме женщины должны иметься запасы железа как минимум на 500 мг больше, чем до беременности. В двух последних триместрах беременности, в зависимости от уровня железа в организме, может потребоваться дополнительный прием железа.
**** На самом деле, селена можно потреблять больше указанной в таблице рекомендованной дозы, поскольку селен по-разному всасывается из разных источников и происходит постоянное обеднение им поверхности, т.е. таблицы питательной ценности продуктов «не поспевают» за истинным положением дел (в них зачастую указываются значения больше реальных).
Максимальные разовые безопасные дозы минеральных веществ и пищевых добавок:
| Минеральное вещество | Доза |
|---|---|
| Кальций (мг) | 2500 |
| Фосфор (мг) | 3000 |
| Калий (мг) | 3,7* |
| Железо (мг) | 60 |
| Цинк (мг) | 25 |
| Медь (мг) | 5 |
| Йод (мкг) | 600 |
| Селен (мкг) | 300 |
* Только из биоактивных добавок или обогащенной пищи
Белок | Определение, структура и классификация
синтез белка
Посмотреть все СМИ
- Ключевые люди:
- Джон Б.
 Фенн
Ричард Хендерсон
Тасуку Хондзё
Джордж П. Смит
Уильям Г. Кэлин-младший
Фенн
Ричард Хендерсон
Тасуку Хондзё
Джордж П. Смит
Уильям Г. Кэлин-младший
- Похожие темы:
- фермент интерферон транскрипционный фактор прион фосфорилирование белка
- Выдающиеся лауреаты:
- Родни Роберт Портер
Просмотреть весь связанный контент →
Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для последующего использования у животных. Когда животное потребляет избыточное количество белков, они превращаются в жиры (глюкозу или триглицериды) и используются для получения энергии или создания запасов энергии.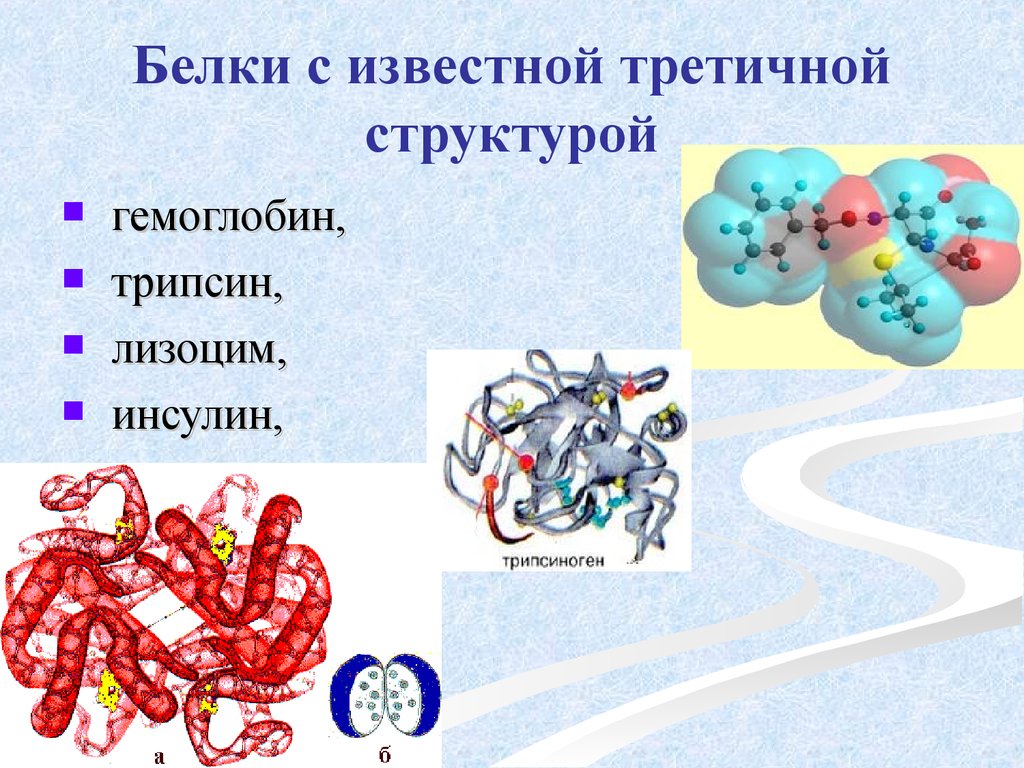 Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной активности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Сводка
Прочтите краткий обзор этой темы
белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую питательную ценность и принимают непосредственное участие в химических процессах, необходимых для жизни.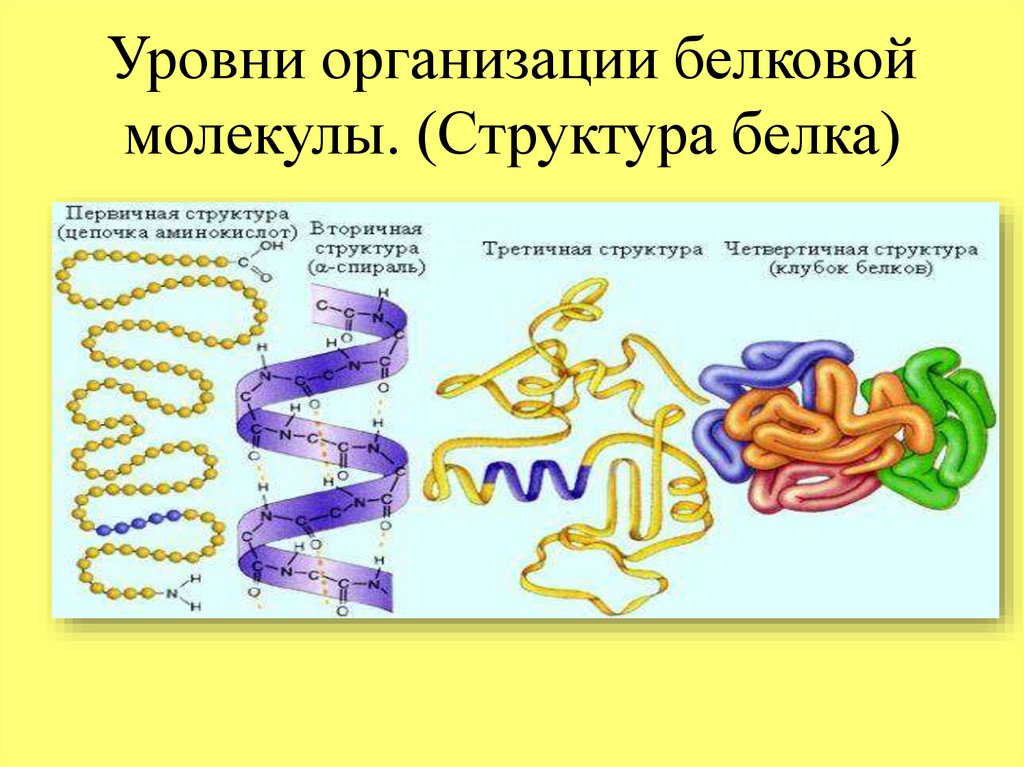 Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных друг с другом в длинные цепи, подобно тому, как бусы расположены на нитке. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка исходя из его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, входящих в состав белков.
Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, таким как жвачные (например, коровы), требуется очень большое количество растительного материала, который питается только растительным материалом для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0057 см. питание человека).
Содержание белка в органах животных обычно намного выше, чем в плазме крови.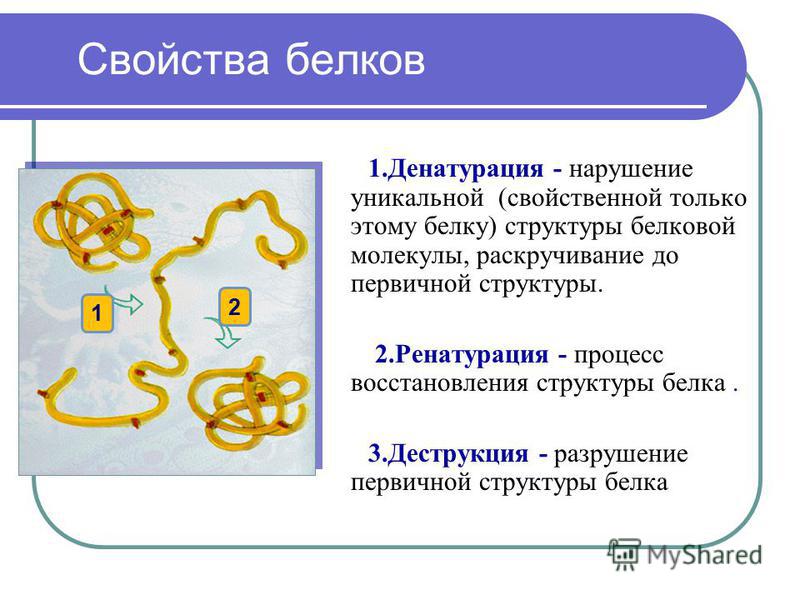 Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Викторина «Британника»
Викторина «Медицинские термины и пионеры»
Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые наиболее важные белки, такие как ферменты и гормоны, встречаются в очень малых количествах. Важность белков связана главным образом с их функцией. Все ферменты, идентифицированные до сих пор, являются белками. Ферменты, являющиеся катализаторами всех метаболических реакций, позволяют организму накапливать необходимые для жизни химические вещества — белки, нуклеиновые кислоты, углеводы и липиды, превращать их в другие вещества и разлагать их.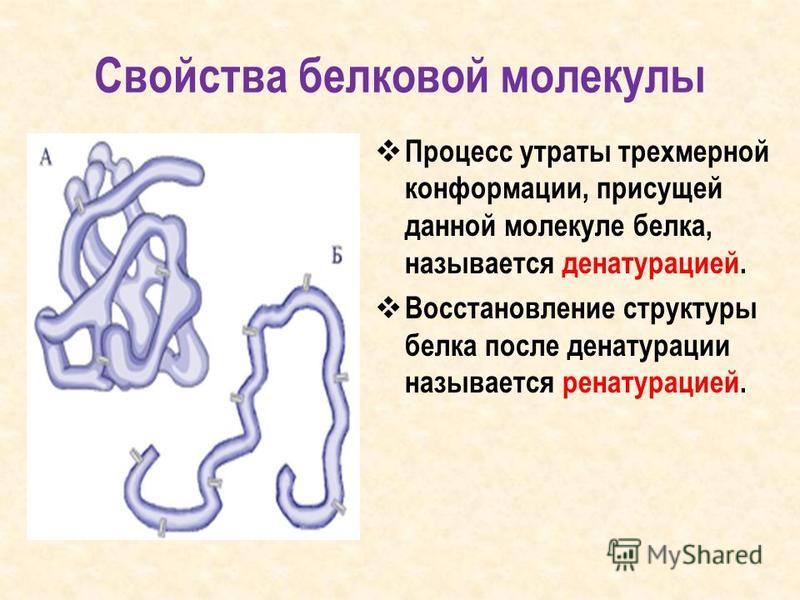 Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Белковая структура: первичная, вторичная, третичная, четвертичная структуры
Загрузить PDF-версию
Разработчики лекарств все чаще обращаются к большим молекулам, особенно белкам, в качестве терапевтического варианта. Составление белкового лекарственного препарата может быть довольно сложной задачей, и без хорошего понимания природы структуры белка и конформационных характеристик конкретного белка результаты могут быть разрушительными. Этот технический обзор призван дать читателю краткий обзор структуры белка. Также будет кратко рассмотрено, как структура белка может быть затронута при составлении рецептуры, и некоторые аналитические методы, которые можно использовать как для определения структуры, так и для анализа стабильности белка.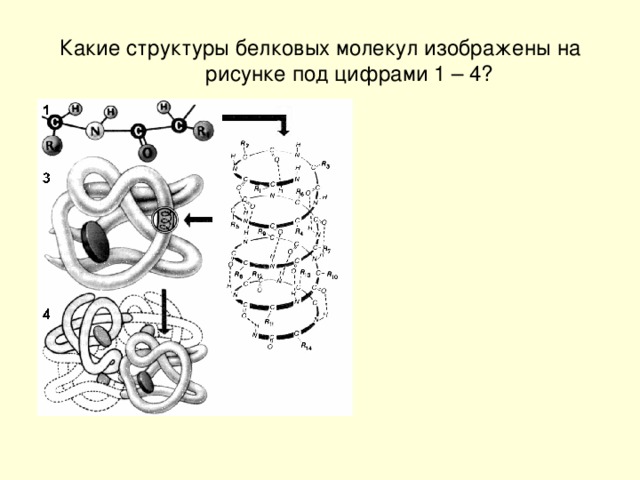
Термин структура, когда он используется в отношении белков, приобретает гораздо более сложное значение, чем для малых молекул. Белки представляют собой макромолекулы и имеют четыре различных уровня строения — первичный, вторичный, третичный и четвертичный.
Первичная структура
Существует 20 различных стандартных L-α-аминокислот, используемых клетками для построения белков. Аминокислоты, как следует из их названия, содержат как основную аминогруппу, так и кислую карбоксильную группу. Эта бифункциональность позволяет отдельным аминокислотам объединяться в длинные цепи, образуя пептидные связи 9.0057 : амидные связи между -NH 2 одной аминокислоты и -COOH другой. Последовательности, содержащие менее 50 аминокислот, обычно называют пептидами, тогда как термины «белок» и «полипептид» используются для более длинных последовательностей. Белок может состоять из одной или нескольких молекул полипептида. Конец пептидной или белковой последовательности со свободной карбоксильной группой называется карбокси-концом или С-концом. Термины амино-конец и N-конец описывают конец последовательности со свободной α-аминогруппой.
Термины амино-конец и N-конец описывают конец последовательности со свободной α-аминогруппой.
Аминокислоты различаются по структуре заместителем в их боковых цепях. Эти боковые цепи придают различные химические, физические и структурные свойства конечному пептиду или белку. Структуры 20 аминокислот, обычно встречающихся в белках, показаны на рисунке 1. Каждая аминокислота имеет как однобуквенное, так и трехбуквенное сокращение. Эти сокращения обычно используются для упрощения письменной последовательности пептида или белка.
В зависимости от заместителя в боковой цепи аминокислота может быть кислой, основной или нейтральной. Хотя для синтеза различных белков, встречающихся в организме человека, требуется 20 аминокислот, мы можем синтезировать только десять. Остальные 10 называются незаменимыми аминокислотами и должны поступать с пищей.
Аминокислотная последовательность белка закодирована в ДНК. Белки синтезируются с помощью ряда стадий, называемых транскрипцией (использование цепи ДНК для создания комплементарной цепи матричной РНК — мРНК) и трансляцией (последовательность мРНК используется в качестве шаблона для направления синтеза цепи аминокислот, составляющих повышайте белок). Часто происходят посттрансляционные модификации, такие как гликозилирование или фосфорилирование, которые необходимы для биологической функции белка. В то время как аминокислотная последовательность составляет первичную структуру белка, химические/биологические свойства белка очень сильно зависят от трехмерной или третичной структуры.
Часто происходят посттрансляционные модификации, такие как гликозилирование или фосфорилирование, которые необходимы для биологической функции белка. В то время как аминокислотная последовательность составляет первичную структуру белка, химические/биологические свойства белка очень сильно зависят от трехмерной или третичной структуры.
Вторичная структура
Участки или нити белков или пептидов имеют отчетливые, характерные локальные структурные конформации или вторичную структуру, зависящую от водородных связей. Двумя основными типами вторичной структуры являются α-спираль и β-лист.
α-спираль представляет собой правозакрученную спираль. Заместители боковой цепи аминокислотных групп в α-спирали простираются наружу. Водородные связи образуются между кислородом каждой связи C=O в цепи и водородом каждой группы NH на четыре аминокислоты ниже ее в спирали. Водородные связи делают эту структуру особенно стабильной. Заместители боковых цепей аминокислот подходят рядом с группами NH.
Водородная связь в ß-листе происходит между нитями (между цепями), а не внутри цепей (внутри цепями). Конформация листа состоит из пар нитей, лежащих бок о бок. Карбонильные атомы кислорода одной цепи связываются с атомами водорода аминогруппы соседней цепи. Две нити могут быть либо параллельными, либо антипараллельными в зависимости от того, являются ли направления нитей (от N-конца к C-концу) одинаковыми или противоположными. Антипараллельный ß-лист более стабилен из-за более хорошо выровненных водородных связей.
Третичная структура
Общая трехмерная форма молекулы белка представляет собой третичную структуру. Белковая молекула будет изгибаться и скручиваться таким образом, чтобы достичь максимальной стабильности или минимального энергетического состояния. Хотя трехмерная форма белка может показаться неправильной и случайной, она создается многими стабилизирующими силами из-за связывающих взаимодействий между группами боковых цепей аминокислот.
В физиологических условиях гидрофобные боковые цепи нейтральных, неполярных аминокислот, таких как фенилаланин или изолейцин, обычно прячутся внутри белковой молекулы, тем самым защищая их от водной среды.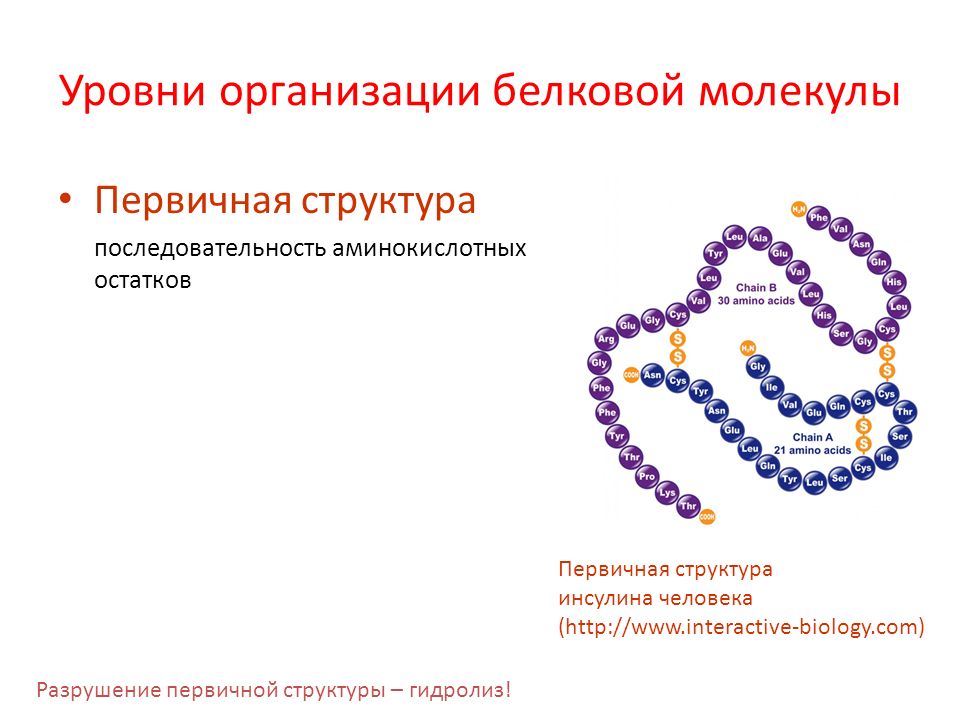 Алкильные группы аланина, валина, лейцина и изолейцина часто образуют гидрофобные взаимодействия друг с другом, в то время как ароматические группы, такие как группы фенилаланина и тирозина, часто складываются вместе. Кислые или основные боковые цепи аминокислот обычно находятся на поверхности белка, поскольку они гидрофильны.
Алкильные группы аланина, валина, лейцина и изолейцина часто образуют гидрофобные взаимодействия друг с другом, в то время как ароматические группы, такие как группы фенилаланина и тирозина, часто складываются вместе. Кислые или основные боковые цепи аминокислот обычно находятся на поверхности белка, поскольку они гидрофильны.
Образование дисульфидных мостиков путем окисления сульфгидрильных групп цистеина является важным аспектом стабилизации третичной структуры белка, позволяющим ковалентно удерживать вместе различные части белковой цепи. Кроме того, водородные связи могут образовываться между различными группами боковой цепи. Как и в случае дисульфидных мостиков , эти водородные связи могут соединять две части цепи, которые находятся на некотором расстоянии друг от друга с точки зрения последовательности. Солевые мостики, ионные взаимодействия между положительно и отрицательно заряженными участками боковых цепей аминокислот, также помогают стабилизировать третичную структуру белка.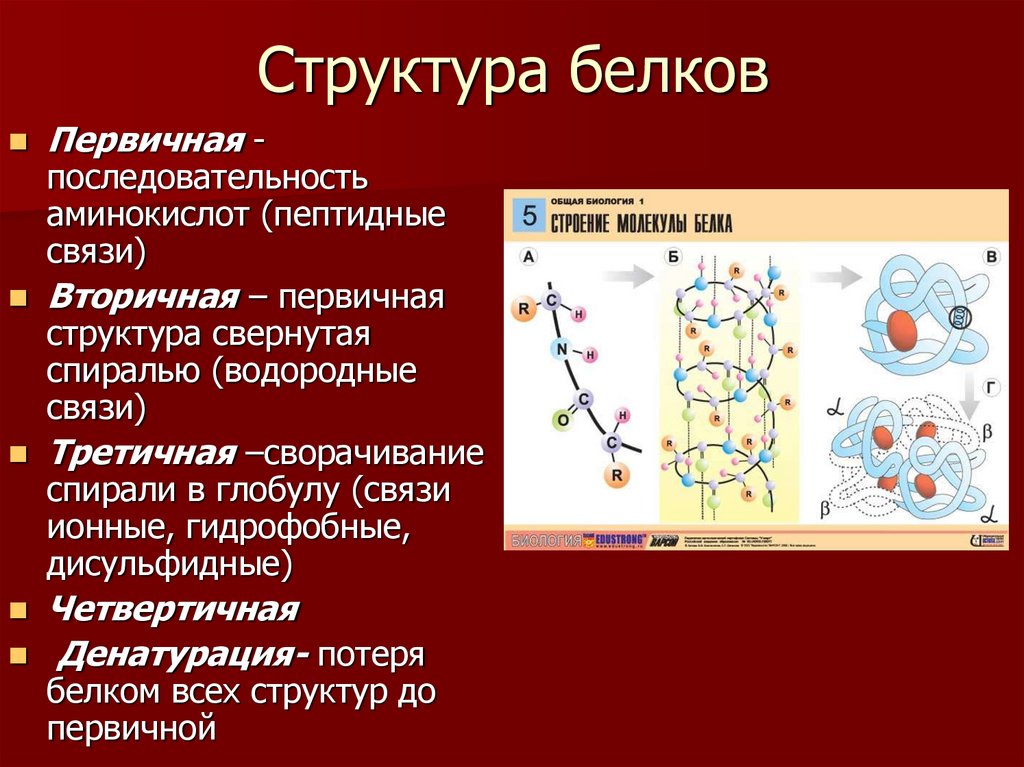
Четвертичная структура
Многие белки состоят из нескольких полипептидных цепей, часто называемых белковыми субъединицами. Эти субъединицы могут быть одинаковыми, как в гомодимере, или разными, как в гетеродимере. Четвертичная структура относится к тому, как эти белковые субъединицы взаимодействуют друг с другом и организуются, образуя более крупный совокупный белковый комплекс. Окончательная форма белкового комплекса снова стабилизируется различными взаимодействиями, включая водородные связи, дисульфидные мостики и солевые мостики. Четыре уровня структуры белка показаны на рисунке 2.9.0125
Стабильность белков
Из-за природы слабых взаимодействий, контролирующих трехмерную структуру, белки являются очень чувствительными молекулами. Термин нативное состояние используется для описания белка в его наиболее стабильной естественной конформации in situ . Это естественное состояние может быть нарушено несколькими внешними факторами стресса, включая температуру, рН, удаление воды, наличие гидрофобных поверхностей, присутствие ионов металлов и высокие сдвиговые усилия.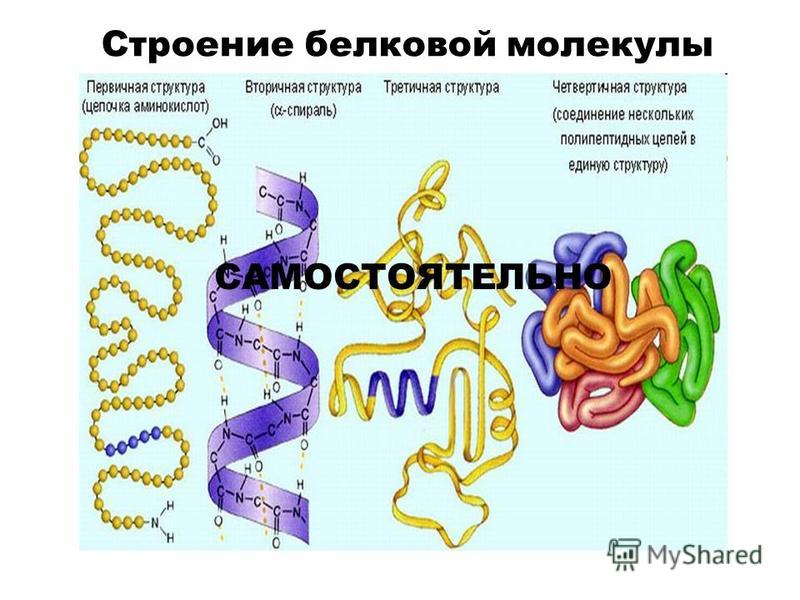 Потеря вторичной, третичной или четвертичной структуры вследствие воздействия стрессового фактора называется денатурацией. Денатурация приводит к разворачиванию белка в случайную или неправильно свернутую форму.
Потеря вторичной, третичной или четвертичной структуры вследствие воздействия стрессового фактора называется денатурацией. Денатурация приводит к разворачиванию белка в случайную или неправильно свернутую форму.
Денатурированный белок может иметь совсем другой профиль активности, чем белок в нативной форме, обычно теряя биологическую функцию. В дополнение к денатурации белки могут также образовывать агрегаты при определенных стрессовых условиях. Агрегаты часто образуются в процессе производства и, как правило, нежелательны, в основном из-за того, что они могут вызывать неблагоприятные иммунные реакции при введении.
В дополнение к этим физическим формам деградации белка также важно знать о возможных путях химической деградации белка. К ним относятся окисление, дезамидирование, гидролиз пептидных связей, перетасовка дисульфидных связей и сшивание. Методы, используемые при обработке и приготовлении белков, включая любую стадию лиофилизации, должны быть тщательно изучены, чтобы предотвратить деградацию и повысить стабильность белкового биофармацевтического препарата как при хранении, так и во время доставки лекарственного средства.
Анализ структуры белка
Сложность структуры белка делает определение полной структуры белка чрезвычайно трудным даже с использованием самого современного аналитического оборудования. Аминокислотный анализатор можно использовать для определения присутствующих аминокислот и молярных соотношений каждой из них. Затем последовательность белка можно проанализировать с помощью пептидного картирования и использования деградации по Эдману или масс-спектроскопии. Этот процесс является обычным для пептидов и небольших белков, но становится более сложным для больших мультимерных белков.
Пептидное картирование обычно включает обработку белка различными ферментами протеазами для расщепления последовательности на более мелкие пептиды в определенных местах расщепления. Двумя широко используемыми ферментами являются трипсин и химотрипсин. Масс-спектроскопия стала бесценным инструментом для анализа белков, расщепленных ферментами, с помощью методов снятия отпечатков пальцев пептидов и поиска в базе данных.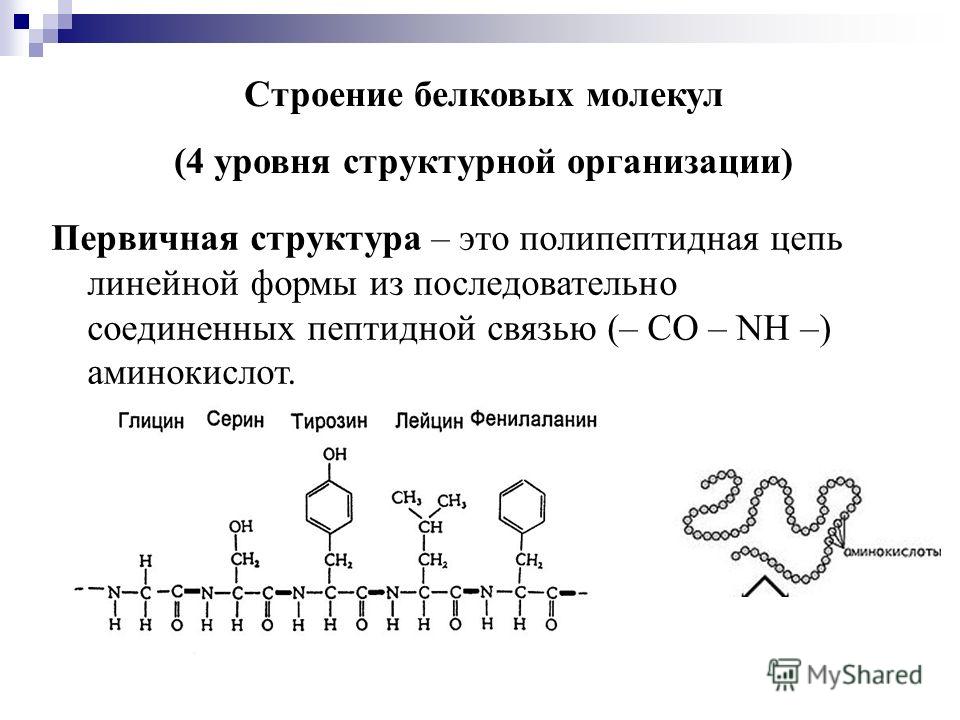 Деградация по Эдману включает расщепление, разделение и идентификацию одной аминокислоты за один раз из короткого пептида, начиная с N-конца.
Деградация по Эдману включает расщепление, разделение и идентификацию одной аминокислоты за один раз из короткого пептида, начиная с N-конца.
Одним из методов, используемых для характеристики вторичной структуры белка, является спектроскопия кругового дихроизма (КД). Различные типы вторичной структуры, α-спираль, ß-лист и случайный клубок, имеют характерные спектры кругового дихроизма в дальней УФ-области спектра (190–250 нм). Эти спектры можно использовать для аппроксимации доли всего белка, состоящего из каждого типа структуры.
Более полный анализ трехмерной структуры белка с высоким разрешением проводится с помощью рентгеноструктурного анализа или ядерно-магнитного резонанса (ЯМР). Для определения трехмерной структуры белка с помощью рентгеновской дифракции требуется большой, хорошо упорядоченный монокристалл. Рентгеновская дифракция позволяет измерять короткие расстояния между атомами и дает трехмерную карту электронной плотности, которую можно использовать для построения модели структуры белка.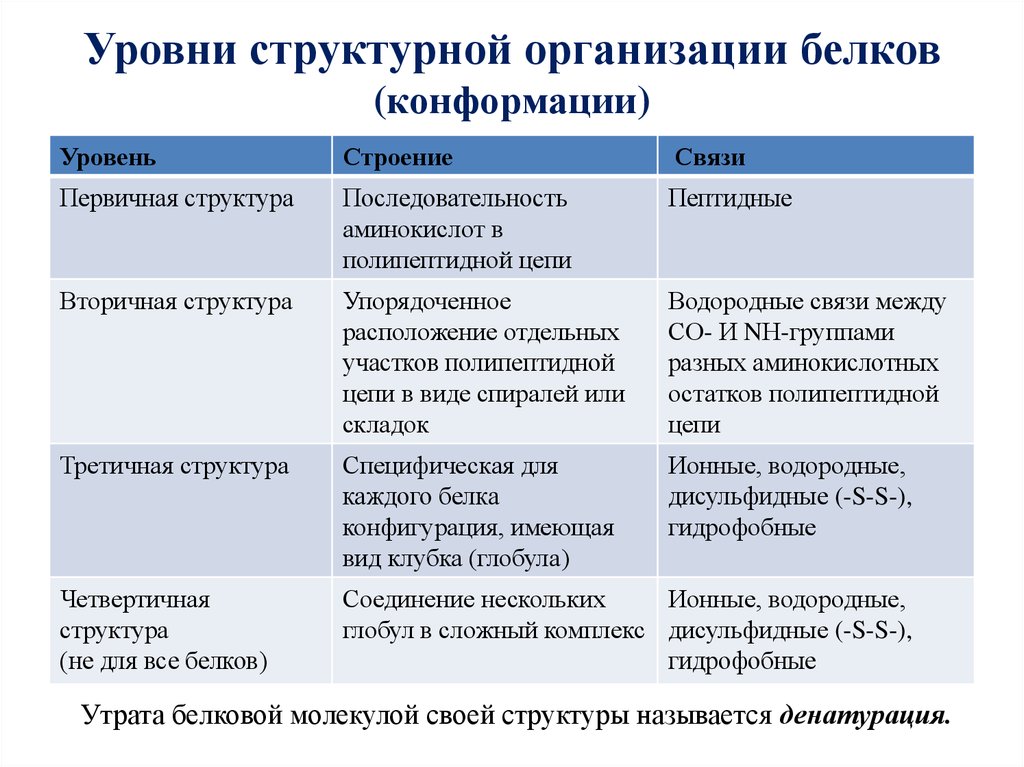
Использование ЯМР для определения трехмерной структуры белка имеет некоторые преимущества по сравнению с дифракцией рентгеновских лучей, поскольку его можно проводить в растворе, и, таким образом, белок свободен от ограничений кристаллической решетки. Обычно используются методы двумерного ЯМР: NOESY, который измеряет расстояния между атомами в пространстве, и COESY, который измеряет расстояния по связям.
Анализ стабильности структуры белка
Для определения стабильности белка можно использовать множество различных методов. Для анализа разворачивания белка можно использовать спектроскопические методы, такие как флуоресценция, УФ, инфракрасное излучение и КД. Термодинамические методы, такие как дифференциальная сканирующая калориметрия (ДСК), могут быть полезны для определения влияния температуры на стабильность белка. Сравнительное картирование пептидов (обычно с использованием ЖХ/МС) является чрезвычайно ценным инструментом для определения химических изменений в белке, таких как окисление или дезамидирование.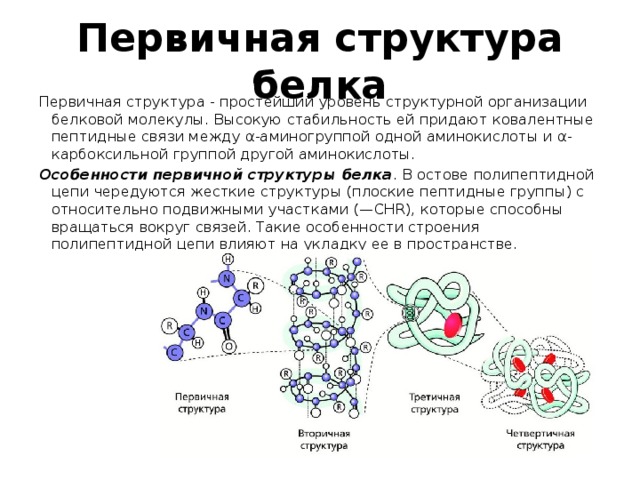

 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.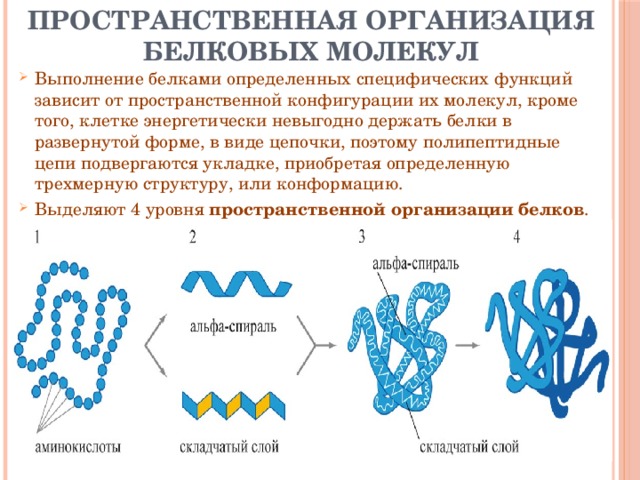 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.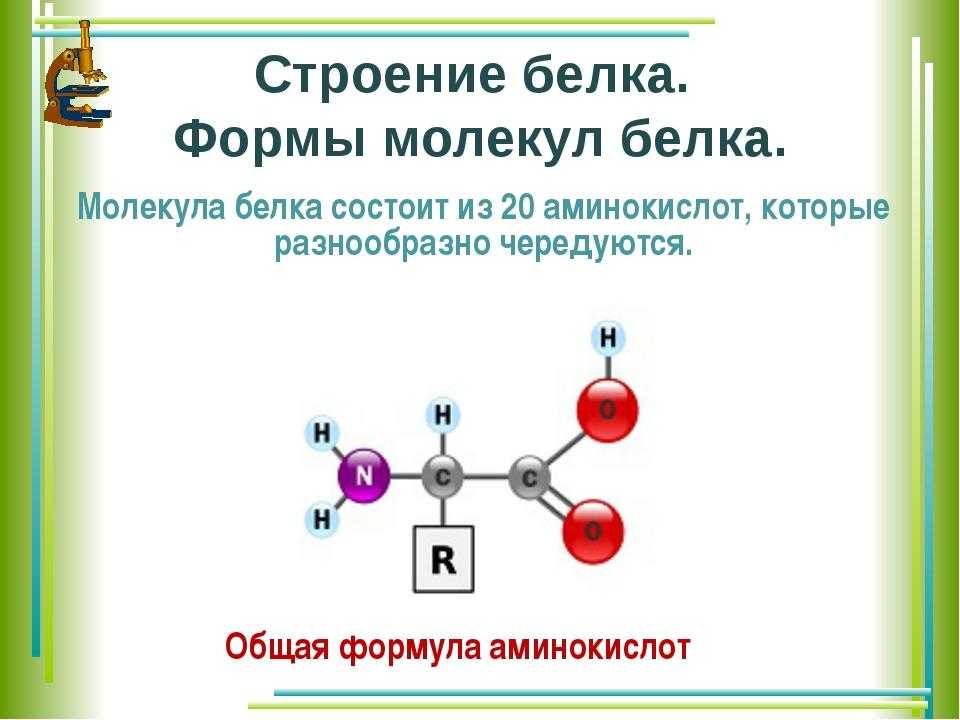
 Фенн
Ричард Хендерсон
Тасуку Хондзё
Джордж П. Смит
Уильям Г. Кэлин-младший
Фенн
Ричард Хендерсон
Тасуку Хондзё
Джордж П. Смит
Уильям Г. Кэлин-младший
Leave A Comment