Строение и функции белков
Урок изучения нового материала в 10-м классе. Данный материал учащиеся уже изучали в 9 классе, поэтому некоторые понятия им уже известны. Соответственно с ребятами ведется диалог о строении и функциях белков. С помощью учителя учащиеся узнают о классификации ферментов.
Для того, чтобы активизировать деятельность учащихся на уроке, приводятся интересные факты о белках, которые помогают ребятам и нацеливают их на дальнейшее усвоение нового материала. Так же для этих целей предлагается провести лабораторную работу. На данном уроке основная масса изучаемого материала записывается в виде таблиц, схемы, которые учитель строит в ходе урока вместе и учениками. Качество изучаемого материала проверяется в виде фронтального опроса. Урок рассчитан как на детей-аудиалов, так и визуалов.
Цель урока: дать представление о строении и функции белков.
Задачи: продолжить расширение и углубление знаний важнейших органических веществах клетки на основе изучения строения и функции белков, сформировать знания функциях белков и их важнейшей роли в органическом мире, продолжить формирование умения выявлять связи между строением и функциями веществ.
Основные понятия: белки, протеины, протеиды, пептид, пептидная связь, простые и сложные белки, первичная, вторичная, третичная и четвертичная структуры белков денатурация.
Средства обучения: таблицы по общей биологии, иллюстрирующие строение молекул белков; лабораторное оборудование для проведения лабораторной работы “Расщепление пероксида водорода с помощью ферментов, содержащихся в плетках листа элодеи”.
Ход урока
I. Изучение нового материала.
1. Рассказ учителя (или фрагмент лекции) об особенностях строения молекул белков как биополимеров, состоящих из большого количества разных аминокислот, между которыми происходит полимеризация на основе пептидной связи. Зарисовка и запись на доске и в тетрадях учащихся.
2. Самостоятельное изучение учащимися текста учебника (С.42) о классификации белков.
3. Беседа об уровнях организации белковой молекулы и химической основы каждого из четырех уровней (структур) этой молекулы, о денатурации как утрате белковой молекулы своей природной структуры.
Структура белковой молекулы.
| Структура белка | Характеристика | Тип связи | Схема (учащиеся рисуют самостоятельно) |
| Первичная | Линейная структура – последовательность аминокислот в полипептидной цепи, которая определяет все другие структуры молекулы, а также свойства и функции белка. | Пептидная. | |
| Вторичная | Закручивание полипептидной цепи в спираль или складывание в “гармошку”. | Водородные связи. | |
| Третичная | Глобулярный белок: упаковка вторичной
структуры в глобулу; фибриллярный белок: несколько вторичных структур, уложенных параллельными слоями, или скручивание нескольких вторичных структур наподобие каната в суперспираль. | Ионные, водородные, дисульфидные, гидрофобные. | |
| Четвертичная | Встречается редко. Комплекс из нескольких третичных структур органической природы и неорганическое вещество, например, гемоглобин. | Ионные, водородные, гидрофобные. |
4. Рассказ учителя о многообразии функций белков с краткой записью в тетрадях сущности функций: структурной, ферментативной, транспортной, защитной, регуляторной, энергетической, сигнальной.
5. Лабораторная работа “Расщепление пероксида водорода с помощью ферментов, содержащихся в клетках листа элодеи”.
Ход работы:
а. Приготовьте микропрепарат листа элодеи и рассмотрите его под микроскопом.
б. Капните на микропрепарат немного пероксида водорода и еще раз рассмотрите, в
каком состоянии находятся клетки листа элодеи.
в. Объясните, с чем связано выделение пузырьков из теток листа, что это за газ,
на какие вещества может расщепиться пероксид водорода, какие ферменты участвуют
в этом процессе?
По завершении лабораторной работы следует провести беседу о биохимических реакциях, протекающих при участии белковых катализаторов-ферментов как основе жизнедеятельности клеток и организмов.
Химические свойства белков обусловлены их различным аминокислотным составом. Существуют белки хорошо растворимые в воде и совершенно нерастворимые, химически активные и устойчивые к действию различных агентов, способные укорачиваться и растягиваться и т. д.
Под влиянием различных факторов – высокой температуры, действия химических веществ, облучения, механического воздействия – может произойти разрушение структур белковой молекулы. Нарушение природной структуры белка называется денатурацией. Если воздействие перечисленных факторов было недолгим и несильным, то белок может вернуть свою природную структуру – обратимая денатурация (ренатурация), если же воздействие было долгим или сильным, то происходит нарушение не только третичной и вторичной структур, но и первичной – необратимая денатурация (рис. 3).
Функции белков.
| Функция | Характеристика |
| 1. Строительная (структурная). | Входят в состав клеточных мембран и органоидов клетки (липопротеиды и гликопротеиды), участвуют в образовании стенок кровеносных сосудов, хрящей, сухожилий (коллаген) и волос (кератин). |
| 2. Двигательная | Обеспечивается сократительными белками (актин и миозин), которые обуславливают движение ресничек и жгутиков, сокращение мышц, перемещение хромосом при делении клетки, движение органов растений. |
| 3. Транспортная. | Связывают и переносят с током крови многие химические соединения, например, гемоглобин и миоглобин транспортируют кислород, белки сыворотки крови переносят гормоны, липиды и жирные кислоты, различные биологически активные вещества. |
| 4. Защитная. | Выработка антител (иммуноглобулинов) в ответ на проникновение в нее чужеродных веществ (антигенов), которые обеспечивают иммунологическую защиту; участие в процессах свертывания крови (фибриноген и протромбин). |
| 5, Сигнальная (рецепторная). | Прием сигналов из внешней среды и передача команд в клетку за счет изменения третичной структуры встроенных в мембрану белков в ответ на действие факторов внешней среды. Например, гликопротеины (встроены в гликокал икс), опсин (составная часть светочувствительных пигментов родопсина и йодопсина), фитохром (светочувствительный белок растений). |
| 6. Регуляторная. | Белки-гормоны оказывают влияние на обмен веществ, т. е. обеспечивают гомеостаз, регулируют рост, размножение, развитие и другие жизненно важные процессы. Например, инсулин регулирует уровень глюкозы в крови, тироксин – физическое и психическое развитие и т.д. |
| 7. Каталитическая (ферментативная). | Белки-ферменты ускоряют биохимические процессы в клетке. |
| Резервные белки животных: альбумин (яйца) запасает воду, ферритин – железо в клетках печени, селезенки; миоглобин – кислород в мышечных волокнах, казеин (молоко) и белки семян – источник питания для зародыша. | |
| 9. Пищевая (основной источник аминокислот). | Белки пищи – основной источник аминокислот (особенно незаменимых) для животных и человека; казеин (белок молока) – основной источник аминокислот для детенышей млекопитающих. |
| 10. Энергетическая. | Являются источником энергии – при окислении 1 г белка выделяется 17,6 кДж энергии, но организм использует белки в качестве источника энергии очень редко, например, при длительном голодании. |
Ферменты (энзимы) – это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при умеренной температуре, нормальном давлении и нейтральной среде. В таких условиях реакции синтеза или распада веществ протекали бы очень медленно, если бы не подвергались воздействию ферментов. Ферменты ускоряют реакцию без изменения ее общего результата за счет снижения энергии активации. Это означает, что в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулам, которые вступают в реакцию. Ферменты отличаются от химических катализаторов высокой степенью специфичности, т. е. фермент катализирует только одну реакцию или действует только на один тип связи. Скорость ферментативных реакций зависит от многих факторов – природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т.д.
Классификация ферментов.
| Группа | Катализируемые реакции, примеры |
| Оксидоредуктазы. | Окислительно-восстановительные реакции: перенос атомов водорода (Н) и кислорода (О) или электронов от одного вещества к другому, при этом окисляется первый и восстанавливается второй. Участвуют во всех процессах биологического окисления, например, вдыхании: АН + В А ВН (окисленный) или А + О АО (восстановленный). |
| Трансферазы. | Перенос группы атомов (метильной,
ацильной, фосфатной или аминогруппы) от одного вещества к другому.
Например, перенос остатков фосфорной кислоты от АТФ на глюкозу или
фруктозу под действием фототрансфераз: АТФ + глюкоза глюкозо-6-фосфат + АДФ. |
| Гидролазы. | Реакции расщепления сложных
органических соединений на более простые путем присоединения молекул
воды в месте разрыва химической связи (гидролиз). Например, амилаза (гидролизирует
крахмал), липаза (расщепляет жиры), трипсин (расщепляет белки) и др.: АВ + Н20 АОН + ВН. |
| Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, С-О, C-S. Например, декарбоксилаза отщепляет карбоксильную группу: |
| Изомеразы | Внутримолекулярные перестройки,
превращение одного изомера в другой (изомеризация): глюкозо-6-фосфат глюкозо-1-фосфат. |
| Лигазы (синтетазы) | Реакции соединения двух молекул с
образованием новых связей С–О, С–S, С–N, С–С, с использованием энергии
АТФ. Например, фермент валин-тРНК-синтетаза, под действием которого
образуется комплекс валин– тРНК: АТФ + валин + тРНК АДФ + Н3Р04 + валин-тРНК. |
Механизм действия фермента представлен на рис. 4. В молекуле каждого фермента имеется активный центр – это один или более участков, в которых происходит катализ за счет тесного контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа), или отдельная аминокислота. Активный центр может формироваться связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы – коферментами или кофакторами. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (комплементарности) друг другу.
Молекула фермента изменяет глобулярную форму молекулы субстрата. Молекула субстрата, присоединяясь к ферменту, тоже в определенных пределах изменяет свою конфигурацию для увеличения реакционности функциональных групп центра.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
II. Обобщающая беседа об основополагающей роли белков как самых необходимых химических соединений для жизней деятельности всего живого на Земле.
III. Закрепление знаний в процессе беседы с помощью следующих вопросов:
- Какие органические вещества клетки можно назвать самыми важными?
- Каким образом создается бесконечное разнообразие белков?
- Что собой представляют мономеры биополимера белка?
- Как формируется пептидная связь?
- Что собой представляет первичная структура белка?
- Каким образом происходит переход первичной структуры молекул белка во вторичную, а затем– в третичную и четвертичную?
- Какие функции могут выполнять белковые молекулы?
- Чем обусловлено многообразие функций белковых молекул?
- Приведите примеры белков, выполняющих самые разные функции. При ответе можно использовать следующую схему:
Биологические функции белков.
Это интересно.
Многие молекулы очень велики и по длине, и по молекулярной массе. Так, молекулярная масса инсулина – 5700, белка-фермента рибонуклеазы – 127 ООО, яичного альбумина – 36 ООО, гемоглобина – 65 ООО. В состав различных белков входят самые разные аминокислоты. Набор всех двадцати видов аминокислот содержит: казеин молока, миозин мышц и альбумин яйца. В белке-ферменте рибонуклеазе – 19, в инсулине – 18 аминокислот. Коллективу ученых под руководством академика Ю.А. Овчинникова удалось расшифровать сложную структуру белка родопсина, ответственного за процесс зрительного восприятия.
Кровь осьминогов, моллюсков и пауков имеет голубой цвет, потому что переносчиком кислорода у них служит не красный гемоглобин, содержащий атомы железа, а гемоцианин с атомами меди.
Почти половина необходимых нам белков, углеводов, 70–80% витаминов, значительное количество минеральных солей, аминокислот и других питательных элементов содержится в хлебе.
Американские ученые выделили из растения (семейство Пентадипландовых), произрастающего в Западной Африке, белок, который слаще сахара в 2 тыс. раз. Этот шестой известный науке сладкий белок, названный бразеином, содержится в плодах, которые с большой охотой поедают местные обезьяны. Биохимики расшифровали строение молекул сладкого белка, в каждой из них содержится 54 аминокислотных остатка.
IV. Домашнее задание: Изучить § 11, ответить на вопросы на с. 46. Приготовить сообщения или рефераты на темы: “Белки – биополимеры жизни”, “Функции белков – основа жизнедеятельности каждого организма на Земле”, “Денатурац
Белки выполняют ведущую роль в жизни организмов, преобладая в них и количественно. В теле животных они составляют 40-50% сухой массы, в растениях – 20-35%. Это самая разнообразная группа молекул – как химически, так и функционально. Состав и структура белков определяет огромное разнообразие их функций в клетке: их так много, что невозможно перечислить и описать их все. Однако можно сгруппировать эти функции в следующие восемь категорий. Но этот список также будет неполным.

- Ферментативная (каталитическая). Ферменты имеют белковое происхождение. Это трёхмерные глобулярные (свёрнутые) белки, плотно прилегающие к молекуле для её расщепления или сборки. Такая подгонка ускоряет специфические химические реакции в клетке.
- Защитная. Другие глобулярные белки используют свою форму для распознавания чужеродных микроорганизмов и раковых клеток. Эти приёмные устройства формируются эндокринной и иммунной системами. Многие живые организмы выделяют белки, ядовитые для других. Токсины синтезируют ряд животных, грибов, растений, микроорганизмов. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
- Транспортная. Глобулярные белки присоединяют и транспортируют мелкие молекулы и ионы. Например, транспортный белок гемоглобин переносит кислород и углекислоту с потоком крови. Мембранные транспортные белки помогают молекулам и ионам двигаться через плазмалемму. Альбумины крови транспортируют жирные кислоты, глобулины – ионы металлов и гормоны.
- Структурная. Белковые молекулы входят в состав всех клеточных мембран и органоидов. Из белков построены элементы цитоскелета, сократительные структуры мышечных волокон. Структурными являются кератин в волосах, фибрин в сгустках крови, коллаген в коже, связках, сухожилиях и костях. В состав связок, стенок артерий и лёгких входит также структурный белок эластин.
- Двигательная. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Мышцы сокращаются за счёт движения двух видов белковых нитей: актина и миозина. Контрактильные (лат. contraho, contractum – стягивать, сокращать) протеины играют ключевую роль в цитоскелете и передвижении веществ внутри клетки. Белок тубулин также входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
- Регуляторная. Крошечные белки, называемые гормонами, служат межклеточными посланниками в теле животных. Другие белки регулируют синтез РНК на ДНК, включая и выключая гены. Кроме того белки получают информацию, действуя в качестве рецепторов клеточной поверхности (эту функцию иногда считают отдельной, называя рецепторной).
- Запасающая. Кальций и железо хранятся в организме в виде ионов, связанных с белками хранения. В семенах растений запасаются резервные белки, которые используются зародышем при прорастании, а затем и проростком как источник азота.
- Энергетическая. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и липидов.
 Сравнительный размер молекул белков. Слева направо: антитело (IgG) (150 кДа), гемоглобин (66,8 кДа), гормон инсулин, фермент аденилаткиназа и фермент глютаминсинтетаза.
Сравнительный размер молекул белков. Слева направо: антитело (IgG) (150 кДа), гемоглобин (66,8 кДа), гормон инсулин, фермент аденилаткиназа и фермент глютаминсинтетаза.Автор: en:User:Gareth White, CC BY-SA 2.0
Функции белков
| |||
| Функция | Класс белка | Образцы | Примеры использования |
| Каталитическая | Ферменты | Карбогидразы | Расщепляют полисахариды |
| Протеазы | Разрушают белки | ||
| Полимеразы | Синтезируют нуклеиновые кислоты | ||
| Киназы | Фосфорилируют сахара и белки | ||
| Защитная | Иммуноглобулины | Антитела | Маркируют чужеродные белки для элиминации (удаления) |
| Токсины | Змеиный яд | Блокирует нервные импульсы | |
| Клеточные белки-антигены | МНС-белки (главный комплекс гистосовместимости) | Опознание чужеродных белков | |
| Транспортная | Циркуляционные транспортёры | Гемоглобин | Переносит кислород и углекислый газ крови |
| Миоглобин | Переносит кислород и углекислый газ в скелетных мышцах и мышце сердца | ||
| Цитохромы | Транспортируют электроны | ||
| Мембранные транспортные белки | Натриево-калиевый насос | Возбуждение мембраны | |
| Протонный насос | Хемиосмос | ||
| Транспортёр глюкозы | Транспортирует глюкозу в клетки | ||
| Структурная | Волокна | Коллаген | Образует хрящ |
| Кератин | Формирует волосы, ногти, перья и др. | ||
| Фибрин | Образует сгустки крови | ||
| Двигательная | Мускулы | Актин | Сокращение мышечных волокон |
| Миозин | Сокращение мышечных волокон | ||
| Регуляционная | Осмотические белки | Сывороточный альбумин | Поддерживает осмотическую концентрацию крови |
| Регуляторы генов | Репрессор | Регулирует транскрипцию | |
| Гормоны | Инсулин | Контролирует уровень глюкозы в крови | |
| Вазопрессин | Увеличивает задержку воды почками | ||
| Окситоцин | Регулирует сокращение матки и выделение молока | ||
| Запасающая | Ион-связывание | Ферритин | Хранит железо, особенно в селезёнке |
| Казеин | Хранит ионы в молоке | ||
| Кальмодулин | Связывает ионы кальция | ||
Белки – это полимеры
Белки, или протеины – это нерегулярные (не имеющие определённой закономерности в последовательности мономеров) полимеры, состоящие из мономеров, называемые аминокислотами. Протеины, в состав молекул которых входит от пятидесяти до нескольких тысяч остатков аминокислот, называются белками. Молекулы с меньшим количеством мономеров именуются пептидами.
 Общие сведения о пептидах и белках
Общие сведения о пептидах и белкахБелок состоит из одной или нескольких длинных неразветвлённых цепей. Каждая цепь называется полипептидом и состоит из аминокислот, скреплённых пептидными связями. Термины «белок» и «полипептид» часто используются свободно, что может вызывать путаницу. Для белка, который включает только одну полипептидную цепь, оба термина являются синонимами.
В природе существуют около 500 аминокислот. В образовании белков обычно (но не всегда) участвуют только 20 из них – их называют белокобразующими. Порядок соединения мономеров в белке определяет его структуру и функции. Многие учёные считают, что аминокислоты были первыми органическими молекулами, появившимися на Земле. Возможно, океаны, которые существовали в начале истории нашей планеты, содержали большое их разнообразие.
 Белокобразующие аминокислоты
Белокобразующие аминокислотыАвтотрофные организмы синтезируют все необходимые им аминокислоты из продуктов фотосинтеза и азотсодержащих неорганических соединений. Для гетеротрофов источником аминокислот являются продукты питания. В организме человека и животных некоторые аминокислоты могут синтезироваться из продуктов обмена веществ (в первую очередь — из других аминокислот). Такие аминокислоты называются заменимыми.
Другие же, так называемые незаменимые аминокислоты, не могут быть собраны в организме и поэтому должны постоянно поступать в него в составе белков пищи. Протеины, содержащие остатки всех незаменимых аминокислот, называются полноценными. Неполноценные белки – это те, в составе которых отсутствуют остатки тех или иных незаменимых аминокислот.
Незаменимыми аминокислотами для человека являются: триптофан, лизин, валин, изолейцин, треонин, фенилаланин, метионин и лейцин. Для детей незаменимыми являются также аргинин и гистидин.
Полипептидные цепи могут быть очень длинными и включать самые разные комбинации аминокислотных остатков. Каждый конкретный белок характеризуется строго постоянным составом и последовательностью аминокислот.
 Димер мембранного белка кальсеквестрина.
Димер мембранного белка кальсеквестрина.Deposition authors: Wang, S., Trumble, W.R., Liao, H., Wesson, C.R., Dunker, A.K., Kang, C., CC BY 3.0
Белки, образованные только остатками аминокислот, называются простыми. Сложными являются протеины, имеющие в своём составе компонент неаминокислотной природы. Это могут быть ионы металлов (Fe2+, Zn2+, Mg2+, Mn2+), липиды, нуклеотиды, сахара и др. Простыми белками являются альбумины крови, фибрин, некоторые ферменты (трипсин) и др. Сложные белки – это большинство ферментов, иммуноглобулины (антитела).
Состав аминокислот
Аминокислоты, как следует из их названия, содержат основную аминогруппу (— NH2), а также кислотную карбоксильную группу (—COOH), обе они связаны с центральным атомом углерода. Углерод дополнительно скреплен с водородом и функциональной белковой группой, называемой радикалом (R). Эти компоненты полностью заполняют все связи центрального атома углерода.
 Общая структура α-аминокислот, составляющих белки (кроме пролина).
Общая структура α-аминокислот, составляющих белки (кроме пролина).Автор: User:X-romix
Уникальный характер каждой аминокислоты определяется природой группы радикала. Обратите внимание, что если группа радикала не содержит атома водорода (Н), как в глицине, то аминокислота хиральна и может существовать в форме двух энантиомеров: d или L. В белках живых систем содержатся обычно α (L)-аминокислоты, а β (d)-аминокислоты встречаются крайне редко.
Группа радикала определяет химические свойства аминокислот – они могут быть полярными или неполярными, гидрофобными или гидрофильными. Серин с радикалом -CH2OH является полярной молекулой, Аланин, который имеет –CH3 как группу радикала – неполярен.
Существуют также основные аминокислоты (более чем с одной аминогруппой) и кислые аминокислоты (более чем с одной карбоксильной группой). Наличие дополнительной амино- или карбоксильной группы оказывает влияние на свойства аминокислоты, которые играют определяющую роль в формировании пространственной структуры белка.
В состав радикала некоторых аминокислот (например, цистеина) входят атомы серы. Все 20 аминокислот сгруппированы в пять химических классов, основанных на группе их радикала.
- Неполярные аминокислоты, такие как лейцин, часто имеют в качестве радикала —CH2 или —CH3.
- Полярные незаряженные аминокислоты, такие как треонин, с радикалом, содержащим кислород или гидроксильную группу (-OH).
- Заряженные аминокислоты, такие как глутаминовая кислота, с радикалом, имеющим кислоты или основания, способные к ионизации.
- Ароматические аминокислоты, такие как фенилаланин, имеющий группу радикала, содержащую органическое (углеродное) кольцо с чередованием одиночных и двойных связей. Они также неполярны.
- Аминокислоты, обладающие особыми функциями и свойствами. Например, метионин, который часто является первой аминокислотой в цепи белков, пролин, вызывающий перегибы в цепях, цистин, связывающий цепи вместе.
Каждая аминокислота влияет на форму белка по-разному, в зависимости от химической природы боковых групп. Например, части белковой цепи с многочисленными неполярными аминокислотами сворачиваются внутрь своей цепи путём гидрофобного исключения.
Белки и пептидные связи
В дополнении к группе радикала каждая аминокислота имеет положительно заряженную аминогруппу (NH3 +) на одном конце и отрицательно заряженную гидроксильную группу (COO -) на другом. Амино- и карбоксильные группы у пары аминокислот могут подвергаться реакции дегидрации (выделение молекулы воды) с образованием ковалентной связи. Ковалентная связь, скрепляющая две аминокислоты, называется пептидной. Скреплённые таким способом аминокислоты не могут свободно вращаться вокруг N-C связи. Этот факт является основным фактором образования конструкции белковых молекул.
 Пептидная связь
Пептидная связьНаличие как основной, так и кислотной групп обусловливает амфотерность (проявление как кислотных, так и основных свойств) и высокую реакционную способность аминокислот.
При соединении двух аминокислот образуется дипептид. На одном конце молекулы дипептида находится свободная аминогруппа, на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется более 10 остатков аминокислот, то образуется полипептид.
Новаторская работа Фредерика Сангера в начале 1950-х годов доказала, что каждый вид белка имеет определённую аминокислотную последовательность. Для отщепления аминокислот он использовал химические методы, после этого определял их. Сангер преуспел в расшифровке аминокислотной последовательности инсулина. Он продемонстрировал, что все молекулы инсулина имеют одинаковый состав аминокислот.
Уровни структурной организации белков
Форма белка определяет его функцию. Один из способов изучить что-то столь же маленькое как белок – посмотреть на него при помощи коротковолнового излучения, которое представлено рентгеновскими лучами. Рентгеновские лучи пропускают через белок для получения дифракции его узора. Эта картинка кропотливо анализируется и позволяет исследователю построить трёхмерное изображение молекулы с положением каждого её атома. Первым белком, проанализированным таким образом, был миоглобин; вскоре такому же анализу был подвергнут связанный с ним белок гемоглобин.
Когда было изучено достаточное количество протеинов, стал очевиден общий принцип их строения: в каждом исследованном белке все внутренние аминокислоты, такие как лейцин, валин и фенилаланин, неполярны. Тенденция воды к исключению неполярных молекул буквально толкает такие части цепи аминокислот внутрь протеина. Неполярные аминокислоты вынуждены тесно контактировать друг с другом, оставляя мало свободного места внутри молекулы. Полярные и заряженные аминокислоты концентрируются на поверхности белка, за исключением немногих, играющих ключевые функциональные роли.
Структура белков, как правило, описывается как иерархия четырёх уровней: первичного, вторичного, третичного и четвертичного. Мы рассмотрим эту точку зрения, а затем интегрируем её с более современным подходом, вытекающим из расширяющихся знаний о белковой структуре.
 Уровни организации молекул белка
Уровни организации молекул белкаПервичная структура белков
Первичная структура белка – это его аминокислотная последовательность, т. е. это цепочка из множества аминокислотных остатков, соединённых пептидными связями. Это наиболее важная структура, так как именно она определяет форму, свойства и функции белка. На основе первичной структуры создаются другие формы молекулы.
Группы радикалов, которыми отличаются аминокислоты, не играют роли в пептидной цепи белков и протеин может включать любую последовательность аминокислот. Так как любая из 20 аминокислот может появиться в любом месте, белок, содержащий 100 мономеров, может образовать любую из 20 100 различных аминокислотных последовательностей. Это важное свойство белков позволяет им быть разнообразными, но каждый из них функционирует только при определённой аминокислотной последовательности.

Вторичная структура белка
Боковые и пептидные группы полипептидных цепей могут образовывать водородные связи. Вторичная структура белка возникает в результате связывания атомов водорода NH-групп и кислорода CO-групп. Полипептидная цепь при этом спирально закручивается. Водородные связи слабые, но благодаря их большому числу они обеспечивают стабильность этой структуры. Спиральную конфигурацию имеют, например, молекулы кератина, миозина и коллагена.
Водородные связи пептидов могут образовываться с водой. Если связей с водой будет слишком много, белки не смогут приобрести глобулярной структуры. Лайнус Полинг предположил, что пептидные группы могут взаимодействовать друг с другом, если пептид свёрнут в спираль, которую он назвал α-спиралью. Этот вид регулярного взаимодействия в пептиде формирует его вторичную структуру.
 Вторичная структура инсулина
Вторичная структура инсулинаДругая форма вторичной структуры формируется между зонами пептида, расположенными в один ряд, в результате чего получается плоская молекула, собранная в складки, называемая β-листом. Части белка могут быть либо параллельными, либо антипараллельными – в зависимости от того, являются ли смежные участки пептида ориентированными в одном или в противоположном направлении.
Эти два вида вторичной структуры создают зоны белка – цилиндрические (α-спирали) и плоские (β-листы). Конечная структура белка может включать области каждого типа вторичной структуры. Например ДНК-связывающие белки обычно имеют области α-спирали, которые могут лежать поперёк ДНК и взаимодействовать непосредственно с основаниями ДНК. Белки порины, образующие отверстия в мембранах, состоят из β-листов. В гемоглобине α и β-структуры (глобины) имеют в молекуле свои зоны.
 Вторичная структура белков
Вторичная структура белковТретичная структура белков
Окончательная структура химически связанных белков называется третичной. Третичная структура формируется за счет образования водородных, ионных и других связей, возникающих в водной среде между разными группами атомов белковой молекулы вторичной структуры.
У некоторых белков важную роль в образовании третичной структуры играют S – S связи (дисульфидные) между остатками цистеина (аминокислоты, содержащей серу). При этом полипептидная спираль укладывается в своеобразный клубок (глобулу) таким образом, что гидрофобные аминокислотные радикалы погружаются внутрь глобулы, а гидрофильные располагаются на поверхности и взаимодействуют с молекулами воды. Третичной структурой определяются специфичность белковых молекул, их биологическая активность. Её имеют многие белки, например миоглобин (белок, который участвует в создании запаса кислорода в мышцах) и трипсин (фермент, расщепляющий белки пищи в кишечнике).
Третичная структура стабилизируется рядом сил, в том числе:
- водородными связами между радикалами различных аминокислот;
- электростатическим притяжением радикалов с противоположными зарядами;
- гидрофобным исключением неполярных радикалов;
- ковалентными дисульфидными связами.
На стадии третичной структуры по форме молекул белки можно разделить на две группы:
- глобулярные – имеют округлую форму. Такую форму имеют глобулины и альбумины крови, фибриноген, гемоглобин;
- фибриллярные – характеризуются вытянутой, нитевидной формой молекул. Это кератин, коллаген, миозин, эластин и др.

Четвертичная структура белка
Когда два или более полипептида связываются с образованием функционального белка, отдельные его цепи называются субъединицами. Расположение этих субъединиц и есть четвертичная структура. Субъединицы в таких белках чаще всего неполярны, поэтому они не связаны химически и отвечают за отдельные виды деятельности. Прочность четвертичной структуры обеспечивается взаимодействием слабых межмолекулярных сил.
Четвертичная структура характерна для белка гемоглобина. Вспомните, что гемоглобин состоит из двух α-цепей и двух β-цепей, а ещё в его состав входит небелковый компонент – гем.
Субъединицы располагаются в их окончательной четвертичной структуре. Это конечная структура некоторых, но не всех белков. У протеинов, которые состоят только из одной полипептидной цепи, например у фермента лизоцима, конечной структурой является третичная.

Мотивы и домены – структурные элементы белков
Ручное определение последовательности аминокислот в белке – трудоёмкая работа. Эту ситуацию изменило открытие способности хранения информации о белке молекулой ДНК. Первоначально геном человека был расшифрован вручную. Появление технологий следующего поколения привело к заметному ускорению секвенирования.
Сегодня расшифрованы более 40 000 бактериальных геномов и почти 8 000 геномов эукариот, в том числе 80 последовательностей генов млекопитающих. Так как состав ДНК имеет непосредственное отношение к последовательности аминокислот в белках, у биологов теперь есть огромная база данных строения протеинов.
Новая информация заставила задуматься о логике генетического кода и основных закономерностях структуры белка. Исследователи до сих пор рассматривают иерархическую систему из четырёх уровней как важную, но в лексикон биологов вошли и новые термины: мотив укладки и белковый домен.
Мотив укладки белковых молекул
Когда биологи обнаружили третичную структуру белка (ещё более трудоёмкая работа, чем определение последовательности аминокислот в цепи), они заметили сходные элементы, расположенные в непохожих белках. Подобные структуры называются мотивами, а иногда «сверхсекундными структурами». Термин «мотив» заимствован из искусства и относится к тематическому повторяющемуся элементу в музыке или дизайне.
Один общий мотив β-α-β образует так называемую «складку Россмана» у большого количества протеинов. Вторым часто встречающимся мотивом является β-баррель, который представляет собой β-лист, сложенный по кругу, чтобы сформировать трубку. Третий тип мотива – спираль-поворот-спираль, состоит из двух α-спиралей, разделённых изгибом. Его используют белки для связывания с молекулой ДНК.
Логику структуры мотивов укладки исследователи до сих пор не могут понять. Вероятно, если аминокислоты являются буквами в языке белков, то мотивы представляют собой повторяющиеся слова или фразы. Мотивы укладки помогли определить неизвестные функции белков, а база данных белковых мотивов используется для поиска новых неизвестных протеинов.
Мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков.
Белковые домены
Домены – это функциональные единицы в виде глобулы внутри более крупной структуры белков. Их можно рассматривать как субструктуры внутри третичной структуры белка. В языке белков это «абзацы». Большинство белков состоит из нескольких доменов, которые выполняют различные части функций протеинов.
Во многих структурах эти домены могут быть физически разделены. Например, так устроены факторы транскрипции – белки, которые связываются с ДНК и инициируют построение РНК по комплементарной ей ДНК. Было выяснено, что если ДНК-связывающие области поменять местами с факторами транскрипции, специфичность фактора может быть изменена без изменения его способности стимулировать транскрипцию. Эксперименты по замене доменов были проведены со многими факторами транскрипции, и они указывают, что активационные и ДНК-связывающие домены действуют отдельно.
Эти образования также могут помогать протеинам складываться. По мере того, как полипептидная цепь приобретает свою структуру, домены принимают правильную форму. Это действие может быть продемонстрировано экспериментально. Искусственное продуцирование фрагмента полипептида, который образует домен в интактном белке, показывает, что фрагмент складывается, чтобы сформировать такую же структуру, как у прототипа.
Процесс складывания, белки-шапероны
Первоначально биохимики думали, что новоиспечённые белки сворачиваются спонтанно, пробуя различные конфигурации, как гидрофобные взаимодействия с водой толкают неполярные аминокислоты внутрь белков до тех пор, пока не будет достигнута их окончательная структура. Оказалось, что эта точка зрения слишком проста. Цепи протеинов могут быть сложены многими способами, поэтому пробы и ошибки заняли бы слишком много времени. По мере того как первичная цепь складывается, приобретая финальную структуру, неполярные «липкие» внутренние участки во время промежуточных стадий обнажаются. Если эти промежуточные формы поместить в пробирку со средой, идентичной той, что внутри клетки, они прилипают к другим, и нежелательные белки-партнёры образуют клейкую массу.
Как клетки избегают того, чтобы их белки слипались в массу? Ответ на вопрос появился во время изучения необычных мутаций, которые спасают бактериальные клетки от размножения внутри них вирусов. При этом белки вирусов, произведённые внутри клетки, не могут сложиться как следует. Дальнейшее исследование помогло выяснить, что клетки содержат белки-шапероны, помогающие другим белкам складываться правильно.
 Свёртывание белков
Свёртывание белковВ настоящее время молекулярные биологи выявили массу белков, действующих как шапероны. Это большой класс полимеров, который можно разделить на подклассы. Представители шаперонов были найдены в каждом исследуемом организме. Некоторые из них, называемые тепловыми шоковыми белками, вырабатывается в ответ на повышение температуры тела. Высокие температуры служат фактором денатурации белков, шоковые белки-шопероны помогают белкам правильно сворачиваться и в такой ситуации.
Один из хорошо изученных классов этих белков, названных шаперонинами, был изучен у кишечной палочки (Escherichia coli). У мутантов при инактивации шаперонинов 30% бактериального белка не складывались должным образом. Шаперонины собираются в комплекс, напоминающий цилиндрический контейнер. Белки могут заходить в этот контейнер, и даже неправильно сложенные молекулы складываются там заново.
Исследователи склонны думать о белках как о фиксированных структурах, но это не относится к шаперонинам. Их гибкость поразительна. Видимо, это нужно им для выполнения своих функций. Клетки используют эти белки для складывания некоторых молекул протеинов и восстановления их неправильной структуры.
Денатурация инактивирует белки
Еще одной важной особенностью белков является то, что они проявляют свою активность лишь в узких температурных рамках и в определённом диапазоне кислотности среды.
Если условия, окружающие белок, изменяются, то он может частично потерять свою структуру или полностью развернуться. Этот процесс называется денатурацией. Белки могут быть денатурированы, когда рН, температура или ионная концентрация окружающего раствора изменена. Денатурация происходит вследствие разрыва водородных, ионных, дисульфидных и других связей, стабилизирующих пространственную структуру белковых молекул. При этом может утрачиваться их четвертичная, третичная и даже вторичная структуры.
Денатурированные белки как правило биологически неактивны. Это особенно значимо в отношении ферментов: так как почти каждая химическая реакция происходит при их помощи, жизненно важно, чтобы они функционировали нормально.
До появления морозильников и холодильников единственным способом предохранения продуктов от размножения в них микроорганизмов было хранение их внутри раствора, содержащего высокую концентрацию соли или уксуса, которые денатурировали ферменты микроорганизмов и предотвращали их рост.
Большинство ферментов функционирует в очень узком диапазоне условий окружающей среды. У каждого энзима этот диапазон специфичен. Ферменты крови, которые работают при рН около 7,4, быстро денатурируют в кислой среде желудка. И наоборот, протеолитические ферменты желудка, работающие при рН=2 или менее, разбираются в основной среде крови. Аналогично у организмов, живущих вблизи океанических гидротермальных источников, есть ферменты, которые хорошо работают только в экстремальных температурах (до 100°С). Эти организмы не могут выжить в более прохладных водах, потому что их энзимы не функционируют должным образом при относительно низких температурах.
Если нормальные показатели окружающего раствора восстанавливаются, небольшой белок, не потерявший первичной структуры, может восстановиться. Этот процесс называется ренатурацией, он происходит благодаря взаимодействию неполярных аминокислот и воды. Первоначально этот процесс был установлен для энзима рибонуклеазы, его ренатурация привела к выводу, что первичная структура определяет третичную структуру белка. Более сложные белки редко складываются вновь из-за их сложной окончательной структуры. Их денатурация носит необратимый характер.

Важно отличать денатурацию от диссоциации. Субъединицы белков с четвертичной структурой могут быть диссоциированы (разделены) без потери своей индивидуальной третичной структуры. Например, молекула гемоглобина может диссоциировать на 4 молекулы (2 α-глобина и 2 β-глобина) без денатурации свёрнутых глобиновых белков. Они легко восстанавливают свою четвертичную структуру из четырёх субъединиц.
Вам будет интересно
Белки (протеины, полипептиды) — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. В состав молекул белков входят атомы углерода, кислорода, водорода, азота и иногда серы, фосфора и железа.
Мономерами белков являются аминокислоты, которые (имея в своём составе карбоксильную и аминогруппы) обладают свойствами кислоты и основания (амфотерны).

Благодаря этому аминокислоты могут соединяться друг с другом (их количество в одной молекуле может достигать нескольких сотен). В связи с этим молекулы белков имеют большие размеры, и их называют макромолекулами.
Структура белковой молекулы
Под структурой белковой молекулы понимают её аминокислотный состав, последовательность мономеров и степень скрученности молекулы белка.
В молекулах белков встречается всего \(20\) видов различных аминокислот, и огромное разнообразие белков создаётся за счёт различного их сочетания.
- Последовательность аминокислот в составе полипептидной цепи — это первичная структура белка (она уникальна для любого белка и определяет его форму, свойства и функции). Первичная структура белка уникальна для любого типа белка и определяет форму его молекулы, его свойства и функции.
- Длинная молекула белка сворачивается и приобретает сначала вид спирали в результате образования водородных связей между —СО и —NН группами разных аминокислотных остатков полипептидной цепи (между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты). Эта спираль — вторичная структура белка.
- Третичная структура белка — трёхмерная пространственная «упаковка» полипептидной цепи в виде глобулы (шарика). Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (гидрофобными, водородными, ионными и дисульфидными S–S связями).
- Некоторые белки (например, гемоглобин крови человека) имеют четвертичную структуру. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Четвертичная структура удерживается непрочными ионными, водородными и гидрофобными связями.
Структура белков может нарушаться (подвергаться денатурации) при нагревании, обработке некоторыми химическими веществами, облучении и др. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остаётся в виде полипептидной цепи. В результате денатурации белок теряет способность выполнять свою функцию.
Нарушение четвертичной, третичной и вторичной структур обратимо. Этот процесс называют ренатурацией.
Разрушение первичной структуры необратимо.
Кроме простых белков, состоящих только из аминокислот, есть ещё и сложные белки, в состав которых могут входить углеводы (гликопротеины), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины) и др.
Функции белков
- Каталитическая (ферментативная) функция. Специальные белки — ферменты — способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз. Каждый фермент ускоряет одну и только одну реакцию. В состав ферментов входят витамины.
- Структурная (строительная) функция — одна из основных функций белков (белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин — хрящи и сухожилия).
- Транспортная функция — белки обеспечивают активный транспорт ионов через клеточные мембраны (транспортные белки в наружной мембране клеток), транспорт кислорода и углекислого газа (гемоглобин крови и миоглобин в мышцах), транспорт жирных кислот (белки сыворотки крови способствуют переносу липидов и жирных кислот, различных биологически активных веществ).

- Сигнальная функция. Приём сигналов из внешней среды и передача информации в клетку происходит за счёт встроенных в мембрану белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды.
- Сократительная (двигательная) функция — обеспечивается сократительными белками — актином и миозином (благодаря сократительным белкам двигаются реснички и жгутики у простейших, перемещаются хромосомы при делении клетки, сокращаются мышцы у многоклеточных, совершенствуются другие виды движения у живых организмов).

- Защитная функция — антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь, образуя тромб.

- Регуляторная функция присуща белкам — гормонам (не все гормоны являются белками!). Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах (например, инсулин регулирует содержание сахара в крови).
- Энергетическая функция — при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры (при полном расщеплении \(1\) г белка до конечных продуктов выделяется \(17,6\) кДж энергии). Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.

Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
http://ours-nature.ru/lib/b/book/1063747118/348
Уровни организации белков | Химия онлайн
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.

Первичная структура белка — определенная последовательность a-аминокислотных остатков в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).

Вторичная структура белка — конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль.
Существует два основных способа укладки цепи.
Одна из моделей вторичной структуры — a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Большинство белков содержит как α-спирали, так и β-структуры.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.

Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S- , водородных связей, гидрофобных и ионных взаимодействий.
Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу».
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— .

Интересно знать!
В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей. Вследствие этого вновь приобретенная структура кератина стабилизируется. Волосы приобретают другую форму.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами.
Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом.
Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема.

Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет.
В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.

Белки
Особенности строения белковой молекулы
Структура белкововой молекулы — сложная пространственная структура, обладающая первичным, вторичным, третичным и четвертичным уровнями организации. Особенности структурной организации белковой молекулы определяются первичным уровнем ее организации.
Первичная структура белковой молекулы — полипептидная цепь с линейной последовательностью амнокислот, связанных между собой за счет пептидной связи. Первичная структура белка наиболее прочная из всех. В отношений всех свойств, которыми будет обладать белковая молекула, эта структура является определящюей. Все остальные структурные уровни организации образуются в соответствии с особенностями строения первичного уровня по принципу самосборки. Внешние факторы не оказывают влияние на этот процесс.
Вторичная структура белковой молекулы — структура белковой молекулы, образующаяся за счёт скручивания линейной последовательности аминокислот первичной структуры с образованием спирали, многочисленные витки которой связаны между собой водородными связями.
Третичная структура белковой молекулы — структура белковой молекулы, образующаяся за счет наложения одних частей спирали белковой молекулы на другие, формирование между этими частями различного рода связей: водородных ковалентных ионных, дисульфидных (при наличии аминокислоты цистин), гидрофобных. Третичная структура имеет вид глобулы. При третичном уровне организации белковой молекулы возможность принимать участие в химических реакциях, проявлять химическую активность остается только у тех аминокислотных остатков, которые имеют поверхностное расположение.
Четвертичная структура белковой молекулы — структура белковой молекулы, представляющая собой сложную пространственную организацию нескольких полипептидных цепей, связанных между собой за счет различных химических связей. Эти связи аналогичны таковым в третичном уровне организации белковой молекулы. Полипептидные цепи, принимающие участие в образовании четвертичной структы белковой молекулы, могут быть одинаковыми или иметь различное строение.
2.3.3. Органические вещества клетки. Белки.
2.3.3. Органические вещества клетки. Белки.
Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу Nh3 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга. Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы – ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
1.Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
2.Длинная молекула белка сворачивается и приобретает сначала вид спирали – вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие цепь.
3.Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями.
4.Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными.
Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.
Таблица. Образование структур (уровня пространственной организации) белков.


Функции белков.
Каталитическая (ферментативная) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Транспортная – белки обеспечивают активный транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа, транспорт жирных кислот.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сократительная – обеспечивается сократительными белками – актином и миозином.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
Таблица. Основные функции белков и пептидов.




Тематические задания.
Часть А
А1. Последовательность аминокислот в молекуле белка зависит от:
1) структуры гена
2) внешней среды
3) их случайного сочетания
4) их строения
А2. Человек получает незаменимые аминокислоты путем
1) их синтеза в клетках
3) приема лекарств
2) поступления с пищей
4) приема витаминов
А3. При понижении температуры активность ферментов
1) заметно повышается
2) заметно понижается
3) остается стабильной
4) периодически изменяется
А4. В защите организма от кровопотерь участвует
1) гемоглобин
2) коллаген
3) фибрин
4) миозин
А5. В каком из указанных процессов белки не участвуют?
1) обмен веществ
2) кодирование наследственной информации
3) ферментативный катализ
4) транспорт веществ
А6. Укажите пример пептидной связи:

Часть В
В1. Выберите функции, характерные для белков
1) каталитическая
2) кроветворная
3) защитная
4) транспортная
5) рефлекторная
6) фотосинтетическая
В2.
Установите соответствие между структурой белковой молекулы и ее особенностями
|
ОСОБЕННОСТИ СТРУКТУРЫ |
СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ |
|
|
|
Часть С
С1. Почему продукты хранят в холодильнике?
С2. Почему продукты, подвергшиеся тепловой обработке, хранятся дольше?
СЗ. Объясните понятие «специфичность» белка, и какое биологическое значение имеет специфичность?
С4. Прочитайте текст, укажите номера предложений, в которых допущены ошибки и объясните их.
1) Большая часть химических реакций в организме катализируется ферментами.
2) Каждый фермент может катализировать множество типов реакций.
3) У фермента есть активный центр, геометрическая форма которого изменяется в зависимости от вещества, с которым фермент взаимодействует.
4) Примером действия фермента может быть разложение мочевины уреазой.
5) Мочевина разлагается на двуокись углерода и аммиак, которым пахнет кошачий лоток с песком.
6) За одну секунду уреаза расщепляет до 30000 молекул мочевины, в обычных условиях на это потребовалось бы около 3 млн. лет.
«Жизнь, есть способ существования белковых тел»
Ф. Энгельс.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
I. Состав белков
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями. В состав этих биополимеров входят мономеры 20 типов. Такими мономерами являются аминокислоты. Каждый белок по своему химическому строению является полипептидом. Некоторые белки состоят из нескольких полипептидных цепей. В составе большинства белков находится в среднем 300-500 остатков аминокислот. Известно несколько очень коротких природных белков, длиной в 3-8 аминокислот, и очень длинных биополимеров, длиной более чем в 1500 аминокислот. Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Аминокислоты соединяются друг с другом за счёт образования новой связи между атомами углерода и азота – пептидной (амидной):
Из двух аминокислот (АК) можно получить дипептид, из трёх – трипептид, из большего числа АК получают полипептиды (белки).
II. Функции белков
Функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α — аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α — аминокислоты. Многие α — аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белковα — аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см. таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.

Рис. 5. Функции белков в организме
1. Каталитическая функция
Oсуществляется с помощью специфических белков — катализаторов (ферментов). При их участии увеличивается скорость различных реакций обмена веществ и энергии в организме.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов. Среди них такие, как, например пепсин, расщепляют белки в процессе пищеварения.
2. Транспортная функция
Cвязывание и доставка (транспорт) различных веществ от одного органа к другому.
Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
3. Защитная функция
Cвязывание и обезвреживание веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), образующиеся в организме (физическая, химическая и иммунная защита). Так, например, защитную функцию выполняет белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
4. Сократительная функция (актин, миозин)
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
5. Структурная функция
Белки составляют основу строения клетки. Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей и кожи, эластин сосудистой стенки, кератин шерсти, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
6. Гормональная (регуляторная) функция
Способность передавать сигналы между тканями, клетками или организмами.
Выполняют белки-регуляторы обмена веществ. Они относятся к гормонам, которые образуются в железах внутренней секреции, некоторых органах и тканях организма.
7. Питательная функция
Осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
III. Физические свойства белков
Белки – очень длинные молекулы, которые состоят из звеньев аминокислот, сцепленных пептидными связями. Это – природные полимеры, молекулярная масса белков колеблется от нескольких тысяч до нескольких десятков миллионов. Например, альбумин молока имеет молекулярную массу 17400, фибриноген крови – 400.000, белки вирусов – 50.000.000. Каждый пептид и белок обладают строго определенным составом и последовательностью аминокислотных остатков в цепи, это и определяет их уникальную биологическую специфичность. Количество белков характеризует степень сложности организма (кишечная палочка – 3000, а в человеческом организме более 5 млн. белков).
Первый белок, с которым мы знакомимся в своей жизни, это белок куриного яйца альбумин — хорошо растворим в воде, при нагревании свертывается (когда мы жарим яичницу), а при долгом хранении в тепле разрушается, яйцо протухает. Но белок спрятан не только под яичной скорлупой. Волосы, ногти, когти, шерсть, перья, копыта, наружный слой кожи — все они почти целиком состоят из другого белка, кератина. Кератин не растворяется в воде, не свертывается, не разрушается в земле: рога древних животных сохраняются в ней так же хорошо, как и кости. А белок пепсин, содержащийся в желудочном соке, способен разрушать другие белки, это процесс пищеварения. Белок инрерферон применяется при лечении насморка и гриппа, т.к. убивает вызывающие эти болезни вирусы. А белок змеиного яда способен убивать человека.
IV. Классификация белков
С точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием так называемых незаменимых аминокислот, белки подразделяются на полноценные и неполноценные.
К полноценным белкам относятся преимущественно белки животного происхождения, кроме желатины, относящейся к неполноценным белкам.
Неполноценные белки — преимущественно растительного происхождения. Однако некоторые растения (картофель, бобовые и др.) содержат полноценные белки. Из животных белков особенно большую ценность для организма представляют белки мяса, яиц, молока и др.
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты (Например, гемоглобин содержит железо).
По общему типу строения белки можно разбить на три группы:
1. Фибриллярные белки — нерастворимы в воде, образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Белки, имеющие вытянутую нитевидную структуру. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
Большинство фибриллярных белков не растворяются в воде. К фибриллярным белкам относят например, α-кератины (на их долю приходится почти весь сухой вес волос, белки шерсти, рогов, копыт, ногтей, чешуи, перьев), коллаген — белок сухожилий и хрящей, фиброин — белок шёлка).
2. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая. Среди глобулярных и фибриллярных белков выделяют подгруппы. К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
3. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортеры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Белки – неотъемлемая часть пищи животных и человека. Живой организм отличается от неживого в первую очередь наличием белков. Для живых организмов характерно огромное разнообразие белковых молекул и их высокая упорядоченность, что и определяет высокую организацию живого организма, а также способность двигаться, сокращаться, воспроизводиться, способность к обмену веществ и к многим физиологическим процессам.
V. Строение белков
Фишер Эмиль Герман, немецкий химик-органик и биохимик. В 1899 начал работы по химии белков. Используя созданный им в 1901 эфирный метод анализа аминокислот, Ф. впервые осуществил качественные и количественные определения продуктов расщепления белков, открыл валин, пролин (1901) и оксипролин (1902), экспериментально доказал, что аминокислотные остатки связываются между собой пептидной связью; в 1907 синтезировал 18-членный полипептид. Ф. показал сходство синтетических полинептидов и пептидов, полученных в результате гидролиза белков. Ф. занимался также изучением дубильных веществ. Ф. создал школу химиков-органиков. Иностранный член-корреспондент Петербургской АН (1899). Нобелевская премия (1902).
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
Выделяют 4 уровня структурной организации белков:
|
1. Первичная структура — определенная последовательность α-аминокислотных остатков в полипептидной цепи. |
|
|
2. Вторичная структура – a) конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. Одна из моделей вторичной структуры — α-спираль.
б) Другая модель — β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
|
А Б
|
|
3. Третичная структура — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. |
|
|
4. Четвертичная структура — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей |
|
Молекула белка стремится не только к реализации своей биоактивности, но и к наиболее компактной структуре, позволяющей ей максимально реализовать свои функции.

Рис. Строение белков
Строение белков: вторичная структура
Строение белков: третичная структура
Иллюстрация. Четвертичная структура белка (на примере гемоглобина)
VI. Тренажеры
Тренажер №1: “Биологические функции белков”
Тренажер №2: “Свойства белков”
ЦОРы
Фильм: «Функции белков»
Функции белков
СТРУКТУРА БЕЛКОВ На этой странице объясняется, как аминокислоты объединяются в белки и что понимают под первичной, вторичной и третичной структурами белков. Четвертичная структура не покрыта. Это относится только к белкам, состоящим из более чем одной полипептидной цепи. В учебном плане по химии IB есть упоминание о четвертичной структуре, но ни в одном другом учебном плане в Великобритании на этом уровне. | |
Примечание: Четвертичная структура может быть очень сложной, и я не знаю точно, какой глубины хочет учебная программа IB (именно поэтому я ее не включил). Я подозреваю, что разыскивается довольно тривиально. Студенты IB должны спросить совета у своего учителя или лектора. | |
Первичная структура белков Рисование аминокислот В химии, если бы вы нарисовали структуру общей 2-аминокислоты, вы, вероятно, нарисовали бы ее так: Однако, чтобы нарисовать структуру белков, мы обычно скручиваем ее так, что группа «R» торчит сбоку.Гораздо легче увидеть, что происходит, если вы это сделаете. Это означает, что две самые простые аминокислоты, глицин и аланин, будут показаны как: Пептиды и полипептиды Глицин и аланин могут сочетаться с удалением молекулы воды с образованием дипептида . Это может произойти одним из двух разных способов — поэтому вы можете получить два разных дипептида. Либо: или: В каждом случае связь, показанная синим цветом в структуре дипептида, известна как , , пептидная связь, , . В химии это также называется амидной связью, но, поскольку мы сейчас находимся в области биохимии и биологии, мы будем использовать их термины. Если бы вы объединили три аминокислоты, вы бы получили трипептид. Если вы объединили много и много вместе (как в цепочке белков), вы получите полипептид . Белковая цепь будет иметь где-то в диапазоне от 50 до 2000 аминокислотных остатков . Вы должны использовать этот термин, потому что, строго говоря, пептидная цепь не состоит из аминокислот. Когда аминокислоты соединяются вместе, молекула воды теряется. Пептидная цепь состоит из того, что осталось после потери воды — другими словами, она состоит из аминокислотных остатков и . По соглашению, когда вы рисуете пептидные цепи, группа -NH 2 , которая не была преобразована в пептидную связь, записывается на левом конце.Неизменная группа -COOH записана в правом конце. Конец пептидной цепи с группой -NH 2 известен как N-конец , а конец с группой -COOH является C-терминал . Белковая цепь (с N-концом слева) будет выглядеть следующим образом: «R» группы происходят из 20 аминокислот, которые содержатся в белках.Пептидная цепь известна как основной цепи , а группы «R» известны как боковых цепей . | |
Примечание: В случае, когда группа «R» происходит от пролина аминокислоты, картина нарушается. В этом случае водород в азоте, ближайшем к группе «R», отсутствует, а группа «R» зацикливается и присоединяется к этому азоту, а также к атому углерода в цепи. Я упоминаю это для полноты — , а не , потому что вы должны были бы знать об этом в химии на этом вводном уровне. | |
Первичная структура белков Теперь есть проблема! Термин «первичная структура» используется двумя различными способами. В самом простом смысле этот термин используется для описания порядка аминокислот, соединенных вместе для образования белка. Другими словами, если вы замените группы «R» на последней диаграмме реальными группами, у вас будет первичная структура определенного белка. Эта первичная структура обычно показана с использованием сокращений для аминокислотных остатков.Эти сокращения обычно состоят из трех букв или одной буквы. Используя трехбуквенные сокращения, часть белковой цепи может быть представлена, например: Если вы посмотрите внимательно, вы найдете аббревиатуры для глицин (Gly) и аланин (Ala) среди других. Если бы вы следовали по цепочке белков до ее левого конца, вы бы обнаружили аминокислотный остаток с неприсоединенной группой -NH 2 . N-конец всегда пишется слева от диаграммы для первичной структуры белка — независимо от того, используете ли вы его полностью или используете эти сокращения. Более широкое определение первичной структуры включает все признаки белка, которые являются результатом ковалентных связей. Очевидно, что все пептидные связи состоят из ковалентных связей, так что это не проблема. Но есть еще одна особенность белков, которая также ковалентно связана. Он включает в себя аминокислоту цистеин. Если две боковые цепи цистеина оказываются рядом друг с другом из-за складывания в пептидной цепи, они могут реагировать с образованием серного мостика .Это еще одно ковалентное звено, поэтому некоторые люди считают его частью первичной структуры белка. Из-за того, как серные мостики влияют на сгиб белка, другие люди считают это частью третичной структуры (см. Ниже). Это, очевидно, потенциальный источник путаницы! | |
Важно: Вам необходимо знать, где ваши конкретные эксперты будут включать серные мосты — как часть первичной структуры или как часть третичной структуры.Вы должны проверить свой текущий учебный план и прошлые документы. Если вы изучаете программу обучения в Великобритании и не получили ее, перейдите по этой ссылке, чтобы узнать, как ее получить. | |
Вторичная структура белков В длинных белковых цепях есть области, в которых цепи организованы в регулярные структуры, известные как альфа-спирали (альфа-спирали) и бета-складчатые листы. Это вторичные структуры в белках. Эти вторичные структуры удерживаются вместе водородными связями. Они формируются, как показано на диаграмме между одной из неподеленных пар на атоме кислорода и водородом, присоединенным к атому азота: Хотя водородные связи всегда находятся между группами C = O и H-N, точная картина их различна для альфа-спирали и листа с бета-складками. Когда вы дойдете до них ниже, потратьте некоторое время, чтобы убедиться, что вы видите, как работают два разных механизма. | |
Важно: Если вы недовольны водородными связями и не знаете, что означает эта диаграмма, перейдите по этой ссылке, прежде чем продолжить.То, что следует, достаточно сложно визуализировать, не беспокоясь о водородных связях! Вы также должны точно узнать, сколько деталей вам нужно знать об этом следующем бите. Вполне возможно, что все, что вам нужно, это услышать об альфа-спирали и знать, что она удерживается вместе водородными связями между группами C = O и N-H. Еще раз, вам нужно проверить свой учебный план и прошлые документы — особенно пометить схемы для предыдущих документов. Если вы перейдете по любой из этих ссылок, используйте кнопку НАЗАД в вашем браузере, чтобы вернуться на эту страницу. | |
Альфа-спираль В альфа-спирали белковая цепь намотана, как слабо свернутая пружина. «Альфа» означает, что если вы посмотрите вниз на длину пружины, то наматывание происходит по часовой стрелке, когда она отходит от вас. | |
Примечание: Если ваше визуальное воображение столь же безнадежно, как и мое, единственный способ по-настоящему понять это — взять кусочек проволоки и свернуть его в пружинную форму.Подойдет немного компьютерного лидерства. По правде говоря, если вы студент химии, вам вряд ли понадобится это знать. Если вторичная структура белка находится в вашей учебной программе, ваши экзаменаторы, скорее всего, только захотят, чтобы вы знали, как структуры скрепляются водородной связью. Проверьте прошлые бумаги, чтобы быть уверенным. Если вы читаете это как студент, изучающий биохимию или биологию, и у вас есть какой-то другой способ распознавания альфа-спирали, придерживайтесь любого метода, который вам дали. | |
Следующая диаграмма показывает, как альфа-спираль удерживается вместе водородными связями. Это очень упрощенная диаграмма, в которой пропущено множество атомов. Мы обсудим это более подробно после того, как вы на это взгляните. Что не так с диаграммой? Две вещи: Прежде всего, показаны только атомы на частях катушек, обращенных к вам. Если вы попытаетесь показать все атомы, все становится настолько сложным, что практически невозможно понять, что происходит. Во-вторых, я не предпринял никаких попыток установить правильные углы связи. Я намеренно нарисовал все связи в основной цепи, как будто они лежат вдоль спирали. По правде говоря, они торчат повсюду. Опять же, если вы нарисуете это правильно, спираль практически невозможно увидеть. Итак, что вам нужно заметить? Обратите внимание, что все группы «R» торчат из основной спирали вбок. Обратите внимание на правильное расположение водородных связей.Все группы N-H направлены вверх, а все группы C = O направлены вниз. Каждый из них участвует в водородной связи. И, наконец, хотя вы не можете видеть это на этой неполной диаграмме, каждый полный виток спирали содержит 3,6 (приблизительно) аминокислотных остатка. Если бы у вас было целое число аминокислотных остатков за ход, каждая группа имела бы идентичную группу под ней на ходу ниже. Водородная связь не может происходить при таких обстоятельствах. Каждый ход имеет 3 полных аминокислотных остатка и два атома из следующего. Это означает, что каждый поворот смещен относительно тех, что выше и ниже, так что группы N-H и C = O приведены в соответствие друг с другом. Бета-плиссированные листы В бета-плиссированном листе цепи сложены так, что они лежат рядом друг с другом. Следующая диаграмма показывает так называемый «антипараллельный» лист. Все это означает, что соседние цепи движутся в противоположных направлениях.Учитывая то, как именно происходит это свертывание, это кажется неизбежным. На самом деле это не неизбежно! Можно сделать более сложное складывание, чтобы соседние цепи действительно двигались в одном направлении. Сейчас мы выходим за рамки требований химии уровня Великобритании (и ее эквивалентов). Сложенные цепи снова удерживаются вместе водородными связями, включающими точно такие же группы, что и в альфа-спирали. | |
Примечание: Обратите внимание, что нет причин, по которым эти листы должны быть изготовлены из четырех частей сложенной цепи рядом друг с другом, как показано на этой диаграмме.Это был произвольный выбор, который дал диаграмму, которая хорошо вписалась в экран! | |
Третичная структура белков Что такое третичная структура? Третичная структура белка — это описание того, как вся цепь (включая вторичные структуры) складывается в свою окончательную трехмерную форму. Это часто упрощается в модели, подобные следующей для фермента дигидрофолатредуктазы.Ферменты, конечно же, основаны на белках. | |
Примечание: Эта диаграмма была получена из банка данных белка RCSB. Если вы хотите найти больше информации о дигидрофолатредуктазе, их ссылочный номер для нее — 7DFR. В этом ферменте нет ничего особенного с точки зрения структуры. Я выбрал его, потому что он содержал только одну белковую цепь и имел примеры обоих типов вторичной структуры. | |
Модель демонстрирует альфа-спирали во вторичной структуре в виде витков «ленты». Листы с бета-складками показаны как плоские кусочки ленты, оканчивающиеся наконечником стрелки. Кусочки белковой цепи, которые представляют собой просто случайные витки и петли, показаны как кусочки «струны». Цветовое кодирование в модели помогает вам обойти структуру — пройтись по спектру от темно-синего до красного. Вы также заметите, что эта конкретная модель имеет две другие молекулы, связанные с ней (показаны как обычные молекулярные модели).Это две молекулы, чья реакция этого фермента катализирует. Что удерживает белок в его третичной структуре? Третичная структура белка удерживается за счет взаимодействия между боковыми цепями — группами «R». Это может произойти несколькими способами. Ионные взаимодействия Некоторые аминокислоты (такие как аспарагиновая кислота и глутаминовая кислота) содержат дополнительную группу -COOH. Некоторые аминокислоты (такие как лизин) содержат дополнительную группу -NH 2 . Можно получить перенос иона водорода из группы -COOH в группу -NH 2 для образования цвиттерионов, как в простых аминокислотах. Очевидно, вы могли бы получить ионную связь между отрицательной и положительной группами, если бы цепочки складывались так, чтобы они были близко друг к другу. Водородные связи Обратите внимание, что сейчас мы говорим о водородных связях между боковыми группами, а не между группами на самом деле в основной цепи. Многие аминокислоты содержат группы в боковых цепях, в которых атом водорода связан с атомом кислорода или азота. Это классическая ситуация, когда может возникнуть водородная связь. Например, аминокислотный серин содержит группу -ОН в боковой цепи. Вы можете установить водородную связь между двумя остатками серина в разных частях сложенной цепи. Можно легко представить себе подобное водородное связывание, включающее группы -ОН, или группы -COOH, или группы -CONH 2 , или группы -NH 2 в различных комбинациях, хотя вам следует помнить, что -COOH группа и группа -NH 2 будут образовывать цвиттерион и производить более сильную ионную связь вместо водородных связей. Ван-дер-Ваальса дисперсионные силы Некоторые аминокислоты имеют довольно большие углеводородные группы в своих боковых цепях. Несколько примеров показаны ниже. Временные флуктуирующие диполи в одной из этих групп могут вызвать противоположные диполи в другой группе на соседней свернутой цепи. Установленных дисперсионных сил будет достаточно, чтобы скрепить сложенную конструкцию. | |
Важно: Если вы недовольны дисперсионными силами Ван-дер-Ваальса, перейдите по этой ссылке. Используйте кнопку НАЗАД в вашем браузере, чтобы вернуться на эту страницу. | |
Серные мосты Серные мостики, которые образуются между двумя остатками цистеина, уже обсуждались в первичных структурах. Где бы вы ни решили разместить их, это никак не повлияет на их формирование!
© Джим Кларк 2004 (последняя редакция ноябрь 2016) | |
 Структура белка , от первичной до четвертичной структуры.
Структура белка , от первичной до четвертичной структуры.Белковая структура описывает, как организованы белковые молекулы. Именно эта структура заставляет белки работать.
Белки являются важными биологическими макромолекулами, присутствующими во всех организмах. Они представляют собой полимеры, образованные из 20 возможных аминокислот путем трансляции РНК. Белковые структуры имеют размеры от десятков до нескольких тысяч аминокислот. [1]
После трансляции белки складываются в определенные формы. Это не сделано химическими связями, но более слабыми силами, такими как водородные связи. Чтобы понять, как работают белки, часто необходимо обнаружить их трехмерную структуру. Для этого в биофизике используются такие методы, как рентгеновская кристаллография, ЯМР-спектроскопия и интерферометрия с двойной поляризацией.
Белок может переключаться с одной формы на другую, выполняя свою работу. Альтернативные состояния одного и того же белка называются конформациями.Например, фермент будет иметь по меньшей мере две конформации: одну с коэнзимом и одну без нее. Форма со своим коферментом будет иметь две конформации: одну с субстратом и одну без.
Существует четыре различных уровня структуры белка.
Первичная структура [изменить | изменить источник]
Белки — это молекулы, которые состоят из одной или нескольких цепей аминокислот. Каждый отдельный белок имеет определенный набор аминокислот в определенном порядке. Первичная структура относится к последовательности аминокислот одной полипептидной цепи от ее начала (N-конец) до ее конца (C-конец).Аминокислоты удерживаются вместе определенным типом ковалентной связи, известной как пептидная связь, которая образуется в процессе биосинтеза или трансляции белка.
Вторичная структура [изменить | изменить источник]
 Альфа-спираль с водородными связями (желтые точки)
Альфа-спираль с водородными связями (желтые точки)Вторичная структура относится к частям белковой цепи, которые образуют регулярные структуры. Существует два основных типа вторичной структуры: альфа-спираль и бета-нить (бета-лист). Альфа-спирали — это спирали, которые вращаются по часовой стрелке, а бета-нити образуют бета-лист, где цепи лежат рядом друг с другом.Два типа вторичной структуры были предложены в 1951 году Линусом Полингом и его коллегами. [2] В отличие от полипептидной цепи, которая связана через ковалентные пептидные связи, вторичная структура образована водородными связями.
Третичная структура [изменить | изменить источник]
Это форма (пространственная организация) всей молекулы белка. Белковый фолдинг в значительной степени самоорганизуется. Это главным образом сделано первичной структурой белка — его последовательностью аминокислот. [3] Это называется догмой Анфинсена. [4] Однако среда, в которой синтезируется и складывается белок, также влияет на его окончательную форму.
Четвертичная структура [изменить | изменить источник]
Если белки построены из субъединиц, это дает другой уровень структуры. Это, четвертичная структура, то, как субъединицы соединяются вместе. Например, гемоглобин имеет две альфа-цепи и две бета-цепи. И альфа-цепи, и бета-цепи кодируются кластером из шести или семи генов, которые обеспечивают код для различных версий молекулы. [5] [6]
- Образовательный портал: Белки IV: первичная, вторичная, третичная и четвертичная структура. [2]
уровней структуры белка
уровней структуры белка
Название белка происходит от греческого протеоса , означает первичный. Хотя существует много других важных биомолекул, акцент на протеин как фундаментальный является уместным. Белки служат важными структурными компонентами клеток. Что еще более важно, почти все катализаторы, или ферментов , в биологических системах состоят из белков.Белки представляют собой линейные цепи из аминокислот , соединенные пептидными связями. Двадцать аминокислот включены в белок путем перевода. В некоторых белках аминокислоты модифицируются последующими трансляционными событиями после — . Последовательность из аминокислот белка называется его первичной структурой .
Аминокислотная цепь или остов образует одну из немногих вторичных структур, на основе взаимодействия пептидной связи с соседними соседями.Вторичная структура, которую образует цепь, определяется первичной структурой цепи. Некоторые аминокислоты предпочитают один тип вторичной структуры, другие предпочитают другой, а третьи, вероятно, вообще не образуют никакой конкретной вторичной структуры. Вторичные структуры основаны на взаимодействиях близко расположенных аминокислот.
20 аминокислот отличаются по природе своих боковых цепей , групп, отличных от повторяющихся пептидных единиц. Взаимодействия между аминокислотными боковыми цепями в одной молекуле белка определяют его третичную структуру . Третичная структура является наиболее важным из структурных уровней при определении, например, ферментативной активности белка. Складывание белка в правильную третичную структуру является важным фактором в биотехнологии. Полезность клонированного гена часто ограничена способностью биохимиков побуждать переводимый белковый продукт приобретать правильную третичную структуру. (В клетке специализированные белки, называемые шаперонинами, помогают некоторым белкам достичь своей окончательной структуры.)
Наконец, белковые цепи взаимодействуют друг с другом, так как субъединицы объединяются, чтобы создать функциональный вид. Например, гемоглобин, кислородный носитель млекопитающих, содержит две из двух разных субъединиц. Способность гемоглобина доставлять кислород к тканям зависит от ассоциации этих субъединиц. Взаимодействие белков с образованием мультимера , состоящего из нескольких субъединиц, называется четвертичной структурой белка . Четвертичная структура часто очень важна для определения регуляторных свойств белка.
,Глава 2: Структура белка — химия
Глава 2: Структура белка
2.1. Структура и свойства аминокислот
2.2 Образование пептидных связей и первичная структура белка
2.3 Структура вторичного белка
2,4 суперсредняя структура и белковые мотивы
2,5 Структура третичного и четвертичного белка
2.6 Фолдинг, денатурация и гидролиз белка
2.7 Ссылки
2.1. Структура и свойства аминокислот
Белки являются одними из самых распространенных органических молекул в живых системах и имеют самые разнообразные функции всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить в транспорте, хранении или мембранах; или они могут быть токсинами или ферментами.Каждая клетка в живой системе может содержать тысячи различных белков, каждый из которых обладает уникальной функцией. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры альфа-аминокислот, расположенные в линейной последовательности и соединенные вместе ковалентными связями.
Альфа-аминокислотная структура
Основной строительный блок белков называется альфа (α) аминокислоты . Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина.Альфа-обозначение используется для обозначения того, что эти две функциональные группы отделены друг от друга одной углеродной группой. Помимо амина и карбоновой кислоты, альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может варьироваться по размеру и длине. На диаграмме ниже эта группа обозначена как R-группа. В живых организмах 20 аминокислот используются в качестве белковых строительных блоков. Они отличаются друг от друга только в положении R-группы. Основная структура аминокислоты показана ниже:
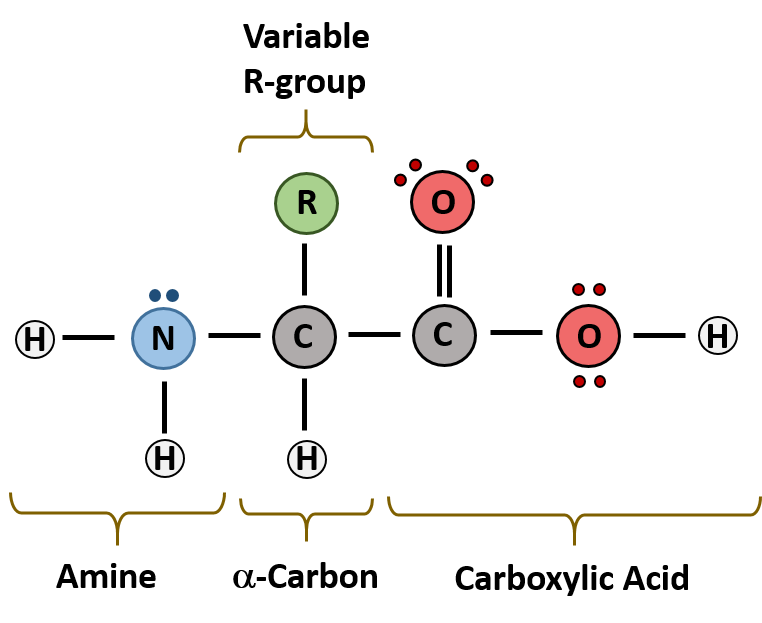
Рисунок 2.1 Общая структура альфа-аминокислоты
Всего существует 20 альфа-аминокислот, которые обычно включаются в белковые структуры (рис. 2.х). Различные R-группы имеют разные характеристики в зависимости от природы атомов, входящих в функциональные группы. Существуют R-группы, которые преимущественно содержат углерод и водород и являются очень неполярными или гидрофобными. Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Несколько аминокислот являются основными (содержащими функциональные группы амина) или кислотными (содержащими функциональные группы карбоновой кислоты).Эти аминокислоты способны образовывать полные заряды и могут иметь ионные взаимодействия. Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
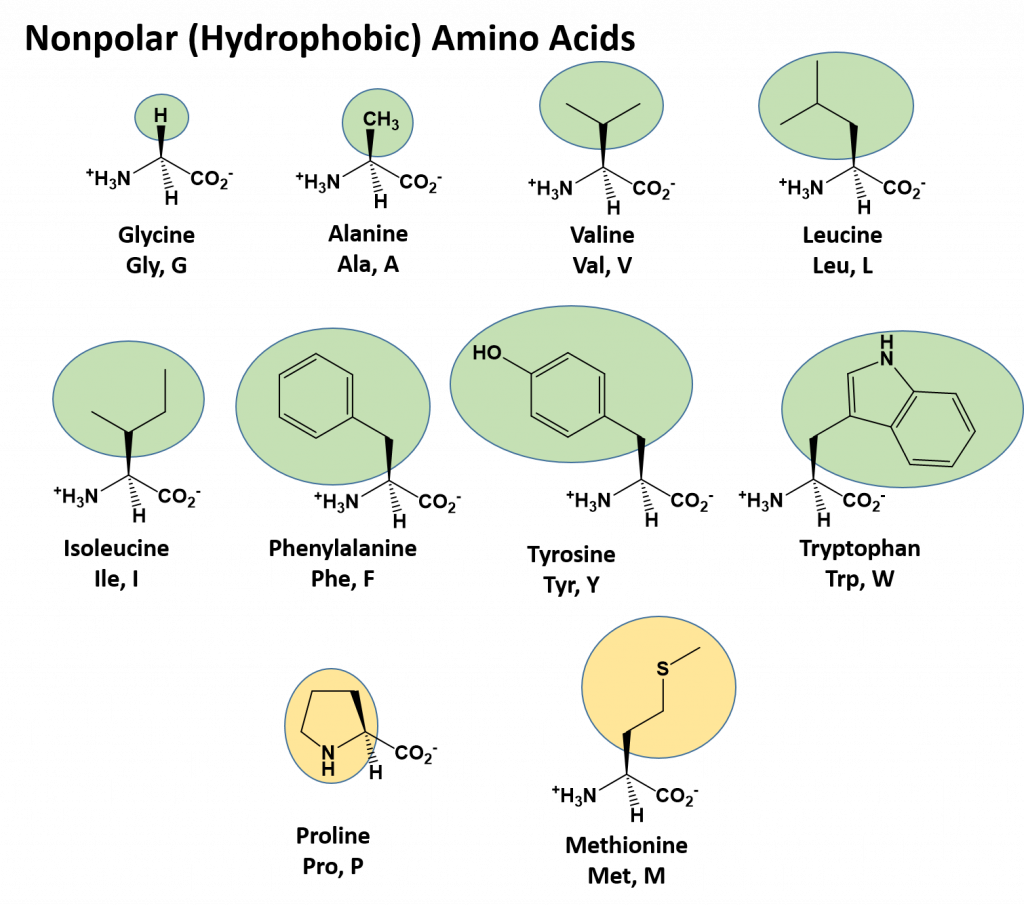
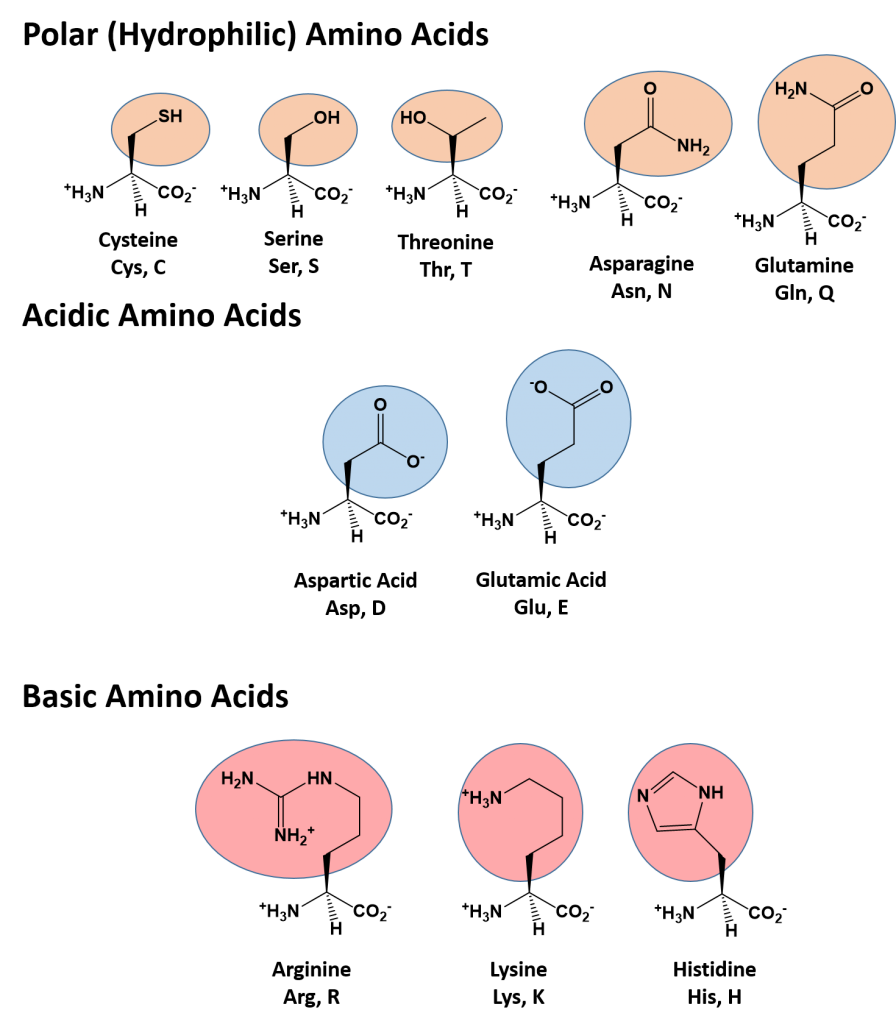
Рис. 2.2. Структура 20 альфа-аминокислот, используемых в синтезе белка. R-группы обозначены обведенной / окрашенной частью каждой молекулы. Цвета указывают на определенные классы аминокислот: гидрофобный — зеленый и желтый, гидрофильный полярный незаряженный — оранжевый, гидрофильный кислотный — синий, основной гидрофильный — розовый.
Нажмите здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты можно в значительной степени подразделить на два более специфических класса: алифатических аминокислот и ароматических аминокислот. Алифатические аминокислоты (глицин, аланин, валин, лейцин, изолейцин и пролин) обычно содержат разветвленные углеводородные цепи, из которых наиболее простыми являются глицин с более сложными структурами лейцина и валина.Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь циклизуется с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, охватывающем первичную структуру, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь и обычно находится в областях белка, где складки или повороты происходят.
Ароматические аминокислоты (фенилаланин, тирозин и триптофан), как следует из названия , содержат в своей структуре ароматические функциональные группы, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода / водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из разных аминокислот может иметь разные физические и химические свойства в зависимости от их структуры. Например, гидроксильная группа, присутствующая в тирозине, повышает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот , обычно классифицируется как неполярные, гидрофобные аминокислоты, поскольку концевая метильная группа создает тиоэфирную функциональную группу, которая обычно не может образовывать постоянный диполь в молекуле и сохраняет низкую растворимость.
Полярные (гидрофильные) аминокислоты
Полярные гидрофильные аминокислоты можно подразделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы.В пределах полярного незаряженного класса боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксилсодержащие аминокислоты, серин, треонин и цистеин —, а также амидсодержащие аминокислоты, глутамин и аспаригин. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат), составляют кислотные аминокислоты и содержат боковые цепи с функциональными группами карбоновой кислоты, способными полностью ионизироваться в растворе.Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные группы амина, которые можно протонировать, чтобы нести полный заряд.
Многие из аминокислот с гидрофильными R-группами могут участвовать в активном сайте , , , ферментах . Активный сайт является частью фермента, который непосредственно связывается с субстратом и проводит реакцию. Белковые ферменты содержат каталитических групп , состоящих из аминокислотных R-групп, которые способствуют образованию и деградации связей.Аминокислоты, которые играют значительную роль в специфичности связывания активного сайта, обычно не соседствуют друг с другом в первичной структуре, но образуют активный сайт в результате складывания при создании третичной структуры, как вы увидите позже в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты, 20 аминокислот, используемых для синтеза белка, имеют как трехбуквенные, так и однобуквенные коды (Таблица 2.1). Эти аббревиатуры обычно используются для обозначения белковых последовательностей для биоинформационных и исследовательских целей.
Таблица 2.1 Сокращения α-аминокислот
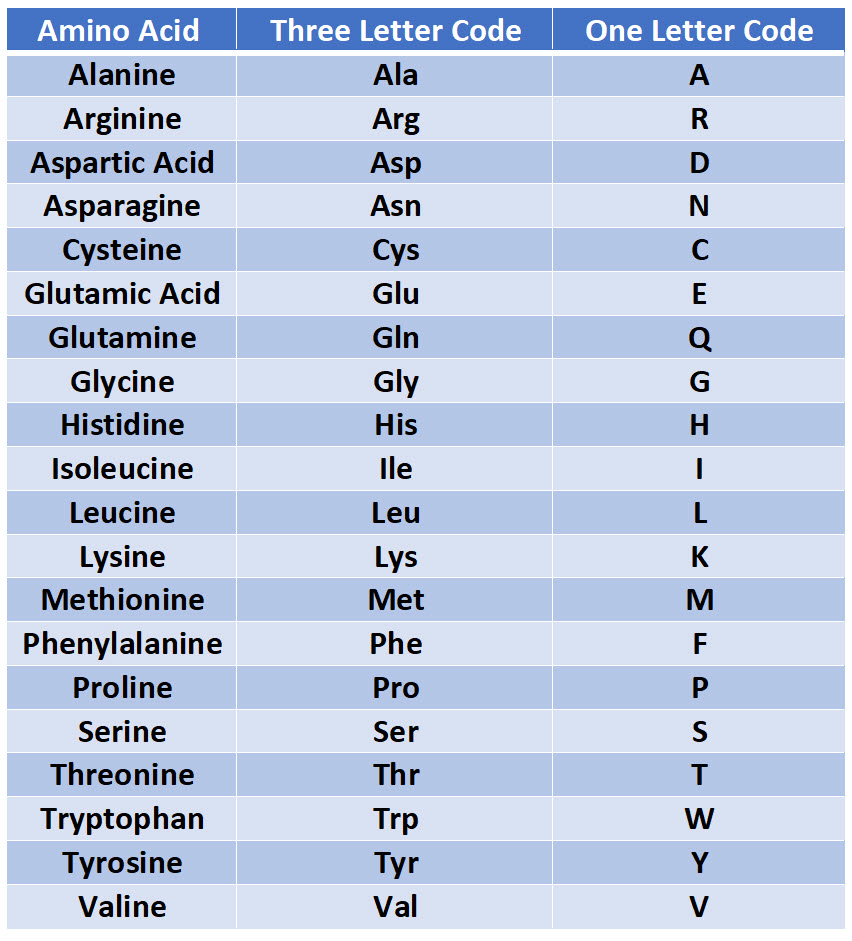
Вопрос для размышления: триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан содержит структуру индольного кольца, которая включает функциональную группу амина. Однако из-за близости и характера удаления электронов ароматической кольцевой структуры одинокая пара электронов на азоте недоступна для принятия протона.Вместо этого они участвуют в образовании — связей в нескольких различных резонансных структурах, возможных для индольного кольца. На рисунке 2.3A показаны четыре возможные резонансные структуры для индола. И наоборот, в структуре кольца имидазола, обнаруженной в гистидине, есть два атома азота, один из которых участвует в образовании резонансных структур (азот № 1 на рисунке 2.3B) и не может принимать протон, а другой (азот № 3). ) у которого есть одинокая пара электронов, которая может принять протон.

Рис. 2.3. Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в структурах кольца индола и иммидизола . (A) Показаны четыре резонансные структуры структуры индольного кольца, демонстрирующие, что неподеленная пара электронов на азоте участвует в образовании пи -связей. (B) Иммидазольная кольцевая структура имеет один азот (1), который участвует в резонансных структурах (не показан) и недоступен для принятия протона, в то время как второй азот (3) имеет неподеленную пару электронов, доступных для принятия протона как показано.
Работай сам:
Учитывая приведенный выше пример, опишите с помощью химической схемы, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты являются киральными молекулами
Если вы изучите структуру альфа-углерода в каждой из аминокислот, вы заметите, что все аминокислоты, за исключением глицина, представляют собой , , хиральные, , , молекулы, , (рис. 2.4) хиральная молекула — это та, которая не наложена на ее зеркальное отображение. Как и левая и правая руки, которые имеют большой палец, пальцы в том же порядке, но являются зеркальными и не одинаковыми, киральные молекулы имеют одинаковые элементы, прикрепленные в одном и том же порядке, но являются зеркальными и не одинаковыми. Версии хиральных молекул в зеркальном отображении имеют физические свойства, которые почти идентичны друг другу, что делает их очень трудными для различения или разделения.Из-за этой природы им дают специальное стереоизомерное имя, называемое , , энантиомеры, , , и фактически самим соединениям дают одно и то же имя! Эти молекулы отличаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, которые вращают свет в правом направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличать один энантиомер от другого.D- и L-формы аланина показаны на рисунке 2.4B.
Хотя большинство аминокислот могут существовать как в левой, так и в правой форме, жизнь на Земле почти полностью состоит из левшей. Протеогенные аминокислоты, включенные в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в не-рибосомально кодируемые пептиды, но использование D-аминокислот в природе редко. Интересно, что когда мы обсудим структуру сахаров в главе XX, мы обнаружим, что сахара, которые включены в углеводные структуры, находятся почти исключительно в D-конформации.Никто не знает, почему это так. Тем не менее, д-р. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, которые падают на землю из космоса на метеоритах, больше в L-конформации, чем в D-конформации. Таким образом, тот факт, что мы сделаны преимущественно из L-аминокислот, может быть из-за аминокислот из космоса.
Почему аминокислоты в космосе благоприятствуют L-конформации? Никто на самом деле не знает, но известно, что излучение также может существовать в левой и правой формах. Итак, существует теория под названием , гипотеза Боннера , , которая предполагает, что преобладают формы излучения в космосе (т.е.например, от вращающейся нейтронной звезды) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще предположительно, но недавние находки метеоритов делают эту гипотезу гораздо более правдоподобной.
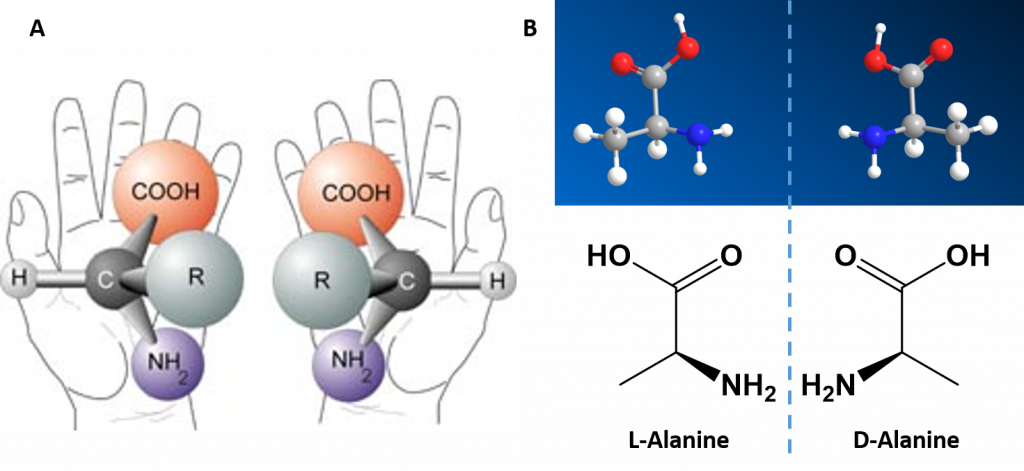
Рисунок 2.4 Хиральность аминокислот. За исключением самой простой аминокислоты, глицина, все другие аминокислоты, которые включены в белковые структуры, являются хиральными по природе. (А) Демонстрирует хиральность структуры ядра альфа-аминокислоты, когда используется неспецифическая R-группа.(B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шарика и стержня, а нижняя диаграмма представляет структуру линии.
Image (A) from NASA
Обратите внимание, что D- и L-обозначения являются конкретными терминами, используемыми для способа, которым молекула вращает простой поляризованный свет. Он не обозначает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию e.грамм. R или S , относящиеся к Rectus или Sinister , соответственно.
Абсолютные конфигурации для хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов кирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. Когда получена абсолютная конфигурация, присвоение R или S основано на правилах приоритета Cahn-Ingold-Prelog, , которые можно просмотреть, перейдя по ссылке и на рисунке 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, в результате чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии. Однако цистеин вращает обычный поляризованный свет в левостороннем или левостороннем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рисунок 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Cahn Ingold Prelog для обозначения хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, причем самый высокий атомный номер получает самый высокий приоритет (A на диаграмме выше), а самый низкий атомный номер получает самый низкий приоритет (D на диаграмме выше). Затем самый низкий приоритет указывается в сторону от зрителя, чтобы правильно ориентировать молекулу для дальнейшей оценки.Затем отслеживаются пути приоритетов № 1, № 2 и № 3 (соответствующие A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь против часовой стрелки, ему присваивается S-обозначение.
Изображение из Википедия
Аминокислоты Цвиттер-ионы
В химии, цвиттериона представляет собой молекулу с двумя или более функциональными группами, из которых по меньшей мере одна имеет положительный, а другая имеет отрицательный электрический заряд, а суммарный заряд всей молекулы равен нулю при определенном рН.Поскольку они содержат по меньшей мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренних солей . Заряды на разных функциональных группах уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном рН. Значение pH, при котором это происходит, известно как изоэлектрическая точка .
В отличие от простых амфотерных соединений, которые могут образовывать только или катионных или анионных частиц, цвиттерион одновременно имеет оба ионных состояния.Аминокислоты являются примерами цвиттерионов (рис. 2.6). Эти соединения содержат аммоний и карбоксилатную группу и могут рассматриваться как возникающие в результате своего рода внутримолекулярной кислотно-щелочной реакции: аминогруппа депротонирует карбоновую кислоту.
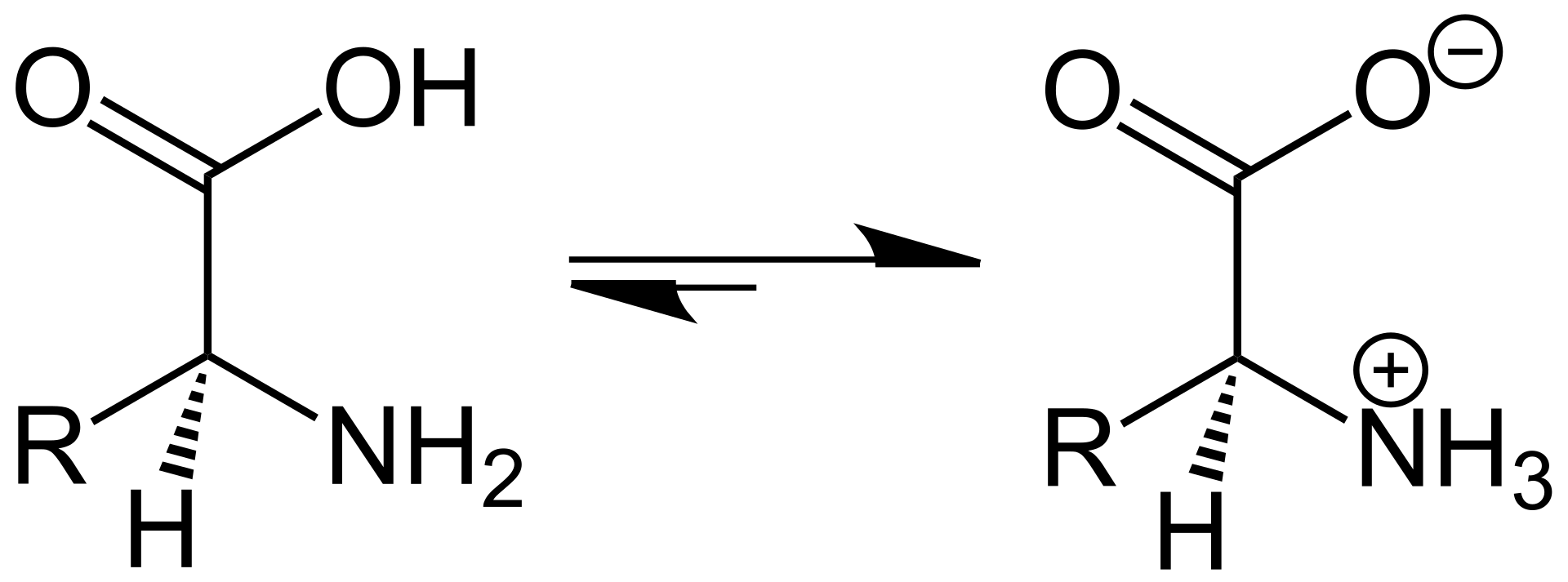
Рисунок 2.6. Аминокислоты — это цвиттерионы. Аминокислота содержит как кислотный (фрагмент карбоновой кислоты), так и основной (аминный фрагмент) центры. Изомер справа является цвиттер-ионной формой.
Поскольку аминокислоты являются цвиттерионами, а некоторые также содержат потенциал для ионизации в своих R-группах, их зарядное состояние in vivo , и, таким образом, их реакционная способность может варьироваться в зависимости от pH, температуры и состояния сольватации локальной микроокружения. в котором они находятся.Диаграмма стандартных pK и значений для аминокислот показана в таблице 2.1 и может использоваться для прогнозирования состояния ионизации / заряда аминокислот и их полученных пептидов / белков. Однако следует отметить, что состояние сольватации в микроокружении аминокислоты может изменять относительные значения 9002 рК и этих функциональных групп и обеспечивать уникальные реакционные свойства в активных центрах ферментов (таблица 2.1). Более глубокое обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Таблица 2.1
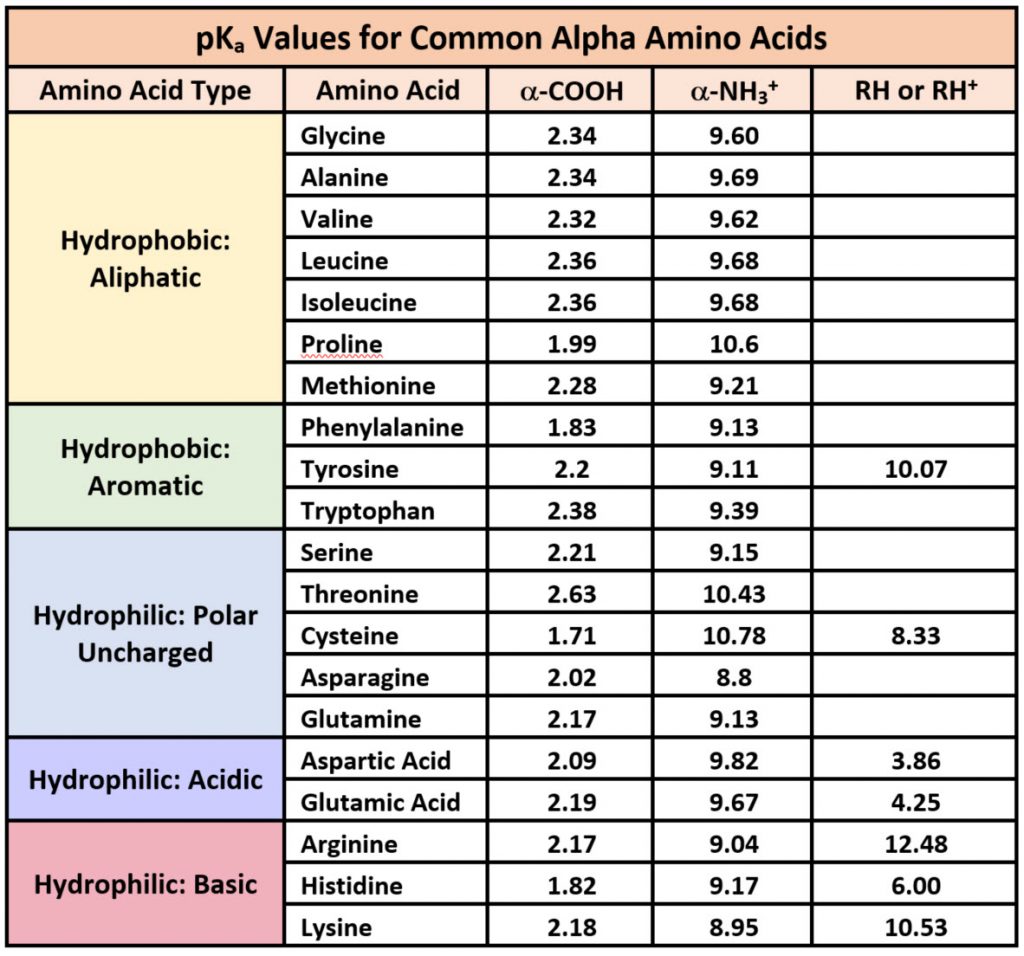
Версия для печати pKa Values
Как видно из таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что рК и определяется как рН, при котором ионизированные и неионизированные формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа смещается выше или ниже своего значения pK на значение , произойдет смещение концентраций ионизированных и неионизированных форм, благоприятствующих одному состоянию по сравнению с другим.На рисунке 2.7 показаны различные R-группы в их неионизированных и ионизированных состояниях, а также их предпочтительные состояния выше или ниже значения pK a .
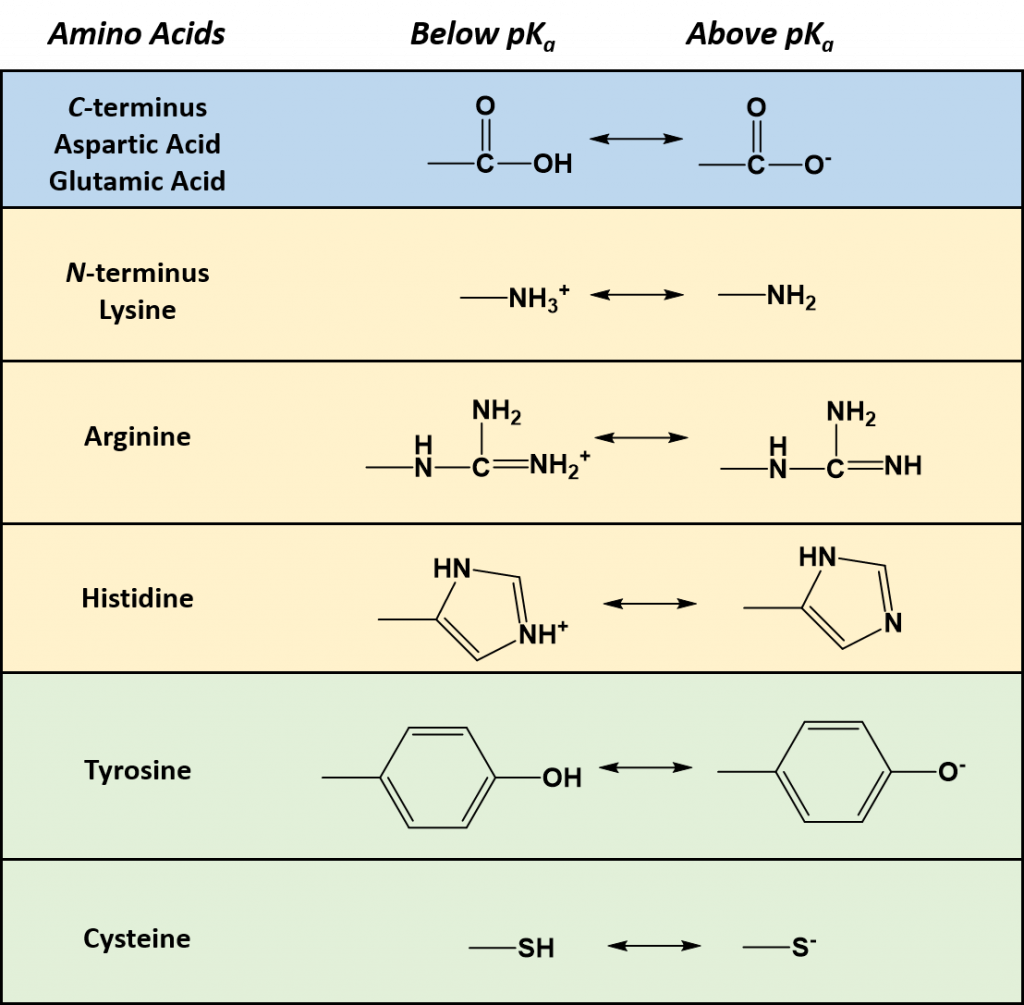
Рисунок 2.7 Ионизируемые функциональные группы в общих аминокислотах. Внутри всех аминокислот и карбоновая кислотная функциональная группа (С-конец), и аминная функциональная группа (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах.Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих значений pK и .
Обычно ионизируемая группа предпочитает протонированное состояние в условиях pH ниже соответствующих значений pK a и предпочитает депротонированное состояние в условиях pH выше соответствующих значений pK a . Таким образом, значения pK и могут использоваться для прогнозирования общего уровня заряда аминокислот и их результирующих пептидов / белков в определенной среде.Например, если мы посмотрим на кривую титрования для основной аминокислоты, гистидина (рис. 2.8). Когда каждый pK и достигнут, зарядное состояние аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком pH (полностью протонированный) до общего заряда -1 при очень высоком pH (полностью депротонированный).
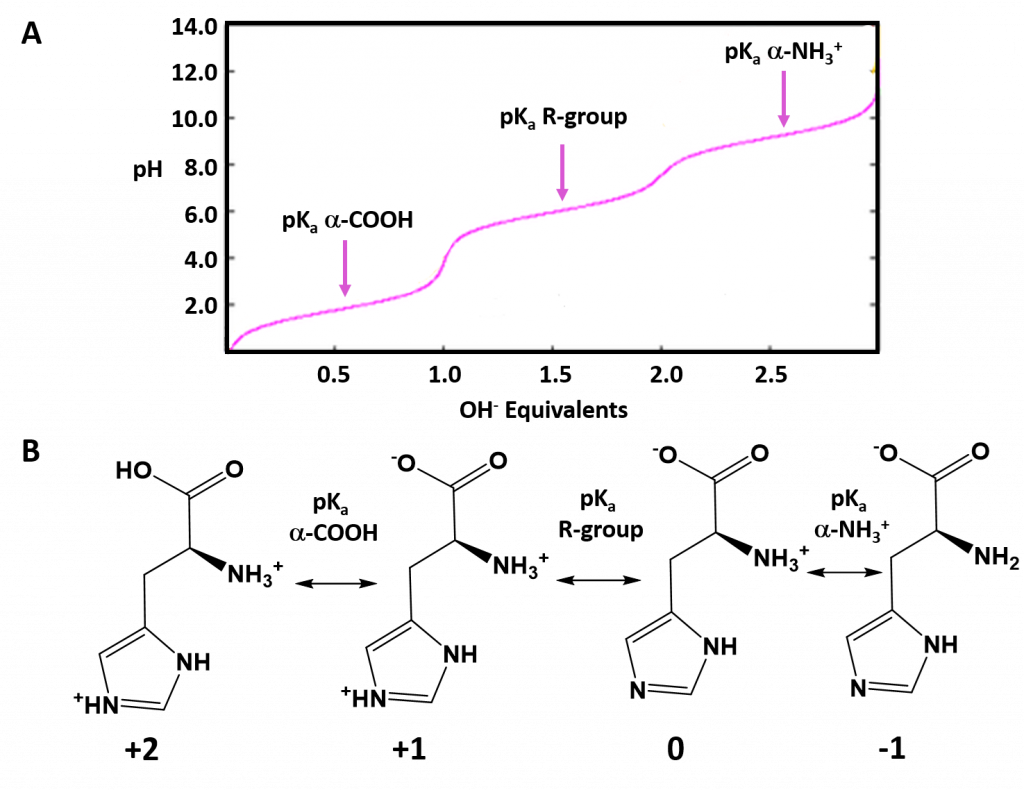
Рисунок 2.8 Ионизационное состояние гистидина в различных средах рН. (A) Кривая титрования гистидина от низкого pH до высокого pH.Каждая точка эквивалентности (pK a ) указывается. (B) Показывает предпочтительное состояние ионизации гистидина после прохождения каждым pK значения .
Изображение адаптировано из Л. Ван Уоррен
Дополнительная практика:
Извлечь глютаминовую кислоту и предсказать общее состояние заряда аминокислоты при pH = 1, pH = 3, pH = 7 и pH = 12.
Образование цистеина и дисульфидной связи
Цистеин также является уникальной аминокислотой, так как эта боковая цепь способна подвергаться обратимой реакции окисления-восстановления ( redox ) с другими остатками цистеина с образованием ковалентной дисульфидной связи в окисленном состоянии (рис. 2.9). Напомним, что когда молекулы окисляются, они теряют электроны, а когда молекулы уменьшаются, они приобретают электроны. Во время биологических окислительно-восстановительных реакций ионы водорода (, , протоны, , ) часто удаляются вместе с электронами из молекулы во время окисления и возвращаются во время восстановления. Таким образом, если реакция приводит к потере или получению протонов, это является хорошим показателем того, что она также теряет или приобретает электроны и что происходит окислительно-восстановительная реакция.Таким образом, выигрыш или потеря протона может быть простым способом идентификации этого типа реакции.
Дисульфидные связи являются неотъемлемой частью формирования трехмерной структуры белков и поэтому могут сильно влиять на функцию получаемого белка. В клеточных системах образование / разрушение дисульфидной связи является фермент-опосредованной реакцией и может использоваться в качестве механизма для контроля активности белка. Дисульфидные связи будут обсуждаться более подробно в разделе 2.xx в этой главе и в главе XX.

Рисунок 2.9 Цистеин может быть окислен с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
вернуться к началу
2.2 Образование пептидной связи и первичная структура белка
В клеточных системах белки связаны друг с другом большим ферментным комплексом, который содержит смесь РНК и белков.Этот комплекс называется , рибосома . Таким образом, поскольку аминокислоты связаны друг с другом, образуя специфический белок, они располагаются в очень специфическом порядке, который определяется генетической информацией, содержащейся в молекуле мессенджер РНК (мРНК). Это специфическое упорядочение аминокислот известно как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно обсуждаться в главе XX.Эта глава будет посвящена только химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов / белков.

Leave A Comment