| Сульфат железа(III) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат железа(III) |
| Традиционные названия | сернокислое железо(III), тетрасульфид(VI) железа(III) |
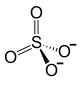
| Химическая формула | Fe2(SО4)3 |
| Эмпирическая формула | Fe2O12S3 |
| Физические свойства | |
| безводный — светло-жёлтый порошок | |
| Молярная масса | (безв.) 399.88 г/моль (пентагидрат) 489.96 г/моль |
| Плотность | (безв.) 3.097 г/см³ (пентагидрат) 1.898 (нонагидрат) 2.1 г/см³ |
| Термические свойства | |
| Температура плавления | (безв.) 480 °C (с разл.) (нонагидрат) 175 °C |
| Температура разложения | 600[1] °C |
| Молярная теплоёмкость (ст. усл.) | 271,75 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −2580 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (безв.) растворим, (нонагидрат) 81,5 г/100 мл |
| Растворимость в остальных веществах | (гидрат) мало растворим в спирте, нерастворим в этаноле (безв.) растворим в разбавленной серной кислоте, ацетоне |
| Классификация | |
| Рег. номер CAS | 10028-22-5 15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2 |
| RTECS | NO8505000 |
| Безопасность | |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Токсичность |   |
Сульфат железа(III) (лат. Ferrum sulfuricum oxydatum, нем. Eisensulfat (oxyd) Ferrisulfat[2]) — неорганическое химическое соединение, соль, химическая формула — .
Физические свойства
Безводный сульфат железа(III) — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 3. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минерал, содержащий в себе смешанный сульфат железа-алюминия называется микасаит (англ.
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее чаще встречающийся среди таковых.
- Паракокимбит (англ. paracoquimbite) — нонагидрат — наоборот — наиболее редко встречающийся минерал в природе.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — так же встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат, малоизученный минерал.
Все перечисленные выше природные гидраты железа являются непрочными соединениями и в открытом состоянии быстро выветриваются.
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: Спирит и Оппортьюнити. Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года марсоход Спирит застрял, когда он ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта[3]. Вследствие того, что сульфат железа имеет очень низкую плотность, то марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммиака и калия, и вода:
Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа(III):
Сульфат железа(II) можно окислить таким экзотическим окислителем, как оксид ксенона(III):
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:
Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при в окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационый регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химическое промышленности как окислитель и катализатор.
См. также
Примечания
Сульфат железа(II), железный купорос, FeSO4 — соль серной кислоты и 2-валентного железа. Твёрдость — 2.
В химии железным купоросом называют кристаллогидрат сульфата железа(II). Кристаллы светло-зелёного цвета. Применяется в текстильной промышленности, в сельском хозяйстве как фунгицид, для приготовления минеральных красок.
Природный аналог — минерал мелантерит; в природе встречается в кристаллах моноклиноэдрической системы, зелёно-жёлтого цвета, в виде примазок или натёков.
Свойства
Сульфат 2-валентного железа выделяется при температурах от 1,82 °C до 56,8 °C из водных растворов в виде светло-зелёных кристаллов кристаллогидрата FeSO4 · 7H2О, который называется в технике железным купоросом. В 100 г воды растворяется: 26,6 г безводного FeSO4 при 20 °C и 54,4 г при 56 °C.
Растворы сульфата железа(II) под действием кислорода воздуха постепенно окисляются, переходя в сульфат железа (III):
При нагревании свыше 480 °C разлагается:
Получение
Железный купорос можно приготовить действием разбавленной серной кислоты на железный лом, обрезки кровельного железа и т. д. В промышленности его получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и др. разбавленной H2SO4.
Другой способ — окислительный обжиг пирита:
Применение
Применяют в производстве чернил, в красильном деле (для окраски шерсти в чёрный цвет), для консервирования дерева.
В медицине используется в качестве лекарственного средства для лечения и профилактики железодефицитной анемии. В России зарегистрирован под торговыми марками «Гемофер пролонгатум», «Тардиферон», а также «Сорбифер Дурулес» и «Ферроплекс» (в двух последних в качестве антиоксиданта добавляется аскорбиновая кислота).
См. также
 Препараты железа (B03A) Препараты железа (B03A) | |
|---|---|
| Пероральные препараты двухвалентного железа | Железа глицин сульфат* • Железа фумарат • Железа глюконат* • Железа карбонат* • Железа хлорид • Железа сукцинат* • Железа сульфат • Железа тартрат* • Железа аспартат* • Железа аскорбат* • Железа йодид* |
| Пероральные препараты трёхвалентного железа | Железа натрия цитрат* • Железа гидроксид сахарозный комплекс • Натрия феределат* • Железа гидроксид* • Железа гидроксид полимальтозат • Железа цитрат* • Железа сульфат-хондроитина комплекс* • Железа ацетил трансферрин* • Железа протеинсукцинилат |
| Парентеральные препараты трёхвалентного железа | Железа гидроксид полимальтозат • Железа гидроксид сахарозный комплекс • Железа сорбитол-лимонной кислоты комплекс* • Железа сорбитол-глюконовой кислоты комплекс* • Железа гидроксид декстран • Железа-натрия глюконат комплекс* |
| Препараты железа в комбинации с фолиевой кислотой | Препараты железа в комбинации с аминокислотами и фолиевой кислотой • Железа фумарат в комбинации с фолиевой кислотой • Железа сульфат в комбинации с фолиевой кислотой • Железа гидроксид полимальтозат в комбинации с фолиевой кислотой* |
| Препараты железа в комбинациях с другими препаратами | Препараты железа в комбинациях с цианокобаламином и фолиевой кислотой • Препараты железа в комбинациях с поливитаминами и фолиевой кислотой • Препараты железа в комбинациях с поливитаминами • Препараты железа в комбинациях с поливитаминами и минеральными веществами |
| * — препарат не зарегистрирован в России | |
Сульфат железа и железный купорос, характеристика, свойства и получение, химические реакции.
Сульфат железа – неорганическое вещество, имеет химическую формулу FeSO4.
Краткая характеристика сульфата железа, железного купороса
Физические свойства сульфата железа, железного купороса
Получение сульфата железа
Химические свойства сульфата железа
Химические реакции сульфата железа и железного купороса
Применение и использование сульфата железа и железного купороса
Краткая характеристика сульфата железа:
Сульфат железа – неорганическое вещество белого или бесцветного цвета.
Химическая формула сульфата железа FeSO4.
Сульфат железа – неорганическое химическое соединение, соль серной кислоты и железа.
Хорошо растворяется в воде, глицерине и этиленгликоле. Растворение сульфата железа проходит со значительным выделением тепла. Сульфат железа гидролизуется и даёт кислую среду.
С водой сульфат железа образует кристаллогидраты: гептагидрат сульфата железа FeSO4·7H2O, именуемый также железный купорос (прозрачные кристаллы светлого голубовато-зелёного цвета), тетрагидрат сульфата железа FeSO4·4H2O (прозрачные кристаллы зелёного цвета), моногидрат сульфата железа FeSO4·H2O.
Очень гигроскопичен.
Сульфат железа негорюч, пожаро- и взрывобезопасен.
В природе сульфат железа встречается в виде минерала мелантерита (FeSO4·7H2O).
Краткая характеристика железного купороса:
Железный купорос – неорганическое вещество светлого голубовато-зелёного цвета.
Химическая формула железного купороса FeSO4·7H2O.
Железный купорос – гептагидрат сульфата железа.
Хорошо растворяется в воде.
На воздухе постепенно выветривается (теряет кристаллизационную воду).
Железный купорос негорюч, пожаро- и взрывобезопасен.
Железный купорос относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.007.
Физические свойства сульфата железа:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4 |
| Синонимы и названия иностранном языке | iron (II) sulfate (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 1898 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 1,898 |
| Температура кипения, °C | — |
| Температура плавления, °C | — |
| Температура разложения, °C | 680 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 151,932 |
| Растворимость в воде (20 oС), г/100 г | 26,3 |
* Примечание:
— нет данных.
Физические свойства железного купороса:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4·7H2O |
| Синонимы и названия иностранном языке | гептагидрат сульфата железа (II) iron (II) sulfate heptahydrate (англ.) железный купорос (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | голубовато-зелёные моноклинные кристаллы |
| Цвет | голубовато-зелёный цвет |
| Вкус | горьковато-металлический вяжущий |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 18 °C), кг/м3 | 1898 |
| Плотность (состояние вещества – твердое вещество, при 18 °C), г/см3 | 1,898 |
| Температура кипения, °C | —* |
| Температура плавления, °C | 64 |
| Температура разложения, °C | 56,8 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 278,01 |
| Растворимость в воде (25 oС), г/100 г | 26,3 |
* Примечание:
— нет данных.
Получение сульфата железа:
В промышленности сульфат железа получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и пр., а также как побочный продукт производства оксида титана из ильменита.
Сульфат железа в промышленности может быть получен путем окислительного обжига пирита (FeS2).
В лаборатории сульфат железа получают в результате следующих химических реакций:
- 1. взаимодействия сульфида железа (II) и кислорода:
FeS + 2O2 → FeSO4.
- 2. взаимодействия сульфида железа (IV) и кислорода:
FeS2 + 2O2 → FeSO4 + SO2.
- 3. взаимодействия сульфата меди и железа:
Fe + CuSO4 → FeSO4 + Cu.
Химические свойства сульфата железа. Химические реакции сульфата железа и кристаллогидратов меди:
Химические свойства сульфата железа аналогичны свойствам сульфатов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция сульфата железа и цинка:
Zn + FeSO4 → ZnSO4 + Fe.
В результате реакции образуются сульфат цинка и железо.
2. реакция сульфата железа и алюминия:
6FeSO4 + 4Al = 2Al2(SO4)3 + 6Fe.
В результате реакции образуются сульфат алюминия и железо.
3. реакция сульфата железа и магния:
FeSO4 + Mg → Fe + MgSO4.
В результате реакции образуются сульфат алюминия и железо.
4. реакция сульфата железа и кальция:
FeSO4 + Ca → CaSO4 + Fe.
В результате реакции образуются сульфат кальция и железо.
5. реакция взаимодействия сульфата железа и кислорода:
12FeSO4 + 3O2 → 4Fe2(SO4)3 + 2Fe2O3.
В результате реакции образуются сульфат железа (III) и оксид железа (III).
6. реакция взаимодействия сульфата железа, кислорода и воды:
4FeSO4 + O2 + 2H2O → 4Fe(OH)SO4.
В результате реакции образуется гидроксосульфат железа (III). Реакция протекает медленно.
7. реакция взаимодействия сульфата железа и гидроксида натрия:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4.
В результате реакции образуются сульфат натрия и гидроксид железа. Реакция протекает в атмосфере азота.
реакция взаимодействия сульфата железа и сульфида натрия:
FeSO4 + Na2S → FeS + Na2SO4.
В результате реакции образуются сульфат натрия и сульфид железа.
реакция взаимодействия сульфата железа и нитрата свинца:
FeSO4 + Pb(NO3)2 → Fe(NO3)2 + PbSO4 (t = 10 °C).
В результате реакции образуются нитрат железа и сульфат свинца. Реакция протекает в атмосфере азота.
реакция взаимодействия сульфата железа и карбоната натрия:
FeSO4 + Na2CO3 → FeCO3 + Na2SO4 (t = 150 °C).
В результате реакции образуются сульфат натрия и карбонат железа.
реакция взаимодействия сульфата железа и фосфата натрия:
3FeSO4 + 2Na3PO4 → Fe3(PO4)2 + 3Na2SO4 (t = 60-80°C).
В результате реакции образуются фосфат железа и сульфат натрия. В ходе реакции используется разбавленный раствор фосфата натрия.
реакция взаимодействия сульфата железа (II) и сульфата меди:
2FeSO4 + CuSO4 → Cu + Fe2(SO4)3.
В результате реакции образуются медь и сульфат железа (III). В ходе реакции используется концентрированный раствор фосфата железа.
реакция термического разложения сульфата железа:
2FeSO4 → Fe2O3 + SO2 + SO3 (t > 480 °C),
4FeSO4 → 2Fe2O3 + 4SO2 + O2 (t = 700°C).
В результате реакции образуются в первом случае – оксид железа (III), оксид серы (IV) и оксид серы (VI), во втором – оксид железа (III), оксид серы (IV) и кислород. В ходе второй реакции также образуется примесь SO3.
реакция термического разложения гептагидрата сульфата железа:
FeSO4•7H2O → FeSO4 + 7H2O (t < 250 °C).
Гептагидрат сульфата железа FeSO4•7H2O разлагается на сульфат железа и воду. Реакция протекает в атмосфере водорода.
Применение и использование сульфата железа и железного купороса:
Сульфат железа и железный купорос используется во множестве отраслей промышленности и для бытовых нужд:
– в медицине в качестве лекарственного средства;
– в производстве чернил;
– в красильном деле железный купорос применятся для окраски шерсти в чёрный цвет;
– для консервирования дерева;
– в сельском хозяйстве применяется как антисептик, фунгицид для опрыскивания садовых деревьев.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
сульфат железа реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата железа
реакции
Коэффициент востребованности 2 674
Сульфат железа(II) — Википедия
Материал из Википедии — свободной энциклопедии
| Сульфат железа | |
| Общие | |
|---|---|
| Систематическое наименование | Железа(II) тетраоксосульфат |
| Традиционные названия | Железный купорос |
| Хим. формула | FeSO4 |
| Рац. формула | O4SFe |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 151,932 (безв.) г/моль |
| Плотность | 1,898 г/см³ |
| Твёрдость | |
| Термические свойства | |
| Мол. теплоёмк. | 100,6[1] Дж/(моль·К) |
| Энтальпия образования | −928,4[1] кДж/моль |
| Химические свойства | |
| Растворимость в воде | 26,3г/100мл при 20°C, 55,3 г/100мл при 63,7°C |
| Классификация | |
| Рег. номер CAS | 7720-78-7 |
| PubChem | 24393 |
| Рег. номер EINECS | 231-753-5 |
| SMILES | |
| InChI | |
| RTECS | NO8500000 |
| ChEBI | 75832 |
| ChemSpider | 22804 |
| Безопасность | |
| ЛД50 | 237 мг/кг |
| Токсичность | среднетоксичен |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфа́т желе́за(II), желе́зо(II) серноки́слое — неорганическое соединение, железная соль серной кислоты с формулой FeSO4. Нелетуч, не имеет запаха. Безводное вещество бесцветное, непрозрачное, очень гигроскопичное. Кристаллогидраты — гигроскопичные прозрачные кристаллы светлого голубовато-зелёного, тетрагидрат FeSO4·4Н2О зелёного цвета (розенит), моногидрат FeSO4·Н2О бесцветный (смольнокит). Вкус сильно-вяжущий железистый (металлический). На воздухе постепенно выветриваются (теряют кристаллизационную воду). Сульфат железа(II) хорошо растворим в воде (26,3 г при 20 °С). Из водных растворов кристаллизуется голубовато-зелёный гептагидрат FeSO4·7Н2О, который носит тривиальное название железный купоро́с. Токсичность железного купороса сравнительно низкая.
Применяется в текстильной промышленности, в сельском хозяйстве как фунгицид, для приготовления минеральных красок.
Природный аналог — минерал мелантерит; в природе встречается в кристаллах моноклинной сингонии, зелёно-жёлтого цвета, в виде примазок или натёков.
Свойства
Сульфат двухвалентного железа выделяется при температурах от 1,82 °C до 56,8 °C из водных растворов в виде светло-зелёных кристаллов кристаллогидрата FeSO4·7H2О, который называется в технике железным купоросом. В 100 г воды растворяется 26,6 г безводного FeSO4 при 20 °C и 54,4 г при 56 °C.
Растворы сульфата железа(II) под действием кислорода воздуха постепенно окисляются, переходя в сульфат железа(III):
- 12 F e S O 4 + 3 O 2 + 6 H 2 O → 4 F e 2 ( S O 4 ) 3 + 4 F e ( O H ) 3 ↓ {\displaystyle {\mathsf {12FeSO_{4}+3O_{2}+6H_{2}O\rightarrow 4Fe_{2}(SO_{4})_{3}+4Fe(OH)_{3}\downarrow }}}
При нагревании свыше 480 °C разлагается:
- 2 F e S O 4 → F e 2 O 3 + S O 2 + S O 3 {\displaystyle {\mathsf {2FeSO_{4}\rightarrow Fe_{2}O_{3}+SO_{2}+SO_{3}}}}
Получение
Железный купорос можно приготовить действием разбавленной серной кислоты на железный лом, обрезки кровельного железа и т. д. В промышленности его получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и др. разбавленной H2SO4.
- F e + H 2 S O 4 → F e S O 4 + H 2 ↑ {\displaystyle {\mathsf {Fe+H_{2}SO_{4}\rightarrow FeSO_{4}+H_{2}\uparrow }}}
Другой способ — окислительный обжиг пирита:
- F e S 2 + 3 O 2 → F e S O 4 + S O 2 {\displaystyle {\mathsf {FeS_{2}+3O_{2}\rightarrow FeSO_{4}+SO_{2}}}}
В промышленности получают как побочный продукт производства оксида титана из ильменита.
Применение
Применяют в производстве чернил, в красильном деле (для окраски шерсти в чёрный цвет), для консервирования дерева.
В медицине используется в качестве лекарственного средства для лечения и профилактики железодефицитной анемии. В России зарегистрирован под торговыми марками «Гемофер пролонгатум», «Тардиферон», а также «Сорбифер Дурулес» и «Ферроплекс» (в двух последних в качестве антиоксиданта добавляется аскорбиновая кислота).
В сельском хозяйстве применяется для опрыскивания садовых деревьев.
Используется в ферросульфатном методе химической дозиметрии.
См. также
Примечания
Ссылки
| B03A | |||
|---|---|---|---|
| B03B | |||
| B03X |
| ||
Препараты железа классически используются в терапии железодефицитных анемий. При этом, чтобы называть препарат железа лекарством, в нём должно содержаться не менее 30 мг железа в пересчёте на элементарное.
Препараты железа делятся по двум основным признакам: валентность железа и состав соли или комплекса:
- Железо может быть двух- (Fe II) и трёхвалентным (Fe III). Во-первых, трёхвалентное железо гидролизуется в верхних отделах тонкого кишечника до малорастворимых гидроксидов, из-за чего хуже всасываются. Во-вторых, трёхвалентное железо для всасывания в любом случае должно восстановиться до двухвалентного (апоферритин энтероцитов кишечника может связываться только с ним). Поэтому препараты двухвалентного железа предпочтительнее.
- Двухвалентное железо может образовывать сульфаты (FeSO4·7h3O — 20 % железа от массы соли), хлориды (FeCl2·4h3O — 28 % железа от массы соли), фумараты (соли фумаровой кислоты — FeC4h5O2 — 33 % железа от массы соли) и другие соли органических кислот. Они имеют отличия, о которых я расскажу ниже.
Ниже я перечислю препараты железа согласно Федеральным клиническим рекомендациям:
- Препараты трёхвалентного железа содержат гидроксиполимальтазный комплекс железа (ГПК), к ним относятся «Мальтофер» и «Феррум-Лек».
- Препараты сульфата железа медленно окисляются до трёхвалентного железа во влажной среде, поэтому их готовят только в виде сухих лекарственных форм. К ним относятся «Актиферрин», «Тардиферон», «Ферроплекс», «Фенюльс». При этом «Актиферрин» изготавливается и в виде капель, но по обозначенным выше причинам его применение спорно.
- Препараты хлорида железа не окисляются во влажной среде, поэтому готовятся в виде жидких лекарственных форм. Однако такое железо может взаимодействовать с сероводородом, образующемся во рту естественной и патологической микрофлорой, и покрывать зубы чёрной плёнкой сульфида железа. Поэтому э
Железо (III), сульфат — Iron(III) sulfate
| имена | |
|---|---|
| название IUPAC Железо (III), сульфат | |
| Другие имена Железа сульфат | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ИКГВ InfoCard | 100.030.054 |
| номер RTECS | NO8505000 |
| UNII | |
| |
| |
| свойства | |
| Fe 2 (SO 4 ) 3 | |
| Молярная масса | 399,88 г / моль (безводный) 489,96 г / моль (пентагидрат) 562.00 г / моль (нонагидрат) |
| Внешность | серовато-белые кристаллы |
| плотность | 3,097 г / см 3 (безводный) 1,898 г / см 3 (пентагидрат) |
| Температура плавления | 480 ° С (896 ° F, 753 К) (безводный) 175 ° С (347 ° F) , (нонагидрата) |
| слабо растворим | |
| Растворимость | умеренно растворим в спирте пренебрежимо мало в ацетоне , этилацетате нерастворимы в серной кислоте , аммиака |
| 1,814 (безводный) 1,552 (нонагидрата) | |
| опасности | |
| NFPA 704 |  |
| Смертельная доза или концентрация ( LD , LC ): | |
| 500 мг / кг (перорально, крыса) | |
| Пределы воздействия здоровья США ( NIOSH ): | |
| REL (рекомендуется) | TWA 1 мг / м 3 |
| Родственные соединения | |
| Железо (III) , хлорид железа (III) нитрат | |
Родственные соединения | Железа (II) сульфат |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
 N проверить ( что ?) N проверить ( что ?)  Y Y N N | |
| ссылки Infobox | |
(III) , сульфат железа (или сульфат железа ), является химическим соединением с формулой Fe 2 (SO 4 ) 3 . Обычно желтый цвет, он представляет собой соль , и растворим в воде. Различные гидраты также известны. Растворы используют при крашении , как протрава , и в качестве коагулянта для промышленных отходов. Он также используется в пигментов, а также в травильные ванны для алюминия и стали.
производство
Как правило, сульфат железа используют в виде раствора, генерируемого из железных отходов. Фактическое видообразование является расплывчатым, но ее применение не требует высокой чистоты материалов.
Железо (III) , сульфат часто генерируется в виде раствора , а не выдел ют в виде твердого вещества. Он производится в больших масштабах путем обработки серной кислоты, горячий раствор сульфата железа , и окислитель . Типичные окисляющие агенты включают хлор , азотную кислоту и перекись водорода .
- 2 FeSO 4 + H 2 SO 4 + Н 2 O 2 → Fe 2 (SO 4 ) 3 + 2 Н 2 О
Природные явления
Mikasaite , смешанный железо-сульфат алюминия химической формулой (Fe 3+ , Al 3+ ) 2 (SO 4 ) 3 является имя минералогической формы железа (III) сульфата. Эта безводная форма встречается очень редко и связана с угольными пожарами. Гидраты являются более распространенными, с coquimbite (наногидрата) , как , вероятно, наиболее часто встречались среди них. Paracoquimbite является другим, редко встречаются естественный нонагидратом. Kornelite (гептагидрат) и quenstedtite (декагидрат) встречаются редко. Lausenite (гекса- или пентагидрат) является сомнительным видом. Все указанные природные гидраты представляют собой неустойчивые соединения , связанные с железосодержащих первичных минералов ( в основном пирита и марказит ) окисление в рудных залежей. В растворах зонах окисления рудных залежей железа (III) , сульфат также является важным окислительным агент .
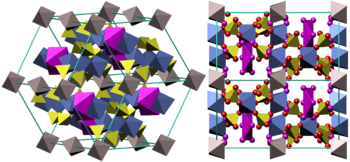 Coquimbite кристаллическая структура
Coquimbite кристаллическая структураСмотрите также
Рекомендации
внешняя ссылка
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Сульфат железа Формула
Формула и структура: Химическая формула сульфата железа FeSO 4 . Как правило, сульфат железа присутствует в природе в основном в виде гидратированных солей; В таблице 1 приведены основные соли сульфата железа. Все сульфаты железа имеют октаэдрическую кристаллическую структуру.
Количество молекул воды | Химическая формула | Молярная масса (г моль -1 ) |
0 → безводная соль | FeSO 4 | 151.908 |
1 → моногидратированная соль | FeSO 4 .H 2 O | 169.+923 |
4 → тетрагидратированная соль | FeSO 4 .4H 2 O | 224.120 |
5 → пентагидратированная соль | FeSO 4 .5H 2 O | 242.135 |
7 → гептагидратированная соль | FeSO 4 .7H 2 O | 278.075 |
Химическая структура безводного сульфата железа может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Возникновение: сульфат железа в основном присутствует в природе в виде гептагидратированной соли. Тем не менее, другие гидратированные соли также встречаются в природе, составляющие некоторые минералы.
. Приготовление: безводный сульфат железа (II) получают по реакции между элементарным железом и серной кислотой с получением сульфата железа (2) и газообразного водорода (реакция I) или путем окисления пирита (реакция II).
Fe + H 2 SO 4 → FeSO 4 + H 2 (реакция I)
2FeS 2 + 7O 2 + 2H 2 O → 2FeSO 4 + 2H 2 SO 4 (реакция II)
Физические свойства: сульфат железа в различных гидратированных состояниях имеет бирюзовый или сине-зеленый цвет, без запаха и кристаллическое твердое вещество. Безводный сульфат железа имеет температуру плавления 680 ºC, однако разлагается при температуре выше 300 ºC. Его плотность равна 1.898 г, мл -1 . Все сульфаты железа растворимы в воде.
Химические свойства: Сульфат железа может терять или приобретать молекулы воды в зависимости от среды. В воде сульфаты железа (II) гидролизуются, образуя водный комплекс [Fe (H 2 O) 6 ] +2 . С другой стороны, эти соли теряют молекулы воды при контакте с воздухом. При влажности окружающей среды соли сульфата железа превращаются в сульфат железа.
Использование: в медицине, сульфат железа является добавкой железа в организме человека.Таким образом, он используется для лечения анемии, а также является источником железа для беременных женщин. В течение многих веков сульфат железа использовался для производства чернил и крашения шерсти / ткани; особенно это использовалось, чтобы получить краситель индиго. Подобно сульфату железа, сульфат железа используется для очистки отходов путем флокуляции.
Воздействие на здоровье / опасности для здоровья: сульфат железа вызывает раздражение дыхательных путей. Имеет низкую токсичность; тем не менее, сульфат железа в чистом виде или в концентрированном растворе очень опасен и может вызвать диарею или даже смерть, повредив кровеносные сосуды.
- Классы
- Класс 1 — 3
- Класс 4 — 5
- Класс 6 — 10
- Класс 11 — 12
- КОНКУРСЫ
- BBS
- 000000000 Книги
- NCERT Книги для 5 класса
- NCERT Книги Класс 6
- NCERT Книги для 7 класса
- NCERT Книги для 8 класса
- NCERT Книги для 9 класса
- NCERT Книги для 10 класса
- NCERT Книги для 11 класса
- NCERT Книги для 12-го класса
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT Exemplar Class 12 9000al Aggar
Agaris Agard Agard Agard Agard Agard 2000 12000000- Классы
- Решения RS Aggarwal класса 10
- Решения RS Aggarwal класса 11
- Решения RS Aggarwal класса 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- Решения класса RD Sharma
- Решения класса 9 Шарма 7 Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- ФИЗИКА
- Механика
- 000000 Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- МАТС
- Теорема Пифагора
- Отношения и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Делительные дроби
- 000 ФОРМУЛЫ
- Математические формулы
- Алгебровые формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- S000
- S0003
- Pегипс Класс 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 11
- Образец образца CBSE pers for Class 12
- CBSE Документ с вопросами о предыдущем году
- CBSE Документы за предыдущий год Class 10
- CBSE Вопросы за предыдущий год Class 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- Решения HC Verma Class 12 Physics
- Решения Lakhmir Singh
- Решения Lakhmir Singh Class 9
- Решения Lakhmir Singh Class 10
- Решения Lakhmir Singh Class 8
- Примечания
- CBSE
- Notes
- CBSE Класс 7 Примечания CBSE
- Класс 8 Примечания CBSE
- Класс 9 Примечания CBSE
- Класс 10 Примечания CBSE
- Класс 11 Примечания CBSE
- Класс 12 Примечания CBSE
- Дополнительные вопросы CBSE 8 класса
- Дополнительные вопросы CBSE 8 по естественным наукам
- CBSE 9 класса Дополнительные вопросы
- CBSE 9 дополнительных вопросов по науке CBSE 9000 Класс 10 Дополнительные вопросы по математике
- Класс 3
- Класс 4
- Класс 5
- Класс 6
- Класс 7
- Класс 8
- Класс 9
- Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для физики класса 11
- Решения NCERT для класса 11 Химия Решения для класса 11 Биология
- NCERT Solutions для Класс 12 Физика
- Решения NCERT для 12 класса Химия
- Решения NCERT для 12 класса Биология
- Решения NCERT для 12 класса Математика
- Решения NCERT Класс 12 Бухгалтерский учет
- Решения NCERT Класс 12 Бизнес исследования
- Решения NCERT Класс 12 Экономика
- NCERT Solutions Class 12 Бухгалтерский учет Часть 1
- NCERT Solutions Class 12 Бухгалтерский учет Часть 2
- NCERT Solutions Class 12 Микроэкономика
- NCERT Solutions Class 12 Коммерция
- NCERT Solutions Class 12 Макроэкономика
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для класса 6 Maths
- Решения NCERT для класса 6 Science
- Решения NCERT для класса 6 Общественные науки
- Решения NCERT для класса 6 Английский
- Решения NCERT для класса 7 Математика
- Решения NCERT для 7 класса Science
- Решения NCERT для 7 класса Общественные науки
- Решения NCERT для 7 класса Английский
- для 8 класса Математика
- Решения NCERT для класса 8 Science
- Решения NCERT для класса 8 Общественные науки
- NCERT Solutio ns для класса 8 Английский
- Решения NCERT для класса 9 Общественные науки
- Решения NCERT для класса 9 Математика Глава 1
- Решения NCERT Для класса 9 Математика 9 класса Глава 2
- Решения NCERT для математики 9 класса Глава 3
- Решения NCERT для математики 9 класса Глава 4
- Решения NCERT для математики 9 класса Глава 5
- Решения NCERT для математики 9 класса Глава 6
- Решения NCERT для Математика 9 класса Глава 7
- Решения NCERT для математики 9 класса Глава 8
- Решения NCERT для математики 9 класса Глава 9
- Решения NCERT для математики 9 класса Глава 10
- Решения NCERT для математики 9 класса Глава 11
- Решения NCERT для Математика 9 класса Глава 12
- Решения NCERT для математики 9 класса Глава 13
- Решения NCERT для математики 9 класса Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки 9 класса Глава 1
Если вам или вашему ребенку прописан сульфат железа, следуйте инструкциям врача о том, как и когда его принимать.
Если вы покупаете сульфат железа в аптеке, следуйте инструкциям, прилагаемым к пакету.
Сульфат железа поступает в виде таблеток по 200 мг или капель, которые вы глотаете.
Капли содержат 125 мг сульфата железа в каждом 1 мл.
Капли могут быть проще для детей и людей, которым трудно глотать таблетки.
Сколько я возьму?
Доза сульфата железа зависит от того, почему вы принимаете его и есть ли у вас таблетки, капсулы или капли.
Для детей в возрасте до 18 лет врач будет использовать данные о возрасте, весе и крови вашего ребенка для определения правильной дозы.
Для лечения анемии
Обычная доза для взрослых:
- таблеток : одна таблетка 200 мг, принимается 2-3 раза в день
- капель : 4 мл, принимается один или два раза в день
Для предотвращения анемии
Обычная доза для взрослых:
- таблеток : одна таблетка 200 мг, принимается один раз в день
- капель : 2.4–4,8 мл в день
Как взять
Сульфат железа работает лучше всего, когда вы принимаете его натощак. Однако, если это расстраивает ваш желудок, вы можете принимать его с едой или после еды.
Врач (или фармацевт) может порекомендовать принимать сульфат железа с апельсиновым соком или добавкой витамина С. Считается, что витамин С увеличивает количество железа, усваиваемого организмом.
Глотать таблетку или капсулу целиком со стаканом воды. Не сосите, не жуйте и не держите таблетку во рту, так как это может вызвать язву во рту или испачкать зубы.
Не принимайте его с чаем, кофе, яйцами, молочными продуктами и соевыми продуктами, так как они могут снизить количество железа, попадающего в вашу систему. Когда вы принимаете сульфат железа (или когда вы едите продукты с высоким содержанием железа), оставьте 2-часовой перерыв перед тем, как принимать эти продукты или напитки.
Если вам трудно глотать таблетки, сообщите об этом своему врачу или фармацевту.
Если вы принимаете сульфат железа в виде капель, он поставляется с пластиковым шприцем или капельницей, чтобы помочь вам отмерить правильную дозу.
Если у вас его нет, попросите его у фармацевта. Не используйте кухонную чайную ложку, поскольку она не даст вам нужного количества лекарства.
Что если я забуду его взять?
Если вы забыли дозу, примите другую, как только вспомните. Если почти пора принять следующую дозу, то не принимайте пропущенную дозу вообще.
Не принимайте двойную дозу, чтобы восполнить забытую дозу.
Если вы часто забываете дозы, это может помочь установить будильник, чтобы напомнить вам.Вы также можете обратиться к своему фармацевту за советом о других способах запоминания лекарства.
Что если я возьму слишком много?
Если вы идете в A & E, не водите себя. Попросите кого-нибудь отвезти вас или вызовите скорую помощь.
Возьмите с собой пакет с сульфатом железа или листовку с собой и все оставшиеся лекарства.
,Сульфат железа | 10028-22-5
Сульфат железа Химические свойства, применение, Производство
Описание
Сульфат железа (сульфат железа) является солью сульфата железа. Он может быть использован в качестве протравы при крашении и в качестве коагулянта для обработки промышленных отходов. В медицинской сфере его можно применять как вяжущее и кровоостанавливающее средство. Это своего рода гемостатический агент, способный контролировать или останавливать кровоток.Также рекомендуется, чтобы сульфат железа был хорошим средством для пульпотомии в молочных зубах с хорошим потенциалом замещения формокрезола. Его также можно использовать в пигментных и травильных ваннах для алюминия и стали. Обычно его получают посредством реакции между сульфатом железа, серной кислотой и окислителем, таким как азотная кислота.Список литературы
Зубулис, А. И., П. А. Мусас и Ф. Василаку. «Сульфат полиферра: приготовление, характеристика и применение в коагуляционных экспериментах.«Журнал опасных материалов 155.3 (2008): 459. Чжан, Ньянронг, Д. Ду и К. Ванг.« Поверхностное окрашивание поведения дубильных экстрактов при окрашивании кожи ». Китайская кожа (2012). Rodríguez-Priego, ME, et. al. «Изменения сульфата железа на первичном дентине и адгезивной поверхности. «Журнал адгезивной стоматологии16.4 (2014): 347-356.» Дан, Э. Фишер. «Сульфат железа как кровоостанавливающее средство». США, US 4551100 A. 1985.
Ли, Санг Хон, М. Н. Ли и С. Х. Ли. «ПРИМАННАЯ ЗУБНАЯ ПУЛЬПОТОМИЯ С ИСПОЛЬЗОВАНИЕМ ЧЕРНОГО СУЛЬФАТА.Журнал Корейской академии детской стоматологии 25.4 (1998): 843-848.
Описание
§184.1307 (a) Сульфат железа (сульфат железа (HI), Fe2 (S04) 3), желтое вещество, которое можно получить окислением сульфата железа (II) или обработкой оксида железа или гидроксида железа серной кислотой.Химические свойства
Желтые кристаллы или серовато-белый порошок. (1) слабо растворим в воде, (2) очень растворим в воде. Хранить в закрытом и защищенном от света месте.Негорючий.Химические свойства
Сульфат железа представляет собой серовато-белый порошок или желтые кусковые кристаллы.Физические свойства
Безводная соль состоит из серовато-белых ромбических кристаллов; гигроскопичен; плотность 3,10 г / см 3 ; слабо растворим в холодной воде; разлагается в горячей воде. Нонагидрат представляет собой желтое гексагональное кристаллическое вещество; показатель преломления 1,54; плотность 2,10 г / см 3 ; твердость 2.5 месяцев разлагается при 400 ° С; очень растворим в воде.Использует
Сульфат железа является питательной и пищевой добавкой, которая является источником железа.Использует
При приготовлении железных квасцов, других солей железа и пигментов; в качестве коагулянта при очистке воды и очистки сточных вод; в травлении алюминия; в травлении нержавеющей стали и меди; как морилка в крашении ткани и печати ситца; в почвенных кондиционерах; в качестве катализатора полимеризации.Определение
Сульфат железа, также известный как ferrisulpas, зеленый коппера, зеленый купорос, сульфат железа и мелантерит, состоит из сине-зеленых моноклинных кристаллов.Растворим в воде и используется в качестве протравы для крашения шерсти в текстильной промышленности. Сульфат железа также используется в качестве дезинфицирующего средства и при производстве чернил.Подготовка
Сульфат железа (III) может быть получен путем окисления сульфата железа (II) перекисью водорода, азотной кислотой или любым другим подходящим окислителем. Реакция проводится в серной кислоте. Сбалансированные молекулярные уравнения для реакций с пероксидом водорода и азотной кислотой:2FeSO 4 + H 2 SO 4 + H 2 O 2 → Fe 2 (SO 4 ) 3 + 2H 2 O
6FeSO 4 + 3H 2 SO 4 + 2HNO 3 → 3Fe 2 (SO 4 ) 3 + 2NO + 4H 2 O
Даже в отсутствие окислителя только концентрированная серная кислота может конвертировать сульфат железа (II) в сульфат железа (III): 2FeSO 4 + 2H 2 SO 4 → Fe 2 (SO 4 ) 3 + SO 2 + 2H 2 O Он также может быть получен путем обработки оксида железа (III) серной кислотой:
Fe 2 O 3 + 3H 2 SO 4 → Fe 2 (SO 4 ) 3 + 3H 2 O
.

Leave A Comment