| ||||||||||||||||||||
| ||||||||||||||||||||
Варианты контрольной работы по теории электролитической диссоциации. Тест.

1. Неэлектролитом является:
А) сульфат алюминия, Б) гидроксид бария,
В) сахар, Г)сероводородная кислота
2. Катионы водорода имеются в растворе:
А) карбоната натрия, Б) сульфата магния, В) серной кислоты, Г) хлорида кальция.
3. Степень диссоциации сульфата алюминия в водном растворе
А) равна 0, Б) от 0 до 100%, В) равна 100%, Г) более 100%.
4.Наибольшее количество хлорид-ионов образуется при диссоциации 1 моль
А) NaClO, Б) KClO3, B) CaCl2, Г) AgCl.
5. Установите соответствие между названием соли и суммой коэффициентов в уравнении электролитической диссоциации этой соли
А)фосфат калия а) 2
Б) хлорид хрома (|||) б) 3
В)сульфид калия в) 4
Г) карбонат натрия г) 5
д) 6
е) 7.
6. Образование осадка происходит при взаимодействии растворов
А) сульфида натрия и сульфата меди (||) Б) сероводорода и гидроксида натрия
В) сульфида натрия и соляной кислоты Г) сероводорода и нитрата калия.
7. Среди предложенных взаимодействий проходит до конца реакция
А) нитрат бария + гидроксид лития Б) азотная кислота + сульфат алюминия
В) хлороводородная кислота+иодид калия Г) оксид цинка + серная кислота
8. Одновременно в растворе могут находиться ионы
А)CO32-, Mg2+, Cl—, Li+ Б) CO32-, Ca2+, OH—, Na+
B) SO42-, Be2+, NO3—, Cr3+ Г) Сl—, Li+, F—, Na+
9. В сокращенном ионном уравнении взаимодействия гидроксида железа (|||) и соляной кислоты сумма коэффициентов равна
А) 3, Б)
6, В) 8, Г) 10.
10. Установите соответствие между реагентами и сокращёнными ионными уравнениями реакций, протекающих в водных растворах
РЕАГЕНТЫ СОКРАЩЕННЫЕ ИОННЫЕ УРАВНЕНИЯ
А) гидроксид железа (|||) и а) ОН— + Н+ = Н2О
соляная кислота; б) Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Б) гидроксид железа (|||) и в) Fe(OH)2 + 2H+ = Fe2+ + 2H2O
азотная кислота
г) Fe(OH)
В) гидроксид бериллия и д) Be(OH)2 + 2H+ = Be2+ + 2H2O
соляная кислота
Г) гидроксид бериллия и
серная кислота.
11. Определите степень окисления серы в соединении SO3
А) +6, Б) — 2, В) + 2, Г) + 1.
12. К окислительно-восстановительным не относится реакция
А) FeCl3 + AgNO3 = Б) 2KNO2 + O2 = В) H2 + O2 = Г) CH4 + O2 =
13.Выберите схему превращений, в которой углерод является окислителем
А) С+2 à C+4 Б) C0 à C -2 B) C -2 à C0 Г) C-4 à C+4 .
14. В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3 , хром проявляет степени окисления соответственно
А) +6, +2, +3. Б) +6, +3, +2, В) +3, +2, +3, Г) +3, +2, +6.
15. Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых
А)N2O5, KNO3;
Б) Li3N, NO2; B) NO2, HNO2;
Г) NH3, N2O3.
1 Слабым электролитом будет являться каждое из двух веществ:
А) нитрат серебра, сульфат цинка; Б) сероводород, азотистая кислота,
В) гидроксид кальция, хлорид калия, Г) гидроксид магния, сульфат алюминия.
2. К неэлектролитам относится каждое из веществ в ряду
A) N2O, K, CO2; Б) Al(NO3)3, HCl, Na2SO4;
B) Ba(OH)2, NH3, SiO2; Г) CaCl2, Cu(OH)2, NO2.
3. Полностью диссоциирует в водном растворе
А) сульфат цинка, Б) этанол, В) сахароза, Г) уксусная кислота.
4 Выберите верную запись правой части уравнения диссоциации нитрата алюминия
А) = 3Al3+ + 2NO3— ; Б) = Al
5 Наибольшее количество анионов образуется при диссоциации 1 моль
А) NaCl, Б) NaClO3 B) CaCl2, Г) FeCl3.
6 C выделением газа протекает реакция между
А) карбонатом натрия и нитратом магния
Б) карбонатом натрия и соляной кислотой,
В) фосфорной кислотой и нитратом магния,
Г) серной кислотой и нитратом бария.
7. Осадок образуется при взаимодействии
А) нитрата меди (||) и сульфида калия,
Б)хлорида кальция и бромида алюминия,
В) фторида цезия и нитрата серебра,
Г) гидроксида бария и иодида лития.
8. Реакция между карбонатом калия и соляной кислотой протекает до конца, потому что образуется
А) газ и вода, Б) осадок, В) вода, Г) комплексная соль.
9. Сокращенному ионному уравнению Ba2+ + SO42- = BaSO4 не соответствует молекулярное
А) BaCl2 + Na2SO4 = BaSO4 + 2NaCl
Б) Ba(OH)2 + K2SO4 = BaSO4 + 2KOH
B) Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
Г) Ba(OH)2 + H2SO4
= BaSO4 + 2H2O.
10. Установите соответствие между реагентами и сокращёнными ионными уравнениями реакций, протекающих в водных растворах
РЕАГЕНТЫ СОКРАЩЕННЫЕ ИОННЫЕ УРАВНЕНИЯ
А) гидроксид кальция и а) CaO + 2HCl = CaCl2 + H2O
соляная кислота б) OH— + H+ = H2O
Б) гидроксид кальция и b) CaO + 2H+ = Ca2+ + H2O
азотная кислота г) 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)3 + 6H2O
В) оксид кальция и д) Ca2+ + SO42- = CaSO4
соляная кислота e) Ca2+ + H2SO4 = CaSO4 + 2H+.
Г)хлорид кальция и
серная кислота
11. В сокращённом
ионном уравнении взаимодействия гидроксида меди (||) и азотной кислотой сумма
коэффициентов равна
В сокращённом
ионном уравнении взаимодействия гидроксида меди (||) и азотной кислотой сумма
коэффициентов равна
А) 6, Б) 8, В) 10, Г) 12.
12. Определите степень окисления азота в соединении N2O
A) + 1, Б) +3, B) +4, Г) + 5.
13. В веществах, формулы которых: Mn2O7, MnCl2, KMnO4 марганец проявляет степень окисления соответственно
А) +6, +2, +3; Б) + 6, + 3, +7; В) +7, +2, +7; Г) +3, +1, +7.
14. Хлор проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых
А) Сl2O7, KClO3; Б) Cl3N, ClO2; B) Cl2O, HClO; Г) HCl, Cl2O.
15. Выберите схему превращений, в которых углерод является восстановителем
А) С+2 à C+4 ; Б) C0 à C -2;
B) C +4 à C +2; Г) С0 à C – 4.
1 Сильными электролитами в водных растворах являются
А) сероводород и хлороводород, Б) сульфат натрия и карбонат калия,
В) угольная кислота, кремниевая кислота, Г) азотистая кислота и азотная кислота.
2. К хорошо растворимым электролитам относится
А) фосфат железа (|||), Б) хлорид серебра, В) карбонат кальция, Г) сульфат меди.
3. В уравнении электролитической диссоциации соли сульфата калия сумма коэффициентов равна
А) 2, Б) 3, В) 4, Г) 5.
4. Выберите верную запись правой части уравнения диссоциации сульфата алюминия
А) = 3Al3+ + 2SO42 —,
Б) = 2Al3+ + 3SO42 —; B) = Al3+ + 3SO42 —; Г) = Al3+ + 2SO42 —.
5. Наибольшее количество анионов образуется при диссоциации
А) СaCO3; Б) Na2SO4; B) H2CO3 Г) Са(NO3)2.
6. Электрический ток проводит
А) раствор брома, Б) раствор сахара,
В) расплав бромида натрия, Г) расплав фосфора.
7. Газ образуется при взаимодействии
А) гидроксид меди + серная кислота,
Б) хлорид меди + серная кислота,
В) сульфат натрия + соляная кислота,
Г) карбонат натрия + соляная кислота.
8. Одновременно в растворе могут находиться ионы
А) CO3 2-, Ca2+, Cl —, Na+; Б) HCO3—, Mg2+, OH —, Li+;
B) S2-, Be2+,
NO3—, Cr3+; Г) Cl —,
Li+, SO42-, Na+.
9. Сульфат калия вступает в реакцию ионного обмена с
А) хлоридом железа(|||),
Б) хлоридом серебра,
В) карбонатом натрия,
Г) нитратом свинца.
10. Взаимодействию гидроксида цинка с серной кислотой соответствует сокращённое ионное уравнение
А) Zn2+ + H2SO4 = Zn(OH)2 + 2Na+;
Б) Zn(OH)2 + 2H+ = Zn2+ + 2H2O;
B) Zn2+ + SO42- = ZnSO4;
Г) Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
11. Определите степень окисления магния в сульфиде MgS
A) +6, Б) — 2, В) +2, Г) +1.
12. В веществах, формулы которых: HClO3, MnCl2, KClO4, хлор проявляет степени окисления соответственно
А) +6, +2,
+3; Б) +6, — 1, +7; В) +3, — 1, +7; Г) +5, — 1, +7.
13. Марганец проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых
А) Mn2O7, KMnO4;
Б) MnCl2, MnO2;
B) MnO, KClO4;
Г) MnCl2, Mn(OH)3.
14. Выберите схему превращения, в которой фосфор является окислителем
А) P+5 à P0, Б) P+3 à P+5; B) P – 3 à P0; Г) P0 à P+5.
15. К окислительно-восстановительным не относится реакция
А) Na + O2 à Na2O2
Б) KMnO4 à K2MnO4 + MnO2 + O2
B) Na2SO3 à Na2SO4 + Na2S
Г) Na2SO3 + HCl à NaCl + SO2 + H2O.
1 Сильным электролитом является
А) СО2,
Б) О2, В) Н2S, Г) H2SO4.
2. Вещества, которые диссоциируют только на катионы металлов и гидроксид-ионы, являются
А) кислотами, Б) щелочами, В) солями, Г) амфотерными гидроксидами.
3. В водном растворе ступенчато будет диссоциировать кислота
А) HNO3, Б) H2SiO3, B) H3PO4, Г) HCl.
4. В уравнении электролитической диссоциации соли сульфата натрия сумма коэффициентов равна
А) 2, Б) 3, В) 4, Г) 5.
5. Выберите верную запись правой части уравнения диссоциации хлорида алюминия
А) = 3Al3+ + 2Cl— ; Б) = Al3+ + 3Cl— ; B) = 3Al3+ + Cl—; Г) = Al3+ + Cl3— .
6. Реакция ионного обмена идет до конца в результате образования нерастворимого в воде вещества при взаимодействии
А) NaOH u MgCl2; Б) NaCl u CuSO4; B) KOH u HNO3; Г) CaCO3 u HCl?
7. Суммы всех коэффициентов
в полном и сокращенном ионных уравнениях реакции нитрата железа (||) с
гидроксидом натрия равны соответственно
Суммы всех коэффициентов
в полном и сокращенном ионных уравнениях реакции нитрата железа (||) с
гидроксидом натрия равны соответственно
А) 10 и 3; Б) 12 и 34; В) 10 и 4; Г) 12 и 4.
8. Сокращённое ионное уравнение Н+ + ОН — = Н2О соответствует взаимодействию
А) Н2 с О2; Б) NaOH c HNO3; B) Cu(OH)2 c HCl; Г) CuO c H2SO4?
9. Реакция ионного обмена протекает до конца при сливании растворов:
А) нитрата натрия и сульфата калия,
Б) сульфата калия и соляной кислоты,
В) хлорида кальция и нитрата серебра,
Г) хлорида калия и сульфата натрия?
10. Уравнению реакции CuCl2 + 2KOH = Cu(OH)2 + 2KCl соответствует сокращенное ионное уравнение
А) СuCl2 + 2OH — = Cu2+ + 2OH — + 2Cl —;
Б) Cu2+ + KOH = K+ + Cu(OH)2;
B) 2Cl — + 2K+ = 2KCl;
Г) Cu2+ + 2OH — = Cu(OH)2
11. . Определите
степень окисления вольфрама в соединении WO3
. Определите
степень окисления вольфрама в соединении WO3
А) +6, Б) — 2, В) + 2, Г) + 1.
12. К окислительно-восстановительным не относится реакция
А) FeCl3 + AgNO3 = Б) 2KNO2 + O2 = В) H2 + O2 = Г) CH4 + O2 =
13. Выберите схему превращений, в которых углерод является восстановителем
А) С+2 à C+4 ; Б) C0 à C -2; B) C +4 à C +2; Г) С0 à C – 4.
14. Частица, входе реакции отдающая электроны, называется
А) восстановителем, Б) окислителем, В) электролитом, Г) неэлектролитом.
15. Реакция, идущая с изменением степеней окисления некоторых элементов, называется
А) реакцией, проходящей до конца,
Б) обратимой реакцией,
В) реакцией ионного обмена,
Г)
окислительно-восстановительной реакцией. {2-}$, а другие утверждают, что сульфат алюминия будет реагировать с водой с образованием гидроксид алюминия и серная кислота.
{2-}$, а другие утверждают, что сульфат алюминия будет реагировать с водой с образованием гидроксид алюминия и серная кислота.
Я даже проводил мини-лабораторию, помещая сульфат алюминия в воду, и иногда выпадал осадок (предположительно гидроксид алюминия), а иногда его не было.
Что происходит на самом деле?
- кислотно-щелочной
- механизм реакции
- экспериментальная химия
$\endgroup$
$\begingroup$
Сульфат алюминия имеет особые свойства и применение. Это правда, что сульфат алюминия растворим в воде и имеет определенные значения растворимости при определенных температурах: 9\circ C}$
Вы заявили, что использовали $12\\mathrm g$ в $100\\mathrm{mL}$, поэтому кажется, что они полностью растворились. Однако в этой ситуации, поскольку он не растворяется в очень большом количестве воды, он не диссоциирует и не образует гидроксид алюминия. Сульфат алюминия можно использовать в очистке воды в небольших количествах, потому что он заставляет примеси группироваться в более крупные частицы, а затем легче оседать на дно контейнера (или отфильтровываться). Твердое вещество, которое вы иногда видите, — это примеси воды, которые сгруппировались и выглядят как осадок. Если вы используете более чистую воду, вы увидите меньше этих нечистых твердых частиц или, возможно, ничего, если вода достаточно чистая (например, если это дистиллированная вода).
Сульфат алюминия можно использовать в очистке воды в небольших количествах, потому что он заставляет примеси группироваться в более крупные частицы, а затем легче оседать на дно контейнера (или отфильтровываться). Твердое вещество, которое вы иногда видите, — это примеси воды, которые сгруппировались и выглядят как осадок. Если вы используете более чистую воду, вы увидите меньше этих нечистых твердых частиц или, возможно, ничего, если вода достаточно чистая (например, если это дистиллированная вода).
$\endgroup$
9
$\begingroup$
Я предполагаю, что вы измеряете 12 мл в колбе. Это очень необычно, потому что сульфат находится в твердой форме, поэтому лучше всего взвесить образец на весах, чтобы определить компонент растворимости, который нужно удерживать в объеме воды.
Предполагается, что плотность квасцов в негидратированной форме составляет 2,572 г на мл, следовательно, у вас есть 32,064 г безводной формы. Растворимость в воде от 31 до 36 г на 100 мл. Вы добавляете в 100 мл воды в лабораторных аналитических условиях. Следовательно, вы приближаетесь слишком близко к спискам растворимости при комнатной температуре.
Растворимость в воде от 31 до 36 г на 100 мл. Вы добавляете в 100 мл воды в лабораторных аналитических условиях. Следовательно, вы приближаетесь слишком близко к спискам растворимости при комнатной температуре.
Другим эффектом, который следует учитывать, является резкое увеличение удельного веса. Объем воды в растворе уменьшится, чтобы компенсировать конечный удельный вес 1,33. Это насытит раствор и выпадет в осадок, чтобы приспособиться к удельному весу и нормальной растворимости раствора при температуре.
Эта таблица поможет вам оценить, как соотношение массы сульфата и объема воды влияет на удельную плотность раствора сульфата алюминия: Ind. Eng. хим. , 1945, 37 (10), 1016–1018
$\endgroup$
$\begingroup$
Сульфат алюминия диссоциирует в воде с образованием ионов. Это правда. Однако большинство катионов с двойным и тройным положительным зарядом очень прочно связывают воду. Сильный положительный заряд делает атомы водорода ассоциированной молекулы воды кислыми, поэтому она легко диссоциирует на катион водорода и гидроксидную группу, связанную с ионом алюминия. Полученная структура может ассоциироваться с другим ионом алюминия, в конечном итоге образуя большую сеть гидроксида алюминия.
Сильный положительный заряд делает атомы водорода ассоциированной молекулы воды кислыми, поэтому она легко диссоциирует на катион водорода и гидроксидную группу, связанную с ионом алюминия. Полученная структура может ассоциироваться с другим ионом алюминия, в конечном итоге образуя большую сеть гидроксида алюминия.
Тем не менее, эта тема избегается в школьной химии для удобства, потому что химия большая, нелогичная и не подчиняется простым правилам.
В общем, можно с уверенностью предположить, что происходит по крайней мере некоторый гидролиз сульфата алюминия, если только речь не идет о сильнокислом растворе. Гидролиз может быть завершен, по крайней мере, для части сульфата алюминия до тех пор, пока не образуется достаточное количество свободной кислоты, чтобы остановить дальнейший гидролиз.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Регистрационное досье — ECHA
Экологическая судьба и пути
Сульфат алюминия это стабилен и имеет высокую температуру плавления 770 ° C. Алюминий сульфат устойчив на воздухе, солнечном свете и к металлам.
Твердый продукт стабилен в течение длительного времени, если хранится в сухом месте и при комнатной температуре. температуры. Законный срок хранения сульфата алюминия составляет 60 месяцев.
Сульфат алюминия не окисляется и не атмосферный не ожидается, что во время транспортировки произойдут преобразования. Если металлические частицы алюминия были выпущены в воздух во время металлического обработки, они будут быстро окисляться. Это не применимо для неорганическое соединение, которое диссоциирует
Сульфат алюминия неорганическое вещество с относительно большим числом атомов кислорода на
молекула, но не атомы водорода или углерода. Нет структурных предупреждений
по окислительному потенциалу вещества.
Нет структурных предупреждений
по окислительному потенциалу вещества.
На воздухе гидраталюминия сульфат будет реагируют с влагой с образованием серной кислоты и оксида алюминия. Поскольку эти сульфаты алюминия обычно не выбрасываются в воздух, количество алюминия, присутствующего в воздухе, было бы ничтожно мало по сравнению с количеством в результате естественной эрозии почвы.
Сульфат алюминия который, как неорганическое соединение, не ожидается ли биоразложения .
Биоразлагаемый материал обычно представляет собой органический материал, такой как растения и вещества животного происхождения и другие вещества, происходящие из живых организмов, или искусственные материалы, достаточно похожие на растительную и животную материю для использования микроорганизмами.
Гидролиз а
химическая реакция, в ходе которой молекулы воды (h3O) расщепляются на
катионы водорода (H+, условно называемые протонами) и
гидроксид-анионы (ОН-) в процессе химического механизма).
При попадании в воду сульфат алюминия гидролизуется до образуют гидроксиды алюминия.
Реакции между сульфатом алюминия, водой и сопутствующими «примесями» приводит к образованию хлопьев, которые отделяются от водной фазы с образованием алюмошлама. Небольшая часть алюминия может оставаться в вода в коллоидной или растворенной форме. Различные реакции участвует в образовании гидроксида алюминия в водной решение было описано; общая реакция может быть представлена следующее уравнение:
Al2(SO4)3+ 6h3O<=>2Al(OH)3 0 + 3х3SO4
Ожидается, что гидроксид алюминия, присутствующий в шламе, останется в основном
твердое вещество после выброса в поверхностные воды. Эксперименты показали, что
высвобождается менее 0,2% гидроксида алюминия, присутствующего в шламе
в надосадочной воде при рН 6 и менее 0,0013% высвобождается при
рН 7,65. В обоих случаях гидроксид алюминия присутствовал в основном в
твердая форма. При этих значениях рН растворимость алюминия низкая и
кинетика способствует образованию твердого гидроксида алюминия.
В обоих случаях гидроксид алюминия присутствовал в основном в
твердая форма. При этих значениях рН растворимость алюминия низкая и
кинетика способствует образованию твердого гидроксида алюминия.
При очистке сточных вод квасцы также вступают в реакцию с фосфатом, т.к. проявляется в следующей реакции:
Al2(SO4)3+ 2PO4 3– <=>AlPO4(тв) + 3SO4 2–
Этот процесс использовался в течение многих лет для обработки фосфора в сточных вод, а также для снижения содержания фосфора в стоке с суши удобряют птичьим пометом и восстанавливают обогащенный фосфором эвтрофный озера .
Алюминий является сильно гидролизующимся металлом и
относительно нерастворим в нейтральном диапазоне pH (6,0–8,0). в
присутствии комплексообразующих лигандов и в кислой (pH < 6) и щелочной
(pH > 8) растворимость алюминия повышается. При низких значениях рН,
растворенный алюминий находится в основном в водной форме (Al3+).
При низких значениях рН,
растворенный алюминий находится в основном в водной форме (Al3+).
Гидролиз происходит по мере повышения pH, в результате чего в ряду менее растворимых гидроксидных комплексов (например, Al(OH)2+, Al(ОН)2+). Минимальная растворимость алюминия составляет около pH 6,5 при 20°C, а затем возрастает по мере того, как анион Al(OH)4–, начинает формироваться при более высоком рН.
Было показано, что температура влияет на
растворимость, гидролиз и молекулярно-массовое распределение водной
формы алюминия, а также pH растворов.
более высокая степень гидролиза алюминия и большая полимеризация до высоких
молекулярной массы в неорганических растворах алюминия, хранящихся в течение одного
месяца при 25°C по сравнению с теми, которые хранились в течение эквивалентного периода при
2°С. Исследователи предположили, что более продвинутая полимеризация
очевидное при более высокой температуре привело к большему депротонированию и
реакции конденсации, что, возможно, объясняет наблюдаемое более низкое значение pH
растворы для испытаний при 25°C (диапазон от 4,83 до 5,07 по сравнению с 5,64 до 5,78 в
растворы при 2°С).
В воде Сульфат алюминия скорее всего быстро исчезнет, из-за его высокой растворимости в воде и нелетучести;
Химическое разложение или фотопревращение под действием света или другая лучистая энергия невозможна, потому что сульфат алюминия как неорганическое соединение не может быть разрушено фотонами.
Сульфат алюминия не разлагает в поверхностных водах и попадает в раствор, не подвергающийся химическому разложению. Ионы алюминия будут остаются в виде ионов алюминия.
При попадании в воду сульфат алюминия гидролизуется с образованием гидроксиды алюминия.
Реакции между сульфатом алюминия, водой и сопутствующими «примесями»
приводит к образованию хлопьев, которые отделяются от водной фазы
с образованием алюмошлама. Небольшая часть алюминия может оставаться в
вода в коллоидной или растворенной форме. Различные реакции
участвует в образовании гидроксида алюминия в водном растворе.
описано; общая реакция может быть представлена следующим
уравнение:
Небольшая часть алюминия может оставаться в
вода в коллоидной или растворенной форме. Различные реакции
участвует в образовании гидроксида алюминия в водном растворе.
описано; общая реакция может быть представлена следующим
уравнение:
Al2(SO4)3+ 6h3O<=> 2Al(OH)3 0+ 3h3SO4
Ожидается, что гидроксид алюминия, присутствующий в шламе, останется в основном твердое вещество после выброса в поверхностные воды. Эксперименты показали, что высвобождается менее 0,2% гидроксида алюминия, присутствующего в шламе в надосадочной воде при рН 6 и менее 0,0013% высвобождается при рН 7,65. В обоих случаях гидроксид алюминия присутствовал в основном в твердая форма. При этих значениях рН растворимость алюминия низкая и кинетика способствует образованию твердого гидроксида алюминия.
При нагревании от 770 до 860°С сульфат алюминия разлагается до
производят оксид алюминия и триоксид серы. Он сочетается с водой
образуя гидратированные соли различного состава
Он сочетается с водой
образуя гидратированные соли различного состава
Al2(SO4) 770–860°C 2Al2O3 + 6SO2 + 3O2
Al2(SO4)3 + 6 NaHCO3 → 3 Na2SO4 + 2 Al(OH)3 + 6 CO2
Уровни фонового кислорода в поверхностных водах также указывают на недостаток значительная деградация.
Сульфат алюминия будет биоаккумулировать в водной и водной среде. наземные виды
Многочисленные полевые и лабораторные исследования показали, что рыба
накапливают алюминий (в виде сульфата алюминия) в жабрах и на них. В нем есть
было высказано предположение, что скорость переноса алюминия (как алюминия
сульфат) в организм рыб либо медленно, либо незначительно при
естественные экологические условия. Первоначальное поглощение алюминия (как
сульфат алюминия) рыбой в основном происходит не на жабрах
поверхности, но преимущественно на слизистом слое жабр.
Рыба может быстро выводить слизь и связанный алюминий после еды. эпизод облучения. Установлено, что очистка алюминия от жабры атлантического лосося ( Salmo salar ) когда-то были очень быстрыми рыбу перевели в чистую воду. Авторы предположили, что быстрая потеря происходит из-за изгнания алюминия, связанного со слизью.
У атлантического лосося (Salmo salar) КБК в стационарном состоянии 76 и 190 были сообщается после 60-дневного воздействия и КБК 362 после 45-дневного воздействия. воздействие алюминия (сульфата алюминия) при pH от 5,6 до 5,8.
КБК 155 также был зарегистрирован у радужной форели (Oncorhynchus mykiss) жаберная ткань после 3-дневного контакта с алюминием (поскольку алюминий сульфат).
Стационарные значения BCF достигают 14 000 в Asellus.
aquaticus после 20-дневного воздействия алюминия (в виде сульфата алюминия).
Однако большая часть накопления происходила за счет пассивной адсорбции
алюминия на кутикулу. Следовательно, эти BCF не являются репрезентативными.
внутренней концентрации алюминия и превышение оценки
накопление у этого вида.
Следовательно, эти BCF не являются репрезентативными.
внутренней концентрации алюминия и превышение оценки
накопление у этого вида.
Сообщалось о устойчивом состоянии BCF 19 000 для ткани кишечника пресноводная улитка Lymnaea stagnalis. Однако кишечник улитки содержит слизь, которая имеет высокое сродство к металлам, таким как алюминий. Слизь может выводиться из организма и может быть основным путем удаления металлов из улиток. Сообщалось, что слизь могла остаться во время анализа кишечника, поэтому этот BCF может завышать накопление алюминия. КБК 155 также было зарегистрировано в радужных жаберная ткань форели (Oncorhynchus mykiss) после 3-дневного воздействия алюминий (в виде сульфата алюминия) у этого вида.
КБК от 0,13 до 0,5 во всем теле для улитки Helix aspersa имеет было сообщено.
КБК для наземных растений рассчитывали на основании данных, приведенных в
обзор Bélanger et al. (1999). Как для лиственных, так и для хвойных
видов, расчетный КБК колебался от 5 до 1300 для листвы и от
От 20 до 79 600 для корней в исследованиях, проведенных с растворами алюминия. Для
проведенные с почвой, КБК были ниже для обеих листьев (0,03–1,3)
и корни (325–3 526). КБК, рассчитанные для зерновых и кормовых культур, варьировались
от 4 до 1260 листов и от 200 до
6000 корней для экспериментов с растворами. Для почвы
В опытах лиственный КБК варьировал от 0,07 до 0,7.
(1999). Как для лиственных, так и для хвойных
видов, расчетный КБК колебался от 5 до 1300 для листвы и от
От 20 до 79 600 для корней в исследованиях, проведенных с растворами алюминия. Для
проведенные с почвой, КБК были ниже для обеих листьев (0,03–1,3)
и корни (325–3 526). КБК, рассчитанные для зерновых и кормовых культур, варьировались
от 4 до 1260 листов и от 200 до
6000 корней для экспериментов с растворами. Для почвы
В опытах лиственный КБК варьировал от 0,07 до 0,7.
Оценка 90 101 BCF, равная 3,16 90 102 л/кг сырой массы, была измерена расчетным путем. из программы EPI SuiteTM v4.0. Это инструменты оценки воздействия и Модели изготовлены из EPA (Агентство по охране окружающей среды).
Результаты программы BCFBAF (v3.00):
===============================
СМАЙЛС: [Al](O)S(=O)(=O)O(=O)S(O(=O))(=O)=OS(O([Al]))(=O)=O
ХИМ : сульфат алюминия
МОЛ ДЛЯ: h5 O12 S3 Al2
Молекулярная масса: 346,17
———————————- БКФБАФ v3. 00
———————————
00
———————————
Итоговые результаты:
Log BCF (оценка на основе регрессии): 0,50 (BCF = 3,16 л/кг сырого веса).
Период полувыведения при биотрансформации (дни): 1,48e-005 (нормализовано до 10 г рыбы).
Log BAF (верхний трофический индекс Арнот-Гобаса): -0,05 (BAF = 0,893 л/кг сырой массы)
Log Kow (экспериментальный): недоступен из базы данных.
Log Kow, используемый в оценках BCF: -7,82.
Уравнение, используемое для оценки BCF:
Лог КБК = 0,50
Исправления: Значение
Поправочные коэффициенты, не используемые для Log Kow < 1
Оценка Log BCF = 0,500 ( BCF = 3,162 л/кг сырой массы)
Расчетный КБК (верхний трофический) в 0,893 л/кг сырой массы был
измерено путем расчета по программе EPI SuiteTM v4. 0. Это экспозиция
Инструменты и модели оценки, созданные EPA (Environmental Protection
агентство).
0. Это экспозиция
Инструменты и модели оценки, созданные EPA (Environmental Protection
агентство).
Итоговые результаты:
Log BCF (оценка на основе регрессии): 0,50 (BCF = 3,16 л/кг сырого веса).
Период полувыведения при биотрансформации (дни): 1,48e-005 (нормализовано до 10 г рыбы).
Log BAF (верхний трофический Арнот-Гобас): -0,05 (BAF = 0,893 л/кг сырой массы)
Log Kow (экспериментальный): недоступен из базы данных.
Log Kow, используемый в оценках BCF: -7,82.
Уравнение, используемое для оценки BCF: Log BCF = 0,50
Исправления: Значение
Поправочные коэффициенты, не используемые для Log Kow < 1
Оценочный Log BCF (верхний трофический) = -0,049 (BCF = 0,893 л/кг сырого веса)
Адсорбция алюминия происходит только в условиях pH
где он гидролизуется
дают различные продукты гидролиза. Прогрессирующий гидролиз приводит к образованию коллоидного гидроксида алюминия.
Прогрессирующий гидролиз приводит к образованию коллоидного гидроксида алюминия.
Ставка на растворимый сульфат алюминия постепенно выщелачивается, зависит при подаче воды. Во влажных регионах верхние слои почвы и горные породы тщательно выщелачиваются, и по мере их формирования растворимые продукты удаляются в дренажную воду. В полузасушливых регионах почвы не полностью выщелочены и растворимые вещества имеют тенденцию накапливать.
При растворении в большом количестве нейтральной или слабощелочной воды сульфат алюминия гидролизуется с образованием гидроксида алюминия осадок (Al(OH)3) и разбавленный раствор серной кислоты и уменьшите pH почвы.
Безводная форма встречается в природе в виде редкого минерала миллосевичита.
найдено напр. в вулканических средах и при сжигании отходов угледобычи
свалки.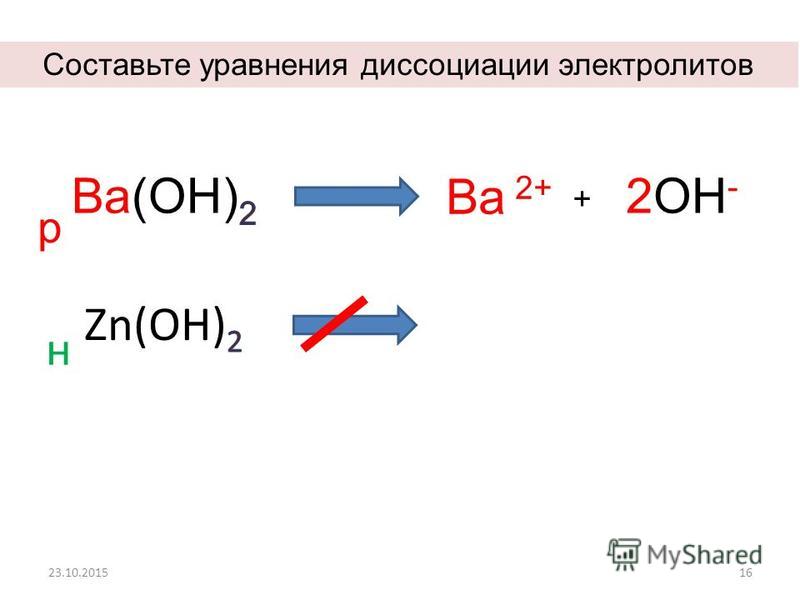 Сульфат алюминия редко, если вообще встречается, в качестве
безводная соль. Он образует ряд различных гидратов, из которых
гексадекагидрат Al 2 (СО 4 ) 3 •16H 2 О
и октадекагидрат Al 2 (SO 4 ) 3 • 18H 2 O
являются наиболее распространенными. Гептадекагидрат, формулу которого можно записать
как [Al(H 2 O) 6 ] 2 (SO 4 ) 3 • 5H 2 O,
встречается в природе в виде минерального алуногена.
Сульфат алюминия редко, если вообще встречается, в качестве
безводная соль. Он образует ряд различных гидратов, из которых
гексадекагидрат Al 2 (СО 4 ) 3 •16H 2 О
и октадекагидрат Al 2 (SO 4 ) 3 • 18H 2 O
являются наиболее распространенными. Гептадекагидрат, формулу которого можно записать
как [Al(H 2 O) 6 ] 2 (SO 4 ) 3 • 5H 2 O,
встречается в природе в виде минерального алуногена.
Приведенная выше информация указывает на то, что сульфат алюминия имеет свойство просачиваться через почву, если вода применяется, т. е. обладает подвижностью в почве и обеспечивает присутствует достаточное количество воды. По мере продвижения вниз в слои, где содержание воды низкое, выщелачивание прекратится.
На этом основании он не имеет высокого
способность к адсорбции почвой, если вода отсутствует и только
часть сульфата алюминия в твердой фазе адсорбируется.
На другом основании при наличии воды сульфат алюминия в виде осадка гидроксида алюминия (Al(OH)3) имеют высокий потенциал адсорбции в почве.
— почва, коллоидная поверхность может поглощать большое количество алюминий
Селективность адсорбции катионов
Сродство большинства катионов к адсорбирующему больше для двухвалентных, чем для одновалентных ионов, а для большие катионы, чем маленькие того же заряда, потому что чем больше катион тем менее гидратирован. Обычная близость:
Al 3+ > Ba 2+ >Sr 2 + >Ca 2+ >Mg 2+ = Cs + >Rb + >K + = NH 4 + >Na +
Почвенные катионы, которые легко поглощаются
на почвенные коллоиды можно разделить на две группы. Во-первых, это база .
катоины, , которые включают
важные питательные вещества для растений Ca 2+ , Mg 2+ , K + и
Na + . Во-вторых, есть катионы кислот , , которые включают Al 3+ и
Н + . С этим различием в катионах связана терминологическая база.
насыщение, которое определяется как доля обменных мест
занимают основные катионы. Почва с высоким насыщением основаниями (больше
более 35%) более плодородна, чем почва с низким насыщением основаниями.
Во-первых, это база .
катоины, , которые включают
важные питательные вещества для растений Ca 2+ , Mg 2+ , K + и
Na + . Во-вторых, есть катионы кислот , , которые включают Al 3+ и
Н + . С этим различием в катионах связана терминологическая база.
насыщение, которое определяется как доля обменных мест
занимают основные катионы. Почва с высоким насыщением основаниями (больше
более 35%) более плодородна, чем почва с низким насыщением основаниями.
Al 3+ , Ca 2+ и H + обычно являются адсорбированный катионов во влажных регионах. Это отражает долгосрочные потери от выщелачивания
основных катионов и замещение их кислотными катионами. Напротив, Ca 2+, Mg 2+ ,
K + и Na + обычно адсорбируются в засушливых условиях.
регионы.
Влияние алюминия на кислотность почвы
По мере выветривания и разрушения глинистых минералов алюминий в октаэдрическом слое выделяется в почвенный раствор, где он либо реагирует с водой, либо составляет адсорбировал на обменные участки отрицательно заряженных глинистых минералов. Al 3+ ионы адсорбируются в большей степени, чем все другие основные катионы. Влияние то, что алюминий оказывает на кислую почву, само зависит от кислотности почва. При pH менее 5 алюминий растворим и существует в виде Al 3+ . Когда Al 3+ попадает в почвенный раствор, он реагирует с водой (это гидролизуется) с образованием ионов H + :
Ал 3+ + Н 2 О <===> AlOH 2+ + H +
При этом повышается кислотность почвы (pH
падает). В почвах с рН от 5 до 6,5 алюминий также
вносит в почвенный раствор H + масел, но разными
механизмы, так как алюминий больше не может существовать в виде ионов Al 3+ , но
превращается в ионы гидроксила алюминия:
В почвах с рН от 5 до 6,5 алюминий также
вносит в почвенный раствор H + масел, но разными
механизмы, так как алюминий больше не может существовать в виде ионов Al 3+ , но
превращается в ионы гидроксила алюминия:
Al 3+ + OH — <===> АлОН 2+
AlOH 2+ +H — <===> Al(OH) 2 +
АЛЮМИНИЙ ГИДРОКСИ-ИОНЫ
Эти гидроксилы алюминия ионы действуют как обменные катионы, как Al 3+ , и адсорбируется глинистыми минералами. Они находятся в равновесии с гидроксилом ионы алюминия в почвенном растворе, где они производят H + ионов по следующим реакциям:
AlOH 2+ +H 2 0 <===> Al(OH) 2 + + H +
Al(OH) 2 + +H 2 0 <===> Al(OH) 3 + + H +
В почвах с рН выше 7 преобладали Ca 2+ и Mg 2+ . обменные центры и большая часть ионов гидроксила алюминия были
превращается в гиббсит (Al(OH) 3 ), нерастворим и не может быть
отрицательными глинистыми минералами как без заряда. В нейтральном грунте
обменные катионы, которые преобладают в центрах катионного обмена, являются
основные катионы, тогда как в кислых почвах ионы алюминия и водорода
доминировать на биржевых площадках.
обменные центры и большая часть ионов гидроксила алюминия были
превращается в гиббсит (Al(OH) 3 ), нерастворим и не может быть
отрицательными глинистыми минералами как без заряда. В нейтральном грунте
обменные катионы, которые преобладают в центрах катионного обмена, являются
основные катионы, тогда как в кислых почвах ионы алюминия и водорода
доминировать на биржевых площадках.
На этом основании при наличии воды сульфат алюминия в виде осадка гидроксида алюминия (Al(OH)3) имеют высокий потенциал адсорбции в почве.
Расчетный коэффициент адсорбции почвы составил 31,82 л/кг, измеренный расчет из EPI SuiteTM v4.0. Это Инструменты оценки воздействия и Модели изготовлены из EPA (Агентство по охране окружающей среды).
Неорганические соединения находятся за пределами области оценки.
Для целей сравнения адсорбции почвы:
Коц оценка из МКИ:
———————
Первый заказ
Индекс молекулярной связности .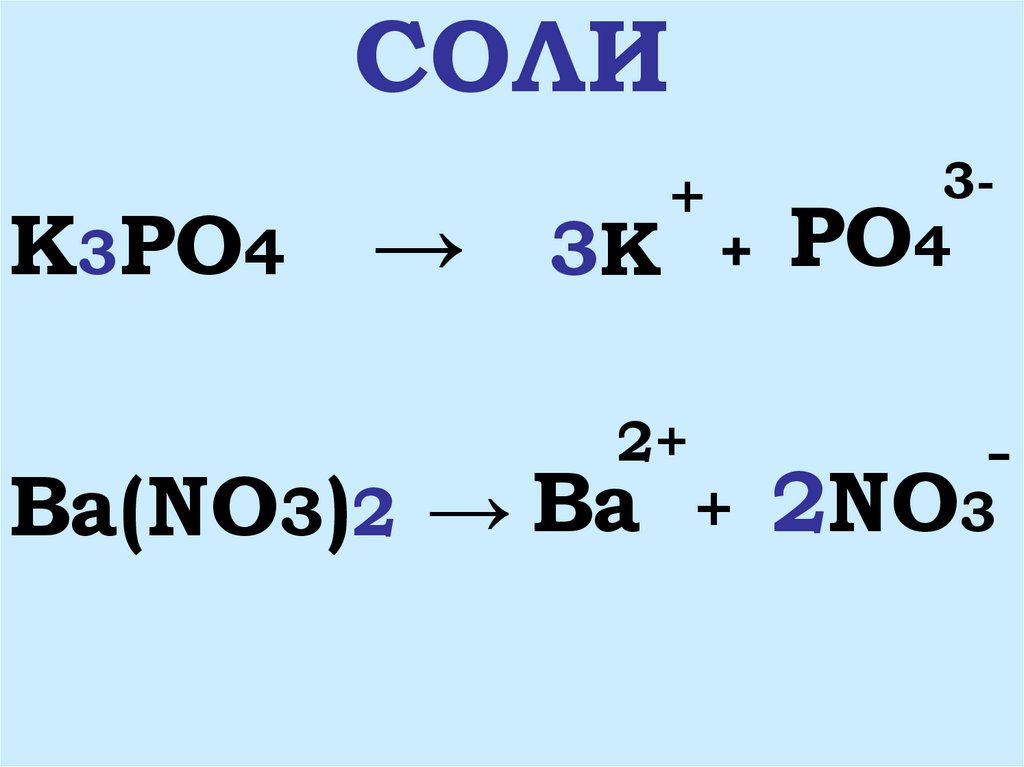

 Запишите уравнения электролитической диссоциации этих веществ.
Запишите уравнения электролитической диссоциации этих веществ. 
Leave A Comment