Кристаллические решетки. Гексагональная тирания Тип кристаллической решетки сухого льда
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.

- Молекулярная кристаллическая решетка.
- кристаллическая решетка.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные . Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки.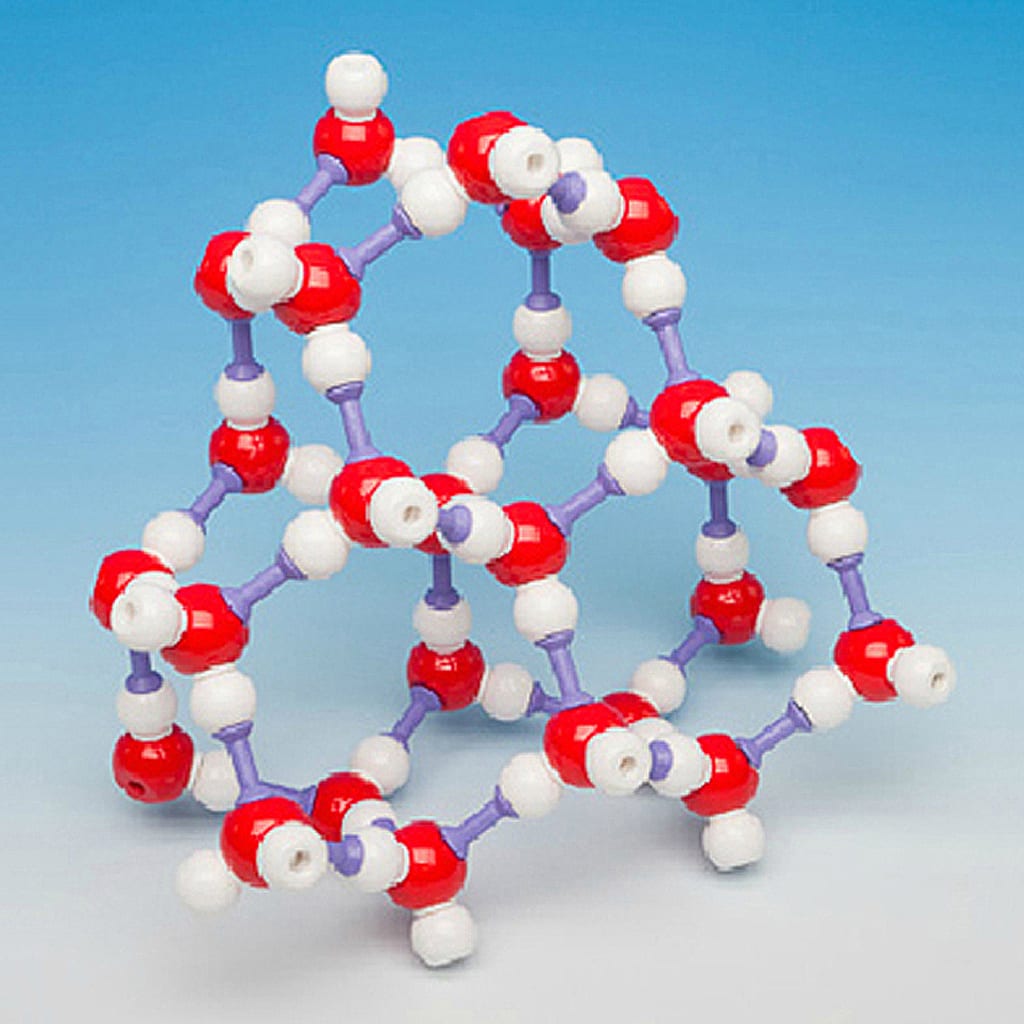
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки.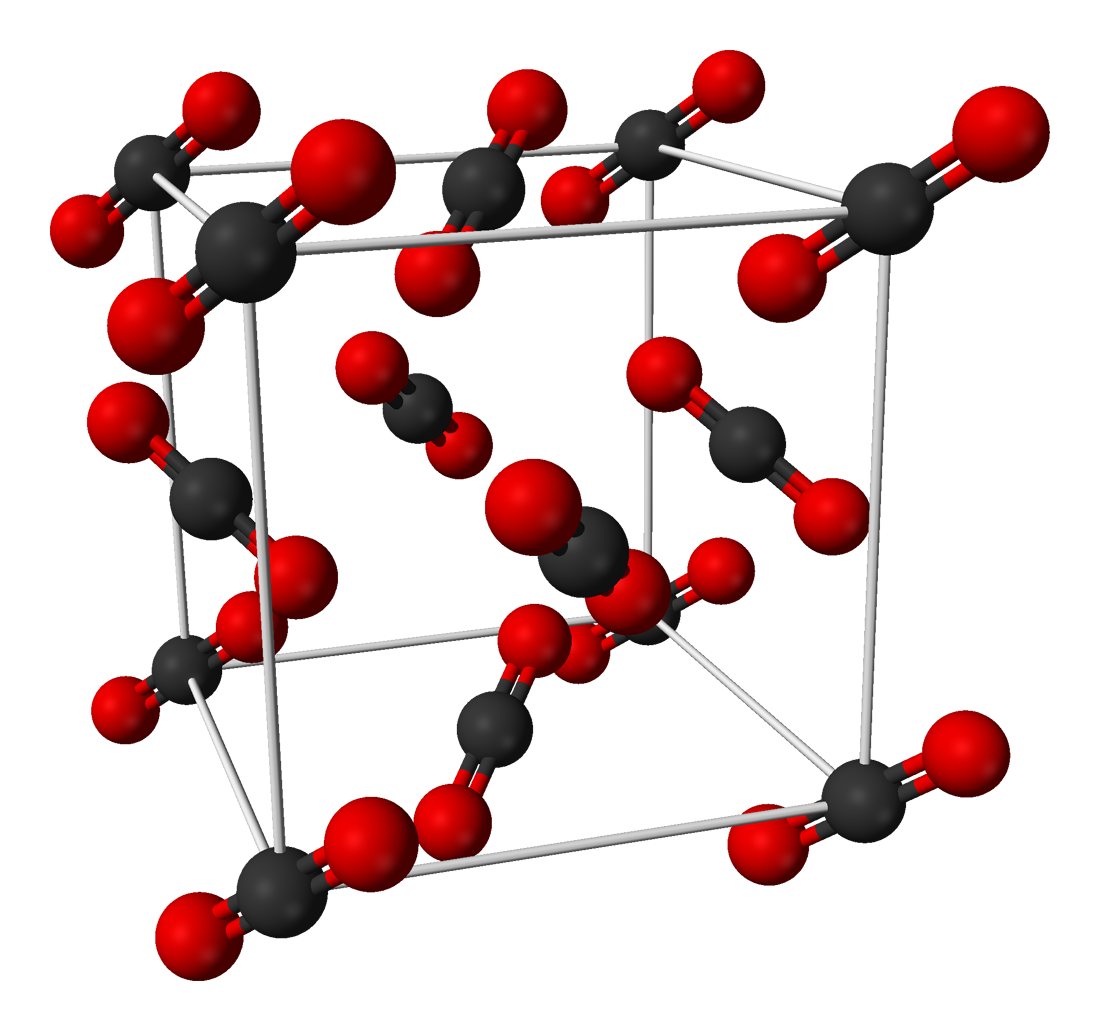
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Вещество, как вам известно, может существовать в трёх агрегатных состояниях: газообразном, жидком и твёрдом (рис. 70). Например, кислород, который при обычных условиях представляет собой газ, при температуре -194 °С превращается в жидкость голубого цвета, а при температуре -218,8 °С затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
Рис. 70.
Агрегатные состояния воды
Твёрдые вещества делят на кристаллические и аморфные.
Аморфные вещества не имеют чёткой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство пластмасс (например, полиэтилен), воск, шоколад, пластилин, различные смолы и жевательные резинки (рис. 71).
К аморфным веществам относится большинство пластмасс (например, полиэтилен), воск, шоколад, пластилин, различные смолы и жевательные резинки (рис. 71).
Рис. 71.
Аморфные вещества и материалы
Кристаллические вещества характеризуются правильным расположением составляющих их частиц в строго определённых точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки.
В узлах воображаемой кристаллической решётки могут находиться одноатомные ионы, атомы, молекулы. Эти частицы совершают колебательные движения. С повышением температуры размах этих колебаний возрастает, что приводит, как правило, к тепловому расширению тел.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические (табл.
Таблица 6
Положение элементов в Периодической системе Д. И. Менделеева и типы кристаллических решёток их простых веществ
Простые вещества, образованные элементами, не представленными в таблице, имеют металлическую решётку.
Ионными называют кристаллические решётки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na + , Cl — , так и сложные , ОН — . Следовательно, ионные кристаллические решётки имеют соли, основания (щёлочи), некоторые оксиды. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решётку в форме куба (рис. 72). Связи между ионами в таком кристалле очень прочны. Поэтому вещества с ионной решёткой обладают сравнительно высокой твёрдостью и прочностью, они тугоплавки и нелетучи.
Рис. 72.
Ионная кристаллическая решётка (хлорид натрия)
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы.
Рис. 73.
Атомная кристаллическая решётка (алмаз)
Такой тип кристаллической решётки имеет алмаз (рис. 73) — одно из аллотропных видоизменений углерода. Огранённые и отшлифованные алмазы называют бриллиантами. Их широко применяют в ювелирном деле (рис. 74).
Рис. 74.
Две императорские короны с алмазами:
а — корона Британской империи; б — Большая императорская корона Российской империи
К веществам с атомной кристаллической решёткой относятся кристаллические бор, кремний и германий, а также сложные вещества, например такие, как кремнезем, кварц, песок, горный хрусталь, в состав которых входит оксид кремния (IV) SiO 2 (рис. 75).
Рис. 75.
Атомная кристаллическая решётка (оксид кремния (IV))
Большинство веществ с атомной кристаллической решёткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С, у кремния — 1415 °С, у кремнезёма — 1728 °С), они прочны и тверды, практически нерастворимы.
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и ковалентными полярными (хлороводород НСl, вода Н 2 0), и ковалентными неполярными (азот N 2 , озон 0 3). Несмотря на то что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решётками имеют малую твёрдость, низкие температуры плавления, летучи.
Примерами веществ с молекулярными кристаллическими решётками являются твёрдая вода — лёд, твёрдый оксид углерода (IV) С) 2 — «сухой лёд» (рис. 76), твёрдые хлороводород НСl и сероводород H 2 S, твёрдые простые вещества, образованные одно- (благородные газы: гелий, неон, аргон, криптон), двух- (водород Н 2 , кислород O 2 , хлор Сl 2 , азот N 2 , иод 1 2), трёх- (озон O 3), четырёх- (белый фосфор Р 4), восьмиатомными (сера S 7) молекулами. Большинство твёрдых органических соединений имеют молекулярные кристаллические решётки (нафталин, глюкоза, сахар).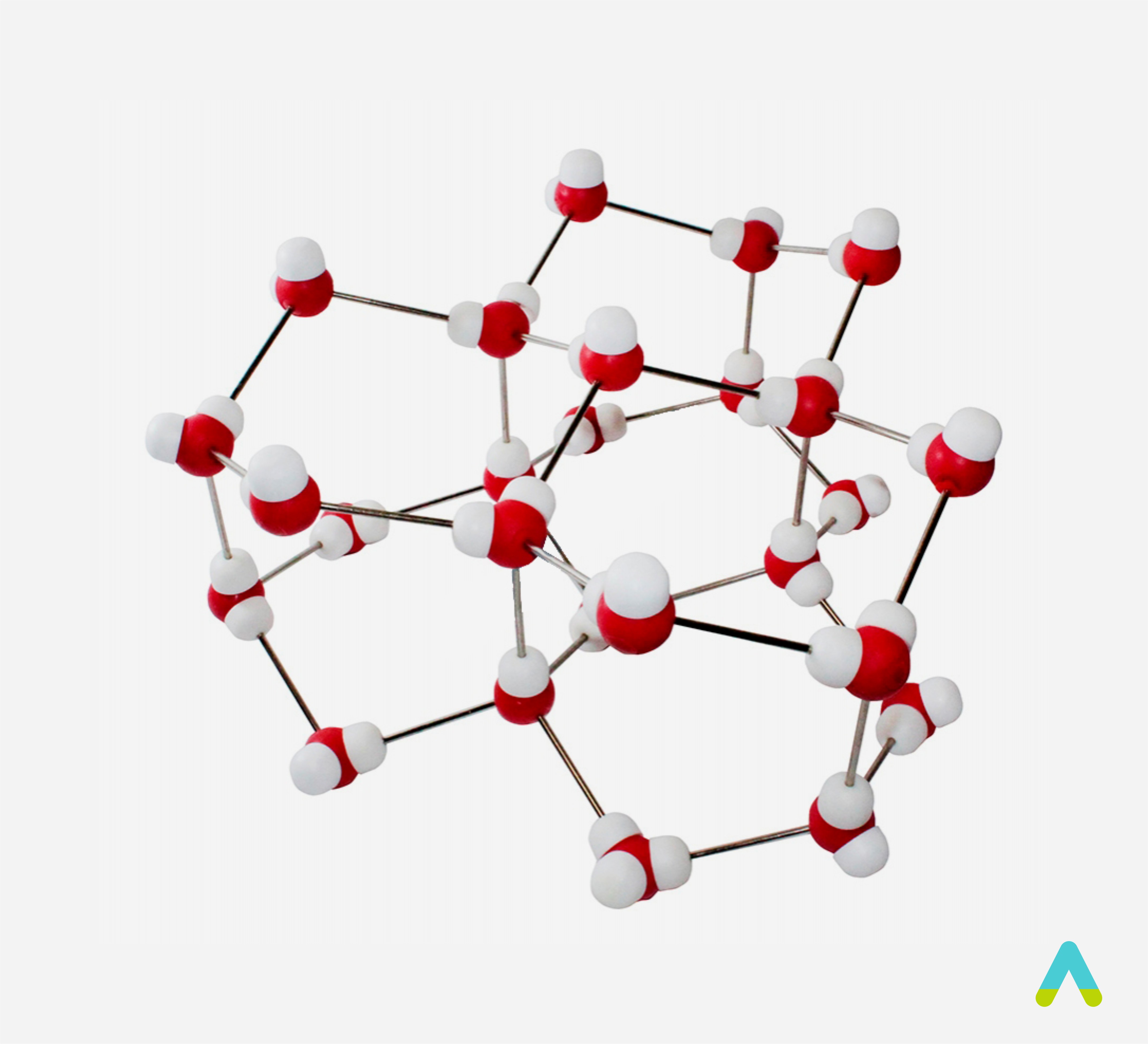
Рис. 76.
Молекулярная кристаллическая решётка (углекислый газ)
Вещества с металлической связью имеют металлические кристаллические решётки (рис. 77). В узлах таких решёток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны в общее пользование). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Рис. 77.
Металлическая кристаллическая решётка (железо)
Лабораторный опыт № 13
Ознакомление с коллекцией веществ с разным типом кристаллической решётки. Изготовление моделей кристаллических решёток
Для веществ, имеющих молекулярное строение, справедлив открытый французским химиком Ж. Л. Прустом (1799-1803) закон постоянства состава. В настоящее время этот закон формулируют так:
Закон Пруста — один из основных законов химии. Однако для веществ немолекулярного строения, например ионного, этот закон не всегда справедлив.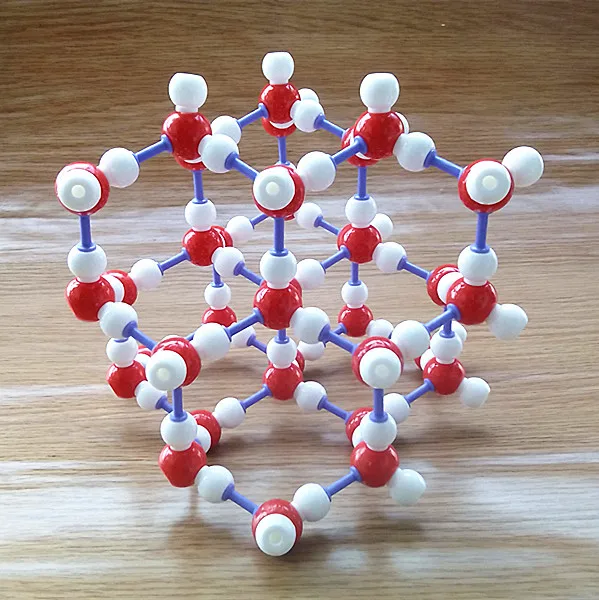
Ключевые слова и словосочетания
- Твёрдое, жидкое и газообразное состояния вещества.
- Твёрдые вещества: аморфные и кристаллические.
- Кристаллические решётки: ионные, атомные, молекулярные и металлические.
- Физические свойства веществ с различными типами кристаллических решёток.
- Закон постоянства состава.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- В каком агрегатном состоянии будет находиться кислород при -205 °С?
- Вспомните произведение А. Беляева «Продавец воздуха» и охарактеризуйте свойства твёрдого кислорода, используя его описание, приведённое в книге.

- К какому типу веществ (кристаллические или аморфные) относятся пластмассы? Какие свойства пластмасс лежат в основе их промышленного применения?
- К какому типу относится кристаллическая решетка алмаза? Перечислите характерные для алмаза физические свойства.
- К какому типу относится кристаллическая решетка иода? Перечислите характерные для иода физические свойства.
- Почему температура плавления металлов изменяется в очень широких пределах? Для подготовки ответа на этот вопрос используйте дополнительную литературу.
- Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? В каком из указанных случаев происходит разрушение химической связи, а в каком — нет? Почему?
Вода — вещество привычное и необычное. Почти 3/4 поверхности нашей
планеты занято океанами и морями. Твёрдой водой — снегом и льдом —
покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают,
что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода.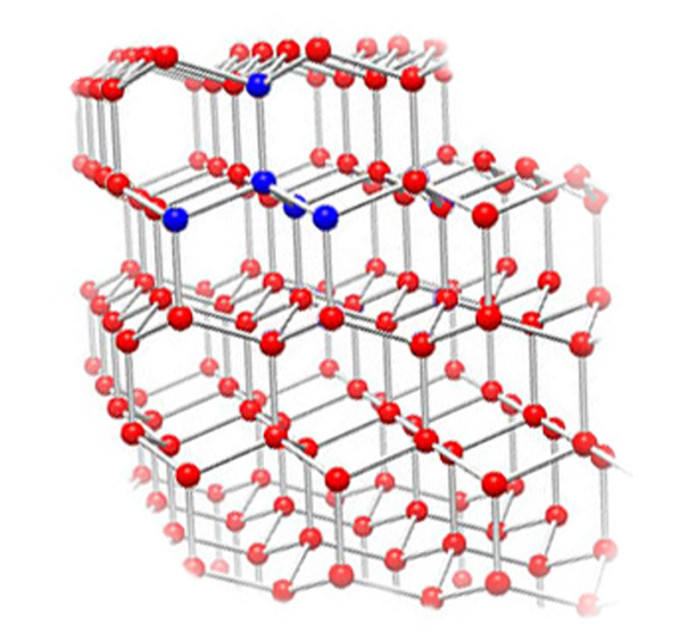 У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло;
остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много
тепла и тем самым «выравнивает» климат. А от космического холода
предохраняет Землю те молекулы воды, которые рассеяны в атмосфере — в
облаках и в виде паров.
У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло;
остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много
тепла и тем самым «выравнивает» климат. А от космического холода
предохраняет Землю те молекулы воды, которые рассеяны в атмосфере — в
облаках и в виде паров.
Вода – самое загадочное вещество в природе после ДНК, обладающее уникальными свойствами, которые не только ещё полностью не объяснены, но далеко не все известны. Чем дольше ее изучают, тем больше находят новых аномалий и загадок в ней. Большинство из этих аномалий, обеспечивающих возможность жизни на Земле, объясняются наличием между молекулами воды водородных связей, которые много сильнее вандерваальсовских сил притяжения между молекулами других веществ, но на порядок величины слабее ионных и ковалентных связей между атомами в молекулах. Такие же водородные связи также присутствуют и в молекуле ДНК.
Молекула воды (H 2 16 O) состоит из двух атомов водорода (H) и одного атома кислорода (16 O).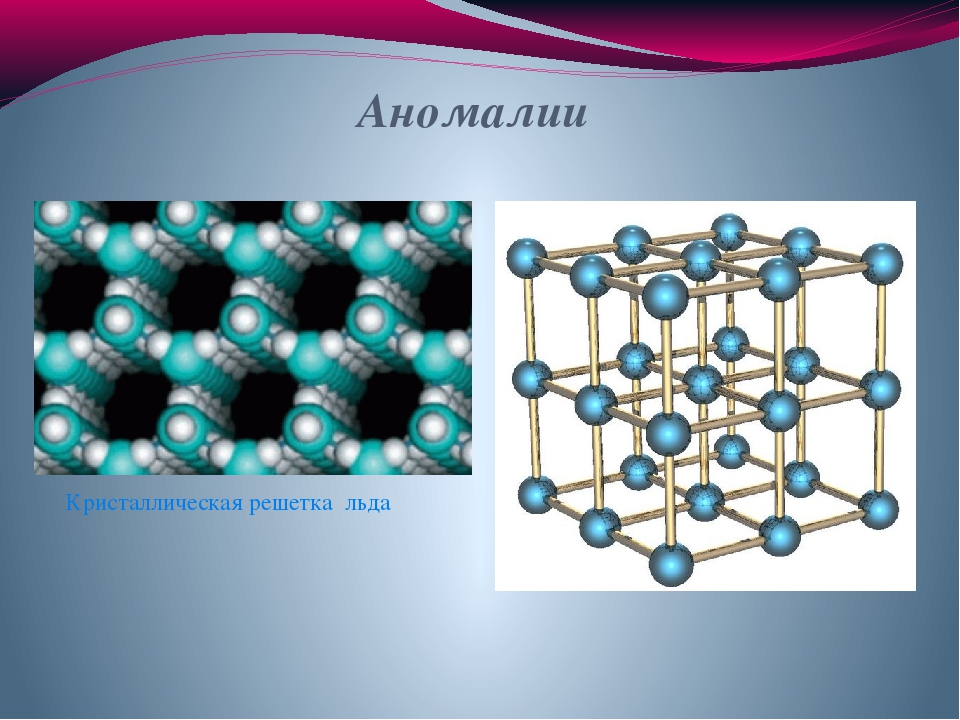 Оказывается, что едва ли не все многообразие свойств воды и необычность
их проявления определяется, в конечном счете, физической природой этих
атомов, способом их объединения в молекулу и группировкой образовавшихся
молекул.
Оказывается, что едва ли не все многообразие свойств воды и необычность
их проявления определяется, в конечном счете, физической природой этих
атомов, способом их объединения в молекулу и группировкой образовавшихся
молекул.
Рис. Строение молекулы воды . Геометрическая схема (а), плоская модель (б) и пространственная электронная структура (в) мономера h3O. Два из четырех электронов внешней оболочки атома кислорода участвуют в создании ковалентных связей с атомами водорода, а два других образуют сильно вытянутые электронные орбиты, плоскость которых перпендикулярна плоскости Н-О-Н.
Молекула воды H 2 O
построена в виде треугольника: угол между двумя связками кислород —
водород 104 градуса. Но поскольку оба водородных атома расположены по
одну сторону от кислорода, электрические заряды в ней
рассредоточиваются. Молекула воды полярная, что является причиной
особого взаимодействия между разными её молекулами. Атомы водорода в
молекуле H 2 O, имея частичный положительный заряд,
взаимодействуют с электронами атомов кислорода соседних молекул.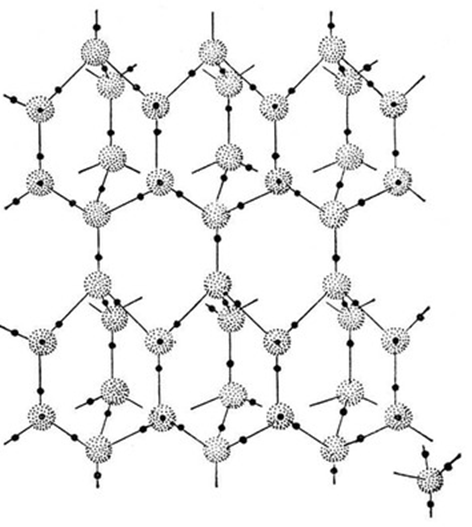 Такая
химическая связь называется водородной. Она объединяет молекулы H 2 O
в своеобразные ассоциаты пространственного строения; плоскость, в
которой расположены водородные связи, перпендикулярны плоскости атомов
той же молекулы H 2 O. Взаимодействием между молекулами воды и
объясняются в первую очередь незакономерно высокие температуры её
плавления и кипения. Нужно подвести дополнительную энергию, чтобы
расшатать, а затем разрушить водородные связи. И энергия эта очень
значительна. Вот почему так велика теплоёмкость воды.
Такая
химическая связь называется водородной. Она объединяет молекулы H 2 O
в своеобразные ассоциаты пространственного строения; плоскость, в
которой расположены водородные связи, перпендикулярны плоскости атомов
той же молекулы H 2 O. Взаимодействием между молекулами воды и
объясняются в первую очередь незакономерно высокие температуры её
плавления и кипения. Нужно подвести дополнительную энергию, чтобы
расшатать, а затем разрушить водородные связи. И энергия эта очень
значительна. Вот почему так велика теплоёмкость воды.
В молекуле воды имеются две полярные ковалентные связи Н–О. Они образованы за счёт перекрывания двух одноэлектронных р — облаков атома кислорода и одноэлектронных S — облаков двух атомов водорода.
В
соответствии с электронным строением атомов водорода и кислорода
молекула воды располагает четырьмя электронными парами. Две из них
участвуют в образовании ковалентных связей с двумя атомами водорода,
т.е. являются связывающими. Две другие электронные пары являются
свободными — не связывающими.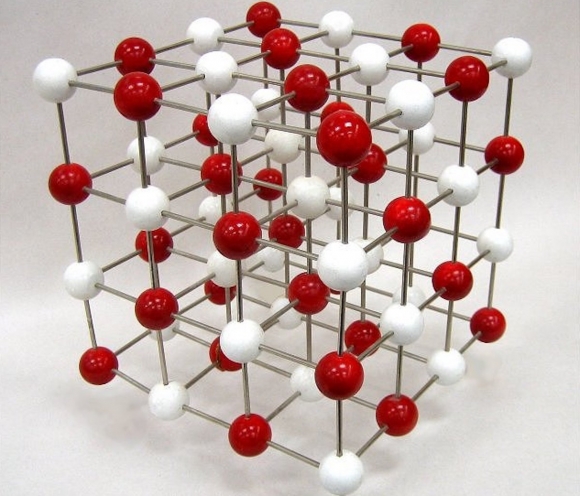 Они образуют электронное облако. Облако
неоднородно – в нем можно различить отдельные сгущения и разрежения.
Они образуют электронное облако. Облако
неоднородно – в нем можно различить отдельные сгущения и разрежения.
В молекуле воды имеются четыре полюс зарядов: два — положительные и два — отрицательные. Положительные заряды сосредоточены у атомов водорода, так как кислород электроотрицательнее водорода. Два отрицательных полюса приходятся на две не связывающие электронные пары кислорода.
У
кислородного ядра создается избыток электронной плотности. Внутренняя
электронная пара кислорода равномерно обрамляет ядро: схематически она
представлена окружностью с центром -ядром O 2- . Четыре внешних
электрона группируются в две электронные пары, тяготеющие к ядру, но
частично не скомпенсированные. Схематически суммарные электронные
орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра –
ядра O 2- . Каждый из оставшихся двух электронов кислорода
образует пару с одним электроном водорода. Эти пары также тяготеют к
кислородному ядру. Поэтому водородные ядра – протоны – оказываются
несколько оголенными, и здесь наблюдается недостаток электронной
плотности.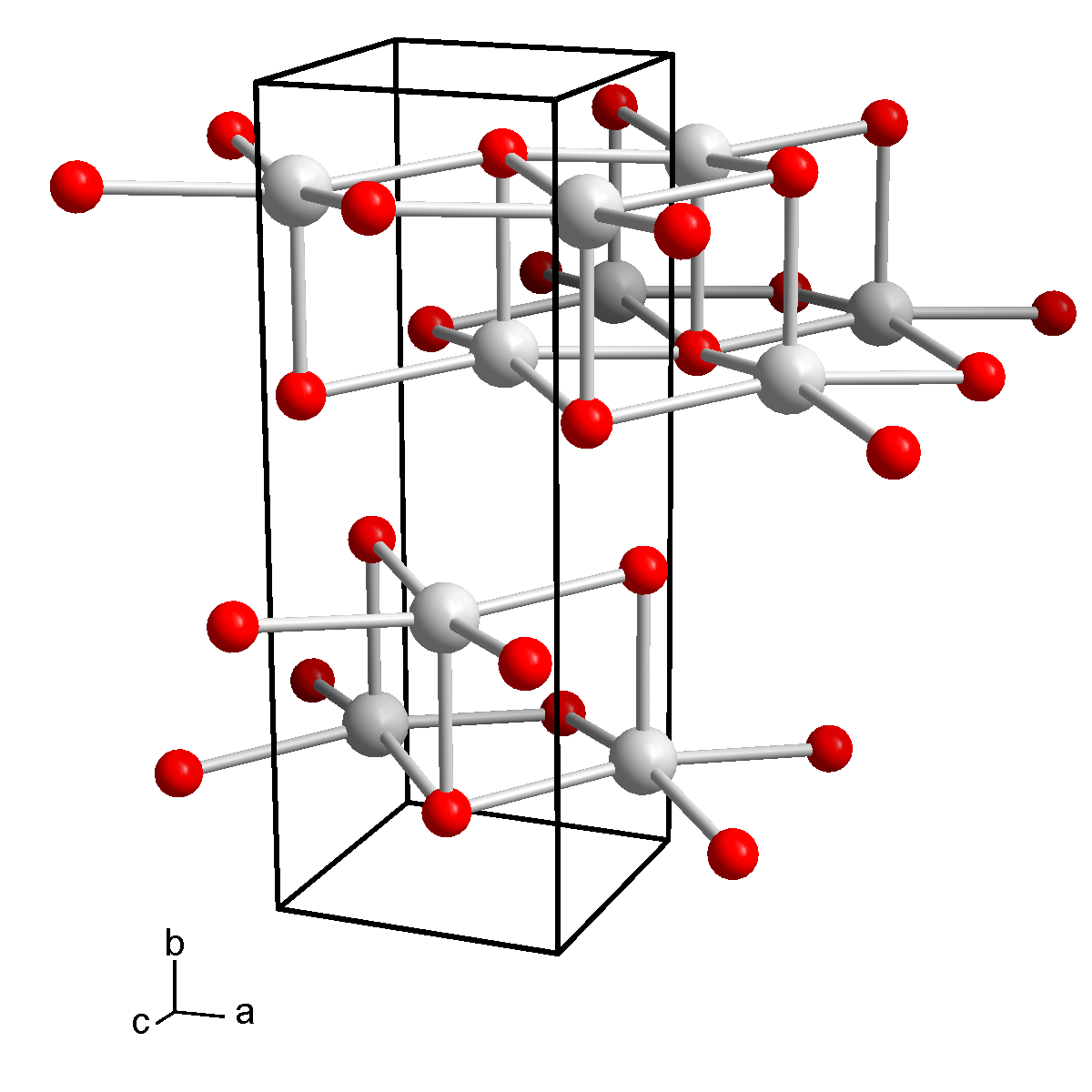
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода.
Рис. Строение молекулы воды: а – угол между связями O-H; б – расположение полюсов заряда; в – внешний вид электронного облака молекулы воды.
Почти
шарообразная молекула воды имеет заметно выраженную полярность, так как
электрические заряды в ней расположены асимметрично. Каждая молекула
воды является миниатюрным диполем с высоким дипольным моментом – 1,87
дебая. Дебай – внесистемная единица электрического дипольного 3,33564·10 30
Кл·м. Под воздействием диполей воды в 80 раз ослабевают межатомные или
межмолекулярные силы на поверхности погруженного в нее вещества. Иначе
говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую
из всех известных нам соединений.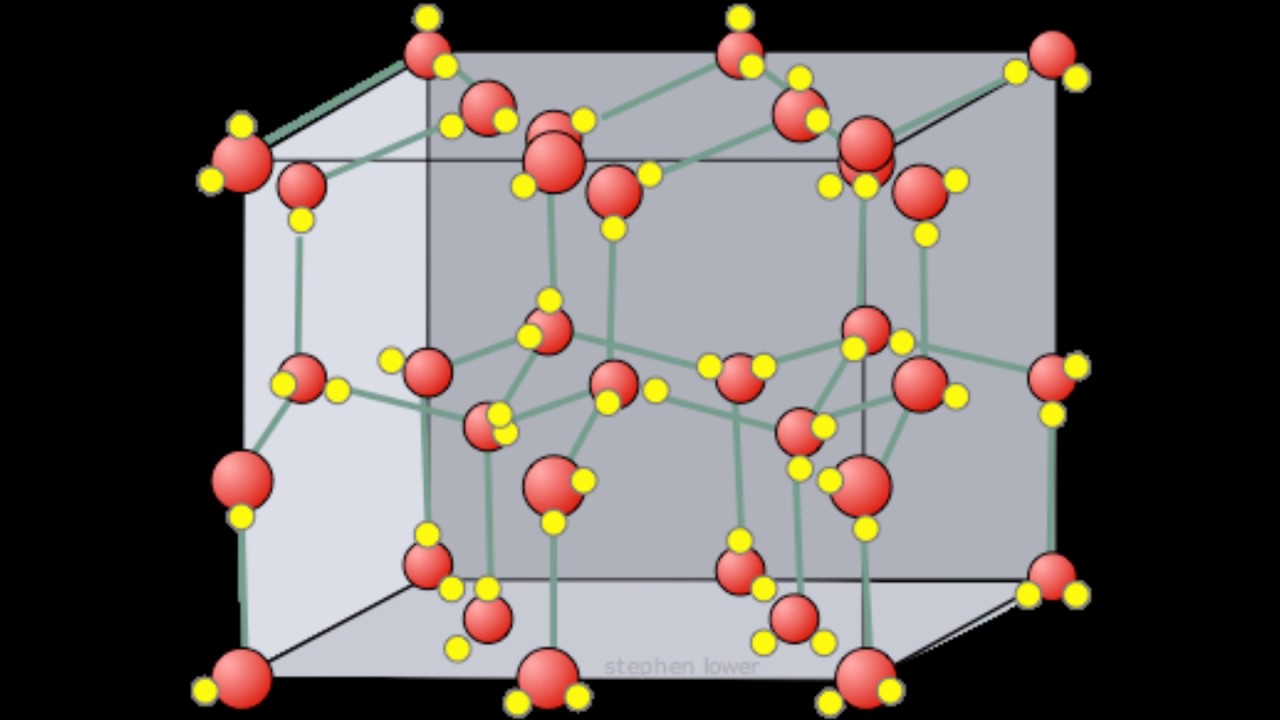
Во многом благодаря этому, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Удельная теплоемкость воды наибольшая среди всех веществ. Кроме того, она в 2 раза выше, чем у льда, в то время как у большинства простых веществ (например, металлов) в процессе плавления теплоемкость практически не изменяется, а у веществ из многоатомных молекул она, как правило, уменьшается при плавлении.
Подобное представление о строении молекулы позволяет объяснить многие свойства воды, в частности структуру льда. В кристаллической решётке льда каждая из молекул окружена четырьмя другими. В плоскостном изображении это можно представить так:
Связь
между молекулами осуществляется посредством атома водорода.
Положительно заряженный атом водорода одной молекулы воды притягивается к
отрицательно заряженному атому кислорода другой молекулы воды. Такая
связь получила название водородной (её обозначают точками). По прочности
водородная связь примерно в 15 — 20 раз слабее ковалентной связи.
Поэтому водородная связь легко разрывается, что наблюдается, например,
при испарении воды.
По прочности
водородная связь примерно в 15 — 20 раз слабее ковалентной связи.
Поэтому водородная связь легко разрывается, что наблюдается, например,
при испарении воды.
Рис. слева — Водородные связи между молекулами воды
Структура жидкой воды напоминает структуру льда. В жидкой воде молекулы также связаны друг с другом посредством водородных связей, однако структура воды менее «жёсткая», чем у льда. Вследствие теплового движения молекул в воде одни водородные связи разрываются, другие образуются.
Рис. Кристаллическая решётка льда. Молекулы воды H 2 O (чёрные шарики) в её узлах расположены так, что каждая имеет четырёх „соседок».
Полярность
молекул воды, наличие в них частично нескомпенсированных электрических
зарядов порождает склонность к группировке молекул в укрупненные
«сообщества» – ассоциаты. Оказывается, полностью соответствует формуле
Н2O лишь вода, находящаяся в парообразном состоянии. Это показали
результаты определения молекулярной массы водяного пара.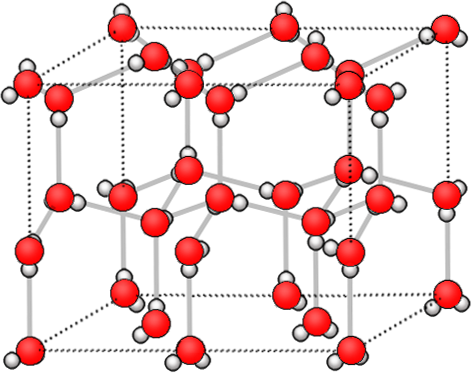 В температурном
интервале от 0 до 100°С концентрация отдельных (мономерных молекул)
жидкой воды не превышает 1%. Все остальные молекулы воды объединены в
ассоциаты различной степени сложности, и их состав описывается общей
формулой (H 2 O)x.
В температурном
интервале от 0 до 100°С концентрация отдельных (мономерных молекул)
жидкой воды не превышает 1%. Все остальные молекулы воды объединены в
ассоциаты различной степени сложности, и их состав описывается общей
формулой (H 2 O)x.
Непосредственной причиной образования ассоциатов являются водородные связи между молекулами воды. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
x·H 2 O↔ (H 2 O) x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдрическую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов.
Большинство
исследователей объясняют аномально высокую теплоемкость жидкой воды тем,
что при плавлении льда его кристаллическая структура разрушается не
сразу. В жидкой воде сохраняются водородные связи между молекулами. В
ней остаются как бы обломки льда — ассоциаты из большого или меньшего
числа молекул воды. Однако в отличие от льда каждый ассоциат существует
недолго. Постоянно происходит разрушение одних и образование других
ассоциатов. При каждом значении температуры в воде устанавливается свое
динамическое равновесие в этом процессе. А при нагревании воды часть
теплоты затрачивается на разрыв водородных связей в ассоциатах. При этом
на разрыв каждой связи расходуется 0,26-0,5 эВ. Этим и объясняется
аномально высокая теплоемкость воды по сравнению с расплавами других
веществ, не образующих водородных связей. При нагревании таких расплавов
энергия расходуется только на сообщение тепловых движений их атомам или
молекулам. Водородные связи между молекулами воды полностью разрываются
только при переходе воды в пар. На правильность такой точки зрения
указывает и то обстоятельство, что удельная теплоемкость водяного пара
при 100°С практически совпадает с удельной теплоемкостью льда при 0°С.
В жидкой воде сохраняются водородные связи между молекулами. В
ней остаются как бы обломки льда — ассоциаты из большого или меньшего
числа молекул воды. Однако в отличие от льда каждый ассоциат существует
недолго. Постоянно происходит разрушение одних и образование других
ассоциатов. При каждом значении температуры в воде устанавливается свое
динамическое равновесие в этом процессе. А при нагревании воды часть
теплоты затрачивается на разрыв водородных связей в ассоциатах. При этом
на разрыв каждой связи расходуется 0,26-0,5 эВ. Этим и объясняется
аномально высокая теплоемкость воды по сравнению с расплавами других
веществ, не образующих водородных связей. При нагревании таких расплавов
энергия расходуется только на сообщение тепловых движений их атомам или
молекулам. Водородные связи между молекулами воды полностью разрываются
только при переходе воды в пар. На правильность такой точки зрения
указывает и то обстоятельство, что удельная теплоемкость водяного пара
при 100°С практически совпадает с удельной теплоемкостью льда при 0°С.
Рисунок ниже:
Элементарным структурным элементом ассоциата является кластер: Рис. Отдельный гипотетический кластер воды. Отдельные кластеры образуют ассоциаты молекул воды (H 2 O) x: Рис. Кластеры из молекул воды образуют ассоциаты.
Существует и другая точка зрения на природу аномально высокой теплоемкости воды. Профессор Г. Н. Зацепина заметила, что молярная теплоемкость воды, составляющая 18 кал/(мольград), точно равна теоретической молярной теплоемкости твердого тела с трехатомными кристаллами. А в соответствии с законом Дюлонга и Пти атомные теплоемкости всех химически простых (одноатомных) кристаллических тел при достаточно высокой температуре одинаковы и равны 6 калДмоль o град). А для трехатомных, в граммоле которых содержится 3 N а узлов кристаллической решетки, — в 3 раза больше. (Здесь N а — число Авогадро).
Отсюда следует, что вода является как бы кристаллическим телом, состоящим из трехатомных молекул Н 2 0. Это соответствует распространенному представлению о воде как смеси
кристаллоподобных ассоциатов с небольшой примесью свободных молекул H 2 O
воды между ними, число которых растет с повышением температуры. С этой
точки зрения вызывает удивление не высокая теплоемкость жидкой воды, а
низкая твердого льда. Уменьшение удельной теплоемкости воды при
замерзании объясняется отсутствием поперечных тепловых колебаний атомов в
жесткой кристаллической решетке льда, где у каждого протона,
обуславливающего водородную связь, остается только одна степень свободы
для тепловых колебаний вместо трех.
Это соответствует распространенному представлению о воде как смеси
кристаллоподобных ассоциатов с небольшой примесью свободных молекул H 2 O
воды между ними, число которых растет с повышением температуры. С этой
точки зрения вызывает удивление не высокая теплоемкость жидкой воды, а
низкая твердого льда. Уменьшение удельной теплоемкости воды при
замерзании объясняется отсутствием поперечных тепловых колебаний атомов в
жесткой кристаллической решетке льда, где у каждого протона,
обуславливающего водородную связь, остается только одна степень свободы
для тепловых колебаний вместо трех.
Но за счет чего и как могут происходить столь большие изменения теплоемкости воды без соответствующих изменений давления? Чтобы ответить на этот вопрос, познакомимся с гипотезой кандидата геолого-минералогических наук Ю. А. Колясникова о структуре воды.
Он указывает, что еще первооткрыватели водородных связей Дж. Бернал и
Р. Фаулер в 1932 г. сравнивали структуру жидкой воды с кристаллической
структурой кварца, а те ассоциаты, о которых говорилось выше, — это в
основном тетрамеры 4Н 2 0, в которых четыре молекулы воды
соединены в компактный тетраэдр с двенадцатью внутренними водородными
связями.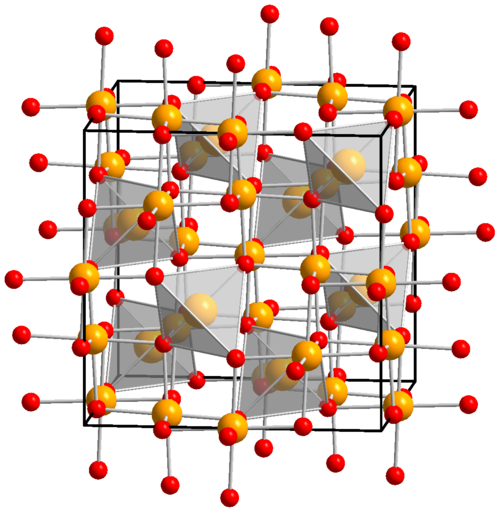 В результате образуется четырёхгранная пирамида — тетраэдр.
В результате образуется четырёхгранная пирамида — тетраэдр.
При этом, водородные связи в этих тетрамерах могут образовывать как право- так и левовинтовую последовательности, подобно тому, как кристаллы широко распространённого кварца (Si0 2), тоже имеющие тетраэдрическую структуру, бывают право- и лево-вращательной кристаллической форм. Поскольку каждый такой тетрамер воды имеет еще и четыре незадействованные внешние водородные связи (как у одной молекулы воды), то тетрамеры могут соединяться этими внешними связями в своего рода полимерные цепочки, наподобие молекулы ДНК. А поскольку внешних связей всего четыре, а внутренних — в 3 раза больше, то это позволяет тяжелым и прочным тетрамерам в жидкой воде изгибать, поворачивать и даже надламывать эти ослабленные тепловыми колебаниями внешние водородные связи. Это и обуславливает текучесть воды.
Такую структуру
вода, по мнению Колясникова, имеет только в жидком состоянии и,
возможно, частично в парообразном. А вот во льду, кристаллическая
структура, которого хорошо изучена, тетрагидроли соединены между собой
негибкими равнопрочными прямыми водородными связями в ажурный каркас с
большими пустотами в нем, что делает плотность льда меньше плотности
воды.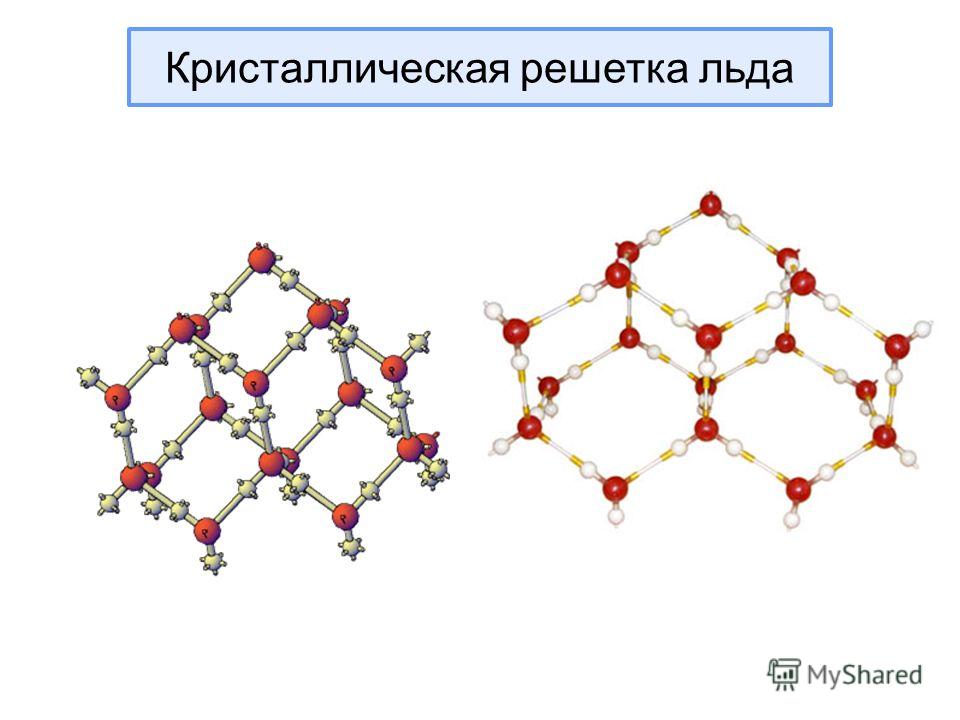
Рис. Кристаллическая структура льда: молекулы воды соединены в правильные шестиугольники
Когда же лед тает, часть водородных связей в нем ослабевает и изгибается, что ведет к перестройке структуры в вышеописанные тетрамеры и делает жидкую воду более плотной, чем лед. При 4°С наступает состояние, когда все водородные связи между тетрамерами максимально изогнуты, чем и обуславливается максимум плотности воды при этой температуре. Дальше связям гнуться некуда.
При температуре выше 4°С начинается
разрывание отдельных связей между тетрамерами, и при 36-37°С оказывается
разорвана половина внешних водородных связей. Это и определяет минимум
на кривой зависимости удельной теплоемкости воды от температуры. При
температуре же 70°С разорваны уже почти все межтетрамерные связи, и
наряду со свободными тетрамерами в воде остаются только короткие обрывки
«полимерных» цепочек из них. Наконец при кипении воды происходит
окончательный разрыв теперь уже одиночных тетрамеров на отдельные
молекулы Н 2 0.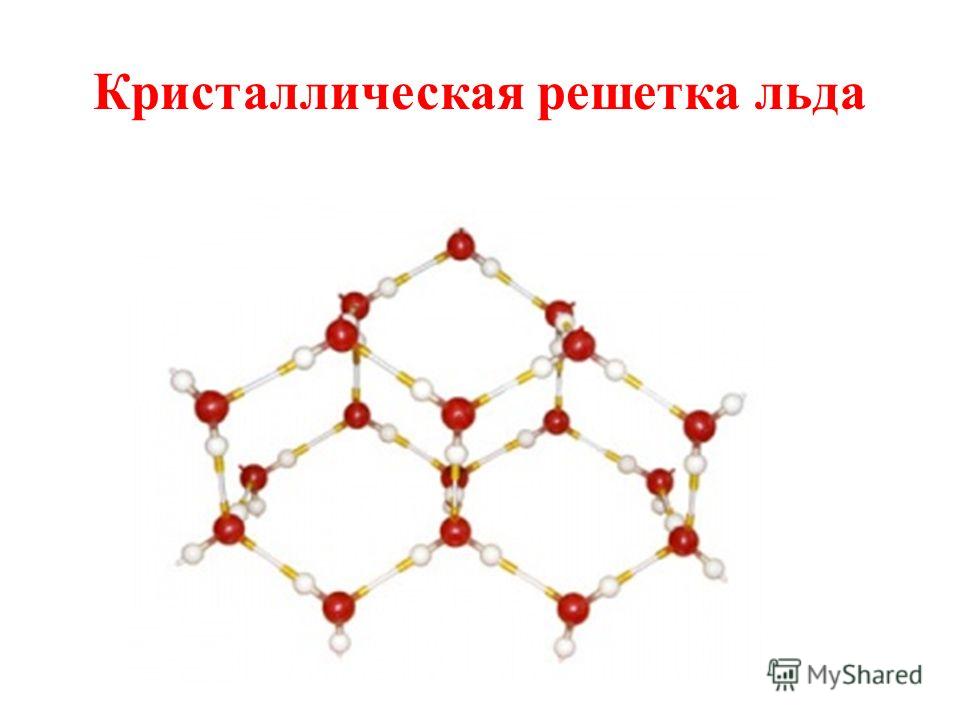 И то обстоятельство, что удельная теплота
испарения воды ровно в 3 раза больше суммы удельных теплот плавления
льда и последующего нагрева воды до 100°С, является подтверждением
предположения Колясникова о том. что число внутренних связей в тетрамере
в 3 раза больше числа внешних.
И то обстоятельство, что удельная теплота
испарения воды ровно в 3 раза больше суммы удельных теплот плавления
льда и последующего нагрева воды до 100°С, является подтверждением
предположения Колясникова о том. что число внутренних связей в тетрамере
в 3 раза больше числа внешних.
Такая тетраэдрально-винтовая
структура воды может быть обусловлена ее древней реологической связью с
кварцем и другими кремнекислородными минералами, преобладающими в земной
коре, из недр которой когда-то появилась вода на Земле. Как маленький
кристаллик соли заставляет окружающий его раствор кристаллизоваться в
подобные ему кристаллы, а не в другие, так кварц заставил молекулы воды
выстраиваться в тетраэдрические структуры, которые, энергетически
наиболее выгодны. А в нашу эпоху в земной атмосфере водяные пары,
конденсируясь в капли, образуют такую структуру потому, что в атмосфере
всегда присутствуют мельчайшие капельки аэрозольной воды, уже имеющей
эту структуру. Они и являются центрами конденсации водяных паров в
атмосфере.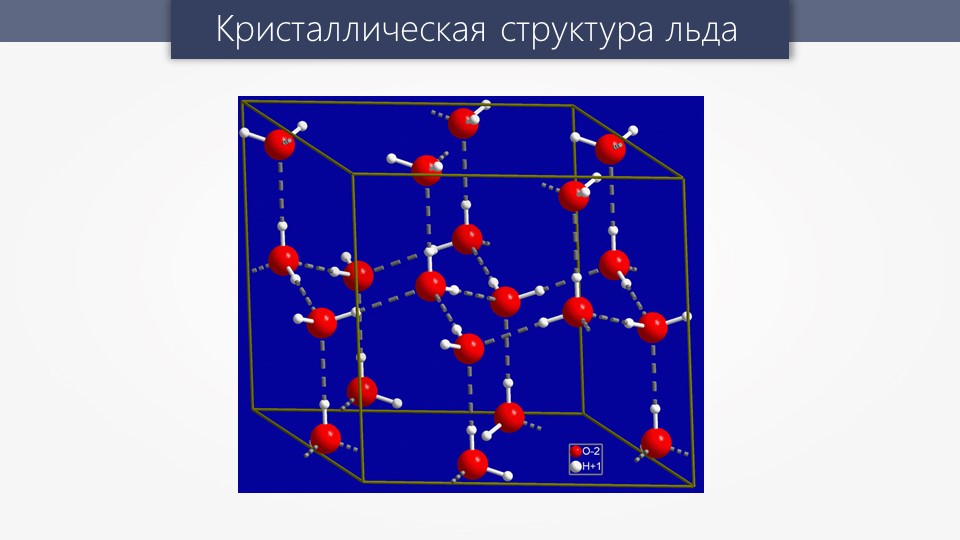 Ниже приведены возможные цепочечные силикатные структуры на
основе тетраэдра, которые могут быть составлены и из тетраэдров воды.
Ниже приведены возможные цепочечные силикатные структуры на
основе тетраэдра, которые могут быть составлены и из тетраэдров воды.
Рис. Элементарный правильный кремне-кислородный тетраэдр SiO 4 4- .
Рис. Элементарные кремнекислородные единицы-ортогруппы SiO 4 4- в структуре Mg-пироксена энстатите (а) и диортогруппы Si 2 O 7 6- в Са-пироксеноиде волластоните (б).
Рис. Простейшие типы островных кремнекислородных анионных группировок: а-SiO 4 , б-Si 2 O 7 , в-Si 3 O 9 , г-Si 4 О 12 , д-Si 6 O 18 .
Рис. ниже — Важнейшие типы кремнекислородных цепочечных анионных группировок (по Белову): а-метагерманатная, б — пироксеновая, в — батиситовая, г-волластонитовая, д-власовитовая, е-мелилитовая, ж-родонитовая, з-пироксмангитовая, и-метафосфатная, к-фторобериллатная, л — барилитовая.
Рис.
ниже — Конденсация пироксеновых кремнекислородных анионов в сотовые
двухрядные амфиболовые (а), трехрядные амфиболоподобные (б), слоистые
тальковые и близкие им анионы (в).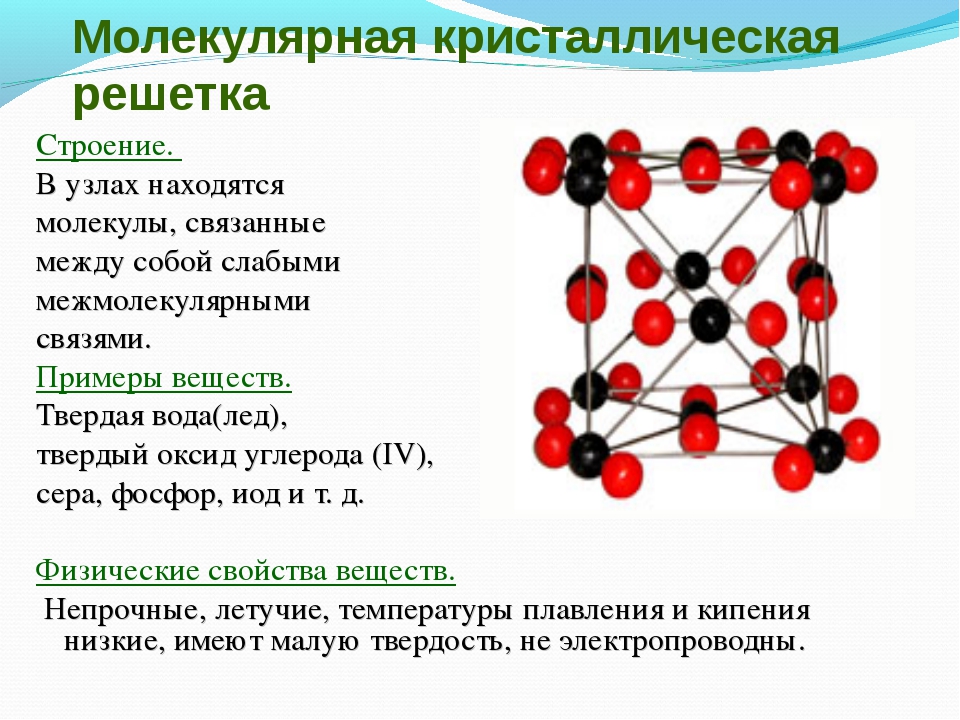
Рис. ниже — Важнейшие типы ленточных кремнекислородных группировок (по Белову): а — силлиманитовая, амфиболовая, ксонотлитовая; б-эпидидимитовая; в-ортоклазовая; г-нарсарсукитовая; д-фенакитовая призматическая; е-эвклазовая инкрустированная.
Рис. справа — Фрагмент (элементарный пакет) слоистой кристаллической структуры мусковита KAl 2 (AlSi 3 O 10 XOH) 2 , иллюстрирующий переслаивание алюмокремне-кислородных сеток с полиэдрическими слоями крупных катионов алюминия и калия, напоминает цепочку ДНК.
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные цепочки довольно стабильного состава. Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры – нететраэдрической.
Определенная часть
молекул воды ассоциирована не в трехмерные каркасы, а в линейные
кольцевые объединения.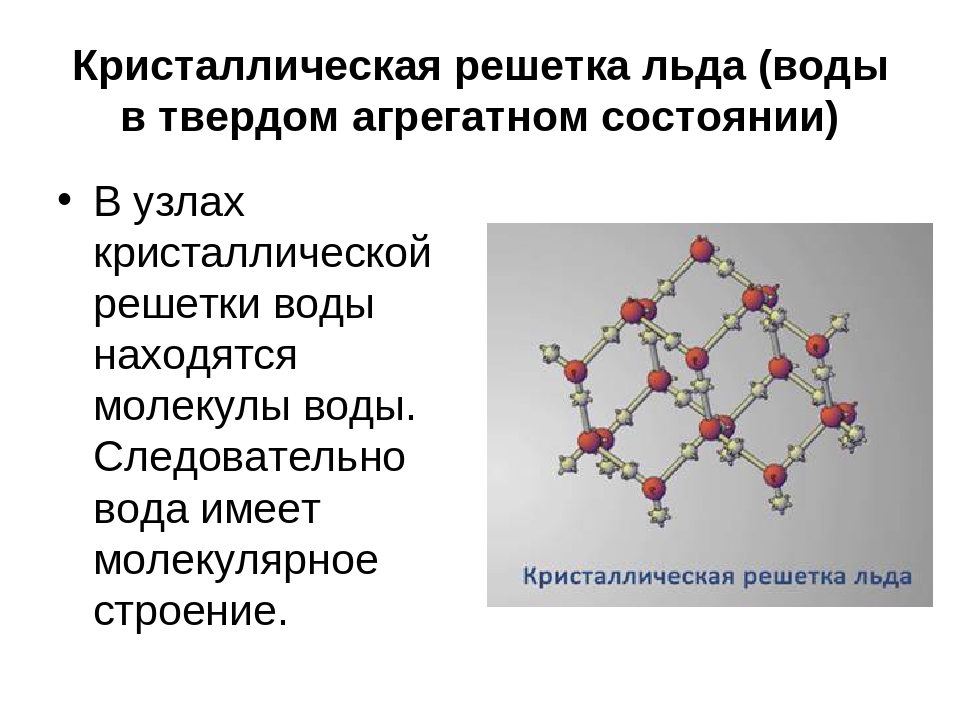 Кольца, группируясь, образуют еще более сложные
комплексы ассоциатов.
Кольца, группируясь, образуют еще более сложные
комплексы ассоциатов.
Таким образом, вода теоретически может образовывать цепочки, наподобие молекулы ДНК, о чём будет сказано ниже. В этой гипотезе интересно еще и то, что из нее следует равновероятность существования право — и левовинтовой воды. Но биологами давно подмечено, что в биологических тканях и структурах наблюдаются только либо лево -, либо правовинтовые образования. Пример тому — белковые молекулы, построенные только из лево-винтовых аминокислот и закрученные только по левовинтовой спирали. А вот сахара в живой природе — все только правовинтовые. Никто пока не смог объяснить, почему в живой природе обнаруживается такое предпочтение к левому в одних случаях и к правому — в других. Ведь в неживой природе с равной вероятностью встречаются как право-, так и левовинтовые молекулы.
Более ста лет назад
знаменитый французский естествоиспытатель Луи Пастер обнаружил, что
органические соединения в составе растений и животных оптически
асимметричны — они вращают плоскость поляризации падающего на них света. Все аминокислоты, входящие в состав животных и растений, вращают
плоскость поляризации влево, а все сахара — вправо. Если мы синтезируем
такие же по химическому составу соединения, то в каждом из них будет
равное количество лево- и правовращающих молекул.
Все аминокислоты, входящие в состав животных и растений, вращают
плоскость поляризации влево, а все сахара — вправо. Если мы синтезируем
такие же по химическому составу соединения, то в каждом из них будет
равное количество лево- и правовращающих молекул.
Как известно, все живые организмы состоят из белков, а они, в свою очередь, — из аминокислот. Соединяясь друг с другом в разнообразной последовательности, аминокислоты образуют длинные пептидные цепи, которые самопроизвольно «закручиваются» в сложные белковые молекулы. Подобно многим другим органическим соединениям, аминокислоты обладают хиральной симметрией (от греч. хирос — рука), то есть могут существовать в двух зеркально симметричных формах, называемых «энантиомеры». Такие молекулы похожи одна на другую, как левая и правая рука, поэтому их называют D- и L-молекулами (от лат. dexter, laevus — правый и левый).
Теперь
представим себе, что среда с левыми и правыми молекулами перешла в
состояние только с левыми или только с правыми молекулами.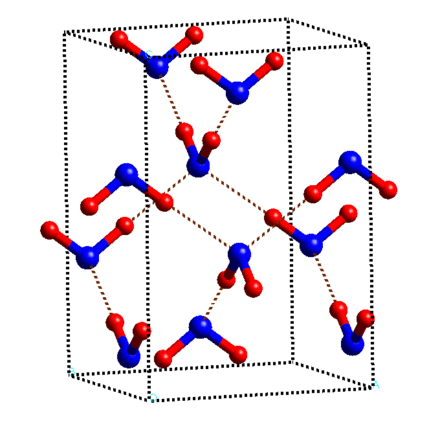 Такую среду
специалисты называют хирально (от греческого слова «хейра» — рука)
упорядоченной. Самовоспроизведение живого (биопоэз — по определению Д.
Бернала) могло возникнуть и поддерживаться только в такой среде.
Такую среду
специалисты называют хирально (от греческого слова «хейра» — рука)
упорядоченной. Самовоспроизведение живого (биопоэз — по определению Д.
Бернала) могло возникнуть и поддерживаться только в такой среде.
Рис. Зеркальная симметрия в природе
Другое название молекул-энантиомеров — «правовращающие» и «левовращающие» — происходит от их способности вращать плоскость поляризации света в различных направлениях. Если линейно поляризованный свет пропустить через раствор таких молекул, происходит поворот плоскости его поляризации: по часовой стрелке, если молекулы в растворе правые, и против — если левые. А в смеси одинаковых количеств D-и L-форм (она называется «рацемат») свет сохранит первоначальную линейную поляризацию. Это оптическое свойство хиральных молекул впервые было обнаружено Луи Пастером в 1848 году.
Любопытно, что почти все природные белки
состоят только из левых аминокислот. Этот факт тем более удивляет, что
при синтезе аминокислот в лабораторных условиях образуется примерно
одинаковое число правых и левых молекул.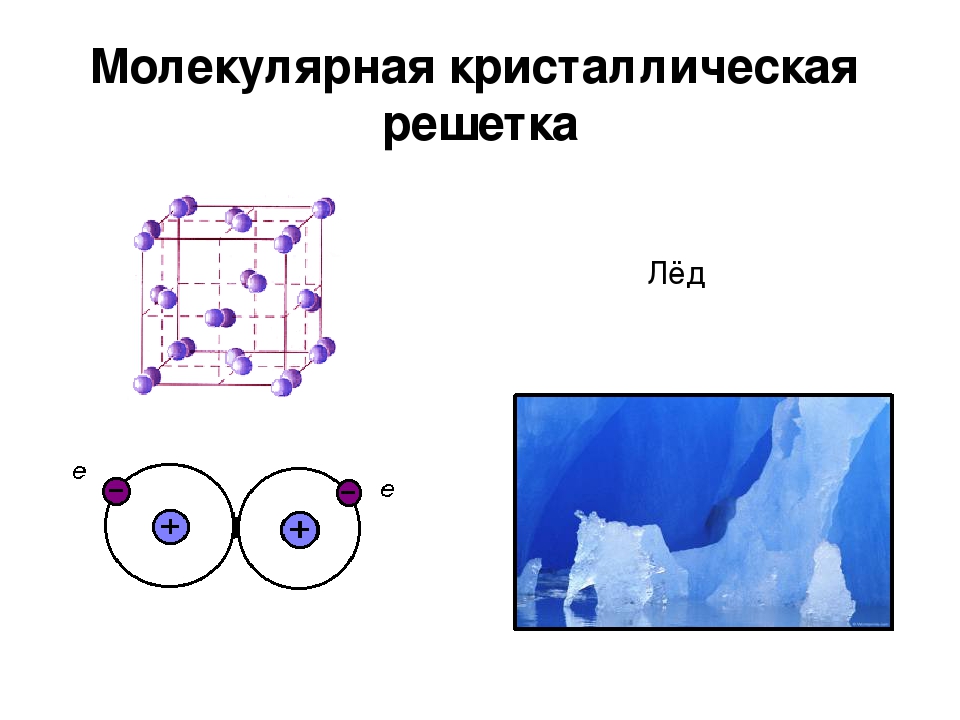 Оказывается, этой особенностью
обладают не только аминокислоты, но и многие другие важные для живых
систем вещества, причем каждое имеет строго определенный знак зеркальной
симметрии во всей биосфере. Например, сахара, входящие в состав многих
нуклеотидов, а также нуклеиновых кислот ДНК и РНК, представлены в
организме исключительно правыми D-молекулами. Хотя физические и
химические свойства «зеркальных антиподов» совпадают, их физиологическая
активность в организмах различна: L-caxaра не усваиваются,
L-фенилаланин в отличие от безвредных его D-молекул вызывает психические
заболевания и т. д.
Оказывается, этой особенностью
обладают не только аминокислоты, но и многие другие важные для живых
систем вещества, причем каждое имеет строго определенный знак зеркальной
симметрии во всей биосфере. Например, сахара, входящие в состав многих
нуклеотидов, а также нуклеиновых кислот ДНК и РНК, представлены в
организме исключительно правыми D-молекулами. Хотя физические и
химические свойства «зеркальных антиподов» совпадают, их физиологическая
активность в организмах различна: L-caxaра не усваиваются,
L-фенилаланин в отличие от безвредных его D-молекул вызывает психические
заболевания и т. д.
Согласно современным представлениям о происхождении жизни на Земле, выбор органическими молекулами определенного типа зеркальной симметрии послужил главной предпосылкой их выживания и последующего самовоспроизводства. Однако вопрос, как и почему произошел эволюционный отбор того или иного зеркального антипода, — до сих пор остается одной из самых больших загадок науки.
Советский
ученый Л.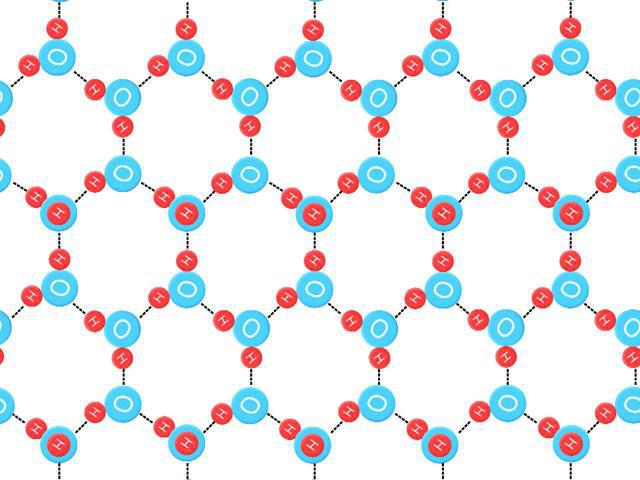 Л. Морозов доказал, что переход к хиральной упорядоченности
мог произойти не эволюционно, а только при каком-то определённом резком
фазовом изменении. Академик В. И. Гольданский назвал этот переход,
благодаря которому зародилась жизнь на Земле хиральной катастрофой.
Л. Морозов доказал, что переход к хиральной упорядоченности
мог произойти не эволюционно, а только при каком-то определённом резком
фазовом изменении. Академик В. И. Гольданский назвал этот переход,
благодаря которому зародилась жизнь на Земле хиральной катастрофой.
Как же возникли условия для фазовой катастрофы, вызвавшей хиральный переход?
Наиболее важным было то, что органические соединения плавились при 800-1000 0С в земной коре, а верхние остывали до температуры космоса, то есть абсолютного нуля. Перепад температуры достигал 1000 °С. В таких условиях органические молекулы плавились под действием высокой температуры и даже полностью разрушались, а верх оставался холодным, так как органические молекулы замораживались. Газы и пары воды, которые просачивались из земной коры, меняли химический состав органических соединений. Газы несли с собой тепло, из-за чего граница плавления органического слоя смещалась вверх и вниз, создавая градиент.
При
очень низких давлениях атмосферы вода была на земной поверхности лишь в
виде пара и льда.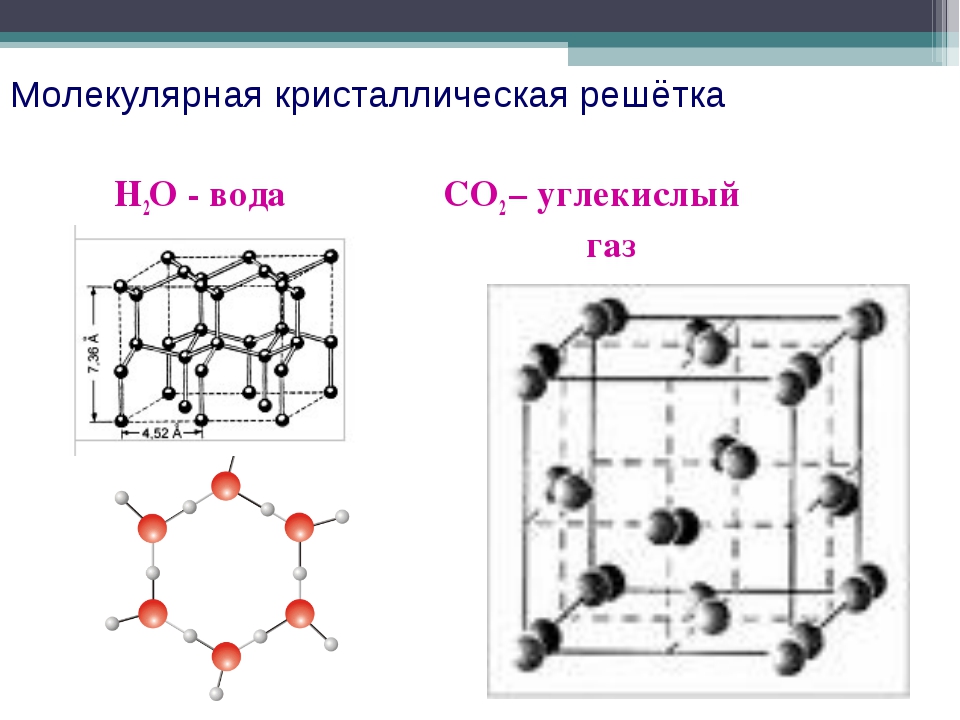 Когда же давление достигало так называемой тройной
точки воды (0,006 атмосферы), вода впервые смогла находиться в виде
жидкости.
Когда же давление достигало так называемой тройной
точки воды (0,006 атмосферы), вода впервые смогла находиться в виде
жидкости.
Конечно, лишь экспериментально можно доказать, что именно вызвало хиральный переход: земные или космические причины. Но так или иначе в какой-то момент хирально упорядоченные молекулы (а именно — левовращающие аминокислоты и правовращающие сахара) оказались более устойчивыми и начался неостановимый рост их количества — хиральный переход.
Летопись планеты повествует и о том, что тогда на Земле не было ни гор, ни впадин. Полурасплавленная гранитная кора представляла собой поверхность столь же ровную, как уровень современного океана. Однако в пределах этой равнины все же были понижения из-за неравномерного распределения масс внутри Земли. Эти понижения сыграли чрезвычайно важную роль.
Дело в том, что плоскодонные впадины
поперечником в сотни и даже тысячи километров и глубиной не более ста
метров, вероятно, и стали колыбелью жизни. Ведь в них стекала вода,
собиравшаяся на поверхности планеты. Вода разбавляла хиральные
органические соединения в пепловом слое. Постепенно менялся химический
состав соединения, стабилизировалась температура. Переход от неживого к
живому, начавшийся в безводных условиях, продолжался уже в водной среде.
Вода разбавляла хиральные
органические соединения в пепловом слое. Постепенно менялся химический
состав соединения, стабилизировалась температура. Переход от неживого к
живому, начавшийся в безводных условиях, продолжался уже в водной среде.
Таков ли сюжет зарождения жизни? Вероятнее всего, что да. В геологическом разрезе Исуа (Западная Гренландия), возраст которого 3,8 миллиарда лет, найдены бензино- и нефтеподобные соединения с изотопным соотношением С12/С13, свойственным углероду фотосинтетического происхождения.
Если биологическая природа углеродистых соединений из разреза Исуа подтвердится, то получится, что весь период зарождения жизни на Земле — от возникновения хиральной органики до появления клетки, способной к фотосинтезу и размножению,- был пройден лишь за сто миллионов лет. И в этом процессе огромную роль сыграли молекулы воды и ДНК.
Самое
удивительное в структуре воды заключается в том, что молекулы воды при
низких отрицательных температурах и высоких давлениях внутри нанотрубок
могут кристаллизоваться в форме двойной спирали, напоминающую ДНК.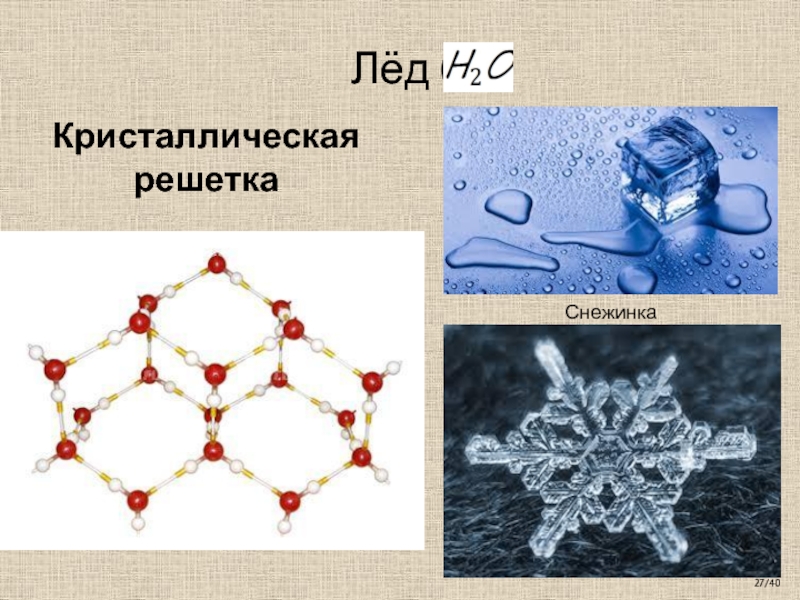 Это было доказано компьютерными экспериментами американских учёных под
руководством Сяо Чэн Цзэна в Университете штата Небраска (США).
Это было доказано компьютерными экспериментами американских учёных под
руководством Сяо Чэн Цзэна в Университете штата Небраска (США).
ДНК представляет собой двойную цепочку, скрученную в спираль. Каждая
нить состоит из «кирпичиков» — из последовательно соединенных
нуклеотидов. Каждый нуклеотид ДНК содержит одно из четырёх азотистых
оснований — гуанин (G), аденин (A) (пурины), тимин (T) и цитозин (C)
(пиримидины), связанное с дезоксирибозой, к последней, в свою очередь,
присоединена фосфатная группа. Между собой соседние нуклеотиды соединены
в цепи фосфодиэфирной связью, образованной 3″-гидроксильной (3″-ОН) и
5″-фосфатной группами (5″-РО3). Это свойство обуславливает наличие
полярности в ДНК, т.е. противоположной направленности, а именно 5″- и
3″-концов: 5″-концу одной нити соответствует 3″-конец второй нити.
Последовательность нуклеотидов позволяет «кодировать» информацию о
различных типах РНК, наиболее важными из которых являются
информационные, или матричные (мРНК), рибосомальные (рРНК) и
транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за
счёт копирования последовательности ДНК в последовательность РНК,
синтезируемой в процессе транскрипции и принимают участие в важнейшем
процессе жизни – передачи и копирования информации (трансляции).
Все эти типы РНК синтезируются на матрице ДНК за
счёт копирования последовательности ДНК в последовательность РНК,
синтезируемой в процессе транскрипции и принимают участие в важнейшем
процессе жизни – передачи и копирования информации (трансляции).
Первичная структура ДНК — это линейная последовательность нуклеотидов ДНК в цепи. Последовательность нуклеотидов в цепи ДНК записывают в виде буквенной формулы ДНК: например — AGTCATGCCAG, запись ведется с 5″- на 3″-конец цепи ДНК.
Вторичная структура ДНК образуется за счет
взаимодействий нуклеотидов (в большей степени азотистых оснований) между
собой, водородных связей. Классический пример вторичной структуры ДНК —
двойная спираль ДНК. Двойная спираль ДНК — самая распространенная в
природе форма ДНК, состоящая из двух полинуклеотидных цепей ДНК.
Построение каждой новой цепи ДНК осуществляется по принципу
комплементарности, т.е. каждому азотистому основанию одной цепи ДНК
соответствует строго определенное основание другой цепи: в
комплемнтарной паре напротив A стоит T, а напротив G располагается C и
т. д.
д.
Чтобы вода сформировала спираль, наподобие, в моделируемом эксперименте она «помещалась» в нанотрубки под высоким давлением, варьирующимися в разных опытах от 10 до 40000 атмосфер. После этого задавали температуру, которая имела значение -23°C. Запас по сравнению с температурой замерзания воды делался в связи с тем, что с повышением давления температура плавления водяного льда понижается. Диаметр нанотрубок составлял от 1,35 до 1,90 нм.
Рис. Общий вид структуры воды (изображение New Scientist)
Молекулы
воды связываются между собой посредством водородных связей, расстояние
между атомами кислорода и водорода равно 96 пм, а между двумя водородами
— 150 пм. В твёрдом состоянии атом кислорода участвует в образовании
двух водородных связей с соседними молекулами воды. При этом отдельные
молекулы H 2 O соприкасаются друг с другом разноимёнными
полюсами. Таким образом, образуются слои, в которых каждая молекула
связана с тремя молекулами своего слоя и одной из соседнего.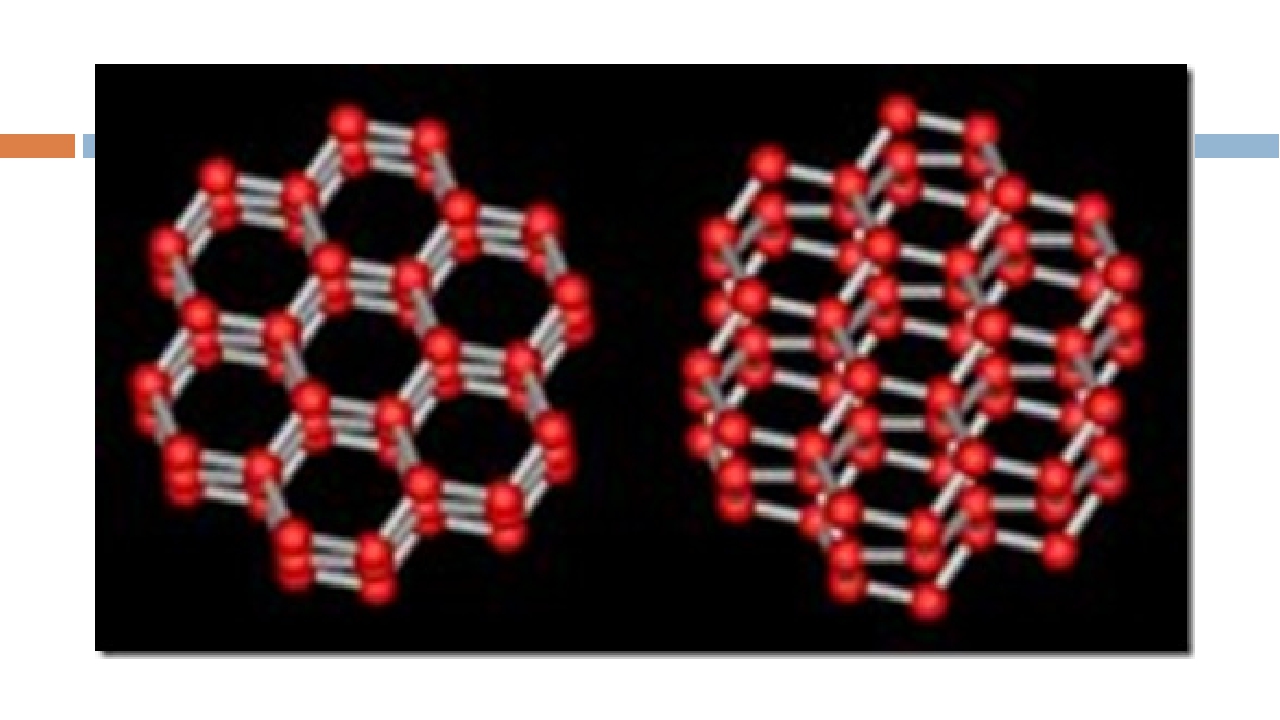 В
результате, кристаллическая структура льда состоит из шестигранных
«трубок» соединенных между собой, как пчелиные соты.
В
результате, кристаллическая структура льда состоит из шестигранных
«трубок» соединенных между собой, как пчелиные соты.
Рис. Внутренняя стенка структуры воды (изображение New Scientist)
Учёные ожидали увидеть, что вода во всех случаях образует тонкую трубчатую структуру. Однако, модель показала, что при диаметре трубки в 1,35 нм и давлении в 40000 атмосфер водородные связи искривились, приведя к образованию спирали с двойной стенкой. Внутренняя стенка этой структуры является скрученной в четверо спиралью, а внешняя состоит из четырёх двойных спиралей, похожих на структуру молекулы ДНК.
Последний
факт накладывает отпечаток не только на эволюцию наших представлений о
воде, но и эволюцию ранней жизни и самой молекулы ДНК. Если
предположить, что в эпоху зарождения жизни криолитные глинистые породы
имели форму нанотрубок, возникает вопрос — не могла ли вода,
сорбированная в них служить структурной основой (матрицей) для синтеза
ДНК и считывания информации? Возможно, поэтому спиральная структура ДНК
повторяет спиральную структуру воды в нанотрубках.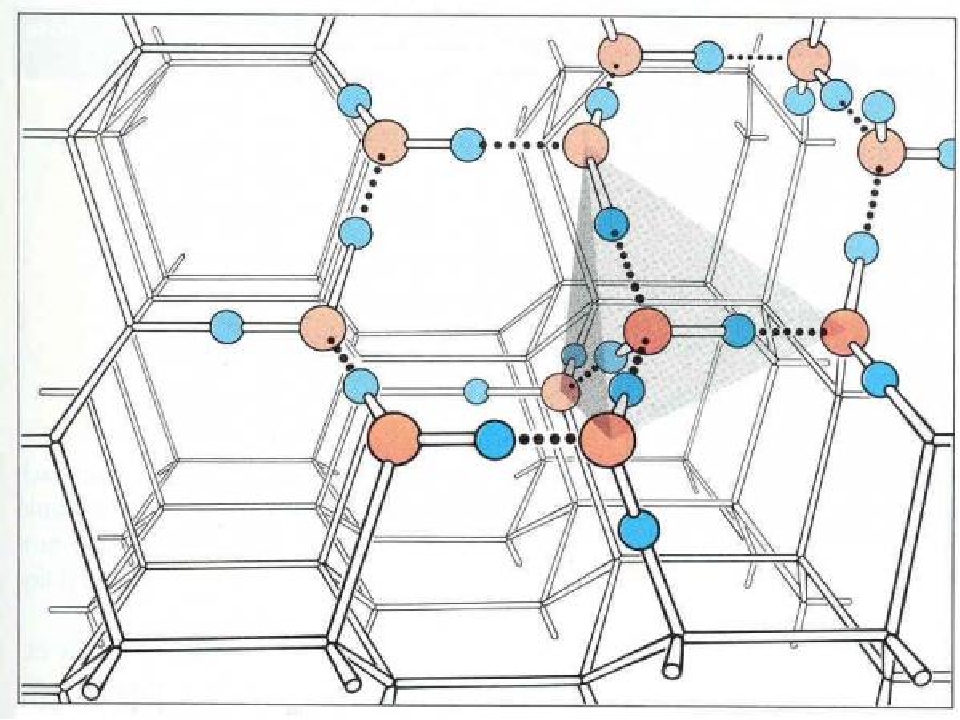 Как сообщает
журнал New Scientist, теперь нашим зарубежным коллегам предстоит
подтвердить существование таких макромолекул воды в реальных
экспериментальных условиях с использованием инфракрасной спектроскопии и
спектроскопии нейтронного рассеяния.
Как сообщает
журнал New Scientist, теперь нашим зарубежным коллегам предстоит
подтвердить существование таких макромолекул воды в реальных
экспериментальных условиях с использованием инфракрасной спектроскопии и
спектроскопии нейтронного рассеяния.
К.х.н. О.В. Мосин
Из 14 известных на сегодняшний день форм твердой воды в природе мы встречаем только одну лед. Остальные образуются в экстремальных условиях и для наблюдений вне специальных лабораторий недоступны. Самое интригующее свойство льда это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки фирна на снежном поле или же гигантских ледниковых масс.
В небольшом японском городе Кага, расположенном на западном берегу острова Хонсю, есть необычный музей. Снега и льда. Основал его Укихиро Накайя первый человек, который научился выращивать в лаборатории искусственные снежинки, такие же красивые, как и те, что падают с неба. В этом музее посетителей со всех сторон окружают правильные шестиугольники, потому что именно такая гексагональная симметрия свойственна кристаллам обычного льда (кстати, греческое слово kristallos, собственно, и означает «лед»). Она определяет многие уникальные его свойства и заставляет снежинки, при всем бесконечном их разнообразии, расти в форме звездочек с шестью, реже тремя или двенадцатью лучами, но никогда с четырьмя или пятью.
В этом музее посетителей со всех сторон окружают правильные шестиугольники, потому что именно такая гексагональная симметрия свойственна кристаллам обычного льда (кстати, греческое слово kristallos, собственно, и означает «лед»). Она определяет многие уникальные его свойства и заставляет снежинки, при всем бесконечном их разнообразии, расти в форме звездочек с шестью, реже тремя или двенадцатью лучами, но никогда с четырьмя или пятью.
Молекулы в ажуре
Разгадка структуры твердой воды кроется в строении ее молекулы. Н2О можно упрощенно представить себе в виде тетраэдра (пирамиды с треугольным основанием). В центре находится кислород, в двух вершинах по водороду, точнее протону, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, отчего их называют неподеленными.
При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы.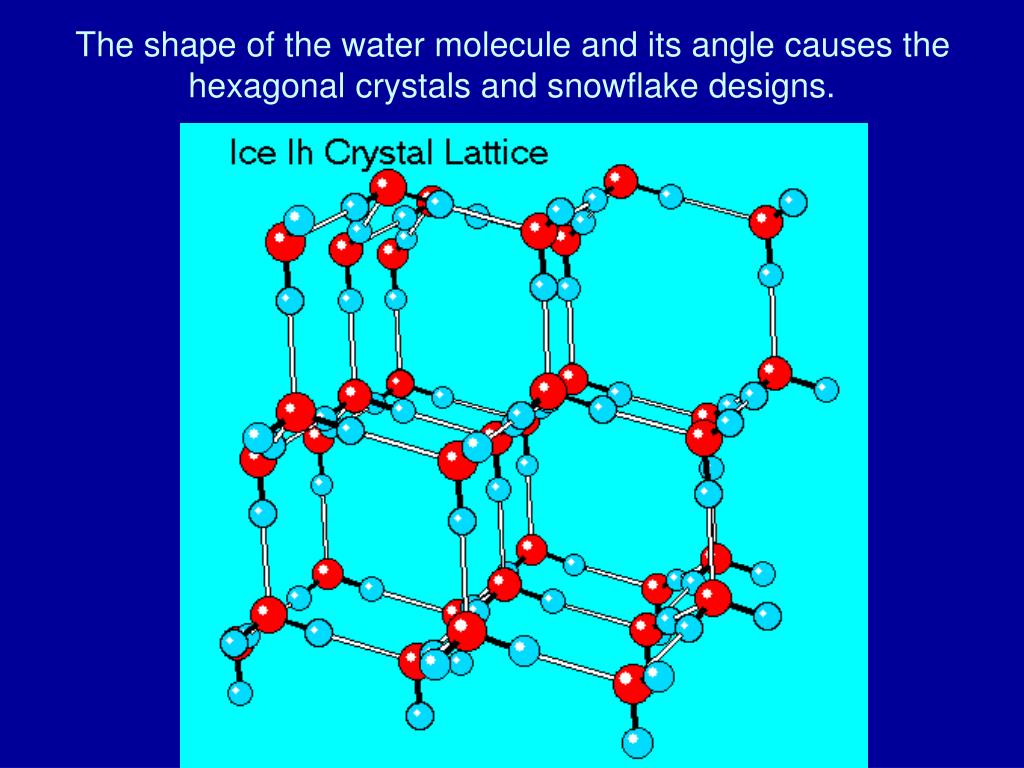 Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, которые не позволяют при замерзании создавать плотную структуру. Этот невидимый каркас из водородных связей располагает молекулы в виде ажурной сетки с полыми каналами. Стоит лед нагреть, как кружево рушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, вот почему вода тяжелее льда.
Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, которые не позволяют при замерзании создавать плотную структуру. Этот невидимый каркас из водородных связей располагает молекулы в виде ажурной сетки с полыми каналами. Стоит лед нагреть, как кружево рушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, вот почему вода тяжелее льда.Лед, который образуется при атмосферном давлении и плавится при 0°С, самое привычное, но все еще не до конца понятное вещество. Многое в его структуре и свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а вот атомы водорода занимают самые разные положения вдоль связей. Такое поведение атомов вообще-то нетипично как правило, в твердом веществе все подчиняются одному закону: либо все атомы расположены упорядоченно, и тогда это кристалл, либо случайно, и тогда это аморфное вещество.
К «странностям» льда относят и генерацию электромагнитного излучения его растущими кристаллами. Давно известно, что большинство растворенных в воде примесей не передается льду, когда он начинает расти, проще говоря, вымораживается. Поэтому даже на самой грязной луже пленка льда чистая и прозрачная. Примеси скапливаются на границе твердой и жидкой сред, в виде двух слоев электрических зарядов разного знака, которые вызывают значительную разность потенциалов. Заряженный слой примесей перемещается вместе с нижней границей молодого льда и излучает электромагнитные волны. Благодаря этому процесс кристаллизации можно наблюдать в деталях. Так, кристалл, растущий в длину в виде иголки, излучает иначе, чем покрывающийся боковыми отростками, а излучение растущих зерен отличается от того, что возникает, когда кристаллы трескаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно определить, с какой скоростью замерзает лед и какая при этом получается ледовая структура.
По форме, последовательности, частоте и амплитуде импульсов излучения можно определить, с какой скоростью замерзает лед и какая при этом получается ледовая структура.
Неправильный лед
В твердом состоянии вода насчитывает, по последним данным, 14 структурных модификаций. Есть среди них кристаллические (их большинство), есть аморфные, но все они отличаются друг от друга взаимным расположением молекул воды и свойствами. Правда, все, кроме привычного нам льда, образуются в условиях экзотических при очень низких температурах и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Например, при температуре ниже 110°С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров это так называемый кубический лед. Если температура чуть выше 110°, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Две последние модификации льда XIII и XIV открыли ученые из Оксфорда совсем недавно, в 2006 году. Предсказание 40-летней давности о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре 160°С очень велика, и собраться вместе молекулам сверхчистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно. Помог катализатор соляная кислота, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но их можно поискать на замерзших спутниках других планет.
Предсказание 40-летней давности о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре 160°С очень велика, и собраться вместе молекулам сверхчистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно. Помог катализатор соляная кислота, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но их можно поискать на замерзших спутниках других планет.
Снежинка это монокристалл льда, вариация на тему гексагонального кристалла, но выросшего быстро, в неравновесных условиях. Над тайной их красоты и бесконечного разнообразия не одно столетие бьются самые пытливые умы. Астроном Иоганн Кеплер в 1611 году написал целый трактат «О шестиугольных снежинках». В 1665 году Роберт Гук в огромном томе зарисовок всего, что он увидел с помощью микроскопа, опубликовал множество рисунков снежинок самой разной формы.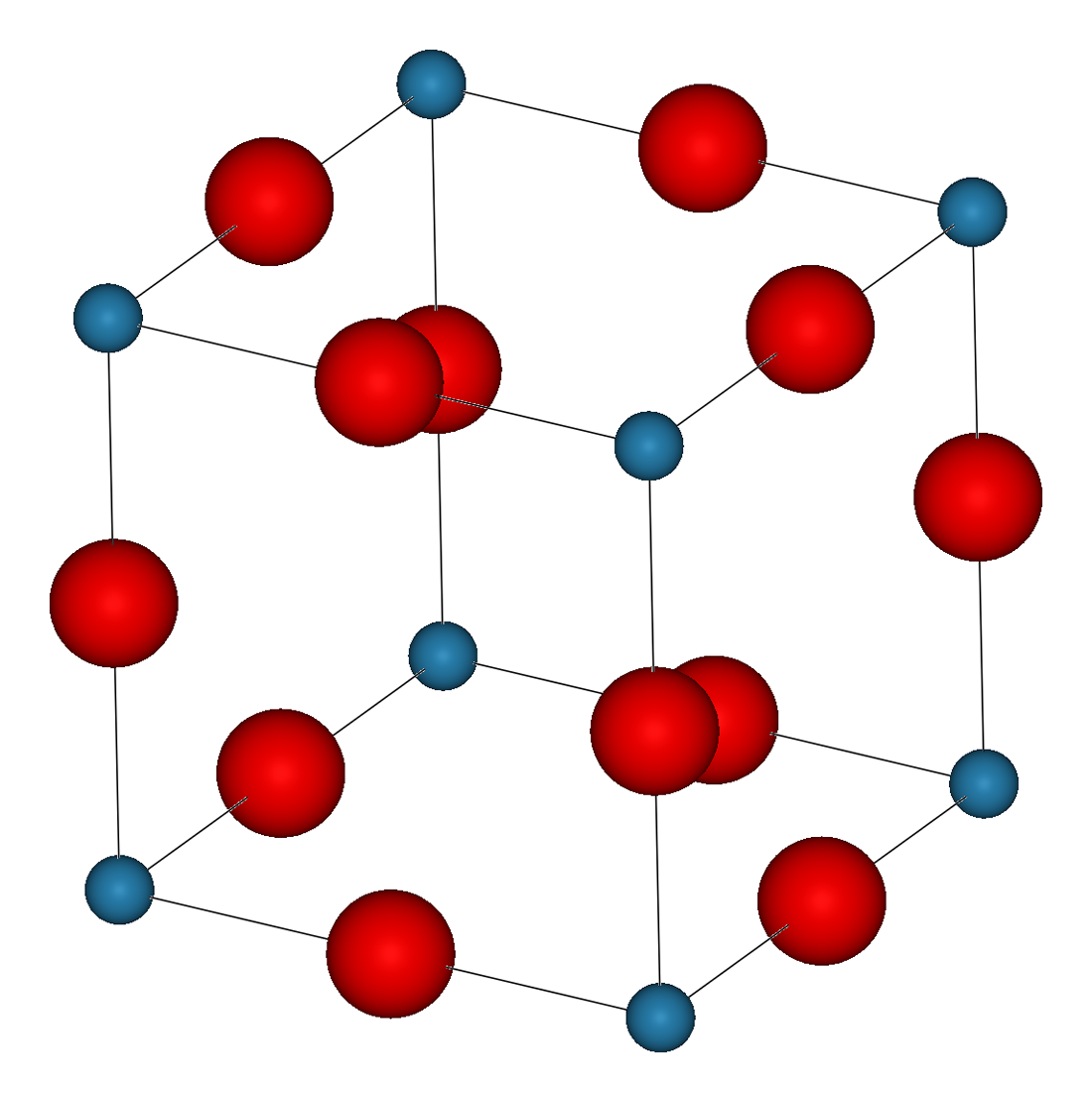 Первую удачную фотографию снежинки под микроскопом сделал в 1885 году американский фермер Уилсон Бентли. С тех пор он уже не мог остановиться. До конца жизни, сорок с лишним лет, Бентли фотографировал их. Более пяти тысяч кристаллов, и ни одного одинакового.
Первую удачную фотографию снежинки под микроскопом сделал в 1885 году американский фермер Уилсон Бентли. С тех пор он уже не мог остановиться. До конца жизни, сорок с лишним лет, Бентли фотографировал их. Более пяти тысяч кристаллов, и ни одного одинакового.
Самые знаменитые последователи дела Бентли это уже упомянутый Укихиро Накайя и американский физик Кеннет Либбрехт . Накайя впервые предположил, что величина и форма снежинок зависят от температуры воздуха и содержания в нем влаги, и блистательно подтвердил эту гипотезу экспериментально, выращивая в лаборатории кристаллы льда разной формы. А Либбрехт у себя в и вовсе стал выращивать снежинки на заказ заранее заданной формы.
Жизнь снежинки начинается с того, что в облаке водяного пара при понижении температуры образуются кристаллические зародыши льда. Центром кристаллизации могут быть пылинки, любые твердые частицы или даже ионы, но в любом случае эти льдинки размером меньше десятой доли миллиметра уже имеют гексагональную кристаллическую решетку.
Водяной пар, конденсируясь на поверхности этих зародышей, образует сначала крошечную гексагональную призму, из шести углов которой начинают расти совершенно одинаковые ледяные иголочки боковые отростки. Одинаковые просто потому, что температура и влажность вокруг зародыша тоже одинаковые. На них в свою очередь вырастают, как на дереве, боковые отростки веточки. Подобные кристаллы так и называют дендритами, то есть похожими на дерево.
Передвигаясь вверх и вниз в облаке, снежинка попадает в условия с разной температурой и концентрацией водяного пара. Ее форма меняется, до последнего подчиняясь законам гексагональной симметрии. Так снежинки становятся разными. Хотя теоретически в одном облаке на одной высоте они могут «зародиться» одинаковыми. Но путь до земли у каждой свой, довольно долгий в среднем снежинка падает со скоростью 0,9 км в час. А значит, у каждой своя история и своя окончательная форма. Образующий снежинку лед прозрачен, но когда их много, солнечный свет, отражаясь и рассеиваясь на многочисленных гранях, создает у нас впечатление белой непрозрачной массы мы называем ее снегом.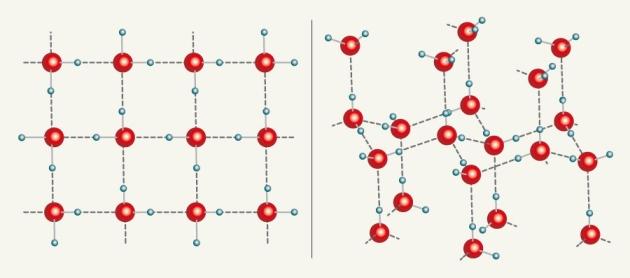
Тем же законам подчиняется и рост инея, изморози и узоров на стеклах. Эти явления, как и снежинки, образуются при конденсации, молекула за молекулой на земле, траве, деревьях. Узоры на окне появляются в мороз, когда на поверхности стекла конденсируется влага теплого комнатного воздуха. А вот градины получаются при застывании капель воды или когда в насыщенных водяным паром облаках лед плотными слоями намерзает на зародыши снежинок. На градины могут намерзать другие, уже сформировавшиеся снежинки, сплавляясь с ними, благодаря чему градины принимают самые причудливые формы.
Нам на Земле довольно и одной твердой модификации воды обычного льда. Он буквально пронизывает все области обитания или пребывания человека. Собираясь в огромных количествах, снег и лед образуют особые структуры с принципиально иными, нежели у отдельных кристаллов или снежинок, свойствами. Горные ледники , ледяные покровы акваторий, вечная мерзлота, да и просто сезонный снежный покров существенно влияют на климат больших регионов и планеты в целом: даже те, кто никогда не видел снега, чувствуют на себе дыхание его масс, скопившихся на полюсах Земли, например, в виде многолетних колебаний уровня Мирового океана. А лед имеет столь большое значение для облика нашей планеты и комфортного обитания на ней живых существ, что ученые отвели для него особую среду криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
Он буквально пронизывает все области обитания или пребывания человека. Собираясь в огромных количествах, снег и лед образуют особые структуры с принципиально иными, нежели у отдельных кристаллов или снежинок, свойствами. Горные ледники , ледяные покровы акваторий, вечная мерзлота, да и просто сезонный снежный покров существенно влияют на климат больших регионов и планеты в целом: даже те, кто никогда не видел снега, чувствуют на себе дыхание его масс, скопившихся на полюсах Земли, например, в виде многолетних колебаний уровня Мирового океана. А лед имеет столь большое значение для облика нашей планеты и комфортного обитания на ней живых существ, что ученые отвели для него особую среду криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
Ольга Максименко, кандидат химических наук
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном , твердом и жидком . Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.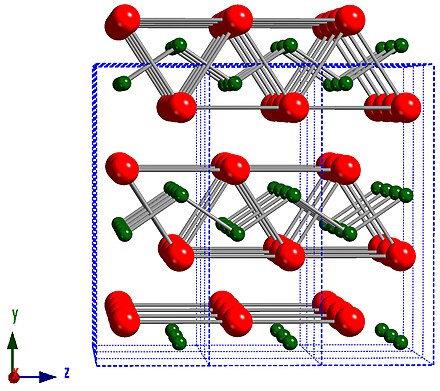
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными .
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные , атомные , молекулярные и металлические .
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO 2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H 2 0), так и неполярными (N 2 , O 3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H 2 , O 2 , CL 2 , N 2 , I 2), трех – (O 3), четырех – (P 4), восьмиатомными (S 8) молекулами. Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Кристаллические решетки. — Химия — Школьный + олимпиадный курс
С помощью имеющегося видеофрагмента учащиеся узнают отличие между аморфными и кристаллическими веществами, познакомятся с различными типами кристаллической решетки, многообразными примерами веществ и их физическими свойствами, чтобы закрепить свои знания о типах химической связи и соответственно типах кристаллической решетки.
Задания по теме для самостоятельного решения
Задание 1
(2 балла)Для веществ с какой кристаллической решеткой характерны следующие свойства: высокая твердость, прочность, нелетучесть, тугоплавкость?
Выберите один из 4 вариантов ответа:
1) металлической
2) нет верного ответа
3) ионной
4) молекулярной
Задание 2
(2 балла)«Сухой лед» имеет кристаллическую решетку:
Выберите один из 4 вариантов ответа:
1) молекулярную
2) атомную
3) ионную
4) металлическую
Задание 3
(2 балла)У NaCl кристаллическая решетка:
Выберите один из 4 вариантов ответа:
1) металлическая
2) ионная
3) молекулярная
4) атомная
Предыдущий урок на тему » Соли. »
»Кристаллическая решетка сухого льда. Кристаллические решетки
Кристаллическая структура льда: молекулы воды соединены в правильные шестиугольники Кристаллическая решётка льда: Молекулы воды H 2 O (чёрные шарики) в её узлах расположены так, что каждая имеет четырёх соседок. Молекула воды (в центре) связана с четырьмя ближайшими соседними молекулами водородными связями. Лёд – кристаллическая модификация воды. По последним данным лёд имеет 14 структурных модификаций. Среди них есть и кристаллические (их большинство) и аморфные модификации, но все они отличаются друг от друга взаимным расположением молекул воды и свойствами. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии, образуются в условиях экзотических при очень низких температурах и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда. Самое необычное свойство льда это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки льда или гигантских ледниковых масс.
Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда. Самое необычное свойство льда это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки льда или гигантских ледниковых масс.
Снежинка это монокристалл льда – разновидность гексагонального кристалла, но выросшего быстро, в неравновесных условиях. Над тайной их красоты и бесконечного разнообразия не одно столетие бьются учёные. Жизнь снежинки начинается с того, что в облаке водяного пара при понижении температуры образуются кристаллические зародыши льда.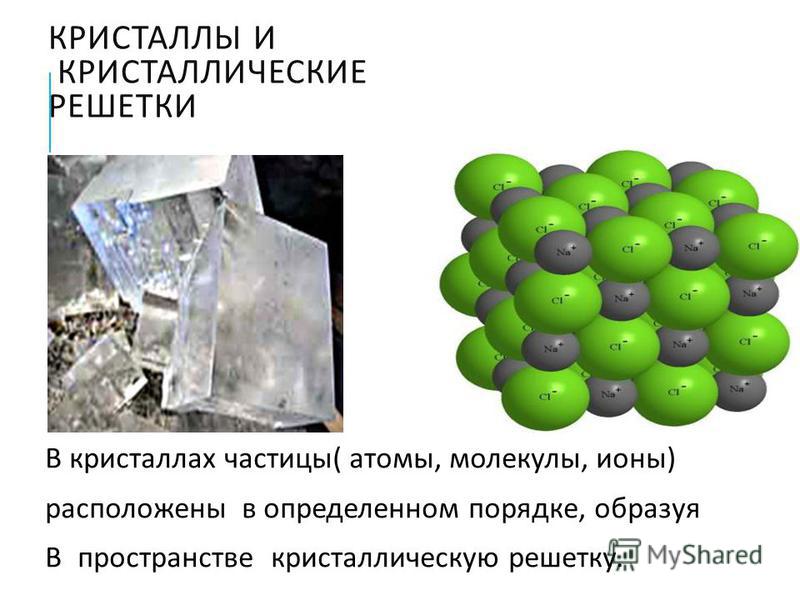 Центром кристаллизации могут быть пылинки, любые твердые частицы или даже ионы, но в любом случае эти льдинки размером меньше десятой доли миллиметра уже имеют гексагональную кристаллическую решетку Водяной пар, конденсируясь на поверхности этих зародышей, образует сначала крошечную гексагональную призму, из шести углов которой начинаю т расти одинаковые ледяные иголочки боковые отростки, т.к. температура и влажность вокруг зародыша тоже одинаковые. На них в свою очередь вырастают, как на дереве, боковые отростки веточки. Подобные кристаллы называют дендритами, то есть похожими на дерево. Передвигаясь вверх и вниз в облаке, снежинка попадает в условия с разной температурой и концентрацией водяного пара. Ее форма меняется, до последнего подчиняясь законам гексагональной симметрии. Так снежинки становятся разными. До сих пор не удалось найти среди снежинок двух одинаковых.
Центром кристаллизации могут быть пылинки, любые твердые частицы или даже ионы, но в любом случае эти льдинки размером меньше десятой доли миллиметра уже имеют гексагональную кристаллическую решетку Водяной пар, конденсируясь на поверхности этих зародышей, образует сначала крошечную гексагональную призму, из шести углов которой начинаю т расти одинаковые ледяные иголочки боковые отростки, т.к. температура и влажность вокруг зародыша тоже одинаковые. На них в свою очередь вырастают, как на дереве, боковые отростки веточки. Подобные кристаллы называют дендритами, то есть похожими на дерево. Передвигаясь вверх и вниз в облаке, снежинка попадает в условия с разной температурой и концентрацией водяного пара. Ее форма меняется, до последнего подчиняясь законам гексагональной симметрии. Так снежинки становятся разными. До сих пор не удалось найти среди снежинок двух одинаковых.
Цвет льда зависит от его возраста и может быть использован для оценки его прочности. Океанический лед в первый год своей жизни белый, потому что он насыщен воздушными пузырьками, от стенок которых свет отражается сразу же, не успев поглотиться.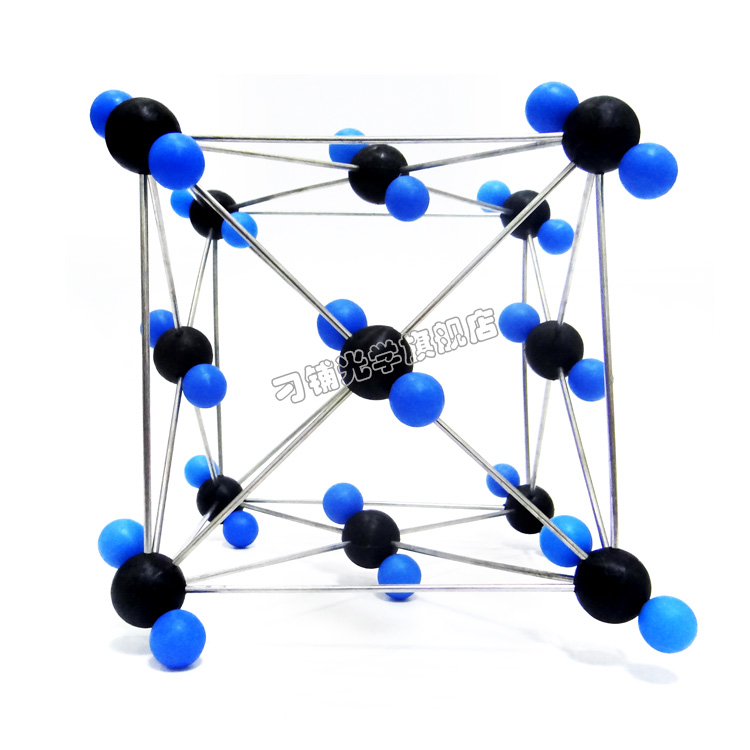 Летом поверхность льда тает, теряет прочность, и под тяжестью ложащихся сверху новых слоев пузырьки воздуха сжимаются и исчезают совсем. Свет внутри льда проходит больший путь, чем прежде, и выходит наружу, имея голубовато-зеленый оттенок. Голубой лед старше, плотнее и прочнее белого «пенистого», насыщенного воздухом. Полярные исследователи это знают и выбирают для своих плавучих баз, научных станций и ледовых аэродромов надежные голубые и зеленые льдины. Бывают черные айсберги. Первое сообщение в печати о них появилось в 1773 г. Черный цвет айсбергов вызван деятельностью вулканов — лёд покрыт толстым слоем вулканической пыли, которая не смывается даже морской водой. Лед неодинаково холоден. Есть очень холодный лед, с температурой около минус 60 градусов, это лед некоторых антарктических ледников. Намного теплее лед гренландских ледников. Его температура равна примерно минус 28 градусам. Совсем «теплые льды» (с температурой около 0 градусов) лежат на вершинах Альп и Скандинавских гор.
Летом поверхность льда тает, теряет прочность, и под тяжестью ложащихся сверху новых слоев пузырьки воздуха сжимаются и исчезают совсем. Свет внутри льда проходит больший путь, чем прежде, и выходит наружу, имея голубовато-зеленый оттенок. Голубой лед старше, плотнее и прочнее белого «пенистого», насыщенного воздухом. Полярные исследователи это знают и выбирают для своих плавучих баз, научных станций и ледовых аэродромов надежные голубые и зеленые льдины. Бывают черные айсберги. Первое сообщение в печати о них появилось в 1773 г. Черный цвет айсбергов вызван деятельностью вулканов — лёд покрыт толстым слоем вулканической пыли, которая не смывается даже морской водой. Лед неодинаково холоден. Есть очень холодный лед, с температурой около минус 60 градусов, это лед некоторых антарктических ледников. Намного теплее лед гренландских ледников. Его температура равна примерно минус 28 градусам. Совсем «теплые льды» (с температурой около 0 градусов) лежат на вершинах Альп и Скандинавских гор.
Плотность воды максимальна при +4 C и равна 1 г/мл, при понижении температуры уменьшается. При кристаллизации воды плотность резко уменьшается, для льда она равна 0,91 г/см 3. Благодаря этому лед легче воды и при замерзании водоёмов лед скапливается сверху, а на дне водоёмов оказывается более плотная вода с температурой 4 ̊ С. Плохая теплопроводность льда и покрывающего его снежного покрова предохраняет водоёмы от замерзания до дна и создаёт тем самым условия для жизни обитателей водоёмов зимой.
При кристаллизации воды плотность резко уменьшается, для льда она равна 0,91 г/см 3. Благодаря этому лед легче воды и при замерзании водоёмов лед скапливается сверху, а на дне водоёмов оказывается более плотная вода с температурой 4 ̊ С. Плохая теплопроводность льда и покрывающего его снежного покрова предохраняет водоёмы от замерзания до дна и создаёт тем самым условия для жизни обитателей водоёмов зимой.
Ледники, ледяные покровы, вечная мерзлота, сезонный снежный покров существенно влияют на климат больших регионов и планеты в целом: даже те, кто никогда не видел снега, чувствуют на себе дыхание его масс, скопившихся на полюсах Земли, например, в виде многолетних колебаний уровня Мирового океана. Лед имеет столь большое значение для облика нашей планеты и комфортного обитания на ней живых существ, что ученые отвели для него особую среду криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору. Природный лёд обычно значительно чище, чем вода, т. к. растворимость веществ (кроме Nh5F) во льде крайне низкая. Общие запасы льда на Земле около 30 млн. км 3. Больше всего льда сосредоточено в Антарктиде, где толщина его слоя достигает 4 км.
к. растворимость веществ (кроме Nh5F) во льде крайне низкая. Общие запасы льда на Земле около 30 млн. км 3. Больше всего льда сосредоточено в Антарктиде, где толщина его слоя достигает 4 км.
Сегодня мы будем говорить про свойства снега и льда. Стоит уточнить, что лед образуются не только из воды. Кроме водяного льда бывает аммиачный и метановый. Не так давно ученые изобрели сухой лед. Свойства его уникальны, их рассмотрим чуть позже. Он образуется при замораживании углекислоты. Свое название сухой лёд получил благодаря тому, что при таянии он не оставляет луж. Находящийся в его составе углекислый газ тут же испаряется в воздух из замороженного состояния.
Определение льда
Прежде всего, подробнее рассмотрим лед, который получают из воды. Внутри него правильная кристаллическая решетка. Лед — это распространенный природный минерал, получаемый во время замерзания воды. Одна молекула этой жидкости связывается с четырьмя ближайшими. Ученые заметили, что такое внутреннее строение присуще различным драгоценным камням и даже минералам. Например, такое строение имеет алмаз, турмалин, кварц, корунд, берилл и другие. Молекулы удерживаются на расстоянии кристаллической решеткой. Эти свойства воды и льда говорят о том, что плотность такого льда будет меньше плотности воды, благодаря которой он образовался. Поэтому лед плавает на поверхности воды и не тонет в ней.
Например, такое строение имеет алмаз, турмалин, кварц, корунд, берилл и другие. Молекулы удерживаются на расстоянии кристаллической решеткой. Эти свойства воды и льда говорят о том, что плотность такого льда будет меньше плотности воды, благодаря которой он образовался. Поэтому лед плавает на поверхности воды и не тонет в ней.
Миллионы квадратных километров льда
А вы знаете, сколько льда на нашей планете? Согласно последним исследованиям ученых, на планете Земля имеется примерно 30 миллионов квадратных километров замороженной воды. Как вы уже догадались, основная масса этого природного минерала находится на полярных шапках. В некоторых местах толщина ледяного покрова достигает 4 км.
Как получить лед
Сделать лед совсем несложно. Этот процесс не составит большого труда, как и не требует особых навыков. Для этого необходима низкая температура воды. Это единственное неизменное условие процесса образования льда. Вода замерзнет тогда, когда ваш термометр покажет температуру ниже 0 градусов по Цельсию. В воде начинается процесс кристаллизации благодаря низким температурам. Молекулы ее строятся в интересную упорядоченную структуру. Этот процесс называют образованием кристаллической решетки. Он одинаков и в океане, и в луже, и даже в морозильной камере.
В воде начинается процесс кристаллизации благодаря низким температурам. Молекулы ее строятся в интересную упорядоченную структуру. Этот процесс называют образованием кристаллической решетки. Он одинаков и в океане, и в луже, и даже в морозильной камере.
Исследования процесса замерзания
Проводя исследование на тему замерзания воды, ученые пришли к выводу, что кристаллическая решетка выстраивается в верхних слоях воды. На поверхности начинают образовываться микроскопические ледяные палочки. Чуть позже между собой они смерзаются. Благодаря этому образуется тончайшая пленка на поверхности воды. Крупные водоемы замерзают намного дольше по сравнению с неподвижной водой. Это связано с тем, что ветер колышет и колеблет поверхность озера, пруда или реки.
Ледяные блины
Ученые провели ещё одно наблюдение. Если при низкой температуре продолжается волнение, то тончайшие пленки собираются в блины диаметром около 30 см. Далее они смерзаются в один слой, толщина которого не меньше 10 см. На ледяные блины сверху и снизу намерзает новый слой льда. Так образуется толстый и прочный ледяной покров. Его прочность зависит от видов: самый прозрачный лед будет в несколько раз прочнее белого льда. Экологи заметили, что 5-сантиметровый лёд выдерживает вес взрослого человека. Слой в 10 см способен выдержать легковую машину, но следует помнить, что выходить на лед в осеннее и весеннее время очень опасно.
На ледяные блины сверху и снизу намерзает новый слой льда. Так образуется толстый и прочный ледяной покров. Его прочность зависит от видов: самый прозрачный лед будет в несколько раз прочнее белого льда. Экологи заметили, что 5-сантиметровый лёд выдерживает вес взрослого человека. Слой в 10 см способен выдержать легковую машину, но следует помнить, что выходить на лед в осеннее и весеннее время очень опасно.
Свойства снега и льда
Физики и химики долгое время изучали свойства льда и воды. Самое известное, а также важное свойство льда для человека — это его способность легко таять уже при нулевой температуре. Но для науки важны и другие физические свойства льда:
- лед обладает прозрачностью, поэтому он хорошо пропускает солнечный свет;
- бесцветность — лед не имеет цвета, но его с легкостью можно покрасить при помощи цветных добавок;
- твердость — ледяные массы прекрасно сохраняют форму без каких-либо наружных оболочек;
- текучесть — это частное свойство льда, присущее минералу только в некоторых случаях;
- хрупкость — кусок льда можно с легкостью расколоть, не прикладывая больших усилий;
- спайность — лед с легкостью раскалывается в тех местах, где он сросся по кристаллографической линии.

Лед: свойства вытеснения и чистоты
По своему составу у льда высокая степень чистоты, так как кристаллическая решетка не оставляет свободного места различным посторонним молекулам. Когда вода замерзает, то она вытесняет различные примеси, которые в ней когда-то растворились. Таким же образом можно получить очищенную воду в домашних условиях.
Но некоторые вещества способны затормаживать процесс замерзания воды. Например, соль в морской воде. Лёд в море образуется только при очень низких температурах. Удивительно, но процесс замерзания воды каждый год способен поддерживать самоочищение от разных примесей в течение многих миллионов лет подряд.
Секреты сухого льда
Особенности этого льда в том, что в своём составе он имеет углерод. Такой лед образуется только при температуре -78 градусов, но тает он уже при -50 градусах. Сухой лед, свойства которого позволяют пропустить стадию жидкостей, при нагревании сразу образуется пар. Сухой лед, как и его собрат — водяной, не имеет запаха.
А вы знаете, где применяют сухой лед? Благодаря его свойствам, этот минерал используют при транспортировке продуктов питания и медикаментов на дальние расстояния. А гранулы этого льда способны потушить воспламенение бензина. Ещё, когда сухой лед тает, он образует густой туман, поэтому его применяют на съемочных площадках для создания спецэффектов. Помимо всего перечисленного, сухой лед можно брать с собой в поход и в лес. Ведь когда он тает, то отпугивает комаров, различных вредителей и грызунов.
Что касается свойств снега, то эту удивительную красоту мы можем наблюдать каждую зиму. Ведь каждая снежинка имеет форму шестигранника — это неизменно. Но помимо шестиугольной формы, снежинки могут выглядеть по-разному. На формирование каждой из них влияет влажность воздуха, атмосферное давление и другие природные факторы.
Свойства воды, снега, льда удивительны. Важно знать ещё несколько свойств воды. Например, она способна принимать форму сосуда, в который ее наливают. При замерзании вода расширяется, а также у нее есть память. Она способна запоминать окружающую энергетику, а при замерзании она «сбрасывает» информацию, которую в себя впитала.
При замерзании вода расширяется, а также у нее есть память. Она способна запоминать окружающую энергетику, а при замерзании она «сбрасывает» информацию, которую в себя впитала.
Мы рассмотрели природный минерал — лед: свойства и его качества. Продолжайте изучать науку, это очень важно и полезно!
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном , твердом и жидком . Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными .
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние.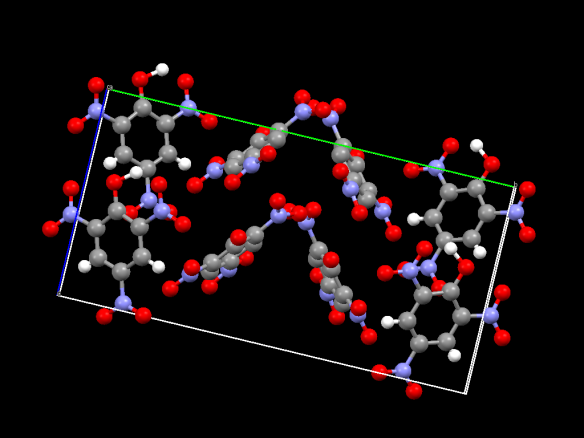 В таком состоянии, например, находятся различные смолы, пластилин.
В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные , атомные , молекулярные и металлические .
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO 2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H 2 0), так и неполярными (N 2 , O 3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H 2 , O 2 , CL 2 , N 2 , I 2), трех – (O 3), четырех – (P 4), восьмиатомными (S 8) молекулами.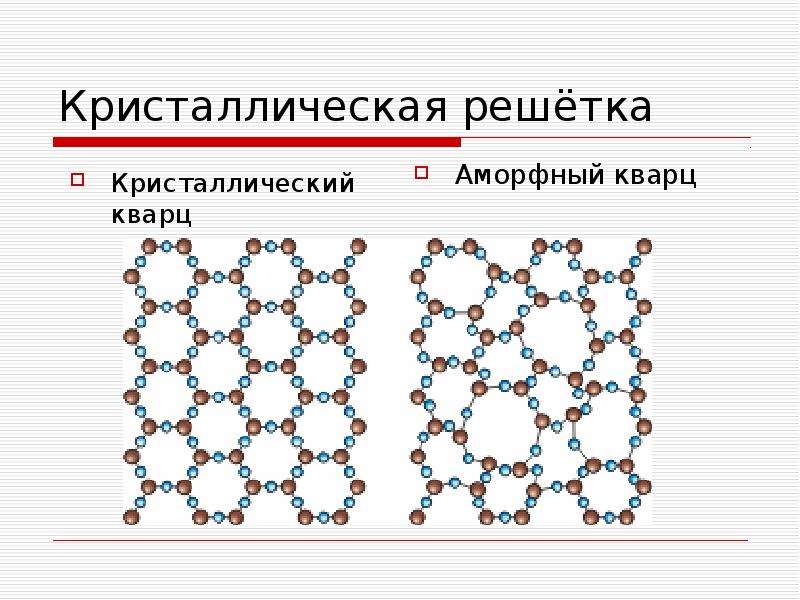 Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Если в узлах кристаллической решетки находятся неполярные молекулы какого-то вещества (вроде иода I 2 , кислорода О 2 или азота N 2 ), то они не испытывают друг к другу никаких электрических «симпатий». Другими словами, их молекулы не должны притягиваться за счет электростатических сил. И все-таки что-то их удерживает рядом. Что именно?
Оказывается, в твердом состоянии эти молекулы подходят настолько близко друг к другу, что в их электронных облаках начинаются мгновенные (правда, очень слабые) смещения — сгущения и разрежения электронных облаков. Вместо неполярных частиц возникают «мгновенные диполи», которые уже смогут притягиваться друг к другу электростатически. Однако это притяжение очень слабое. Поэтому кристаллические решетки неполярных веществ непрочные и существуют только при очень низкой температуре, при «космическом» холоде.
Поэтому кристаллические решетки неполярных веществ непрочные и существуют только при очень низкой температуре, при «космическом» холоде.
Астрономы действительно обнаружили небесные тела — кометы, астероиды, даже целые планеты, состоящие из замерзшего азота , кислорода и других веществ, которые в обычных земных условиях существуют в виде газов и становятся твердыми в межпланетном пространства.
| Многие простые и сложные вещества с молекулярной кристаллической решеткой хорошо всем известны. Это, например, кристаллический иод I 2 : | |
| Вот как построена кристаллическая решетка иода : она состоит из молекул иода (в каждой из них — два атома иода). | |
И эти молекулы довольно слабо связаны между собой. Вот почему кристаллический иод такой летучий и уже при самом легком нагревании испаряется, превращаясь в газообразный иод — пар красивого фиолетового цвета. |
У каких широко распространенных веществ молекулярная кристаллическая решетка ?
- Кристаллическая вода (лед) состоит из полярных молекул воды H 2 O.
- Кристаллы «сухого льда», которым охлаждают мороженое, — это тоже молекулярные кристаллы углекислого газа CO 2 .
- Еще один пример — сахар, который образует кристаллы из молекул сахарозы .
Когда в узлах кристаллической решетки находятся молекулы вещества, связи между ними не очень-то крепкие, даже если эти молекулы — полярные.
Поэтому для того, чтобы расплавить такие кристаллы или испарить вещества с молекулярной кристаллической структурой, не требуется нагревать их до красного каления.
Уже при 0 °С кристаллическая структура льда разрушается, и получается вода . А «сухой лед» при обычном давлении не плавится, а сразу переходит в газообразный диоксид углерода — возгоняется.
Другое дело — вещества с атомной кристаллической решеткой, где каждый атом связан со своими соседями очень прочными ковалентными связями, а весь кристалл в целом при желании можно считать огромной молекулой.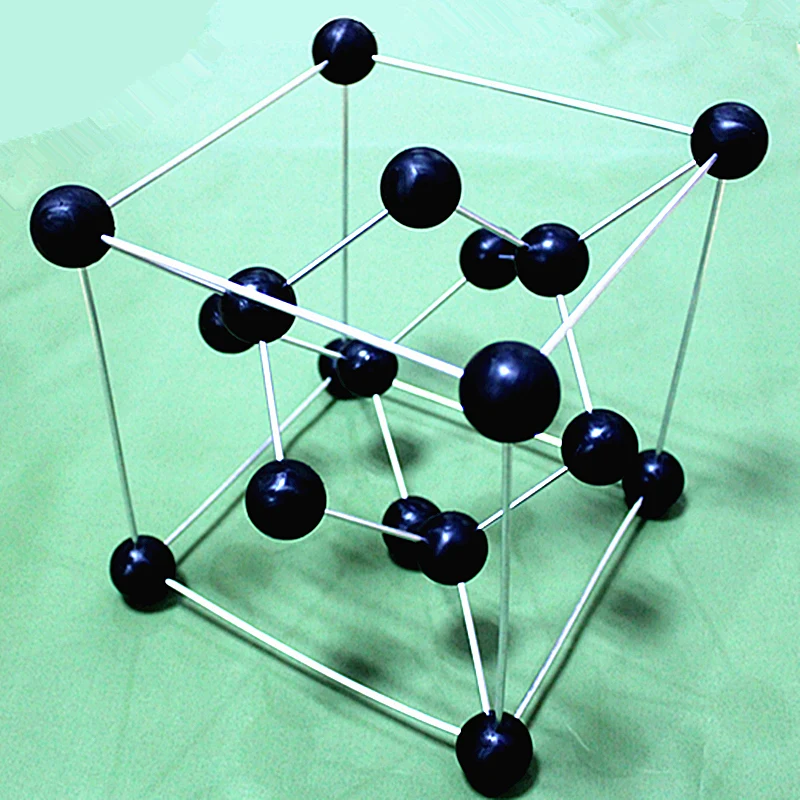
Для примера можно рассмотреть кристалл алмаза, который состоит из атомов углерода .
| Атом углерода С , который содержит два неспаренных р -электрона, превращается в атом углерода С* , где все четыре электрона внешнего валентного уровня расположены на орбиталях поодиночке и способны образовывать химические связи . Химики называют такой атом «возбужденным «. | |
| В этом случае химических связей оказывается целых четыре, и все очень прочные . Недаром алмаз — самое твердое вещество в природе и с незапамятных времен считается царем всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». | |
| Из ограненных кристаллов алмаза получаются бриллианты, которыми украшают дорогие ювелирные изделия |
Самые красивые из найденных людьми алмазов имеют свою, порой трагическую, историю. Читайте >>>
Читайте >>>
Но алмаз идет не только на украшения. Его кристаллы используются в инструменте для обработки самых твердых материалов, бурения горных пород, резки и огранки стекла и хрусталя.
Кристаллическая решетка алмаза (слева) и графита (справа)
Графит по составу тот же углерод , но структура кристаллической решетки у него не такая, как у алмаза. В графите атомы углерода расположены слоями, внутри которых соединение атомов углерода похоже на пчелиные соты. Эти слои связаны между собой гораздо слабее, чем атомы углерода в каждом слое. Поэтому графит легко расслаивается на чешуйки, и им можно писать. Применяется он для изготовления карандашей, а также в качестве сухой смазки, пригодной для деталей машин, работающих при высокой температуре. Кроме того, графит хорошо проводит электрический ток, и из него делают электроды.
Можно ли недорогой графит превратить в драгоценный алмаз ? Можно, но для этого потребуется немыслимо большое давление (несколько тысяч атмосфер) и высокая температура (полторы тысячи градусов).
Гораздо проще «испортить» алмаз : надо просто нагреть его без доступа воздуха до 1500 °С, и кристаллическая структура алмаза превратится в менее упорядоченную структуру графита .
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.

- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- кристаллическая решетка.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные . Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой . Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой . Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Онлайн урок: Кристаллическое состояние веществ по предмету Химия 8 класс
Кристаллические решётки бывают:
- молекулярные
- атомные (атомно- ковалентные)
- ионные
- металлические (атомно- металлические)
Остановимся на характеристике основных типов кристаллических решеток и установим зависимость от них свойств веществ.
Молекулярные кристаллические решетки– это решетки, в узлах которых расположены молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия.
Примером вещества с молекулярной кристаллической решеткой может служить кристаллический оксид углерода (IV) CO2 – «сухой лед».
С помощь сухого льда кулинары делают забавные представления, ведь он совершенно безопасен для здоровья!
Рассмотрим модель его кристаллической решетки.
В ее узлах находятся молекулы.
Многие вещества в твердом состоянии имеют молекулярную кристаллическую решетку, особенно органические (например, белки, углеводы, полимеры).
Атомы в их молекулах связаны прочными ковалентными связями.
Молекулы же в кристаллах стянуты слабыми межмолекулярными силами, которые легко разорвать.
Поэтому кристаллы с молекулярной решеткой обладают малой твердостью, легкоплавкие, летучие.
Молекулярные вещества легко переходят из одного агрегатного состояния в другое.
Примером может служить сублимация йода.
Сублимация – возгонка, переход из твердого состояния не в жидкое, а сразу в газообразное.
Йод – это твёрдый (при нормальных условиях) неметалл темно-фиолетового цвета.
При нагревании йод не плавится, а возгоняется: сразу переходит в газообразное состояние.
У меня есть дополнительная информация к этой части урока!
ЗакрытьТот же эффект можно наблюдать и с сухим льдом. Если положить на стол кусочек сухого льда, то он не плавится, а сразу же испаряется (то есть переходит в газообразное состояние).
Интересно то, что он при этом начинает бегать по поверхности. Происходит это потому, что между кристаллом и столом образуется слой углекислого газа, который и толкает этот кристалл в разные стороны.
Если ненадолго взять его в руку, мы почувствуем небольшой холод, но жидкости не будет. Именно поэтому это вещество и назвали «сухой лёд».
Однако получить эти вещества в жидком виде всё же возможно. Эти жидкости существуют при повышенном давлении. Хотя термин «повышенное давление» в данном случае понятие весьма растяжимое и вовсе не означает большущие гидравлические прессы размером со шкаф. Например, жидкий йод можно легко получить в пробирке, нагревая его кристаллы, но при этом охлаждая горлышко пробирки. В таком случае пары йода не будут выходить из пробирки, а будут опять оседать на ней в виде кристаллов, и в итоге в пробирке образуется повышенное давление паров йода.
Атомные кристаллические решетки – решетки, в которых расположены атомы, стянутые в кристалле прочными ковалентными связями.
Атомных кристаллов сравнительно немного.
Примерами таких твердых веществ служат как простые вещества: алмаз, кремний; так и сложные вещества: карбид кальция, сульфид цинка, диоксид кремния и др.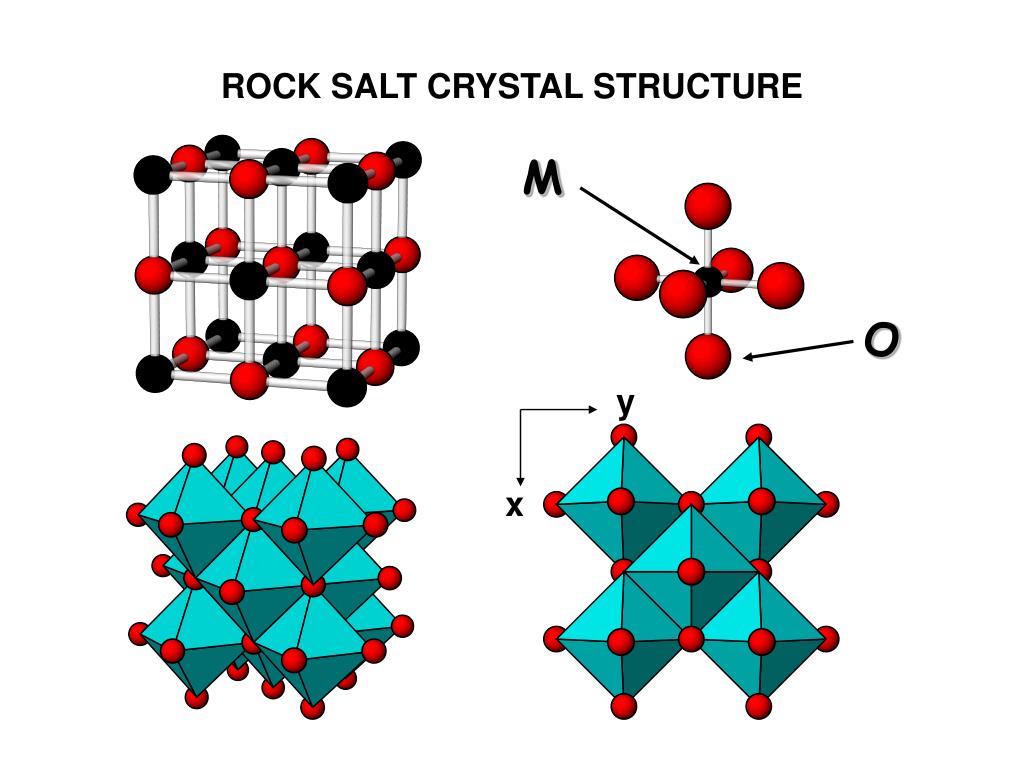
Так, например, кристалл алмаза имеет форму тетраэдра.
Следовательно, структурную его единицу представляет тетраэдр.
В центре его ячейки расположен атом углерода, прочно связанный с четырьмя другими атомами углерода с помощью электронных пар.
Все связи одинаковы, как и углы, образующиеся между атомами.
Именно благодаря ковалентным связям атомные кристаллы имеют высокую твёрдость и температуру плавления.
Именно тот факт, что в алмазе каждый атом связан четырьмя ковалентными связями, и объясняет столь высокую его твёрдость.
Ионные кристаллические решетки – это решетки, в узлах которых расположены ионы с противоположными зарядами.
Связь между ионами осуществляется за счет электростатических сил притяжения.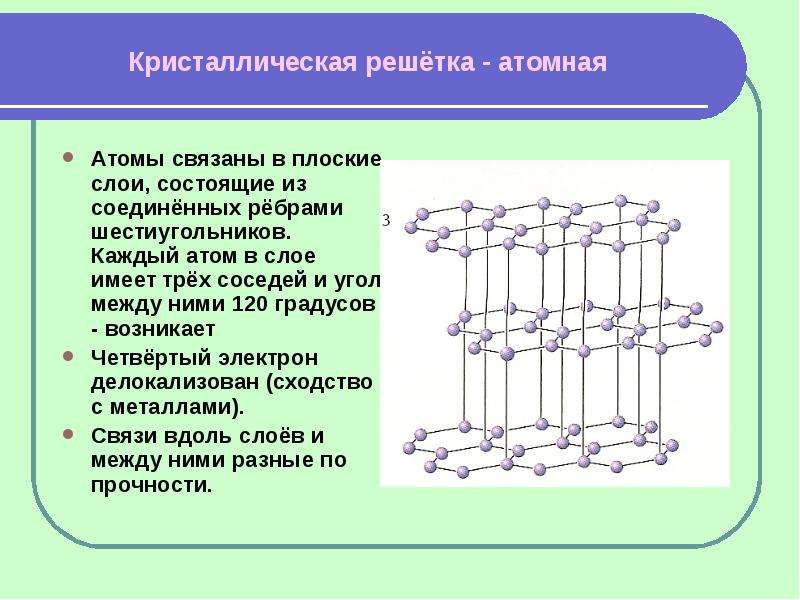
Типичный представитель веществ с такой решеткой – поваренная соль (схематичное изображение решетки поваренной соли есть выше в этом уроке).
Ионные кристаллические решетки характерны для многих соединений с ионной связью. Это соли щелочных и щелочно-земельных металлов, щёлочи.
Ионные кристаллы отличаются высокой твердостью и температурой плавления, малой летучестью. По физическим свойствам они сходны с атомными кристаллами.
Металлические кристаллические решетки присущи простым веществам – металлам. Подробно они будут рассмотрены позже.
Многие простые и сложные вещества имеют кристаллическую структуру.
Для них характерны закономерное расположение частиц в трехмерном пространстве и строгая правильная геометрическая форма кристаллов. Свойства таких веществ зависят не только от строения образующих их атомов и характера их химической связи, но и от кристаллической структуры веществ.
Определить тип кристаллической решетки вещества поможет таблица:
| Металл | Неметалл | Тип кристаллической решетки | Свойства веществ с этим типом кристаллической решетки | |
1, 2, 3 гр главных п/г | не 1, 2, 3 гр главных п/г | ||||
Простые вещества | — | — | С (алмаз и графит) Р (черный фосфор) | Атомная | Твердые, тугоплавкие, нерастворимые или слаборастворимые. Диэлектрики или полупроводники |
+ | + | — | Металлическая | Твердые, пластичные, нерастворимые. Проводники | |
— | — | + |
Молекулярная | Непрочные, летучие, жидкие и твердые, растворимые в большинстве. Диэлектрики | |
Сложные вещества | — | — | + | ||
— | + | — | Атомная | Твердые, тугоплавкие, нерастворимые или слаборастворимые. Диэлектрики или полупроводники | |
+ | — | — | Ионная | Твердые, тугоплавкие, растворимые. Проводники или полупроводники | |
Выводы:
- Если вещество состоит из одного металла, то решетка металлическая.
- Если в составе вещества нет металла, либо оно органическое, то решетка молекулярная. Исключение составляют С (алмаз и графит) и Р (черный фосфор), имеющие атомную решетку.
- Если в составе вещества есть металл 1, 2, 3 групп главных подгрупп, то решетка ионная.
- Если в составе вещества есть металл не из 1, 2, 3 групп главных подгрупп, то решетка атомная.
 Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Исходя из сказанного выше составим обобщающую таблицу:
Характеристика решетки | Металлическая | Атомная | Ионная | Молекулярная |
(атомно- металлическая) | (атомно- ковалентная) | |||
Состав узла решетки | Атом металла и электрон | Атомы, связанные ковалентной полярной и неполярной связью | Атомы, связанные ионной связью | Молекулы с слабыми связями |
Тип связи между структурами решетки | Металлическая | Ковалентная | Ионная
| Водородная |
Частично ковалентная | Ковалентная полярная и неполярная | |||
Прочность связи | умеренно прочная | Очень прочная | Умеренно прочная | Непрочная |
Агрегатное состояние | Твердые, пластичные, металлы и сплавы | Твердые, тугоплавкие | Твердые, тугоплавкие | Летучие (имеют запах) |
Жидкие | ||||
Твердые | ||||
Температура плавления | Высокая | Высокая | Высокая | Низкая |
Электропроводность | Проводники | Диэлектрики и полупроводники | Проводники и полупроводники | Диэлектрики |
Растворимость в воде | Нерастворимы | Нерастворимы или полурастворимы | Растворимы | Растворимы в большинстве |
Металл | Да | Металл в составе вещества | Нет | |
Состав | Простые вещества | Сложные вещества | Простые вещества неметаллы и сложные в-ва | |
Металлы | Металлы | Неметаллы | ||
побочных групп | 1, 2, 3 групп главных подгрупп | с неметаллами | ||
с неметаллами (в том числе оксиды), щелочами, солями | ||||
кремниевая кислота (исключение) | все кислоты за исключением кремниевой | |||
благородные газы | ||||
органические вещества | ||||
двухатомные молекулы за исключением ранее преречисленных | ||||
Пример | Al, Cu, Mn, Fe, Zn | Н2SiO3, SiO2, B, Al2O3, C (алмаз и графит), Р (черный фосфор) | NaCl, KNO3, Na3PO4, K2SO4 | NH3, H2O, Cl2, CO2, N2, J2, Br2, P (красный и белый фосфор) |
Углекислый газ сухой лед — Справочник химика 21
Свойства и реакции 2-аминоэтансульфокислоты и ее производных.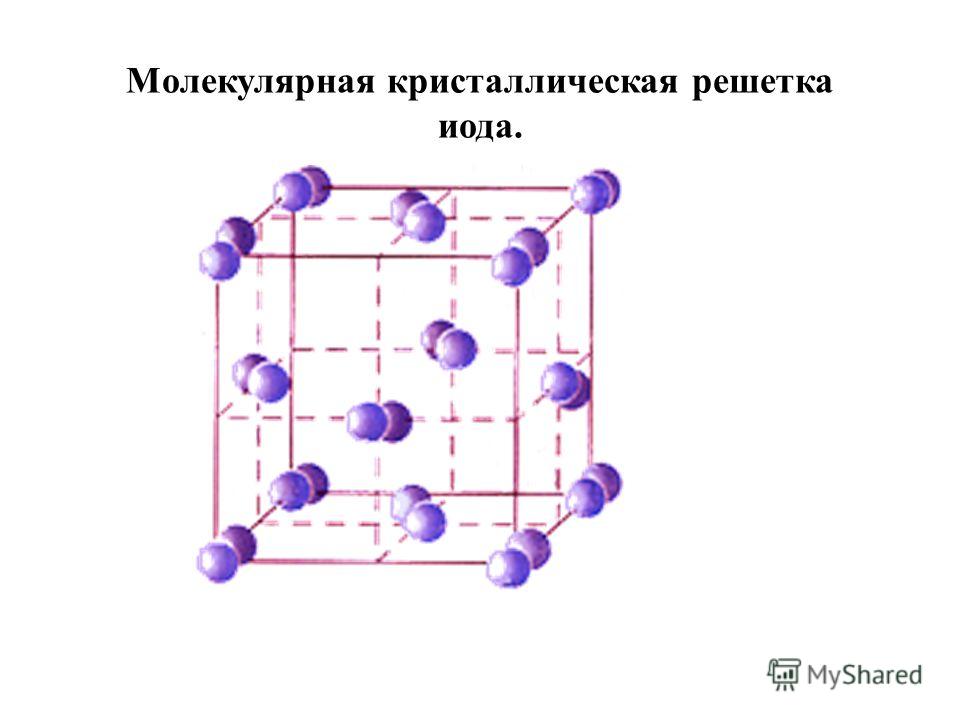 Как отмечено выше, таурин обладает слабо выраженными кислотными свойствами. Определение константы ионизации дало различные величины, причем два более новых значения [170] составляют 1,8-10″ и 5,77-10 . Водные растворы таурина имеют диэлектрическую постоянную выше, чем у воды, причем она увеличивается пропорционально концентрации раствора 171]. Аналогичное действие оказывают другие солеобразные соединения, в которых положительные и отрицательные ионы, присутствуя в одной молекуле (двухполярные ионы), создают постоянные диполи. В кислом растворе таурин чрезвычайно устойчив к действию окисляющих агентов. Он не вступает в реакцию с серной кислотой, кипящей азотной кислотой, царской водкой или сухим хлором [172]. Однако при сплавлении таурина с углекислым натрием и азотнокислым калием сера полностью превращается [c.134]
Как отмечено выше, таурин обладает слабо выраженными кислотными свойствами. Определение константы ионизации дало различные величины, причем два более новых значения [170] составляют 1,8-10″ и 5,77-10 . Водные растворы таурина имеют диэлектрическую постоянную выше, чем у воды, причем она увеличивается пропорционально концентрации раствора 171]. Аналогичное действие оказывают другие солеобразные соединения, в которых положительные и отрицательные ионы, присутствуя в одной молекуле (двухполярные ионы), создают постоянные диполи. В кислом растворе таурин чрезвычайно устойчив к действию окисляющих агентов. Он не вступает в реакцию с серной кислотой, кипящей азотной кислотой, царской водкой или сухим хлором [172]. Однако при сплавлении таурина с углекислым натрием и азотнокислым калием сера полностью превращается [c.134] Катализаторы (N1 30%, Си 5% N1 30%, Си 10% N1 16%, Си 10%) готовились осаждением карбонатов путем предварительной пропитки диатомита 10%-ным раствором углекислого натрия и последующей обработкой 10%-ными растворами сернокислых солей никеля, меди с последующим восстановлением в токе водорода при 350 °С.
 Уменьшение времени восстановления катализатора с 20 до 10 ч практически мало сказывалось на активности катализатора содержание глицерина в гидрогенизате не менялось, содержание гликолей возрастало с 34% (20 ч) до 44% к сухим веществам (10 ч). Катализатор, выгруженный в токе азота и углекислого газа, дает практически одинаковые результаты. Уменьшение скорости подачи водорода с 12 до 6 т /не сказывается на активности катализатора. При восстановлении шихты катализатора в течение 20 ч получен катализатор, расщепляющий углевод с содержанием в катализате высших полиолов 24%, глицерина 28%, гликолей 30% к сухим веществам. При гидрогенолизе 10%)-ного раствора сахарозы в течение 153 ч непрерывной работы получен гидрогенизат с содержанием глицерина 29%, глико-лей 34%, высших полиолов 18% к сухим веществам. [c.24]
Уменьшение времени восстановления катализатора с 20 до 10 ч практически мало сказывалось на активности катализатора содержание глицерина в гидрогенизате не менялось, содержание гликолей возрастало с 34% (20 ч) до 44% к сухим веществам (10 ч). Катализатор, выгруженный в токе азота и углекислого газа, дает практически одинаковые результаты. Уменьшение скорости подачи водорода с 12 до 6 т /не сказывается на активности катализатора. При восстановлении шихты катализатора в течение 20 ч получен катализатор, расщепляющий углевод с содержанием в катализате высших полиолов 24%, глицерина 28%, гликолей 30% к сухим веществам. При гидрогенолизе 10%)-ного раствора сахарозы в течение 153 ч непрерывной работы получен гидрогенизат с содержанием глицерина 29%, глико-лей 34%, высших полиолов 18% к сухим веществам. [c.24] Диоксид, обычно называемый двуокисью угле рода, СО2 образуется при полном сгорании свободного углерода в атмосфере кислорода. Он представляет собой бесцветный газ, в связи с чем и носит тривиальное название углекислый газ . Теплота образования двуокиси углерода из графита составляет 393,7 кдж г-моль. Плотность двуокиси углерода при н.у. 1,977 г/л (по воздуху 1,53). Двуокись углерода легко сжижается ее критическая температура 31,3° С, критическое давление 72,9 атм.. При сильном охлаждении она превращается в белую снегообразную массу (сухой лед), которая при нормальном давлении возгоняется (не плавясь) при —78,5 С. При давлении 5 атм твердая двуокись углерода плавится при —56,7 С. Теплота плавления двуокиси углерода 51 дж г, теплота испарения (при —56 С) 569 5ж/г. Жидкая двуокись углерода не проводит электрического тока. Кристаллическая решетка — молекулярного типа. [c.196]
Теплота образования двуокиси углерода из графита составляет 393,7 кдж г-моль. Плотность двуокиси углерода при н.у. 1,977 г/л (по воздуху 1,53). Двуокись углерода легко сжижается ее критическая температура 31,3° С, критическое давление 72,9 атм.. При сильном охлаждении она превращается в белую снегообразную массу (сухой лед), которая при нормальном давлении возгоняется (не плавясь) при —78,5 С. При давлении 5 атм твердая двуокись углерода плавится при —56,7 С. Теплота плавления двуокиси углерода 51 дж г, теплота испарения (при —56 С) 569 5ж/г. Жидкая двуокись углерода не проводит электрического тока. Кристаллическая решетка — молекулярного типа. [c.196]
Примем, что 10% кислорода топлива дадут ири сухом разложении углекислый газ по реакции [c.285]
В сухом колошниковом газе по объему до 32% оксида углерода (И), 9—14% углекислого газа, остальное — азот. Сколько ио расчету кубических метров кислорода требуется для сжигания 1000 м этого газа [c.
 131]
131]СО. СО, 0 и N2 — содержание (в % объ-змн.) соответственно углекислого газа, окиси углерода, кислорода и азота в сухих газах. [c.280]
В последнее десятилетие начал особенно интенсивно разрабатываться метод увеличения нефтеотдачи путем нагнетания в залежь углекислого газа. Углекислый газ непосредственно не смешивается в нефтью в пластовых условиях, но по мере продвижения по пласту в углекислом газе все больше растворяются легкие УВ нефти и одновременно газ растворяется в нефти. Этот процесс приводит к образованию переходной зоны, и при длительном контакте возможно полное смещение СО2 с нефтью. Так как углекислый газ растворяет УВ лучше, чем метан и сухой природный газ, то давление смесимости при нагнетании в пласт СО2 всегда ниже, чем при закачке сухого природного газа. [c.118]
Получение белого фосфора из красного. На дно сухой пробирки длиной 17—20 см поместите 0,3—0,5 г сухого красного фосфора так, чтобы он не попал на стенки пробирки.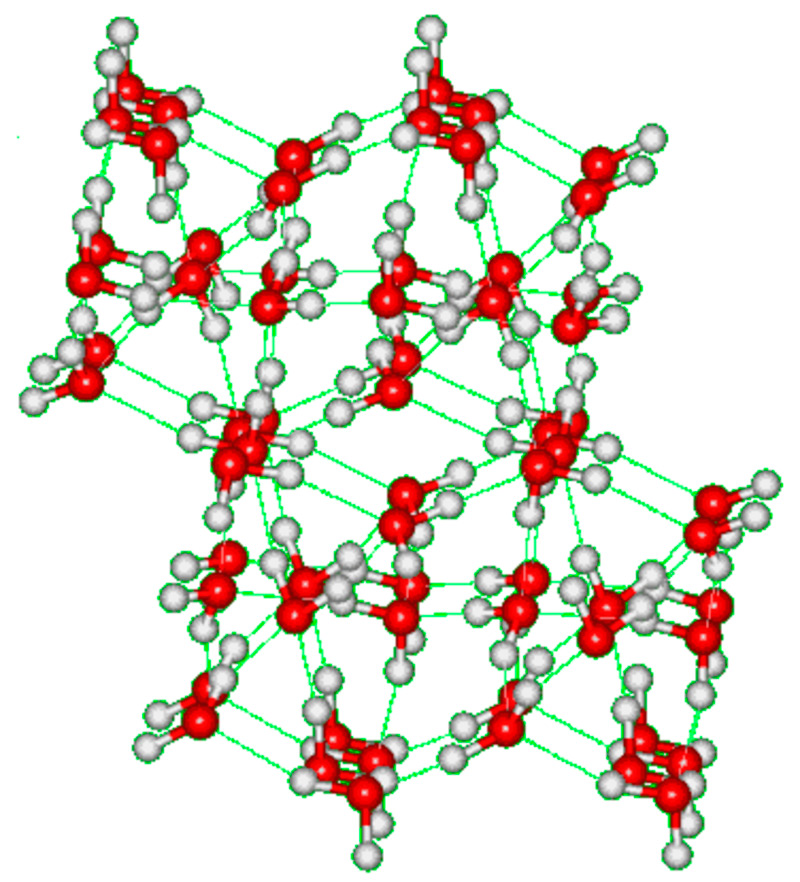 В течение 1 мин пропустите в пробирку сухой углекислый газ. Укрепите пробирку в лапках штатива, находящегося в вытяжном шкафу, в горизонтальном положении. Неплотно закройте ее пробкой из ваты и слегка нагрейте ту ее часть, где находится фосфор. Наблюдайте осаждение белого фосфора на холодных частях пробирки. В темноте мон но увидеть свечение белого фосфора, вызванное его [c.179]
В течение 1 мин пропустите в пробирку сухой углекислый газ. Укрепите пробирку в лапках штатива, находящегося в вытяжном шкафу, в горизонтальном положении. Неплотно закройте ее пробкой из ваты и слегка нагрейте ту ее часть, где находится фосфор. Наблюдайте осаждение белого фосфора на холодных частях пробирки. В темноте мон но увидеть свечение белого фосфора, вызванное его [c.179]
Помещают в сухую пробирку кирпичик, приготовленный заранее из известкового раствора. Пропускают в пробирку углекислый газ до момента появления влаги на стенках пробирки. Обратить внимание на тепловой эффект реакции. Написать уравнение реакции карбонизации с учетом теплового эффекта. [c.112]
Углекислый кальций и углекислый магний (в сумме) в пересчете на сухое вещество. [c.63]
Механическое смешение фтористого натрия, талька, углекислого магния и сухих минеральных красок [c.233]
Модифицированный ТЗК. Перед приготовлением адсорбента из ТЗК его обрабатывают. Из порошка ТЗК отсеивают 500 г целевой фракции с частицами размером 0,25 — 0,5 мм. Отсеянную фракцию обрабатывают 2%-ным водным раствором углекислого натрия, затем воду испаряют в сушильном шкафу при 150 С и периодическом перемешивании порошка стеклянной палочкой. После удаления воды сухой порошок помеш ают в фарфоровую чашку и ставят в муфельную печь для прокаливания при 800 °С в течение 3 ч. Обработанный содой и прокаленный в муфеле ТЗК охлал дают в эксикаторе там же его хранят, используя по мере надобности. [c.98]
Из порошка ТЗК отсеивают 500 г целевой фракции с частицами размером 0,25 — 0,5 мм. Отсеянную фракцию обрабатывают 2%-ным водным раствором углекислого натрия, затем воду испаряют в сушильном шкафу при 150 С и периодическом перемешивании порошка стеклянной палочкой. После удаления воды сухой порошок помеш ают в фарфоровую чашку и ставят в муфельную печь для прокаливания при 800 °С в течение 3 ч. Обработанный содой и прокаленный в муфеле ТЗК охлал дают в эксикаторе там же его хранят, используя по мере надобности. [c.98]
Высший оксид углерода (IV) СОг (углекислый газ) — бесцветный газ, имеющий слабокислый запах и вкус. Он в 1,5 раза тяжелее воздуха (р = 1,98 г/л). В одном объеме воды при 20 °С растворяется 0,88 объема СО2. При охлаждении в условиях нормального давления газ затвердевает при — 78,515 С, минуя жидкое состояние. Твердый оксид углерода (IV) — снегообразная масса, называемая сухим льдом. Жидкий СО2 образуется только под давлением (при 20 °С, 58,46-10 Па). [c.133]
[c.133]
Для некоторых природных газов характерно высокое содержание азота например, в султангуловском газе Куйбышевской области его 20%. В таких газах азоту часто сопутствуют редкие газы — гелий, аргон и др. Содержание гомологов метана в природном газе невелико этана от 0,1 до 8,0% (редко), пропана от 0,1 до 3%, бутана и высших, как правило, — доли процента. Примеси углекислого газа не превышают 2,5%. Ввиду резкого преобладания метана и небольшого количества углеводородов С4—С5 большинство природных газов относят к так называемым сухим газам. [c.22]
В пробирках находятся сухие хлористый кальций, углекислый натрий, сернокислый калий, хлористый барий. Как распознать эти вещества, не прибегая к помощи химических реактивов [c.76]
Хлористый кальций содержит всегда некоторое количество окиси кальция, поглощающей вследствие этого, кроме воды, также углекислый газ. Поэтому через трубкн с хлористым кальцием необходимо сначала пропустить сильный ток углекислого газа и затем продуть сухим воздухом.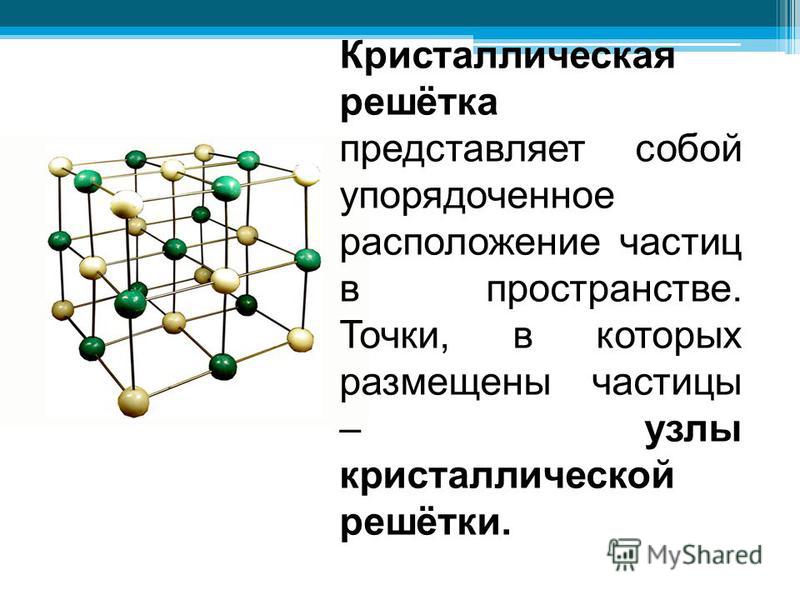 [c.187]
[c.187]
Значительно труднее отделить магний, так как для этого необходимо предварительно удалить аммонийные соли выпариванием раствора и прокаливанием сухого остатка. После этого магний отделяют от щелочных металлов путем осаждения раствором гидроокиси бария или, удобнее, спиртовым раствором углекислого аммония. Осадок углекислого магния отфильтровывают, фильтрат выпаривают, прокаливают и взвешивают сульфаты щелочных металлов. Ниже подробнее описан ход анализа этим методом. [c.470]
В небольших количествах (0,03% по объему) углекислый газ всегда содержится в воздухе. Он не имеет цвета и запаха. При —78,5° С превращается в твердую снегообразную массу, называемую сухим льдом , который возгоняется, не плавясь. [c.246]
Получение сухого льда . На вентиль баллона с СО2 наденьте мешок из плотной ткани и пропустите сильный ток газа. Наблюдайте образование в мешке сухого льда . Измерьте температуру твердого углекислого газа.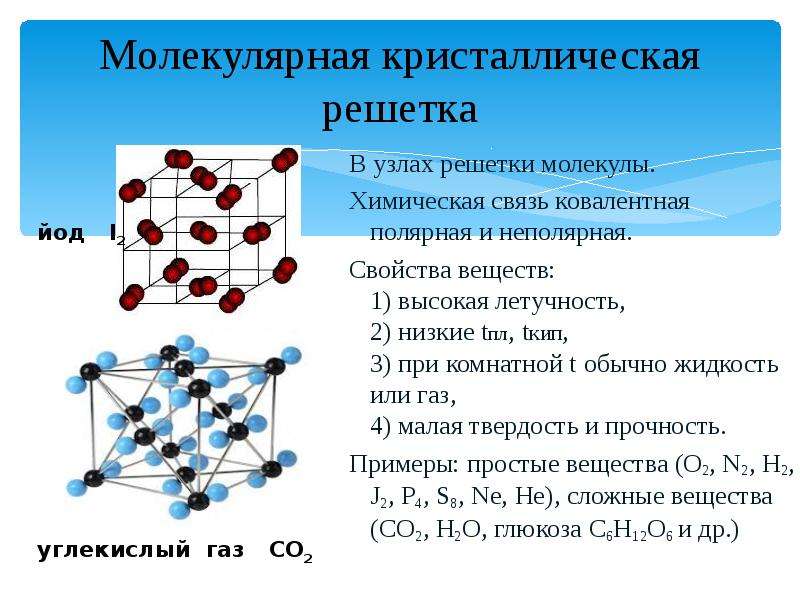 [c.207]
[c.207]
Соберите прибор для получения чистого и сухого газа. Это могут быть кислород, водород, хлор, углекислый газ и др. Если Вы не будете пользоваться аппаратом Киппа, рассчитайте то количество исходного вещества (но в трехкратном избытке), которое потребуется для получения объема газа, соответствующего емкости колбы. [c.119]
Воздух имеет сложный состав. Его основные составные части можно подразделить на три группы постоянные, переменные и случайные. К первым относятся кислород (около 21% по объему), азот (около 78%) и так называемые инертные газы (около 1%). Содержание этих составных частей практически не зависит от того, в каком месте поверхности земного шара взята проба сухого воздуха. Ко второй группе относятся углекислый газ (0,02—0,04%) и водяной пар (до 3%). Содержание случайных составных частей зависит от местных условий вблизи металлургических заводов к воздуху часто бывают примешаны заметные количества сернистого газа, в местах, где происходит распад органических остатков, — аммиака и т. д. Помимо различных газов, воздух всегда содержит большее или меньшее количество пыли. [c.34]
д. Помимо различных газов, воздух всегда содержит большее или меньшее количество пыли. [c.34]
Так как СОг не поддерживает жизнедеятельности бактерий и плесеней, сроки сохраняемости пищевых продуктов в атмосфере этого газа увеличиваются. С другой стороны, повышение содержания СОг в воздухе теплиц ведет к стимулированию роста растений ( углекислое удобрение ). Практически это достигается путем помещения в теплицы кусков сухого льда. Для большинства овош,ных культур наиболее благоприятным оказалось содержание СОг от 0,2 до 0,3%. [c.508]
Тпе . Твердый углекислый газ — удобный хладагент, так ч. ii i (1м > как у него большая энтальпия испарения, причем он переходит в газообразное состояние, минуя жидкое. Поэтому его называют сухим льдом. В промышленности СО2 получают как побочный продукт при производстве извести из известняка и при брожении сахара. [c.498]
ВЗЯТЬ не Б большом избытке, нагревание смеси с обратным холодильником приводит к образованию некоторого количества сложного эфира. Сообщение о получении алкилсульфонатов при нагревании сульфохлорида со спиртом [145] показывает, что в данном случае взято эквимолекулярное количество спирта или реакция велась короткое время. н-Пропиловый и н-бутиловый эфиры п-толуолсульфокислоты с выходом 25—30% получены при нагревании с обратным холодильником сульфохлорида с 10%-ным избытком спирта [146]. При пропускании сухого воздуха через смесь п-толуолсульфохлорида и и-пропилового спирта при 100—125° с целью удаления образующегося хлористого водорода [147] получается около 70% сложного и около 5% простого эфиров. К реакционной смеси добавляется небольшое количество углекислого натрия для нейтрализации п-толуолсульфокислоты, могущей образоваться в результате побочной реакции. Другим побочным продуктом является, повидимому, хлористый этил, хотя он и не упоминается в сообщении. При нагревании бензолсульфохлорида и метилового спирта в запаянной трубке до 160° единственными продуктами реакции получаются хлористый метил и бензолсульфокислота [144].
Сообщение о получении алкилсульфонатов при нагревании сульфохлорида со спиртом [145] показывает, что в данном случае взято эквимолекулярное количество спирта или реакция велась короткое время. н-Пропиловый и н-бутиловый эфиры п-толуолсульфокислоты с выходом 25—30% получены при нагревании с обратным холодильником сульфохлорида с 10%-ным избытком спирта [146]. При пропускании сухого воздуха через смесь п-толуолсульфохлорида и и-пропилового спирта при 100—125° с целью удаления образующегося хлористого водорода [147] получается около 70% сложного и около 5% простого эфиров. К реакционной смеси добавляется небольшое количество углекислого натрия для нейтрализации п-толуолсульфокислоты, могущей образоваться в результате побочной реакции. Другим побочным продуктом является, повидимому, хлористый этил, хотя он и не упоминается в сообщении. При нагревании бензолсульфохлорида и метилового спирта в запаянной трубке до 160° единственными продуктами реакции получаются хлористый метил и бензолсульфокислота [144].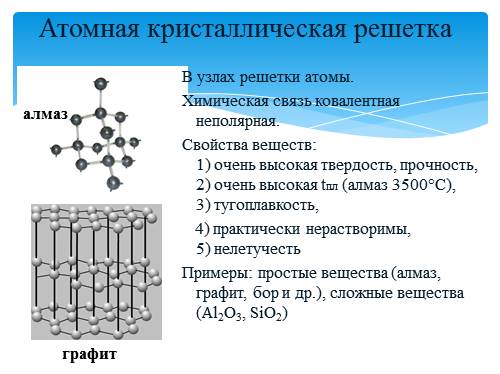 Вторичные и третичные спирты, вероятно, легче превращаются в хлориды при действии сульфохлоридов, чем первичные спирты, однако опытных данных по этому вопросу не имеется. Наличие й-атома хлора в молекуле спирта как будто уменьшает побочные реакции, и при нагревании с обратным холодильником п-толуолсульфохлорида и избытком этиленхлоргидрина образуется не простой эфир или дихлорэтан, а сложный эфир [148]. Такое же действие оказывает цианогруппа — при кипячении ксилольного раствора Р-цианоэтилового. спирта с п-толуолсульфохлоридом в течение нескольких часов образуется соответствующий сложный эфир с выходом 65% [149]. [c.336]
Вторичные и третичные спирты, вероятно, легче превращаются в хлориды при действии сульфохлоридов, чем первичные спирты, однако опытных данных по этому вопросу не имеется. Наличие й-атома хлора в молекуле спирта как будто уменьшает побочные реакции, и при нагревании с обратным холодильником п-толуолсульфохлорида и избытком этиленхлоргидрина образуется не простой эфир или дихлорэтан, а сложный эфир [148]. Такое же действие оказывает цианогруппа — при кипячении ксилольного раствора Р-цианоэтилового. спирта с п-толуолсульфохлоридом в течение нескольких часов образуется соответствующий сложный эфир с выходом 65% [149]. [c.336]
В лаборатории углекислый газ получают при дей-ствии разбавленных соляной или азотной кислот на 4401(110 (. (пропускают через воду (для удаления следов хлороводорода) и через концентрированную серную кислоту (для осушки) и собирают (рис. 23.5). [c.498]
Для ликвидации небольших загораний веществ, не поддающихся тушению водой или другими огнетушащими средствами, применяют твердые инертные вещества в виде порошков.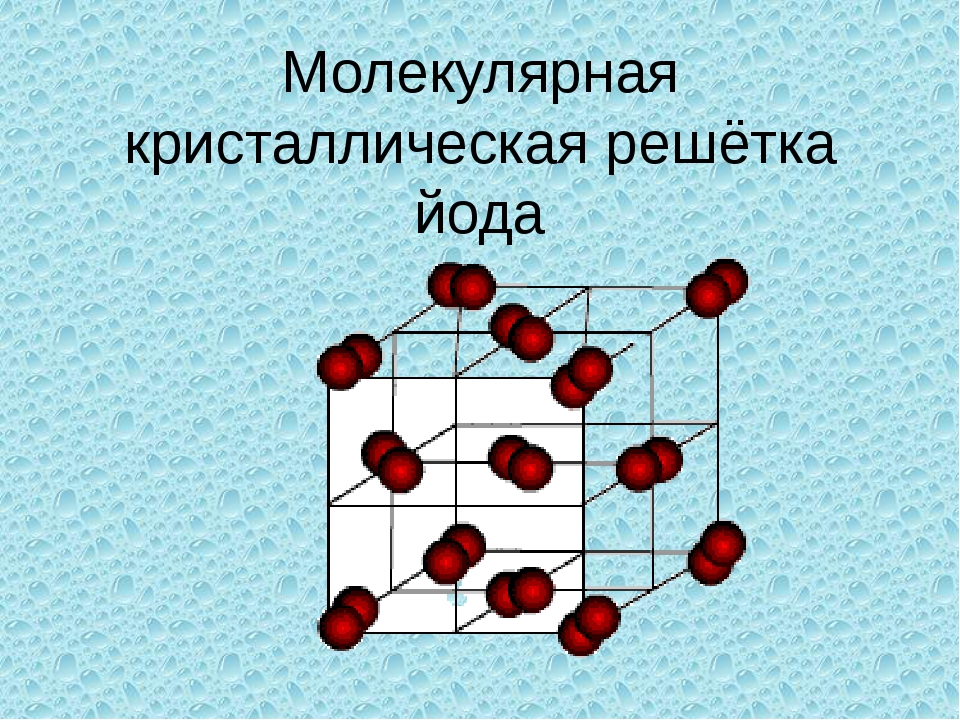 К таким веществам относятся хлориды щелочных и щелочноземельных металлов (флюсы), альбуминсодержащие вещества, сухой остаток после выпарки сульфитных щелоков, карналлит, двууглекислый и углекислый натрий, поташ, квасцы. [c.446]
К таким веществам относятся хлориды щелочных и щелочноземельных металлов (флюсы), альбуминсодержащие вещества, сухой остаток после выпарки сульфитных щелоков, карналлит, двууглекислый и углекислый натрий, поташ, квасцы. [c.446]
Промышленный генератор СО2 позволяет получать при сжигании чистых (неодоризованных) СНГ чистый углекислый газ исключительно простым способом. При окислении СНГ при избыточном количестве воздуха образуется смесь СО2, паров воды и азота, которая может сразу же компримироваться и вдуваться непосредственно в напиток, так как пары воды конденсируются, а азот, обладающий меньщей, чем СО2, растворимостью, пройдет через жидкость, не абсорбируясь. При другом способе получения СО2 накапливается за счет абсорбции в одном из многочисленных селективных растворителей (моноэтаноламин, модифицированный карбонат калия, некоторые аминоспирты, сульфинол и т. п.), а затем регенерируется в виде концентрированного газа из растворителя. Дальнейшая очистка осуществляется при глубоком охлаждении (СО2 затвердевает при —78,5 °С, при этом отделяется большая часть газообразных примесей, имеющих более низкую точку кипения). Твердая двуокись углерода (сухой лед) используется для газирования напитков, в частности в тех случаях, когда масштабы розлива по бутылкам невелики, а организация местного производства СО2 неэкономична. [c.272]
Твердая двуокись углерода (сухой лед) используется для газирования напитков, в частности в тех случаях, когда масштабы розлива по бутылкам невелики, а организация местного производства СО2 неэкономична. [c.272]
Оксид углерода(1У), или диоксид углерода, СО2 — бесцветный газ. Он известен также под названием углекислый газ. Прн пониженной температуре или повышенном давлении СО2 легко переходит в жидкое и твердое состояние. Твердый оксид углерода(IV) называется сухим льдом. В больших количествах оксид углерода(IV) вреден для человека и животных, может вызвать удушье. [c.173]
Вторая группа включает методы, основанные на взаимораст-воримости нефтн и вытесняющего реагента углекислого газа, углеводородных газов высокого давления, растворителей и т. д. В эту группу входят следующие методы закачка сухого газа высокого давления вытеснение нефти обогащенным газом закачка диоксида углерода [c.188]
Snyder life испытаиие (трансформаторных масел) на срок службы [на стойкость к окислению] по Снайдеру soap определение жёсткости котельной воды (с помощью стандартных растворов углекислого кальция и сухого мыла) [c. 509]
509]
В большинстве органических соединений, в растворах азотнокислых, сернокислых и хлористых солей, в окиси углерода, сухом хлоре и сернистом газе, окислах азота, сероводороде, углекислом газе и т, п. аустенитиые хромоиикелевые стали достаточно устойчивы. [c.227]
Методика оцределения температуры замерзания применялась следующая. Собранный прибор без охладителя и образца углеводорода продувался ТОКОМ сухого воздуха со скоростью от 10 до 20 мл/мин. Рубашка пробирки для замора ки1 апия заполнена воздухом, освобожденным от углекислого газа и паров поды. [c.349]
Паро-кислородо-углекислотная конверсия. Паро-кислородо-углеки-слотная (ПКУ) конверсия применяется для получения технологического газа для синтеза метанола и высших спиртов. При замене 0,3 объема водяного пара углекислым газом степень превращения метана и содержание его в сухом конвертирова1Шом газе практически не меняются.Но равновесие сдвигается в сторону образования СО.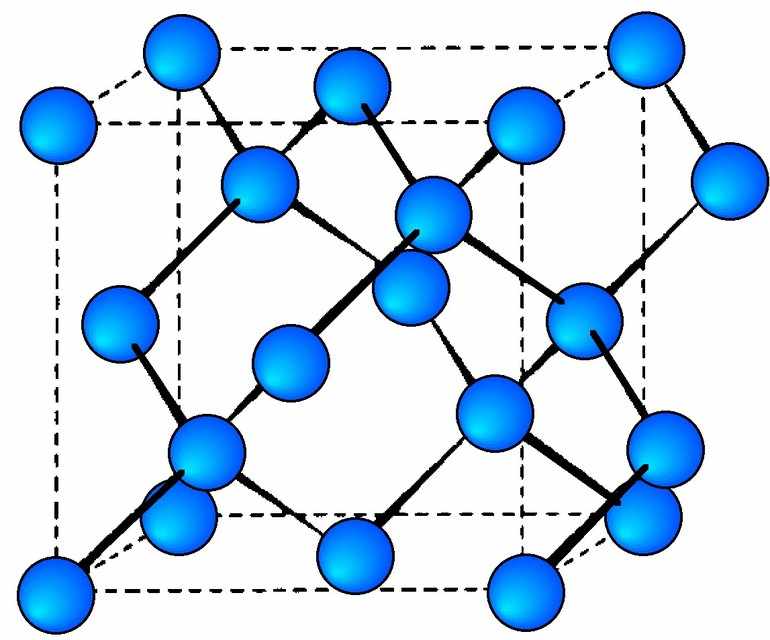 И если при низких температурах происходит конверсия СО, образовавшейся из метана, то при BH oioix температурах протекает конверсия Og с получением дополнительного количества СО. [c.105]
И если при низких температурах происходит конверсия СО, образовавшейся из метана, то при BH oioix температурах протекает конверсия Og с получением дополнительного количества СО. [c.105]
Азотистокислый калий дает приблизительно такие же выходы, как и азотистокислый натрий, но с нитритами кальция и бария получаются нейколько пониженные результаты. В процессе сплавления в значительных количествах образуется спирт. Поскольку исходные соединения, повидимому, были сухими, становится неясным источник воды, необходимой для гидролиза. В течение реакции непрерывно выделяется окись азота, и возможно, что алкилнитриты образуются за счет взаимодействия азотистой кислоты со спиртами, а пе из исходных реагентов. При сплавлении смеси, содержаш ей метилсульфат калия, в качестве побочного продукта выделяется метиламин. Полученный указанным способом нитроэтан содержит небольшое количество нитробутана, образование которого, равно как и образование метиламина, объяснить затруднительно.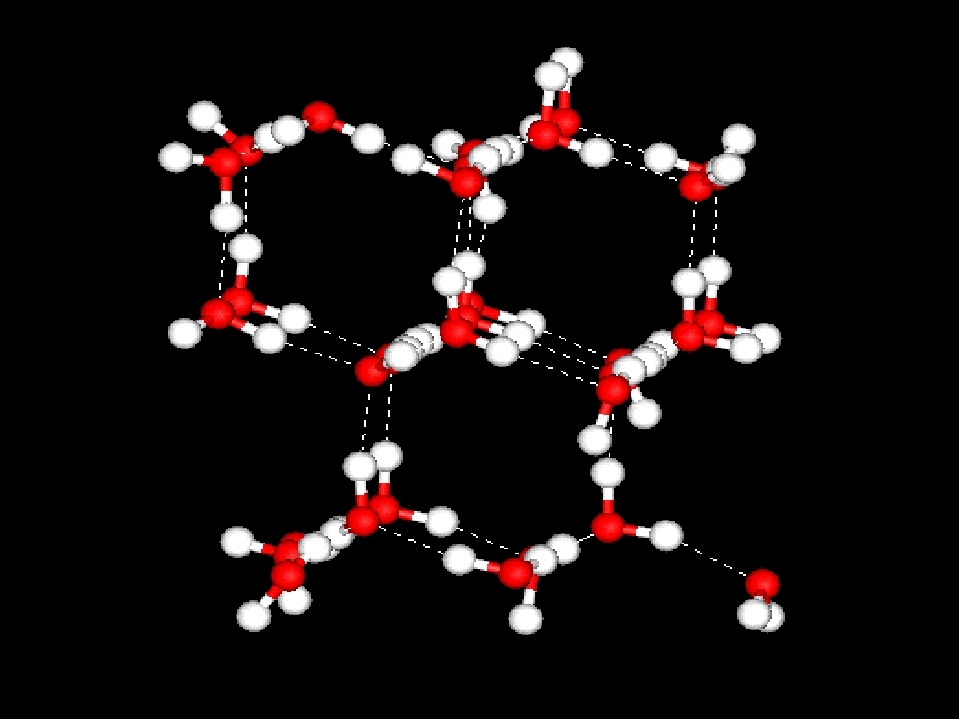 Реакция нитритов с алкилсульфатами, в зависимости от взятого соединения, начинается при 90—140°, причем температуру начала реакции можно несколько снизить, прибавляя к реакционной Смеси небольшое количество воды. Согласно патенту [123], повысить выход нитросоединения можно смешением реагентов с углекислым натрием. [c.23]
Реакция нитритов с алкилсульфатами, в зависимости от взятого соединения, начинается при 90—140°, причем температуру начала реакции можно несколько снизить, прибавляя к реакционной Смеси небольшое количество воды. Согласно патенту [123], повысить выход нитросоединения можно смешением реагентов с углекислым натрием. [c.23]
В трехгорлую колбу, снабженную обратным холодильником и мешалкой, помещают 14,8 г изобутилового спирта, 45 мл воды и 12 г углекислого натрия. В смесь при непрерывном перемешивании и охлаждении в ледяной воде постепенно приливают раствор 20 г мар-ганцевокислого калия в 400 мл воды остальную часть окислителя добавляют небольшими порциями в сухом виде через боковой тубус (температура не должна подниматься выше 5° С). [c.138]
Кислород, применяемый в аппаратах искусственного дыхания, часто содержит углекислый газ, возбулодающий дыхательный центр. Можно ли получить из такого кислорода чистый и сухой кислород путем пропускания газа через трубку, содержащую [c. 118]
118]
Приборы и реактивы секундомер, термометр до 150 С, технохимические весы, прибор для получения углекислого газа (см, рис, 16), фарфоровая ложка, микроскоп, стеклянная пластинка, воронка, спиртовка, фарфоровая чашка, часовое стекло, фильтровальная бумага, стаканы фарфоровые емкостью 150 мл и 500 мп, пробка с отверстием для термометра, цилиндр мерный емкостью 50 мл, колба коническая емкостью 250 мл, бюретка емкостью 25 мл, «кипелки, сухой теплоизолирующий материал (асбестовая крошка, опилки, стекловата), известь-кипелка, гцпс природный и синтетический, вазелин. Растворы соляной кислогы эквивалентной концентрации — 1 моль/л и J = 1,19 г/см фенолфталеина сульфата аммония с массовой допей 10 % гидроксида кальция (насыщ.) карбоната натрия, роданида калия — 0,5 мопь/л. [c.110]
Соли надугольной кислоты (надуглекислые, или перкарбонаты) известны для Ыа, К и РЬ. Они образуются в результате анодного окисления концентрированных растворов карбонатов при низких температурах (по схеме 2СО3 — 2е = С О ) и представляют собой бесцветные (или бледно-синеватые) кристаллические вещества, чрезвычайно гигроскопичные, но в сухом состоянии устойчивые.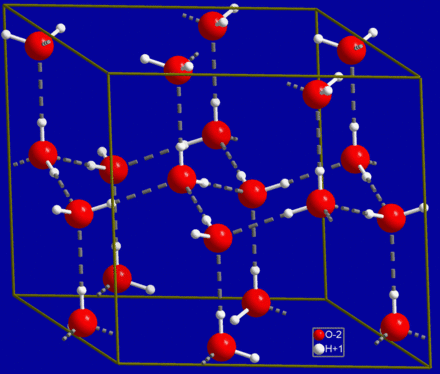 При нагревании эти соли переходят в карбонаты с выделением углекислого газа и кислорода, при [c.509]
При нагревании эти соли переходят в карбонаты с выделением углекислого газа и кислорода, при [c.509]
В земной атмосфере углерод находится в виде углекислого газа СОа. Содержание его в сухом воздухе незначительно и составляет приблизительно 0,03 объемных %. Интересно, что атмосфера планеты Вешра на 97% состоит из оксида углерода (IV). Это было вгервые установлено с помощью автоматической станции [c.410]
Крупная компания ОМИ (Удилайт, г Детройт, шт. Мичиган), которая является поставщиком сырья ДЛЯ цехов электролитических покрытий, извлекает никель из осадков, образующихся из сточных вод от установок ее заказчиков. Никель, являющийся дорогостоящим металлом, удаляют из сточных вод, содержащих раствор сернокислого никеля, путем осаждения его бикарбонатом натрия в виде нерастворимого углекислого никеля. Последний осаждают и затем обезвоживают пресс-фильтром до содержания в нем 50 % твердых веществ. Сухой осадок отправляют обратно поставщику в один из четырех региональных центров, где углекислый никель превращают в высококачественный раствор сернокислого никеля [43].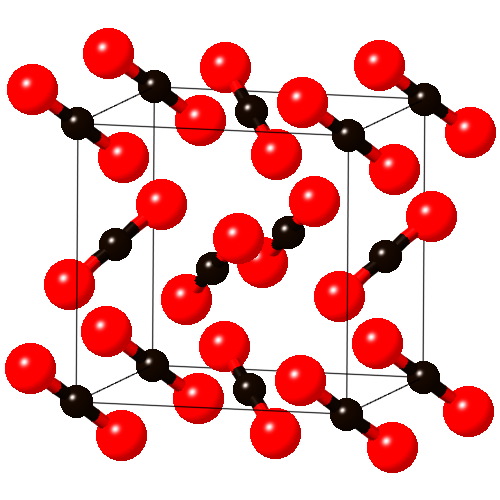 [c.93]
[c.93]
Тип кристаллической решетки сухого льда. Гексагональная тирания. Некоторые другие элементы и решетки
Трехмерное состояние жидкой воды трудно исследовать, но многое было изучено путем анализа структуры кристаллов льда. Четыре соседних атома кислорода с водородным взаимодействием занимают вершины тетраэдра (тетра = четыре, гедрон = плоскость). Средняя энергия, необходимая для разрушения подобной связи во льду, оценивается в 23 кДж / моль -1 .
Способность молекул воды образовывать данное количество водородных цепей, а также указанная прочность создает необычно высокую температуру плавления. Когда он тает, то удерживается жидкой водой, структура которой нерегулярна. Большая часть водородных связей искажается. Для разрушения кристаллической решетки льда с водородной связью требуется большая масса энергии в виде тепла.
Особенности появления льда (Ih)
Многие из обывателей задаются вопросом о том, какая кристаллическая решетка у льда. Необходимо отметить, что плотность большинства веществ возрастает при замораживании, когда молекулярные движения замедляются и образуются плотно упакованные кристаллы. Плотность воды также увеличивается, когда она остывает до достижения максимума при 4°C (277K). Затем, когда температура опускается ниже этого значения, она расширяется.
Необходимо отметить, что плотность большинства веществ возрастает при замораживании, когда молекулярные движения замедляются и образуются плотно упакованные кристаллы. Плотность воды также увеличивается, когда она остывает до достижения максимума при 4°C (277K). Затем, когда температура опускается ниже этого значения, она расширяется.
Это увеличение обусловлено образованием открытого водородно-связанного кристалла льда с его решеткой и меньшей плотностью, в котором каждая молекула воды жестко связана указанным выше элементом и четырьмя другими значениями, и при этом двигается достаточно быстро, чтобы обладать большей массой. Поскольку происходит подобное действие, жидкость замерзает сверху вниз. Это имеет важные биологические результаты, вследствие которых слой льда на пруду изолирует живых существ подальше от сильного холода. Кроме того, два дополнительных свойства воды связаны с его водородными характеристиками: удельной теплоемкостьюи испарением.
Детальное описание структур
Первый критерий представляет собой количество, необходимое для повышения температуры 1 грамма вещества на 1°С. Для повышения градусов воды требуется относительно большая часть тепла, потому что каждая молекула участвует в многочисленных водородных связях, которые должны быть разрушены, чтобы кинетическая энергия увеличивалась. Кстати, обилие H 2 O в клетках и тканях всех крупных многоклеточных организмов означает, что флуктуация температуры внутри клеток сведена к минимуму. Эта особенность имеет решающее значение, поскольку скорость большинства биохимических реакций чувствительна.
Для повышения градусов воды требуется относительно большая часть тепла, потому что каждая молекула участвует в многочисленных водородных связях, которые должны быть разрушены, чтобы кинетическая энергия увеличивалась. Кстати, обилие H 2 O в клетках и тканях всех крупных многоклеточных организмов означает, что флуктуация температуры внутри клеток сведена к минимуму. Эта особенность имеет решающее значение, поскольку скорость большинства биохимических реакций чувствительна.
Также значительно выше, чем у многих других жидкостей. Для преобразования этого тела в газ требуется большое количество тепла, потому что водородные связи должны быть разрушены, чтобы молекулы воды могли дислоцироваться друг от друга и войти в указанную фазу. Изменяемые тела представляют собой постоянные диполи и могут взаимодействовать с другими подобными соединениями и теми, что ионизируются и растворяются.
Иные вещества, указанные выше, могут вступать в контакт только при наличии полярности. Именно такое соединение участвует в строении этих элементов. Кроме того, оно может выравниваться вокруг этих частиц, образованных из электролитов, так что отрицательные атомы кислорода молекул воды ориентированы на катионы, а положительные ионы и атомы водорода, ориентированы на анионы.
Кроме того, оно может выравниваться вокруг этих частиц, образованных из электролитов, так что отрицательные атомы кислорода молекул воды ориентированы на катионы, а положительные ионы и атомы водорода, ориентированы на анионы.
В образуются, как правило, молекулярные кристаллические решетки и атомные. То есть если йод построен таким образом, что в нем присутствует I 2, то в твердом диоксиде углерода, то есть в сухом льде, в узлах кристаллической решетки находятся молекулы CO 2 . При взаимодействии с подобными веществами, ионную кристаллическую решетку имеет лед. Графит, например, обладающий атомной структурой, в основе которой углерод, не способен ее менять, также как и алмаз.
Что происходит, когда кристалл столовой соли растворяется в воде: полярные молекулы притягиваются к заряженным элементам в кристалле, что приводит к образованию подобных частиц натрия и хлорида на его поверхности, в результате эти тела дислоцируются друг от друга, и он начинает растворяться. Отсюда можно наблюдать, что лед имеет кристаллическую решетку с ионной связью. Каждый растворенный Na + притягивает отрицательные концы нескольких молекул воды, тогда как каждый растворенный Cl — притягивает положительные концы. Оболочка, окружающая каждый ион, называется сферой спасения и, обычно, содержит несколько слоев частиц растворителя.
Каждый растворенный Na + притягивает отрицательные концы нескольких молекул воды, тогда как каждый растворенный Cl — притягивает положительные концы. Оболочка, окружающая каждый ион, называется сферой спасения и, обычно, содержит несколько слоев частиц растворителя.
Говорят, что переменные или ион, окруженные элементами, являются сульфатированными. Когда растворителем выступает вода, такие частицы гидратируются. Таким образом, любая полярная молекула имеет тенденцию к сольватации элементами жидкого тела. У сухого льда тип кристаллической решетки образует в агрегатном состоянии атомные связи, которые неизменны. Другое дело кристаллический лед (замороженная вода). Ионные органические соединения, такие как карбоксилазы и протонированные амины, должны обладать растворимостью в гидроксильной и карбонильной группах. Частицы, содержащиеся в таких структурах, двигаются между молекулами, причем их полярные системы образуют водородные связи с этим телом.
Конечно, количество последних указанных групп в молекуле влияет на ее растворимость, которая также зависит от реакции различных структур в элементе: например, одно-, двух- и трех углеродные спирты смешиваются с водой, но более крупные углеводороды с одиночными гидроксильными соединениями гораздо менее разбавляемы в жидкости.
Шестиугольный Ih схож по форме с атомной кристаллической решеткой. У льда и всего естественного снега на Земле она выглядит именно так. Об этом свидетельствует симметрия кристаллической решетки льда, выращенная из водяного пара (то есть снежинок). Находится в космической группе P 63/мм с 194; D 6h, класса Лауэ 6/мм; аналогичный β-, имеющей кратную 6-ти винтовую ось (вращение вокруг в дополнение к сдвигу вдоль нее). Он обладает довольно открытой структурой с низкой плотностью, где эффективность низкая (~ 1/3) по сравнению с простыми кубическими (~ 1/2) или гранецентрированными кубическими (~ 3/4) структурами.
По сравнению с обычным льдом, кристаллическая решетка сухого льда, связанная молекулами CO 2 , статична и меняется лишь при распаде атомов.
Описание решеток и входящих в них элементов
Кристаллы можно рассматривать, как кристаллические модели, состоящие из листов, расположенных друг над другом. Водородная связь упорядочена, тогда как в действительности она случайна, поскольку протоны могут перемещаться между молекулами воды (льда) при температурах выше примерно 5 К. Действительно, вполне вероятно, что протоны ведут себя, как квантовая жидкость в постоянном туннелированном потоке. Это усиливается рассеянием нейтронов, показывающих плотность их рассеяния на полпути между атомами кислорода, что указывает на локализацию и согласованное движение. Здесь наблюдается схожесть льда с атомной, молекулярной кристаллической решеткой.
Действительно, вполне вероятно, что протоны ведут себя, как квантовая жидкость в постоянном туннелированном потоке. Это усиливается рассеянием нейтронов, показывающих плотность их рассеяния на полпути между атомами кислорода, что указывает на локализацию и согласованное движение. Здесь наблюдается схожесть льда с атомной, молекулярной кристаллической решеткой.
Молекулы имеют ступенчатое расположение водородной цепи по отношению к трем своим соседям в плоскости. Четвертый элемент имеет затмеваемое расположение водородной связи. Существует небольшое отклонение от идеальной шестиугольной симметрии, как на 0,3% короче в направлении этой цепи. Все молекулы испытывают одинаковые молекулярные среды. Внутри каждой «коробки» достаточно места для удержания частиц интерстициальной воды. Хотя это, как правило, не считается, недавно они были эффективно обнаружены нейтронной дифракцией порошкообразной кристаллической решеткой льда.
Изменение веществ
Шестиугольное тело имеет тройные точки с жидкой и газообразной водой 0,01 ° C, 612 Па, твердыми элементами — три -21,985 ° C, 209,9 МПа, одиннадцать и два -199,8 ° C, 70 МПа, а также -34,7 ° C, 212,9 МПа. Диэлектрическая проницаемость гексагонального льда составляет 97,5.
Диэлектрическая проницаемость гексагонального льда составляет 97,5.
Кривая плавления этого элемента дается МПа. Уравнения состояния доступны, кроме них некоторые простые неравенства, связывающие изменение физических свойств с температурой гексагонального льда и его водных суспензий. Твердость колеблется в зависимости от градусов, возрастающих примерно от или ниже гипса (≤2) при 0°С, до уровня полевого шпата (6 по при -80 ° С, аномально большое изменение абсолютной твердости (> 24 раза).
Шестиугольная кристаллическая решетка льда образует гексагональные пластины и столбцы, где верхняя и нижняя грани являются базальными плоскостями {0 0 0 1} с энтальпией 5,57 мкДж · см -2 , а другие эквивалентные боковые называются частями призмы {1 0 -1 0} с 5,94 мкДж · см -2 . Вторичные поверхности {1 1 -2 0} с 6.90 μJ ˣ см -2 могут быть сформированы по плоскостям, образованными сторонами структур.
Подобное строение показывает аномальное уменьшение теплопроводности с увеличением давления (как и кубический, и аморфный лед низкой плотности), но отличается от большинства кристаллов. Это связано с изменением водородной связи, уменьшающей поперечную скорость звука в кристаллической решетке льда и воды.
Это связано с изменением водородной связи, уменьшающей поперечную скорость звука в кристаллической решетке льда и воды.
Существуют методы, описывающие, как подготовить большие образцы кристалла и любую желаемую поверхность льда. Предполагается, что водородная связь на поверхности гексагонального исследуемого тела будет более упорядоченной, чем внутри объемной системы. Вариационная спектроскопия с генерацией по частоте колебаний с фазовой решеткой показала, что существует структурная асимметрия между двумя верхними слоями (L1 и L2) в подповерхностной HO цепи базальной поверхности гексагонального льда. Принятые водородные связи в верхних слоях шестиугольниках (L1 O ··· HO L2) сильнее, чем принятые во втором слое к верхнему накоплению (L1 OH ··· O L2). Доступны интерактивные структуры гексагонального льда.
Особенности развития
Минимальное количество молекул воды, необходимых для зарождения льда, примерно 275 ± 25, как и для полного икосаэдрического кластера 280. Образование происходит с коэффициентом 10 10 на поверхности раздела воздух-вода, а не в объемной воде. Рост кристаллов льда зависит от разных темпов роста различных энергий. Вода должна быть защищена от замерзания при крио консервировании биологических образцов, пищи и органов.
Образование происходит с коэффициентом 10 10 на поверхности раздела воздух-вода, а не в объемной воде. Рост кристаллов льда зависит от разных темпов роста различных энергий. Вода должна быть защищена от замерзания при крио консервировании биологических образцов, пищи и органов.
Обычно это достигается быстрыми скоростями охлаждения, использованием небольших образцов и крио консерватора, а также увеличением давления для образования зародышей льда и предотвращения повреждения клеток. Свободная энергия льда / жидкости увеличивается от ~ 30 мДж/м 2 при атмосферном давлении до 40 мДж/м -2 при 200 МПа, что указывает на причину, по которой происходит подобный эффект.
В качестве альтернативы они могут расти быстрее с поверхностей призмы (S2), на случайно нарушенной поверхности быстрозамороженных или взволнованных озер. Рост от граней {1 1 -2 0}, по крайней мере, такой же, но превращает их в основания призмы. Данные о развитии кристалла льда были полностью исследованы. Относительные скорости роста элементов разных граней зависят от способности образовывать большую степень совместной гидратации. Температура (низкая) окружающей воды определяет степень разветвления в кристалле льда. Рост частиц ограничивается скоростью диффузии при низкой степени переохлаждения, то есть
Температура (низкая) окружающей воды определяет степень разветвления в кристалле льда. Рост частиц ограничивается скоростью диффузии при низкой степени переохлаждения, то есть
Но ограничено кинетикой развития при более высоких уровнях понижения градусов >4°C, что приводит к игольчатому росту. Эта форма схожа со строением сухого льда (имеет кристаллическую решетку с шестиугольной структурой), различными характеристиками развития поверхности и температурой окружающей (переохлажденной) воды, которая находится за плоскими формами снежинок.
Зарождение льда в атмосфере глубоко влияет на образование и свойства облаков. Полевые шпаты, обнаруженные в пустынной пыли, которая попадает в атмосферу миллионами тонн в год, являются важными образователями. Компьютерное моделирование показало, что это связано с зарождением плоскостей призматических кристаллов льда на плоскостях поверхности высоких энергий.
Некоторые другие элементы и решетки
Растворенные вещества (за исключением очень небольшого гелия и водорода, которые могут входить в междоузлия) не могут быть включены в структуру Ih при атмосферном давлении, но вытесняются на поверхность или аморфный слой между частицами микрокристаллического тела.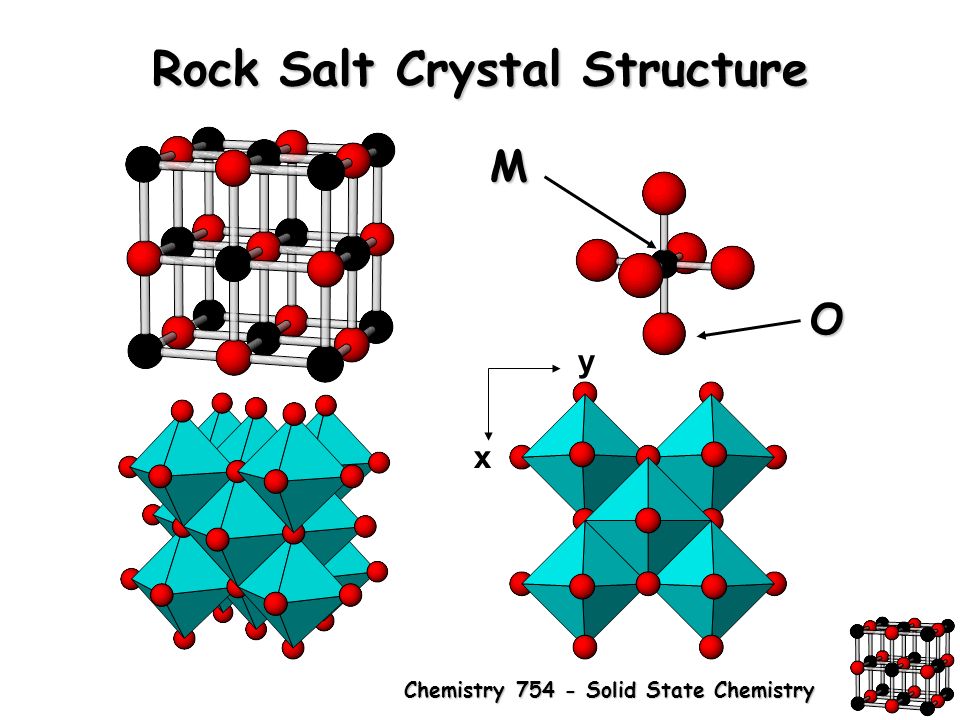 В узлах кристаллической решетки сухого льда находятся некоторые иные элементы: хаотропные ионы, такие как NH 4 + и Cl — , которые включены в более легкое замораживание жидкости, чем другие космотропные, такие как Na + и SO 4 2- , поэтому удаление их невозможно, ввиду того, что они образуют тонкую пленку из оставшейся жидкости между кристаллами. Это может привести к электрической зарядке поверхности из-за диссоциации поверхностной воды, уравновешивающей оставшиеся заряды (что также может привести к магнитному излучению) и изменению рН остаточных жидких пленок, например, NH 4 2 SO 4 становится более кислым и NaCl становится более щелочным.
В узлах кристаллической решетки сухого льда находятся некоторые иные элементы: хаотропные ионы, такие как NH 4 + и Cl — , которые включены в более легкое замораживание жидкости, чем другие космотропные, такие как Na + и SO 4 2- , поэтому удаление их невозможно, ввиду того, что они образуют тонкую пленку из оставшейся жидкости между кристаллами. Это может привести к электрической зарядке поверхности из-за диссоциации поверхностной воды, уравновешивающей оставшиеся заряды (что также может привести к магнитному излучению) и изменению рН остаточных жидких пленок, например, NH 4 2 SO 4 становится более кислым и NaCl становится более щелочным.
Они перпендикулярны граням кристаллической решетке льда, показывающей присоединенный следующий слой (с атомами О-черный). Им характерна медленно растущая базальная поверхность {0 0 0 1}, где прикрепляются только изолированные молекулы воды. Быстро растущая {1 0 -1 0} поверхность призмы, где пары вновь присоединенных частиц могут связываться друг с другом водородом (одна его связь/две молекулы элемента). Наиболее быстро растущая грань {1 1 -2 0} (вторичная призматика), где цепочки вновь присоединенных частиц могут взаимодействовать друг с другом водородной связью. Одна ее цепочка/ молекула элемента — это форма, образующая хребты, которые делят и поощряют превращение в две стороны призмы.
Наиболее быстро растущая грань {1 1 -2 0} (вторичная призматика), где цепочки вновь присоединенных частиц могут взаимодействовать друг с другом водородной связью. Одна ее цепочка/ молекула элемента — это форма, образующая хребты, которые делят и поощряют превращение в две стороны призмы.
Энтропия нулевой точки
k B ˣ Ln (N
Ученые и их труды в этой сфере
Может быть определена, как S 0 = k B ˣ Ln (N E0), где k B — это постоянная Больцмана, N E — эточисло конфигураций при энергии E, а E0 — наименьшая энергия. Это значение для энтропии гексагонального льда при нулевом кельвине не нарушает третьего закона термодинамики «Энтропия идеального кристалла при абсолютном нуле ровно равна нулю», поскольку эти элементы и частицы не идеальны, имеют неупорядоченное водородное связывание.
В этом теле водородная связь является случайной и быстро меняющейся. Эти структуры не точно равны по энергии, а распространяются на очень большое количество энергетически близких состояний, подчиняются «правилам льда». Энтропия нулевой точки — это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1 . Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Энтропия нулевой точки — это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1 . Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Хотя порядок протонов в объемном льду не упорядочен, поверхность, вероятно, предпочитает порядок указанных частиц в виде полос свисающих Н-атомов и О-одиночных пар (нулевая энтропия с упорядоченными водородными связями). Найден беспорядок нулевой точки ZPE, J ˣ mol -1 ˣ K -1 и других. Из всего вышеизложенного видно и понятно, какие типы кристаллических решеток характерны для льда.
Вещество, как вам известно, может существовать в трёх агрегатных состояниях: газообразном, жидком и твёрдом (рис. 70). Например, кислород, который при обычных условиях представляет собой газ, при температуре -194 °С превращается в жидкость голубого цвета, а при температуре -218,8 °С затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
Рис. 70.
Агрегатные состояния воды
Твёрдые вещества делят на кристаллические и аморфные.
Аморфные вещества не имеют чёткой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство пластмасс (например, полиэтилен), воск, шоколад, пластилин, различные смолы и жевательные резинки (рис. 71).
Рис. 71.
Аморфные вещества и материалы
Кристаллические вещества характеризуются правильным расположением составляющих их частиц в строго определённых точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки.
В узлах воображаемой кристаллической решётки могут находиться одноатомные ионы, атомы, молекулы. Эти частицы совершают колебательные движения. С повышением температуры размах этих колебаний возрастает, что приводит, как правило, к тепловому расширению тел.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические (табл. 6).
Таблица 6
Положение элементов в Периодической системе Д. И. Менделеева и типы кристаллических решёток их простых веществ
Простые вещества, образованные элементами, не представленными в таблице, имеют металлическую решётку.
Ионными называют кристаллические решётки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na + , Cl — , так и сложные , ОН — . Следовательно, ионные кристаллические решётки имеют соли, основания (щёлочи), некоторые оксиды. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решётку в форме куба (рис. 72). Связи между ионами в таком кристалле очень прочны. Поэтому вещества с ионной решёткой обладают сравнительно высокой твёрдостью и прочностью, они тугоплавки и нелетучи.
Рис. 72.
Ионная кристаллическая решётка (хлорид натрия)
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы. В таких решётках атомы соединены между собой очень прочными ковалентными связями.
Рис. 73.
Атомная кристаллическая решётка (алмаз)
Такой тип кристаллической решётки имеет алмаз (рис. 73) — одно из аллотропных видоизменений углерода. Огранённые и отшлифованные алмазы называют бриллиантами. Их широко применяют в ювелирном деле (рис. 74).
Рис. 74.
Две императорские короны с алмазами:
а — корона Британской империи; б — Большая императорская корона Российской империи
К веществам с атомной кристаллической решёткой относятся кристаллические бор, кремний и германий, а также сложные вещества, например такие, как кремнезем, кварц, песок, горный хрусталь, в состав которых входит оксид кремния (IV) SiO 2 (рис. 75).
Рис. 75.
Атомная кристаллическая решётка (оксид кремния (IV))
Большинство веществ с атомной кристаллической решёткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С, у кремния — 1415 °С, у кремнезёма — 1728 °С), они прочны и тверды, практически нерастворимы.
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и ковалентными полярными (хлороводород НСl, вода Н 2 0), и ковалентными неполярными (азот N 2 , озон 0 3). Несмотря на то что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решётками имеют малую твёрдость, низкие температуры плавления, летучи.
Примерами веществ с молекулярными кристаллическими решётками являются твёрдая вода — лёд, твёрдый оксид углерода (IV) С) 2 — «сухой лёд» (рис. 76), твёрдые хлороводород НСl и сероводород H 2 S, твёрдые простые вещества, образованные одно- (благородные газы: гелий, неон, аргон, криптон), двух- (водород Н 2 , кислород O 2 , хлор Сl 2 , азот N 2 , иод 1 2), трёх- (озон O 3), четырёх- (белый фосфор Р 4), восьмиатомными (сера S 7) молекулами. Большинство твёрдых органических соединений имеют молекулярные кристаллические решётки (нафталин, глюкоза, сахар).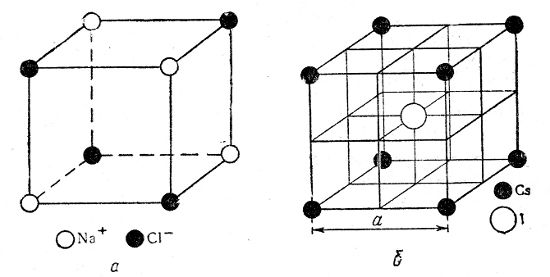
Рис. 76.
Молекулярная кристаллическая решётка (углекислый газ)
Вещества с металлической связью имеют металлические кристаллические решётки (рис. 77). В узлах таких решёток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны в общее пользование). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Рис. 77.
Металлическая кристаллическая решётка (железо)
Лабораторный опыт № 13
Ознакомление с коллекцией веществ с разным типом кристаллической решётки. Изготовление моделей кристаллических решёток
Для веществ, имеющих молекулярное строение, справедлив открытый французским химиком Ж. Л. Прустом (1799-1803) закон постоянства состава. В настоящее время этот закон формулируют так:
Закон Пруста — один из основных законов химии. Однако для веществ немолекулярного строения, например ионного, этот закон не всегда справедлив.
Ключевые слова и словосочетания
- Твёрдое, жидкое и газообразное состояния вещества.
- Твёрдые вещества: аморфные и кристаллические.
- Кристаллические решётки: ионные, атомные, молекулярные и металлические.
- Физические свойства веществ с различными типами кристаллических решёток.
- Закон постоянства состава.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- В каком агрегатном состоянии будет находиться кислород при -205 °С?
- Вспомните произведение А. Беляева «Продавец воздуха» и охарактеризуйте свойства твёрдого кислорода, используя его описание, приведённое в книге.

- К какому типу веществ (кристаллические или аморфные) относятся пластмассы? Какие свойства пластмасс лежат в основе их промышленного применения?
- К какому типу относится кристаллическая решетка алмаза? Перечислите характерные для алмаза физические свойства.
- К какому типу относится кристаллическая решетка иода? Перечислите характерные для иода физические свойства.
- Почему температура плавления металлов изменяется в очень широких пределах? Для подготовки ответа на этот вопрос используйте дополнительную литературу.
- Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? В каком из указанных случаев происходит разрушение химической связи, а в каком — нет? Почему?
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме.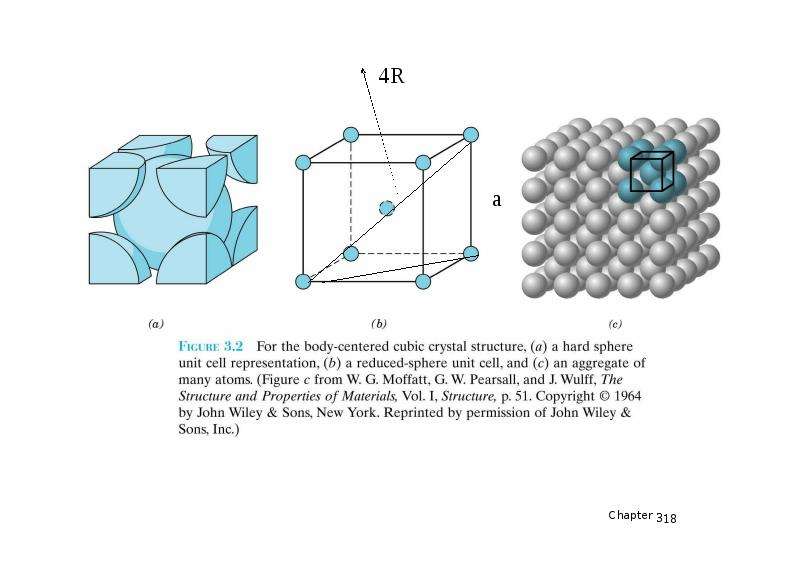 Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- кристаллическая решетка.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные . Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой . Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул.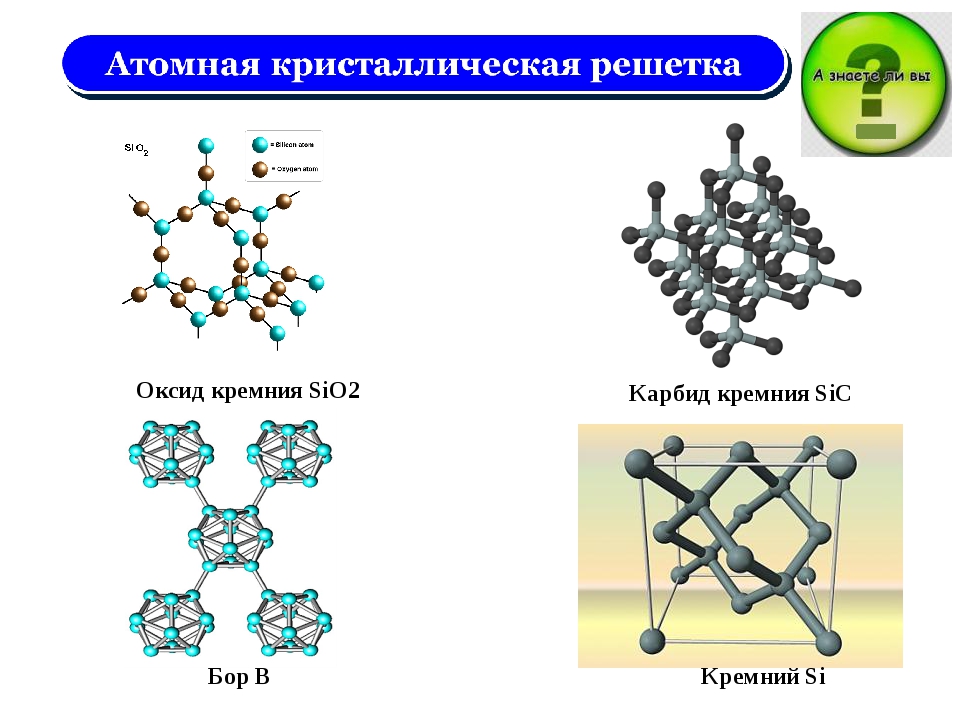 Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.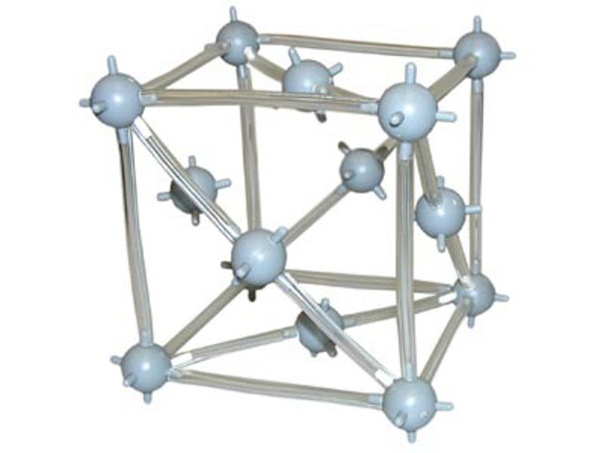
Из 14 известных на сегодняшний день форм твердой воды в природе мы встречаем только одну лед. Остальные образуются в экстремальных условиях и для наблюдений вне специальных лабораторий недоступны. Самое интригующее свойство льда это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки фирна на снежном поле или же гигантских ледниковых масс.
В небольшом японском городе Кага, расположенном на западном берегу острова Хонсю, есть необычный музей. Снега и льда. Основал его Укихиро Накайя первый человек, который научился выращивать в лаборатории искусственные снежинки, такие же красивые, как и те, что падают с неба. В этом музее посетителей со всех сторон окружают правильные шестиугольники, потому что именно такая гексагональная симметрия свойственна кристаллам обычного льда (кстати, греческое слово kristallos, собственно, и означает «лед»). Она определяет многие уникальные его свойства и заставляет снежинки, при всем бесконечном их разнообразии, расти в форме звездочек с шестью, реже тремя или двенадцатью лучами, но никогда с четырьмя или пятью.
Она определяет многие уникальные его свойства и заставляет снежинки, при всем бесконечном их разнообразии, расти в форме звездочек с шестью, реже тремя или двенадцатью лучами, но никогда с четырьмя или пятью.
Молекулы в ажуре
Разгадка структуры твердой воды кроется в строении ее молекулы. Н2О можно упрощенно представить себе в виде тетраэдра (пирамиды с треугольным основанием). В центре находится кислород, в двух вершинах по водороду, точнее протону, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, отчего их называют неподеленными.
При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, которые не позволяют при замерзании создавать плотную структуру. Этот невидимый каркас из водородных связей располагает молекулы в виде ажурной сетки с полыми каналами. Стоит лед нагреть, как кружево рушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, вот почему вода тяжелее льда.
Этот невидимый каркас из водородных связей располагает молекулы в виде ажурной сетки с полыми каналами. Стоит лед нагреть, как кружево рушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, вот почему вода тяжелее льда.Лед, который образуется при атмосферном давлении и плавится при 0°С, самое привычное, но все еще не до конца понятное вещество. Многое в его структуре и свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а вот атомы водорода занимают самые разные положения вдоль связей. Такое поведение атомов вообще-то нетипично как правило, в твердом веществе все подчиняются одному закону: либо все атомы расположены упорядоченно, и тогда это кристалл, либо случайно, и тогда это аморфное вещество.
Лед трудно расплавить, как бы ни странно это звучало. Не будь водородных связей, сцепляющих молекулы воды, он плавился бы при 90°С. При этом, замерзая, вода не уменьшается в объеме, как это происходит с большинством известных веществ, а увеличивается за счет образования ажурной структуры льда.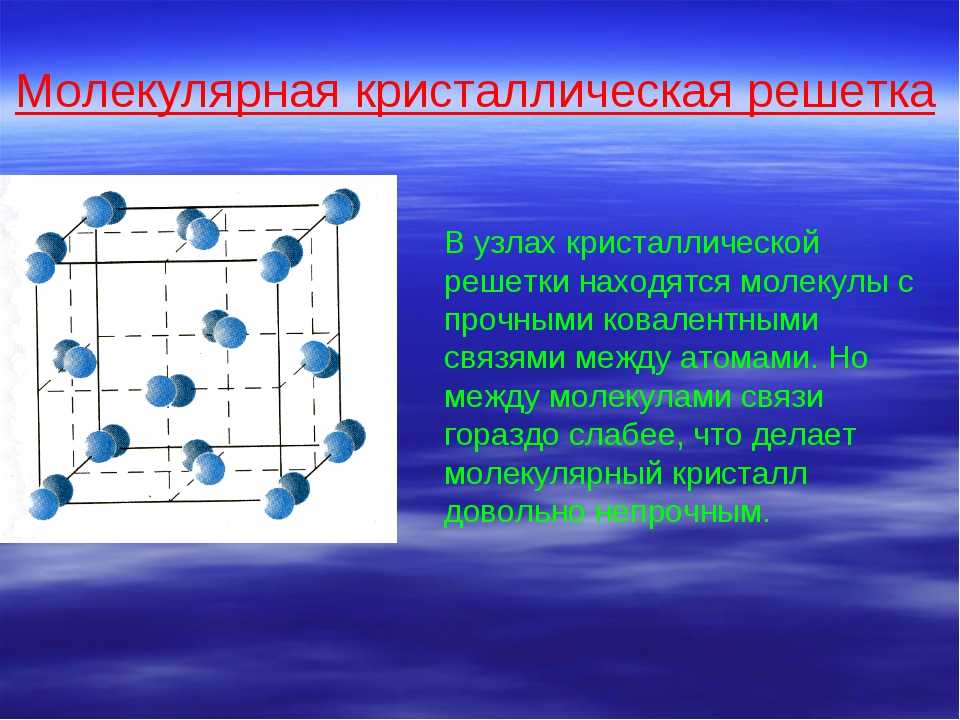
К «странностям» льда относят и генерацию электромагнитного излучения его растущими кристаллами. Давно известно, что большинство растворенных в воде примесей не передается льду, когда он начинает расти, проще говоря, вымораживается. Поэтому даже на самой грязной луже пленка льда чистая и прозрачная. Примеси скапливаются на границе твердой и жидкой сред, в виде двух слоев электрических зарядов разного знака, которые вызывают значительную разность потенциалов. Заряженный слой примесей перемещается вместе с нижней границей молодого льда и излучает электромагнитные волны. Благодаря этому процесс кристаллизации можно наблюдать в деталях. Так, кристалл, растущий в длину в виде иголки, излучает иначе, чем покрывающийся боковыми отростками, а излучение растущих зерен отличается от того, что возникает, когда кристаллы трескаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно определить, с какой скоростью замерзает лед и какая при этом получается ледовая структура.
Неправильный лед
В твердом состоянии вода насчитывает, по последним данным, 14 структурных модификаций. Есть среди них кристаллические (их большинство), есть аморфные, но все они отличаются друг от друга взаимным расположением молекул воды и свойствами. Правда, все, кроме привычного нам льда, образуются в условиях экзотических при очень низких температурах и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Например, при температуре ниже 110°С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров это так называемый кубический лед. Если температура чуть выше 110°, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Две последние модификации льда XIII и XIV открыли ученые из Оксфорда совсем недавно, в 2006 году. Предсказание 40-летней давности о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре 160°С очень велика, и собраться вместе молекулам сверхчистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно.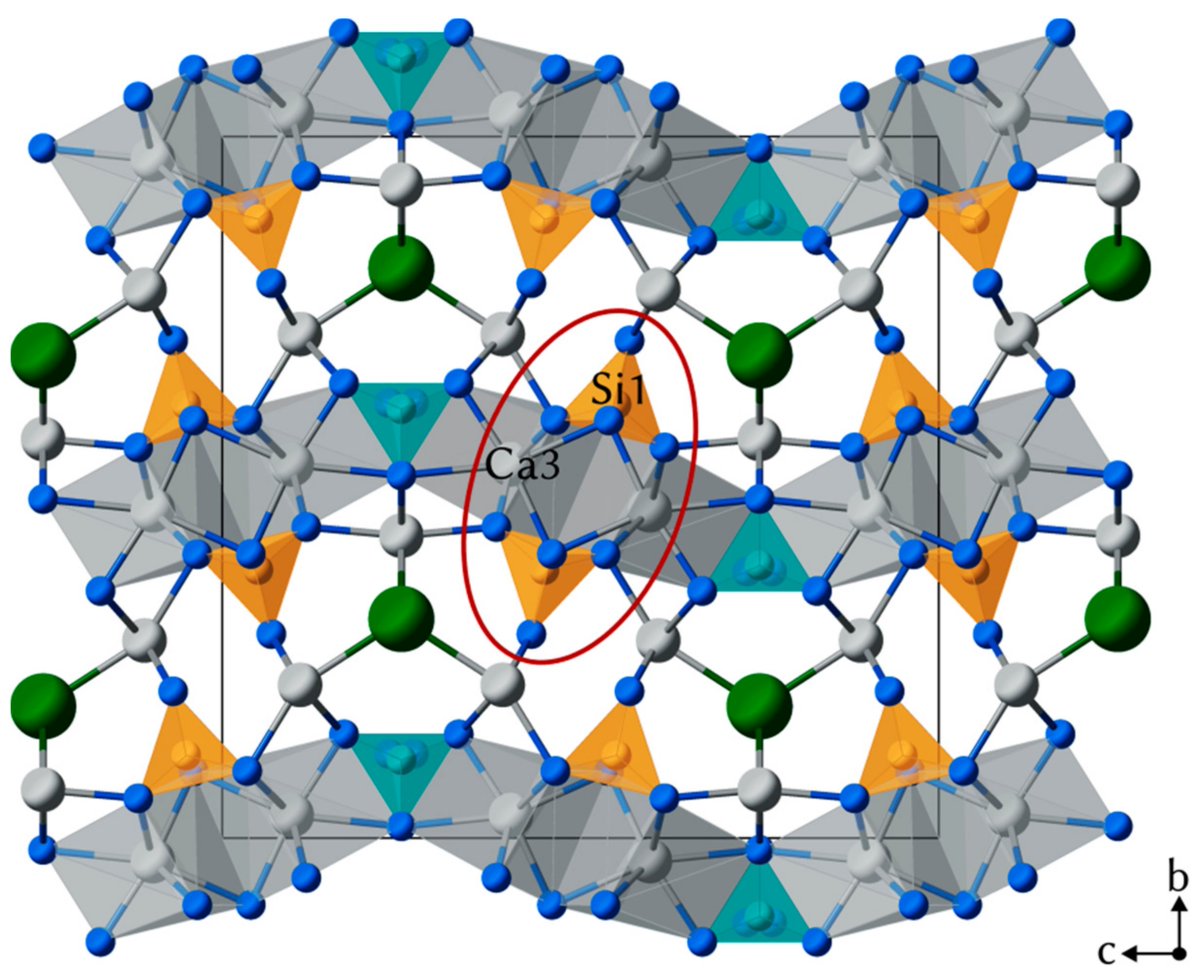 Помог катализатор соляная кислота, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но их можно поискать на замерзших спутниках других планет.
Помог катализатор соляная кислота, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но их можно поискать на замерзших спутниках других планет.
Снежинка это монокристалл льда, вариация на тему гексагонального кристалла, но выросшего быстро, в неравновесных условиях. Над тайной их красоты и бесконечного разнообразия не одно столетие бьются самые пытливые умы. Астроном Иоганн Кеплер в 1611 году написал целый трактат «О шестиугольных снежинках». В 1665 году Роберт Гук в огромном томе зарисовок всего, что он увидел с помощью микроскопа, опубликовал множество рисунков снежинок самой разной формы. Первую удачную фотографию снежинки под микроскопом сделал в 1885 году американский фермер Уилсон Бентли. С тех пор он уже не мог остановиться. До конца жизни, сорок с лишним лет, Бентли фотографировал их. Более пяти тысяч кристаллов, и ни одного одинакового.
Самые знаменитые последователи дела Бентли это уже упомянутый Укихиро Накайя и американский физик Кеннет Либбрехт . Накайя впервые предположил, что величина и форма снежинок зависят от температуры воздуха и содержания в нем влаги, и блистательно подтвердил эту гипотезу экспериментально, выращивая в лаборатории кристаллы льда разной формы. А Либбрехт у себя в и вовсе стал выращивать снежинки на заказ заранее заданной формы.
Накайя впервые предположил, что величина и форма снежинок зависят от температуры воздуха и содержания в нем влаги, и блистательно подтвердил эту гипотезу экспериментально, выращивая в лаборатории кристаллы льда разной формы. А Либбрехт у себя в и вовсе стал выращивать снежинки на заказ заранее заданной формы.
Жизнь снежинки начинается с того, что в облаке водяного пара при понижении температуры образуются кристаллические зародыши льда. Центром кристаллизации могут быть пылинки, любые твердые частицы или даже ионы, но в любом случае эти льдинки размером меньше десятой доли миллиметра уже имеют гексагональную кристаллическую решетку.
Водяной пар, конденсируясь на поверхности этих зародышей, образует сначала крошечную гексагональную призму, из шести углов которой начинают расти совершенно одинаковые ледяные иголочки боковые отростки. Одинаковые просто потому, что температура и влажность вокруг зародыша тоже одинаковые. На них в свою очередь вырастают, как на дереве, боковые отростки веточки. Подобные кристаллы так и называют дендритами, то есть похожими на дерево.
Подобные кристаллы так и называют дендритами, то есть похожими на дерево.
Передвигаясь вверх и вниз в облаке, снежинка попадает в условия с разной температурой и концентрацией водяного пара. Ее форма меняется, до последнего подчиняясь законам гексагональной симметрии. Так снежинки становятся разными. Хотя теоретически в одном облаке на одной высоте они могут «зародиться» одинаковыми. Но путь до земли у каждой свой, довольно долгий в среднем снежинка падает со скоростью 0,9 км в час. А значит, у каждой своя история и своя окончательная форма. Образующий снежинку лед прозрачен, но когда их много, солнечный свет, отражаясь и рассеиваясь на многочисленных гранях, создает у нас впечатление белой непрозрачной массы мы называем ее снегом.
Чтобы не путаться с многообразием снежинок, Международная комиссия по снегу и льду приняла в 1951 году довольно простую классификацию кристаллов льда: пластинки, звездчатые кристаллы, столбцы или колонны, иглы, пространственные дендриты, столбцы с наконечниками и неправильные формы.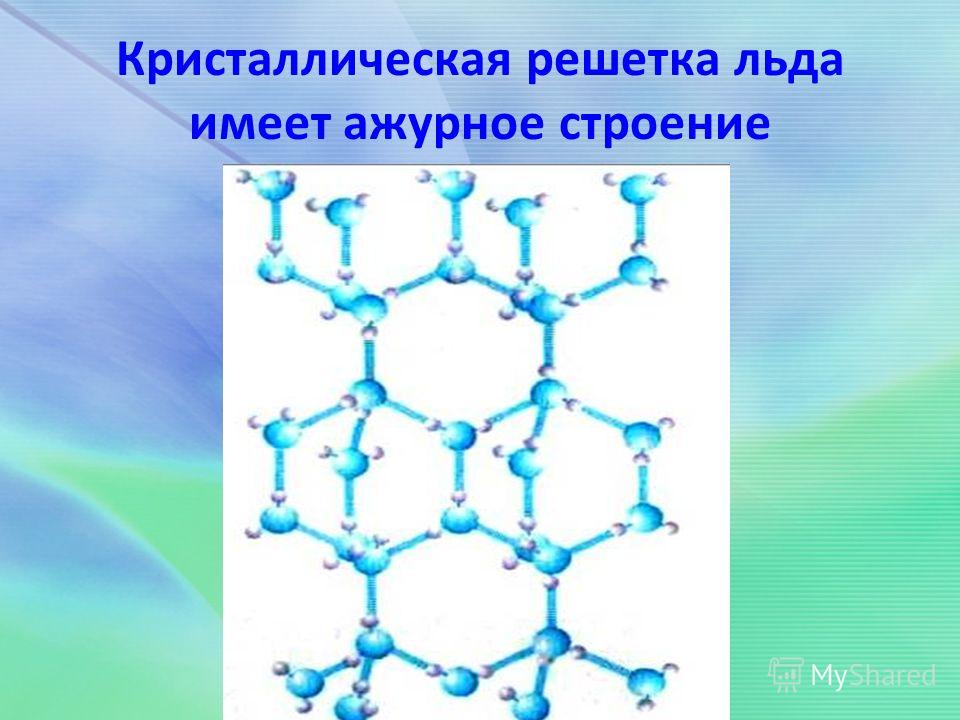 И еще три вида обледенелых осадков: мелкая снежная крупка, ледяная крупка и град.
И еще три вида обледенелых осадков: мелкая снежная крупка, ледяная крупка и град.Тем же законам подчиняется и рост инея, изморози и узоров на стеклах. Эти явления, как и снежинки, образуются при конденсации, молекула за молекулой на земле, траве, деревьях. Узоры на окне появляются в мороз, когда на поверхности стекла конденсируется влага теплого комнатного воздуха. А вот градины получаются при застывании капель воды или когда в насыщенных водяным паром облаках лед плотными слоями намерзает на зародыши снежинок. На градины могут намерзать другие, уже сформировавшиеся снежинки, сплавляясь с ними, благодаря чему градины принимают самые причудливые формы.
Нам на Земле довольно и одной твердой модификации воды обычного льда. Он буквально пронизывает все области обитания или пребывания человека. Собираясь в огромных количествах, снег и лед образуют особые структуры с принципиально иными, нежели у отдельных кристаллов или снежинок, свойствами. Горные ледники , ледяные покровы акваторий, вечная мерзлота, да и просто сезонный снежный покров существенно влияют на климат больших регионов и планеты в целом: даже те, кто никогда не видел снега, чувствуют на себе дыхание его масс, скопившихся на полюсах Земли, например, в виде многолетних колебаний уровня Мирового океана.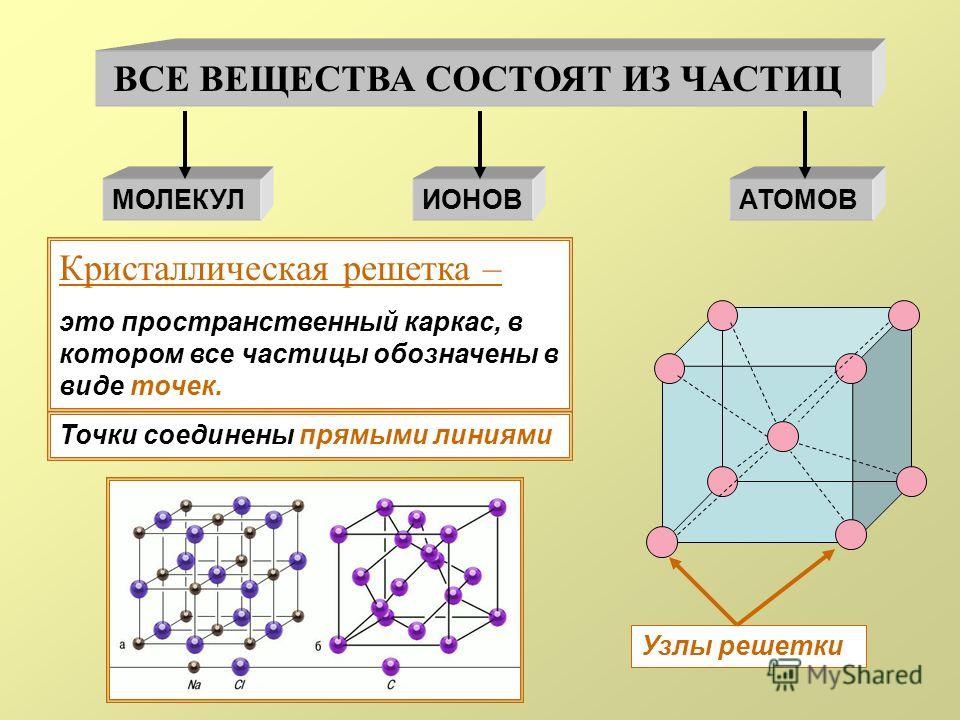 А лед имеет столь большое значение для облика нашей планеты и комфортного обитания на ней живых существ, что ученые отвели для него особую среду криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
А лед имеет столь большое значение для облика нашей планеты и комфортного обитания на ней живых существ, что ученые отвели для него особую среду криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
Ольга Максименко, кандидат химических наук
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном , твердом и жидком . Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными .
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные , атомные , молекулярные и металлические .
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы.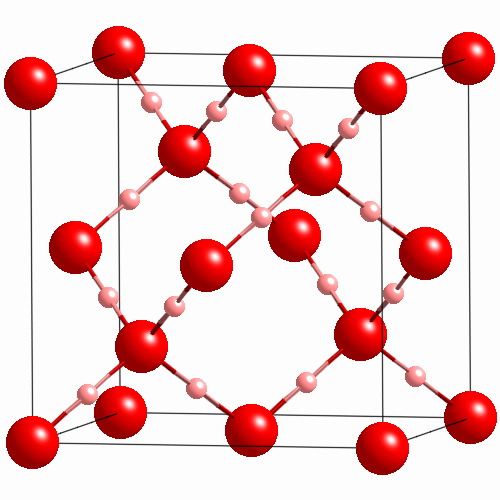 Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO 2: кремнезем, кварц, песок, горный хрусталь.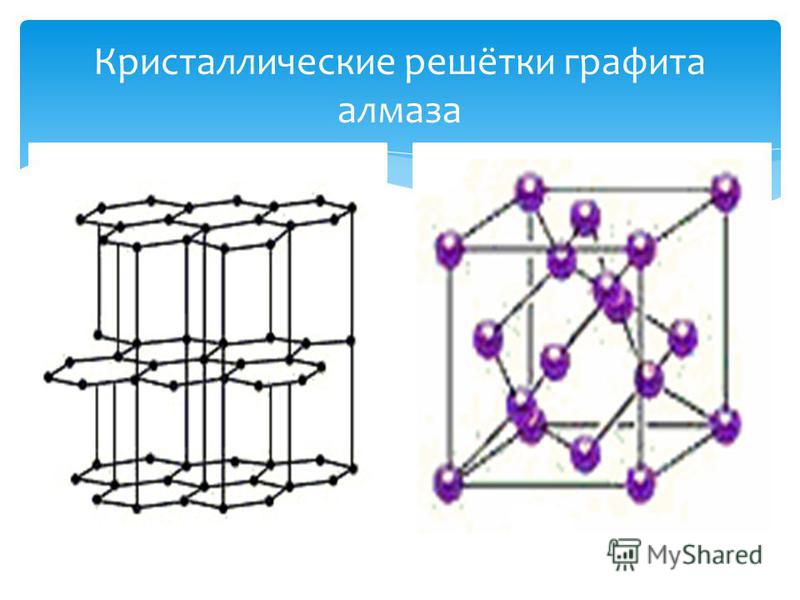
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H 2 0), так и неполярными (N 2 , O 3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H 2 , O 2 , CL 2 , N 2 , I 2), трех – (O 3), четырех – (P 4), восьмиатомными (S 8) молекулами. Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Кристаллическая решетка льда и воды
Трехмерное состояние жидкой воды трудно исследовать, но многое было изучено путем анализа структуры кристаллов льда. Четыре соседних атома кислорода с водородным взаимодействием занимают вершины тетраэдра (тетра = четыре, гедрон = плоскость). Средняя энергия, необходимая для разрушения подобной связи во льду, оценивается в 23 кДж / моль-1.
Способность молекул воды образовывать данное количество водородных цепей, а также указанная прочность создает необычно высокую температуру плавления. Когда он тает, то удерживается жидкой водой, структура которой нерегулярна. Большая часть водородных связей искажается. Для разрушения кристаллической решетки льда с водородной связью требуется большая масса энергии в виде тепла.
Особенности появления льда (Ih)
Многие из обывателей задаются вопросом о том, какая кристаллическая решетка у льда. Необходимо отметить, что плотность большинства веществ возрастает при замораживании, когда молекулярные движения замедляются и образуются плотно упакованные кристаллы. Плотность воды также увеличивается, когда она остывает до достижения максимума при 4°C (277K). Затем, когда температура опускается ниже этого значения, она расширяется.
Это увеличение обусловлено образованием открытого водородно-связанного кристалла льда с его решеткой и меньшей плотностью, в котором каждая молекула воды жестко связана указанным выше элементом и четырьмя другими значениями, и при этом двигается достаточно быстро, чтобы обладать большей массой. Поскольку происходит подобное действие, жидкость замерзает сверху вниз. Это имеет важные биологические результаты, вследствие которых слой льда на пруду изолирует живых существ подальше от сильного холода. Кроме того, два дополнительных свойства воды связаны с его водородными характеристиками: удельной теплоемкостьюи испарением.
Детальное описание структур
Первый критерий представляет собой количество, необходимое для повышения температуры 1 грамма вещества на 1°С. Для повышения градусов воды требуется относительно большая часть тепла, потому что каждая молекула участвует в многочисленных водородных связях, которые должны быть разрушены, чтобы кинетическая энергия увеличивалась. Кстати, обилие H2O в клетках и тканях всех крупных многоклеточных организмов означает, что флуктуация температуры внутри клеток сведена к минимуму. Эта особенность имеет решающее значение, поскольку скорость большинства биохимических реакций чувствительна.
Теплота испарения воды также значительно выше, чем у многих других жидкостей. Для преобразования этого тела в газ требуется большое количество тепла, потому что водородные связи должны быть разрушены, чтобы молекулы воды могли дислоцироваться друг от друга и войти в указанную фазу. Изменяемые тела представляют собой постоянные диполи и могут взаимодействовать с другими подобными соединениями и теми, что ионизируются и растворяются.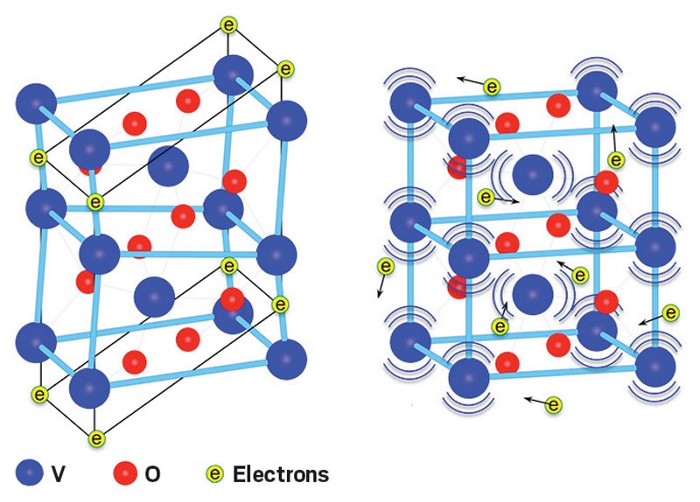
Иные вещества, указанные выше, могут вступать в контакт только при наличии полярности. Именно такое соединение участвует в строении этих элементов. Кроме того, оно может выравниваться вокруг этих частиц, образованных из электролитов, так что отрицательные атомы кислорода молекул воды ориентированы на катионы, а положительные ионы и атомы водорода, ориентированы на анионы.
В твердых веществах образуются, как правило, молекулярные кристаллические решетки и атомные. То есть если йод построен таким образом, что в нем присутствует I2, то в твердом диоксиде углерода, то есть в сухом льде, в узлах кристаллической решетки находятся молекулы CO2. При взаимодействии с подобными веществами, ионную кристаллическую решетку имеет лед. Графит, например, обладающий атомной структурой, в основе которой углерод, не способен ее менять, также как и алмаз.
Что происходит, когда кристалл столовой соли растворяется в воде: полярные молекулы притягиваются к заряженным элементам в кристалле, что приводит к образованию подобных частиц натрия и хлорида на его поверхности, в результате эти тела дислоцируются друг от друга, и он начинает растворяться. Отсюда можно наблюдать, что лед имеет кристаллическую решетку с ионной связью. Каждый растворенный Na + притягивает отрицательные концы нескольких молекул воды, тогда как каждый растворенный Cl — притягивает положительные концы. Оболочка, окружающая каждый ион, называется сферой спасения и, обычно, содержит несколько слоев частиц растворителя.
Отсюда можно наблюдать, что лед имеет кристаллическую решетку с ионной связью. Каждый растворенный Na + притягивает отрицательные концы нескольких молекул воды, тогда как каждый растворенный Cl — притягивает положительные концы. Оболочка, окружающая каждый ион, называется сферой спасения и, обычно, содержит несколько слоев частиц растворителя.
Кристаллическая решетка сухого льда
Говорят, что переменные или ион, окруженные элементами, являются сульфатированными. Когда растворителем выступает вода, такие частицы гидратируются. Таким образом, любая полярная молекула имеет тенденцию к сольватации элементами жидкого тела. У сухого льда тип кристаллической решетки образует в агрегатном состоянии атомные связи, которые неизменны. Другое дело кристаллический лед (замороженная вода). Ионные органические соединения, такие как карбоксилазы и протонированные амины, должны обладать растворимостью в гидроксильной и карбонильной группах. Частицы, содержащиеся в таких структурах, двигаются между молекулами, причем их полярные системы образуют водородные связи с этим телом.
Конечно, количество последних указанных групп в молекуле влияет на ее растворимость, которая также зависит от реакции различных структур в элементе: например, одно-, двух- и трех углеродные спирты смешиваются с водой, но более крупные углеводороды с одиночными гидроксильными соединениями гораздо менее разбавляемы в жидкости.
Шестиугольный Ih схож по форме с атомной кристаллической решеткой. У льда и всего естественного снега на Земле она выглядит именно так. Об этом свидетельствует симметрия кристаллической решетки льда, выращенная из водяного пара (то есть снежинок). Находится в космической группе P 63/мм с 194; D 6h, класса Лауэ 6/мм; аналогичный β-, имеющей кратную 6-ти винтовую ось (вращение вокруг в дополнение к сдвигу вдоль нее). Он обладает довольно открытой структурой с низкой плотностью, где эффективность низкая (~ 1/3) по сравнению с простыми кубическими (~ 1/2) или гранецентрированными кубическими (~ 3/4) структурами.
По сравнению с обычным льдом, кристаллическая решетка сухого льда, связанная молекулами CO2, статична и меняется лишь при распаде атомов.
Описание решеток и входящих в них элементов
Кристаллы можно рассматривать, как кристаллические модели, состоящие из листов, расположенных друг над другом. Водородная связь упорядочена, тогда как в действительности она случайна, поскольку протоны могут перемещаться между молекулами воды (льда) при температурах выше примерно 5 К. Действительно, вполне вероятно, что протоны ведут себя, как квантовая жидкость в постоянном туннелированном потоке. Это усиливается рассеянием нейтронов, показывающих плотность их рассеяния на полпути между атомами кислорода, что указывает на локализацию и согласованное движение. Здесь наблюдается схожесть льда с атомной, молекулярной кристаллической решеткой.
Молекулы имеют ступенчатое расположение водородной цепи по отношению к трем своим соседям в плоскости. Четвертый элемент имеет затмеваемое расположение водородной связи. Существует небольшое отклонение от идеальной шестиугольной симметрии, как элементарной ячейки на 0,3% короче в направлении этой цепи. Все молекулы испытывают одинаковые молекулярные среды. Внутри каждой «коробки» достаточно места для удержания частиц интерстициальной воды. Хотя это, как правило, не считается, недавно они были эффективно обнаружены нейтронной дифракцией порошкообразной кристаллической решеткой льда.
Все молекулы испытывают одинаковые молекулярные среды. Внутри каждой «коробки» достаточно места для удержания частиц интерстициальной воды. Хотя это, как правило, не считается, недавно они были эффективно обнаружены нейтронной дифракцией порошкообразной кристаллической решеткой льда.
Изменение веществ
Шестиугольное тело имеет тройные точки с жидкой и газообразной водой 0,01 ° C, 612 Па, твердыми элементами – три -21,985 ° C, 209,9 МПа, одиннадцать и два -199,8 ° C, 70 МПа, а также -34,7 ° C, 212,9 МПа. Диэлектрическая проницаемость гексагонального льда составляет 97,5.
Кривая плавления этого элемента дается МПа. Уравнения состояния доступны, кроме них некоторые простые неравенства, связывающие изменение физических свойств с температурой гексагонального льда и его водных суспензий. Твердость колеблется в зависимости от градусов, возрастающих примерно от или ниже гипса (≤2) при 0°С, до уровня полевого шпата (6 по шкале Мооса) при -80 ° С, аномально большое изменение абсолютной твердости (> 24 раза).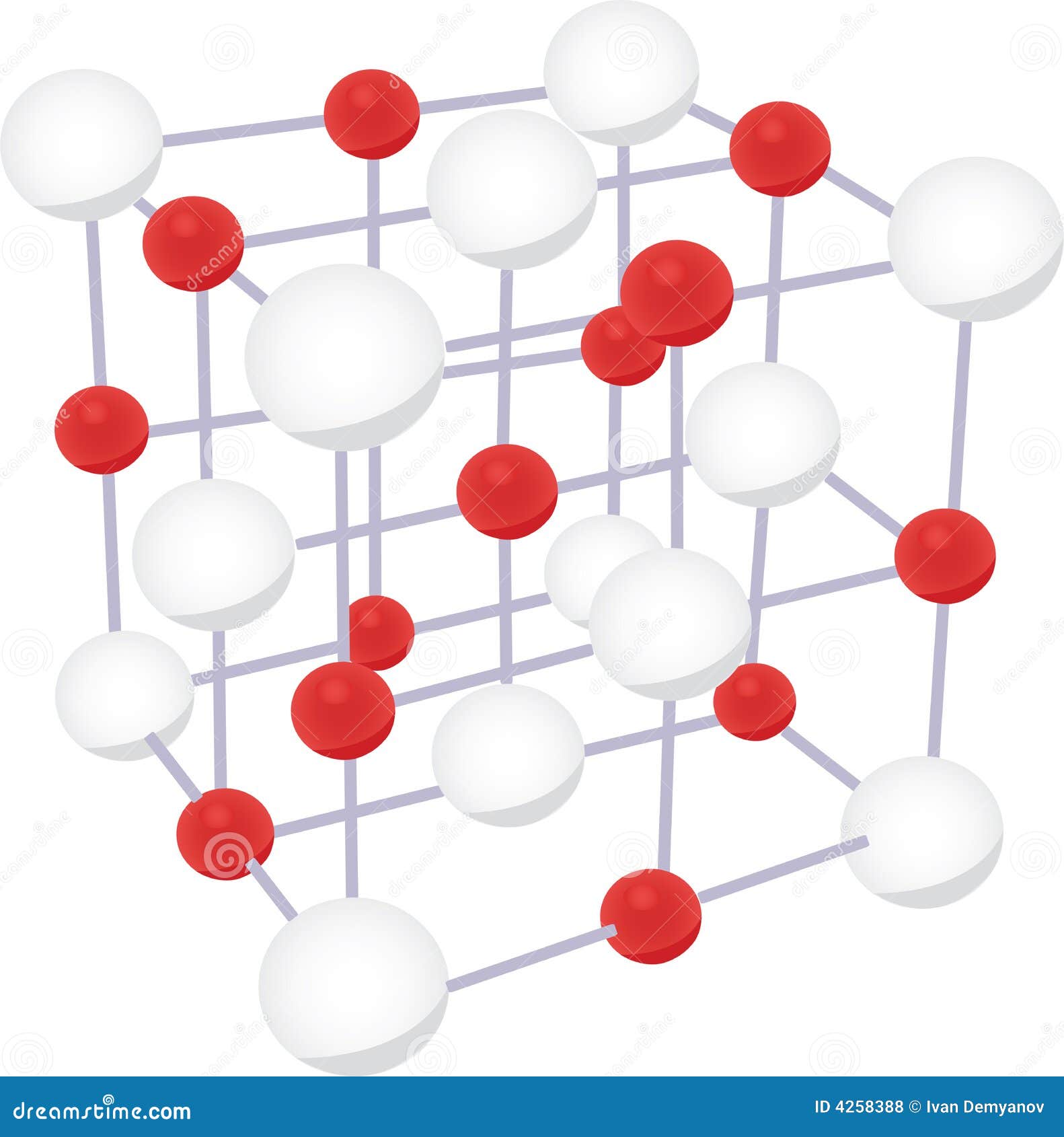
Шестиугольная кристаллическая решетка льда образует гексагональные пластины и столбцы, где верхняя и нижняя грани являются базальными плоскостями {0 0 0 1} с энтальпией 5,57 мкДж · см -2, а другие эквивалентные боковые называются частями призмы {1 0 -1 0} с 5,94 мкДж · см -2. Вторичные поверхности {1 1 -2 0} с 6.90 μJ ˣ см -2 могут быть сформированы по плоскостям, образованными сторонами структур.
Подобное строение показывает аномальное уменьшение теплопроводности с увеличением давления (как и кубический, и аморфный лед низкой плотности), но отличается от большинства кристаллов. Это связано с изменением водородной связи, уменьшающей поперечную скорость звука в кристаллической решетке льда и воды.
Существуют методы, описывающие, как подготовить большие образцы кристалла и любую желаемую поверхность льда. Предполагается, что водородная связь на поверхности гексагонального исследуемого тела будет более упорядоченной, чем внутри объемной системы.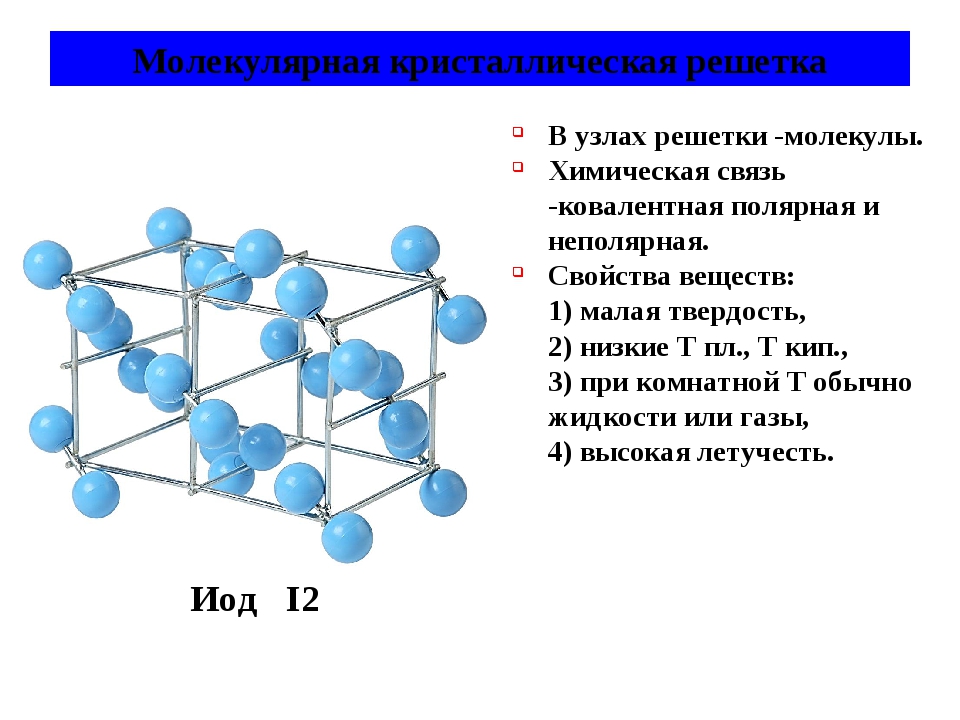 Вариационная спектроскопия с генерацией по частоте колебаний с фазовой решеткой показала, что существует структурная асимметрия между двумя верхними слоями (L1 и L2) в подповерхностной HO цепи базальной поверхности гексагонального льда. Принятые водородные связи в верхних слоях шестиугольниках (L1 O ··· HO L2) сильнее, чем принятые во втором слое к верхнему накоплению (L1 OH ··· O L2). Доступны интерактивные структуры гексагонального льда.
Вариационная спектроскопия с генерацией по частоте колебаний с фазовой решеткой показала, что существует структурная асимметрия между двумя верхними слоями (L1 и L2) в подповерхностной HO цепи базальной поверхности гексагонального льда. Принятые водородные связи в верхних слоях шестиугольниках (L1 O ··· HO L2) сильнее, чем принятые во втором слое к верхнему накоплению (L1 OH ··· O L2). Доступны интерактивные структуры гексагонального льда.
Особенности развития
Минимальное количество молекул воды, необходимых для зарождения льда, примерно 275 ± 25, как и для полного икосаэдрического кластера 280. Образование происходит с коэффициентом 10 10 на поверхности раздела воздух-вода, а не в объемной воде. Рост кристаллов льда зависит от разных темпов роста различных энергий. Вода должна быть защищена от замерзания при крио консервировании биологических образцов, пищи и органов.
Обычно это достигается быстрыми скоростями охлаждения, использованием небольших образцов и крио консерватора, а также увеличением давления для образования зародышей льда и предотвращения повреждения клеток. Свободная энергия льда / жидкости увеличивается от ~ 30 мДж/м2 при атмосферном давлении до 40 мДж/м-2 при 200 МПа, что указывает на причину, по которой происходит подобный эффект.
Свободная энергия льда / жидкости увеличивается от ~ 30 мДж/м2 при атмосферном давлении до 40 мДж/м-2 при 200 МПа, что указывает на причину, по которой происходит подобный эффект.
Какой тип кристаллической решетки характерен для льда
В качестве альтернативы они могут расти быстрее с поверхностей призмы (S2), на случайно нарушенной поверхности быстрозамороженных или взволнованных озер. Рост от граней {1 1 -2 0}, по крайней мере, такой же, но превращает их в основания призмы. Данные о развитии кристалла льда были полностью исследованы. Относительные скорости роста элементов разных граней зависят от способности образовывать большую степень совместной гидратации. Температура (низкая) окружающей воды определяет степень разветвления в кристалле льда. Рост частиц ограничивается скоростью диффузии при низкой степени переохлаждения, то есть <2 ° C, что приводит к большему их количеству.
Но ограничено кинетикой развития при более высоких уровнях понижения градусов >4°C, что приводит к игольчатому росту.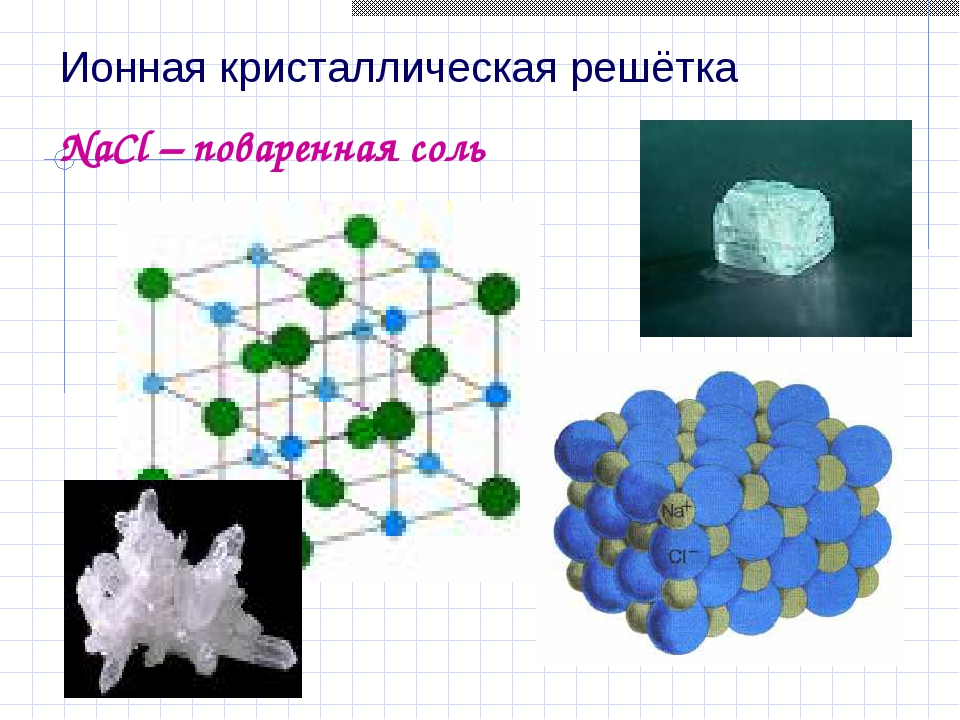 Эта форма схожа со строением сухого льда (имеет кристаллическую решетку с шестиугольной структурой), различными характеристиками развития поверхности и температурой окружающей (переохлажденной) воды, которая находится за плоскими формами снежинок.
Эта форма схожа со строением сухого льда (имеет кристаллическую решетку с шестиугольной структурой), различными характеристиками развития поверхности и температурой окружающей (переохлажденной) воды, которая находится за плоскими формами снежинок.
Зарождение льда в атмосфере глубоко влияет на образование и свойства облаков. Полевые шпаты, обнаруженные в пустынной пыли, которая попадает в атмосферу миллионами тонн в год, являются важными образователями. Компьютерное моделирование показало, что это связано с зарождением плоскостей призматических кристаллов льда на плоскостях поверхности высоких энергий.
Некоторые другие элементы и решетки
Растворенные вещества (за исключением очень небольшого гелия и водорода, которые могут входить в междоузлия) не могут быть включены в структуру Ih при атмосферном давлении, но вытесняются на поверхность или аморфный слой между частицами микрокристаллического тела. В узлах кристаллической решетки сухого льда находятся некоторые иные элементы: хаотропные ионы, такие как NH4 + и Cl —, которые включены в более легкое замораживание жидкости, чем другие космотропные, такие как Na + и SO42-, поэтому удаление их невозможно, ввиду того, что они образуют тонкую пленку из оставшейся жидкости между кристаллами. Это может привести к электрической зарядке поверхности из-за диссоциации поверхностной воды, уравновешивающей оставшиеся заряды (что также может привести к магнитному излучению) и изменению рН остаточных жидких пленок, например, NH 42SO4 становится более кислым и NaCl становится более щелочным.
Это может привести к электрической зарядке поверхности из-за диссоциации поверхностной воды, уравновешивающей оставшиеся заряды (что также может привести к магнитному излучению) и изменению рН остаточных жидких пленок, например, NH 42SO4 становится более кислым и NaCl становится более щелочным.
Они перпендикулярны граням кристаллической решетке льда, показывающей присоединенный следующий слой (с атомами О-черный). Им характерна медленно растущая базальная поверхность {0 0 0 1}, где прикрепляются только изолированные молекулы воды. Быстро растущая {1 0 -1 0} поверхность призмы, где пары вновь присоединенных частиц могут связываться друг с другом водородом (одна его связь/две молекулы элемента). Наиболее быстро растущая грань {1 1 -2 0} (вторичная призматика), где цепочки вновь присоединенных частиц могут взаимодействовать друг с другом водородной связью. Одна ее цепочка/ молекула элемента – это форма, образующая хребты, которые делят и поощряют превращение в две стороны призмы.
Энтропия нулевой точки
Может быть определена, как S 0 = k B ˣ Ln (N E0), где k B – это постоянная Больцмана, NE– эточисло конфигураций при энергии E, а E0 — наименьшая энергия. Это значение для энтропии гексагонального льда при нулевом кельвине не нарушает третьего закона термодинамики «Энтропия идеального кристалла при абсолютном нуле ровно равна нулю», поскольку эти элементы и частицы не идеальны, имеют неупорядоченное водородное связывание.
В этом теле водородная связь является случайной и быстро меняющейся. Эти структуры не точно равны по энергии, а распространяются на очень большое количество энергетически близких состояний, подчиняются «правилам льда». Энтропия нулевой точки – это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1. Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Ученые и их труды в этой сфере
Может быть определена, как S 0 = k B ˣ Ln (N E0), где k B – это постоянная Больцмана, NE– эточисло конфигураций при энергии E, а E0 — наименьшая энергия. Это значение для энтропии гексагонального льда при нулевом кельвине не нарушает третьего закона термодинамики «Энтропия идеального кристалла при абсолютном нуле ровно равна нулю», поскольку эти элементы и частицы не идеальны, имеют неупорядоченное водородное связывание.
В этом теле водородная связь является случайной и быстро меняющейся. Эти структуры не точно равны по энергии, а распространяются на очень большое количество энергетически близких состояний, подчиняются «правилам льда». Энтропия нулевой точки – это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1. Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1. Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Хотя порядок протонов в объемном льду не упорядочен, поверхность, вероятно, предпочитает порядок указанных частиц в виде полос свисающих Н-атомов и О-одиночных пар (нулевая энтропия с упорядоченными водородными связями). Найден беспорядок нулевой точки ZPE, J ˣ mol -1 ˣ K -1 и других. Из всего вышеизложенного видно и понятно, какие типы кристаллических решеток характерны для льда.
Структура и плотность льда CO2 в марсианских атмосферных условиях
Основные моменты
- •
CO 2 Лед выращен в условиях, соответствующих мезосфере Марса.
- •
Определена кубическая кристаллическая структура.

- •
Параметр решетки уточняется в диапазоне 80–130 К.
- •
Сообщается о плотности льда CO 2 как функции температуры.
- •
Исследуются последствия новой параметризации плотности для марсианских облаков.
Abstract
Облака, состоящие из CO 2 льда, образуются по всей марсианской атмосфере. Считается, что в мезосфере ледяные облака CO 2 образуются в результате гетерогенного зародышеобразования льда на наночастицах метеорного происхождения при температурах, часто ниже 100 K. На малых высотах CO 2 ледяных облаков в зимних полярных регионах образуются с температурой около 145 K и приводят к нарастанию полярных ледяных шапок.Однако кристаллическая структура и связанные с ней фундаментальные свойства льда CO 2 в марсианских условиях плохо изучены. Здесь мы представляем измерения дифракции рентгеновских лучей (XRD) льда CO 2 , выращенного путем осаждения из паровой фазы в условиях температуры и давления, аналогичных марсианской мезосфере. Была определена кристаллическая кубическая структура, соответствующая полиморфу низкого давления (CO 2 -I, пространственная группа Па, -3 (№ 205)). CO 2 осаждался при температурах 80-130 К и давлениях 0.01–1 мбар соответствовало измерениям сухого льда и предыдущим литературным данным, что исключает возможность более сложной фазовой диаграммы для CO 2 в этой области. При 80 K был определен параметр решетки 5.578 ± 0.002 Å, объем ячейки 173.554 ± 0.19 Å 3 и плотность 1.684 ± 0.002 г см −3 . Используя эти измерения, мы определили тепловое расширение CO 2 в диапазоне 80–130 K, что позволило сопоставить измерения плотности льда CO 2 в более широком диапазоне температур (80–195 K) в сочетании с литературными данными (CO 2 плотность = 1.72391 — 2,53 × 10 −4 T — 2,87 × 10 — 6 T 2 ). Температурно-зависимые значения плотности CO 2 используются для оценки скорости седиментации и скорости образования зародышей гетерогенного льда, что свидетельствует об увеличении скорости образования зародышей до 1000 раз по сравнению с обычно используемыми в литературе значениями.
Была определена кристаллическая кубическая структура, соответствующая полиморфу низкого давления (CO 2 -I, пространственная группа Па, -3 (№ 205)). CO 2 осаждался при температурах 80-130 К и давлениях 0.01–1 мбар соответствовало измерениям сухого льда и предыдущим литературным данным, что исключает возможность более сложной фазовой диаграммы для CO 2 в этой области. При 80 K был определен параметр решетки 5.578 ± 0.002 Å, объем ячейки 173.554 ± 0.19 Å 3 и плотность 1.684 ± 0.002 г см −3 . Используя эти измерения, мы определили тепловое расширение CO 2 в диапазоне 80–130 K, что позволило сопоставить измерения плотности льда CO 2 в более широком диапазоне температур (80–195 K) в сочетании с литературными данными (CO 2 плотность = 1.72391 — 2,53 × 10 −4 T — 2,87 × 10 — 6 T 2 ). Температурно-зависимые значения плотности CO 2 используются для оценки скорости седиментации и скорости образования зародышей гетерогенного льда, что свидетельствует об увеличении скорости образования зародышей до 1000 раз по сравнению с обычно используемыми в литературе значениями. Это зависимое от температуры уравнение состояния предлагается использовать в будущих исследованиях марсианских мезосферных облаков CO 2 .Наконец, мы обсуждаем возможные формы кристаллов льда CO 2 в марсианской атмосфере и показываем, что вероятен ряд форм, включая кубы и октаэдры, а также их комбинацию в форме кубооктаэдров.
Это зависимое от температуры уравнение состояния предлагается использовать в будущих исследованиях марсианских мезосферных облаков CO 2 .Наконец, мы обсуждаем возможные формы кристаллов льда CO 2 в марсианской атмосфере и показываем, что вероятен ряд форм, включая кубы и октаэдры, а также их комбинацию в форме кубооктаэдров.
Ключевые слова
Марс
Атмосфера Марса
Климат Марса
Льдов
Атмосферы
Состав
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию© 2017 Авторы.Опубликовано Elsevier Inc.
Рекомендуемые статьи
Ссылки на статьи
(Цветной онлайн) Кубическая структура P a 3 из сухого льда (твердый CO 2).
Контекст 1
… постоянная решетки вдоль киральной цепочки (c) завышена всеми функционалами, использованными в этом исследовании, тогда как точность для постоянной решетки a варьируется. LDA значительно недооценивает a, тогда как PBE значительно улучшает описание a, что хорошо согласуется с предыдущими исследованиями.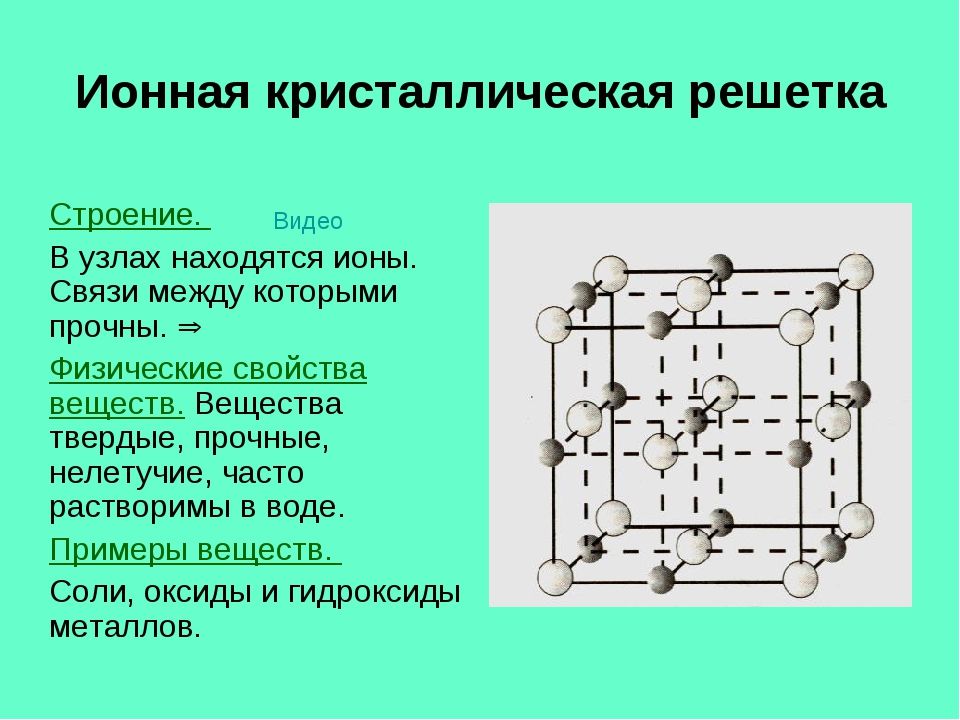 И vdW-DF, и vdW-DF2 переоценивают a и c, тогда как использование обмена C09 (vdW-DF C09x и vdW-DF2 C09x) приводит к недооценке a. С другой стороны, хотя c немного завышено, rVV10 дает сбалансированное описание обеих постоянных решетки. Из наших результатов было обнаружено, что существует корреляция между вычисленными a и c: если a завышено, ошибка c имеет тенденцию быть меньше. Таким образом, чтобы получить точные структурные параметры для тригонального селена, очень важно точно описать как ковалентные, так и vdW взаимодействия, предполагая, что этот материал может быть хорошей тестовой системой для функционала, включающего vdW.Твердая форма углекислого газа называется сухим льдом. Двуокись углерода не имеет дипольного момента, поэтому силы притяжения vdW играют важную роль в конденсации. Мы выбрали этот материал как пример применения нашей реализации vdW-DF для немагнитных молекулярных кристаллов. Кристаллический сухой лед имеет кубическую симметрию с пространственной группой P a 3 (см.
И vdW-DF, и vdW-DF2 переоценивают a и c, тогда как использование обмена C09 (vdW-DF C09x и vdW-DF2 C09x) приводит к недооценке a. С другой стороны, хотя c немного завышено, rVV10 дает сбалансированное описание обеих постоянных решетки. Из наших результатов было обнаружено, что существует корреляция между вычисленными a и c: если a завышено, ошибка c имеет тенденцию быть меньше. Таким образом, чтобы получить точные структурные параметры для тригонального селена, очень важно точно описать как ковалентные, так и vdW взаимодействия, предполагая, что этот материал может быть хорошей тестовой системой для функционала, включающего vdW.Твердая форма углекислого газа называется сухим льдом. Двуокись углерода не имеет дипольного момента, поэтому силы притяжения vdW играют важную роль в конденсации. Мы выбрали этот материал как пример применения нашей реализации vdW-DF для немагнитных молекулярных кристаллов. Кристаллический сухой лед имеет кубическую симметрию с пространственной группой P a 3 (см. Структуру на рис. 2). Для волновых функций и электронной плотности использовались отсечки плоских волн 160 и 960 Ry соответственно. Набор 8 × 8 × 8 MP k -point был использован для выборки зоны Бриллюэна.Оптимизированные структурные параметры и энергия связи для сухого льда приведены в таблице V вместе с результатами MP2 69 и экспериментальными (150K) 70. Наш равновесный объем PBE хорошо согласуется с теоретическим значением, полученным Bonev et al. 72 (52,9 A 3 / CO 2) с использованием того же функционала. С другой стороны, как равновесный объем, так и энергия связи, полученные с использованием vdW-DF, лучше согласуются с высокоточными результатами MP2 и экспериментальными (150K) результатами, что свидетельствует об улучшении по сравнению с LDA и PBE.Максимальное отклонение равновесного объема, полученного с использованием vdW-DF, составляет 9,1% по сравнению с полученным в низкотемпературном эксперименте. Приведенные выше результаты предполагают, что PBE переоценивает равновесный объем из-за отсутствия дисперсионных сил, и более точное описание структуры и энергетики сухого льда стало возможным благодаря учету дисперсионных сил с vdW-DF.
Структуру на рис. 2). Для волновых функций и электронной плотности использовались отсечки плоских волн 160 и 960 Ry соответственно. Набор 8 × 8 × 8 MP k -point был использован для выборки зоны Бриллюэна.Оптимизированные структурные параметры и энергия связи для сухого льда приведены в таблице V вместе с результатами MP2 69 и экспериментальными (150K) 70. Наш равновесный объем PBE хорошо согласуется с теоретическим значением, полученным Bonev et al. 72 (52,9 A 3 / CO 2) с использованием того же функционала. С другой стороны, как равновесный объем, так и энергия связи, полученные с использованием vdW-DF, лучше согласуются с высокоточными результатами MP2 и экспериментальными (150K) результатами, что свидетельствует об улучшении по сравнению с LDA и PBE.Максимальное отклонение равновесного объема, полученного с использованием vdW-DF, составляет 9,1% по сравнению с полученным в низкотемпературном эксперименте. Приведенные выше результаты предполагают, что PBE переоценивает равновесный объем из-за отсутствия дисперсионных сил, и более точное описание структуры и энергетики сухого льда стало возможным благодаря учету дисперсионных сил с vdW-DF. Что касается серьезной недооценки энергии связи с использованием vdW-DF2 C09x, было обнаружено 73 из систематической оценки с использованием набора данных S22, что, хотя он предсказывает разумное межмолекулярное разделение (расстояние), функционал сильно недооценивает энергию связи, потому что обмен C09 является слишком отталкивающим при относительно большом градиенте плотности, относящемся к межмолекулярной области.Этот результат означает, что vdW-DF2 C09x неточно описывает межмолекулярное взаимодействие vdW. α -O 2 имеет антиферромагнитное основное состояние с кристаллической структурой пространственной группы C 2 / m, как показано на рис. 3. Имеются четыре параметра решетки: a, b, c и β, а также внутренние параметры lb (длина связи молекулы O 2) и θ (угол наклона оси молекулы). Ось молекулы почти перпендикулярна плоскости ab и немного наклонена в плоскости ac. Сообщалось, что в эксперименте угол θ составлял 3 ◦.4. В расчетах использовались отсечки плоских волн 160 и 960 Ry …
Что касается серьезной недооценки энергии связи с использованием vdW-DF2 C09x, было обнаружено 73 из систематической оценки с использованием набора данных S22, что, хотя он предсказывает разумное межмолекулярное разделение (расстояние), функционал сильно недооценивает энергию связи, потому что обмен C09 является слишком отталкивающим при относительно большом градиенте плотности, относящемся к межмолекулярной области.Этот результат означает, что vdW-DF2 C09x неточно описывает межмолекулярное взаимодействие vdW. α -O 2 имеет антиферромагнитное основное состояние с кристаллической структурой пространственной группы C 2 / m, как показано на рис. 3. Имеются четыре параметра решетки: a, b, c и β, а также внутренние параметры lb (длина связи молекулы O 2) и θ (угол наклона оси молекулы). Ось молекулы почти перпендикулярна плоскости ab и немного наклонена в плоскости ac. Сообщалось, что в эксперименте угол θ составлял 3 ◦.4. В расчетах использовались отсечки плоских волн 160 и 960 Ry …
Связывание в твердом СО2 высокого давления, выявленное методом дифракции на монокристалле
22-02-2010
Твердая двуокись углерода претерпевает радикальное изменение из молекулярного твердого состояния в немолекулярное «полимерное» состояние при повышенных давлениях и температурах [1]. Полимерное состояние характеризуется исчезновением двойных связей между атомами углерода и кислорода и образованием новых одинарных связей.Остается неизвестным, происходит ли это преобразование в результате химических реакций в твердом состоянии между молекулами, достигающими критического разделения, или через промежуточные состояния, когда молекулы постепенно деформируются по мере увеличения давления. Чтобы разгадать эту загадку, исследователи из Université Pierre et Marie Curie определили структуру CO2 в фазе высокого давления IV, конечной молекулярной фазе перед ее полимеризацией в фазу V.
Полимерное состояние характеризуется исчезновением двойных связей между атомами углерода и кислорода и образованием новых одинарных связей.Остается неизвестным, происходит ли это преобразование в результате химических реакций в твердом состоянии между молекулами, достигающими критического разделения, или через промежуточные состояния, когда молекулы постепенно деформируются по мере увеличения давления. Чтобы разгадать эту загадку, исследователи из Université Pierre et Marie Curie определили структуру CO2 в фазе высокого давления IV, конечной молекулярной фазе перед ее полимеризацией в фазу V.
В условиях окружающей среды молекулярный CO 2 является линейным и состоит из двух сильных ковалентных двойных связей между атомами углерода и кислорода длиной 1.168 Å. При приложении давления при 300 К диоксид углерода кристаллизуется при 0,6 ГПа в той же структуре, что и при низких температурах, так называемый «сухой лед» или фаза I. Эта твердая фаза типична для молекулярных твердых веществ, характеризующихся большой энергетическое разделение между сильными внутримолекулярными связями и слабыми межмолекулярными взаимодействиями . Несколько других кристаллических структур были обнаружены для CO 2 за последние десять лет, что привело к фазовой диаграмме P-T, представленной на рис. 1 .В этой работе мы сосредоточились на фазе IV, стабильной выше ~ 11 ГПа, которая была предложена в качестве промежуточного состояния между молекулярным твердым телом низкого давления I и немолекулярной фазой высокого давления V. Действительно, структура Pbcn предложила из предыдущих экспериментов [2] предположил, что молекулы в фазе IV имели длину связи на 30% больше, чем в фазе I, и больше не были линейными, показывая угол ОСО 160 °. Однако такое искажение противоречило другим экспериментальным и теоретическим результатам, и возникла острая дискуссия о фактической структуре этой фазы.
Несколько других кристаллических структур были обнаружены для CO 2 за последние десять лет, что привело к фазовой диаграмме P-T, представленной на рис. 1 .В этой работе мы сосредоточились на фазе IV, стабильной выше ~ 11 ГПа, которая была предложена в качестве промежуточного состояния между молекулярным твердым телом низкого давления I и немолекулярной фазой высокого давления V. Действительно, структура Pbcn предложила из предыдущих экспериментов [2] предположил, что молекулы в фазе IV имели длину связи на 30% больше, чем в фазе I, и больше не были линейными, показывая угол ОСО 160 °. Однако такое искажение противоречило другим экспериментальным и теоретическим результатам, и возникла острая дискуссия о фактической структуре этой фазы.
Рисунок 1. Фазовая диаграмма CO 2 при высоком давлении и температуре. |
Чтобы разрешить этот спор, мы провели эксперименты по дифракции на монокристалле фазы IV.Получение монокристалла фазы IV является сложной задачей, так как требует очень точного контроля давления в условиях высоких температур, необходимых для выращивания фазы IV из расплава (T> 800 K). Мы достигли этого, выполнив дифракцию на монокристалле с использованием ячейки с алмазными наковальнями с большими конусами для падающего и выходящего рентгеновского пучка. Ячейка была разработана для высоких температур за счет резистивного нагрева. Мы начали с поликристаллического образца фазы IV при 15 ГПа и медленно декомпрессировали до точки плавления (11 ГПа при 830 К), пока не стабилизировалась уникальная затравка кристалла (, рис. 2, ). Затем кристаллы были исследованы с использованием источников жесткого рентгеновского излучения и угловых дисперсионных установок, имеющихся на линиях пучка ID09A и ID27. Из-за небольшого размера образца и слабого поперечного сечения рассеяния CO 2 , высокий поток фотонов синхротрона ESRF и крошечные размеры рентгеновских пятен имели решающее значение для получения хороших дифракционных данных.
Затем кристаллы были исследованы с использованием источников жесткого рентгеновского излучения и угловых дисперсионных установок, имеющихся на линиях пучка ID09A и ID27. Из-за небольшого размера образца и слабого поперечного сечения рассеяния CO 2 , высокий поток фотонов синхротрона ESRF и крошечные размеры рентгеновских пятен имели решающее значение для получения хороших дифракционных данных.
Рис. 2. Деталь дифракционной картины монокристалла CO 2 -IV в точке 15.2 ГПа и 295 К, полученные поворотом кристалла на 60 ° вокруг оси фи. Цифры представляют собой (hkl) индексы отражений от кристалла CO 2 , а D — отражения от алмазных наковален. На вставке показано изображение ограненного монокристалла, находящегося в равновесии с жидкостью при 11,7 ГПа – 830 К, если смотреть через алмазные наковальни. |
Высокое качество кристаллов и дифракционных данных позволило нам решить структуру фазы IV с использованием методов ab initio : это ромбоэдрическая, пространственная группа R-3c , с 8 молекулами в примитивной элементарной ячейке ( Рисунок 3 ). Длина внутримолекулярной связи C = O оказалась немного меньше (1,155 Å), чем длина изолированной молекулы, что резко контрастирует со сценарием промежуточного связывания. Более того, никакого изгиба молекул не наблюдалось. Это показывает, что CO 2 остается чисто молекулярным твердым телом в диапазоне давлений фазы IV.
Длина внутримолекулярной связи C = O оказалась немного меньше (1,155 Å), чем длина изолированной молекулы, что резко контрастирует со сценарием промежуточного связывания. Более того, никакого изгиба молекул не наблюдалось. Это показывает, что CO 2 остается чисто молекулярным твердым телом в диапазоне давлений фазы IV.
Рисунок 3. Элементарная ячейка CO 2 фаза IV ( R- 3c).Показана гексагональная тройная элементарная ячейка с 24 молекулами. |
Устойчивость этой структуры была дополнительно исследована с помощью теоретических расчетов, основанных на теории функционала плотности. Результаты очень хорошо согласуются с экспериментальными данными как по структурным параметрам, так и по рамановскому и инфракрасному спектрам.
Эти результаты также свидетельствуют о поразительном сходстве между фазовыми диаграммами высокого давления CO 2 и N 2 , по крайней мере, для молекулярных фаз. Действительно, эти две системы кристаллизуются в одной и той же структуре R-3c при высоком давлении, а также имеют общие структуры Pa-3 и P42 / mnm при более низких значениях P / T. Структура R-3c также воспринимается молекулами CO при высоком давлении, показывая, что это благоприятное компактное расположение для молекул стержневой формы с сильными электрическими квадруполями. Таким образом, мы можем ожидать найти такую же структуру для ряда подобных соединений.
Действительно, эти две системы кристаллизуются в одной и той же структуре R-3c при высоком давлении, а также имеют общие структуры Pa-3 и P42 / mnm при более низких значениях P / T. Структура R-3c также воспринимается молекулами CO при высоком давлении, показывая, что это благоприятное компактное расположение для молекул стержневой формы с сильными электрическими квадруполями. Таким образом, мы можем ожидать найти такую же структуру для ряда подобных соединений.
В заключение, наши результаты показывают, что полимеризация в диоксиде углерода не происходит через промежуточные состояния и, скорее всего, происходит из-за химических реакций в твердом состоянии между молекулами CO 2 .Помимо рационализации фазовой диаграммы молекулярного CO 2 , наши результаты должны помочь в понимании образования полимерных фаз; действительно, недавние исследования показывают, что структура полимерной фазы, образующейся при высоком давлении / температуре, сильно зависит от одной из исходных молекулярных фаз (III, II или IV) [3]. В частности, структура полимерной фазы V, которая все еще обсуждается, вполне могла быть связана со структурой фазы IV. Дальнейшие экспериментальные и теоретические исследования находятся в процессе определения поведения фазы IV при ее сжатии в диапазоне давлений полимерных состояний.
В частности, структура полимерной фазы V, которая все еще обсуждается, вполне могла быть связана со структурой фазы IV. Дальнейшие экспериментальные и теоретические исследования находятся в процессе определения поведения фазы IV при ее сжатии в диапазоне давлений полимерных состояний.
Ссылки
[1] В. Йота, К.С. Ю и Х. Синн, Science 283 , 1510 (1999).
[2] J.H. Пак, К.С. Ю, В. Йота, Х. Синн, М.Ф. Николь, Т. Ле Бихан, Phys. Ред. B 68 , 014107 (2003).
[3] J. Sun, D.D. Клуг, Р. Мартонак, Я.А. Монтойя, М.-С. Ли, С. Скандоло и Э. Тосатти, Proc. Natl. Акад. Sci. США 106 , 6077 (2009).
Основная публикация и авторы
F.Дачи (а), В. Джордано (б), П. Мюнш (а) и А. Саитта (а), Структура фазы IV диоксида углерода: нарушение сценария промежуточного состояния связи, Phys. Rev. Lett. 103 , 185701 (2009).
(a) Université Pierre et Marie Curie (Париж, 6) и CNRS, IMPMC, Париж (Франция)
(b) ESRF
Изображение вверху: Сухой лед — низкотемпературная фаза твердого CO2 промышленного производства.
Физический Свойства твердых тел
В п.9.1 и снова в Разделе 10.2B мы обсуждали характеристики твердых тел. Эти свойства предполагают, что частицы (ионы, молекулы или атомы) в твердом теле занимают фиксированные позиции от которые они не могут легко переместить. Такое упорядоченное расположение называется кристаллом. структура или кристаллическая решетка твердого тела. Сильные силы притяжения между частицы удерживают их в таком порядке. Даже в этом случае, как показано на рисунке 10.9, каждая частица в твердом теле имеет некоторую кинетическую энергию и находится в
РИСУНОК 10.9 Кристаллическая структура
сплошной, показывая движение компонента
ионы, атомы или молекулы в пределах назначенных им
Космос. |
постоянное движение в своем пространстве в твердом теле (если твердое тело не имеет температуру абсолютного нуля, при которой все движение прекращается). Ионы, атомы или молекулы, из которых состоит твердое тело, колеблются, вращаются и даже перемещаются в пределах отведенного им пространства в кристаллической структуре.
Как и в газовых и жидких образцах, частицы в твердом теле имеют распределение кинетических энергий, которое зависит от температуры образца. При любой температуре некоторые частицы обладают достаточной энергией, чтобы преодолеть силы, удерживающие их на месте, и выйти из твердого тела в виде пара. Следовательно, каждое твердое тело, как и каждая жидкость, имеет давление пара, которое увеличивается с увеличением температуры. Процесс, при котором атомы или молекулы переходят непосредственно из твердого состояния в газообразное, называется сублимацией.Возвышенные твердые вещества имеют необычно высокое давление пара.
Сухой лед (твердая двуокись углерода) — знакомый пример твердого вещества, которое возгоняется.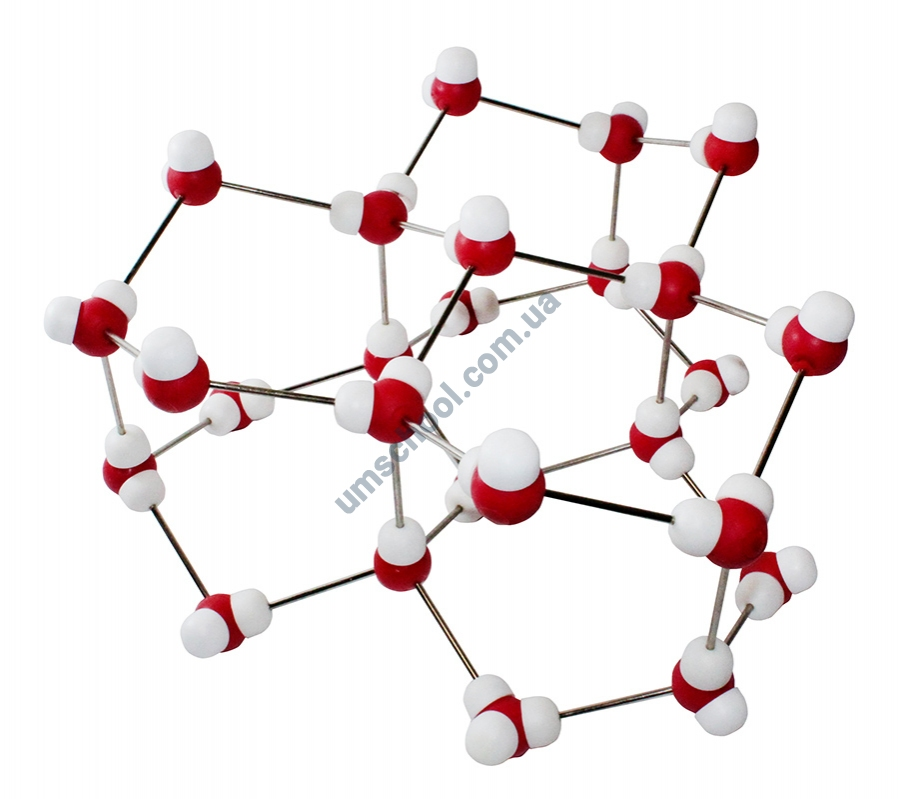 Твердая вода (лед) возгоняется. Если вы живете в холодном и сухом климате, вы могли заметить, что лед исчезает (фактически он превращается в бесцветный газ) при температуре ниже 0 ° C. Шарики моли возвышенные; они исчезают после защиты шерстяных изделий жарким летом.
Твердая вода (лед) возгоняется. Если вы живете в холодном и сухом климате, вы могли заметить, что лед исчезает (фактически он превращается в бесцветный газ) при температуре ниже 0 ° C. Шарики моли возвышенные; они исчезают после защиты шерстяных изделий жарким летом.
Когда твердое тело нагревается, изменение его температуры зависит от его удельной теплоемкости.Решение задач удельной теплоемкости одинаково для жидкости (раздел 10.3B) или твердое тело (Раздел 2.5B).
Твердое тело плавится (превращается в жидкость), когда средняя кинетическая энергия его частиц достаточно высока, чтобы преодолеть силы притяжения между ними. По определению Точка плавления твердого тела — это температура, при которой жидкое и твердое состояния находятся в равновесии при давлении 1 атм. Мы показываем это равновесие в форме уравнения, записывая «твердое тело» как реагент и «жидкость» как продукт и соединив их двойной (равновесной) стрелкой:
Во время плавления и твердое, и жидкое вещество присутствуют до тех пор, пока все твердое не превратится.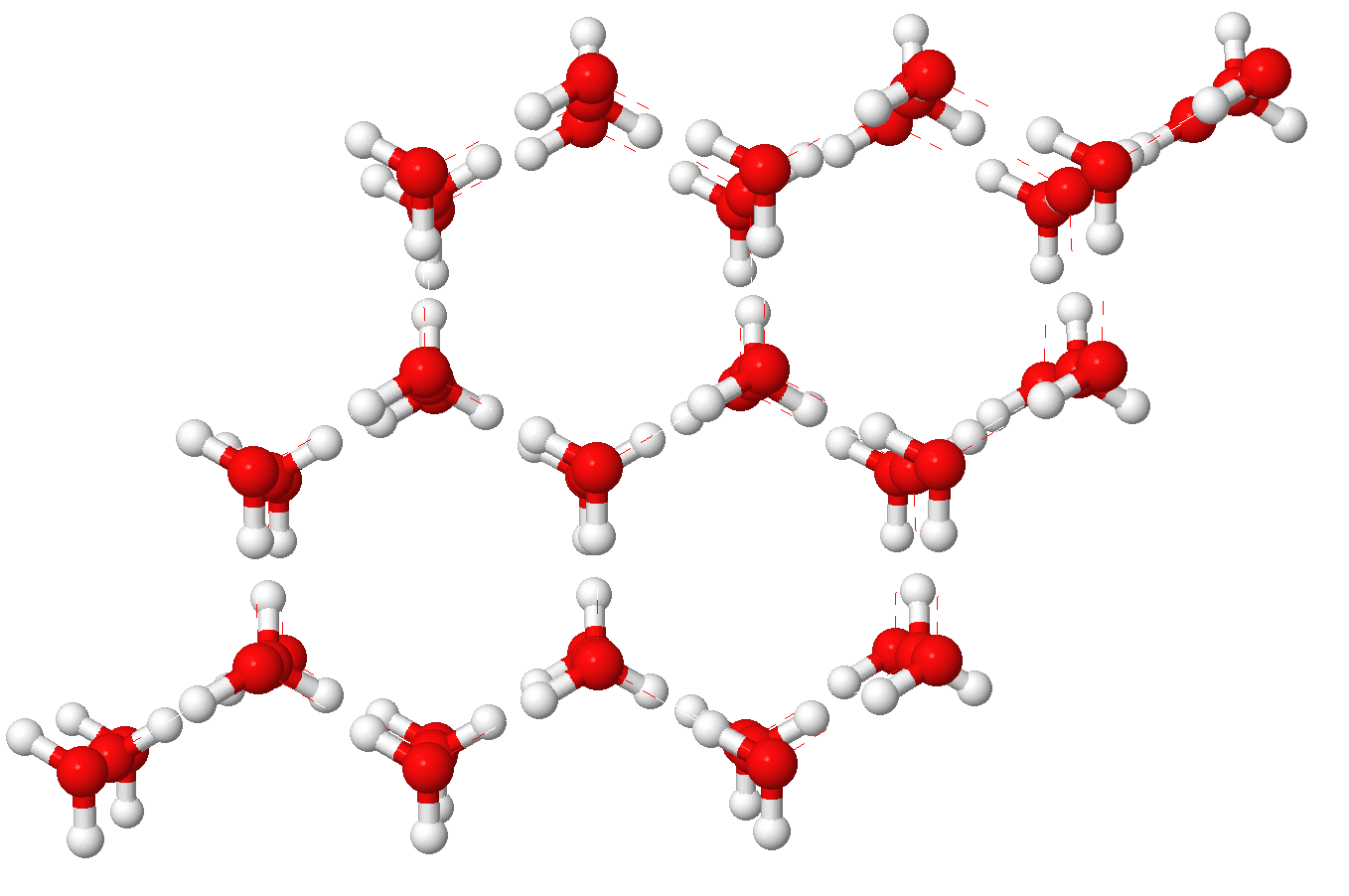 в жидкость.И наоборот, во время замораживания твердые и жидкие вещества присутствуют до тех пор, пока все
жидкость превращается в твердое вещество. Процессы обозначаются надписью «плавление».
над стрелкой прямого равновесия и «замораживание» при обратном равновесии
стрелка. Поскольку замерзание — это процесс, обратный плавлению, точка замерзания вещества
такая же, как его температура плавления. Молярная теплота плавления,
H fus , вещества — это количество тепла, которое необходимо подвести
преобразовать один моль этого вещества из твердого вещества в жидкость при его плавлении
точка.Расчеты, связанные с теплотой плавления, аналогичны расчетам с использованием
теплота испарения.
в жидкость.И наоборот, во время замораживания твердые и жидкие вещества присутствуют до тех пор, пока все
жидкость превращается в твердое вещество. Процессы обозначаются надписью «плавление».
над стрелкой прямого равновесия и «замораживание» при обратном равновесии
стрелка. Поскольку замерзание — это процесс, обратный плавлению, точка замерзания вещества
такая же, как его температура плавления. Молярная теплота плавления,
H fus , вещества — это количество тепла, которое необходимо подвести
преобразовать один моль этого вещества из твердого вещества в жидкость при его плавлении
точка.Расчеты, связанные с теплотой плавления, аналогичны расчетам с использованием
теплота испарения.
Пример: Молярная теплота плавления четыреххлористого углерода (CCl4) составляет 3,26 кДж / моль. Сколько джоулей необходимо ввести в 34 г твердого четыреххлористого углерода при есть точка плавления, чтобы превратить образец в жидкость? Решение Разыскивается ? J Учитывая 34 г CCl4 Коэффициенты пересчета Уравнение Ответ 0. |
Категории твердых тел
Категориитвердых тел
Категории твердых тел На основе Solid Pack
Твердые вещества можно разделить на три категории на основе как частицы, образующие твердую упаковку.
- Кристаллические тела — трехмерные аналоги кирпичной стены.Они имеют регулярную структуру, в которой частицы упаковываются в повторяющийся узор с одного края твердого тела к другому.
- Аморфные твердые тела (буквально «твердые тела без form «) имеют случайную структуру, почти не имеют дальний заказ.
- Поликристаллические твердые вещества представляют собой совокупность
большого количества мелких кристаллов или зерен, в которых
структура правильная, но кристаллы или зерна
расположены случайным образом.

Степень кристалличности твердого вещества имеет большое значение. влияние на его физические свойства.
Примеры: полиэтилен, используемый для изготовления пакетов для сэндвичей и Мусорные пакеты — это аморфное твердое тело, состоящее более или менее из случайно ориентированные цепочки (-CH 2 -CH 2 -) связи. Бутылки для молока изготавливаются из более кристаллической формы полиэтилен, и они имеют гораздо более жесткую структуру.
Категории Твердые тела на основе связей, удерживающих твердое тело вместе
Твердые вещества можно классифицировать на основе облигаций, которые содержат атомы или молекулы вместе.Этот подход классифицирует твердые тела как молекулярные, ковалентные, ионные или металлические.
Йод (I 2 ), сахар (C 12 H 22 O 11 ),
и полиэтилен являются примерами соединений, которые являются молекулярными
твердых веществ при комнатной температуре. Вода и бром — жидкости
образующие твердые молекулярные частицы при небольшом охлаждении; H 2 O
замерзает при 0 o C и Br 2 замерзает при -7 o C.
Вода и бром — жидкости
образующие твердые молекулярные частицы при небольшом охлаждении; H 2 O
замерзает при 0 o C и Br 2 замерзает при -7 o C.
Молекулярные твердые вещества характеризуются относительно сильным внутримолекулярным связывает между атомами, образующими молекулы, и многое другое. более слабые межмолекулярных связей между этими молекулами.Поскольку межмолекулярные связи относительно слабые, молекулярные твердые вещества часто представляют собой мягкие вещества с низкой температурой плавления.
Сухой лед или твердая двуокись углерода — прекрасный пример молекулярное твердое вещество. Силы Ван-дер-Ваальса удерживают CO 2 вместе достаточно слабы, чтобы сухой лед сублимировал непосредственно из твердой фазы в газовую при -78 o C.
Ковалентные твердые вещества , такие как алмаз, образуют кристаллы, которые
можно рассматривать как одну гигантскую молекулу, состоящую из почти
бесконечное количество ковалентных связей. Каждый атом углерода в алмазе
ковалентно связан с четырьмя другими атомами углерода, ориентированными к
углы тетраэдра, как показано на рисунке ниже. Потому что
все связи в этой структуре одинаково прочны, ковалентны
твердые вещества часто бывают очень твердыми, и их, как известно, трудно
плавиться. Алмаз — самое твердое природное вещество, и он плавится при
3550C.
Каждый атом углерода в алмазе
ковалентно связан с четырьмя другими атомами углерода, ориентированными к
углы тетраэдра, как показано на рисунке ниже. Потому что
все связи в этой структуре одинаково прочны, ковалентны
твердые вещества часто бывают очень твердыми, и их, как известно, трудно
плавиться. Алмаз — самое твердое природное вещество, и он плавится при
3550C.
Ионные твердые частицы представляют собой соли, такие как NaCl, которые удерживаются вместе сильной силой притяжения между ионами противоположный заряд.
Поскольку эта сила притяжения зависит от квадрата расстояние между положительным и отрицательным зарядами, сила ионной связи зависит от радиусов ионов, образующих твердый. По мере того, как эти ионы становятся больше, связь становится слабее. Но ионная связь все еще достаточно сильна, чтобы гарантировать, что соли имеют относительно высокие температуры плавления и кипения.
Чтобы понять металлические твердые тела , мы должны прояснить
распространенное заблуждение о химических связях. Ионный и ковалентный
облигации часто представляют, как если бы они были противоположными концами
двухмерная модель склеивания, в которой соединения, содержащие
полярные связи находятся где-то между этими крайностями.
Ионный и ковалентный
облигации часто представляют, как если бы они были противоположными концами
двухмерная модель склеивания, в которой соединения, содержащие
полярные связи находятся где-то между этими крайностями.
ионный …….. полярный …….. ковалентный
На самом деле существует три вида связей между соседними атомы: ионные, ковалентные и металлические, как показано на рисунке ниже. Сила притяжения между атомами в металлах, таких как медь и алюминий или сплавы, такие как латунь и бронза, металлические связи.
Молекулярные, ионные и ковалентные твердые вещества имеют одно общий. За редкими исключениями электроны в этих твердых телах локализованы . Они либо находятся на одном из атомов, либо ионов, или они разделяются парой атомов или небольшой группой атомы.
У атомов металла недостаточно электронов, чтобы заполнить свою валентность
оболочки, разделяя электроны со своими ближайшими соседями.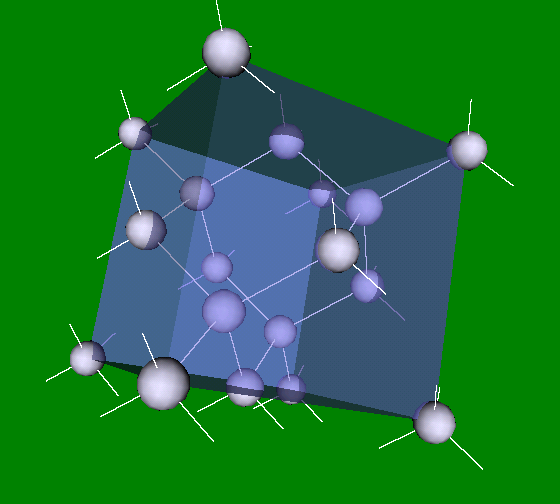 Поэтому электроны в валентной оболочке разделяют многие
атомов, вместо двух.Фактически валентные электроны делокализованы над многими атомами металлов. Потому что эти электроны не плотно
связанные с отдельными атомами, они могут свободно перемещаться через
металл. В результате металлы являются хорошими проводниками электричества.
Электроны, попадающие в металл одним краем, могут вытеснять другой.
электронов, чтобы вызвать чистый поток электронов через
металл.
Поэтому электроны в валентной оболочке разделяют многие
атомов, вместо двух.Фактически валентные электроны делокализованы над многими атомами металлов. Потому что эти электроны не плотно
связанные с отдельными атомами, они могут свободно перемещаться через
металл. В результате металлы являются хорошими проводниками электричества.
Электроны, попадающие в металл одним краем, могут вытеснять другой.
электронов, чтобы вызвать чистый поток электронов через
металл.
Изменяющееся состояние — Плавление | Глава 2: Состояния материи
Попросите учащихся посмотреть, как тает небольшой кусок льда.
Покажите студентам видеосюжет «Лед тает на разных поверхностях».
В этом видео лед помещен на две похожие на вид черные поверхности — алюминиевая и пластиковая. Лед тает на алюминии быстрее, потому что он лучше проводит теплоту, чем пластик.
Обсудите наблюдения студентов.
Спросите студентов:
- Как вы думаете, откуда взялась энергия, чтобы растопить лед?
- Энергия исходит от воздуха и поверхности, на которую кладется лед, причем обе имеют комнатную температуру.Поскольку комнатная температура теплее, чем температура льда, энергия передается от поверхности и воздуха ко льду.
- Как вы думаете, что произошло со скоростью молекул льда, когда он нагрелся?
- Молекулы воды двигались быстрее.
Раздайте каждому учащемуся лист с упражнениями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально в зависимости от ваших инструкций.Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Дайте ученикам время ответить на первые два вопроса в листе задания.
Предложите учащимся узнать, как заставить лед таять быстрее.
Введите вопрос для исследования:
- Как сделать так, чтобы лед таял быстрее?
Помогите учащимся спланировать и провести эксперимент, спросив:
- Как вы могли бы поставить эксперимент для проверки вашего метода?
- Учащиеся могут предложить подышать льдом, держа его в руке, или поместить лед в воду комнатной температуры или в теплую воду.Любой из этих методов хорош, но постарайтесь, чтобы учащиеся подумали о включении элемента управления в эксперимент. В каждом случае им понадобятся два куска льда одинакового размера — один, который они каким-то образом нагревают, а другой — нет.
Вот один метод, который студенты могут попробовать:
Вопрос для расследования
Будет ли лед, помещенный в воду, таять быстрее?
Материалы
- 2 маленьких кусочка льда
- 2 маленьких прозрачных пластиковых стаканчика
- Вода
Процедура
- Добавьте в чашку воды комнатной температуры, пока она не наполнится примерно на ½.

Положите небольшой кусочек льда в воду, а другой — в чашку без воды.
Ожидаемые результаты
Лед, помещенный в воду, тает быстрее, чем лед в воздухе. Поскольку вода и воздух имеют комнатную температуру, может быть неочевидно, почему лед в воде тает быстрее. В воде так много молекул, которые могут контактировать со льдом, что передача тепла льду в воде намного эффективнее и быстрее, чем в воздухе.
Дайте студентам время написать свою процедуру и ответить на вопрос в листе действий.
Показать анимацию таяния льда.
Показать анимацию Тающий лед.
Отметьте, что молекулы воды во льду вибрируют, но не движутся друг мимо друга. С повышением температуры они начинают больше вибрировать. В конце концов их движение преодолевает их привлекательность, и они больше не могут оставаться в своей упорядоченной кристаллической структуре.По мере таяния льда упорядоченная структура разрушается, и молекулы воды движутся мимо друг друга и фактически сближаются, превращаясь в жидкую воду.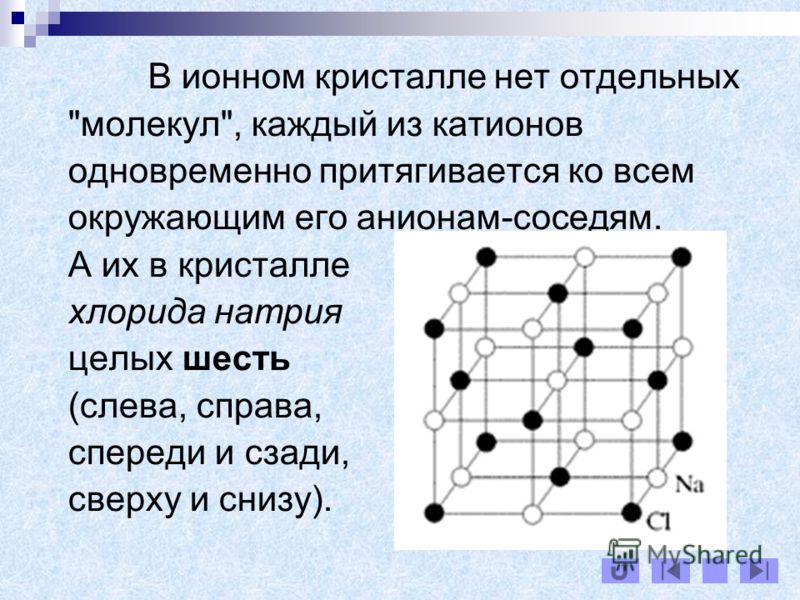
Спроецировать изображение Лед и вода
Спросите студентов
- Как изменилось движение и расположение молекул воды при таянии льда?
- Когда энергия передается молекулам воды во льду, движение молекул увеличивается. Движение молекул увеличивается настолько, что преодолевает притяжение молекул воды друг к другу, в результате чего лед тает.
Сравните движение и расположение молекул вещества (не воды) для каждого состояния вещества.
Спроецируйте изображение состояний материи.
Объясните, что диаграмма иллюстрирует движение и расположение атомов или молекул в одном веществе (не в воде), когда оно изменяется между твердым телом, жидкостью и газом.
Попросите учащихся сравнить изменения состояния большинства веществ с изменениями состояния воды.
Спроецируйте изображение State of Water.
Скажите студентам, что движение молекул воды в каждом состоянии вещества аналогично тому, что происходит с большинством веществ.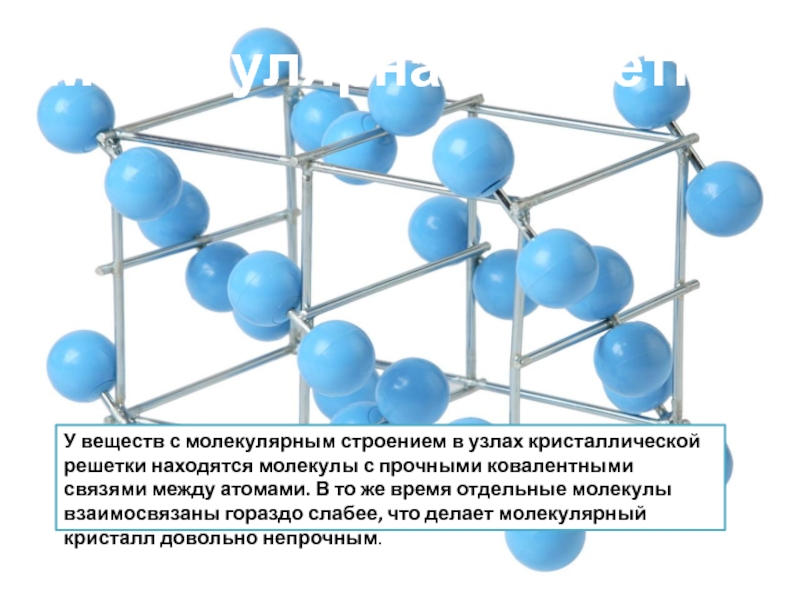 Добавление энергии увеличивает движение молекул и заставляет их расходиться дальше. Удаление энергии уменьшает движение молекул и заставляет их сближаться. Но вода делает что-то очень необычное, когда замерзает, превращаясь в лед. Молекулы, которые двигались все ближе и ближе друг к другу, отдаляются друг от друга, организуясь в открытый узор кольца, показанный ниже для льда.Вот почему при замерзании лед расширяется.
Добавление энергии увеличивает движение молекул и заставляет их расходиться дальше. Удаление энергии уменьшает движение молекул и заставляет их сближаться. Но вода делает что-то очень необычное, когда замерзает, превращаясь в лед. Молекулы, которые двигались все ближе и ближе друг к другу, отдаляются друг от друга, организуясь в открытый узор кольца, показанный ниже для льда.Вот почему при замерзании лед расширяется.
Спросите студентов:
Подробнее об изменениях энергии и состояния читайте в разделе «Биография учителя».
- Чем изменения состояния воды похожи и отличаются от изменений состояния большинства других веществ?
- Для воды или любого другого вещества движение молекул увеличивается при добавлении энергии и уменьшается при ее удалении. Основное отличие воды от других веществ — это расположение молекул твердого вещества и жидкости.В воде молекулы льда находятся дальше друг от друга, чем в жидкой воде. Это необычно, потому что молекулы твердых тел в большинстве других веществ расположены ближе друг к другу, чем в жидком состоянии.

Предложите группам использовать свои молекулы воды для моделирования замерзания, таяния, испарения и конденсации.
Процедура
- Спроецировать изображение Лед.
- Пусть каждая группа расположит свои молекулы воды в шестигранное кольцо льда.Попросите учащихся осторожно обращаться с моделями, потому что они понадобятся им на других уроках.
- Тает льда
- Попросите учащихся использовать свои модели, чтобы показать, что происходит при таянии льда. Обратите внимание на то, что молекулы воды ближе друг к другу, чем они были, как лед. Студенты могли показать молекулы воды, движущиеся друг мимо друга.
- Испарение воды
- Попросите учащихся использовать свои молекулы, чтобы смоделировать, что произошло бы, если бы вода нагрелась, а молекулы испарились.Ученики должны показать, как молекулы воды движутся быстрее, отделяются от других молекул и попадают в воздух.
- Конденсируется водяной пар
- Попросите учащихся использовать свои молекулы, чтобы смоделировать, что произойдет, если водяной пар будет достаточно охлажден, чтобы вызвать его конденсацию.
 Учащиеся должны показать, как молекулы воды в воздухе замедляются и соединяются вместе, но все же движутся мимо друг друга как жидкая вода.
Учащиеся должны показать, как молекулы воды в воздухе замедляются и соединяются вместе, но все же движутся мимо друг друга как жидкая вода.
Соберите молекулы воды.Эти модели будут снова использованы в главе 5, урок 1.
Проведите демонстрацию для сравнения таяния обычного льда и сухого льда.
Сообщите учащимся, что сухой лед — это замороженный углекислый газ. Углекислый газ должен быть очень холодным, чтобы стать твердым (около -78 ° C или -109 ° F).
Препарат
Для этой демонстрации вам понадобится немного сухого льда.Если у вас нет сухого льда, покажите видео «Сухой лед».
Вопрос для расследования
Тает ли сухой лед так же, как и обычный?
Материалы
- Лед
- Сухой лед
- Полотенце коричневое
- Холодная вода
- Горячая вода (около 50 ° C)
Процедура
- Положите кусок сухого льда и кусок обычного льда на коричневое бумажное полотенце.

Ожидаемые результаты
Через короткое время лед начнет таять, и бумажное полотенце вокруг льда станет влажным и темнее. Бумажное полотенце вокруг сухого льда останется сухим и не потемнеет. Если вы заметили небольшое темное пятно на бумажном полотенце рядом с сухим льдом, возможно, водяной пар из воздуха сконденсировался на сухом льду и растаял на бумажном полотенце.
Если ученики видят туманный белый туман, исходящий от сухого льда, сообщите им, что это не сам углекислый газ.Двуокись углерода не имеет цвета, запаха и невидима. Туманный дым или туман — это на самом деле водяной пар в воздухе, который становится достаточно холодным, чтобы конденсироваться. Водяной пар охлаждается сухим льдом и холодным углекислым газом. Туман имеет тенденцию дрейфовать вниз, потому что он переносится углекислым газом, который более плотен, чем окружающий его воздух.
Обсудите наблюдения студентов и представьте идею о том, что некоторые вещества могут непосредственно превращаться из твердого тела в газ.
Спросите студентов:
- Тает ли обычный лед и сухой лед одинаково?
- Нет. Обычный лед превращается в жидкость, которую вы видите на коричневом бумажном полотенце. Сухой лед не превращается в жидкость.
Объясните студентам: причина того, что сухой лед не делает бумажное полотенце влажным, заключается в том, что оно не тает. Когда энергия передается на сухой лед, твердый диоксид углерода не плавится в жидкий диоксид углерода.Вместо этого твердое вещество превращается непосредственно в газ. Этот процесс называется сублимацией. Сублимация происходит, когда молекулы твердого тела движутся достаточно быстро, чтобы преодолеть притяжение других молекул и стать газом. Поскольку замороженный углекислый газ никогда не становится жидкостью при нормальном давлении, его называют сухим льдом.
Покажите студентам, что происходит, когда сухой лед помещается в воду.
Поместите кусок сухого льда в воду и добавьте немного средства для мытья посуды или посмотрите видео «Сухой лед в воде».
Ожидаемые результаты
Сформируются пузыри и образуется туманный белый туман. Поскольку вода намного теплее сухого льда, энергия передается от воды к сухому льду, в результате чего он превращается из твердого вещества в газ и пузырится через воду. После добавления моющего средства образуется холмик из пузырьков.
Студентам будет интересно узнать, какой туман выходит из чашки. Скажите им, что вода превращается в водяной пар в пузырьках углекислого газа, а затем конденсируется.Это вызывает туман внутри пузырьков, который улетучивается, когда пузырь лопается.
Спросите студентов:
- Вы видели, что сухой лед очень быстро сублимируется в воде. Что можно сделать, чтобы сухой лед сублимировался еще быстрее?
- Есть несколько способов ускорить возгонку сухого льда. Один из вариантов — положить сухой лед в горячую воду.
Поместите кусок сухого льда в стакана холодной воды, а другой кусок — в стакана горячей воды.Или покажите видео «Сухой лед в горячей и холодной воде».
Ожидаемые результаты:
Гораздо больше тумана будет образовывать чаша с горячей водой.
Скажите ученикам, что при помещении сухого льда в горячую воду образуется больше тумана, потому что передача энергии и сублимация происходят быстрее. Это вызывает более быстрое образование тумана.
Химическая структура SiO2 по сравнению с CO2
$ \ ce {SiO2} $ образует тетраэдрическую сеть с ковалентными связями, а $ \ ce {CO2} $ — строго молекулярное соединение, которое образует двойные связи между углеродом и кислородом.Это потому, что Si находится в следующем периоде, поэтому он имеет 3p-орбитали вместо 2p-орбиталей. Орбитали более высокой оболочки (большее главное квантовое число) физически больше, но кислород все еще имеет меньшие 2p-орбитали, поэтому между p-орбиталями кремния и кислорода меньше перекрытие, чем между p-орбиталями кислорода и углерода. Это делает связь Si-O π намного выше по энергии, поэтому она не образуется. Вместо этого образуется только тетраэдрическая сетка из σ-связей с более низкой энергией, что дает нам кремнезем, каким мы его знаем.Это объясняет, почему $ \ ce {SiO2} $ не может образовывать молекулы с двойной связью, подобные $ \ ce {CO2} $. Кроме того, одинарные связи Si-O особенно стабильны (466 кДж / моль -1 ) и коротки. Это объясняется перекрытием p-орбиталей кислорода и пустых d-орбиталей кремния. Кроме того, кремний является более крупным атомом, чем углерод, поэтому отталкивание связывающих пар электронов между атомами кислорода, связанными с кремнием в SiO2, намного ниже, чем то, что произошло бы, если бы могла существовать такая тетраэдрически координированная сетка CO2. Таким образом, поведение кремнезема можно объяснить энтальпией, теорией МО и VSPER.
Crystal $ \ ce {CO2} $ определенно можно сделать в лаборатории, и он известен как сухой лед. $ \ ce {CO2} $ замерзает при -56 ° C. Он закипает при -78 ° C, и вы часто увидите, что эта температура написана под стрелками в синтезе, потому что сухой лед является наиболее распространенным методом проведения реакций при такой низкой температуре. Однако при атмосферном давлении кристаллическая структура сухого льда не похожа на сетчатый ковалентный кремнезем, но некоторые твердые фазы высокого давления $ \ ce {CO2} $ имеют сетчатую ковалентную структуру.Вот фазовая диаграмма:
Фаза I $ \ ce {CO2} $, показанная в нижнем левом углу, является наиболее распространенной кристаллической структурой сухого льда, и она является молекулярной, демонстрируя гранецентрированное кубическое расположение по отношению к углероду. Фаза высокого давления V $ \ ce {CO2} $ (вверху справа), с другой стороны, имеет структуру «частично схлопнувшегося кристобалита». Изоструктурный с одним из полиморфов кремнезема, он не является молекулярным.
Что касается газовой фазы $ \ ce {SiO2} $, ее, безусловно, будет сложно получить, так как она кипит при температуре, близкой к 3000 ° C, предположительно по причинам стабильности связи, перечисленным выше.Я не читал некую литературу о его газофазной структуре, но предполагаю, что она будет похожа на структуру $ \ ce {CO2} $, но крайне нестабильна.


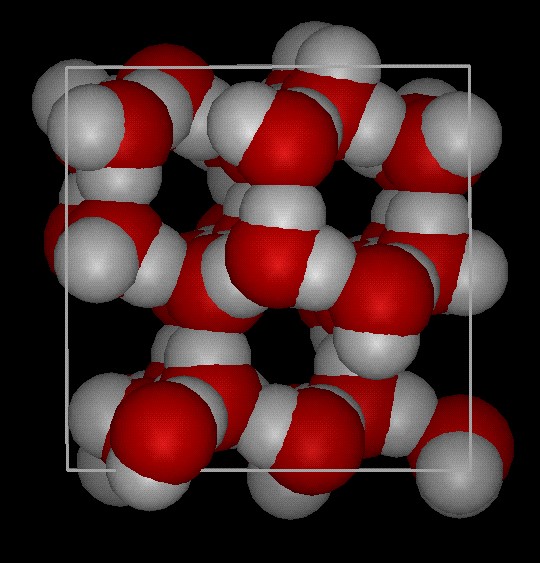
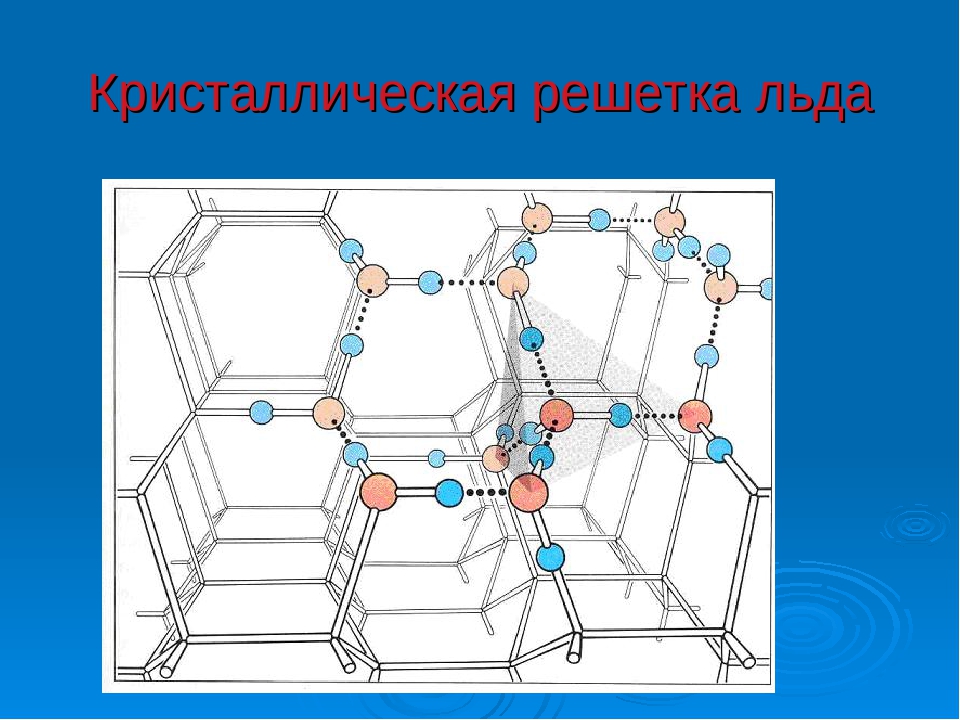
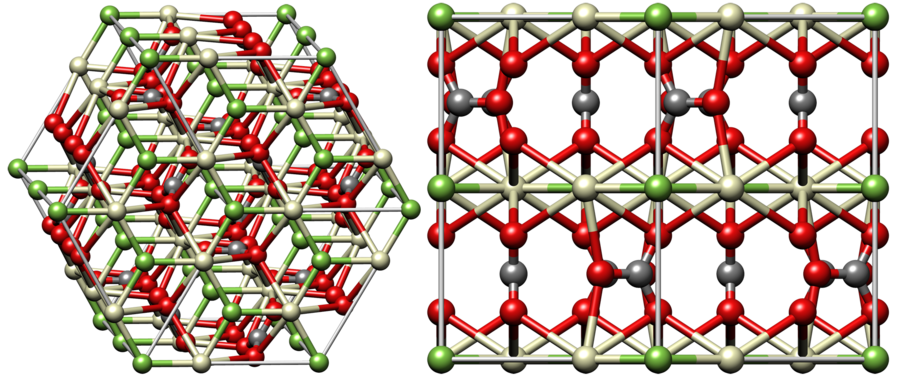
 Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).

 Пунктирными линиями показаны экстраполяции измерений, пунктирная линия считается кинетической линией, а пунктирные линии — гипотетическими линиями перехода. Разные цвета отличают молекулярные фазы от немолекулярных.
Пунктирными линиями показаны экстраполяции измерений, пунктирная линия считается кинетической линией, а пунктирные линии — гипотетическими линиями перехода. Разные цвета отличают молекулярные фазы от немолекулярных. 72 кДж
72 кДж
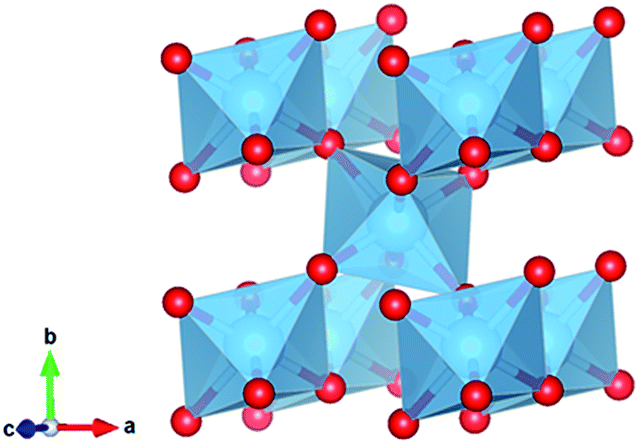



Leave A Comment