Изопрен, химические свойства, применение, Ch3=C(Ch4)-CH=Ch3
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Формула Изопрена структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C5H8
Химический состав Изопрена
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 5 | 88,2% |
| H | Водород | 1,008 | 8 | 11,8% |
Молекулярная масса: 68,119
Изопрен (2-метилбутадиен-1,3)- ненасыщенный углеводород, принадлежащий к диеновому ряду, представляющий собой бесцветную летучую жидкость с характерным запахом.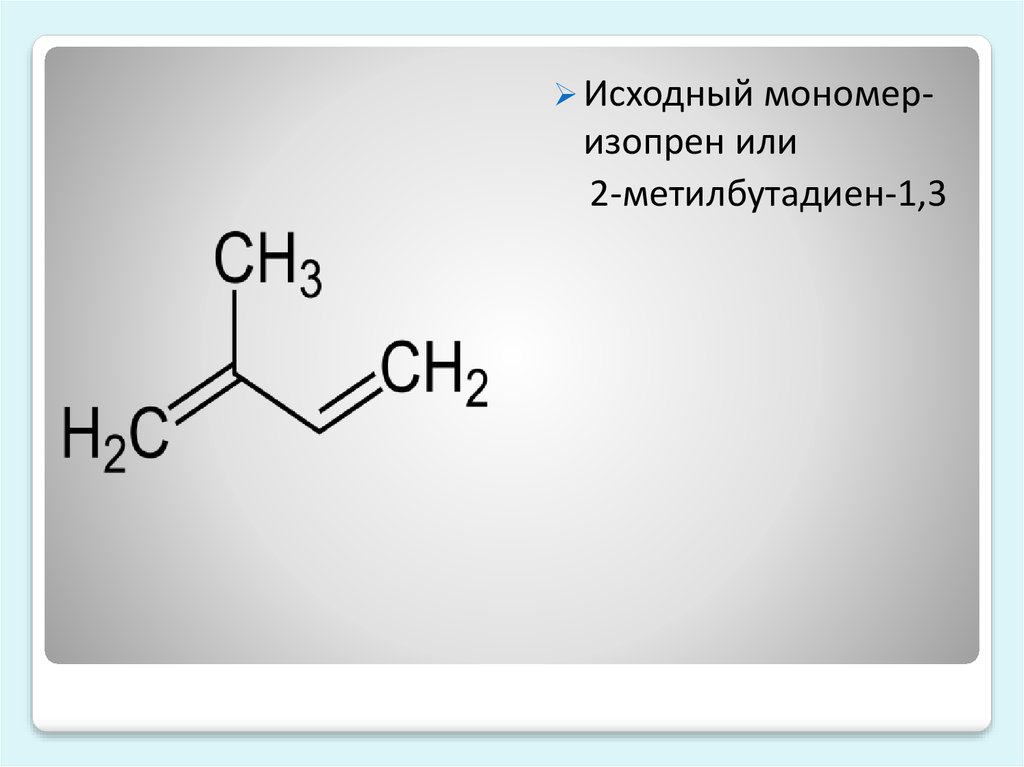 Является мономером натурального каучука, остаток его молекулы входит во множество других природных соединений — изопреноидов, терпеноидов и т. д.
Является мономером натурального каучука, остаток его молекулы входит во множество других природных соединений — изопреноидов, терпеноидов и т. д.
Изопрен растворим во многих органических растворителях, например, с этиловым спиртом смешивается в произвольном соотношении. Плохо растворим в воде. При полимеризации образует изопреновые каучуки и гуттаперчи. Изопрен также вступает в различные реакции сополимеризации.
Основное применение в промышленности — синтез изопреновых каучуков, некоторых медицинских препаратов, душистых веществ.
Получение изопрена
Устаревшие методы
Изопрен был впервые получен Уильямсом в 1860 году путём пиролиза натурального каучука. Наиболее распространённым способом получения изопрена в лабораторных условиях было термическое разложение скипидарного масла в так называемой изопреновой лампе — специальном приборе с нагреваемой электрическим током спиралью. Во время Второй мировой войны в США изопрен получали пиролизом лимонена в промышленных масштабах. До окончания войны изопрен был слишком дорог для производства синтетического каучука, однако ситуация изменилась с появлением методов его получения из нефти, а также с развитием технологии его полимеризации.
До окончания войны изопрен был слишком дорог для производства синтетического каучука, однако ситуация изменилась с появлением методов его получения из нефти, а также с развитием технологии его полимеризации.
Синтетические методы
Промышленные методы получения изопрена могут быть разделены на группы в зависимости от исходных реагентов для сборки пятиуглеродного скелета молекулы:
- C1 + C4 → C5;
- C2 + C3 → C5;
- C3 + C3 → C6 → C5 + C1;
- C4 + C4 → C8 → C5 + C3.
Основным блоком C4 для синтеза изопрена является изобутилен, к которому в кислой среде (серная кислота или ионообменные смолы) присоединяют формальдегид с образованием 4,4-диметил-1,3-диоксана с выходом 74—80 % (реакция Принса), который далее разлагают при нагревании (200—300 °C) в присутствии ортофосфорной кислоты, что даёт изопрен с выходом 43—46 %.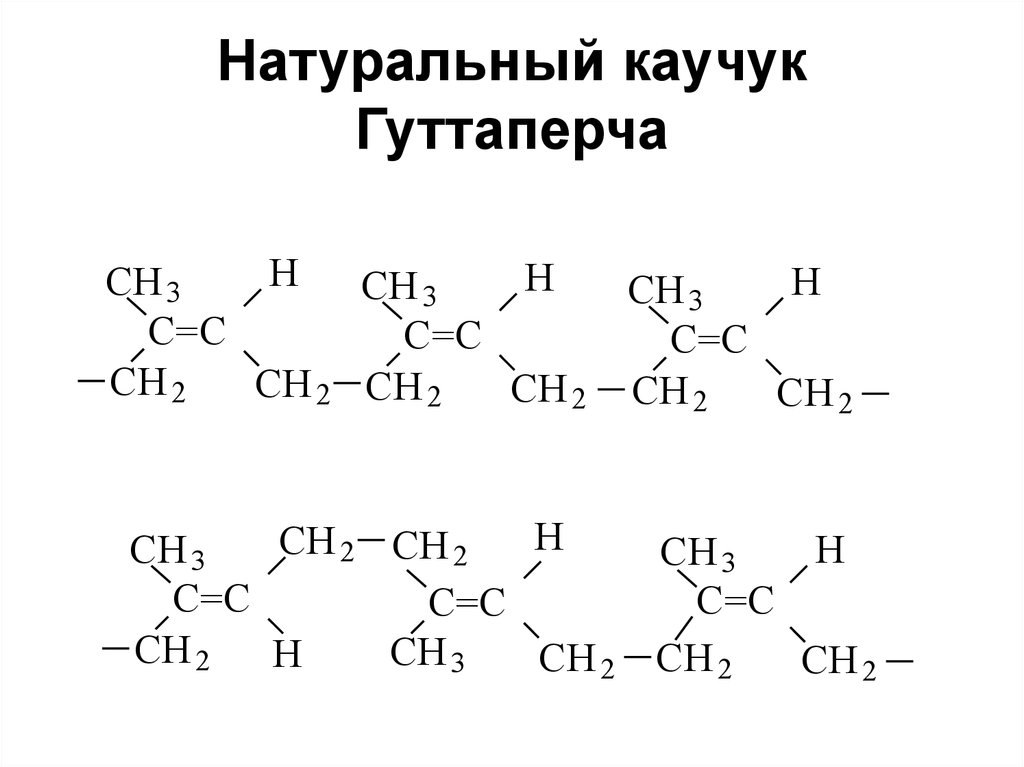 Метод был предложен в 1938 году и стал известен, благодаря работам сотрудников Французского института нефти. Предпринимались попытки улучшения данного синтеза, связанные преимущественно с технологическими особенностями и использованием различных катализаторов. Существенной чертой метода является выделение формальдегида при разложении 1,3-диоксана и связанное с этим образование резины в установках по синтезу изопрена. Чтобы избежать подобных побочных процессов, предлагалось использовать различные химические аналоги формальдегида (метилаль, метилхлорметиловый эфир, диоксолан), а также генерировать его непосредственно при синтезе целевого продукта.
Метод был предложен в 1938 году и стал известен, благодаря работам сотрудников Французского института нефти. Предпринимались попытки улучшения данного синтеза, связанные преимущественно с технологическими особенностями и использованием различных катализаторов. Существенной чертой метода является выделение формальдегида при разложении 1,3-диоксана и связанное с этим образование резины в установках по синтезу изопрена. Чтобы избежать подобных побочных процессов, предлагалось использовать различные химические аналоги формальдегида (метилаль, метилхлорметиловый эфир, диоксолан), а также генерировать его непосредственно при синтезе целевого продукта.
Также в качестве блока C4 может использоваться бутен-2. Его гидроформилирование в присутствии родиевого катализатора приводит к 2-метилбутаналю, который затем подвергается каталитической дегидратации под действием фосфата магния-аммония, молекулярных сит либо цеолитов, что приводит к изопрену. Данный метод не был реализован на промышленных предприятиях.
Синтез изопрена из блоков C2 и C3 был предложен Снампроджетти и использовался в Италии, давая 30 тыс. тонн изопрена в год. На первой стадии данного процесса происходит реакция между ацетоном и ацетиленом в присутствии KOH в жидком аммиаке при 10—40 °C и 20 бар. Продукт присоединения селективно гидрируется до алкена, после чего дегидратируется при 250—300°C на оксиде алюминия, давая изопрен. Общая селективность в расчёте на ацетон и ацетилен составляет 85 %. Метод позволяет получать очень чистый изопрен, однако такое производство является относительно затратным.
Промышленное получение изопрена путём димеризации пропилена, последующей изомеризации получаемого 2-метилпентена-1 в 2-метилпентен-2 и крекинга последнего в присутствии HBr с образованием метана и изопрена было воплощено на заводе в городе Бомонт (Техас), однако в 1975 году прекращено после пожара по причине роста цены на пропилен.
Интересным подходом к синтезу изопрена является метатезис бутена-2 с образованием пропилена и 2-метилбутена-2. Последний может быть дегидрирован различными известными способами. Недостаток данного подхода заключается в том, что поскольку в реакцию метатезиса могут вступать любые алкены, происходит образование разнообразных побочных продуктов. Особенно эта ситуация усугубляется при промышленных масштабах производства, когда в качестве исходного реагента используется более дешёвый технический бутен-2, содержащий примесь бутена-1.
Последний может быть дегидрирован различными известными способами. Недостаток данного подхода заключается в том, что поскольку в реакцию метатезиса могут вступать любые алкены, происходит образование разнообразных побочных продуктов. Особенно эта ситуация усугубляется при промышленных масштабах производства, когда в качестве исходного реагента используется более дешёвый технический бутен-2, содержащий примесь бутена-1.
Процессы дегидрирования
Реакции дегидрирования изопентана и изопентенов с образованием изопрена широко исследованы и напоминают аналогичные реакции получения бутадиена.
Одностадийный процесс дегидрирования изопентана под действием катализатора на основе Cr2O3/Al2O3 при 600 °C и 7 кПа даёт изопрен с выходом 52 %. Этот метод применялся в СССР. Дегидрирование изопентенов (метилбутенов) протекает под действием катализатора Shell (Fe2O3/K2CO3/Cr2O3) при 600 °C с выходом 85 %. Исходные углеводороды можно выделить из соответствующих перегонных фракций путём растворения в серной кислоте с последующим разложением эфира серной кислоты при 35 °C и обратной экстрацией изопентенов насыщенными углеводородами. Данный подход применяется на заводах Shell, Arco и Exxon.
Исходные углеводороды можно выделить из соответствующих перегонных фракций путём растворения в серной кислоте с последующим разложением эфира серной кислоты при 35 °C и обратной экстрацией изопентенов насыщенными углеводородами. Данный подход применяется на заводах Shell, Arco и Exxon.
Получение из фракции C5
Фракция C5 является побочным продуктом крекинга углеводородов в процессе получения этилена. Она содержит небольшое количество изопрена, другие углеводороды с пятью атомами углерода в молекуле, а также ароматические углеводороды C6—C8. Такая смесь может быть перегнана с выделением изопрена, обычно в количестве 2—5 массовых % в пересчёте на этилен. Однако выход может быть увеличен, если в качестве исходного сырья использовать более тяжёлую фракцию. Если крекинг проводится в более жёстких условиях (при повышенной температуре и в течение более долгого времени), то выход изопрена уменьшается. Тем не менее такое ужесточение условий приводит к увеличению концентрации изопрена во фракции C5.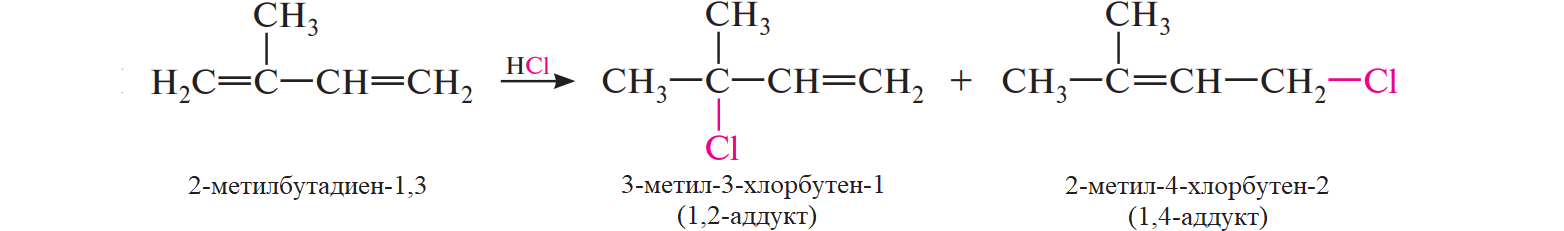 Такое обогащение коммерчески выгодно, поскольку оно уменьшает затраты на транспортировку и получение чистого изопрена.
Такое обогащение коммерчески выгодно, поскольку оно уменьшает затраты на транспортировку и получение чистого изопрена.
Перегонка фракции C5 не позволяет получить чистый изопрен, поскольку в смеси присутствуют некоторые компоненты, которые мало отличаются по температуре кипения. Для выделения чистого изопрена были предложены методы, основанные на отгонке азеотропной смеси с пентаном, а также методы с использованием экстракции селективными органическими растворителями (N-метилпирролидоном, диметилформамидом и ацетонитрилом).
В целом, с точки зрения энергозатрат, выделение изопрена подобным способом гораздо выгоднее, нежели его химический синтез.
Экономические факторы
Ключевым фактором при планировании промышленного производства изопрена является месторасположение завода по разделению фракции C5, поскольку прибыльность зависит от возможности доставить эти фракции к месту разделения из нескольких заводов, на которых производится крекинг.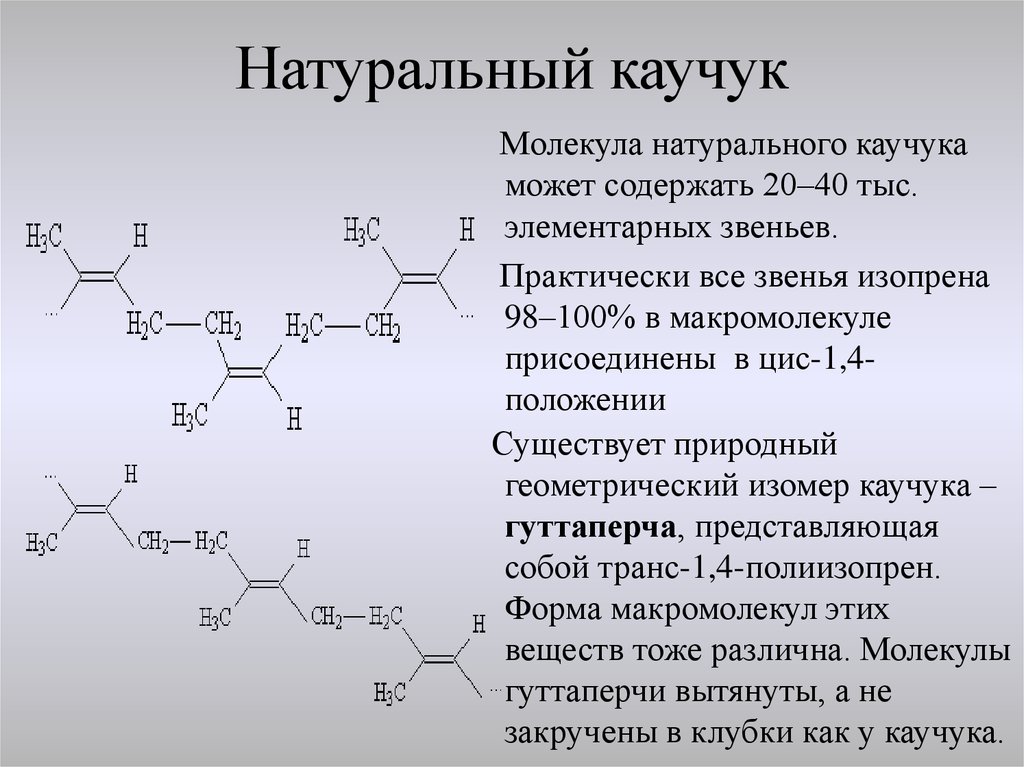 Также необходимо учитывать необходимость утилизации остальных углеводородов из фракции C5.
Также необходимо учитывать необходимость утилизации остальных углеводородов из фракции C5.
По состоянию на 1987 год в Западной Европе производилось 83 000 тонн диенов C5, из них 44 000 тонн приходилось на димеризованный циклопентадиен и 23 000 тонн на изопрен. Остальные 15 000 тонн составляли пиперилены. К 1997 году мировые объёмы производства изопрена возросли до 850 000 тонн в год, из них 180 тыс., 130 тыс. и 30 тыс. тонн производились в США, Японии и Западной Европе соответственно. Крупнейшим производителем изопрена является Goodyear (США, 61 тыс. тонн в год).
Физические свойства
При стандартных условиях изопрен представляет собой бесцветную летучую жидкость. Изопрен практически не растворяется в воде (0,029 мол. %), но смешивается во всех соотношениях с этанолом, диэтиловым эфиром, ацетоном и бензолом. Изопрен образует азеотропные смеси с рядом органических растворителей.
Химические свойства
Согласно данным спектроскопических исследований, при 50 °C большинство молекул изопрена находится в более устойчивой s-транс-конформации, и только 15 % молекул имеют s-цис-конформацию. Разность энергий между этими состояниями составляет 6,3 кДж/моль.
Разность энергий между этими состояниями составляет 6,3 кДж/моль.
По химическим свойствам изопрен представляет собой типичный сопряжённый диен, вступающий в реакции присоединения, замещения, циклизации, комплексообразования и теломеризации. По сравнению с бутадиеном, он более активно реагирует с электрофилами и диенофилами за счёт донорного индуктивного эффекта метильной группы.
Применение
Синтез полимеров
Бо́льшая часть производимого изопрена используется в синтезе цис-1,4-полиизопрена — изопренового каучука, который по свойствам и строению похож на природный каучук и широко применяется в производстве автомобильных шин. Другой продукт полимеризации изопрена — транс-1,4-полиизопрен — имеет свойства гуттаперчи и не находит широкого использования в промышленности, кроме изготовления шаров для гольфа и изоляции проводов.
Важную область применения изопрена составляет синтез блок-сополимеров типа стирол-изопрен-стирол.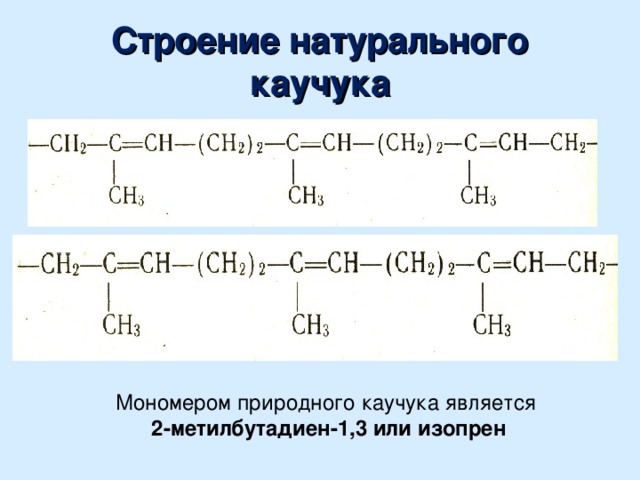 Подобные продукты используются как термопластические полимеры и адгезивы, чувствительные к давлению. Изопрен также используется в синтезе бутилового каучука — продукта сополимеризации изопрена с изобутиленом, где мольная доля изопрена составляет от 0,5 до 3,0 %.
Подобные продукты используются как термопластические полимеры и адгезивы, чувствительные к давлению. Изопрен также используется в синтезе бутилового каучука — продукта сополимеризации изопрена с изобутиленом, где мольная доля изопрена составляет от 0,5 до 3,0 %.
Синтез терпенов
С 1972 года компанией Rhodia Incorporated (США) была начата разработка методов промышленного синтеза терпенов из изопрена, ацетона и ацетилена. Синтетическая схема включала в себя присоединение хлороводорода к изопрену с образованием пренилхлорида, который затем в две стадии превращали в дегидролиналоол. Последний служил в качестве исходного соединения для синтеза различных терпенов, например, линалоола, гераниола, цитраля, β-ионона и их производных. Позже завод был закрыт, однако японский производитель Kuraray продолжил выпускать по этой схеме не только указанные продукты, но также сквалан и другие соединения. Rhodia Incorporated разработала также способ синтеза лавандулола из двух молекул изопрена при помощи синтеза Гриньяра.
Природные терпены состоят из фрагментов изопрена, соединённых друг с другом по принципу «голова — хвост». Синтетические аналоги также должны иметь такую структуру, а также содержать двойные связи в определённых положениях. В связи с этим, промышленный синтез терпенов методами олигомеризации и теломеризации затруднён, и обычно пользуются другими подходами. Тем не менее предложен способ синтеза мирцена димеризацией изопрена на катализаторе (натрий/диалкиламин). Этот способ реализуется в промышленном масштабе компанией Nissan Chemical Industries. Теломеризация изопрена под действием диэтиламина и бутиллития в качестве катализатора приводит к N,N-диэтилнериламину, который далее может быть превращён в линалоол, гераниол, нерол, цитронеллаль, гидроксицитранеллаль и ментол.
Безопасность
В высоких концентрациях в отношении животных изопрен проявляет анестетические свойства с последующим параличом и летальным исходом. Изопрен не вызывает точечных мутаций в тесте Эймса. Метаболизм происходит, в основном, в дыхательной системе: при этом происходит превращение изопрена в соответствующие эпоксиды и затем диолы. Насыщение происходит при атмосферных концентрациях, равных 300—500 м. д.; при более низких концентрациях скорость метаболизма прямо пропорциональна концентрации. Изопрен также синтезируется эндогенно: для мышей и крыс скорость синтеза оценивается в 0,4 и 1,9 мкмоль·ч–1·кг–1 соответственно.
Метаболизм происходит, в основном, в дыхательной системе: при этом происходит превращение изопрена в соответствующие эпоксиды и затем диолы. Насыщение происходит при атмосферных концентрациях, равных 300—500 м. д.; при более низких концентрациях скорость метаболизма прямо пропорциональна концентрации. Изопрен также синтезируется эндогенно: для мышей и крыс скорость синтеза оценивается в 0,4 и 1,9 мкмоль·ч–1·кг–1 соответственно.
В высоких концентрациях изопрен оказывает на человека наркотическое действие, а также может вызывать раздражение кожи, глаз, слизистых оболочек и дыхательной системы. Предельно допустимая концентрация, установленная для изопрена в СССР, составляет 40 мг/м³.
Изопрен взрывоопасен и легко воспламеняется.
Биологическая роль
Изопрен, в том числе, в составе молекул других терпенов, встречается в разнообразных живых организмах: животных, растениях и микроорганизмах. В зависимости от организма число изопреновых фрагментов в молекуле терпена может составлять 1 (гемитерпены), 2 (монотерпены), 3 (сесквитерпены), 4 (дитерпены), 6 (тритерпены) или 8 (тетратерпены). В некоторых растениях обнаружены очень длинные терпены (каучук, гуттаперча), число звеньев изопрена в которых варьируется от нескольких тысяч до одного миллиона. Изопрен может также входить в состав других природных соединений неизопреноидного строения (например, прениллипидов), повышая их липофильность. Известно, что синтез изопреноидов в растениях осуществляется двумя независимыми путями: ацетат/мевалонатным путём (ацетат/MVA) и дезоксиксилозафосфат/метилэритритфосфатным путём (DOXP/MEP). Оба пути приводят к изопрену в виде так называемого «активного изопрена» — изопентенилпирофосфата (IPP), который под действием изомеразы может превращаться в изомерный 3,3-диметилаллилдифосфат (DMAPP). Сам изопрен получается из DMAPP при действии изопренсинтазы.
В некоторых растениях обнаружены очень длинные терпены (каучук, гуттаперча), число звеньев изопрена в которых варьируется от нескольких тысяч до одного миллиона. Изопрен может также входить в состав других природных соединений неизопреноидного строения (например, прениллипидов), повышая их липофильность. Известно, что синтез изопреноидов в растениях осуществляется двумя независимыми путями: ацетат/мевалонатным путём (ацетат/MVA) и дезоксиксилозафосфат/метилэритритфосфатным путём (DOXP/MEP). Оба пути приводят к изопрену в виде так называемого «активного изопрена» — изопентенилпирофосфата (IPP), который под действием изомеразы может превращаться в изомерный 3,3-диметилаллилдифосфат (DMAPP). Сам изопрен получается из DMAPP при действии изопренсинтазы.
В середине XX века было обнаружено, что растения выделяют в атмосферу пары изопрена. Мировые объёмы фитогенного изопрена оцениваются в (180—450)·10¹² г углерода в год. Эмиссия изопрена листьями растений ускоряется при температуре выше 28 °C и при высокой интенсивности солнечного излучения, когда процесс фотосинтеза полностью насыщен. Подтвердить это явление или проверить, способно ли растение выделять изопрен, можно при помощи спектроскопии в ультрафиолетовой области или путём анализа газов в газовом хроматографе, комбинированном с масс-спектрометром. Биосинтез изопрена ингибируется фосмидомицином, а также соединениями ряда статинов.
Подтвердить это явление или проверить, способно ли растение выделять изопрен, можно при помощи спектроскопии в ультрафиолетовой области или путём анализа газов в газовом хроматографе, комбинированном с масс-спектрометром. Биосинтез изопрена ингибируется фосмидомицином, а также соединениями ряда статинов.
Физиологическая роль выделения растениями изопрена до конца не выяснена. Изопрен обеспечивает растениям повышенную устойчивость к перегреванию. Кроме того, как потенциальный уловитель радикалов, он может защищать растения от разрушающего воздействия озона и активных форм кислорода. Предполагается также, что поскольку синтез изопрена требует постоянной затраты молекул АТФ и НАДФН, образующихся в процессе фотосинтеза, он таким образом сохраняет фотосистемы от перевосстановления и фотоокислительного разрушения в условиях чрезмерного освещения. Недостатком такого механизма защиты является то, что углерод, связываемый растениями в процессе фотосинтеза, выбрасывается путём выделения изопрена.
Из гомологического ряда диеновых углеводородов изопрен является наиболее часто встречающимся диеновым углеводородом в организме человека. По некоторым оценкам, скорость синтеза изопрена в организме человека составляет около 0,15 мкмоль/(кг·ч), что соответствует приблизительно 17 мг в час для человека весом 70 кг. Изопрен также присутствует в ничтожных концентрациях во многих пищевых продуктах
Изопрен | химическое соединение | Британика
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полета на Луну до управления космосом — мы изучаем широкий спектр тем, которые питают наше любопытство к космосу!
Содержание
- Введение
Краткие факты
- Факты и сопутствующий контент
Изопрен | Encyclopedia.
 com
comбуря
просмотров обновлено 18 мая 2018
ОБЗОР
Изопрен (EYE-so-preen) представляет собой прозрачную, бесцветную, летучую жидкость, которая является одновременно очень легковоспламеняющейся и весьма взрывоопасной. Он классифицируется как соединение диена , поскольку его молекулы содержат две («ди-») двойные связи («-ен»). Он также является членом семейства терпенов. Терпены представляют собой большое семейство органических соединений, содержащих две или более изопреновых единиц. Примером терпена является витамин А, молекулярная формула которого C9.0148 20 H 30 O. Витамин А содержит четыре единицы изопрена. Терпены в изобилии встречаются в природе как у растений, так и у животных.
ОСНОВНЫЕ ФАКТЫ
ДРУГИЕ НАЗВАНИЯ:
2-метил-1,3-бутадиен
ФОРМУЛА:
CH 2 =CH(CH 2 3 9019 04CH=CH 23
ЭЛЕМЕНТЫ:
Углерод, водород
ТИП СОЕДИНЕНИЯ:
Алкадиен; ненасыщенный углеводород (органический)
СОСТОЯНИЕ:
Жидкость
МОЛЕКУЛЯРНАЯ МАССА:
68,12 г/моль
РАСТВОРИМОСТЬ:
Нерастворимый в воде; смешивается с этиловым спиртом, ацетоном, эфиром и бензолом
Некоторые распространенные терпены включают гераниол, содержащийся в герани; лимонен, масло апельсина; а-пинен или скипидарное масло; а-фарнезен, масло цинтронеллы; цингиберен, масло имбиря; фарнезол, содержащийся в ландыше; β-селинен, масло сельдерея; и кариофиллен, масло гвоздики.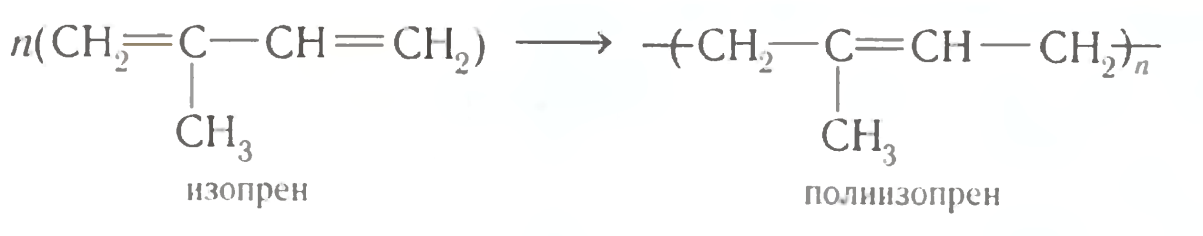 Изопрен также вырабатывается в организме животных и считается наиболее распространенным углеводородом, присутствующим в организме человека. По некоторым оценкам, 70-килограммовый (150-фунтовый) человек вырабатывает около 17 миллиграммов изопрена в день. Вероятно, самым известным источником изопрена является натуральный каучук, представляющий собой полимер, состоящий из длинных цепей изопреновых звеньев, соединенных друг с другом.
Изопрен также вырабатывается в организме животных и считается наиболее распространенным углеводородом, присутствующим в организме человека. По некоторым оценкам, 70-килограммовый (150-фунтовый) человек вырабатывает около 17 миллиграммов изопрена в день. Вероятно, самым известным источником изопрена является натуральный каучук, представляющий собой полимер, состоящий из длинных цепей изопреновых звеньев, соединенных друг с другом.
КАК ЭТО ПРОИЗВОДИТСЯ
Существует ряд методов получения изопрена из нефти. Возможно, наиболее распространенным процессом является крекинг углеводородов, присутствующих в лигроиновой части очищенной нефти. Крекинг — это процесс, при котором большие углеводороды расщепляются на более мелкие углеводороды либо с помощью тепла, либо с помощью катализатора, либо с помощью некоторого сочетания тепла и катализатора. Лигроиновая часть нефти состоит из углеводородов с температурой кипения примерно от 50°C до 200°C (от 120°F до 400°F). Другие методы получения изопрена включают дегидрирование (удаление водорода) изопентена (CH 3 CH(CH 3 )CH=CH 2 ), пиролиз (разложение при высокой температуре) метилпентена (CH 2 =C(CH 3 )CH 2 CH 9 8 3 ), или дегидратация (удаление воды) метилбутенола (CH 3 C(CH 3 )(OH)CH 2 CH 3 ).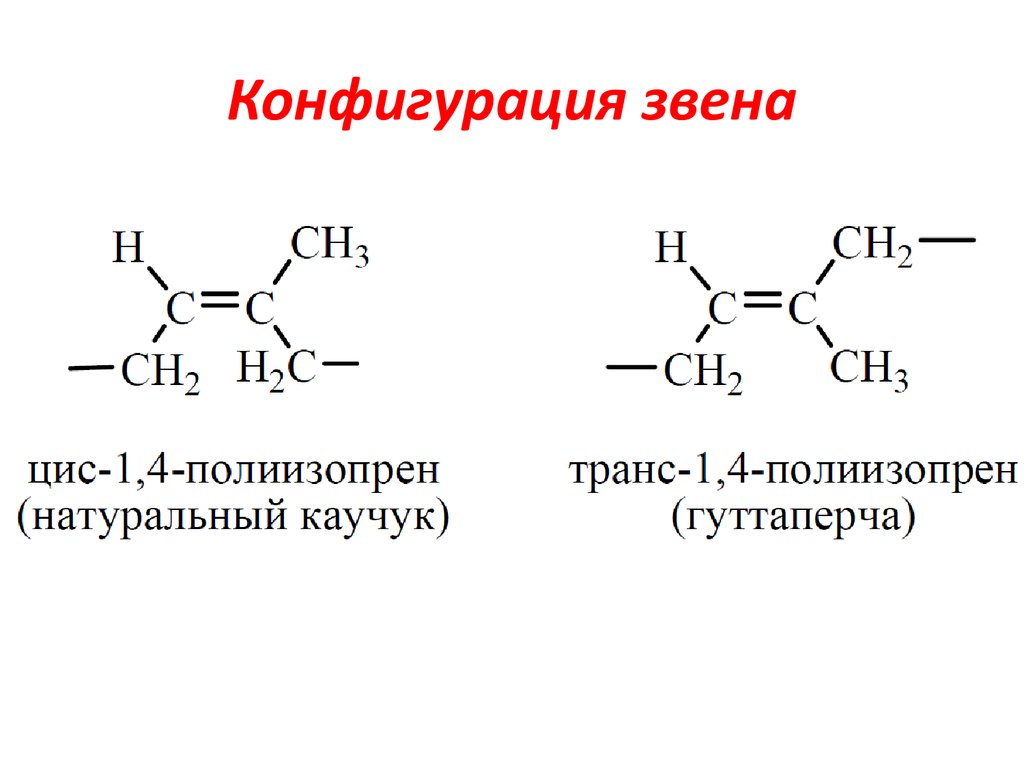
Интересные факты
- В настоящее время известно, что изопрен и другие терпены вступают в реакции, способствующие образованию загрязняющих веществ, таких как озон и оксиды азота в атмосфере.
- Изопрен является ключевым посредником в синтезе холестерина в организме человека.
- Производство изопрена растениями, по-видимому, связано с процессом фотосинтеза и зависит от температуры, солнечного света, других газов и других факторов.
- Полимер изопрена называется полиизопреном. Он существует в двух формах: цис — и транс -полиизопрен. Две формы называются геометрическими изомерами . У них один и тот же вид и количество атомов, но атомы расположены по-разному в этих двух формах. Натуральный каучук состоит из транс -полиизопрен, в то время как другой продукт, содержащийся в каучуковых растениях, гуттаперча, состоит из цис -полиизопрена.
ОБЫЧНОЕ ПРИМЕНЕНИЕ И ПОТЕНЦИАЛЬНАЯ ОПАСНОСТЬ
Натуральный каучук известен людям уже сотни лет. Археологи установили, что индейцы Южной и Центральной Америки изготавливали резиновые изделия еще в XI веке. До конца девятнадцатого века природные запасы каучука получали из каучукового дерева Hevea brasiliensis 9.0147, были достаточными для удовлетворения потребительского спроса на продукт. Однако с развитием современных технологий, особенно с изобретением автомобиля, природных запасов продукта оказалось недостаточно для удовлетворения растущего спроса. Исследователи-химики начали искать способы производства синтетических форм каучука.
Археологи установили, что индейцы Южной и Центральной Америки изготавливали резиновые изделия еще в XI веке. До конца девятнадцатого века природные запасы каучука получали из каучукового дерева Hevea brasiliensis 9.0147, были достаточными для удовлетворения потребительского спроса на продукт. Однако с развитием современных технологий, особенно с изобретением автомобиля, природных запасов продукта оказалось недостаточно для удовлетворения растущего спроса. Исследователи-химики начали искать способы производства синтетических форм каучука.
Один из подходов заключался в попытке получить синтетический каучук с точно таким же химическим составом, как у натурального каучука, то есть полимер транс- -полиизопрена. Еще в 1880-х годах британский химик сэр Уильям Август Тилден (1842–1819 гг.26) удалось достичь этой цели. Тилден обнаружил, что может производить изопрен путем нагревания скипидара (C 10 H 16 ). Затем изопрен легко полимеризовался под воздействием света. Однако после более чем двадцати лет исследований Тилден решил, что синтетический -транс--полиизопрен никогда не будет экономически выгодным, и посоветовал своим друзьям забыть об этом процессе.
Однако после более чем двадцати лет исследований Тилден решил, что синтетический -транс--полиизопрен никогда не будет экономически выгодным, и посоветовал своим друзьям забыть об этом процессе.
За прошедшие годы химики нашли способы производства других видов синтетического каучука, а некоторые никогда не отказывались от попыток сделать синтетический транс -полиизопрен. Критический прорыв, необходимый для этого исследования, произошел примерно в 1953 году, когда швейцарский химик Карл Циглер (1898–1973) и итальянский химик Джулио Натта (1903–1979) каждый из них нашли способ полимеризации изопрена таким образом, чтобы его геометрическая структура соответствовала геометрической структуре природного резина точно. Год спустя химики двух крупнейших каучуковых компаний мира, B. F. Goodrich и Firestone, объявили о том, что они разработали методы получения синтетического транс- — полиизопрен, используя, по существу, методы, разработанные ранее Циглером и Наттой.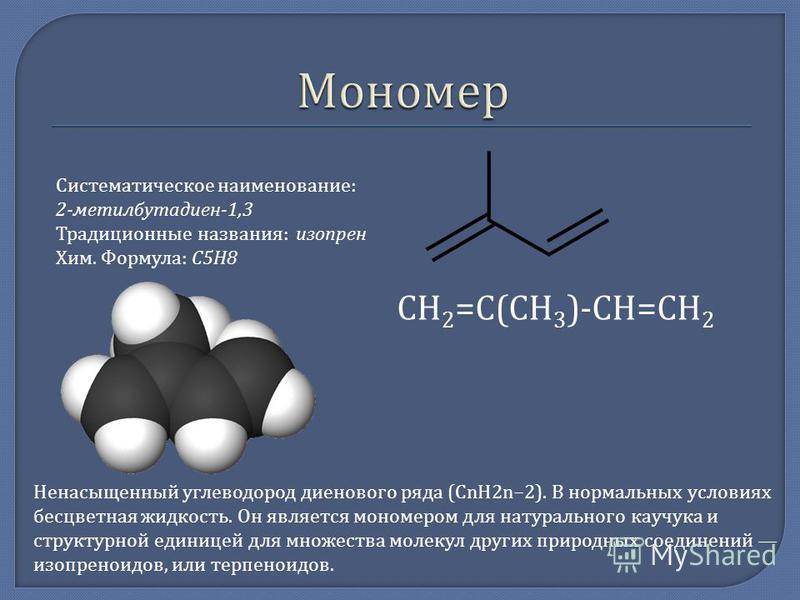
В начале двадцать первого века более 95 процентов произведенного изопрена используется для производства транс -полиизопренового синтетического каучука. Остальные 5 процентов используются для производства других видов синтетического каучука и других видов полимеров. Небольшое количество соединения используется в качестве химического посредника, вещества, из которого производятся другие органические химические вещества.
Изопрен представляет опасность пожара. Это также представляет опасность для здоровья человека и других животных. Это раздражает кожу, глаза и дыхательную систему. При воздействии он вызывает такие симптомы, как покраснение, слезотечение и зуд глаз, а также зуд, покраснение и образование волдырей на коже. При вдыхании может раздражать легкие и дыхательную систему. Изопрен является известным канцерогеном.
Полезные слова
- КАРЦИНОГЕН
- Химическое вещество, вызывающее рак у людей и других животных.
- СМЕШИВАЕМЫЕ
- Можно смешивать; особенно относится к смешиванию одной жидкости с другой.

- ФОТОСИНТЕЗ
- Процесс, при котором зеленые растения и некоторые другие организмы используют энергию солнечного света для преобразования углекислого газа и воды в углеводы и кислород.
- ПОЛИМЕР
- Соединение, состоящее из очень больших молекул, состоящих из одной или двух небольших повторяющихся единиц, называемых мономерами.
- ЛЕТУЧИЙ
- Способен легко превращаться в пар при относительно низкой температуре.
ДЛЯ ДОПОЛНИТЕЛЬНОЙ ИНФОРМАЦИИ
«Информационный бюллетень об опасных веществах: изопрен». Департамент здравоохранения и обслуживания пожилых людей штата Нью-Джерси. http://www.state.nj.us/health/eoh/rtkweb/1069.pdf (по состоянию на 29 декабря 2005 г.).
«Изопрен». Химикаты Шелл. http://www.shellchemicals.com/isoprene/1,1098,1116,00.html (по состоянию на 29 декабря 2005 г.).
«Паспорт безопасности материала: паспорт безопасности изопрена». ScienceLab.com. http://www.



Leave A Comment