Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
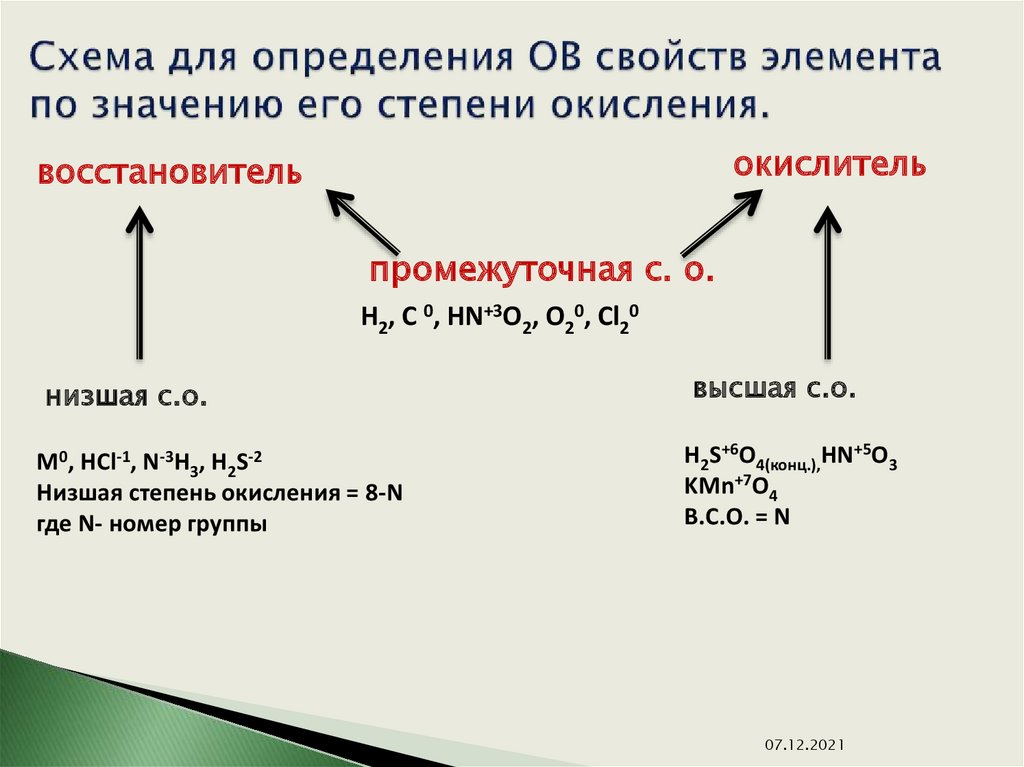
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.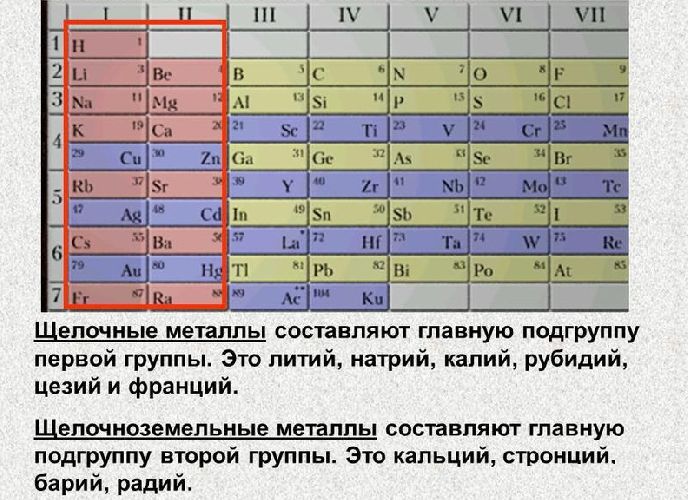
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте info@k-tree.ru
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Степень окисления цинка — Цинковый портал
Степень окисления — это численное значение, которое показывает, сколько электронов потерял или приобрел атом в химической реакции. Вещества, в которых атомы имеют разное количество электронов, имеют разные степени окисления. Степень окисления цинка может быть положительной, отрицательной или нулевой, в зависимости от того, сколько электронов потерял или приобрел атом цинка.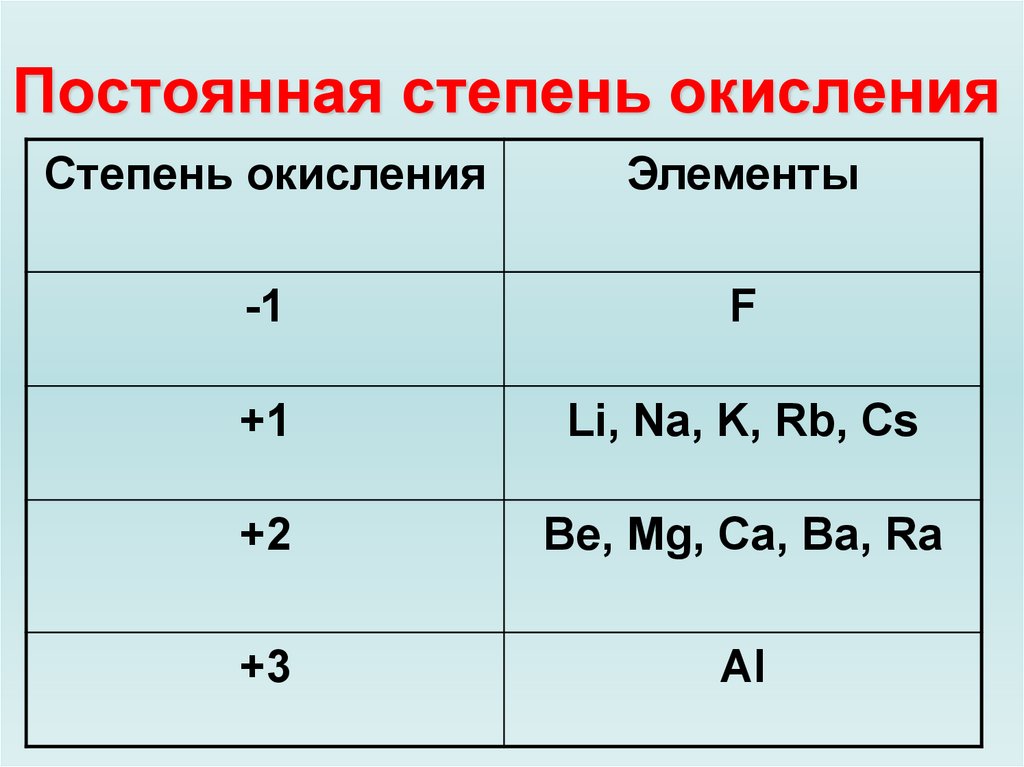
Степень окисления элемента отражает количество присоединенных к нему атомов кислорода, которое может варьироваться от -2 до +4 в зависимости от соединения. Стандартная степень окисления (или состояние) цинка составляет +2, однако, в определенных соединениях, его степень окисления может варьироваться от 0 (сам металлический цинк) до +4.
В сочетании с хлором Zn может образовывать несколько соединений, степень окисления которых варьируется от +1 (ZnCl) до +3 (ZnCl2). В сочетании с азотом его степень окисления может варьироваться от +2 (Zn(NO3)2) до +4 (Zn(NO2)4). Аналогичным образом, при соединении с серой цинк образует два соединения со степенью окисления +2 (ZnS) и +4 (ZnSO4).
Самая высокая степень окисления цинка наблюдается, когда он образует оксид цинка (ZnO). В этом соединении степень окисления цинка составляет +4. Аналогично, в сочетании с серой (ZnS) степень окисления цинка также составляет +4. При взаимодействии с ионами гидроксида (OH-), например, в случае Zn(OH) 2, цинк также достигает степени окисления +4.
Некоторые комплексы могут содержать смешанные валентные состояния, которые содержат как более низкие, так и более высокие степени окисления элемента, чем обычно; они обычно обозначаются как гибридизации. Комплексы, содержащие как Zn (II), так и Zn (IV), известны как цинковые амальгамы и встречаются в нескольких химических применениях, включая лекарства и промышленные катализаторы.
Цинк также может окисляться непосредственно под воздействием воздуха или других кислородсодержащих сред, таких как вода. Полученный оксид обычно имеет степень окисления либо 0 (металлический цинк), либо 2 + (оксид цинка), в зависимости от условий. При воздействии влаги с течением времени цинк образует на своей поверхности тонкий слой гидратированного оксида, который содержит различное количество ионов 0 и 2 +.
Некоторые цинксодержащие соли содержат соединения с более высокой степенью окисления, такие как Zn (h3O) 63 + или даже Zn (h3O) 64 +. Это относительно редкие случаи, хотя и не считаются частью стандартных «степеней окисления», которые обычно обсуждаются, когда речь идет о цинке.
В соединениях, где цинк соединен с более электроотрицательными элементами, такими как кислород, сера или хлор, степень окисления цинка может быть положительной. В оксиде цинка (ZnO) степень окисления цинка равна +2, а в хлориде цинка (ZnCl2) степень окисления равна +2 для каждого атома цинка.
В других соединениях, где цинк соединен с менее электроотрицательными элементами, такими как водород или кислород в воде, степень окисления цинка может быть нулевой. В гидроксиде (Zn(OH)2) степень окисления цинка равна 0.
В соединениях, где цинк соединен с более электроотрицательными элементами, но обладает отрицательным зарядом, степень окисления цинка может быть отрицательной. В сульфиде цинка (ZnS) степень окисления цинка равна -2.
Степень окисления цинка может меняться в зависимости от условий, в которых происходит реакция, и может варьировать от -2 до +2.
Хотя стандартная степень окисления цинка составляет +2, он демонстрирует различные степени окисления, когда присутствует в различных соединениях с другими элементами (Cl, N и S). Такая универсальность делает цинк идеальным материалом для использования во многих областях, где изменение его степени окисления может оказаться выгодным.
Такая универсальность делает цинк идеальным материалом для использования во многих областях, где изменение его степени окисления может оказаться выгодным.
Содержание
Соединения цинка с положительной степенью окисления
Цинк может иметь положительную степень окисления в различных соединениях, таких как оксид цинка, карбонат цинка, нитрат цинка и других. Эти соединения имеют различные химические свойства, включая свойства окислителя, противоположные свойствам соединений цинка с отрицательной степенью окисления.
Соединения цинка с положительной степенью окисления образуются, когда цинк теряет электроны в химической реакции и становится положительно заряженным. Наиболее распространенными степенями окисления цинка являются +1 и +2.
Соединения цинка с +1 степенью окисления включают хлорид цинка(І) — ZnCl, и гидроксид цинка(І) — Zn(OH)₂. Хлорид цинка(І) может быть получен в результате реакции металлического цинка с хлоридом водорода:
Zn + 2 HCl → ZnCl + H₂
Гидроксид цинка(І) может быть получен путем обработки раствора хлорида цинка(І) гидроксидом натрия:
ZnCl + 2 NaOH → Zn (OH)₂ + 2 NaCl
Соединения цинка с +2 степенью окисления включают оксид цинка, ZnO, сульфат цинка, ZnSO₄, и нитрат цинка, Zn(NO₃)₂. Оксид цинка может быть получен путем нагревания цинка в присутствии кислорода:
Оксид цинка может быть получен путем нагревания цинка в присутствии кислорода:
2 Zn + O₂ → 2 ZnO
Сульфат цинка может быть получен реакцией цинка с серной кислотой:
Zn + H₂SO₄ → ZnSO₄ + H₂
Нитрат цинка может быть получен реакцией цинка с азотной кислотой:
Zn + 2 HNO₃ → Zn(NO₃)₂ + H₂
Соединения цинка с положительной степенью окисления имеют широкое применение в промышленности и быту. Оксид цинка используется в производстве каучука, лакокрасочных материалов, косметики, и как добавка в пищевых продуктах. Сульфат цинка используется в качестве удобрения, а также в производстве батарей и красителей. Нитрат цинка используется в производстве древесных защитных средств и пиротехники.
Соединения цинка с «-» степенью
Это соединения, в которых цинк присутствует в виде иона или атома, имеющих больше электронов, чем в нейтральном состоянии. Обычно это соединения, в которых цинк соединяется с более электроотрицательными элементами, такими как хлор, сера и кислород.
Одним из наиболее распространенных соединений цинка с отрицательной степенью окисления является хлорид цинка (ZnCl2). Это белый кристаллический порошок, который хорошо растворяется в воде и обладает хорошей электропроводностью. Хлорид цинка является сильным электролитом и используется в различных процессах — гальваническое цинкование, производство смол и красок, а также в качестве катализатора в химических реакциях.
Сульфид цинка (ZnS) — соединение цинка с отрицательной степенью окисления. Это желтый кристаллический порошок, который слабо растворяется в воде. Сульфид цинка используется в производстве лаков, пигментов, стекла и других продуктов.
Гидроксид цинка (Zn(OH)2) — это белый порошок, который хорошо растворяется в кислотах и слабых щелочах. Гидроксид цинка используется в производстве каучука, лаков, красок и других продуктов.
Соединения цинка с отрицательной степенью окисления относятся к группе ZnX2, где X — анион. Такие соединения имеют формулу ZnX2, где X может быть хлоридом (Cl), бромидом (Br), иодидом (I), сульфатом (SO4) и т.
Рассмотрим несколько реакций с участием соединений цинка с отрицательной степенью окисления:
- Реакция с хлоридом натрия (NaCl): ZnCl2 + 2NaCl → ZnCl4Na2
- Реакция с гидроксидом натрия (NaOH): ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
- Реакция с серной кислотой (h3SO4): ZnCl2 + h3SO4 → ZnSO4 + 2HCl
- Реакция с аммиаком (Nh4): ZnCl2 + 2Nh4 → Zn(Nh4)2Cl2
Свойства соединений цинка с отрицательной степенью окисления значительно отличаются от химических характеристик соединений с положительной степенью окисления. Они обычно являются более реактивными, чем соединения с положительной степенью окисления, и могут обладать свойствами восстановителя. Кроме того, они могут использоваться в качестве катализаторов в химических реакциях.
Соединения цинка с отрицательной степенью окисления используются в различных областях промышленности и быта. Хлорид цинка (ZnCl2) используется в качестве катализатора в производстве этилена, а также как дезодорирующее средство для обработки сточных вод.
Степени окисления цинка в биологии
Цинк играет важную роль в биологических системах и является необходимым микроэлементом для жизнедеятельности многих организмов. Он участвует во многих биохимических процессах, таких как синтез белков, гормонов, ферментов и нуклеиновых кислот. Кроме того, цинк влияет на функционирование иммунной системы и роста клеток.
Степени окисления цинка в биологических системах обычно равны +2. Эта степень окисления обеспечивает цинку возможность связываться с различными биологическими молекулами, включая белки, ферменты и ДНК. Степени окисления цинка могут изменяться в зависимости от конкретного биологического процесса или функции. В некоторых белках цинк может иметь степень окисления +1. Это позволяет ему связываться с карбоксилатными группами в белковой структуре и играть важную роль в каталитических реакциях. Цинк может иметь степени окисления +3 и +4 в некоторых комплексах с другими металлами, такими как железо и медь.
Степени окисления цинка влияют на его биологическую активность и связывание с другими молекулами. В белковых структурах цинк с +2 степенью окисления может связываться с аминокислотами, содержащими кислород и нитроген, а также с гидроксильными группами, образуя ковалентные связи. Это позволяет цинку выполнять различные функции в биологических процессах, таких как каталитические реакции и стабилизация белковой структуры.
Изменяющейся степени окисления цинк играет важную роль во многих химических процессах и применениях, таких как медицина и промышленность. Возможные степени окисления варьируются от + 1 до + 4, при этом наиболее распространенным состоянием является + 2; однако более высокие степени могут быть достигнуты в зависимости от того, с какими другими элементами он связывается, образуя сложную молекулу или соединение.
Степень окисления цинка является важным показателем его химической активности и может варьироваться в зависимости от соединения, в котором он находится. Понимание степени окисления цинка позволяет лучше понять его реакционную способность и использовать его в различных химических процессах.
Понимание степени окисления цинка позволяет лучше понять его реакционную способность и использовать его в различных химических процессах.
Цинк | Свойства, использование и факты
цинк
Посмотреть все СМИ
- Ключевые люди:
- Андреас Сигизмунд Маргграф Негиши Эй-ити Георг Брандт
- Похожие темы:
- химический элемент переработка цинка нейзильбер Месторождение типа долины Миссисипи дефицит цинка
Просмотреть весь связанный контент →
цинк (Zn) , химический элемент, легкоплавкий металл группы 12 (IIb, или группа цинка) периодической таблицы, который необходим для жизни и является одним из наиболее широко используемых металлов. Цинк имеет большое коммерческое значение.
| atomic number | 30 |
|---|---|
| atomic weight | 65. 39 39 |
| melting point | 420 °C (788 °F) |
| boiling point | 907 °C (1,665 °F) |
| density | 7.133 grams/cm 3 at 25 °C (68 °F) |
| oxidation state | |
| электронная конфигурация | [Ar]3 d 10 4 s 2 |
Цинк, немного более распространенный, чем медь, составляет в среднем 65 граммов (2,3 унции) на каждую тонну земной коры. Главный минерал цинка — сульфидный сфалерит (цинковая обманка), который вместе с продуктами его окисления смитсонитом и гемиморфитом составляет почти всю мировую цинковую руду. Сообщается о самородном цинке из Австралии, Новой Зеландии и США, а ведущими производителями цинка в начале 21 века являются Китай, Австралия и Перу. По минералогическим свойствам цинка см.
Цинк является важным микроэлементом в организме человека, где он содержится в высоких концентрациях в красных кровяных тельцах как неотъемлемая часть фермента карбоангидразы, который способствует многим реакциям, связанным с метаболизмом углекислого газа. Цинк, присутствующий в поджелудочной железе, может способствовать хранению инсулина. Цинк входит в состав некоторых ферментов, расщепляющих белок в желудочно-кишечном тракте. Дефицит цинка у орехоплодных и плодовых деревьев вызывает такие заболевания, как розетка пекана, мелколистность и крапчатость листьев. Цинк функционирует в гемосикотипсине крови улиток, перенося кислород аналогично железу в гемоглобине крови человека.
Металлический цинк получают путем обжига сульфидных руд с последующим либо выщелачиванием окисленного продукта в серной кислоте, либо плавкой в доменной печи. Цинк выделяют из выщелачивающего раствора электролизом или конденсируют из доменного газа, а затем отгоняют от примесей. Для получения конкретной информации о добыче, извлечении и очистке цинка, см. обработка цинка.
Для получения конкретной информации о добыче, извлечении и очистке цинка, см. обработка цинка.
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Металлический цинк в основном используется для гальванического покрытия железа и стали от коррозии, а также для изготовления латуни и сплавов для литья под давлением. Сам цинк образует непроницаемое покрытие из своего оксида при воздействии атмосферы, и, следовательно, металл более устойчив к обычным атмосферам, чем железо, и подвергается коррозии с гораздо меньшей скоростью. Кроме того, поскольку цинк имеет тенденцию окисляться в большей степени, чем железо, поверхность стали получает некоторую защиту, даже если часть ее обнажена через трещины. Цинковое покрытие формируется либо горячим цинкованием, либо гальванопокрытием.
Горячее цинкование является наиболее распространенной процедурой покрытия стали цинком. Это может быть периодический процесс, известный как общее цинкование, или непрерывное покрытие рулонов стальной полосы. При обычном цинковании сталь травят в кислоте, обрабатывают флюсами, а затем погружают в ванну с расплавленным цинком при температуре около 450 ° C (840 ° F). На поверхности формируются слои железо-цинкового сплава, которые покрываются внешним слоем цинка. Обрабатываемые таким образом объекты варьируются от небольших гаек и болтов до стальных оконных рам и больших балок, используемых в строительстве. В этом процессе обычно используется обычный сорт цинка, содержащий до 1,5% свинца.
При обычном цинковании сталь травят в кислоте, обрабатывают флюсами, а затем погружают в ванну с расплавленным цинком при температуре около 450 ° C (840 ° F). На поверхности формируются слои железо-цинкового сплава, которые покрываются внешним слоем цинка. Обрабатываемые таким образом объекты варьируются от небольших гаек и болтов до стальных оконных рам и больших балок, используемых в строительстве. В этом процессе обычно используется обычный сорт цинка, содержащий до 1,5% свинца.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
При гальваническом цинковании цинк наносится на стальную ленту в 20 последовательных ячейках электролитического покрытия. Есть несколько успешных конструкций ячеек; простая вертикальная ячейка обсуждается здесь, чтобы объяснить принцип. Полоса, подключенная к минусовой стороне постоянного тока через токопроводящие валки большого диаметра, расположенные над и между двумя ячейками, погружным опускающим валиком погружается в бак с электролитом. Частично погруженные аноды, расположенные напротив полосы, соединены с положительной стороной электрического тока толстыми шинами. Катионы цинка (т. е. положительно заряженные атомы цинка), присутствующие в электролите, под действием тока превращаются в обычные атомы цинка, которые осаждаются на полосе. Ванна снабжается катионами цинка либо с помощью цинковых анодов, которые непрерывно растворяются постоянным током, либо с помощью соединений цинка, непрерывно добавляемых в электролит. В последнем случае аноды изготовлены из нерастворимых материалов, таких как титан, покрытый оксидом иридия. Электролит представляет собой кислый раствор сульфида или хлорида цинка с другими добавками в ванну для улучшения качества покрытия и выхода по току. Толщину покрытия легче контролировать, чем в процессе горячего погружения, из-за хорошей зависимости между электрическим током и нанесенным цинком.
Частично погруженные аноды, расположенные напротив полосы, соединены с положительной стороной электрического тока толстыми шинами. Катионы цинка (т. е. положительно заряженные атомы цинка), присутствующие в электролите, под действием тока превращаются в обычные атомы цинка, которые осаждаются на полосе. Ванна снабжается катионами цинка либо с помощью цинковых анодов, которые непрерывно растворяются постоянным током, либо с помощью соединений цинка, непрерывно добавляемых в электролит. В последнем случае аноды изготовлены из нерастворимых материалов, таких как титан, покрытый оксидом иридия. Электролит представляет собой кислый раствор сульфида или хлорида цинка с другими добавками в ванну для улучшения качества покрытия и выхода по току. Толщину покрытия легче контролировать, чем в процессе горячего погружения, из-за хорошей зависимости между электрическим током и нанесенным цинком.
Отрицательный электрод (внешняя банка) в одном из распространенных типов электрических сухих элементов состоит из цинка. Другой важный ряд сплавов — сплавы, образованные добавлением 4—5% алюминия к цинку; они имеют относительно низкую температуру плавления, но обладают хорошими механическими свойствами и могут отливаться под давлением в стальных кокилях. Значительные количества цинка в прокатном виде используются для кровли, особенно в Европе; небольшие добавки меди и титана улучшают сопротивление ползучести, т. е. устойчивость к постепенной деформации.
Другой важный ряд сплавов — сплавы, образованные добавлением 4—5% алюминия к цинку; они имеют относительно низкую температуру плавления, но обладают хорошими механическими свойствами и могут отливаться под давлением в стальных кокилях. Значительные количества цинка в прокатном виде используются для кровли, особенно в Европе; небольшие добавки меди и титана улучшают сопротивление ползучести, т. е. устойчивость к постепенной деформации.
Свежеотлитый цинк имеет голубовато-серебристую поверхность, но медленно окисляется на воздухе с образованием сероватой защитной оксидной пленки. Высокочистый цинк (99,99%) пластичен; так называемый первоклассный западный сорт (чистота 99,8 процента) является хрупким в холодном состоянии, но при температуре выше 100 ° C (212 ° F) его можно свернуть в листы, которые остаются гибкими. Цинк кристаллизуется в гексагональной плотноупакованной структуре. Когда железо и цинк вместе подвергаются воздействию коррозионной среды, они образуют электролитическую ячейку, и цинк подвергается атаке (окисляется до Zn 9). 0057 2 + ион) преимущественно из-за более высокого электродного потенциала. Эта так называемая жертвенная защита в сочетании с гораздо большей коррозионной стойкостью цинка в атмосферных условиях является основой для цинкования.
0057 2 + ион) преимущественно из-за более высокого электродного потенциала. Эта так называемая жертвенная защита в сочетании с гораздо большей коррозионной стойкостью цинка в атмосферных условиях является основой для цинкования.
Природный цинк представляет собой смесь пяти стабильных изотопов: 6 4 Zn (48,6%), 6 6 Zn (27,9%), 6 7 Zn (4,6%), 8 Zn (4,6%). 8 Zn (18,8%) и 7 0 Zn (0,6%).
Периодическая таблица WebElements » Цинк » оксид цинка
- Формула: ZnO
- Формула системы Хилла: O 1 Zn 1
- Регистрационный номер CAS: [1314-13-2]
- Вес формулы: 81.389
- Класс: оксид
- Цвет: белый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 2248°C; 1975°С
- Точка кипения: возгонов при 1800
- Плотность: 5600 кг·м -3
Ниже приведены некоторые синонимы оксида цинка :
- оксид цинка
- оксид цинка(II)
Степень окисления цинка в оксиде цинка составляет 2 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия из цинка:
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для ZnO (оксид цинка).
| Элемент | % |
|---|---|
| О | 19,66 |
| Цинк | 80,34 |
Изотопная схема ZnO
На приведенной ниже диаграмме показана рассчитанная изотопная картина для формулы ZnO с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.
 Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997. - Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Wyckoff, in Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (редактор) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996 г.


 Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
Leave A Comment