Азот, соединения азота
Азот, соединения азота
Азот – элемент V A группы главной подгруппы, значит, на внешнем энергетическом уровне у него 5 электронов. До завершения внешнего уровня ему не хватает 3 электрона, которые он может присоединить, в этом случае степень окисления его будет равна -3. Кроме этого, атом азота может и отдавать электроны и приобретать положительные степени окисления. Таким образом, для атома азота в соединениях возможны степени окисления от -3 до +5.
Рассмотрим соединения азота.
Например,
в аммиаке – NH3
– степень окисления азота -3; в оксиде азота (I) – N2O
– степень окисления азота +1; в оксиде азота (II) – NO
– степень окисления азота +2; в азотистой кислоте – HNO2
– степень окисления азота +3; в оксиде азота (IV) – NO2
– степень окисления азота +4; в азотной кислоте – HNO3
– степень окисления азота +5.
Таким образом, если степень окисления азота -3, то он проявляет восстановительные свойства, если степень окисления +5, то азот проявляет окислительные свойства, а если у азота в соединении промежуточные степени окисления: +1, +2, +3, +4, то он может проявлять и окислительные, и восстановительные свойства.
Азот входит в состав воздуха, где его объёмная доля составляет 78%, он входит в состав земной коры и живых организмов. В космосе азот занимает по распространённости четвёртое место, вслед за водородом, гелием и кислородом.
Азот
входит и в состав чилийской селитры – NaNO
Азот
входит в состав всех белков, а белок просто необходим
для жизни. Человек получает белок из растительной и животной пищи, а животные получают
белок, в основном, из растений. А сами растения являются источником пополнения
азота. Поэтому в природе постоянно происходит круговорот азота.
Человек получает белок из растительной и животной пищи, а животные получают
белок, в основном, из растений. А сами растения являются источником пополнения
азота. Поэтому в природе постоянно происходит круговорот азота.
Так как азот входит в состав органических соединений, то он недоступен для растений. Но, в результате жизнедеятельности определённой группы бактэрий, органические соединения превращаются в неорганические – минеральные – это соли аммония и нитраты. И уже эти неорганические вещества усваиваются растениями. Затем растениями, которые усвоили азот, питаются животные и из растений получают необходимый белок.
Большую роль в фиксации азота играют клубеньковые бактерии, которые живут в клубеньках бобовых растений (клевера, гороха, люпина). Они усваивают атмосферный азот и превращают его в соединения, которые доступные растениям.
Кроме этого, соединения азота в почве пополняются за счёт грозовых ливней
 Сначала из азота и кислорода образуется оксид азота (II), который под действием
кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой
в присутствии кислорода воздуха и получается азотная кислота. Кислота
затем вступает во взаимодействие с соединениями натрия, кальция и калия,
которые находятся в почве, и образует соли – селитры, которые нужны для питания
растений.
Сначала из азота и кислорода образуется оксид азота (II), который под действием
кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой
в присутствии кислорода воздуха и получается азотная кислота. Кислота
затем вступает во взаимодействие с соединениями натрия, кальция и калия,
которые находятся в почве, и образует соли – селитры, которые нужны для питания
растений.Простое вещество азот состоит из двухатомных молекул – N2. В молекуле азота атомы связаны между собой
Азот
является бесцветным газом, не имеет запаха и вкуса, немного легче воздуха.
Не сжижается при обычной температуре, плохо растворим в воде, его температура
плавления -210 0C,
а температура кипения -196 0C.
В лаборатории азот получают разложением нитрита аммония при слабом нагревании.
Азот относительно инертен в химических реакциях
При обычных условиях азот реагирует только с литием. При этом образуется нитрид лития.
Литий повышает свою степень окисления с 0 до +1, а азот понижает с 0 до -3. Каждый атом алюминия отдает по 6 электронов молекуле азота, при этом литий является восстановителем, а азот окислителем.
С другими металлами азот реагирует только при высоких температурах.
Например, в реакции с магнием образуется нитрид магния. Магний изменяет свою степень окисления с 0 до +2, а азот понижает с 0 до -3. Каждый атом магния отдаёт по 3 электрона молекуле азота. Магний в реакции является восстановителем, а азот – окислителем.
При
высоких температуре, давлении и в присутствии катализатора
азот реагирует с водородом, образуя при этом аммиак. В этой реакции азот
понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот
является окислителем, а водород восстановителем.
В этой реакции азот
понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот
является окислителем, а водород восстановителем.
Как видите, это реакция соединения, так как из двух простых веществ образуется одно сложное, реакция экзотермическая, так как протекает с выделением теплоты, обратимая, то есть идёт как в прямом, так и в обратном направлении,
При высокой температуре азот соединяется с кислородом, образуя оксид азота два.
В
этой реакции азот повышает свою степень окисления с 0 до +2, а кислород
понижает с 0 до -2.
Так как эта реакция идёт с изменением степеней окисления, то она является окислительно-восстановительной, это реакция соединения, потому что из двух простых веществ образуется одно сложное. Реакция обратимая, идёт в прямом и обратном направлении, эндотермическая, так как теплота поглощается, реакция некаталитическая, потому что не требует участия катализатора, является гомогенной, так как все вещества находятся в газообразном состоянии.
Следует отметить, что в реакциях с металлами и водородом азот проявляет окислительные свойства, а в реакциях с кислородом – восстановительные
Основная
область применения азота – производство аммиака и азотной кислоты. Азот
применяют также для создания инертной среды при сушке взрывчатых веществ, при
хранении ценных произведений живописи и рукописей. Азотом раньше
наполняли электрические лампы. Жидкий азот используют в охладительных системах.
Жидкий азот используют в охладительных системах.
В медицине чистый азот применяют в качестве инертной среды при лечении туберкулёза лёгких, а жидкий азот – при лечении заболеваний позвоночника и суставов.
В 1772 году английский учёный Резерфорд и шведский исследователь Шееле в экспериментах по сжиганию веществ обнаружили газ, не поддерживающий дыхание и горение. Позднее, в 1787 году, Лавуазье установил наличие в воздухе газа, не поддерживающего дыхания и горения. Он дал название этому газу «азот», означающее «безжизненный» (от латинского а – нет и зоэ – жизнь). В 1790 году Шапталь дал азоту другое название – нитрогениум – означающее «рождающий селитру».
Решим задачу. Определим массу соединения, которое образуется при нагревании металлического магния массой 7,2 г в азоте объёмом 10 л при нормальных условиях.
В
условии задачи нам дана масса магния и объём азота. Найти необходимо массу
образовавшегося соединения, то есть массу нитрида магния. Найдём количество
вещества магния, для этого необходимо массу магния разделить на его молярную
массу. То есть 7,2 г разделим на 24 г/моль, получим 0,3 моль, теперь найдём
количество вещества азота, для этого нужно объём азота разделить на молярный
объём. Для этого разделим 10 л на 22,4 л/моль, получается 0,446 моль. По
уравнению реакции видно, что соотношение моль магния и азота составляет 3 :
1. Следовательно, количество вещества азота должно быть в три раза меньше
количества вещества магния, то есть 0,1 моль. В результате вычислений мы
получили количество вещества азота, равное 0,446 моль. Поэтому азот находится в
избытке, и количество вещества нитрида магния находим по магнию.
Найти необходимо массу
образовавшегося соединения, то есть массу нитрида магния. Найдём количество
вещества магния, для этого необходимо массу магния разделить на его молярную
массу. То есть 7,2 г разделим на 24 г/моль, получим 0,3 моль, теперь найдём
количество вещества азота, для этого нужно объём азота разделить на молярный
объём. Для этого разделим 10 л на 22,4 л/моль, получается 0,446 моль. По
уравнению реакции видно, что соотношение моль магния и азота составляет 3 :
1. Следовательно, количество вещества азота должно быть в три раза меньше
количества вещества магния, то есть 0,1 моль. В результате вычислений мы
получили количество вещества азота, равное 0,446 моль. Поэтому азот находится в
избытке, и количество вещества нитрида магния находим по магнию.
Получается,
что количество вещества нитрида магния будет 0,1 моль, то есть 0,3 умножим на 1
и разделим на 3 и получится 0,1 моль. Найдём молярную массу нитрида магния. Для
этого относительную атомную массу магния (24) умножим на 3 и прибавим
относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль.
Найдём массу этого вещества. Для этого следует количество вещества умножить на
молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Для
этого относительную атомную массу магния (24) умножим на 3 и прибавим
относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль.
Найдём массу этого вещества. Для этого следует количество вещества умножить на
молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Таким образом масса нитрида магния будет равна десять г.
Химия — 9
в воде, не образуют ионов Н+. Соединения типа RH3 (в особенности NH3), напротив, в воде присоединяют ионы Н+, проявляя тем самым основные свойства.
Таблица 22.1. Некоторые характеристики азота и фосфора
| Элемент | Валентные электроны |
Относительная электроотрицательность |
Степень окисления ( в соединениях) |
| 2s22p3 | 3,0 | –3, +1, +2, +3, +4, +5 | |
| 3s23p3 | 2,1 | –3, +3, +5 |
В подгруппе сверху вниз (от азота до висмута) стабильность соединений
RH3уменьшается, а восстановительные свойства их возрастают.
Элементы подгруппы азота с кислородом образуют оксиды состава R2O3 и R2O5. В соответствии с этими оксидами фосфор образует кислоты состава H3PO3 и H3PO4 и др., а азот – состава HNO2 и HNO3.
В указанных кислотах, с ростом степени окисления элемента R, сила кислоты возрастает. Например, азотная кислота HNO3 сильнее азотистой HNO2.
В подгруппе, с ростом порядкового номера элемента R, кислотные свойства кислородсодержащих кислот ослабевают. Например,
Aзот и его оксиды
Открытие. Aзот впервые был открыт в 1772 году (Д.Резерфорд, Англия).
Степень окисления азота в соединениях изменяется от –3 до +5.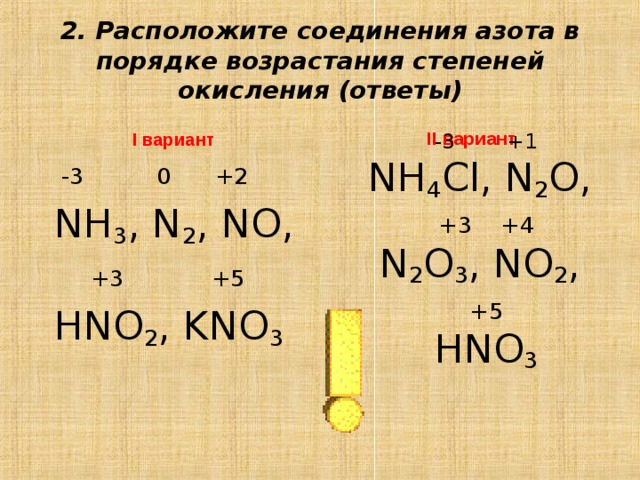
Положение в Периодической системе и строение атома (см. стр. 89).
Шкатулка знаний • Из-за отсутствия d-подуровня на внешнем уровне атома, азот не проявляет валентность, равную V. Степень окисления азота в соединениях с менее электроотрицательными элементами равна –3 (NH3, Ca3N2 и др.), а в соединениях с кислородом изменяется от +5 до +1 (N2O5, NO2, N2O и др.).
Нахождение в природе. В природе азот встречается в свободном и связанном состоянии. Азот (N2) составляет 78% объема воздуха. В малых количествах в виде нитратов (чилийская селитра NaNO3, индийская селитра KNO3,
норвежская селитра Ca(NO3)2) азот распространен в верхних слоях Земной
коры. Он также входит в состав белков и многих природных органических
соединений.
Он также входит в состав белков и многих природных органических
соединений.
Получение. В лаборатории азот можно получать термическим разложеним нитрита и дихромата аммония, а также восстановлением оксида меди(II) аммиаком:
В промышленности азот получают фракционной дистилляцией жидкого воздуха.
Вопрос Видео: Расчет изменения степени окисления азота при окислении графита
Стенограмма видео
Азотная кислота является сильным окислителем и даже реагирует с элементарным углеродом в виде аллотропного графита. Реакция показана ниже. Три C графита плюс четыре HNO3 дают три CO2 плюс четыре NO плюс два H3O. На какую величину изменится степень окисления азота в этой реакции?
Это вопрос о степени окисления. Степень окисления указывает на степень окисления атома, которая обычно соответствует количеству потерянных электронов. В качестве простого примера мы можем посмотреть на молекулу воды в уравнении. Атом кислорода имеет степень окисления минус два, потому что он частично получил два электрона. Мы по-прежнему считаем частично потерянные или полученные электроны при определении степени окисления. Между тем каждый атом водорода в этой молекуле имеет степень окисления плюс один, потому что каждый из них частично потерял один электрон. Обратите внимание, что положительная степень окисления означает, что электроны были потеряны, а отрицательная степень окисления означает, что электроны были получены.
В качестве простого примера мы можем посмотреть на молекулу воды в уравнении. Атом кислорода имеет степень окисления минус два, потому что он частично получил два электрона. Мы по-прежнему считаем частично потерянные или полученные электроны при определении степени окисления. Между тем каждый атом водорода в этой молекуле имеет степень окисления плюс один, потому что каждый из них частично потерял один электрон. Обратите внимание, что положительная степень окисления означает, что электроны были потеряны, а отрицательная степень окисления означает, что электроны были получены.
Чтобы ответить на этот вопрос, нам нужно определить степень окисления, или, другими словами, степень окисления азота в HNO3 и NO. К счастью, есть некоторые правила, которым мы можем следовать, чтобы помочь нам на этом пути.
Первое правило состоит в том, что нейтральные соединения имеют общую степень окисления, равную нулю. Например, в нашей молекуле воды объединение двух плюс один степеней окисления атомов водорода с минус два степени окисления атома кислорода дает нам ноль. Далее, степень окисления иона равна его заряду. Наконец, степень окисления кислорода минус два, за исключением особых случаев, таких как пероксиды или соединения со фтором.
Далее, степень окисления иона равна его заряду. Наконец, степень окисления кислорода минус два, за исключением особых случаев, таких как пероксиды или соединения со фтором.
Давайте применим эти правила для определения степени окисления азота в этих двух соединениях. Напоминаем, что фразы «степень окисления» и «степень окисления» взаимозаменяемы. Начнем с азотной кислоты. Ион нитрата имеет заряд минус один, поэтому он также должен иметь степень окисления минус один. Это не особый случай. Таким образом, каждый атом кислорода имеет степень окисления минус два. В этом ионе есть три атома кислорода, каждый со степенью окисления минус два. Когда мы объединяем их с неизвестной степенью окисления атома азота, мы должны получить минус один, заряд и, следовательно, степень окисления нитрат-иона.
Степень окисления азота в этом соединении плюс пять. Степени окисления азота и кислорода объединяются, чтобы дать иону общую степень окисления минус один. В сочетании с плюсом от атома водорода это нейтральное соединение имеет общую степень окисления, равную нулю. Но больше всего нас интересует степень окисления азота плюс пять. Так что это число, которое мы будем держать, когда мы перейдем ко второму соединению.
Но больше всего нас интересует степень окисления азота плюс пять. Так что это число, которое мы будем держать, когда мы перейдем ко второму соединению.
Второй состав немного проще. Это не особый случай для кислорода, поэтому его степень окисления минус два. Это нейтральное соединение, поэтому применяется первое правило. Его совокупная степень окисления должна быть равна нулю. Степень окисления плюс два делает свое дело. Две степени окисления в сумме дают ноль. Итак, мы получили наше второе ключевое число. Степень окисления азота в продукте этой реакции плюс два. Поскольку он связан с разными атомами, степень окисления азота меняется от начала к концу реакции от плюс пяти до плюс двух. Можно сказать, что степень окисления изменяется на значение минус три; он уменьшается на три. Это правильный ответ.
Поскольку степень окисления является общим показателем количества потерянных электронов, изменение степени окисления на минус три означает, что три электрона присоединились к азоту с начала реакции до конца реакции. На сколько же изменяется степень окисления азота в ходе этой реакции? Оно меняется на минус три.
На сколько же изменяется степень окисления азота в ходе этой реакции? Оно меняется на минус три.
Азот может иметь несколько различных степеней окисления в диапазоне …
Последние каналы
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Клеточная биология
Математика
- Колледжская алгебра
- Тригонометрия
- Предварительное исчисление
Физика
- Физика
Business
- Микроэкономика
- Macroeconomics
- Financial Accounting
Social Sciers

Общая химия6. Химические количества и водные реакцииРасчет степеней окисления
3:25
минуты
Задача 112b
Вопрос из учебника
Проверенное решение
Наши преподаватели рекомендовали это видео-решение как полезное для описанной выше проблемы.
201просмотр
Было ли это полезно?
Смотреть дальше
Master Рассчитать числа окисления с небольшим видео-объяснением от Жюля Бруно
Начать обучение
Похожие видео0005
176views
Как рассчитать число окисления или степень окисления? Easy Trick
Najam Academy
280 просмотров
Вычисление числа окисления
Не думайте слишком много! с Praxis Academic
141 просмотров
Расчет чисел окисления
Jules Bruno
357 просмотров
Как рассчитать степень окисления переходных металлов в координационных соединениях
Полное руководство по всему0005115Views
Как вычислять номера окисления — Базовое введение — DR K
CHEMESIMPLIED
104Views
.

Leave A Comment