Азот, подготовка к ЕГЭ по химии
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
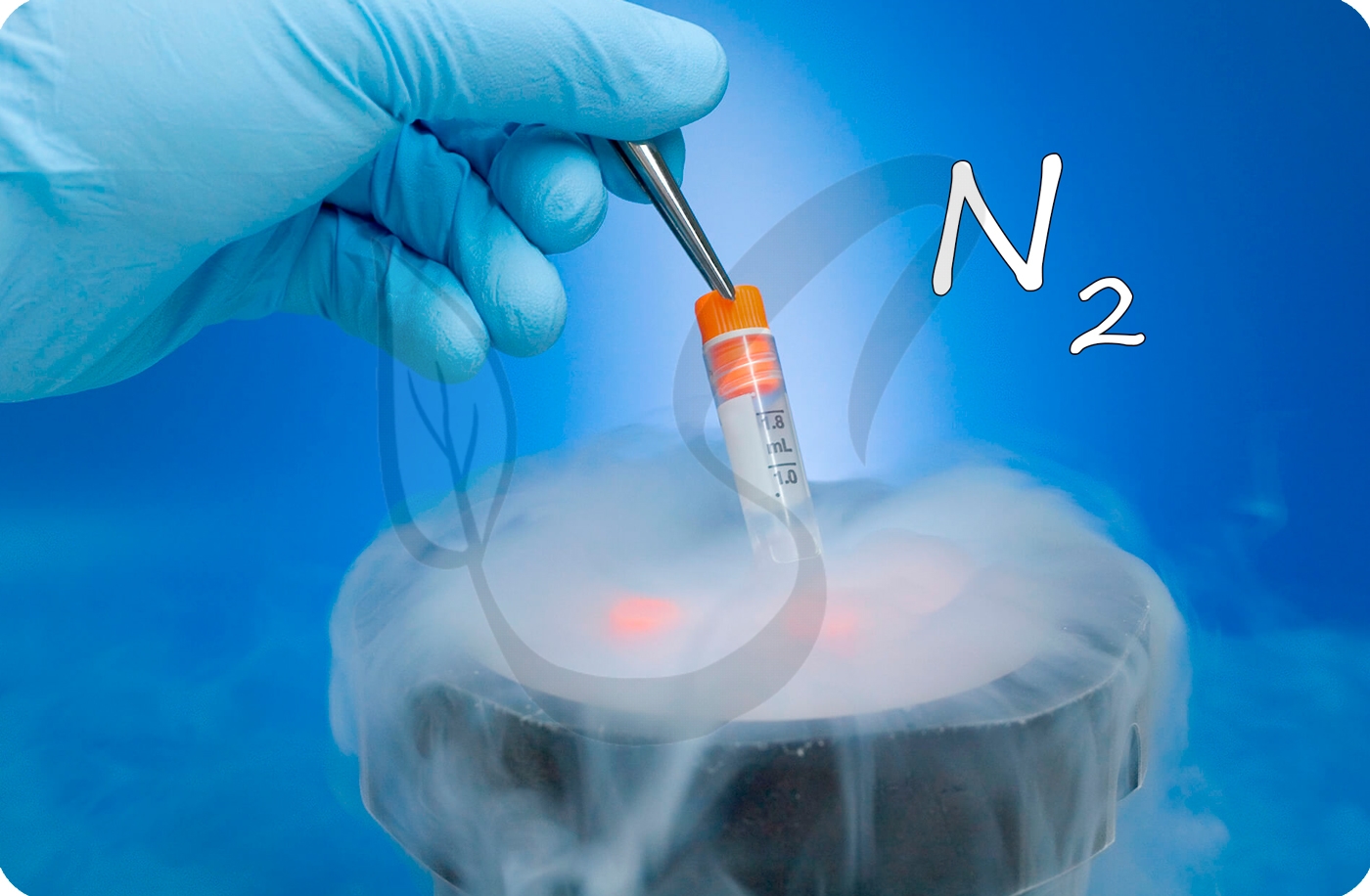
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
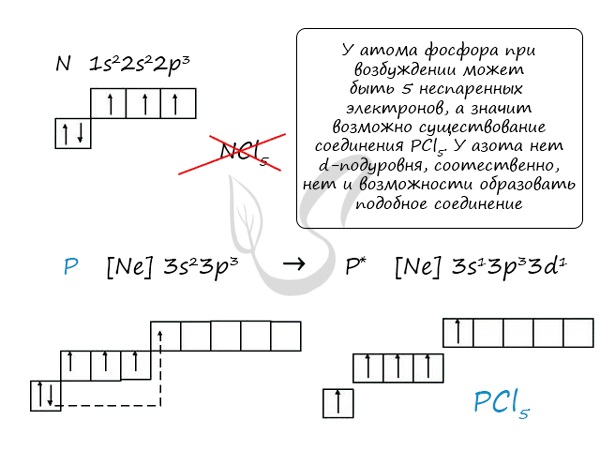
Основное и возбужденное состояние азота
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
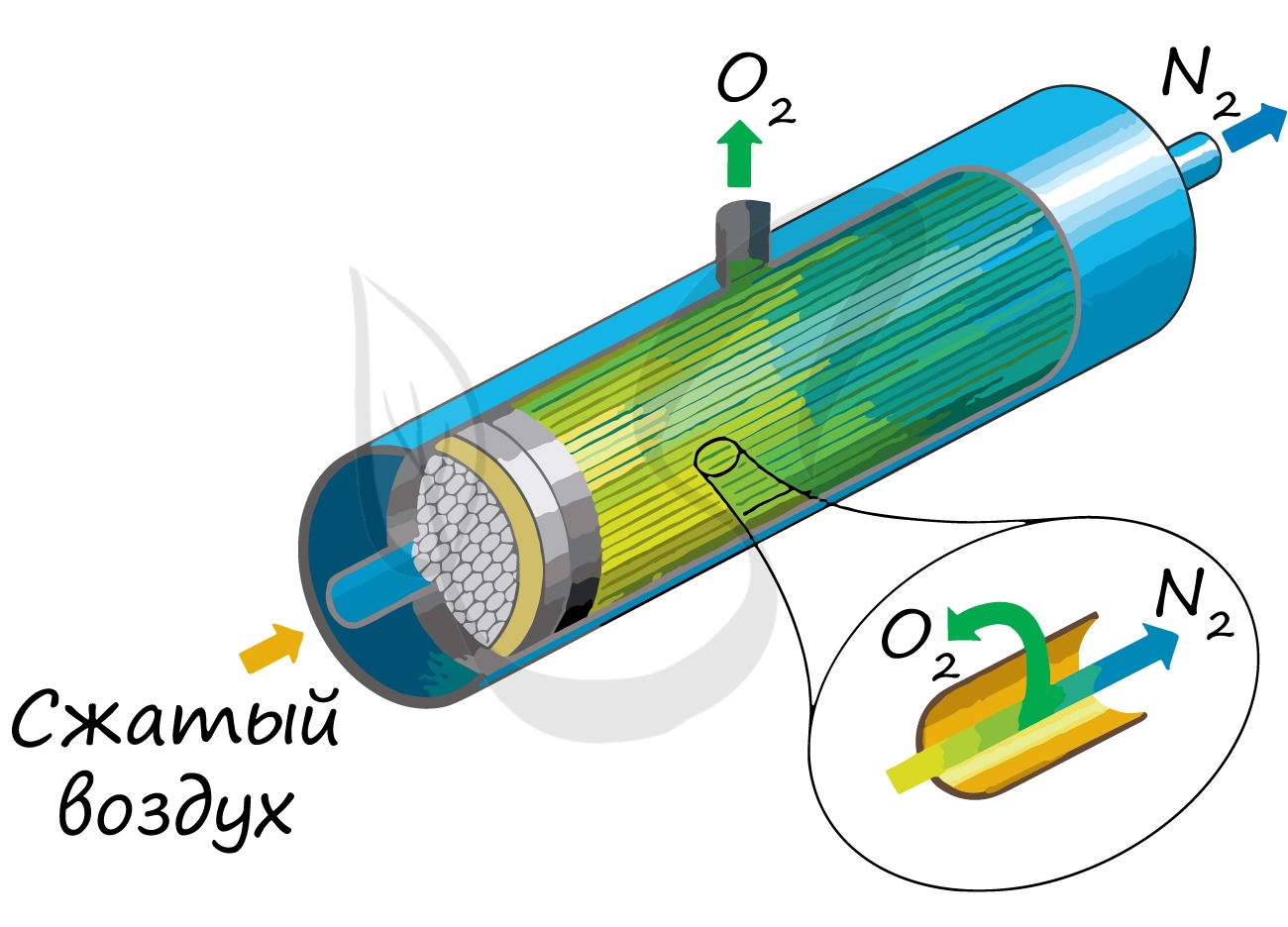
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

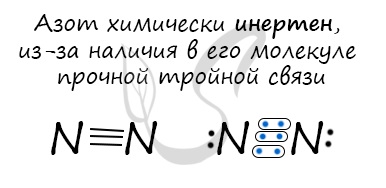
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.
- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
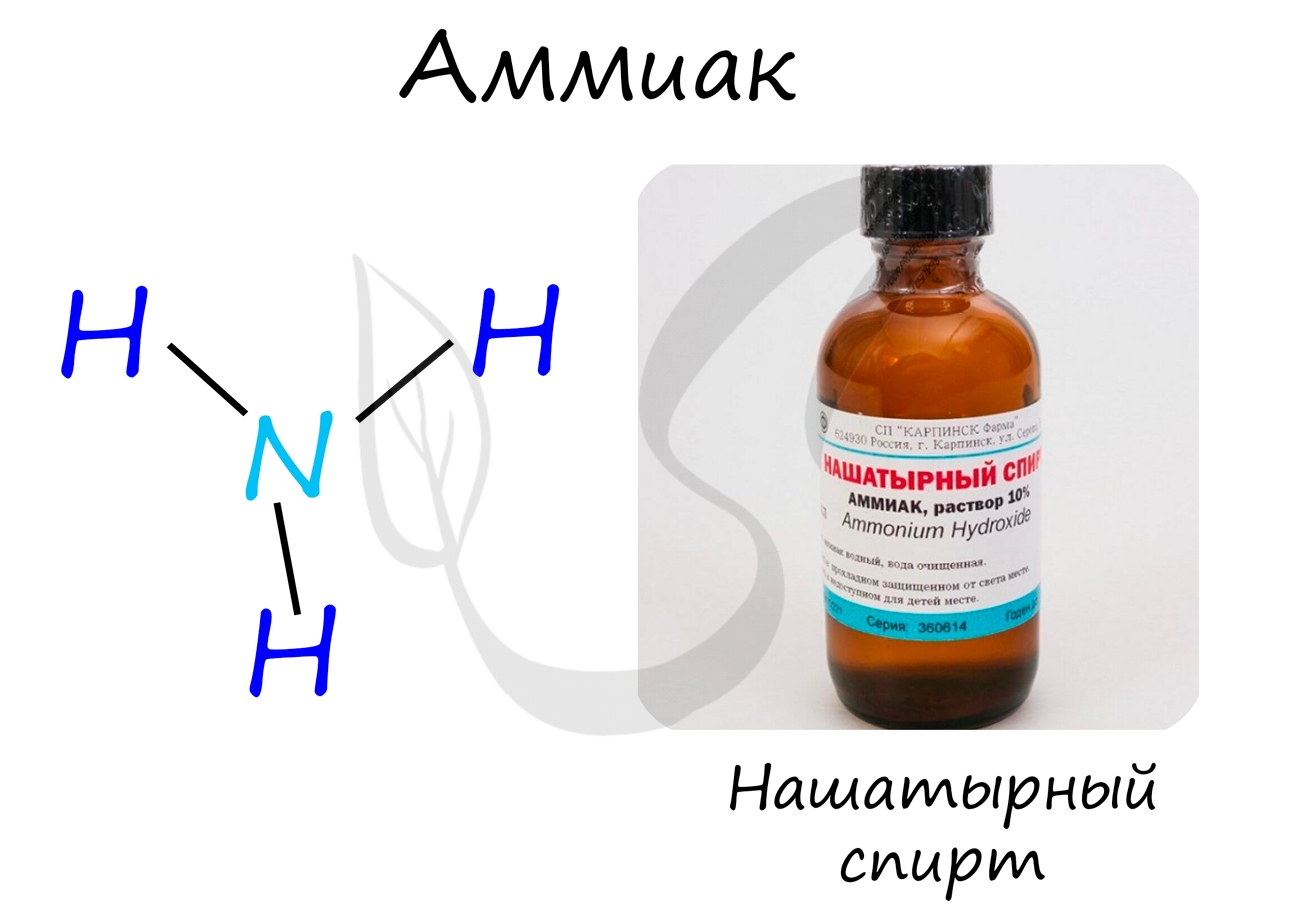
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 → H3AsO 3 + NO↑ + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислота — HNO2, соли которой называются нитриты (NO2—). Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Азот — урок. Химия, 8–9 класс.
Химический элемент
Азот — химический элемент № \(7\). Он расположен в VА группе Периодической системы химических элементов.
N7+7)2e)5e
На внешнем слое атома азота содержатся пять валентных электронов, до его завершения не хватает трёх электронов. Поэтому в соединениях с металлами и водородом азоту характерна степень окисления \(–3\), а при взаимодействии с более электроотрицательными кислородом и фтором он проявляет положительные степени окисления от \(+1\) до \(+5\).
Азот в виде простого вещества содержится в воздухе. Его объёмная доля составляет \(78\) %. В земной коре соединения азота встречаются редко. Известно месторождение нитрата натрия NaNO3 (чилийская селитра).
Азот относится к жизненно важным элементам, так как входит в состав молекул белков и нуклеиновых кислот.
Простое вещество
Молекулы простого вещества состоят из двух атомов, связанных прочной тройной связью:
N:::N…., N≡N.
При обычных условиях азот — бесцветный газ без запаха и вкуса, малорастворимый в воде.
Не ядовит.
Азот химически малоактивен из-за прочной тройной связи и в химические реакции вступает только при высоких температурах.
При комнатной температуре он реагирует только с литием с образованием нитрида лития:
6Li0+N20=2Li+13N−3.
При нагревании образует нитриды и с некоторыми другими металлами:
3Ca+N2=tCa3N2.
С водородом азот реагирует только при высоком давлении, повышенной температуре и в присутствии катализатора. В реакции образуется аммиак:
N20+3h30⇄t,p,k2N−3h4+1.
В реакциях с металлами и водородом азот проявляет окислительные свойства.
Восстановительные свойства азота проявляются в реакции с кислородом:
N20+O20⇄t2N+2O−2.
Реакция возможна только при очень высокой температуре (\(3000\) °С) и частично протекает в атмосфере во время грозы. Образуется оксид азота(\(II\)).
Применение и получение
Большое количество азота используется для получения аммиака и азотных удобрений.
Применяется он для создания инертной среды при проведении химических реакций. Жидкий азот находит применение в медицине, используется для охлаждения в химических и физических исследованиях.
Чистый азот получают из воздуха.
HNO3, степень окисления азота и др элементов
Общие сведения об азотной кислоте и степени окисления в HNO3
При обычных условиях азотная кислота представляет собой бесцветную жидкость (плотность 1,52 г/см3), кипящую при 82,6oC, а при температуре (-41,6oC) затвердевающую в прозрачную кристаллическую массу. Брутто-формула – HNO3. Молярная масса – 93 г/моль. Строение молекулы азотной кислоты приведено на рис. 1.
Азотная кислота смешивается с водой в любых соотношениях. Является сильным электролитом, т.е. в водном растворе практически полностью диссоциирует на ионы. В ОВР проявляет себя в роли окислителя.
Рис. 1. Строение молекулы азотной кислоты с указанием валентных углов между связями и длин химических связей.
HNO3, степени окисления элементов в ней
Чтобы определить степени окисления элементов, входящих в состав азотной кислоты, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно. Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
(+1) + х + 3×(-2) = 0;
1 + х — 6 = 0;
x — 5 = 0;
x = +5.
Значит степень окисления азота в азотной кислоте равна (+5):
H+1N+5O-23.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Nh5NO3, степень окисления азота и др элементов
Общие сведения о нитрате аммония и степени окисления в Nh5NO3
Температура плавления – 169,6oC. Брутто-формула – NH4NO3. Молярная масса нитрата аммония равна 80,03 г/моль.
Рис. 1. Нитрат аммония. Внешний вид.
Хорошо растворим в воде (гидролизуется по катиону). Кристаллогидратов не образует. Разлагается концентрированными щелочами. В ОВР может проявлять свойства слабого окислителя и восстановителя.
Nh5NO3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав нитрата аммония, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Известно, что суммарная степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав кислоты и записывается со знаком минус. Нитраты – это соли азотной кислоты, брутто-формула, которой имеет вид HNO3. В составе азотной кислоты имеется один атом водорода, следовательно, степень окисления кислотного остатка (нитрат-иона) равна (-1): NO31-.
Степень окисления кислорода в составе неорганических кислот, а, значит и их кислотных остатков, всегда равна (-2). Для нахождения степени окисления азота в нитрат-ионе примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(-2) = -1;
x — 6 = -1;
x = +5.
Значит степень окисления азота в составе нитрат-иона равна (+5).
Катион NH4+ является производным аммиака (гидрид водорода), степень окисления водорода, в составе которого равна (+1). Определим степень окисления азота из иона аммония аналогичным образом:
y + 4×(+1) + (+5) + 3×(-2) = 0;
y + 4 + 5 – 6 = 0;
y + 3 = 0;
y = -3.
Следовательно, степень окисления азота равна (-3):
N-3H+14N+5O-23.
Примеры решения задач
Nh4, степень окисления азота и водорода в нем
Общие сведения об аммиаке и степени окисления в Nh4
Брутто-формула – NH3. Молярная масса – 17 г/моль. Молекула аммиака имеет форму тригональной пирамиды (dNH = 0,10 нм, угол HNH равен 107,3o). Согласно методу валентных связей, это отвечает sp3-гибридизации валентных орбиталей атома азота (рис. 1).
Рис. 1. Энергетическая диаграмма орбиталей молекулы аммиака.
При охлаждении до (-33,4oC) аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при (-77,8oC).
Аммиак хорошо растворим в воде: один объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% (масс.) NH3 и имеет плотность 0,91 г/см3.Раствор аммиака в воде называют нашатырным спиртом.
Nh4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав аммиака, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Аммиак – это тривиальное название гидрида азота, а, как известно, степень окисления водорода в гидридах равна (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(+1) = 0;
x + 3 = 0;
x = -3.
Значит степень окисления азота в аммиаке равна (-3):
N-3H+13.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
N2O3, степень окисления азота и кислорода в нем
Общие сведения об оксиде азота (III) и степени окисления в N2O3
В твердом состоянии это вещество белого или голубоватого цвета с ионным строением носящее название нитрит нитрозила (NO+) (NO2—). В виде газообразного вещества имеет молекулярное строение, показанное на рис. 1. Брутто-формула – N2O3. Молярная масса оксида азота (III) – 76,01 г/моль.
Рис. 1. Строение молекулы оксида азота (III).
Проявляет кислотные свойства.
N2O3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав оксида азота (III), сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в оксидах всегда равна ( — 2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2×х + 3× (-2)= 0;
2х – 6 = 0;
2х = 6;
x = +3.
Степень окисления азота в оксиде азота (III) равна (+3):
N+32O-23.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Периодическая таблица состояний окисления — Сложный процент
нажмите, чтобы увеличитьСуществует множество периодических таблиц, и я уже добавил их к этой таблице Менделеева ранее. Сегодняшний пост — еще одна вариация на эту тему: периодическая таблица, показывающая возможные и общие степени окисления каждого элемента. На прошлой неделе я искал один из них из интереса и не смог найти ни одного, в котором информация была бы представлена в простой для понимания форме.Чтобы попытаться решить эту проблему, я составил таблицу, которую вы видите в верхней части сообщения здесь.
Нехимикам, вероятно, стоит уточнить, что мы подразумеваем под «степенью окисления». На самом деле это довольно простая концепция для химиков, но ее сложно определить. По сути, это число, присвоенное элементу в соединении, и (на базовом уровне) обозначает количество электронов, которые были удалены или добавлены к этому элементу. Элемент, который не комбинируется с другими элементами, имеет степень окисления 0, потому что в него не добавлялись и не удалялись электроны.
Атом элемента в соединении будет иметь положительную степень окисления, если из него были удалены электроны. Сначала это может показаться нелогичным, но помните, что электроны заряжены отрицательно. Следовательно, удаление отрицательных зарядов с атома приводит к положительной степени окисления. Точно так же добавление электронов приводит к отрицательной степени окисления. Сумма всех степеней окисления различных элементов в соединении должна быть равна нулю.
Если ваш единственный опыт химии получил еще в школе, вы могли бы вспомнить концепцию ионов — атомов, которые приобрели или потеряли электроны, чтобы сформировать положительно или отрицательно заряженные ионы.Например, натрий (Na) может потерять электрон с образованием ионов натрия (Na + ). Они имеют степень окисления +1, такую же, как заряд иона. Точно так же железо (Fe) может потерять два электрона с образованием иона Fe 2+ или потерять три электрона с образованием иона Fe 3+ . Они имеют степень окисления +2 и +3 соответственно. С ионом хлора (атом хлора, который приобрел один электрон, Cl — ), степень окисления будет -1.
Состояние окисления 0 наблюдается для всех элементов — это просто элемент в его элементарной форме.Как видно из таблицы, наличие других степеней окисления варьируется, но следует некоторым закономерностям. Общие степени окисления всех металлов в периодической таблице все положительны. С другой стороны, все неметаллы в таблице имеют по крайней мере одну общую отрицательную степень окисления. Металлы d-блока, показанные в таблице желтым цветом, имеют самый широкий диапазон степеней окисления.
Атомы одного и того же элемента с разными степенями окисления могут иметь разные свойства. Самый очевидный из них с внешней точки зрения — это цвет, умело иллюстрированный элементами блока d.Большинство из них имеют несколько общих степеней окисления, и они различаются по цвету. Происхождение этих разных цветов объясняется в предыдущем посте на сайте.
Это был самый короткий вводный курс по степени окисления, но, надеюсь, его достаточно, чтобы хотя бы частично прояснить приведенный выше рисунок для нехимиков. Конечно, есть место для будущей публикации, в которой более подробно описаны состояния окисления и способы их определения! А пока вы можете загрузить в формате PDF этот рисунок ниже или приобрести его в качестве плаката здесь.
Понравились этот пост и рисунок? Подумайте о поддержке сложного процента на Patreon и получайте предварительные просмотры будущих публикаций и многое другое!
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. См. Рекомендации по использованию содержания сайта.
Ссылки и дополнительная литература
.азота | Факты, определение, использование, свойства и открытие
Азот (N) , неметаллический элемент 15 группы [Va] периодической таблицы Менделеева. Это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в атмосфере Земли и является составной частью всего живого.
Encyclopædia Britannica, Inc.Британская викторина
118 Названия и символы из таблицы Менделеева
см
| атомный номер | 7 |
|---|---|
| атомный вес | 14.0067 |
| точка плавления | −209,86 ° C (−345,8 ° F) |
| точка кипения | −195,8 ° C (−320,4 ° F) |
| плотность (1 атм, 0 ° C) | 1,2506 грамм / литр |
| обычные степени окисления | −3, +3, +5 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 3 |
История
Около четырех пятых атмосферы Земли составляет азот, который был выделен и признан особенным веществом в ходе ранних исследований воздуха.Карл Вильгельм Шееле, шведский химик, показал в 1772 году, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой «грязным воздухом», потому что он остался после « огненный воздух ». «Огненный воздух» — это, конечно, кислород, а «грязный воздух» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле дается заслуга открытия кислорода.Более поздние работы показали, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, французский химик Жан-Антуан-Клод Шапталь в 1790 году назвал его азотом. считался химическим элементом Антуаном-Лораном Лавуазье, чье объяснение роли кислорода в горении в конечном итоге опровергло теорию флогистона, ошибочное представление о горении, которое стало популярным в начале 18 века. Неспособность азота поддерживать жизнь (по-гречески: zoe ) побудила Лавуазье назвать его азот , по-прежнему французский эквивалент азота .
Возникновение и распространение
Среди элементов азот занимает шестое место по количеству в космосе. Атмосфера Земли состоит из 75,51 процента по весу (или 78,09 процента по объему) азота; это основной источник азота для торговли и промышленности. Атмосфера также содержит различные небольшие количества аммиака и солей аммония, а также оксидов азота и азотной кислоты (последние вещества образуются во время гроз и в двигателе внутреннего сгорания).Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также присутствует в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти отложения существуют в количествах, которые совершенно не соответствуют потребностям человека. Еще один богатый азотом материал — гуано, которое можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами.В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде — в виде аммония (NH 4 + ), нитрита (NO 2 —) и нитрата (NO 3 ). — ) ионы. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000 человек. Космическое содержание — предполагаемое общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, что считается стандартом.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчасИндия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Коммерческое производство и использование
Промышленное производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади.Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образовавшегося диоксида углерода и воды от остаточного азота. В небольших масштабах чистый азот получают путем нагревания азида бария, Ba (N 3 ) 2 . Различные лабораторные реакции, дающие азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги.В жидком состоянии азот имеет ценные криогенные применения; За исключением газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление пара при температуре кипения азота и, следовательно, существуют в виде кристаллических твердых веществ при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого порчи продукта, в качестве инертного разбавителя химически активного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора пожара или взрывов.В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для сублимационной сушки и для холодильных систем. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для создания избыточного давления в оболочках кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке, где он помогает предотвратить окисление, науглероживание и обезуглероживание. В качестве инертного газа азот используется для производства вспененного или вспененного каучука, пластиков и эластомеров, в качестве газа-вытеснителя для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реакционных струй.В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
.Окислительно-восстановительная реакция | химическая реакция
Основные классификации
Большинство окислительно-восстановительных (окислительно-восстановительных) процессов включают перенос атомов кислорода, атомов водорода или электронов, причем все три процесса имеют две важные характеристики: (1) они взаимосвязаны, т. Е. В любой реакции окисления происходит взаимное восстановление, и (2) они связаны с характерным чистым химическим изменением, т. Е. Атом или электрон переходит от одной единицы вещества к другой. И взаимность, и чистое изменение проиллюстрированы ниже на примерах трех наиболее распространенных типов окислительно-восстановительных реакций.
Углерод реагирует с оксидом ртути (II) (соединение, в котором ртуть имеет связывающую способность, выраженную как +2; см. Ниже Изменение состояния окисления) с образованием диоксида углерода и металлической ртути. Эту реакцию можно записать в виде уравнения:
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчасУглерод, получая кислород, окисляется; оксид ртути (II), теряя кислород, подвергается дополнительному восстановлению; и чистым изменением является перенос двух атомов кислорода от единиц оксида ртути (II) к атому углерода.
Атомы водорода переходят от гидразина, соединения азота и водорода, к кислороду в следующей реакции:
Гидразин, теряя водород, окисляется до молекулярного азота, а кислород, получая водород, восстанавливается до воды.
Металлический цинк и ион меди (II) реагируют в водном растворе с образованием металлической меди и водного (обозначенного водным) иона цинка в соответствии с уравнением
При переносе двух своих электронов металлический цинк окисляется, превращаясь в водный ион цинка, а ион меди (II), приобретая электроны, восстанавливается до металлической меди.Чистое изменение — это перенос двух электронов, потерянных цинком и приобретенных медью.
Из-за их взаимодополняемости процессы окисления и восстановления вместе называются окислительно-восстановительными реакциями. Реагент, вызывающий окисление, называется окислителем, и сам этот реагент восстанавливается восстановителем. В приведенных выше примерах оксид ртути (II), кислород и ион меди (II) являются окислителями, а углерод, гидразин и цинк — восстановителями.
.
Leave A Comment