Утилизация кислот: как правильно обращаться с опасными веществами: Статьи экологии ➕1, 20.01.2022
Большинство кислот, знакомых нам еще по школьной программе, могут быть опасны даже в небольших количествах: их неумелое использование может привести к химическим ожогам или стать причиной пожара. Plus‑one.ru разбирался, почему слив кислот в промышленных масштабах представляет угрозу не только для человека, но и для всего живого.
Фото: Milos Dimic / iStock
Кислоты широко применяются, например, в производстве удобрений и чистящих средств, но они также являются опасными отходами, которые нельзя просто вылить в канализацию. Некоторые из них могут быть взрывоопасными. Так, пикриновая кислота может взорваться от малейшего трения, даже если неосторожно открыть крышку емкости, в которой она находится. При попадании в природную среду кислоты отравляют воду, почву и воздух, а их испарения могут конденсироваться в атмосфере и возвращаться на землю с осадками.
За нарушение требований к обращению с отходами производства и потребления, к которым относятся кислоты, в том числе за их накопление дольше 11 месяцев и неправильную утилизацию (слив концентратов кислот в канализацию, природную среду), выписывается штраф как для частных, так и для юридических лиц. Более длительное складирование считается хранением, допустимым только при наличии лицензии. Чтобы избежать штрафных санкций и снизить риски от вдыхания токсичных паров для сотрудников, предприятия своевременно утилизируют остатки химикатов или обращаются для этого в специализированные компании.
Как из мусора получить энергию
Разбираемся в технологиях и пытаемся понять, насколько безопасно сжигать отходы
Некоторые кислотные растворы используются в быту. Например, соляная кислота удаляет известковый налет и выводит пятна ржавчины с одежды, а азотная — очищает ювелирные изделия. Для безопасной утилизации кислот в домашних условиях их необходимо обезвредить:
1
Приготовьте холодную воду, чтобы разбавить вещество до концентрации не более 5%, и пластиковый контейнер объемом вдвое больше объема утилизируемого раствора. Налейте воду в контейнер, а затем медленно добавьте в нее кислоту. Нельзя поступать наоборот, иначе едкая жидкость может начать разбрызгиваться.
Налейте воду в контейнер, а затем медленно добавьте в нее кислоту. Нельзя поступать наоборот, иначе едкая жидкость может начать разбрызгиваться.
2
Осторожно добавьте туда же 5%-й раствор гидроксида кальция (гашеная известь), карбоната натрия (кальцинированная сода) или гидроксида натрия (каустическая сода). Оптимальное соотношение нейтрализатора и кислотного раствора: 6:1.
3
Определите уровень pH раствора с помощью индикаторной бумаги, он не должен быть больше шести-семи. При использовании карбоната натрия понять, что отходы обезврежены, можно по отсутствию пузырьков.
4
Откройте кран с холодной водой и вылейте полученный раствор в слив. Когда контейнер опустеет, оставьте кран открытым еще на несколько минут.
Токсичные и взрывоопасные кислоты — синильную и пикриновую не рекомендуется использовать в домашних условиях. Но если необходимость в утилизации этих веществ все-таки возникла, их необходимо сдать в лабораторию или в специальные службы, которые занимаются вывозом опасных отходов.
Нужны ли России 25 мусоросжигательных заводов
Plus-one.ru спросил экспертов и компанию «РТ-Инвест», которая собирается их построить
Фото: Андрей Клеменков / iStock
Для утилизации больших объемов отходов кислот необходимо воспользоваться услугами специалистов. До их приезда химикаты нужно хранить в промаркированной герметичной таре из пластика и других материалов, не вступающих в реакцию с содержимым. Такую тару могут производить только лицензированные предприятия. Нельзя допускать соединения разных веществ, каждое из них следует хранить и транспортировать отдельно.
Помещение, в котором накапливаются отходы, должно быть оборудовано вытяжной вентиляцией с системой фильтров, предотвращающей выход вредных испарений наружу.
Специалист компании проводит инвентаризацию химических веществ и упаковывает их в бочки с абсорбентом. Бочки маркируются, а затем вывозятся на полигон или производство по переработке кислот.
Бочки маркируются, а затем вывозятся на полигон или производство по переработке кислот.
Фото: Alexander Zvir / Pexels
При выборе метода нейтрализации кислот учитывается их состав и степень токсичности. Для утилизации соляной кислоты используется 5%-й раствор щелочи (гидроксида натрия, калия или кальция). Полученный состав можно использовать повторно в виде минеральных солей или отправить на утилизацию.
Для утилизации серной кислоты чаще всего используют гидроксид кальция. Получившийся в результате смешивания раствор использовать нельзя, его вывозят на полигоны для захоронения. Отработанная серная кислота может быть уничтожена в плазмотроне или в огненной печи.
В процессе обезвреживания азотной кислоты выделяется большое количество тепла, поэтому ее нейтрализуют небольшими порциями или в охлаждаемой емкости. Реагент соединяют с раствором щелочи, а затем добавляют нитрат кальция (подробный метод утилизации кислот указан выше).
Самый эффективный метод утилизации уксусной кислоты — сжигание. Отходы впрыскивают в реактор под высоким давлением, где они превращаются в газ и сгорают под воздействием температуры около 5 000°С.
Утилизация пикриновой, плавиковой и синильной кислот требует особой осторожности. Так, пикриновая (2,4,6-тринитрофенол) взрывоопасна, ее нельзя отправлять на полигоны. На производстве химикат очищают от примесей и используют повторно. Синильную (цианистоводородную) кислоту в промышленности нейтрализуют щелочью, а затем вывозят на полигон опасных отходов. Пары плавиковой (фтороводородной) кислоты токсичны, поэтому ее нейтрализуют, а затем восстанавливают для повторного использования.
Подписывайтесь на наш канал в Яндекс.Дзен.
Автор
Вера Жихарева
Гидроксид натрия и соляная кислота реагируют, как показано в этом уравнении.
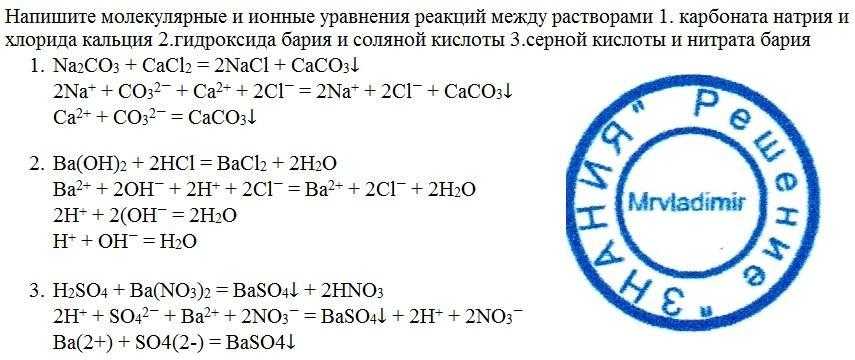 text{aq}}} \right) \to {\text{NaCl}}\left( {\text{aq}}} \right) + {{\text{H}}_{\text{2}} {\text{O}}\left( {\text{l}} \right)$i) Какой это тип химической реакции?ii) Реакция экзотермическая. Объясняет, что это означает. iii) Различают экзотермическую реакцию и эндотермическую реакцию. iv) Что происходит с температурой раствора, когда химические вещества реагируют?
text{aq}}} \right) \to {\text{NaCl}}\left( {\text{aq}}} \right) + {{\text{H}}_{\text{2}} {\text{O}}\left( {\text{l}} \right)$i) Какой это тип химической реакции?ii) Реакция экзотермическая. Объясняет, что это означает. iii) Различают экзотермическую реакцию и эндотермическую реакцию. iv) Что происходит с температурой раствора, когда химические вещества реагируют?Подсказка: Чтобы решить это, мы должны знать, что гидроксид натрия $\left( {{\text{NaOH}}} \right)$ является основанием, а соляная кислота $\left( {{\text{HCl}} } \right)$ — кислота. В реакции образуется хлорид натрия $\left( {{\text{NaCl}}} \right)$. Хлорид натрия также известен как поваренная соль.
Полный пошаговый ответ:
i) Дана реакция, в которой реагируют гидроксид натрия и соляная кислота. Данная реакция выглядит следующим образом:
${\text{NaOH}}\left( {\text{водный}}} \right) + {\text{HCl}}\left( {\text{водный}} } \right) \to {\text{NaCl}}\left( {\text{aq}}} \right) + {{\text{H}}_{\text{2}}}{\text{ O}}\left( {\text{l}} \right)$
Мы знаем, что гидроксид натрия $\left( {{\text{NaOH}}} \right)$ является основанием, а соляная кислота $\left( {{\text{HCl}}} \right)$ является кислотой. В реакции образуется хлорид натрия $\left( {{\text{NaCl}}} \right)$. Хлорид натрия – это соль. Наряду с соленой водой в реакции также образуется вода.
В реакции образуется хлорид натрия $\left( {{\text{NaCl}}} \right)$. Хлорид натрия – это соль. Наряду с соленой водой в реакции также образуется вода.
Реакция кислоты и основания с образованием соли и воды известна как реакция нейтрализации.
Таким образом, типом данной химической реакции является реакция нейтрализации.
ii) Нам известно, что реакция экзотермическая.
Химическая реакция, при которой тепловая энергия выделяется или высвобождается или отдается веществом, известна как экзотермическая реакция. В экзотермической реакции чистый прирост энергии отрицательный.
Энергия высвобождается в виде тепла или света.
iii) Разница между экзотермической реакцией и эндотермической реакцией следующая:
| Экзотермическая реакция | Эндотермическая реакция 900 29 |
Химическая реакция, при которой тепловая энергия выделяется или высвобождается или отдается веществом, известна как экзотермическая реакция. | Химическая реакция, при которой тепловая энергия поглощается веществом, называется эндотермической реакцией. |
| Энергия высвобождается из системы в окружающую среду. | Энергия поглощается системой из окружающей среды. |
| Энергия высвобождается в виде тепла или света. | Поглощенная энергия находится в форме тепла. |
| Примеры: взрывы, деление ядер, ржавление железа и т. д. | Примеры: фотосинтез, таяние льда, испарение и т. д. |
следующим образом:
Нам известно, что реакция экзотермическая. Химическая реакция, при которой тепловая энергия выделяется или высвобождается или отдается веществом, известна как экзотермическая реакция. По мере выделения тепла в ходе реакции температура раствора повышается. Таким образом, температура раствора будет повышаться по мере реакции химических веществ.
Примечание: Не путайте экзотермическую реакцию с эндотермической реакцией. Химическая реакция, при которой тепловая энергия выделяется, высвобождается или отдается веществом, называется экзотермической реакцией, тогда как химическая реакция, при которой тепловая энергия поглощается веществом, называется эндотермической реакцией.
Химическая реакция, при которой тепловая энергия выделяется, высвобождается или отдается веществом, называется экзотермической реакцией, тогда как химическая реакция, при которой тепловая энергия поглощается веществом, называется эндотермической реакцией.
Титрование гидроксида натрия соляной кислотой | Эксперимент
- Четыре из пяти
В этом эксперименте студенты нейтрализуют гидроксид натрия соляной кислотой для получения растворимой соли хлорида натрия в растворе. Затем они концентрируют раствор и позволяют ему кристаллизоваться для получения кристаллов хлорида натрия
Вы должны решить, подходит ли этот эксперимент для использования с другими классами, и рассмотреть необходимость предварительного обучения методам титрования (см. ). Дальнейшее здесь предполагает, что учителя оценили класс как способный провести этот эксперимент с бюреткой с разумным ожиданием успеха.
). Дальнейшее здесь предполагает, что учителя оценили класс как способный провести этот эксперимент с бюреткой с разумным ожиданием успеха.
Предполагая, что студенты прошли обучение, практическая работа должна, по возможности, начинаться с готовой аппаратуры на каждом рабочем месте в лаборатории. Это делается для того, чтобы избежать сбора уязвимой и дорогой стеклянной посуды (бюретки) в переполненном центральном месте.
Источник: © Getty Images
Учащиеся проводят эксперимент по титрованию в школьной научной лаборатории.
Необходимое время
Стадия 1
Заполнение бюретки, отмеривание щелочи в колбе и ее титрование до ее нейтрализации занимает около 20 минут, при этом для многих групп возможны фальстарты. На практике не имеет значения, превышается ли конечная точка даже на несколько кубических сантиметров, но цель состоит в том, чтобы найти пропорции для примерно нейтрального раствора.
Стадия 2
Приготовление нейтрального раствора без индикатора занимает не более 10 минут.
Выпаривание раствора может затянуть оставшуюся часть урока до момента, когда раствор можно будет оставить кристаллизоваться для следующего урока. Наблюдение за испарением растворов может быть утомительным для студентов, и им может понадобиться другая задача, чтобы занять себя, например, промывка бюреток и опорожнение очищенной водой.
Оборудование
Аппарат
- Защита глаз
- Бюретка, 30 или 50 см 3 (примечание 1)
- Коническая колба, 100 см 3
- Стакан, 100 см 3
- Пипетка, 20 или 25 см 3 , с фильтром для пипетки
- Стержень для перемешивания
- Маленькая (фильтрующая) воронка диаметром около 4 см
- Подставка для бюреток и зажим (примечание 2)
- Белая плитка (опционально; примечание 3)
- Горелка Бунзена
- Штатив
- Треугольник из пластилина (примечание 4)
- Испарительная чаша, не менее 50 см 3 вместимость
- Чашка для кристаллизации (примечание 5)
- Микроскоп или ручная линза для изучения кристаллов в чашке для кристаллизации
Примечания к аппарату
- Если в вашей школе все еще используются бюретки со стеклянными кранами, обратитесь к Справочнику лаборатории CLEAPSS, раздел 10.
 10.1, по уходу за ними и их техническому обслуживанию. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов.
10.1, по уходу за ними и их техническому обслуживанию. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов. - Стойки и зажимы для бюреток предназначены для предотвращения сдавливания бюретки из-за чрезмерного затягивания, что может произойти при использовании стандартных губчатых зажимов.
- Дополнительная белая плитка должна помещаться под колбу для титрования, но вместо нее можно использовать белую бумагу.
- Вместо треугольников из глины можно использовать керамические сетки, но в этом случае испарение занимает больше времени.
- Стадии испарения и кристаллизации могут быть незавершенными во время урока. Чашки для кристаллизации необходимо отставить в сторону, чтобы кристаллизация происходила медленно.
 Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов. Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем.
Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов. Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем.
Химикаты
- Раствор гидроксида натрия, 0,4 М (РАЗДРАЖАЮЩЕЕ), около 100 см 3 в маркированной и закупоренной бутылке
- Разбавленная соляная кислота, 0,4 М, около 100 см 3 в маркированной и закрытой бутылке
- Индикаторный раствор метилового оранжевого (или аналог) в маленькой бутылочке-капельнице
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Раствор гидроксида натрия, NaOH (водн.) (РАЗДРАЖАЕТ при используемой концентрации) — см. карточку опасности CLEAPSS HC091a и книгу рецептов CLEAPSS RB085.

- Разбавленная соляная кислота, HCl (водн.) — см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043. Концентрация раствора не требует высокой точности, но должна быть достаточно близкой к той же концентрации, что и раствор гидроксида натрия, и менее 0,5 М.
- Раствор индикатора метилового оранжевого (твердое вещество является ТОКСИЧНЫМ, но не раствор) — см. карту опасности CLEAPSS HC032 и книгу рецептов CLEAPSS RB000.
Процедура
Источник: Королевское химическое общество
Аппарат для титрования гидроксида натрия соляной кислотой с получением хлорида натрия.
Стадия 1- С помощью небольшой воронки налейте несколько кубических сантиметров 0,4 М соляной кислоты в бюретку с открытым краном и стаканом под открытым краном.

- Используйте пипетку с наполнителем для пипеток, чтобы перенести 25 (или 20) см 3 0,4 М раствора гидроксида натрия в коническую колбу и добавить две капли индикатора метилового оранжевого. Аккуратно перемешайте. Поместите колбу на белую плитку или лист чистой белой бумаги под кран бюретки.
- Добавляйте соляную кислоту в раствор гидроксида натрия небольшими объемами, осторожно взбалтывая после каждого добавления. Продолжайте до тех пор, пока раствор не изменит цвет с желто-оранжевого на красный, и в этот момент запишите показания на бюретке. Теперь этот окрашенный раствор следует смыть в раковину.
- Заполните бюретку до нулевой отметки. Осторожно добавьте тот же объем свежей соляной кислоты, который вы использовали на этапе 1, шаге 3, к другим 25 (или 20) см 3 раствора гидроксида натрия, чтобы получить нейтральный раствор, но на этот раз без индикатора.

- Вылейте этот раствор в испарительную емкость. Уменьшите объем раствора примерно наполовину, нагревая его на треугольнике из глины или керамической сетке над пламенем горелки Бунзена от слабого до среднего. Раствор выплескивается ближе к концу, и вы получаете меньше кристаллов. Не кипятить всухую. Вам может понадобиться выпарить раствор, скажем, в 20 см 3 во избежание переполнения резервуара испарителя. Не пытайтесь снять горячую чашу со штатива — сначала дайте остыть, а затем перелейте в чашу для кристаллизации.
- Оставьте концентрированный раствор для дальнейшего испарения в кристаллизаторе. Это должно дать белое кристаллическое твердое вещество в течение одного или двух дней.
- Рассмотрите кристаллы под микроскопом.
Ищете альтернативный метод?
Посмотрите наше практическое видео о приготовлении соли для более безопасного метода выпаривания раствора, а также технические заметки, инструкции и задание по оценке рисков для учащихся.
Учебные заметки
Титрование с использованием бюретки для точного измерения объемов раствора требует тщательной и организованной работы, манипулятивных навыков в сочетании с умственной концентрацией и вниманием к деталям. Все это, конечно, желательные качества, которые следует развивать у учащихся, но прежде чем использовать бюретку в классе, должна быть определенная степень базовой компетентности и надежности. Эксперимент, скорее всего, подойдет учащимся 14–16 лет. Это обсуждается далее ниже, но нижеследующее предполагает, что вы оценили класс как способный провести этот эксперимент с использованием бюретки с разумным ожиданием успеха.
Учащиеся должны научиться правильно пользоваться бюретками, в том числе тому, как их надежно зажимать и наполнять. Вам следует рассмотреть возможность демонстрации техники бюреток и дать студентам возможность попрактиковаться в этом. В этом эксперименте пипетка не нужна, так как цель состоит в том, чтобы нейтрализовать любой объем используемой щелочи, и это можно приблизительно измерить с помощью мерного цилиндра.
Здесь не ставится цель провести количественные измерения, ведущие к расчетам. Цель состоит в том, чтобы познакомить учащихся с методом титрования только для получения нейтрального раствора.
Альтернативные индикаторы, которые вы можете использовать, включают экранированный метиловый оранжевый (зеленый в щелочи, фиолетовый в кислоте) и фенолфталеин (розовый в щелочи, бесцветный в кислоте).
Если оставить концентрированные растворы для медленной кристаллизации, это поможет получить более крупные кристаллы. Растворимость хлорида натрия не сильно зависит от температуры, поэтому простое охлаждение раствора вряд ли приведет к образованию кристаллов.
Под микроскопом (если возможно, лучше стереомикроскопом) можно увидеть кубическую природу кристаллов. Если кристаллизация произошла в неглубоком растворе, когда кристаллы погружены лишь частично, можно увидеть кристаллы в форме воронки. В этих кристаллах каждая грань куба принимает форму полой ступенчатой пирамиды.
Вопросы учащихся
Стадия 1Какие вещества образовались в этой реакции? Напишите уравнение слова и уравнение символа.
Стадия 2
Почему необходимо использовать еще 25 см 3 раствора гидроксида натрия, а не получать кристаллы из раствора на стадии 1?
Стадия 3
Какой формы кристаллы?
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Эксперимент также является частью курса непрерывного профессионального развития Королевского химического общества: Химия для неспециалистов.

 10.1, по уходу за ними и их техническому обслуживанию. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов.
10.1, по уходу за ними и их техническому обслуживанию. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов. Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов. Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем.
Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов. Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем.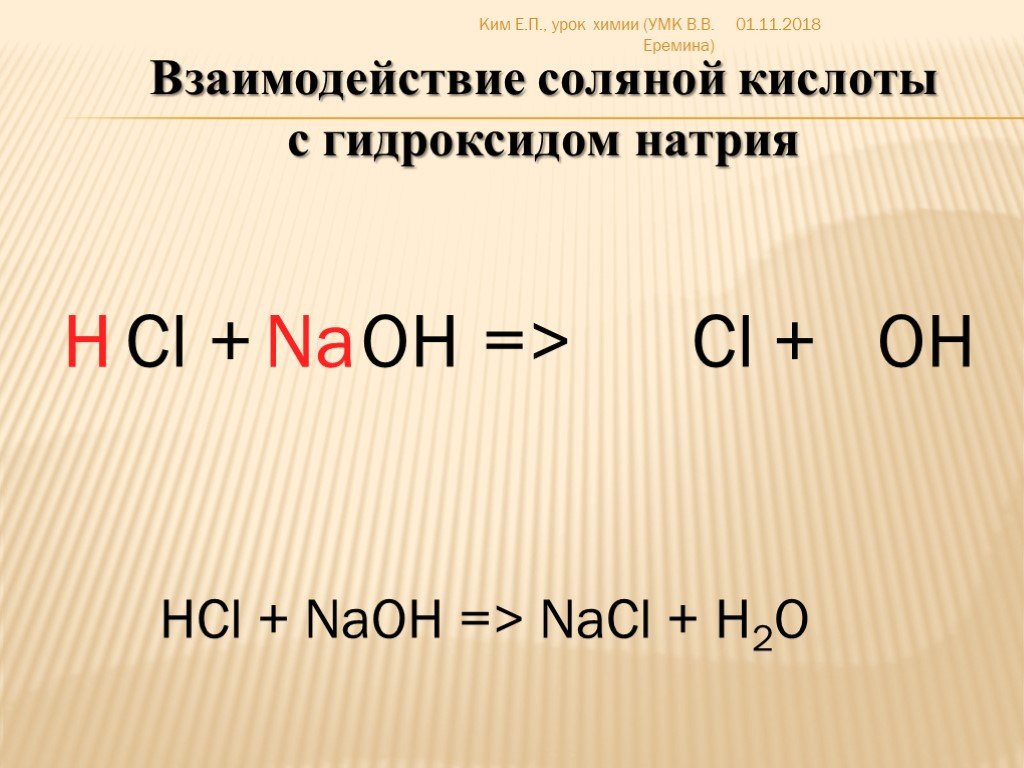


Leave A Comment