Мир Химии: 11 А класс
ВСЕМ, КТО РЕШИЛ ЗАНИМАТЬСЯ ХИМИЕЙ — СЮДА!!!
ВЫ РАБОТАЕТЕ С ЭЛЕМЕНТАМИ И НЕ ТОЛЬКО….
5 — 7 АПРЕЛЯ
УРОК -1
1. БЕРЁМ КАЛЬКУЛЯТОРЫ. ВАМ СЮДА! ПЕРЕПИСАТЬ В РАБОЧУЮ ТЕТРАДЬ!
2. НА УРОКЕ РАБОТАЕМ С УЧЕБНИКАМИ.
УРОК -2
1. НА УРОКЕ РАБОТАЕМ С УЧЕБНИКАМИ.
2. ВЫПОЛНИТЬ ИЗ ПАРАГРАФА 32 ЦЕПОЧКИ, КОТОРЫЕ
НЕ СДЕЛАЛИ В КЛАССЕ.
12 — 14 АПРЕЛЯ
УРОК -1
РЕШИТЬ ЗАДАЧУ:
К 280 г оксида азота (4)
прилили воду и добавили кислород.
Получили азотную кислоту.
Масса полученной кислоты 160г,
выход которой 70%.
Найти массовую долю примесей ,
которые содержатся в оксиде азота (4).
УРОК -2.
РЕШИТЬ ЗАДАЧИ:
1) Смесь карбоната лития и карбоната бария обработали избытком раствора серной кислоты. При этом выделилось 4,48 л (н.у.) газа и образовалось 11,65 г осадка. Определите массу исходной смеси. Ответ запишите в граммах с точностью до сотых.
2) Смесь безводных сульфата алюминия и сульфата меди(II) добавили к избытку разбавленного раствора гидроксида натрия. При этом образовалось 4,9 г осадка. Если эту же смесь добавить к раствору нитрата бария, то выделится 46,6 г осадка. Определите массовую долю сульфата алюминия в исходной смеси.
3) Смесь оксида железа (II) и карбоната железа (II) растворили в избытке бромоводородной кислоты. В результате было получено 3,808 л (при н. у.) газа и 64,8 г соли. Вычислите массу исходной смеси.
19 -21 АПРЕЛЯ!
УРОК -1
РЕШИТЬ ЗАДАЧУ!
При растворении смеси меди и оксида меди(II) в концентрированной
серной кислоте выделилось 4,48 л (н. у.) газа и было получено
у.) газа и было получено
300 г раствора с массовой долей соли 16%. Определите массовую долю
оксида меди(II) в исходной смеси.
ОБ ЭТОМ РАЗГОВОР НА УРОКЕ !
УРОК -2.
У НАС ПРАКТИЧЕСКАЯ РАБОТА! ДЕЖУРНЫМ ПОДОЙТИ
НАКРЫТЬ ПАРТЫ. Свете на уроке быть!
1). ВАМ СЮДА! ВЫ, РЕШАЕТЕ НА ОТДЕЛЬНОМ ЛИСТЕ ЭТИ ЗАДАНИЯ!
ЛИСТ В КЛАССЕ ПЕРЕПИСЫВАЕТЕ И ВКЛАДЫВАЕТЕ
ЕГО В ТЕТРАДЬ ДЛЯ ПРОВЕРОЧНЫХ РАБОТ!
КТО БУДЕТ РАБОТУ СДАВАТЬ БЕЗ ЛИСТА,
ПОЛУЧАЕТ СООТВЕТСТВУЩУЮ ОЦЕНКУ.
26 — 28 АПРЕЛЯ
УРОК -1.
1) РЕШИТЬ ЗАДАЧИ.
Определить формулу кислоты, если массовая доля водорода 2 процента, массовая доля серы 32 процента, массовая доля кислорода 64 процента.

Определить массу полученной соли, если потребовалось 0,1 моль гидроксида калия и 340 гр 10% раствора сероводородной кислоты.
УРОК — 2.
1) НАПИСАТЬ УРАВНЕНИЯ:
Получить хлорид алюминия 3 способами.
2) Написать уравнение взаимодействия воды.
С барием.
Оксидом бария.
Оксидом азота 5.
Этиленом.
Этиловым эфиром муравьиной кислоты.
*******
Задачи на смеси
На смесь массой 20 г, состоящую из опилок цинка и меди, подействовали избытком хлороводородной кислоты. В результате реакции выделился водород объемом 2.24 дм3. Рассчитайте массовую долю меди в смеси.
В результате реакции выделился водород объемом 2.24 дм3. Рассчитайте массовую долю меди в смеси.
Смесь меди и цинка обработали хлороводородной кислотой. Масса исходной смеси равна 16.5 г. В результате реакции выделился водород массой 0.2 г. Во сколько раз масса меди больше массы цинка в исходной смеси.
Смесь массой 18 г, состоящую из меди и оксида меди (II), обработали избытком хлороводородной кислоты. После окончания реакции химическое количество хлороводорода уменьшилось на 0.2 моль. Определите массу меди и исходной смеси.
К смеси массой 28г, состоящей из меди и оксида меди (II), добавили избыток соляной кислоты. В результате реакции образовался хлорид меди (II) массой 13.5 г. Определите массовую долю меди в исходной смеси.
Латунь массой 29 г обработали избытком соляной кислоты, в результате чего выделился водород объемом 4.48 дм3. Определите массовую долю меди в латуни.
Смесь медных и цинковых опилок массой 40 г опустили в избыток соляной кислоты. К окончанию химической реакции масса смеси составила 23 г. Какая соль образовалась при этом и чему равна ее масса.
Смесь массой 20 г, состоящую из меди и цинка, обработали избытком серной кислоты. В результате был собран газ объемом 5.6 дм3. Рассчитайте массовые доли металлов в смеси.
Смесь массой 20 г, состоящую из меди и оксида меди (II) обработали избытком серной кислоты. В результате масса нерастворившегося твердого вещества составила 8 г. Рассчитайте массовые доли веществ в исходной смеси.
Смесь натрий-хлорида и натрий-сульфата массой 2 г растворили в воде. К раствору добавили избыток барий-хлорида, в результате чего выпал осадок массой 2.33 г. Определите массовую долю натрий-хлорида в исходной смеси.
На полное растворение смеси массой 18.3 г содержащей оксид цинка и оксид кальция, была затрачена хлороводородная кислота химическим количеством 0. 6 моль. Определите массу оксида кальция в смеси.
6 моль. Определите массу оксида кальция в смеси.
При нагревании смеси гидроксида меди (II) и гидроксида железа (III) массой 20.5 г образовалась смесь оксида меди (II) и оксида железа (III) массой 16 г. Рассчитайте массовую долю веществ в смеси.
В избыток раствора серной кислоты опустили смесь, состоящую из цинка массой 6.5 г и магния массой 2.4 г. Рассчитайте объем выделившегося водорода.
Смесь массой 30.8 г, содержащую хлорид бария и хлорид натрия, растворили в воде. К полученному раствору добавили избыток серной кислоты. В результате реакции образовался осадок массой 23.3 г. Определите массу хлорида натрия в исходной смеси.
При растворении смеси массой 31.2 г, состоящей из оксида натрия и оксида калия, образовался раствор, способный поглотить углекислый газ массой 17.6 г. Рассчитайте массу оксида натрия в исходной смеси и массовую долю оксида калия в исходной смеси.
Смесь, состоящую из бария массой 13. 7 г и оксида бария массой 15.3 г, растворили в воде. Рассчитайте, гидроксид бария, какой массы образовался и газ, какого объема при этом выделился.
7 г и оксида бария массой 15.3 г, растворили в воде. Рассчитайте, гидроксид бария, какой массы образовался и газ, какого объема при этом выделился.
Сплав цинка с магнием массой 4.4 г полностью растворили в избытке соляной кислоты в результате реакции выделился водород объемом 2.24 дм3. Рассчитайте массу магния в сплаве.
Сплав лития и кальция массой 5.4 г растворили в воде. Выделившийся водород сожгли и получили воду массой 3.6 г рассчитайте массу лития в сплаве.
Образец смеси цинковых и алюминиевых стружек общей массой 11 г растворили в избытке щелочи. Массовая доля цинка 30 %. Рассчитайте объем выделившегося водорода.
Навеску массой 16.5 г, состоящую из железа и оксида железа (II)-оксида, растворили в избытке соляной кислоты. В результате реакции выделился водород объемом 3.3 дм3. Определите массовую долю железа в навеске.
Смесь, содержащую калий-карбонат и калий-силикат, растворили в воде. Затем к раствору добавили избыток серной кислоты. В результате реакции выделился газ объемом 4.48 дм3 и выпал осадок массой 3.9 г. Определите массовую долю калий силиката в исходной смеси.
Затем к раствору добавили избыток серной кислоты. В результате реакции выделился газ объемом 4.48 дм3 и выпал осадок массой 3.9 г. Определите массовую долю калий силиката в исходной смеси.
Смесь натрий-карбоната, натрий-сульфата и калий-карбоната общей массой 7.72 г обработали избытком соляной кислоты. Выделился газ объемом 0.896 дм3. Затем к раствору добавили избыток раствора барий-хлорида, выпал осадок массой 4.66 г. Определите массовую долю калий карбоната в смеси.
Смесь стружек цинка и железа обработали избытком раствора гидроксида калия. При этом выделился газ объемом 2.24 дм3. Такой же образец смеси обработали избытком соляной кислоты, выделился газ объемом 8.96 дм3. Определите массу железа в образце.
При прокаливании смеси карбоната и гидрокарбоната натрия массой 40 г образовалось 3.6 г воды. Определите массовую долю карбоната натрия в исходной смеси.
Смесь содержащую фторид калия и бромид калия, растворили в воде. К половине раствора добавили избыток раствора гидроксида кальция. В результате выпал осадок массой 15.6 г. Ко второй половине добавили избыток раствора нитрата серебра. При этом образовался осадок массой 18.8 г. Определите массовую долю фторида калия в исходной смеси.
В хлороводородную кислоту, взятую в избытке, опустили смесь, содержащую цинк массой 6.5 г, железо массой 11.2 г и медь массой 12.8 г. Рассчитайте объем выделившегося при этом водорода.
На смесь цинковых и железных стружек общей массой 23,3г подействовали избытком соляной кислоты. В результате выделилось 8,96 дм3 газа (н.у.). Определите массовую долю железа в исходной смеси.
Смесь железа (II) и алюминия обработали соляной кислотой. Масса полученных хлоридов равна 30,2 г. Такую же навеску смеси обработали разбавленной серной кислотой. Масса полученных сульфатов равна 37,4 г. Найдите массы металлов в смеси.
Найдите массы металлов в смеси.
28. Сплав магния с цинком растворили в избытке соляной кислоты. Выделившийся газ пропустили над нагретым оксидом меди (II), взятым в избытке. При этом масса оксида меди (II) уменьшилась на 0,64 г. 1) Приведите уравнения химических реакций, протекавших в описанном эксперименте.
29. При прокалывании смеси гидроксида меди (II) и железа (III) массой 4,10 г. образовалась смесь оксидов металлов массой 3,20 г. Рассчитайте массовую долю гидроксида железа в исходной смеси.
Для растворения 10,7 г смеси металлического цинка и оксида цинка израсходовали 100 г 10,22 % раствора соляной кислоты. определите массовые доли веществ в исходной смеси.
Смесь алюминия и железа массой 22 г растворили в соляной кислоте, в результате чего выделился газ объемом 17,92 дм3. Вычислите массовую долю железа в смеси.
При взаимодействии смеси цинка и магния массой 8,9 г с соляной кислотой выделился водород химическим количеством 0,2 моль. Определите массу цинка в смеси.
Определите массу цинка в смеси.
При взаимодействии смеси цинка и железа массой 35,4 г с серной кислотой выделился водород химическим количеством 0,6 моль. Определите массовую долю железа в смеси.
При действии серной кислоты на смесь железа и магния массой 5,12г образовалась смесь сульфата железа (II) и сульфата магния массой 20,48г. Рассчитайте массовую долю магния в смеси.
При растворении навески сплава кальция и натрия массой 3,44г в избытке воды выделился водород объемом 1,814 дм3. Рассчитайте массу кальция в сплаве.
На нейтрализацию раствора, содержащего гидроксид натрия и гидроксид калия общей массой 13,6 г, была затрачена серная кислота химическим количеством 0,15 моль. Определите массу гидроксида калия в исходном растворе.
При растворении навески сплава магния и алюминия массой 15,0г в избытке разбавленного раствора серной кислоты выделился газ, объем которого равен 15,68 дм3. рассчитайте массовую долю алюминия в сплаве.
рассчитайте массовую долю алюминия в сплаве.
Смесь массой 6,16 г, содержащую хлорид бария и хлорид натрия, растворили в воде. К полученному раствору добавили избыток серной кислоты. В результате реакции образовался осадок массой 4,66г. Определите массовую долю хлорида натрия в исходной смеси.
На хлорирование 3,0г смеси железа и меди пошло 1,12 л хлора. Найти массовый состав смеси.
При взаимодействии 20 г сплава цинка и магния с избытком разбавленной серной кислоты образовалось 69 г сульфатов. Определите массы металлов в сплаве.
Метод анализа карбоната лития: Pharmaguideline
1. Описание
Белый порошок.
2. Растворимость
Мало растворим в воде, практически не растворим в спирте.
3. Обозначение
А. При увлажнении соляной кислотой придает красный цвет несветящемуся пламени.
B. Растворить 0,2 г в 1 мл соляной кислоты. Выпарить досуха на водяной бане. Остаток растворяют в 3 мл спирта.
C. Внести в пробирку 0,1 г образца. Добавьте 3 мл 2М уксусной кислоты, немедленно закройте пробирку пробкой, снабженной стеклянной пробиркой, изогнутой под двумя прямыми углами. Раствор или суспензия вскипает, выделяя бесцветный газ без запаха. Осторожно нагрейте и соберите газ в 5 мл 0,1 М гидроксида бария. Образуется белый осадок, который растворяется при добавлении избытка 7М соляной кислоты.
4. Внешний вид раствора
Ограничение: Раствор S прозрачный и бесцветный.
Прозрачность раствора
Подготовка образца: (Раствор S) Растворить 10,0 г в 30 мл дистиллированной воды и растворить добавлением 22 мл азотной кислоты. Добавляют разбавленный раствор гидроксида натрия, пока раствор не станет нейтральным, и разбавляют до 100 мл дистиллированной водой.
Стандартный препарат: Растворяют 1,0 г сульфата гидразина в воде, достаточном для получения 100,0 мл, и оставляют на 4-6 часов. Добавьте 25,0 мл этого раствора к раствору, содержащему 2,5 г уротропина в 25,0 мл воды, хорошо перемешайте и оставьте на 24 часа. Для приготовления эталона опалесценции 15,0 мл суспензии разводят водой до 1000,0 мл.
Цвет раствора
Пробоподготовка: Раствор S
Стандартный раствор: Вода
Используя идентичные пробирки из бесцветного прозрачного нейтрального стекла с плоским дном и внутренним диаметром от 15 до 25 мм, сравните 40-мм слой жидкости исследован с 40-мм слоем воды. Исследуйте столбики жидкости в рассеянном дневном свете, рассматривая вертикальные оси трубок на белом фоне.
Исследуйте столбики жидкости в рассеянном дневном свете, рассматривая вертикальные оси трубок на белом фоне.
5. Хлориды
Ограничение:
Процедура: 2,5 мл раствора S, разбавленного водой до 15 мл. К этому раствору прибавляют 1 мл 2М азотной кислоты, смесь вливают однократно в 1 мл раствора азотнокислого серебра и выдерживают 5 мин в защищенном от света месте. При поперечном рассмотрении на черном фоне опалесценция не более интенсивна, чем опалесценция, полученная при обработке смеси 10 мл стандартного раствора хлорида (5 ppm Cl) и 5 мл воды таким же образом.
6. Сульфат
Ограничение: Не более 200 частей на миллион.
Процедура: Подготовка проб: Растворите 1,25 г в 5 мл дистиллированной воды и растворите, добавив 5 мл соляной кислоты. Кипятить 2 мин. Остудить и добавить разбавленный раствор гидроксида натрия до нейтральной реакции.
Добавьте 1 мл 25-процентного раствора хлорида бария к 1,5 мл стандартного раствора сульфата (10 частей на миллион SO4), встряхните и оставьте на 1 минуту. Добавьте 15 мл пробоподготовки и 0,5 мл 5М уксусной кислоты и оставьте на 5 минут. Любая полученная опалесценция не более интенсивна, чем опалесценция стандарта, приготовленного таким же образом, но с использованием 15 мл стандартного раствора сульфата (10 частей на миллион SO4) вместо исследуемого раствора.
7. Мышьяк
Ограничение: Не более 2 частей на миллион.
Процедура: Аппарат состоит из конической колбы вместимостью 100 мл, закрытой притертой пробкой, через которую проходит стеклянная трубка длиной около 200 мм и внутренним диаметром 5 мм. Нижняя часть трубки вытянута до внутреннего диаметра 1,0 мм, а в 15 мм от ее кончика имеется боковое отверстие диаметром 2-3 мм. Когда пробирка находится в пробке, боковое отверстие должно быть не менее чем на 3 мм ниже нижней поверхности пробки. Верхний конец трубки имеет идеально плоскую отшлифованную поверхность под прямым углом к оси трубки. Вторая стеклянная трубка того же внутреннего диаметра и длины 30 мм с такой же плоской поверхностью соприкасается с первой и удерживается на месте двумя спиральными пружинами. В нижнюю трубку вводят 50—60 мг ваты из ацетата свинца, неплотно набитой, или небольшой тампон из ваты и свернутый кусок бумаги из ацетата свинца массой 50—60 мг. Между плоскими поверхностями пробирок поместите диск или небольшой квадрат бумаги из бромистого ртути (II) достаточного размера, чтобы закрыть отверстие пробирки (15 мм × 15 мм).
Верхний конец трубки имеет идеально плоскую отшлифованную поверхность под прямым углом к оси трубки. Вторая стеклянная трубка того же внутреннего диаметра и длины 30 мм с такой же плоской поверхностью соприкасается с первой и удерживается на месте двумя спиральными пружинами. В нижнюю трубку вводят 50—60 мг ваты из ацетата свинца, неплотно набитой, или небольшой тампон из ваты и свернутый кусок бумаги из ацетата свинца массой 50—60 мг. Между плоскими поверхностями пробирок поместите диск или небольшой квадрат бумаги из бромистого ртути (II) достаточного размера, чтобы закрыть отверстие пробирки (15 мм × 15 мм).

8. Кальций
Ограничение: Не более 200 частей на миллион.
Процедура: Подготовка пробы: 5 мл раствора S разбавляют до 15 мл дистиллированной водой.
К 0,2 мл спиртового стандартного раствора кальция (100 ppm Ca) добавить 1 мл раствора оксалата аммония. Через 1 минуту добавить смесь 1 мл 2М уксусной кислоты и 15 мл пробоподготовки и встряхнуть. Через 15 минут любая полученная опалесценция не более интенсивна, чем у стандарта, приготовленного таким же образом с использованием смеси 10 мл стандартного раствора кальция (10 ppm Ca) и 5 мл воды вместо раствора исследуемого вещества. .
9. Тяжелые металлы
Ограничение: Не более 20 частей на миллион.
Процедура: К 12 мл раствора S добавить 2 мл ацетатного буфера рН 3,5, перемешать, добавить к 1,2 мл тиоацетамидного реагента, немедленно перемешать и оставить на 2 минуты. Любой полученный коричневый цвет не более интенсивен, чем тот, который получается при обработке таким же образом смеси 10 мл стандартного раствора свинца (2 ppm Pb) и 2 мл исследуемого раствора. Стандартный раствор имеет слегка коричневый цвет по сравнению с раствором, полученным путем обработки таким же образом смеси 10 мл воды и 2 мл исследуемого раствора.
Стандартный раствор имеет слегка коричневый цвет по сравнению с раствором, полученным путем обработки таким же образом смеси 10 мл воды и 2 мл исследуемого раствора.
10. Железо
Ограничение: Не более 20 частей на миллион.
Процедура: Подготовка к тесту: 5 мл раствора S, разбавленного до 10 мл водой
Перенесите подготовленный образец в цилиндр Несслера. Добавляют 2 мл 20%-ного раствора лимонной кислоты и 0,1 мл меркаптоуксусной кислоты, перемешивают, подщелачивают 10М раствором аммиака, разбавляют до 20 мл водой и оставляют на 5 минут. Любая полученная розовая окраска не более интенсивна, чем при обработке 10 мл стандартного раствора железа (1 ppm Fe) таким же образом.
11. Магний
Ограничение: Не более 150 частей на миллион.
Методика: Подготовка к тесту: Разбавьте 1 мл раствора S водой до 10 мл. 6,7 мл этого раствора разбавляют водой до 10 мл.
К 10 мл испытуемого препарата добавляют 0,1 г тетрабората натрия. При необходимости отрегулируйте рН раствора до 8,8–9,2 с помощью 2М соляной кислоты или 2М гидроксида натрия. Встряхивают с двумя порциями по 5 мл 0,1% раствора 8-гидроксихинолина в хлороформе, встряхивая в течение 1 минуты, оставляя стоять, каждый раз отделяя и отбрасывая органический слой. К водному слою добавляют 0,4 мл н-бутиламина и 0,1 мл триэтаноламина. При необходимости отрегулируйте рН раствора до 10,5–11,5. Добавляют 4 мл раствора 8-гидроксихинолина, встряхивают в течение 1 минуты, дают отстояться и разделяют. Любой цвет, полученный в нижнем слое, не более интенсивен, чем цвет, полученный при обработке смеси 1 мл стандартного раствора магния (10 частей на миллион мг) и 9мл воды таким же образом.
12. Калий
Ограничение: Не более 300 частей на миллион.
Методика: Определено методом атомно-эмиссионной спектрометрии
Тестовый раствор: 1,0 г исследуемого вещества растворяют в 10 мл соляной кислоты и доводят до 50,0 мл водой.
Эталонные растворы: Приготовьте эталонные растворы, используя раствор хлорида калия R, содержащий 500 мг K на миллилитр, разбавленный по мере необходимости. Измерьте интенсивность излучения при 766,5 нм.
13. Натрий
Ограничение: Не более 300 частей на миллион.
Процедура: Определено методом атомно-эмиссионной спектрометрии.
Тестовый раствор: 1,0 г исследуемого вещества растворяют в 10 мл соляной кислоты и доводят до 50,0 мл водой.
Эталонные растворы: Приготовьте эталонные растворы, используя раствор хлорида натрия R, содержащий 500 мг Na на миллилитр, разбавленный по мере необходимости. Измерьте интенсивность излучения на 589нм.
14. Потери при сушке
Ограничение: Не более 1,0%
Процедура: Взвешивание 1000 г вещества в чистой и высушенной предварительно взвешенной бутыли LOD. Закройте пробку и осторожно встряхните, чтобы распределить материал на высоту не более 10 мм. Поместите бутылку LOD в духовку, снимите крышку и оставьте ее также внутри духовки. Высушите образец при 200°С в течение 4 часов. При открытии камеры немедленно закройте бутылку LOD, перенесите ее в эксикатор и доведите до комнатной температуры.
Поместите бутылку LOD в духовку, снимите крышку и оставьте ее также внутри духовки. Высушите образец при 200°С в течение 4 часов. При открытии камеры немедленно закройте бутылку LOD, перенесите ее в эксикатор и доведите до комнатной температуры.
Расчет
W2 – W1
% Потери при сушке = ————— X 100
W2 – W3
Где:
W1 = Вес пустой чистой и высушенной бутылки LOD.
W2 = Вес бутылки LOD + образец.
W3 = Вес бутылки LOD + образец. (После высыхания)
15. Нерастворимые вещества
Ограничение: Масса остатка не более 0,02% от массы взятого карбоната лития.
Процедура: Перенесите образец 10 г в химический стакан на 250 мл, добавьте 50 мл воды, затем медленно добавьте 50 мл 6 н. соляной кислоты. Накройте часовым стеклом и кипятите раствор в течение 1 часа. Фильтруют раствор через высушенный просмоленный фильтрующий тигель, снабженный фильтрующим диском из стекловолокна, используя отсасывание. Промойте фильтр горячей водой до тех пор, пока последняя промывка не будет свободна от хлоридов при тестировании с нитратом серебра. Сушат тигель в печи при 110° в течение 1 часа: масса остатка не более 0,02% от массы взятого карбоната лития.
Промойте фильтр горячей водой до тех пор, пока последняя промывка не будет свободна от хлоридов при тестировании с нитратом серебра. Сушат тигель в печи при 110° в течение 1 часа: масса остатка не более 0,02% от массы взятого карбоната лития.
16. Алюминий
Ограничение: Помутнения или осадка не наблюдается.
Процедура: Растворить образец 500 мг в 10 мл воды путем добавления по каплям при перемешивании соляной кислоты. Раствор кипятят, охлаждают и к 5 мл раствора добавляют 6 н. гидроксида аммония до щелочной реакции: не наблюдается помутнения или осадка.
17. Органические летучие примеси
Ограничение: Хлороформ: не более 60 частей на миллион.
1,4 Диоксан: не более 380 частей на миллион.
Метиленхлорид: не более 600 частей на миллион.
Трихлорэтилен: не более 80 частей на миллион.
Процедура: В следующей процедуре используется газовый хроматограф с программируемой температурой, оснащенный открытой трубчатой колонкой с широким просветом и пламенно-ионизационным детектором.
Стандартный раствор: Приготовьте раствор в воде, не содержащей органические вещества, содержащий в каждом мл. 12,0 мкг метиленхлорида, 7,6 мкг 1,4-диоксана, 1,6 мкг трихлорэтилена и 1,2 мкг хлороформа.
Тестовый раствор: растворить в воде, не содержащей органических веществ, и точно взвесить часть тестируемого материала, чтобы получить конечный раствор с известной концентрацией около 20 мг нерасфасованного фармацевтического химиката на мл.
Хроматографические условия:
Колонка: Аналитическая колонка из плавленого кварца 0,53 мм x 30 м, покрытая химически сшитой неподвижной фазой G27 размером 5 мкм, и защитная колонка с силикагелем 0,53 мм x 5 м, дезактивированная фенилметилом силоксан.
Детектор | Пламенно-ионизационный детектор |
Газ-носитель | Гелий |
Несущий поток | 35 см/с |
Столбец Внутр. | 35°C в течение 5 минут |
Температура колонки. | |
Скорость нагрева-II | 35°C/мин |
Температура колонки. | 260°C в течение 16 минут. |
Температура форсунки. | |
Объем впрыска | |
Введите стандартный раствор и запишите ответы пиков, как указано в процедуре. Подходящей системой является та, которая дает хроматограммы, в которых разрешены все компоненты стандартного раствора, разрешение R между любыми двумя компонентами не менее 1,0. и относительное стандартное отклонение индивидуальных пиковых ответов от повторных инъекций не превышает 15%
и относительное стандартное отклонение индивидуальных пиковых ответов от повторных инъекций не превышает 15%
Процедура: Отдельно введите равные объемы стандартного раствора и тестового раствора в хроматограф, запишите хроматограммы и измерьте отклики пиков.
Идентифицируйте, основываясь на времени удерживания, любые пики, присутствующие на хроматограмме тестового раствора. Идентичность и пик отклика на хроматограмме могут быть установлены как относящиеся к любым органическим летучим примесям, перечисленным в таблице 1, или к некоторым другим летучим примесям, элюирующимся с сопоставимым временем удерживания, с помощью масс-спектрометрических методов относительного содержания или с использованием второго утвержденного столбец, содержащий другую фазу станции.
18. Анализ
Предел: 98,5 % — 100,5 %.
Требуемый реагент
1М соляная кислота
1М гидроксид натрия
Процедура: Растворить 0,500 г в 25,0 мл 1М соляной кислоты.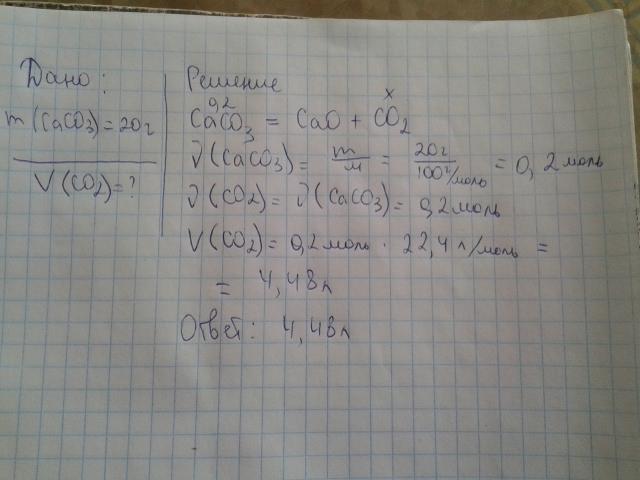 Титруют 1 М раствором гидроксида натрия, используя в качестве индикатора раствор метилового оранжевого. 1 мл 1 М соляной кислоты эквивалентен 36,95 мг Li2CO3.
Титруют 1 М раствором гидроксида натрия, используя в качестве индикатора раствор метилового оранжевого. 1 мл 1 М соляной кислоты эквивалентен 36,95 мг Li2CO3.
Расчет
V x M x F x 100
% Количественное определение на высушенной основе. = ————————
1 x W
Где:
V = потребляемый объем 1 M соляной кислоты
M = молярность 1 M соляной кислоты
F = Коэффициент
W = Масса вещества
Напишите сбалансированное химическое уравнение для реакции, которая происходит …
Последние каналы
- Общая химия
Общая химия
- 5
- Органическая химия
- Аналитическая химия
- GOB Химия
- Биохимия
- Общая биология
- Микробиология
- Микробиология 9034 345
- Генетика
- Клеточная биология
- Алгебра колледжа
- Тригонометрия
- Предварительное исчисление
- Физика
- Микроэкономика
- Макроэкономика
- Финансовый учет
- Психология
- 5
- 5
- 5
- 5 9034
Биология
Математика
Физика
Бизнес
Социальные науки
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.


 Темп
Темп
Leave A Comment