Пробный вариант ЕГЭ по химии 2013 г. | Тест по химии (11 класс) по теме:
На выполнение экзаменационной работы по химии отводится 3 часа (180 минут). Работа состоит из 3 частей и включает 43 задания.
- Часть 1 включает 28 заданий (А1–А28). К каждому заданию даётся 4 варианта ответа, из которых только один правильный. Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов.
- Часть 2 состоит из 10 заданий (В1–В10), на которые надо дать краткий ответ в виде числа или последовательности цифр.
- Часть 3 содержит 5 наиболее сложных заданий по общей, неорганической и органической химии. Задания C1–C5 требуют полного (развёрнутого) ответа.
Все бланки ЕГЭ заполняются яркими чёрными чернилами. Допускается использование гелевой, капиллярной или перьевой ручек. При выполнении заданий Вы можете пользоваться черновиком. Обращаем Ваше внимание, что записи в черновике не будут учитываться при оценке работы.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
При выполнении работы Вы можете пользоваться периодической системой химических элементов Д.И. Менделеева; таблицей растворимости солей, кислот и оснований в воде; электрохимическим рядом напряжений металлов (они прилагаются к тексту работы), а также непрограммируемым калькулятором, который выдается на экзамене.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (A1–A28) поставьте знак «×» в клеточке, номер которой соответствует номеру выбранного вами ответа.
А1 Одинаковое число электронов содержат частицы
1) Al3+ и N3–
2) Ca2+ и Cl+5
3) S0 и Cl–
4) N3– и Р3–
А2 В ряду элементов Na → Mg → Al → Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
А3 Верны ли следующие суждения о соединениях металлов?
А.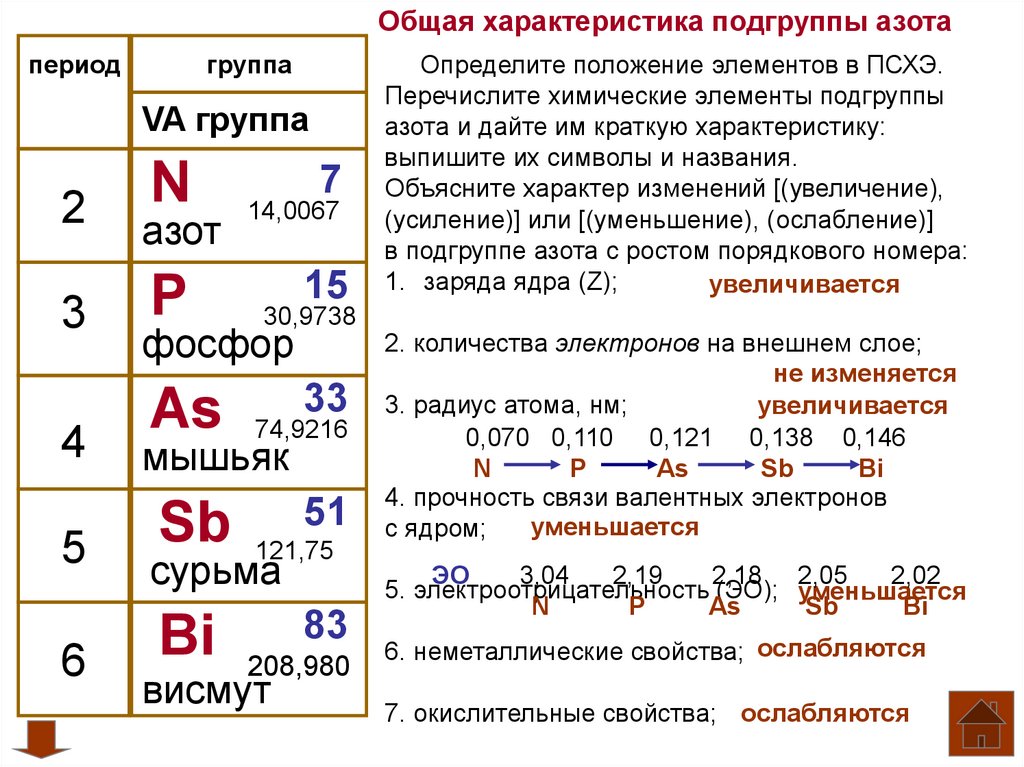 Степень окисления бериллия в высшем оксиде равна +2.
Степень окисления бериллия в высшем оксиде равна +2.
Б. Оснóвные свойства оксида магния выражены сильнее, чем у оксида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А4 Химическая связь в молекулах метана и хлорида кальция соответственно
1) ковалентная полярная и металлическая
2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
А5 Степень окисления хлора равна +7 в соединении
1) Ca(ClO2)2
2) HClO3
3) Nh5Cl
4) HClO4
А6 Молекулярное строение имеет
1) оксид кремния(IV)
2) нитрат бария
3) хлорид натрия
4) оксид углерода(II)
А7 Среди перечисленных веществ:
А) NaHCO3
Б) HCOOK
В) (Nh5)2SO4
Г) KHSO3
Д) Na2HPO4
Е) Na3PO4
кислыми солями являются
1) АГД
2) АВЕ
3) БДE
4) BДЕ
А8 Цинк взаимодействует с раствором
1) CuSO4
2) MgCl2
3) Na2SO4
4) CaCl2
А9 Какой оксид реагирует с раствором НСl, но не реагирует с раствором NaOH?
1) CO
2) SO3
3) P2O5
4) MgO
А10 Гидроксид алюминия реагирует с каждым из двух веществ:
1) KOH и Na2SO4
2) HCl и NaOH
3) CuO и KNO3
4) Fe2O3 и HNO3
А11 Карбонат бария реагирует с раствором каждого из двух веществ:
1) h3SO4 и NaOH
2) NaCl и CuSO4
3) HCl и Ch4COOH
4) NaHCO3 и HNO3
А12 В схеме превращений
веществами «X» и «Y» являются соответственно
1) Cl2 и Cu(OH)2
2) CuCl2(р-р) и NaOH
3) Cl2 и NaOH
4) HCl и h3O
А13 Бутен-1 является структурным изомером
1) бутана
2) циклобутана
3) бутина
4) бутадиена
А14 В отличие от пропана, циклопропан вступает в реакцию
1) дегидрирования
2) гидрирования
3) горения в кислороде
4) этерификации
А15 Свежеосаждённый гидроксид меди(II) реагирует с
1) пропанолом
2) глицерином
3) этиловым спиртом
4) диэтиловым эфиром
А16 Формальдегид не реагирует с
1) Ag2O(Nh4 р-р)
2) O2
3) h3
4) СН3ОСН3
А17 Бутанол-1 образуется в результате взаимодействия
1) бутаналя с водой
2) бутена-1 с водным раствором щёлочи
3) 1-хлорбутана с одным раствором щёлочи
4) 1,2-дихлорбутана с водой
А18 В схеме превращений HC ≡ CH → X → Ch4COOH веществом «Х» является
1) Ch4CHO
2) Ch4 − CO − Ch4
3) Ch4 − Ch3OH
4) Ch4 − Ch4
А19 Взаимодействие оксида углерода(IV) с водой относится к реакциям
1) соединения, необратимым
2) обмена, обратимым
3) соединения, обратимым
4) обмена, необратимым
А20 Скорость реакции азота с водородом понизится при
1) уменьшении температуры
2) увеличении концентрации азота
3) использовании катализатора
4) увеличении давления
А21 Химическое равновесие в системе
сместится в сторону продуктов реакции при
1) повышении давления
2) повышении температуры
3) понижении давления
4) использовании катализатора
А22 Наибольшее количество сульфат-ионов образуется в растворе при диссоциации 1 моль
1) сульфата натрия
2) сульфата меди(II)
3) сульфата алюминия
4) сульфата кальция
А23 Сокращённому ионному уравнению Н+ + ОН– = Н2О соответствует взаимодействие
1) h3SO4 с NaOH
2) Cu(OH)2 с HCl
3) h3SiO3 с KOH
4) HCl с HNO3
А24 Одинаковую реакцию среды имеют растворы хлорида меди(II) и
1) хлорида кальция
2) нитрата натрия
3) сульфата алюминия
4) ацетата натрия
А25 Окислительные свойства серная кислота проявляет в реакции, схема которой:
1) h3SO4 + Nh4 → Nh5HSO4
2) h3SO4 + KOH → K2SO4 + h3O
3) h3SO4 + P → h4PO4 + SO2
4) h3SO4 + P2O5 → HPO3 + SO3
А26 Верны ли следующие суждения о правилах обращения с веществами?
А. Вещества в лаборатории запрещается пробовать на вкус.
Вещества в лаборатории запрещается пробовать на вкус.
Б. С солями ртути следует обращаться особо осторожно ввиду их ядовитости.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А27 Полимер, имеющий формулу
получают из
1) толуола
2) фенола
3) пропилбензола
4) стирола
А28 Согласно термохимическому уравнению реакции
СаО(тв) + Н2О(ж) = Са(ОН)2(тв) + 70 кДж
для получения 15 кДж теплоты потребуется оксид кальция массой
1) 3 г
2) 6 г
3) 12 г
4) 56 г
Часть 2
Ответом к заданиям этой части (В1–В10) является последовательность цифр или число, которые следует записать в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
В заданиях B1–B5 к каждому элементу первого столбца подберите соответствующий элемент второго и запишите в таблицу выбранные цифры под соответствующими буквами, а затем получившуюся последовательность цифр перенесите в бланк ответов № 1 без пробелов, запятых и других дополнительных символов. (Цифры в ответе могут повторяться.)
(Цифры в ответе могут повторяться.)
В1 Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит.
НАЗВАНИЕ СОЕДИНЕНИЯ | ОБЩАЯ ФОРМУЛА |
| 1) Cnh3n+2 |
А) бутин | 2) Cnh3n |
Б) циклогексан | 3) Cnh3n–2 |
В) пропан | 4) Cnh3n–4 |
Г) бутадиен | 5) Cnh3n–6 |
Ответ:
В2 Установите соответствие между уравнением реакции и свойством азота, которое он проявляет в этой реакции.
УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО АЗОТА |
А) Nh5HCO3 = Nh4 + h3O + CO2 | 1) окислитель |
Б) 3СuO + 2Nh4 = N2 + 3Cu + 3h3O | 2) восстановитель |
В) 4Nh4 + 5O2 = 4NО + 6h3O | 3) и окислитель, и восстановитель |
Г) 6Li + N2 = 2Li3N | 4) ни окислитель, ни восстановитель |
Ответ:
В3 Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
ФОРМУЛА СОЛИ | ПРОДУКТ НА КАТОДЕ |
| 1) водород |
А) CuCl2 | 2) кислород |
Б) AgNO3 | 3) металл |
В) K2S | 4) галоген |
Г) NaBr | 5) сера |
| 6) азот |
Ответ:
В4 Установите соответствие между названием соли и её отношением к гидролизу.
НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
А) хлорид аммония | 1) гидролизуется по катиону |
Б) сульфат калия | 2) гидролизуется по аниону |
В) карбонат натрия | 3) гидролиз не происходит |
Г) сульфид алюминия | 4) необратимый гидролиз |
Ответ:
В5 Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА | ФОРМУЛЫ ВЕЩЕСТВ |
А) оксид калия | 1) h3O, MgO, LiOH |
Б) оксид углерода(II) | 2) Fe3O4, h3O, Si |
В) оксид хрома(III) | 3) h3, Fe3O4, O2 |
Г) оксид фосфора(V) | 4) h3O, N2O5, h4PO4 |
| 5) HCl, NaOH, Al |
| 6) Al, N2O5, h3O |
Ответ:
Ответом к заданиям B6–B8 является последовательность из трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания сначала в текст работы, а затем перенесите их в бланк ответов № 1 без пробелов, запятых и других дополнительных символов.
В6 Взаимодействие 2-метилпропана и брома при комнатной температуре на свету
1) относится к реакциям замещения
2) протекает по радикальному механизму
3) приводит к преимущественному образованию 1-бром-2-метилпропана
4) приводит к преимущественному образованию 2-бром-2-метилпропана
5) протекает с разрывом связи C – C
6) является каталитическим процессом
Ответ:___________________________
В7 Фенол реагирует с
1) кислородом
2) бензолом
3) гидроксидом натрия
4) хлороводородом
5) натрием
6) оксидом углерода(IV)
Ответ:___________________________
В8 Метиламин может взаимодействовать с
1) пропаном
2) хлорметаном
3) кислородом
4) гидроксидом натрия
5) хлоридом калия
6) серной кислотой
Ответ:___________________________
Ответом к заданиям B9–B10 является число. Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
В9 Определите массу воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей 70% для получения раствора уксусной кислоты с массовой долей 5%. (Запишите число с точностью до целых.)
Ответ: ___________ г.
В10 Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2, равна __________ г. (Запишите число с точностью до целых.)
Не забудьте перенести все ответы в бланк ответов № 1.
Часть 3
Для записи ответов к заданиям этой части (С1–С5) используйте бланк ответов № 2. Запишите сначала номер задания (С1, С2 и т. д.), а затем его полное решение. Ответы записывайте чётко и разборчиво.
С1 Используя метод электронного баланса, составьте уравнение реакции
Na2SO3 + … + KOH → K2MnO4 + … + h3O
Определите окислитель и восстановитель.
С2 Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
С3 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С4 К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3 ⋅10h3O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
С5 При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Система оценивания экзаменационной работы по химии
ЧАСТЬ 1
За правильный ответ на каждое задание части 1 ставится 1 балл. Если указаны два и более ответов (в их числе правильный), неверный ответ или ответ отсутствует – 0 баллов.
№ задания | Ответ | № задания | Ответ | № задания | Ответ |
А1 | 1 | А11 | 3 | А21 | 2 |
А2 | 1 | А12 | 3 | А22 | 3 |
А3 | 3 | А13 | 2 | А23 | 1 |
А4 | 4 | А14 | 2 | А24 | 3 |
А5 | 4 | А15 | 2 | А25 | 3 |
А6 | 4 | А16 | 4 | А26 | 3 |
А7 | 1 | А17 | 3 | А27 | 4 |
А8 | 1 | А18 | 1 | А28 | 3 |
А9 | 4 | А19 | 3 |
|
|
А10 | 2 | А20 | 1 |
|
|
ЧАСТЬ 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число).
За полный правильный ответ в заданиях В1–В8 ставится 2 балла, если допущена одна ошибка – 1 балл, за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
За правильный ответ в заданиях В9 и В10 ставится 1 балл, за неверный ответ или его отсутствие – 0 баллов.
№ задания | Ответ |
В1 | 3213 |
В2 | 4221 |
В3 | 3311 |
В4 | 1324 |
В5 | 4351 |
В6 | 124 |
В7 | 135 |
В8 | 236 |
В9 | 260 |
В10 | 144 |
ЧАСТЬ 3
КРИТЕРИИ ПРОВЕРКИ И ОЦЕНКИ ВЫПОЛНЕНИЯ ЗАДАНИЙ С РАЗВЁРНУТЫМ ОТВЕТОМ
За выполнение заданий ставится: С1, С5 – от 0 до 3 баллов; С2, С4 – от 0 до 4 баллов; С3 – от 0 до 5 баллов.
С1 Используя метод электронного баланса, составьте уравнение реакции
Na2SO3 + … + KOH → K2MnO4 + … + h3O
Определите окислитель и восстановитель.
Содержание верного ответа и указания по оцениванию | Баллы |
Элементы ответа: 2) указано, что сера в степени окисления +4 является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счёт марганца в степени окисления +7) — окислителем; |
|
Ответ правильный и полный, включает все названные выше элементы | 3 |
В ответе допущена ошибка только в одном из элементов | 2 |
В ответе допущены ошибки в двух элементах | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 3 |
C2 Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия.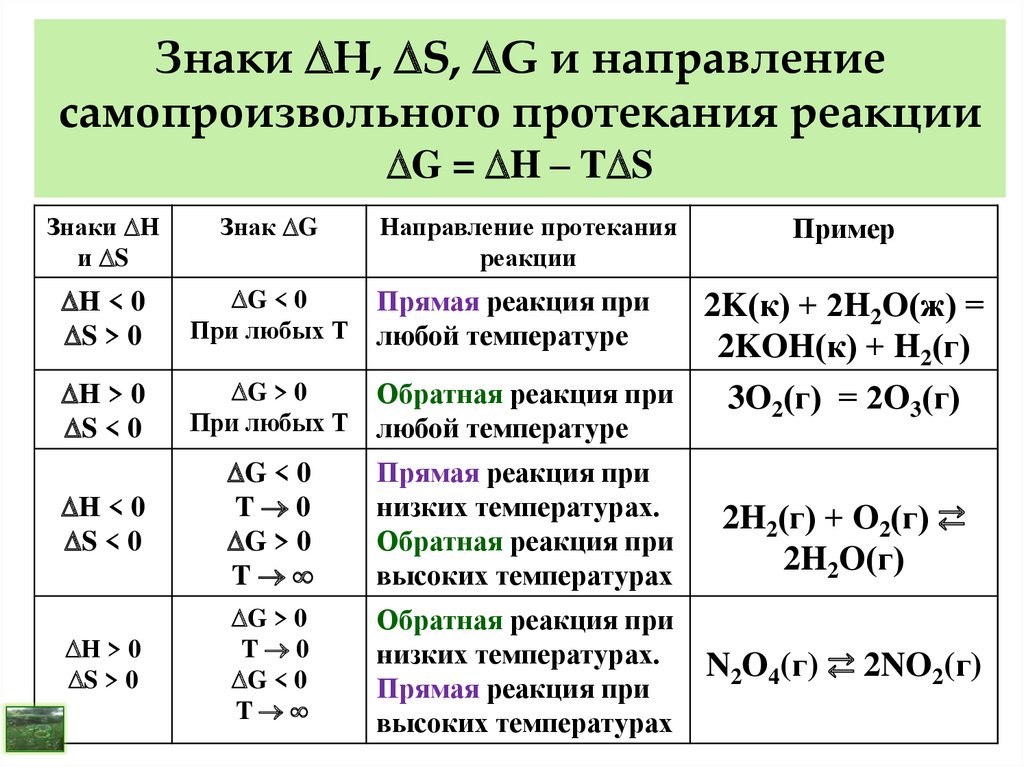
Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Содержание верного ответа и указания по оцениванию | Баллы |
Элементы ответа: |
|
Правильно записаны 4 уравнения реакций | 4 |
Правильно записаны 3 уравнения реакций | 3 |
Правильно записаны 2 уравнения реакций | 2 |
Правильно записано 1 уравнение реакций | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 4 |
C3 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Содержание верного ответа и указания по оцениванию | Баллы |
Элементы ответа: |
|
Ответ правильный и полный, включает все названные выше элементы | 5 |
Правильно записаны 4 уравнения реакций | 4 |
Правильно записаны 3 уравнения реакций | 3 |
Правильно записаны 2 уравнения реакций | 2 |
Правильно записано одно уравнение реакций | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл |
|
С4 К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3 ⋅10h3O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3 ⋅10h3O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа: Возможен также расчёт на основании уравнений реакций образования NaHSO4 и последующего его взаимодействия с Na2CO3. Конечный ответ не изменится; 2) рассчитано общее количество серной кислоты, а также количество 3) рассчитано количество серной кислоты, вступившей в реакцию с гидроксидом натрия и масса гидроксида натрия в исходном растворе: n(h3SO4 ) = 2 − 0,5 =1,5 моль 4) рассчитана массовая доля гидроксида натрия в исходном растворе: |
|
Ответ правильный и полный, включает все названные выше элементы | 4 |
В ответе допущена ошибка в одном из названных выше элементов | 3 |
В ответе допущены ошибки в двух из названных выше элементов | 2 |
В ответе допущены ошибки в трёх из названных выше элементов | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 4 |
* Примечание. В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
С5 При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Содержание верного ответа и указания по оцениванию | Баллы |
Элементы ответа. Сnh3n+1COOH + NaHCO3= Сnh3n+1COONa + h3O + CO2 2) Рассчитана молярная масса кислоты: 3) Установлена молекулярная формула кислоты: Молекулярная формула – C4H9COOH |
|
Ответ правильный и полный, включает все названные выше элементы | 3 |
Правильно записаны первый и второй элементы ответа | 2 |
Правильно записан первый или второй элементы ответа | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 3 |
* Примечание. В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
1. С наибольшей скоростью протекает химическая реакция: 1) Al + H+ → 2) Al3+ + OH- → 3) Al + I2 → 4) Al2O3 + NaOH → 2. Площадь поверхности соприкосновения реагирующих веществ не влияет на скорость химической реакции между: 1) Zn и HCl 2) FeS2 и O2 3) N2 и h3 4) CuO и Al 3. В меньшей степени изменение давления скажется на скорости реакции: 1) Fe + 2HCl(г) → FeCl2 + h3 3) Fe + h3O(г) → FeO + h3 2) 2h3 + O2 → 2h3O 4) Fe + 2HCl(р-р) → FeCl2 + h3 4. 1) концентрации диоксида азота 3) концентрации кислорода 2) давления в системе 4) температуры 5. Для увеличения скорости химической реакции Mg(тв) + 2H+ → Mg2+ + h3(г) необходимо 1) добавить несколько кусочков магния 2) увеличить концентрацию ионов водорода 3) уменьшить температуру 4) увеличить концентрацию ионов магния 6. Скорость химической реакции CuO + 2H+ = Cu2+ + 2h3O не зависит от: 1) степени измельчения оксида меди(II) 2) температуры 3) концентрации ионов меди 4) концентрации ионов водорода 7. С наименьшей скоростью протекает реакция между 1) Fe и О2 2) CaCO3 и HCl(р-р) 3) Na и О2 4) Na2SO4(р-р) и BaCl2(р-р) 8. Не зависит от давления скорость взаимодействия веществ 1) h3(г) и I2(г) 2) Nh4 и HCl(г) 3) Zn(OH)2 и h3SO4 4) Na(ж) и Cl2(г) 9. системе, возрастает при: 1) уменьшении концентрации NO2 2) добавлении оксида азота (IV) 3) увеличении температуры 4) разбавлении газовой смеси азотом
1) уменьшение температуры 2) изменение площади платинового катализатора 3) увеличение концентрации аммиака 4) уменьшение давления 20. Скорость реакции не зависит от давления для веществ 1) Cu и HNO3(разб) 2) h3(г) и Cl2(г) 3) SO2(г) и О2(г) 4) С(кр) и О2(г)
21. Скорость прямой реакции 2SO2(г) + O2 (г) = 2SO3(г) + Q снизится при 1) отравлении катализатора 2) уменьшении концентрации SO3 3) увеличении температуры 4) изменении твердого катализатора – V2O5 22. 1) увеличить концентрацию реагирующих веществ 2) ввести в систему катализатор 3) повысить температуру 4) понизить температуру 23. При обычных условиях с наибольшей скоростью протекает реакция 1) 2Ba + O2 = 2BaO 2) Ba2+ + CO32- = BaCO3 3) Ba + 2H+ = Ba2+ + h3 4) Ba + S = BaS 24. С наибольшей скоростью протекает реакция 1) нейтрализации 2) горения серы в воздухе 3) растворения магния в кислороде 4) восстановления оксида меди(II) водородом 25. При обычных условиях с наименьшей скоростью происходит взаимодействие между 1) Fe и О2 2) Mg и HCl (10%-ный р-р) 3) Cu и О2 4) Zn и HCl (10%-ный р-р)
26. С наибольшей скоростью происходит 1) коррозия металлов на воздухе 2) брожение глюкозы 3) реакция нейтрализации 4) взаимодействия водорода с бромом 27. необходимо 1) увеличить концентрацию CO2 2) уменьшить концентрацию CO2 3) уменьшить температуру 4) увеличить степень измельчения FeO 36. Скорость химической реакции между цинком и кислотой зависит от: 1) понижения давления 2) природы кислоты 3) повышения давления 4) присутствия индикатора 37. С наибольшей скоростью при комнатной температуре протекает реакция взаимодействия: 1) углерода с кислородом 2) железа с раствором уксусной кислоты 3) железа с соляной кислотой 4) растворов гидроксида натрия и серной кислоты 38. Для увеличения скорости химической реакции 2CuS(тв) + 3O2(г) = 2CuO(тв) + 2SO2(г) + 2920 кДж необходимо: 1) увеличить концентрацию SO2 2) уменьшить концентрацию SO2 3) уменьшить температуру 4) увеличить степень измельчения СuS 39. 1) не влияет на ее скорость, так как теплота не может быть участником превращения веществ 2) увеличивает скорость реакции, так как увеличивается число эффективных соударений молекул 3) уменьшает скорость реакции, так как увеличивается число упругих соударений молекул 4) не влияет на скорость реакции, так как в равной мере увеличивается число эффективных и упругих соударений молекул 40. С большей скоростью идет взаимодействие соляной кислоты с: 1) Cu 2) Fe 3) Mg 4) Zn 41. Скорость химической реакции горения угля в кислороде уменьшается при: 1) увеличении концентрации кислорода 2) повышении температуры 3) понижении температуры 4) повышении давления 42. Катализатор AlCl3 увеличивает скорость: 1) любой химической реакции между органическими веществами 2) некоторых химических реакций между органическими веществами 3) любой химической реакции между неорганическими веществами 4) некоторых реакций между неорганическими веществами 52. 1) увеличить концентрацию СО 2) уменьшить концентрацию О2 3) понизить давление 4) понизить температуру 53. Оцените справедливость суждений: А. При нагревании скорость многих химических реакций уменьшается. Б. Катализатор – это вещество, которое увеличивает скорость химической реакции, но само в ней не участвует. 1) Верно только А; 2) верно только Б; 3) верны оба суждения 4) оба суждения неверны. 54. На скорость реакции между уксусной кислотой и этанолом не влияет: 1) катализатор 2) температура проведения реакции 3) концентрация исходных веществ 4) давление 55. С наибольшей скоростью с водородом реагирует 1) Cl2 2) F2 3) S 4) С 56. 1) понижении температуры 2) понижении давления 3) разбавлении смеси воздухом 4) использовании катализатора 57. Скорость реакции угарного газа с кислородом уменьшится при: 1) понижении температуры 3) повышении концентрации кислорода 2) повышении давления 4) понижении концентрации углекислого газа 58. Скорость реакции оксида серы(IV) с кислородом увеличится при: 1) понижении температуры 2). понижении давления 2) разбавлении смеси азотом 4) использовании катализатора 59. Скорость реакции горения метана уменьшится при: 1) понижении температуры 3) повышении концентрации кислорода 2) повышении давления 4) понижении концентрации углекислого газа
60. Скорость реакции оксида углерода(II) с водородом увеличится при: 1) понижении температуры 2). 3) разбавлении смеси азотом 4) понижении концентрации СН3ОН 69. Из приведенных утверждений: А. При увеличении температуры на каждые 100 скорость химической реакции увеличится в 2 – 4 раза. Б. По мере протекания реакции ее скорость уменьшается. 1) верно только А; 2) верно только Б 3) верно А и Б; 4) оба суждения неверны 70. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно 1) разбавить кислоту; 2) измельчить мрамор 3) добавить индикатор; 4) проводить реакцию в атмосфере инертного газа 71. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, — это 1) нейтрализация серной кислоты раствором гидроксида натрия; 2) горение водорода в кислороде; 3) взаимодействие растворов хлорида меди и гидроксида калия; 4) горение алюминия в кислороде | 10. 1) FeO(кр) и Н2(г) 2) 2SO2(г) и O2(г) 3) Н2(г) и I2(г) 4) СaCO3(кр) и HCl(ж) 11. Скорость обратной реакции Nh5Cl (кр) = Nh4(г) + HCl(г) – Q , протекающей в замкнутом сосуде, возрастает при 1) добавлении кристаллов соли 2) понижении температуры 3) повышении концентрации HCl 4) удалении аммиака 12. Скорость реакции не зависит от давления для веществ: 1) h3(г) и Fe2O3(кр) 2) СО(г) и Н2О(г) 3) СаО и HNO3(разб) 4) N2(г) и О2(г) 13. Скорость прямой реакции Ca(HCO3)2(р-р) = CaCO3(кр) + СО2(г) + Н2О(ж) — Q , протекающей в замкнутой системе, возрастает при 1) уменьшении концентрации СО2 2) увеличении концентрации СО2 3) уменьшении температуры 4) увеличении температуры 14. Скорость реакции не зависит от давления для веществ: 1) С(кр) и О2(г) 2) CaO(кр) и С(кр) 3) Nh4(г) и HCl(г) 4) S (кр) и Н2(г) 15. 1) увеличении температуры 2) увеличении концентрации аммиака 3) уменьшении температуры 4) уменьшении концентрации аммиака 16. Скорость реакции не зависит от давления для веществ: 1) Н2(г) и О2(г) 2) Na и Н2О 3) h3(г) и WO3 4) h3O и СО2(г) 17. Скорость прямой реакции О2(г) + 2SO2(г) = 2SO3(г) + Q возрастает при 1) увеличении температуры 2) увеличении концентрации оксида серы(VI) 3) уменьшении температуры 4) уменьшении концентрации оксида серы(VI) 18. Скорость реакции не зависит от давления для веществ 1) С(кр) и СО2(г) 2) h3(г) и Br2(г) 3) NO(г) и O2(г) 4) Hg и HNO3(разб) 19. На скорость прямой реакции N2(г) + 3h3(г) ======= 2Nh4(г) + Q существенно не повлияет 28. Для увеличения скорости химической реакции Zn + 2H+ → Zn2+ + h3 + 154 кДж необходимо 1) уменьшить концентрацию ионов цинка 2) увеличить концентрацию ионов водорода 3) уменьшить температуру 4) увеличить концентрацию ионов цинка 29. Zn(тв) + 2HСl9г) → ZnСl2(тв) + h3(г) + 231 кДж необходимо 1) увеличить концентрацию водорода 2) увеличить количество цинка 3) уменьшить температуру 4) увеличить концентрацию хлороводорода 30. При повышении температуры на 200 скорость реакции, температурный коэффициент которой равен 3, возрастает в 1) 2 раза 2) 3 раза 3) 8 раз 4) 9 раз 31. При обычных условиях с наибольшей скоростью происходит взаимодействие между 1) N2 и О2 2)Fe и S 3) C2H5OH и О2 4) Na2CO3 и HCl 32. Скорость химической реакции характеризует: 1) изменение количеств веществ за единицу времени в единице объема или единице площади 2) время, за которое заканчивается химическая реакция 3) число структурных единиц вещества, вступивших в химическую реакцию 4) движение молекул или ионов реагирующих веществ относительно друг друга 33. 1) массы меди 2) объема кислоты 3) концентрации кислоты 4) объема колбы 34. При увеличении температуры на 300С скорость реакции возрастает в 8 раз. Чему равен температурный коэффициент реакции? 1) 8 2) 2 3) 3 4) 4 35. Для увеличения скорости химической реакции Мg + 2H+ → Mg2+ + h3 + 462 кДж необходимо 1) уменьшить концентрацию ионов водорода 2) увеличить концентрацию ионов водорода 3) понизить температуру 4) повысить давление 43. Скорость прямой реакции N2 + 3h3 → 2Nh4 + Q возрастает при: 1) увеличении концентрации азота 2) уменьшении концентрации азота 3) увеличении концентрации аммиака 4) уменьшении концентрации аммиака 44. Какой из факторов не оказывает влияния на скорость химической реакции в растворах? 1) концентрация веществ 2) использование катализатора 3) использование индикатора 4) объем реакционного сосуда 45. температуры на 200С, если температурный коэффициент 3? 1) в3 раза 2) в 6 раз 3) в 9 раз 4) в 90 раз 46. Скорость химической реакции между металлом и серой не зависит от: 1) температуры 2) площади поверхности соприкосновения веществ 3) давления 4) природы металла 47. Реакция, протекающая на границе раздела двух фаз, называется: 1) гетерогенной 2) окислительно-восстановительной 3) гомогенной 4) каталитической 48. Взаимодействие какой пары веществ будет протекать с большей скоростью, если известно, что концентрация растворов кислот во всех случаях одинакова? 1) Pb и HCl 2) Fe и HCl 3) Zn и HCl 4) Mg и HCl 49. С наименьшей скоростью протекает реакция между: 1) железным гвоздем и 4%-ным раствором CuSO4 2) железной стружкой и 4%-ным раствором CuSO4 3) железным гвоздем и 10%-ным раствором CuSO4 4) железной стружкой и 10%-ным раствором CuSO4 50. вещества А уменьшить в 2 раза? 1) увеличится в 4 раза 2) уменьшится в 2 раза 3) уменьшится в 4 раза 4) увеличится в 2 раза 51. Как повлияет на скорость реакции CaO + CO2 = CaCO3 увеличение давления в 3 раза? 1) скорость увеличится в 3 раза 2) скорость уменьшится в 9 раз 3) скорость уменьшится в 3 раза 4) скорость не изменится 61. Катализатор требуется для проведения реакции 1) бромирования гексана 2) нейтрализации уксусной кислоты 3) бромировании фенола 4) этерификации уксусной кислоты 62. Для увеличения скорости взаимодействия железа с соляной кислотой следует 1) добавить ингибитор; 2) понизить температуру 3) повысить давление; 4) увеличить концентрацию HCl 63. Давление влияет на скорость реакции между 1) гидроксидом цинка и азотной кислотой; 2) цинком и серной кислотой; 3) аммиаком и кислородом; 4) серой и алюминием 64. 1) повысить давление; 2) понизить давление 3) повысить температуру; 4) понизить температуру 65. Скорость реакции Zn + h3SO4 = ZnSO4 + h3 + Q понизится при 1) повышении температуры; 2) понижении давления 3) повышении давления; 4) разбавлении раствора кислоты 66. Скорость реакции 2А + В = А2В при уменьшении концентрации вещества А в 2 раза 1) понизится в 2 раза; 2) повысится в 4 раза 3) понизится в 4 раза; 4) не изменится 67. Оцените справедливость суждений: А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия. Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции. 1) верно только А; 2) верно только Б 3) верны оба суждения; 4) оба суждения неверны 68. 1) понижении температуры; 2) понижении концентрации Nh4 3) разбавлении смеси аргоном; 4) использовании катализатора Ответы на вопросы
|
Процесс Габера — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1344
- Джим Кларк
- Школа Труро в Корнуолле
Процесс Габера используется при производстве аммиака из азота и водорода, а затем следует объяснение причин условий, используемых в процессе. В процессе азот из воздуха сочетается с водородом, полученным в основном из природного газа (метана), в аммиак. Реакция обратима, а образование аммиака экзотермическое.
В процессе азот из воздуха сочетается с водородом, полученным в основном из природного газа (метана), в аммиак. Реакция обратима, а образование аммиака экзотермическое.
\[\ce{ N2(g) + 3h3(g) <=> 2Nh4 (g)} \label{eq1}\]
с \(ΔH=-92,4 кДж/моль\).
Блок-схема процесса Габера выглядит следующим образом:
Общие условия процесса
- Катализатор: Катализатор на самом деле немного сложнее, чем чистое железо. В качестве промоутера в него добавлен гидроксид калия — вещество, повышающее его эффективность.
- Давление : Давление варьируется от одного завода к другому, но всегда высокое. Вы не ошибетесь, если на экзамене получите 200 атмосфер.
- Рециркуляция: При каждом прохождении газов через реактор только около 15% азота и водорода превращается в аммиак. (Эта цифра также варьируется от завода к заводу.) При непрерывной переработке непрореагировавшего азота и водорода общая конверсия составляет около 98%.

Состав
Соотношение азота и водорода: Смесь азота и водорода, поступающая в реактор, находится в соотношении 1 объем азота к 3 объемам водорода. Закон Авогадро гласит, что равные объемы газов при одинаковых температуре и давлении содержат одинаковое количество молекул. Это означает, что газы поступают в реактор в соотношении 1 молекула азота на 3 молекулы водорода. Это пропорция, требуемая уравнением.
В некоторых реакциях вы можете использовать избыток одного из реагентов. Вы бы поступили так, если бы особенно важно израсходовать как можно больше другого реагента — если бы, например, он был намного дороже. Это не применимо в данном случае. Всегда есть обратная сторона использования чего-либо, кроме пропорций уравнения. Если у вас есть избыток одного реагента, через реактор будут проходить молекулы, которые не смогут реагировать, потому что им не с чем реагировать. При этом расходуется пространство реактора, особенно пространство на поверхности катализатора.
Температура
- Равновесие : Вам необходимо сдвинуть положение равновесия (уравнение \(\ref{eq1}\)) как можно дальше вправо, чтобы произвести максимально возможное количество аммиака в равновесная смесь. Прямая реакция является экзотермической с \(ΔH=-92,4 кДж/моль\). Согласно принципу Ле Шателье, этому будет способствовать понижение температуры. Система отреагирует изменением положения равновесия, чтобы противодействовать этому, другими словами, производством большего количества тепла. Чтобы получить как можно больше аммиака в равновесной смеси, нужна как можно более низкая температура. Однако 400 — 450°С — это не низкая температура!
- Соображения по скорости : Чем ниже температура, которую вы используете, тем медленнее становится реакция. Производитель старается производить как можно больше аммиака в сутки. Нет смысла пытаться получить равновесную смесь, содержащую очень высокую долю аммиака, если для достижения равновесия реакции требуется несколько лет.
 Вам нужно, чтобы газы достигли равновесия за очень короткое время, пока они будут в контакте с катализатором в реакторе.
Вам нужно, чтобы газы достигли равновесия за очень короткое время, пока они будут в контакте с катализатором в реакторе. - Компромисс: 400 — 450°C является компромиссной температурой, обеспечивающей достаточно высокую долю аммиака в равновесной смеси (даже если она составляет всего 15%), но за очень короткое время.
Давление
Обратите внимание, что в левой части уравнения \(\ref{eq1}\) 4 молекулы, а в правой только 2. Согласно принципу Ле Шателье, если вы увеличите давление, система отреагирует, отдавая предпочтение реакции, которая производит меньше молекул. Это приведет к тому, что давление снова упадет. Чтобы получить как можно больше аммиака в равновесной смеси, нужно как можно более высокое давление. 200 атмосфер — это высокое давление, но не невероятно высокое.
- Оценки: Повышение давления сближает молекулы. В данном конкретном случае это увеличит их шансы на попадание и прилипание к поверхности катализатора, где они могут реагировать.
 Чем выше давление, тем лучше с точки зрения скорости газовой реакции.
Чем выше давление, тем лучше с точки зрения скорости газовой реакции. - Экономические соображения: Очень высокое давление очень дорого производить по двум причинам. Вы должны построить чрезвычайно прочные трубы и защитную оболочку, чтобы выдержать очень высокое давление. Это увеличивает ваши капитальные затраты при строительстве завода. Высокое давление требует больших затрат на производство и обслуживание. Это означает, что эксплуатационные расходы вашего завода очень высоки.
- Компромисс : 200 атмосфер – компромиссное давление, выбранное по экономическим соображениям. Если используемое давление слишком высокое, затраты на его создание превышают цену, которую вы можете получить за дополнительный произведенный аммиак.
Катализатор
- Вопросы равновесия: Катализатор не оказывает никакого влияния на положение равновесия. Добавление катализатора не приводит к увеличению процентного содержания аммиака в равновесной смеси.
 Его единственная функция — ускорить реакцию.
Его единственная функция — ускорить реакцию. - Соображения скорости: В отсутствие катализатора реакция настолько медленная, что практически никакая реакция не происходит в любое разумное время. Катализатор обеспечивает достаточно быстрое протекание реакции для установления динамического равновесия за очень короткое время, в течение которого газы фактически находятся в реакторе.
- Отделение аммиака : Когда газы покидают реактор, они горячие и находятся под очень высоким давлением. Аммиак легко сжижается под давлением, если он не слишком горячий, и поэтому температура смеси снижается достаточно, чтобы аммиак превратился в жидкость. Азот и водород остаются в виде газов даже при таком высоком давлении и могут быть переработаны.
При смешивании одной части аммиака с девятью частями воздуха с использованием катализатора аммиак окисляется до азотной кислоты .
\[\begin{align*} \ce{4 NH_3} + \ce{5 O_2} &\rightarrow \ce{4 NO} + \ce{6 H_2O} \\[4pt] \ce{2 NO} + \ce{O_2} &\rightarrow \ce{2 NO_2} \\[4pt] \ce{2 NO_2} + \ce{2 H_2O} &\rightarrow \ce{2 HNO_3} + \ce{H_2} \end {выравнивание*}\]
Эта страница под названием «Процесс Хабера» публикуется под лицензией CC BY-NC 4. 0 и была создана, изменена и/или курирована Джимом Кларком с помощью исходного контента, отредактированного в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
0 и была создана, изменена и/или курирована Джимом Кларком с помощью исходного контента, отредактированного в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Процесс Хабера
- источник@https://www.chemguide.co.uk/physical/equilibria/haber.html
Вопрос Видео: Описание обратимой реакции в процессе Габера
Стенограмма видео
Процесс Габера включает обратимую реакцию азота и водорода. Приведите сбалансированное химическое уравнение этой реакции.
В закрытой системе, подобной той, что используется в процессе Габера, обратимая реакция приведет к равновесию. Это означает, что химическое уравнение должно включать стрелку равновесия. Нашими реагентами являются газообразный азот и водород, состоящие из двухатомных молекул N2 и h3. Итак, у нас есть начало нашего уравнения, N2 плюс h3. Так что же это за продукт? Процесс Габера был изобретен для производства аммиака в больших количествах. Таким образом, продуктом этой равновесной реакции является Nh4. Теперь, когда у нас есть реагенты и продукты, мы можем перейти к балансировке.
Таким образом, продуктом этой равновесной реакции является Nh4. Теперь, когда у нас есть реагенты и продукты, мы можем перейти к балансировке.
Начнем с того, что у нас есть два атома азота со стороны реагентов и один со стороны продуктов, а у водорода два слева и три справа. Мы могли бы сначала выбрать любой элемент для балансировки, но проще всего начать с азота. Это приводит нас к двум атомам азота с каждой стороны и шести атомам водорода со стороны продуктов. Утроение количества водорода на стороне реагентов дает нам шесть атомов водорода с обеих сторон, и теперь реакция уравновешена. Если бы вы хотели, вы могли бы зафиксировать количество аммиака, вдвое уменьшить количество азота и использовать полторы молекулы водорода. В любом случае правильно, но первый способ имеет круглые числа, поэтому его легко читать.
Почему эту реакцию называют обратимой?
Давайте вернемся к уравнению, которое мы вычислили в части (а). Стрелка равновесия в уравнении указывает на то, что и прямая, и обратная реакции протекают одновременно.
Вопрос в том, почему эту реакцию называют обратимой. Ответ заключается в том, что часть продукта, аммиак, в условиях реакции снова превращается в исходные реагенты, азот и водород. Поскольку обратная реакция протекает при тех же условиях, что и прямая, реакция обратима. Одна из ключевых частей этого ответа заключается в том, что он должен быть в условиях реакции. Возьмем, к примеру, необратимую реакцию магния и кислорода при сжигании магния на воздухе. Можно было бы изменить условия реакции и электролизовать оксид магния обратно до составляющих его элементов. Но это не сделало бы реакцию обратимой, поскольку условия реакции были бы другими.
Если реакцию проводят при более высоком давлении газа, что происходит со скоростью реакции и процентным выходом?
Термин «скорость реакции» может относиться как к прямой, так и к обратной реакции, тогда как процентный выход относится исключительно к прямой реакции. Давайте посмотрим на наше уравнение и снова разложим его на прямую и обратную реакции. Здесь прямая и обратная реакции выражены отдельно. Поскольку мы рассматриваем вопрос о давлении газа, важно, чтобы мы включили государственные символы. В условиях процесса Габера аммиак является газом, наряду с азотом и водородом.
Давайте посмотрим на наше уравнение и снова разложим его на прямую и обратную реакции. Здесь прямая и обратная реакции выражены отдельно. Поскольку мы рассматриваем вопрос о давлении газа, важно, чтобы мы включили государственные символы. В условиях процесса Габера аммиак является газом, наряду с азотом и водородом.
Поскольку этот вопрос требует от нас предсказать, что произойдет, когда условия равновесия изменятся, нам нужно будет использовать принцип Ле Шателье. Принцип Ле Шателье гласит, что для динамического равновесия, если условия изменяются, положение равновесия смещается, чтобы противодействовать изменению. Вообще говоря, положение равновесия отражает относительные концентрации продуктов и реагентов. Что часто происходит с равновесием, так это то, что либо прямая, либо обратная реакция благоприятствует изменению. А это вызывает изменение концентрации продуктов и реагентов.
Итак, вопрос: «Что произойдет со скоростью реакции и процентным выходом, когда мы сожмем газ?» Когда мы сжимаем газ, его частицы сближаются. Это означает, что будет больше столкновений, и скорость реакций увеличится. Это касается как прямой, так и обратной реакции. Так, для процесса Габера более высокое давление газа приведет к увеличению скорости реакции.
Это означает, что будет больше столкновений, и скорость реакций увеличится. Это касается как прямой, так и обратной реакции. Так, для процесса Габера более высокое давление газа приведет к увеличению скорости реакции.
А как насчет процентной доходности? Процентный выход реакции рассчитывается на основе количества полученного продукта. И это равно фактическому количеству продукта, деленному на теоретическое максимальное количество, умноженному на 100 процентов. Фактическая сумма, которую мы получаем от равновесия в процессе Габера, определяется положением равновесия. Мы можем вернуться к принципу Ле Шателье, чтобы увидеть, какое влияние оказывает повышение давления газа на положение равновесия.
Чтобы добиться прогресса, мы можем вернуться к закону идеального газа, который показывает нам зависимость между количеством вещества в газе и его давлением. Если объем и температура газа остаются постоянными, то давление и количество газа пропорциональны друг другу. Это означает, что чем меньше молекул, тем ниже давление. В прямой реакции процесса Габера четыре молекулы превращаются в две, следовательно, давление падает, а в обратной реакции две молекулы становятся четырьмя. Так давление поднимается.
В прямой реакции процесса Габера четыре молекулы превращаются в две, следовательно, давление падает, а в обратной реакции две молекулы становятся четырьмя. Так давление поднимается.
Принцип Ле Шателье гласит, что положение равновесия сместится, чтобы противодействовать изменению. Следовательно, увеличение давления газа будет способствовать протеканию прямой реакции. Более быстрая прямая реакция увеличит выход. Итак, мы продемонстрировали, что увеличение давления газа в процессе Габера увеличивает скорость реакции и выход. Итак, ответ на вопрос: «Если реакцию проводить при более высоком давлении газа, что происходит со скоростью реакции и процентным выходом?» заключается в том, что скорость реакции и процентный выход увеличиваются.
Если реакцию проводят при более низкой температуре, что происходит со скоростью реакции и процентным выходом?
Я сохранил часть информации из предыдущего вопроса, потому что она относится и к этому вопросу. Здесь изменением наших равновесных условий является более низкая температура. Но мы снова смотрим на скорость реакции и процентный выход. Первая часть, влияние более низкой температуры на скорость реакции, проста. Скорость реакции примерно пропорциональна температуре. Это связано с тем, что чем больше энергии имеют молекулы газа, тем больше вероятность того, что они вступят в реакцию. Таким образом, чем ниже температура и меньше энергии у этих молекул, тем ниже скорость реакции. Следовательно, понижение температуры уменьшит скорость реакции.
Но мы снова смотрим на скорость реакции и процентный выход. Первая часть, влияние более низкой температуры на скорость реакции, проста. Скорость реакции примерно пропорциональна температуре. Это связано с тем, что чем больше энергии имеют молекулы газа, тем больше вероятность того, что они вступят в реакцию. Таким образом, чем ниже температура и меньше энергии у этих молекул, тем ниже скорость реакции. Следовательно, понижение температуры уменьшит скорость реакции.
Что касается выхода в процентах, мы можем полагаться на тот факт, что снижение температуры реакции будет благоприятствовать той реакции, которая выделяет тепло. Это приведет к смещению положения равновесия и повлияет на процент выхода. Для ответа на этот вопрос вам нужно помнить, что изменение энтальпии прямой реакции отрицательно, минус 92 кДж на моль. Это означает, что на каждый потребленный моль азота, каждые три потребленных моля водорода или каждые два моля образованного аммиака в окружающую среду выделяется 92 килоджоуля энергии.

 Скорость химической реакции 2NO2(г) = 2NO(г) +O2(г) не зависит от изменения
Скорость химической реакции 2NO2(г) = 2NO(г) +O2(г) не зависит от изменения Скорость прямой реакции 2NO(г) + O2 (г) = 2NO2(г) + Q , протекающей в замкнутой
Скорость прямой реакции 2NO(г) + O2 (г) = 2NO2(г) + Q , протекающей в замкнутой Для уменьшения скорости химической реакции необходимо
Для уменьшения скорости химической реакции необходимо Для увеличения скорости химической реакции FeO + CO → Fe + CO2 + 17 кДж
Для увеличения скорости химической реакции FeO + CO → Fe + CO2 + 17 кДж Увеличение температуры поведения реакции:
Увеличение температуры поведения реакции: Для увеличения скорости реакции 2СО + О2 = 2 СО2 + Q необходимо:
Для увеличения скорости реакции 2СО + О2 = 2 СО2 + Q необходимо: Скорость реакции водорода с азотом увеличится при:
Скорость реакции водорода с азотом увеличится при: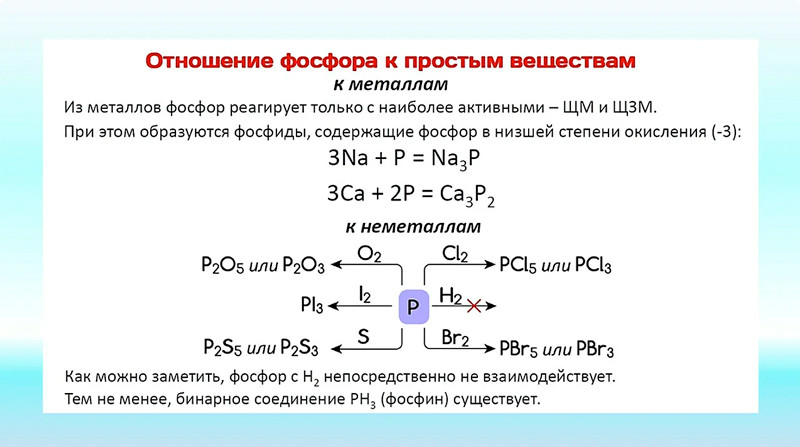 повышении давления
повышении давления Повышение давления не повлияет на скорость реакции
Повышение давления не повлияет на скорость реакции Скорость прямой реакции N2(г) + 3h3(г) = 2Nh4(г) + Q возрастает при
Скорость прямой реакции N2(г) + 3h3(г) = 2Nh4(г) + Q возрастает при Для увеличения скорости химической реакции
Для увеличения скорости химической реакции  Скорость химической реакции между медью и азотной кислотой зависит от:
Скорость химической реакции между медью и азотной кислотой зависит от: Во сколько раз увеличивается скорость химической реакции при повышении
Во сколько раз увеличивается скорость химической реакции при повышении Во сколько раз изменится скорость реакции 2А + В = 2С, если концентрацию
Во сколько раз изменится скорость реакции 2А + В = 2С, если концентрацию Реакцию, уравнение которой FeO + 2H+ = Fe2+ + h3O + Q можно ускорить, если
Реакцию, уравнение которой FeO + 2H+ = Fe2+ + h3O + Q можно ускорить, если Скорость реакции N2 + 3h3 = 2Nh4 + Q увеличится при:
Скорость реакции N2 + 3h3 = 2Nh4 + Q увеличится при:
 Вам нужно, чтобы газы достигли равновесия за очень короткое время, пока они будут в контакте с катализатором в реакторе.
Вам нужно, чтобы газы достигли равновесия за очень короткое время, пока они будут в контакте с катализатором в реакторе. Чем выше давление, тем лучше с точки зрения скорости газовой реакции.
Чем выше давление, тем лучше с точки зрения скорости газовой реакции. Его единственная функция — ускорить реакцию.
Его единственная функция — ускорить реакцию.
Leave A Comment