Скорость химической реакции
Дидактический материал
Скорость химической реакции и ее зависимость от различных факторов
1. При обычных условиях с наименьшей скоростью происходит взаимодействие между
1) железом и кислородом
2) магнием и 10%-ным раствором соляной кислоты
3) медью и кислородом
4) цинком и 10%-ным раствором
2. Для увеличения скорости химической реакции
2СО+O2=2CO + Q необходимо
1) увеличить концентрацию оксида углерода (II)
2) уменьшить концентрацию кислорода
3) понизить давление
4) понизить температуру
3. При комнатной температуре с наибольшей скоростью протекает реакция между
1) Zn и HCl (1 % р-р)
2) Zn и HCl (30 % р-р)
3) Zn и HCl (10 % р-р)
4) ZnCl2 (р-р) и AgNO3 (р-р)
4. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
1) концентрация кислоты
2) измельчение железа
3) температура реакции
4) увеличение давления
5. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
FeO(тв) + CO(г) → Fe(тв) + СO2 (г) + 17 кДж
необходимо
1) увеличить концентрацию СО2
2) уменьшить концентрацию СО2
3) уменьшить температуру
4) увеличить степень измельчения FeO
6. Для увеличения скорости химической реакции
2CuS(тв) + 3О2(г) = 2CuO(тв) + 2SO2 (г) + 2920 кДж
необходимо
1) увеличить концентрацию SО2
2) уменьшить концентрацию SО2
3) уменьшить температуру
4) увеличить степень измельчения CuS
7. Для увеличения скорости химической реакции
Zn(тв) + 2Н+ → Zn2+ + H2 (г) + 154 кДж
необходимо
1) уменьшить концентрацию ионов цинка
2) увеличить концентрацию ионов водорода
3) уменьшить температуру
4) увеличить концентрацию ионов цинка
8. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
Mg(тв) + 2Н+ → Mg2+ + H2(г)
необходимо
1) уменьшить концентрацию ионов водорода
2) увеличить концентрацию ионов водорода
3) понизить температуру
4) повысить давление
9. Для увеличения скорости химической реакции
Zn(тв) + 2НСl(г) = ZnCl2(тв) + H2(г) + 231 кДж
необходимо
1) увеличить концентрацию водорода
2) увеличить количество цинка
3) уменьшить температуру
4) увеличить концентрацию хлороводорода
10. Для увеличения скорости взаимодействия железа с хлороводородной кислотой следует
1) добавить ингибитор
2) понизить температуру
3) повысить давление
4) увеличить концентрацию соляной кислоты HCl
11. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно
1) разбавить кислоту
2) измельчить мрамор
3) добавить индикатор
4) проводить реакцию в атмосфере инертного газа
12. С наибольшей скоростью при обычных условиях взаимодействуют
С наибольшей скоростью при обычных условиях взаимодействуют
1) азот и водород
2) магний и вода
3) раствор гидроксида натрия и соляная кислота
4) сера и железо
13. С наибольшей скоростью при обычных условиях взаимодействуют
1) цинк и соляная кислота
2) натрий и вода
3) магний и вода
4) свинец и соляная кислота
14. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других — уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты столкновений частиц.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. C наибольшей скоростью реагирует с водородом
1) Сl2
2) F2
3) S
4) C
16. Оцените правильность утверждений.
А. Катализатор — это вещество, которое увеличивает скорость химической реакции, но при этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Для увеличения скорости реакции водорода с азотом
1) охлаждают азотоводородную смесь
2) снижают давление в системе
3) используют катализатор
4) используют циркуляцию азотоводородной смеси
18. При повышении давления увеличивается скорость реакции
1) кислорода с сернистым газом
2) цинка с серной кислотой
3) серы с железом
4) гидроксида натрия с хлоридом меди (II)
19. Катализатор требуется для проведения реакции
1) хлорирования алканов
2) нейтрализации фосфорной кислоты
3) пиролиза метана
4) этерификации уксусной кислоты
20. С наибольшей скоростью при обычных условиях взаимодействуют
1) аммиак и хлороводород
2) азот и водород
3) азот и кислород
4) сернистый газ и кислород
21. Оцените правильность утверждений.
Оцените правильность утверждений.
А. При нагревании скорость многих реакций уменьшается.
Б. Катализатор — это вещество, которое увеличивает скорость химической реакции, но само в ней не расходуется
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
22. Давление влияет на скорость реакции между
1) гидроксидом цинка и азотной кислотой
2) цинком и серной кислотой
3) аммиаком и кислородом
4) серой и алюминием
23. Реакцию, уравнение которой
FeO + 2H+ = Fe2+ + H2O + Q,
можно ускорить, если
1) повысить давление
2) понизить давление
3) повысить температуру
4) понизить температуру
24. Скорость реакции
Zn + H2SO4 = ZnSO4 + H2 + Q
понизится при
1) повышении температуры
2) понижении давления
3) повышении давления
4) разбавлении раствора кислоты
25. Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
1) | Na, Ca, Zn, Cr, Cu |
2) | Mg, Na, Ni, Zn, Cu |
3) | Na, Ba, Fe, Cu, Zn |
4) | Ba, Na, Zn, Cu, Fe |
26. Оцените справедливость суждений.
А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия..
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Скорость реакции
N2 + 3H2 = 2NH3 + Q
увеличится при
1) понижении температуры
2) понижении концентрации NH3
3) разбавление смеси аргоном
4) использовании катализатора
28. Какой металл реагирует с серной кислотой быстрее других?
Какой металл реагирует с серной кислотой быстрее других?
1) | Zn |
2) | Mg |
3) | Fe |
4) | Pb |
29. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, — это
1) нейтрализация серной кислоты раствором гидроксида натрия
2) горение водорода в кислороде
3) взаимодействие растворов хлорида меди и гидроксида калия
4) горение алюминия в кислороде
Ответ: 1-3, 2-1, 3-4, 4-4, 5-4, 6-4, 7-2, 8-2, 9-4, 10-4, 11-2, 12-3, 14-2, 14-2, 15-2, 16-3, 17-3, 18-1, 19-4, 20-1, 21-2, 22-3, 23-3, 25-44, 25-1, 26-3, 27-4, 28-2, 29-4.
Новости школы -Подготовка к ЕГЭ по химии. Часть А-4
Классификация химических реакций.
Скорость химической реакции
Обязательный минимум знаний
Схема 5
Классификация химических реакций
Схема 6
Классификация реакций в органической химии
гидрирования (+ Н2)
галогенирования (+ Г2)
гидрогалогенирования (+ НГ)
· Реакции присоединения
гидратации (+Н2О)
полимеризации
дегидрирования ( — Н2)
дегалогенирования (- Г2)
дегидрогалогенирования ( — НГ)
· Реакции отщепления
дегидратации ( — Н2О)
деполимеризации
· Реакции замещения
· Реакции изомеризации
Частные случаи органических реакций:
· этерификации (кислота + спирт ↔ сложный эфир + вода) и обратный процесс – гидролиз (щелочной гидролиз – омыление),
· поликонденсации (образуются полимер и низкомолекулярный продукт, часто вода)
· ОВР
Технологические процессы, часто отождествляемые с типом химической реакции:
· пиролиз (разложение органического вещества без доступа воздуха)
· крекинг (разрыв углеродной цепи под действием высокой температуры)
· конверсия (разложение органического вещества под действием перегретого водяного пара)
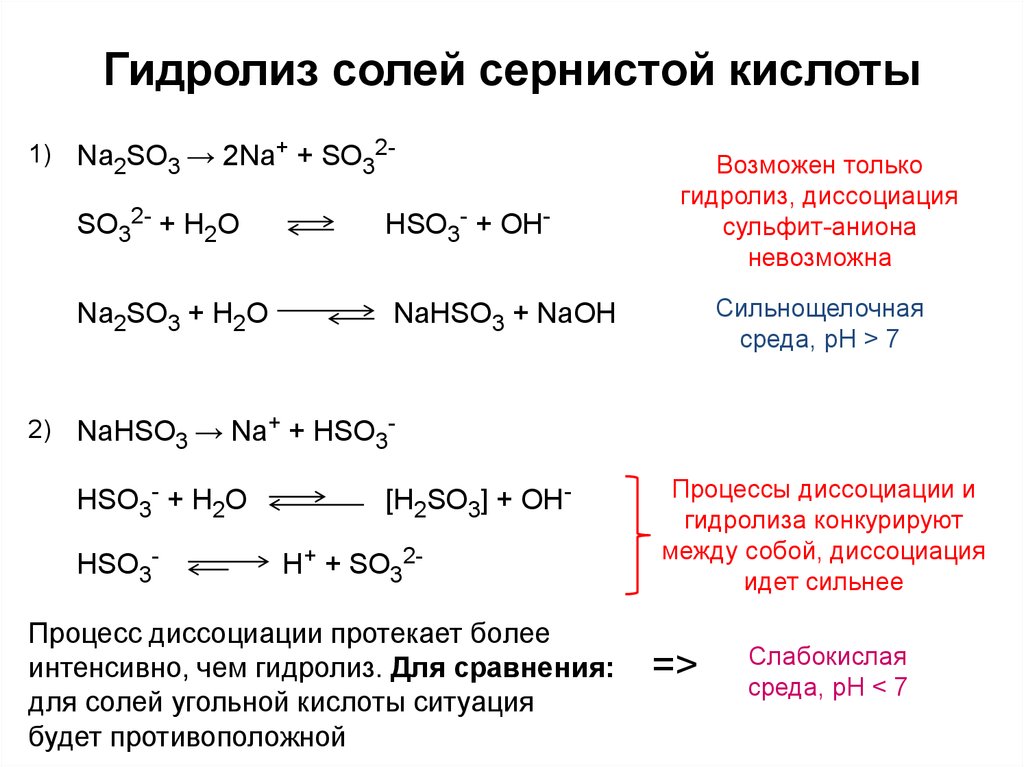
Скорость химической реакции
Скорость химической реакции – изменение концентрации реагирующих веществ в единицу времени:
Δ С
v = —————— (моль/л∙с)
Δ t
Таблица 5
Факторы, влияющие на скорость химической реакции
Примечание. Для гетерогенных реакций скорость реакции зависит и от площади поверхности соприкосновения реагирующих веществ (для ее увеличения твердые вещества измельчают, используют «кипящий слой» и др.)
Для гетерогенных реакций скорость реакции зависит и от площади поверхности соприкосновения реагирующих веществ (для ее увеличения твердые вещества измельчают, используют «кипящий слой» и др.)
Катализаторы:
· изменяют скорость химической реакции или направление ее протекания,
· по окончании реакции остаются неизмененными качественно и количественно,
· не смещают химическое равновесие (в равной мере изменяют скорость как прямой, так и обратной реакций).
Биологические катализаторы белковой природы называются ферментами (энзимами).
Примеры тестовых заданий и
рекомендации к их выполнению
1. Взаимодействием растворов сульфата калия и хлорида бария относится к реакциям
1) замещения 2) нейтрализации 3) ионного обмена 4) соединения
Так как исходные вещества являются электролитами, то определить верный ответ несложно. Ответ 3.
Ответ 3.
2. Взаимодействие кислоты и щелочи относится к реакциям
1) соединения, окислительно-восстановительным
2) обмена, нейтрализации
3) обмена, этерификации
4) обмена, эндотермическим
Сразу исключается ответ 1. Следовательно, взаимодействие кислоты и щелочи, как двух сложных веществ, относится к реакциям обмена. Остальные ответы можно даже не анализировать в целях экономии времени. Ответ 2.
3. Взаимодействие между глицерином и высшими карбоновыми кислотами относится к реакциям
1) изомеризации
2) дегидратации
3) нейтрализации
4) этерификации
Сразу исключается ответ 1, так как в условии даны два исходных вещества. Реакция дегидратации (отщепления воды) по этой же причине не удовлетворяет требованиям задания. Реакция нейтрализации – реакция между сильной кислотой и щелочью – ни одно, ни второе исходные вещества не являются таковыми. Ответ 4.
Ответ 4.
4. Соляная кислота вступает в реакцию замещения с
1) гидроксидом меди (II)
2) медью
3) оксидом железа (II)
4) железом
Элементарные сведения о реакции замещения как реакции простого и сложного веществ позволят исключить из числа возможных ответы 1 и 3, т.к. в них предложены сложные вещества. Ответ 2 неверен по своей химической сути – медь в ряду напряжений металлов находится после водорода. Ответ 4.
5. Реакцией замещения является взаимодействие
1) метана с бромом
2) этилена с бромом
3) ацетилена с кислородом
4) пропилена с водой
Для алканов (предельных углеводородов), родоначальником которых является метан, наиболее характерны реакции замещения с галогенами. Верный ответ – 1. Остальные ответы можно не рассматривать. Ответ 1.
6. В неорганической химии к окислительно-восстановительным реакциям относятся
В неорганической химии к окислительно-восстановительным реакциям относятся
1) реакции обмена
2) реакции гидролиза
3) реакции замещения
4) реакции нейтрализации
Реакции обмена не относятся к окислительно-восстановительным, следовательно, условию задания не отвечают задания 1, 2 и 4. Ответ 3.
7. К окислительно-восстановительным реакциям не относятся
1) реакции горения
2) реакции соединения с участием простых веществ
3) реакции разложения с участием простых веществ
4) реакции обмена
Реакции обмена не относятся к окислительно-восстановительным. Остальные ответы можно не анализировать. Ответ 4.
8. К реакциям с участием воды не относятся
1) реакции гидролиза
2) реакции гидрирования
3) реакции гидратации
4) реакции этерификации
Реакции гидролиза – это разложение веществ водой. Реакции гидрирования – присоединение водорода – это и будет верный ответ. Остальные ответы можно не анализировать. Ответ 2
Реакции гидрирования – присоединение водорода – это и будет верный ответ. Остальные ответы можно не анализировать. Ответ 2
9. К экзотермическим реакциям не относится взаимодействие
1) оксида натрия с водой
2) фосфора с кислородом
3) оксида фосфора с водой
4) азота с кислородом
Все указанные в ответах реакции относятся к реакциям соединения, которые, как правило, являются экзотермическими реакциями, т.е. протекают с выделением теплоты. Одно из немногих исключений – взаимодействие азота с кислородом. Ответ 4.
10. К эндотермическим процессам относится
1) гашение извести
2) обжиг известняка
3) нейтрализация фосфорной кислоты известковым молоком
4) помутнение известковой воды
Очень сложное задание, требующее знаний тривиальных названий веществ и процессов, связанных с химией кальция. Гашением извести называется взаимодействие оксида кальция (негашеной извести) с водой. Известковым молоком называется взвесь гидроксида кальция в воде. Известковой водой называется раствор гидроксида кальция в воде. Реакции с участием этих соединений – экзотермические. Ответ 2.
Известковым молоком называется взвесь гидроксида кальция в воде. Известковой водой называется раствор гидроксида кальция в воде. Реакции с участием этих соединений – экзотермические. Ответ 2.
К этому ответу можно прийти гораздо проще. Достаточно знать, что практически все реакции разложения относятся к эндотермическим, т.е. протекают с поглощением теплоты. Обжиг известняка – разложение карбоната кальция.
11. Верны ли следующие суждения применительно к реакции синтеза аммиака?
А) Это реакция соединения, гомогенная, каталитическая
Б) Это реакция окислительно-восстановительная, обратимая, экзотермическая
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Верный ответ – 3. К такому выводу позволяет прийти запись уравнения реакции:
kat
N2 + 3H2 ↔ 2NH3 + Q
12. Верны ли следующие суждения применительно к способам получения сульфата цинка?
Верны ли следующие суждения применительно к способам получения сульфата цинка?
А) Сульфат цинка можно получить реакциями замещения и обмена
Б) Сульфат цинка можно получить реакциями разложения и соединения
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
На школьном уровне экзаменующемуся будет несложно прийти к выводу о возможности получения сульфата цинка реакцией замещения (например, взаимодействием цинка и разбавленной серной кислоты), а также реакцией обмена (например, взаимодействием оксида, гидроксида или карбоната цинка и серной кислоты). Можно получить сульфат цинка и реакцией соединения оксида цинка с оксидом серы (VI). А вот получить такую соль реакцией разложения почти невозможно. Ответ – 1.
13. Химические свойства этилена не характеризуются реакциями
1) полимеризации
2) гидратации
3) поликонденсации
4) гидрирования
Этилен, как непредельное соединение вступает в реакции присоединения, а потому ответы 1,2 и 4 – не отвечают условию задания. Ответ 3.
Ответ 3.
14. Для фенола не характерны реакции
1) поликонденсации
2) замещения
3) галогенирования
4) гидролиза
Знание свойств фенола позволяет выбрать верный ответ: фенол не гидролизуется. Ответ 4.
15. Реакцией соединения и окислительно-восстановительной является взаимодействие между
1) хлором и водородом
2) хлором и водой
3) фтором и водой
4) хлороводородом и аммиаком
Получение сложного вещества из простых и отвечает условию задания. Остальные ответы можно не рассматривать в целях экономии времени. Ответ 1.
16. К реакциям замещения и соединения относятся соответственно взаимодействия
1) оксид алюминия + соляная кислота и оксид железа (III) + алюминий
2) алюминий + хлорид меди (II) и алюминий + хлор
3) гидроксид алюминия + серная кислота и алюминий + кислород
4) сульфат алюминия + хлорид бария и алюминий + иод
Так как по условию задания первой в верном ответе должна быть реакция замещения (взаимодействие простого и сложного веществ), то определить верный ответ не составит труда. Это ответ – 2. Остальные ответы можно не анализировать. Ответ 2.
Это ответ – 2. Остальные ответы можно не анализировать. Ответ 2.
17. К реакциям обмена и замещения соответственно относятся взаимодействия
1) азотной кислоты с оксидом меди (II) и гидроксида кальция с оксидом углерода (IV)
2) этина с бромом и серной кислоты с оксидом магния
3) соляной кислоты с гидроксидом железа (III) и метана с хлором
4) фенола с натрием и с гидроксидом натрия
Достаточно сложное задание, так как требует знаний не только классификации химических реакций, но и номенклатуры органических и неорганический соединений. Однако его можно выполнить быстро на основании логики и знания о том, что реакция замещения – это, как правило, взаимодействие простого и сложного веществ. Эта реакция по условию задания должна быть предложена в условиях ответа второй. Ответ 3.
18. С наибольшей скоростью с водородом реагирует
1) фтор 2) хлор 3) бром 4) иод
Активность галогенов и их окислительные свойства уменьшаются в подгруппе сверху вниз. Ответ 1.
Ответ 1.
19. С наименьшей скоростью с водой реагирует
1) литий 2) натрий 3) калий 4) цезий
Активность щелочных металлов и их восстановительные свойства усиливаются в подгруппе сверху вниз. Ответ 1.
20. С наибольшей скоростью при комнатной температуре протекает реакция между
1) кислородом и водородом
2) железом и раствором серной кислоты
3) этиловым спиртом и натрием
4) растворами сульфата меди (II) и гидроксидом калия
В растворах электролитов реакции ионного обмена протекают почти мгновенно. Ответ 4.
21. Скорость химической реакции между цинком (в гранулах) и раствором серной кислоты не зависит от
1) концентрации серной кислоты
2) размера гранул цинка
3) давления
4) температуры
Скорость реакции зависит от концентрации веществ, температуры. Скорость гетерогенной реакции зависит от поверхности соприкосновения веществ (в данном случае размеров гранул цинка). Поскольку взаимодействие протекает не в газовой фазе, а на границе раздела жидкость — твердое вещество, давление не оказывает влияния на скорость химической реакции. Ответ 3.
Скорость гетерогенной реакции зависит от поверхности соприкосновения веществ (в данном случае размеров гранул цинка). Поскольку взаимодействие протекает не в газовой фазе, а на границе раздела жидкость — твердое вещество, давление не оказывает влияния на скорость химической реакции. Ответ 3.
22. Одинаковые кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой, если
1) разбавить кислоту
2) увеличить концентрацию кислоты
3) увеличить давление
4) уменьшить температуру
Увеличение концентрации вещества в растворе увеличивает скорость протекания химической реакции. Ответ 2.
23. Для увеличения скорости химической реакции
Fe (тв.) + 2H+ (р-р) = Fe2+ (р-р) + H2 (г)
необходимо
1) увеличить концентрацию ионов железа
2) добавить несколько кусочков железа
3) уменьшить температуру
4) увеличить концентрацию кислоты
Скорость реакции зависит от концентрации реагирующих веществ. Ответ 4.
Ответ 4.
24. На скорость химической реакции между цинком и раствором сульфата меди (II) не оказывает влияния увеличение
1) площади соприкосновения реагирующих веществ
2) температуры
3) концентрации раствора сульфата меди (II)
4) давления
Очевидный ответ 4.
25. С увеличением давления возрастает скорость реакции между
1) растворами нитрата серебра и хлорида натрия
2) цинком и соляной кислотой
3) водородом и кислородом
4) этиловым спиртом и натрием
Давление существенно влияет на скорость гомогенной реакции, протекающей в газовой фазе. Ответ 3.
26. Для увеличения скорости химической реакции разложения аммиака на водород и азот необходимо
1) увеличить концентрацию водорода
2) уменьшить температуру
3) увеличить температуру
4) уменьшить концентрацию аммиака
Так как реакция разложения аммиака – это экзотермический процесс, повышение температуры способствует его протеканию. Ответ 3.
Ответ 3.
27. Применение технологии «кипящего слоя» на производстве способствует увеличению скорости промышленных процессов потому, что
1) увеличивается концентрация реагирующих веществ
2) увеличивается поверхность соприкосновения реагирующих веществ
3) возрастает энергия активации процесса
4) возрастают масса и объем реагирующих веществ
«Кипящий слой» — технологический прием, позволяющий увеличить поверхность соприкосновения реагирующих веществ путем измельчения твердого сырья с последующим пропусканием через него газа или паров жидкости, в результате чего создается иллюзия кипения. Ответ 2.
28. Верны ли следующие суждения о катализаторах?
А) Это вещества, которые изменяют скорость химической реакции и расходуются при этом
Б) Это вещества, которые изменяют скорость химической реакции и ее направление
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Так как катализаторы по завершению каталитической реакции не меняются качественно и количественно, то суждение А не верно. Ответ 2.
Ответ 2.
29. Верны ли следующие суждения о ферментах?
А) Это биологические катализаторы белковой природы
Б) Это биологические катализаторы, которые «работают» в узком интервале температур и pH среды, обладают высокой эффективностью и селективностью
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Для некоторых экзаменующихся небольшое затруднения вызовут термины «рН среды» и «селективность». Первый характеризует «работу» фермента в определенном значении кислотно-основных свойств среды, а второй – избирательное действие на конкретное вещество или группу сходных веществ. Ответ 3.
30. Верны ли следующие суждения о скорости химической реакции?
А) Это изменение концентрации реагирующих веществ
Б) Это изменение количества вещества реагента в единицу времени
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Наиболее близко к истинному суждение А, но не содержит такой важнейшей характеристики скорости химической реакции, как отношение изменения концентрации реагирующих веществ ко времени, за которое оно произошло.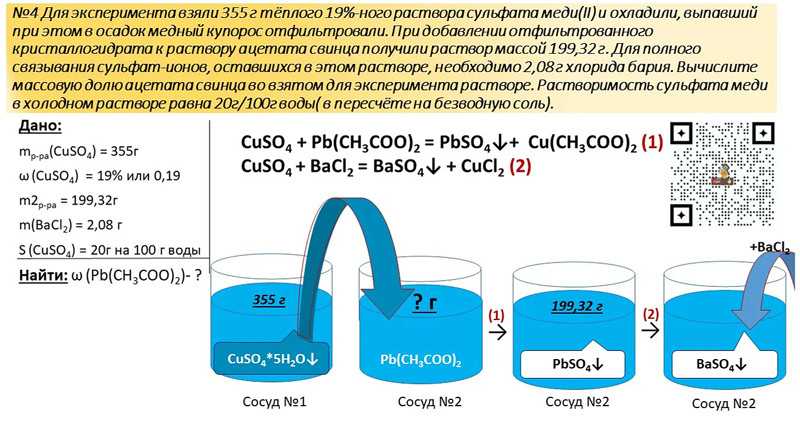 Ответ 4.
Ответ 4.
Задания для самостоятельной работы
1. Взаимодействие алюминия с оксидом хрома (III) – это реакция
1) замещения 2) присоединения 3) разложения 4) обмена
2. Внутримолекулярная дегидратация спиртов – это реакция
1) замещения 2) присоединения 3) отщепления 4) изомеризации
3. При сливании растворов иодида калия и нитрата свинца (II) протекает реакция
1) замещения 2) присоединения 3) разложения 4) обмена
4. Хлор вступает в реакцию замещения с
1) хлоридом железа (II)
2) бромидом калия
3) оксидом углерода (II)
4) гидроксидом натрия
5. Не является окислительно-восстановительной реакция, схема которой
1) (CuOH)2CO3 ® CuO + H2O + CO2↑
2) KMnO4 ® K2MnO4 + O2↑ + MnO2
3) KClO3 ® KCl + O2↑
4) NH4NO3 ® N2O + H2O
6. К гомогенным реакциям относится
К гомогенным реакциям относится
1) обжиг сульфида меди (II)
2) алюминотермия
3) взаимодействие цинка с соляной кислотой
4) хлорирование метана
7. Окислительно-восстановительная реакция лежит в основе получения
1) сульфата аммония из аммиака и серной кислоты
2) кислорода разложением пероксида водорода
3) оксида бария разложением карбоната бария
4) гидроксида кальция из оксида кальция
8. Химическое взаимодействие отсутствует при получении
1) бензина каталитическим крекингом
2) кислорода фракционной перегонкой воздуха
3) синтез-газа конверсией метана
4) аммиака из азото-водородной смеси.
9. Эндотермическим процессом является
1) нейтрализация серной кислоты гидроксидом натрия
2) горение серы
3) разложение гидроксида кальция
4) взаимодействие алюминия с бромом
10. С уменьшением относительной молекулярной массы органического вещества протекает реакция
1) дегидрирования этана
2) изомеризации н-бутана
3) гидрирования бутаналя
4) хлорирования метана
11. С увеличением относительной молекулярной массы органического вещества протекает реакция
С увеличением относительной молекулярной массы органического вещества протекает реакция
1) гидролиза этилового эфира уксусной кислоты
2) дегидрирования этана
3) окисления пропанола-1 до пропаналя
4) гидратации ацетилена
12. К реакциям обмена относится взаимодействие между
1) оксидом меди (II) и соляной кислотой
2) оксидом натрия и водой
3) оксидом углерода (IV) и магнием
4) оксидом серы (VI) и оксидом цинка
13. К реакциям замещения не относится взаимодействие между хлором и
1) метаном
2) этиленом
3) этаном
4) уксусной кислотой
14. В реакцию соединения вступят вещества, формулы которых
1) СO и FeO
2) CO2 и Mg
3) CO и Сl2
4) СО и CuO
15. Окислительно-восстановительной является реакция, схема которой
1) CuO + H2SO4 ® CuSO4 + H2O
2) FeO + HNO3 ® Fe (NO3)3 + NO + H2O
3) NaHSO4 + NaOH ® Na2SO4 + H2O
4) NH4HCO3 ® NH3 + CO2 + H2O
16. Реакцией горения нельзя назвать процесс, уравнение которого
Реакцией горения нельзя назвать процесс, уравнение которого
1) S + O2 = SO2
2) C + O2 = CO2
3) N2 + О2 = 2 NO
4) 4 P + 5 O2 = 2 P2O5
17. С наибольшей скоростью с водой реагирует
1) калий 2) литий 3) кальций 4) железо
18. С наименьшей скоростью с водородом реагирует
1) фтор 2) хлор 3) бром 4) иод
19. С наибольшей скоростью при комнатной температуре протекает реакция между
1) водородом и азотом
2) уксусной кислотой и этиловым спиртом
3) цинком и соляной кислотой
4) растворами нитрата серебра и хлорида натрия
20. Скорость реакции разложения пероксида водорода увеличится при
1) разбавлении раствора
2) увеличении давления
3) внесении катализатора
4) охлаждении раствора
21. Увеличение давления повысит скорость реакции между
Увеличение давления повысит скорость реакции между
1) Mg и H2SO4
2) N2 и Н2
3) KI (р-р) и AgNO3 (р-р)
4) СаСО3 и HCl (р-р)
22. С наибольшей скоростью протекает реакция между водным раствором гидроксида натрия и
1) соляной кислотой
2) алюминием
3) хлорэтаном
4) оксидом кремния (IV)
23. Увеличение концентрации кислорода увеличит скорость реакции, схема которой
1) H2O2 ® H2O + O2
2) NO + O2 ® NO2
3) KClO3 ® KCl + O2
4) KMnO4 ® K2MnO4 + MnO2 + O2
24. Давление не влияет на скорость реакции между
1) H2 и Br2 2) CO2 и С 3) Fe и S 4) СО и О2
25. К каталитическим реакциям относится получение
К каталитическим реакциям относится получение
1) хлороводорода из хлора и водорода
2) фосфора из фосфата кальция
3) хрома алюминотермией
4) аммиака из азота и водорода
26. Увеличение температуры
1) увеличивает скорость любой реакции
2) уменьшает скорость любой реакции
3) увеличивает скорость только эндотермических реакций
4) не влияет на скорость реакции
27. Скорость реакции увеличивается при
1) повышении концентрации реагирующих веществ
2) повышении концентрации продуктов реакции
3) понижении температуры
4) понижении давления
28. Соли двухвалентной ртути используются в качестве катализатора реакции
1) окисления спиртов
2) гидрировния аренов
3) гидратации ацетилена
4) тримеризации ацетилена
29. Для увеличения скорости реакции синтеза аммиака из азота и водорода нужно:
1) понизить температуру
2) уменьшить давление
3) увеличить концентрацию аммиака
4) увеличить давление
30. Ингибитор – это вещество,
Ингибитор – это вещество,
1) ускоряющее химическую реакцию
2) замедляющее химическую реакцию
3) усиливающее действие катализатора
4) нейтрализующее каталитические яды
03 Октябрь 2011, 24667 просмотров.
Комментарии
Скорость реакции магния с соляной кислотой | Эксперимент
- Четыре из пяти
Магний реагирует с разбавленной соляной кислотой в конической колбе, соединенной с перевернутым мерным цилиндром в ванне с водой. Объем произведенного газообразного водорода измеряется в течение нескольких минут, и результаты используются для построения графика 9.0018
Это предназначено для практических занятий. Лучше всего, если учащиеся будут работать в парах, потому что для установки и начала эксперимента требуется более одной пары рук. Один учащийся может добавить магниевую ленту в кислоту и закупорить колбу, а другой запускает секундомер. Во время эксперимента один ученик может снимать показания, а другой записывать их. Сам эксперимент занимает всего несколько минут. Но дайте учащимся хотя бы 30 минут на настройку, снятие показаний и построение графика.
Один учащийся может добавить магниевую ленту в кислоту и закупорить колбу, а другой запускает секундомер. Во время эксперимента один ученик может снимать показания, а другой записывать их. Сам эксперимент занимает всего несколько минут. Но дайте учащимся хотя бы 30 минут на настройку, снятие показаний и построение графика.
В ходе эксперимента образуется газообразный водород (чрезвычайно легковоспламеняющийся). Учащиеся не должны иметь доступа к каким-либо источникам воспламенения.
Оборудование
Аппаратура
- Защита глаз
- Коническая колба (100 см 3 )
- Резиновая пробка с одним отверстием и напорная трубка для конической колбы (примечание 1)
- Корыто или пластмассовая чаша для мытья посуды (примечание 2)
- Мерные цилиндры (100 см 3 ), 2 шт.
- Стойка зажима, втулка и зажим
- Секундомер
- Миллиметровая бумага
Примечания к аппарату
- Пробки в колбах должны быть резиновыми.
 Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку.
Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку. - Газовые шприцы можно использовать вместо корыт с водой и мерных цилиндров. Но они очень дороги и, вероятно, лучше всего используются учителем в демонстрации. Шприцы не должны намокать, иначе поршень застрянет внутри ствола.
Химикаты
- Магниевая лента, нарезанная на отрезки по 3 см
- Разбавленная соляная кислота, 1M
Примечания по охране труда и технике безопасности
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности
- Всегда используйте защитные очки. Убедитесь, что нет открытого огня.
- Лента из магния, Mg(s) — см. CLEAPSS Hazcard HC59a . Магниевая лента должна быть чистой и не иметь очевидных следов коррозии или окисления. При необходимости очистите, протирая отрезки ленты мелкой наждачной бумагой, чтобы удалить слой окисления.

- Соляная кислота, HCl (водн.) — см. карту опасности CLEAPSS HC47a и книгу рецептов CLEAPSS RB043. Соляная кислота должна быть около 1М для разумной скорости реакции. Для каждого эксперимента потребуется 50 см 3 . Несмотря на низкую опасность, защита глаз необходима, так как вы можете получить брызги, когда крошечные пузырьки лопнут.
- Газообразный водород, H 2 (g) (ЧРЕЗВЫЧАЙНО ОГНЕОПАСНЫЙ) – см. CLEAPSS Hazcard HC048 . Убедитесь, что все открытое пламя потушено и что у учащихся нет других источников воспламенения.
Процедура
- Отмерьте 50 см 3 1М соляной кислоты, используя один из мерных цилиндров. Налейте кислоту в коническую колбу 3 вместимостью 100 см.
- Установите аппарат, как показано на схеме. Наполовину заполните корыто или миску водой.
- Наполните другой мерный цилиндр водой и убедитесь, что он остается наполненным водой, когда вы переворачиваете его вверх дном.

- Когда вы будете готовы, добавьте в колбу 3-сантиметровую полоску магниевой ленты, вставьте пробку обратно в колбу как можно быстрее и включите секундомер.
- Запишите объем выделяемого газообразного водорода через соответствующие интервалы (например, 10 секунд). Продолжайте отсчитывать время до тех пор, пока не перестанет выделяться газ.
Учебные заметки
Уравнение реакции: магний + соляная кислота → хлорид магния + водород
Mg(т) + 2HCl(водн.) → MgCl )
Учащиеся следят за скоростью реакции между магнием и кислотой, измеряя количество выделяющегося газа с 10-секундными интервалами.
3 см магниевой ленты обычно имеет массу 0,04 г и дает 40 см 3 водорода при реакции с избытком кислоты. 50 см 3 1М соляной кислоты представляет собой шестикратный избыток кислоты.
В этой реакции магний и кислота постепенно расходуются. Однако кислота находится в избытке, так что главным образом потеря магния (площадь поверхности становится меньше) вызывает изменение скорости.
Если построить график зависимости объема (ось Y) от времени (ось X), наклон графика будет самым крутым в начале. Это показывает, что реакция протекает быстрее всего в начале. Когда магний израсходован, показатель падает. Это видно на графике, поскольку наклон становится менее крутым, а затем выравнивается, когда реакция останавливается (когда больше не выделяется газ).
Реакция экзотермическая, но разбавленная кислота находится в избытке, и повышение температуры составляет всего порядка 3,5°C. Наблюдается некоторое ускорение скорости реакции из-за повышения температуры. Некоторые студенты могут заметить, что колба слегка нагревается, и их можно спросить, как это повлияет на скорость реакции и как они могут адаптировать эксперимент, чтобы сделать его «справедливым испытанием».
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Проверка здоровья и безопасности, 2016 г.
© Фонд Наффилда и Королевское химическое общество
- Четыре из пяти
Глава 14.1: Факторы, влияющие на скорость реакции
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 28659
- Анонимный
- LibreTexts
Цель обучения
- Понять факторы, влияющие на скорость реакции.

Хотя сбалансированное химическое уравнение реакции описывает количественные отношения между количествами присутствующих реагентов и количествами продуктов, которые могут образоваться, оно не дает нам информации о том, будет ли происходить данная реакция и как быстро. Эта информация получается путем изучения химической кинетики реакции, которая зависит от различных факторов: концентрации реагентов, температуры, физического состояния и площади поверхности реагентов, а также свойств растворителя и катализатора, если они присутствуют. Изучая кинетику реакции, химики получают представление о том, как контролировать условия реакции для достижения желаемого результата.
Эффекты концентрации
Два вещества не могут реагировать друг с другом, если составляющие их частицы (молекулы, атомы или ионы) не вступают в контакт. Если контакта нет, скорость реакции будет равна нулю. И наоборот, чем больше частиц реагентов сталкивается в единицу времени, тем чаще может происходить реакция между ними. Следовательно, скорость реакции обычно увеличивается с увеличением концентрации реагентов. Одним из примеров этого эффекта является реакция сахарозы (столового сахара) с серной кислотой, показанная на рис. 14.1.1. 9Рис. 14.1.1 Влияние концентрации на скорость реакции Смешивание такого же количества сахарозы с концентрированной серной кислотой (а, слева) приводит к драматической реакции (б), в результате которой образуется столб черного пористого графита (в) и появляется интенсивный запах горящего сахара.
Следовательно, скорость реакции обычно увеличивается с увеличением концентрации реагентов. Одним из примеров этого эффекта является реакция сахарозы (столового сахара) с серной кислотой, показанная на рис. 14.1.1. 9Рис. 14.1.1 Влияние концентрации на скорость реакции Смешивание такого же количества сахарозы с концентрированной серной кислотой (а, слева) приводит к драматической реакции (б), в результате которой образуется столб черного пористого графита (в) и появляется интенсивный запах горящего сахара.
Влияние температуры
В главе 10 вы узнали, что повышение температуры системы увеличивает среднюю кинетическую энергию составляющих ее частиц. По мере увеличения средней кинетической энергии частицы движутся быстрее, поэтому они чаще сталкиваются в единицу времени и обладают большей энергией при столкновении. Оба эти фактора увеличивают скорость реакции. Следовательно, скорость практически всех реакций увеличивается с повышением температуры. И наоборот, скорость практически всех реакций уменьшается с понижением температуры. Например, охлаждение замедляет скорость роста бактерий в пищевых продуктах за счет снижения скорости биохимических реакций, которые позволяют бактериям размножаться. На рис. 14.1.2 показано, как температура влияет на свет, излучаемый двумя хемилюминесцентными световыми палочками. 9Рисунок 14.1.2 Влияние температуры на скорость реакции Следовательно, свет в горячей воде светится ярче (слева), чем в ледяной воде (справа).
Например, охлаждение замедляет скорость роста бактерий в пищевых продуктах за счет снижения скорости биохимических реакций, которые позволяют бактериям размножаться. На рис. 14.1.2 показано, как температура влияет на свет, излучаемый двумя хемилюминесцентными световыми палочками. 9Рисунок 14.1.2 Влияние температуры на скорость реакции Следовательно, свет в горячей воде светится ярче (слева), чем в ледяной воде (справа).
В системах, где возможно проведение более одной реакции, одни и те же реагенты могут давать разные продукты при разных условиях реакции. Например, в присутствии разбавленной серной кислоты и при температуре около 100°С этанол превращается в диэтиловый эфир:
\( 2CH_{3}CH_{2}OH \overset{H_{2}SO_{4}}{\longrightarrow} CH_{3}CH_{2}OCH_{2}CH_{3} + H_{2} O \tag{14.1.1} \)
Однако при 180°C происходит совершенно другая реакция, основным продуктом которой является этилен:
\( CH_{3}CH_{2}OH \overset{H_ {2}SO_{4}}{\longrightarrow} CH_{2}CH_{2} + H_{2}O \tag{14.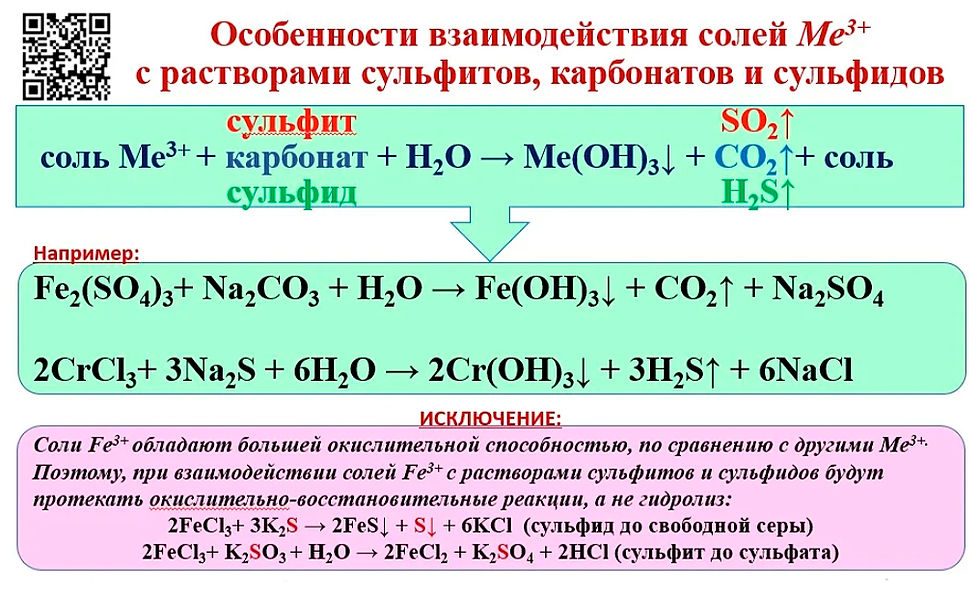 1.2} \)
1.2} \)
Эффекты фазы и площади поверхности
Когда два реагента находятся в В одной и той же жидкой фазе их частицы сталкиваются чаще, чем когда один или оба реагента являются твердыми (или когда они находятся в разных несмешивающихся жидкостях). Если реагенты равномерно диспергированы в одном гомогенном растворе, то, как мы только что видели, число столкновений в единицу времени зависит от концентрации и температуры. Однако если реакция гетерогенна, реагенты находятся в двух разных фазах, и столкновения между реагентами могут происходить только на границах раздела фаз. Количество столкновений между реагентами в единицу времени существенно уменьшается по сравнению с гомогенным случаем, а значит, и скорость реакции. Скорость реакции гетерогенной реакции зависит от площади поверхности более конденсированной фазы.
Автомобильные двигатели используют эффект площади поверхности для увеличения скорости реакции. Бензин впрыскивается в каждый цилиндр, где он воспламеняется при воспламенении от искры от свечи зажигания.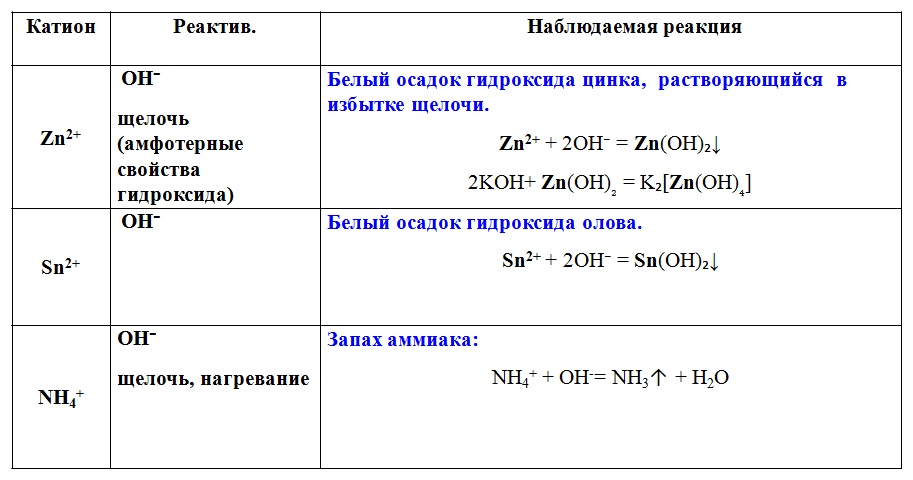 Бензин впрыскивается в виде микроскопических капель, потому что в такой форме он имеет гораздо большую площадь поверхности и может сгорать гораздо быстрее, чем если бы он подавался в цилиндр в виде потока. Точно так же куча мелкоизмельченной муки горит медленно (или не горит вообще), но распыление мелкоизмельченной муки в пламя вызывает бурную реакцию (рис. 14.1.3). Подобные явления частично ответственны за взрывы пыли, которые иногда разрушают элеваторы или угольные шахты.
Бензин впрыскивается в виде микроскопических капель, потому что в такой форме он имеет гораздо большую площадь поверхности и может сгорать гораздо быстрее, чем если бы он подавался в цилиндр в виде потока. Точно так же куча мелкоизмельченной муки горит медленно (или не горит вообще), но распыление мелкоизмельченной муки в пламя вызывает бурную реакцию (рис. 14.1.3). Подобные явления частично ответственны за взрывы пыли, которые иногда разрушают элеваторы или угольные шахты.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Аноним
- Встроить Hypothes.


 Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку.
Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку.



Leave A Comment