химия твгту 2018 вариант 74 / 56
66. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
Ответ:
Распределение электронов внешнего энергетического уровня хлора … 3s23p5 (учитывая правило Хунда, по квантовым ячейкам в нормальном состоянии имеет вид:
s | p d | |||||||
↑↓ | ↑↓ | ↑↓ | ↑ | |||||
3s 3px 3py 3pz | ||||||||
Атом хлора в основном состоянии имеет один неспаренный электрон
Атомы хлора имеют свободные d- орбитали, поэтому возможен переход одного 3s и двух 3p – электронов в 3d – состояние, следовательно в возбужденном состоянии распределение по квантовым ячейкам имеет следующие виды
s | p d | |||||||
↑↓ | ↑↓ | ↑ | ↑ | ↑ | ||||
3s 3px 3py 3pz 3dxy 3dxz | ||||||||
s | p d | |||||||
↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | |||
3s 3px 3py 3pz 3dxy 3dxz | ||||||||
s | p d | |||||||
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ||
3s 3px 3py 3pz | ||||||||
В возбужденном состояниях атом хлора имеет 3, 5 или 7 неспаренных электронов
Валентность хлора обусловленная неспаренными электронами:
В нормальном состоянии 1, например в поваренной соли ;
В возбужденных состояниях 3, 5 или 7 для примера можно привести соединения
— хлористая кислота;
— хлорноватая кислота;
—
хлорная кислота.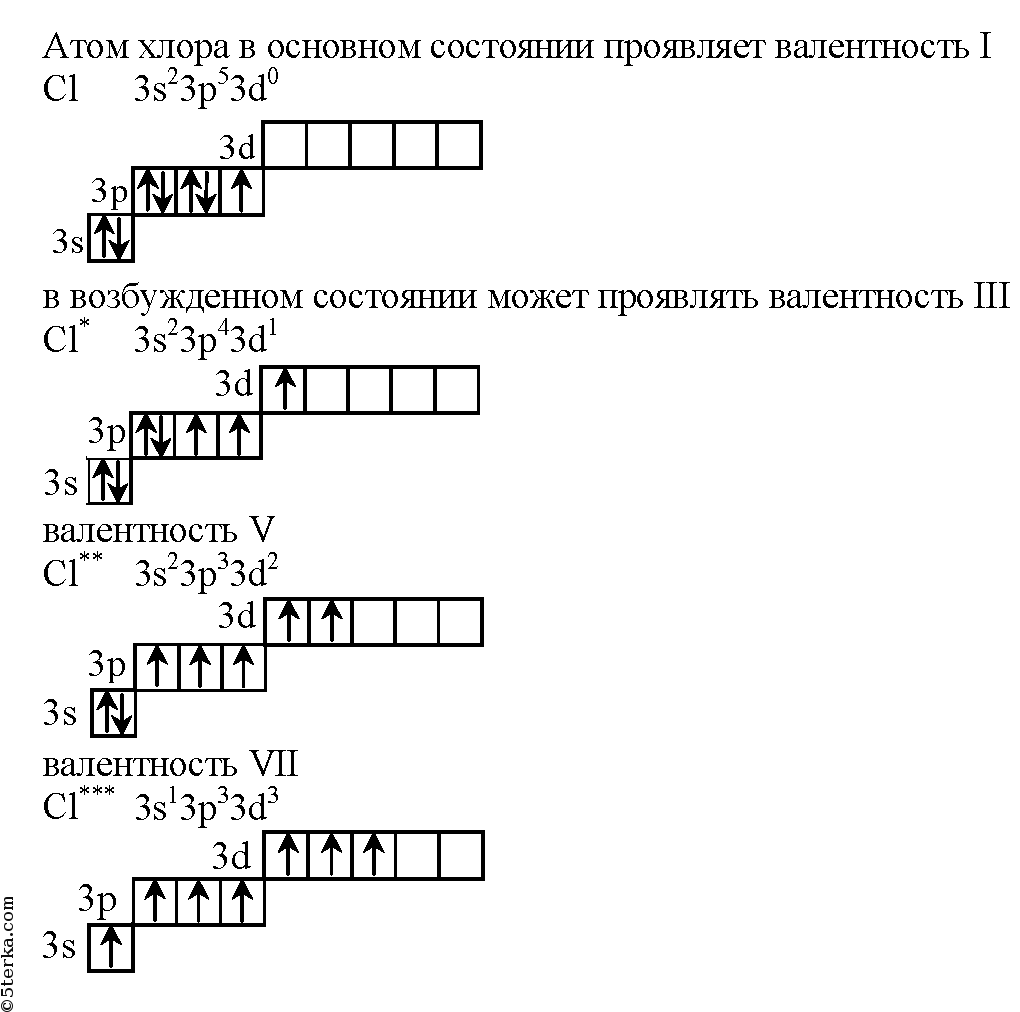
Онлайн урок: Галогены по предмету Химия 8 класс
Некоторые физические свойства галогенов собраны в таблице.
Фтор | Хлор | Бром | Йод | |
Внешний вид | Бледно-желтый газ с резким запахом | Желто-зеленый газ с резким запахом | Коричневая жидкость с резким удушающим запахом | Тёмно-серые кристаллы |
Относительная атомная масса | 19 | 35,4 | 79,9 | 126,9 |
Температура плавления | –220 °С | –101 °С | –7 °С | 114 °С |
Температура кипения | –188 °С | –35 °С | 59 °С | 184 °С |
Растворимость в воде | Окисляет воду | Небольшая | Небольшая | Небольшая |
Растворимость в органических растворителях | Окисляет растворитель | Небольшая | Хорошая | Хорошая |
Астат в связи с его очень большой скоростью радиоактивного распада не был получен в значительных количествах.
Водные растворы галогенов называют соответственно:
- хлорной водой
- бромной водой
- йодной водой
Все галогены ядовиты.
Физиологическое действие галогенов определяется сильными окислительными свойствами.
Особенно опасен фтор (F). При вдыхании даже небольших количеств фтора развивается отек легких, разрушается костная ткань.
Хлор (Cl) применялся как боевое отравляющее вещество во время Первой мировой войны. Отравление хлором вызывает легочные и бронхиальные заболевания.
Токсичность йода (I) используется при хлорировании воды – одном из способов очистки питьевой воды и обеззараживания сточных вод.
Однако в последнее время из-за токсичности хлора всё чаще применяют озонирование – обработку воды озоном.
Озон при разложении даёт кислород, который в небольших концентрациях не ядовит.
Пары брома (Br) вызывают удушье, головокружение, головную боль. При попадании брома на кожу образуются сильные, не заживающие длительное время ожоги.
Наименее ядовит из галогенов йод (I), однако и с ним необходимо обращаться осторожно, так как вдыхание паров йода оказывает раздражающее действие на дыхательные пути, нервную систему.
Кристаллический йод также может вызвать ожог кожи. Именно из-за небольшой токсичности йод применяется как антисептик в медицине.
Галогены химически очень активны, реагируют с очень многими простыми и сложными веществами.
С водородом они образуют бинарные соединения: HF, HCl, HBr, HI
Это ядовитые газы с резким запахом, напоминающим запах соответствующих галогенов.
Эти газы хорошо растворяются в воде и диссоциируют на ионы, образуя кислоты, которые реагируют с металлами с образованием галогенидов и выделением водорода.
Первые две кислоты используются больше двух других и поэтому имеют собственные названия:
хлороводородная кислота HCl (соляная)
фтороводородная кислота HF (плавиковая)
Своё название они получили из-за того, что хлороводородная кислота HCl (соляная) образует поваренную соль:
фтороводородная кислота HF (плавиковая), хотя и не очень сильная именно как кислота, но способна растворять стекло: фтор в составе кислоты вытесняет кислород из оксида кремния (основного компонента стекла):
Это свойство плавиковой кислоты используется при нанесении надписей и рисунков на стекло.
Галогены активно реагируют с металлами, образуя соли:
- фториды
- хлориды
- бромиды
- йодиды
При повышенной температуре хлор реагирует с медью, железом и некоторыми другими не очень активными металлами.
Металлы, как правило, горят в галогенах ярким пламенем с образованием большого количества искр.
Интересна реакция горения алюминия в броме.
Реакция сопровождается выделением большого количества энергии. Образующийся бромид алюминия сразу же гидролизуется во влаге воздуха с образованием большого количества дыма – выглядит это очень эффектно.
Тем не менее, хлор вполне можно хранить в стальных баллонах, потому что при отсутствии влаги реакция не идёт – главное, чтобы хлор был сухим. Баллоны с хлором окрашивают в зеленый цвет с тёмно-зеленой полосой или в желтый цвет с зеленой полосой.
Баллоны с хлором окрашивают в зеленый цвет с тёмно-зеленой полосой или в желтый цвет с зеленой полосой.
Большинство неметаллов непосредственно взаимодействуют с галогенами.
С хлором и бромом энергично взаимодействуют сера и фосфор:
Галогены взаимодействуют и со сложными веществами (водой, сероводородом).
Причем активность галогенов в подгруппе убывает сверху вниз.
Если вам когда-нибудь зададут вопрос: «А может ли гореть вода?» – смело отвечайте: «Да, может».
Всё дело в том, что более сильный окислитель вытесняет более слабый из его соединений.
Точно также происходит и с водой, если на неё воздействовать фтором (фтор – более сильный окислитель, чем кислород).
В атмосфере фтора вода в прямом смысле горит.
Химическая реакция горения воды в струе фтора выглядит так:
Галогены также способны вытеснять друг друга из солей – более активный элемент вытесняет менее активный.
На этом основан промышленный метод получения йода: хлор пропускают через насыщенный раствор морской соли, который содержит большое количество йодидов, и йод выделяется в виде простого вещества:
ГДЗ (ответы) Химия 8 класс Григорович А.В., 2016 §13 Распределение электронов в электронной оболочке атомов » Допомога учням
Другие задания смотри здесь…
Контрольные вопросы
Вопрос 1 Сколько электронов может максимально находиться на одной электронной орбитали? На одной орбитали могут находиться не более двух электронов, причем их спины должны быть антипараллельными.
Вопрос 2 Сколько электронов максимально может находиться на
s-подуровне?
Два электрона, поскольку имеет 1 орбиталь, на каждой максимально может быть 2 электрона
p-подуровне?
Шесть электронов, поскольку имеет 3 орбитали, на каждой максимально может быть 2 электрона
d-подуровне?
Десять электронов, поскольку имеет 5 орбиталей, на каждой максимально может быть 2 электрона
Вопрос 3 Какой энергетический уровень заполняется раньше: первый или второй? Первый
Ответ поясните. Энергетические уровни заполняются по принципу наименьшей энергии: электроны занимают орбитали последовательно, начиная с первого энергетического уровня, в порядке увеличения энергии уровня.
Энергетические уровни заполняются по принципу наименьшей энергии: электроны занимают орбитали последовательно, начиная с первого энергетического уровня, в порядке увеличения энергии уровня.
Вопрос 4 Почему в атоме Лития электрон, расположенный на втором электронном уровне, находится на s-орбитали, а не на р-орбитали? Согласно принципу наименьшей энергии каждый электрон располагается таким образом, чтобы его энергия была наименьшей. Среди названных орбиталей s-орбиталь имеет меньшую энергию.
Вопрос 5 Как распределяются электроны по орбиталям на р-подуровне?
Электрон занимает свободную орбиталь, а при отсутствии свободной — образует пару с другим электроном в полузаполненной орбитали. Другими словами по правилу Хунда: в пределах одного энергетического подуровня электроны распределяются по орбиталям таким образом, чтобы число неспаренных электронов было максимальным.
Вопрос 6 Сколько электронов находится на внешнем энергетическом уровне атомов:
а) Гелия
Два электрона
б) Лития
Один электрон
в) Бериллия
Два электрона
г) Бора
Три электрона
д) Карбона
Четыре электрона
е) Оксигена?
Шесть электронов
Для элементов главных подгрупп на количество электронов на внешнем энергетическом уровне указывает номер группы, в которой размещен элемент. Исключением является Гелий, атом имеет два электрона, но является элементом VIII группы Периодической системы.
Исключением является Гелий, атом имеет два электрона, но является элементом VIII группы Периодической системы.
Вопрос 7 Сколько энергетических уровней заняты электронами в атомах:
а) Лития, Натрия, Калия
Два, три, четыре энергетических уровня
б) Бериллия, Магния, Кальция
Два, три, четыре энергетических уровня
в) Флуора, Хлора, Брома
Два, три, четыре энергетических уровня
Количество энергетических уровней совпадает с номером периода, в котором размещен химический элемент.
Задания для усвоения материала
Упражнение 1 Составьте графическую электронную формулу Нитрогена, Флуора, Магния, Алюминия и Силиция. Определите число электронных пар и неспаренных электронов на внешнем энергетическом уровне.
|
Нитроген электронных пар: 1 неспаренных электронов: 3 |
|
Флуор электронных пар: 3 неспаренных электронов: 1 |
|
Магній электронных пар: 1 неспаренных электронов: 0 |
|
Алюміній электронных пар: 1 неспаренных электронов: 1 |
|
Силіцій электронных пар: 1 неспаренных электронов: 2 |
Упражнение 2 По числу орбиталей, составляющих энергетические уровни, определите, какое максимальное число электронов может находиться на втором и третьем энергетических уровнях.
Каждый уровень с номером n содержит n2 орбиталей и 2n2 максимальное количество электронов, поэтому
2-й энергетический уровень содержит 22=4 орбитали и 2•22=2•4=8 электронов
3-й энергетический уровень содержит 32= 9 орбиталей и 2•32= 2•9=18 электронов
Обратите внимание, что третий энергетический уровень заполняется в элементов побочных подгрупп, начиная с 4 периода.
Упражнение 3 Назовите два химических элемента, в атомах которых полностью заполнены внешние энергетические уровни.
Полностью заполнены внешние энергетические уровни в атомах инертных элементов: Гелий He, Неон Ne, Аргон Ar, Криптон Kr, Ксенон Xe.
Упражнение 4 Сколько неспаренных электронов в электронной оболочке атома Оксигена? Два
Атомы какого еще химического элемента второго периода содержат такое же число неспаренных электронов? Карбона
Упражнение 5 Изобразите строение электронных оболочек атомов Нитрогена и Фосфора.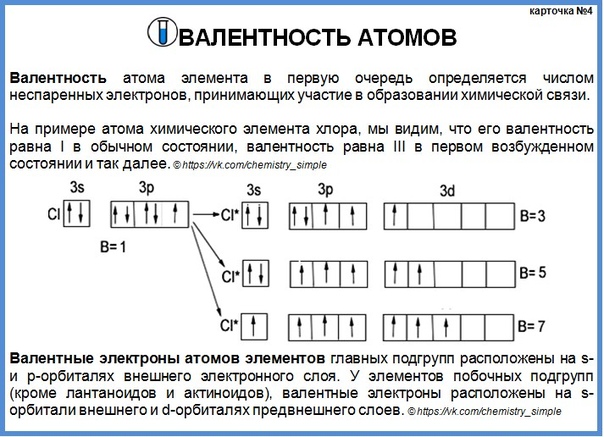
Нитроген 1s22s22p3 или [He]2s22p3
Фосфор 1s22s22p63s23p3 или [Ne]3s23p3
Что общего в строении электронных оболочек этих атомов?
Число электронов на внешнем энергетическом уровне (пять, из них, одна электронная пара и три неспаренных электрона).
Чем они отличаются? Числом энергетических уровней (два в атома Нитрогена, три ― Фосфора).
Упражнение 6 Атомы каких элементов имеют следующую электронную формулу внешнего электронного уровня:
а) 1s2
Гелий Не (1 ― номер периода, s-элемент ― главная подгруппа, 2 группа)
б) 2s2
Бериллий Ве (2 ― номер периода, s-элемент ― главная подгруппа, 2 группа)
в) 2s22p4
Оксиген О (2 ― номер периода, р-элемент ― главная подгруппа, 2+4=6 группа)
г) 3s23p2
Силиций Si (3 ― номер периода, р-элемент ― главная подгруппа, 2+2=4 группа)
д) 4s2?
Кальций Са (4 ― номер периода, s-элемент ― главная подгруппа, 2 группа)
Объяснение. Первая цифра в записи электронной конфигурации указывает на номер периода, в котором находится элемент, s- i p-элементы являются элементами главных подгрупп, а сумма s- и р-электронов равна номеру группы.
Первая цифра в записи электронной конфигурации указывает на номер периода, в котором находится элемент, s- i p-элементы являются элементами главных подгрупп, а сумма s- и р-электронов равна номеру группы.
Упражнение 7 Атом какого элемента второго периода содержит наибольшее число:
а) электронов;
Неон Ne (10 электронов)
б) неспаренных электронов;
Нитроген N (3 неспареных электрона)
в) электронных пар?
Неон Ne (5 электронных пар)
Другие задания смотри здесь…
Шиманович И. Л. Химия: методические указания. Задачи 61-80
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
61. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды? Решение с ключом
62. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей: HI, ICl, BrF – наиболее полярна. Решение
Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей: HI, ICl, BrF – наиболее полярна. Решение
63. Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и ВF4—? Укажите донор и акцептор. Решение с ключом
64. Как метод валентных связей (ВС) объясняет линейное строение молекулы BeCl2 и тетраэдрическое СН4? Решение с ключом
65. Какую ковалентную связь называют s-связью и какую p-связью? Разберите на примере строения молекулы азота. Решение с ключом
66. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами? Решение с ключом
67. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами? Решение с ключом
Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами? Решение с ключом
68. Что называют электрическим моментом диполя? Какая из молекул HCl, НВr, HI имеет наибольший момент диполя? Почему? Решение
69. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода, цинк – имеют указанные структуры? Решение
70. Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S и линейное молекулы CO2? Решение с ключом
71. Нарисуйте энергетическую схему образования молекулы Нe2 и молекулярного иона Нe2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона Нe2+ и невозможность существования молекулы He2? Решение
72. Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? Решение
Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? Решение
73. Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы. Решение
74. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях СН4, СН3ОН, НСООН, CO2. Решение с ключом
75. Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы и какова их природа? Решение с ключом
76. Нарисуйте энергетическую схему образовании молекулярного иона H2+ и молекулы H2 по методу молекулярных орбиталей. Где энергия связи больше? Почему? Решение
Где энергия связи больше? Почему? Решение
77. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей (ВС) объясняет симметричную треугольную форму молекулы BF3? Решение с ключом
78. Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода? Решение с ключом
79. Нарисуйте энергетическую схему образования молекулы F2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? Решение с ключом
80. Нарисуйте энергетическую схему образования молекулы N2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? Решение с ключом
Хлор — презентация на Slide-Share.ru 🎓
1
Первый слайд презентации: Хлор
Презентация по химии Студентки ИСП-1 Цыганковой Олеси
Изображение слайда
2
Слайд 2: Строение атома
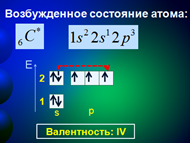
З аряд ядра + 17, электронная конфигурация внешней электронной оболочки атома: 3 s 2 3 p 5. Хлор проявляет степени окисления –1, +1, +3, +5, +7 (+4, +6 – редко).
При движении по группе сверху вниз число энергетических уровней увеличивается, значит увеличивается радиус атома и ослабляется связь валентных электронов с ядром. Таким образом, среди галогенов самый маленький атом у фтора и самый большой у астата. Легче всего оторвать электрон от атома At и труднее – от атома F.
Хлор проявляет степени окисления –1, +1, +3, +5, +7 (+4, +6 – редко).
При движении по группе сверху вниз число энергетических уровней увеличивается, значит увеличивается радиус атома и ослабляется связь валентных электронов с ядром. Таким образом, среди галогенов самый маленький атом у фтора и самый большой у астата. Легче всего оторвать электрон от атома At и труднее – от атома F.
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
3
Слайд 3: Возбуждения
В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном (переход электронов на вакантные d -облака) увеличивается число неспаренных электронов до 7. Следовательно, валентность галогенов может быть 3; 5; 7 (исключение атом фтора).
Следовательно, валентность галогенов может быть 3; 5; 7 (исключение атом фтора).
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
4
Слайд 4: Молекула хлора
Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р- облаков двух атомов хлора. Кроме того, в молекуле хлора имеет место донорно-акцепторное взаимодействие, упрочняющие связь.
Связь одинарна и образуется при перекрывании одноэлектронных р- облаков двух атомов хлора. Кроме того, в молекуле хлора имеет место донорно-акцепторное взаимодействие, упрочняющие связь.
Изображение слайда
Изображение для работы со слайдом
5
Слайд 5: Физические свойства
При н.у. хлор -ядовитый газ желтовато-зелёного цвета, с резким, удушающим запахом.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Растворитель
Растворимость г/100 г
Бензол
Растворим
Вода (0 ° C)
1,48
Вода (80 ° C)
0,22
Хлороформ
Хорошо растворим
Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Растворитель
Растворимость г/100 г
Бензол
Растворим
Вода (0 ° C)
1,48
Вода (80 ° C)
0,22
Хлороформ
Хорошо растворим
Изображение слайда
Изображение для работы со слайдом
6
Слайд 6
Свойство Значение Температура кипения −34 °C Температура плавления −101 °C Температура разложения (диссоциации на атомы) ~1400 °C Плотность (газ, н.у. ) 3,214 г/л Сродство к электрону атома 3,65 эВ Первая энергия ионизации 12,97 эВ Теплоемкость (298 К, газ) 34,94 (Дж/моль· K) Критическая температура 144 °C Критическое давление 76 атм Стандартная энтальпия образования (298 К, газ) 0 (кДж/моль) Стандартная энтропия образования (298 К, газ) 222,9 (Дж/моль· K) Энтальпия плавления 6,406 (кДж/моль) Энтальпия кипения 20,41 (кДж/моль)
Изображение слайда
7
Слайд 7: Химические свойства
Х лор – активный окислитель.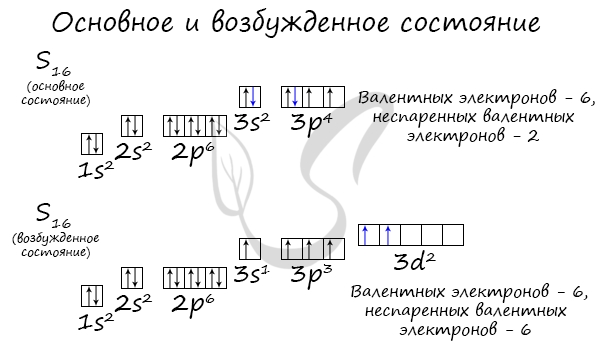 Энергично реагирует с металлами и большинством неметаллов (за исключением O 2, N 2 и благородных газов). Вступает также в реакции диспропорционирования, для протекания которых наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов.
Энергично реагирует с металлами и большинством неметаллов (за исключением O 2, N 2 и благородных газов). Вступает также в реакции диспропорционирования, для протекания которых наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов.
Изображение слайда
8
Слайд 8: С металлами
Х лор — один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью ( Fe, Cr ) в отличие от соляной кислоты заставляет их проявлять большую степень окисления: 2 K + Cl 2 = 2 КCl 2Al + 3Cl2 = 2AlCl3 2 Fe + 3Cl 2 = 2 FeCl 3 (1) Cu + Cl2 = CuCl2 (2) (1) (2)
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
9
Слайд 9: С неметаллами
H 2 + Cl 2 = 2 HCl (на свету)
2 Cl 2 + C = C Cl 4
3Cl 2 + 2P ( крист. ) = 2PCl 3
5 Cl 2 + 2 P = 2PCl 5
5Cl 2 + 2Sb = 2SbCl 5
О бразует соединения с другими галогенами :
Cl 2 + F 2 = 2ClF
Cl 2 + 3F 2 = 2ClF 3, t = 200–400 ° C
Cl 2 + 5F 2 = 2ClF 5
) = 2PCl 3
5 Cl 2 + 2 P = 2PCl 5
5Cl 2 + 2Sb = 2SbCl 5
О бразует соединения с другими галогенами :
Cl 2 + F 2 = 2ClF
Cl 2 + 3F 2 = 2ClF 3, t = 200–400 ° C
Cl 2 + 5F 2 = 2ClF 5
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
10
Слайд 10: С водой, щелочами, бескислородными кислотами, солями
Х лор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием «хлорной воды»: Cl 2 + H 2 O = HCl + HClO Cl2 + 2KOH( хол ) = KCl + KClO (гипохлорит) + h3O Cl2 + 6KOH( гор) = 5KCl + KClO3 (хлорат) + 3h3O Cl 2 + HBr = 2 H Cl + Br 2 Cl 2 + HI = 2 H Cl + I 2 Cl 2 + 2NaI = 2NaCl + I 2 Cl 2 + FeCl2 = 2 FeCl3
Изображение слайда
11
Слайд 11: Хлор в органике
Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул соединений, относящихся к различным классам органических веществ.
Cnh3n+2 + Cl2 ( на свету ) = Cnh3n+1Cl + HCl [ р. Семенова ]
Cnh3n + Cl2 = Cnh3nCl2
Cnh3n-2 + Cl2 – в несколько стадий
C6H6 + Cl2 ( AlCl3 ) = C6H5Cl + HCl
C6H6 + Cl2 (на свету) = гексахлоран
Гомологи бензола + Cl 2 (на свету) = замещение
по радикальному механизму ( Cl к альфа- H )
R-Ch3-COOH + Cl2 (PCl5) = R- CHCl -COOH + HCl
Его атомы входят в состав молекул соединений, относящихся к различным классам органических веществ.
Cnh3n+2 + Cl2 ( на свету ) = Cnh3n+1Cl + HCl [ р. Семенова ]
Cnh3n + Cl2 = Cnh3nCl2
Cnh3n-2 + Cl2 – в несколько стадий
C6H6 + Cl2 ( AlCl3 ) = C6H5Cl + HCl
C6H6 + Cl2 (на свету) = гексахлоран
Гомологи бензола + Cl 2 (на свету) = замещение
по радикальному механизму ( Cl к альфа- H )
R-Ch3-COOH + Cl2 (PCl5) = R- CHCl -COOH + HCl
Изображение слайда
12
Слайд 12: Распространение в природе
Хлор – активный элемент
В природе он встречается только в виде соединений в составе минералов: галита NaCI,
сильвина KCl,
сильвинита KCl · NaCl,
бишофита MgCl 2 · 6h3O,
карналлита KCl · MgCl 2 · 6Н 2 O,
каинита KCl · MgSO 4 · 3Н 2 О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Изображение слайда
13
Слайд 13
Изотоп
Относительная масса, а.е.м.
Период полураспада
Тип распада
Ядерный спин
35 Cl
34.968852721
Стабилен
—
3/2
36 Cl
35.9683069
301000 лет
β- распад в 36 Ar
0
37 Cl
36. 96590262
Стабилен
—
3/2
38 Cl
37.9680106
37,2 минуты
β- распад в 38 Ar
2
39 Cl
38.968009
55,6 минуты
β- распад в 39 Ar
3/2
40 Cl
39.97042
1,38 минуты
β- распад в 40 Ar
2
41 Cl
40.9707
34 c
β- распад в 41 Ar
42 Cl
41.9732
46,8 c
β- распад в 42 Ar
43 Cl
42.9742
3,3 c
β- распад в 43 Ar
96590262
Стабилен
—
3/2
38 Cl
37.9680106
37,2 минуты
β- распад в 38 Ar
2
39 Cl
38.968009
55,6 минуты
β- распад в 39 Ar
3/2
40 Cl
39.97042
1,38 минуты
β- распад в 40 Ar
2
41 Cl
40.9707
34 c
β- распад в 41 Ar
42 Cl
41.9732
46,8 c
β- распад в 42 Ar
43 Cl
42.9742
3,3 c
β- распад в 43 Ar
Изображение слайда
14
Последний слайд презентации: Хлор: Применение хлора
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
Основным компонентом отбеливателей является хлорная вода
В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Для обеззараживания воды — «хлорирования».
В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений. Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора.
Использовался как оружие массового поражения и в производстве других отравляющих веществ массового поражения: иприт, фосген.
Для обеззараживания воды — «хлорирования».
В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений. Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора.
Использовался как оружие массового поражения и в производстве других отравляющих веществ массового поражения: иприт, фосген.
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Строение атома — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И.
 Давыдова (Юдина).
Давыдова (Юдина).Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).

Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 и -1/2.
Возможных значений всего два: +1/2 и -1/2.
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2.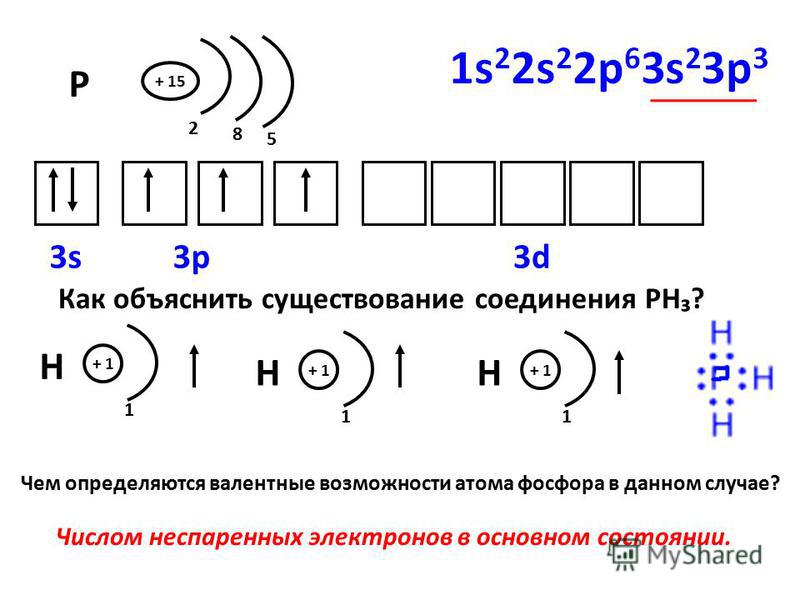 Итого получаем1s22s22p63s2.
Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
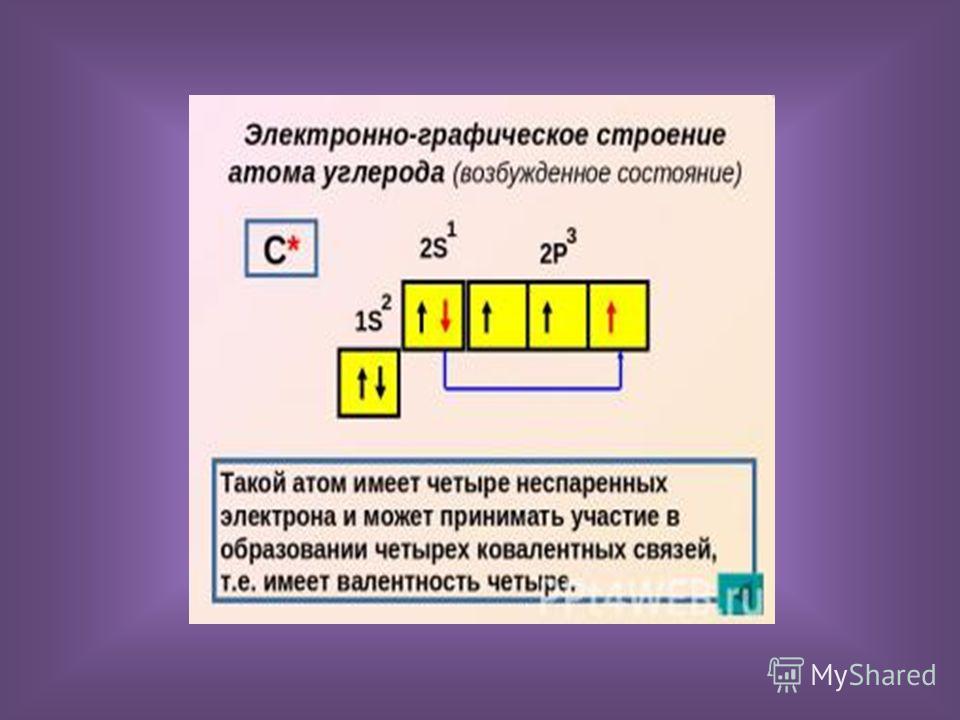
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий — элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены — 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s2. Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
|
|
Домашняя страница | Yahoo Answers
Я согласен на 100 процентов.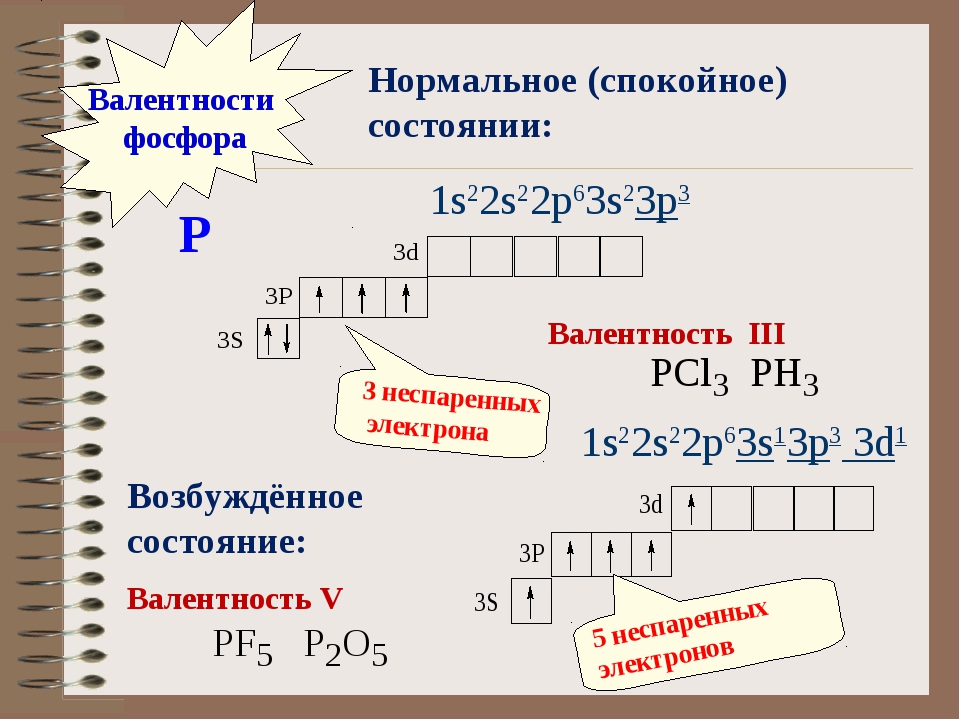 Сегодня нет рабов или рабовладельцев. Требование, чтобы афроамериканцы были чем-то должны, потому что некоторые из них пережили рабство, не делают ничего, кроме разжигания негодования со стороны белых людей, которым постоянно «белые привилегии запихивают нам в глотку».
Сегодня нет рабов или рабовладельцев. Требование, чтобы афроамериканцы были чем-то должны, потому что некоторые из них пережили рабство, не делают ничего, кроме разжигания негодования со стороны белых людей, которым постоянно «белые привилегии запихивают нам в глотку».
Сколько чернокожих спортивных профессионалов, актеров и актрис, имеющих музыкальный успех, родились благодаря наркоманам, членам банд и притеснениям, или имели проблемы с наркотиками или сами члены банды? Довольно много
Как они вылезли из этого? Карты сложились против них.Они тоже ВЫБИРАЮТ. У каждого чернокожего есть такая же возможность. Больше, чем белые с низким и средним доходом (их больше, чем белых с высоким доходом), потому что колледжи и работа должны предлагать определенное количество стипендий и рабочих мест для меньшинств из-за расы. Легко сказать, что существует такая вещь, как привилегия черных.
Было много европейцев, которые были рабами, когда они приехали в Америку, особенно ирландские женщины, до трех поколений ежедневно подвергались изнасилованиям и избиениям. Моя семья была одна.Были ли их страдания меньше из-за того, что они были белыми?
Моя семья была одна.Были ли их страдания меньше из-за того, что они были белыми?
Рабство было ужасным и одним из самых мрачных периодов в Америке, но ничто не может и никогда не изменит этого КОГДА-ЛИБО.
Представьте себе, что до телевидения в социальных сетях, даже до того, как газеты стали широко распространяться, ваша семья и ваши друзья родственники сказали вам, что трава была розовой, небо было фиолетовым, и вы были рабом, потому что это то, что их семья сказала им, а затем, по мере развития страны, вы узнали, что они ошибались обо всем, что вам говорили, и что владеть людьми было неправильно и аморально.Все, что вы могли сделать, это освободить рабов и научить своих детей праву.
Так случилось с большинством людей. Тех, кто продолжал, было немного, а тех, кто был kkk, было немного, учитывая население, и они были и остаются невежественными. Чернокожие должны отказаться от возмещения ущерба, расизма и рабства, двигаться дальше и быть хорошими образцами для подражания для детей. Учите их, что есть возможность. Им просто нужно взять это
Учите их, что есть возможность. Им просто нужно взять это
Chem4Kids.com: Хлор: орбитальная и связующая информация
Посмотрите на доску.В этом поле слева есть вся информация, которую вам нужно знать об одном элементе. Он сообщает вам массу одного атома, сколько частей находится внутри и где его следует разместить в периодической таблице.
В следующем разделе мы рассмотрим электронные орбитали или электронные оболочки. Для некоторых из вас это может быть новой темой.
 Как только одна оболочка заполнится, следующий добавленный электрон должен перейти к следующей оболочке.
Как только одна оболочка заполнится, следующий добавленный электрон должен перейти к следующей оболочке.Итак … для элемента ХЛОРА, вы уже знаете, что атомный номер говорит вам количество электронов. Это означает, что в атоме хлора 17 электронов.Глядя на картинку, вы можете увидеть, что есть два электрона в первой оболочке, восемь — в второй и семь — в третьей.
| Это хлорид натрия , также известный как поваренная соль. Большинство ученых знают, что формула соли — NaCl . Один атом натрия (Na) отдает свой электрон одному атому хлора (Cl). Затем у хлора есть восемь электронов во внешней оболочке, которые делают его «счастливым».Натрий «счастлив», потому что он отказался от одного лишнего электрона. | ||
Хлор (Cl) также может связываться с алюминием (Al). Алюминий имеет три дополнительных электрона и легко позволяет атомам хлора использовать их. Поскольку у алюминия их три, это означает, что три атома хлора могут связываться. Они образуют формулу AlCl 3 , также известную как треххлористый алюминий . Каждый из атомов хлора получает электрон, заполняющий его оболочку, а алюминий теряет три, что также дает ему заполненную оболочку (помните, у алюминия есть три дополнительных электрона).Название трихлорид означает, что задействованы три атома хлора. Алюминий имеет три дополнительных электрона и легко позволяет атомам хлора использовать их. Поскольку у алюминия их три, это означает, что три атома хлора могут связываться. Они образуют формулу AlCl 3 , также известную как треххлористый алюминий . Каждый из атомов хлора получает электрон, заполняющий его оболочку, а алюминий теряет три, что также дает ему заполненную оболочку (помните, у алюминия есть три дополнительных электрона).Название трихлорид означает, что задействованы три атома хлора. | ||
| Азот может соединяться с тремя атомами хлора, образуя Трихлорид азота или NCl 3 . Азот делится своими электронами с атомами хлора, поэтому оболочки всех атомов заполнены. Посмотрите на точки вокруг атомов. У всех теперь восемь электронов и заполненная внешняя оболочка! | ||
Chem4Kids Разделы
Сеть сайтов по науке и математике Рейдера
Химические связи | Комбинации атомов
Почему атомы связаны? (ESBM5)
В начале этого раздела важно помнить, что мы продолжим обсуждать модель связывания , которая основана на конкретной модели атома . Вы помните из обсуждения атомов (в Grade \ (\ text {10} \)), что модель — это представление того, что происходит в действительности. В модели атома, которую вы изучаете в Уровне \ (\ text {10} \), атом состоит из центрального ядра, окруженного электронами, которые расположены на фиксированных энергетических уровнях (иногда называемых оболочками , ). Внутри каждого энергетического уровня электроны движутся по орбиталям различной формы. Электроны на внешнем энергетическом уровне атома называются валентными электронами .Эта модель атома полезна в попытке понять, как между атомами происходят различные типы связи.
Вы помните из обсуждения атомов (в Grade \ (\ text {10} \)), что модель — это представление того, что происходит в действительности. В модели атома, которую вы изучаете в Уровне \ (\ text {10} \), атом состоит из центрального ядра, окруженного электронами, которые расположены на фиксированных энергетических уровнях (иногда называемых оболочками , ). Внутри каждого энергетического уровня электроны движутся по орбиталям различной формы. Электроны на внешнем энергетическом уровне атома называются валентными электронами .Эта модель атома полезна в попытке понять, как между атомами происходят различные типы связи.
Модель берет то, что мы видим в окружающем мире, и использует это, чтобы делать определенные прогнозы относительно того, что мы не видим.
Рисунок 3.1: Электронное устройство атома фтора. Черные электроны (маленькие кружки на внутреннем кольце) — это центральные электроны, а белые электроны (маленькие кружки на внешнем кольце) — валентные электроны.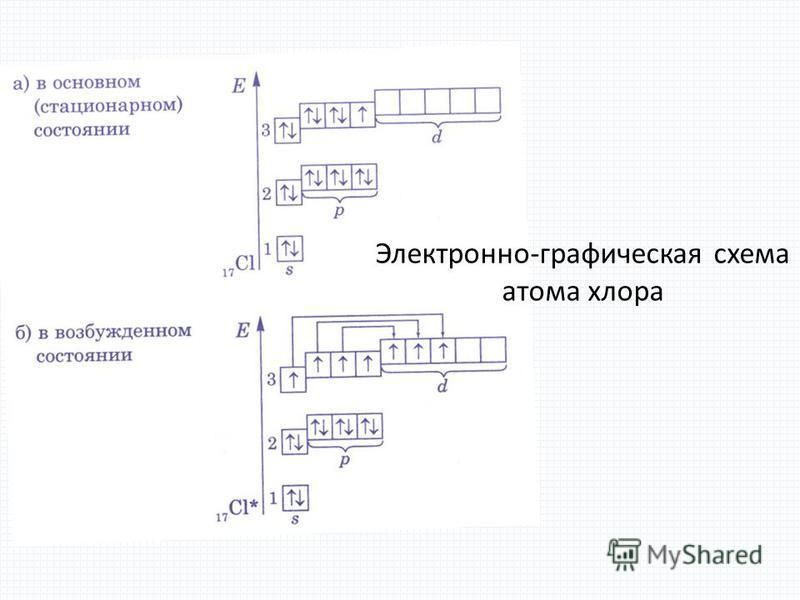
В предыдущих обсуждениях электронов и уровней энергии были отмечены следующие моменты:
- Электроны всегда стараются занять как можно более низкий уровень энергии.{6} \). Второй энергетический уровень является внешней (валентной) оболочкой и заполнен.
- Атомы образуют связи, чтобы попытаться достичь той же электронной конфигурации, что и благородные газы.
- Атомы с полной валентной электронной орбиталью менее реактивны.
Энергия и связь (ESBM6)
Нам нужно рассмотреть два случая, когда два атома сближаются. В первом случае два атома сближаются и образуют связь. Во втором случае два атома сближаются, но не образуют связи.Мы будем использовать водород в качестве примера первого случая и гелий в качестве примера второго случая.
Случай 1: Облигация образует
Начнем с представления, что два атома водорода приближаются друг к другу. По мере того, как они сближаются, на атомы одновременно действуют три силы. Эти силы описаны ниже:
Эти силы описаны ниже:
сила отталкивания между электронами атомов, поскольку одинаковые заряды отталкивают
Рисунок 3.2: Отталкивание электроновСила притяжения между ядром одного атома и электронами другого
Рисунок 3.3: Притяжение между электронами и протонами.сила отталкивания между двумя положительно заряженными ядрами
Рисунок 3.4: Отталкивание между протонами
Эти три силы работают вместе, когда два атома сближаются. По мере изменения общей силы, испытываемой атомами, изменяется и количество энергии в системе.
Теперь взгляните на рисунок 3.5, чтобы понять изменения энергии, которые происходят, когда два атома движутся навстречу друг другу.
Рисунок 3.5: График, показывающий изменение энергии, которое происходит при сближении двух атомов водорода.
Представим, что мы зафиксировали один атом и переместим другой атом ближе к первому атому. По мере того, как мы перемещаем второй атом водорода ближе к первому (из точки A в точку X), энергия системы уменьшается. Силы притяжения доминируют в этой части взаимодействия.Когда второй атом приближается к первому и приближается к точке X, требуется больше энергии для разрыва атомов. Это дает отрицательную потенциальную энергию.
В точке X силы притяжения и отталкивания, действующие на два атома водорода, уравновешены. Энергия системы минимальная.
Дальше левее точки X силы отталкивания сильнее сил притяжения, и энергия системы увеличивается.
Для водорода энергия в точке X достаточно мала, чтобы два атома оставались вместе и больше не распадались.Вот почему, когда мы рисуем диаграмму Льюиса для молекулы водорода, мы рисуем два атома водорода рядом друг с другом с электронной парой между ними.
Мы также отмечаем, что такое расположение дает обоим атомам водорода полный внешний энергетический уровень (за счет обмена электронами или ковалентной связи).
Случай 2: Облигация не образует
Теперь, если мы посмотрим на гелий, мы увидим, что каждый атом гелия имеет заполненный внешний энергетический уровень. Глядя на рисунок 3.6, мы обнаруживаем, что минимум энергии для двух атомов гелия очень близок к нулю.Это означает, что два атома могут очень легко соединиться и разъединиться и никогда не слипаться.
Рисунок 3.6: График, показывающий изменение энергии, которое происходит при сближении двух атомов гелия.Для гелия минимум энергии в точке X недостаточно низок, чтобы два атома оставались вместе, и поэтому они снова расходятся. Вот почему, когда мы рисуем диаграмму Льюиса для гелия, мы рисуем один атом гелия отдельно. Связи нет.
Мы также видим, что гелий уже имеет полный внешний энергетический уровень и поэтому никаких соединений не образуется.
Валентные электроны и диаграммы Льюиса (ESBM7)
Теперь, когда мы немного больше разбираемся в связывании, нам нужно обновить концепцию диаграмм Льюиса, о которой вы узнали в Grade \ (\ text {10} \). Зная, почему атомы связываются, и зная, как рисовать диаграммы Льюиса, мы будем иметь все инструменты, которые нам понадобятся, чтобы попытаться предсказать, какие атомы будут связываться и какой формы будет молекула.
Зная, почему атомы связываются, и зная, как рисовать диаграммы Льюиса, мы будем иметь все инструменты, которые нам понадобятся, чтобы попытаться предсказать, какие атомы будут связываться и какой формы будет молекула.
В классе \ (\ text {10} \) мы научились писать электронную структуру любого элемента.{5} \). Сжатая спектроскопическая запись быстро показывает валентные электроны элемента.
Используя число валентных электронов, мы можем легко нарисовать диаграммы Льюиса для любого элемента. В классе \ (\ text {10} \) вы научились рисовать диаграммы Льюиса. Мы обновим концепции здесь, поскольку они помогут нам в обсуждении связывания.
Диаграмма Льюиса использует точки или крестики для представления валентных электронов на разных атомах. Химический символ элемента используется для обозначения ядра и основных электронов атома.
Диаграммы Льюиса для элементов периода \ (\ text {2} \) показаны ниже:
Вы можете разместить неспаренные электроны в любом месте (сверху, снизу, слева или справа).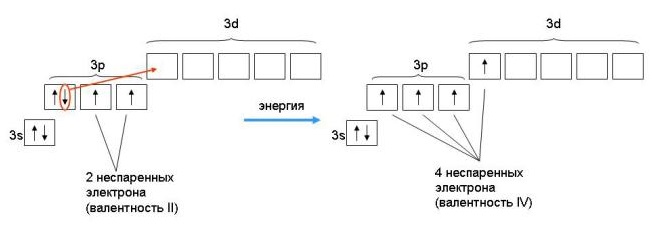 {6} \)
{6} \)
Ковалентные связи и образование связей (ESBM8)
Ковалентная связь включает обмен электронами с образованием химической связи.Внешние орбитали атомов перекрываются, так что неспаренные электроны в каждом из связанных атомов могут быть общими. За счет перекрывания орбиталей заполняются внешние энергетические оболочки всех связывающих атомов. Общие электроны движутся по орбиталям вокруг и атомов. По мере их движения между отрицательно заряженными электронами и положительно заряженными ядрами возникает притяжение. Эта сила притяжения удерживает атомы вместе ковалентной связью.
- Ковалентная связь
- Форма химической связи, при которой пары электронов разделяются между атомами.
Ковалентные связи являются примерами межатомных сил.
Мы рассмотрим несколько простых случаев, чтобы вывести некоторые правила, касающиеся ковалентных связей.
Помните, что только валентных электрона участвуют в связывании, и поэтому при рисовании диаграмм, показывающих, что происходит во время связывания, показаны только эти электроны. Точки или крестики обозначают электроны в разных атомах.
Точки или крестики обозначают электроны в разных атомах.
Случай 1: Два атома, каждый из которых имеет неспаренный электрон
В этом случае мы рассмотрим хлористый водород и метан.{5} \). У атома водорода есть \ (\ text {1} \) валентный электрон, а у атома хлора есть \ (\ text {7} \) валентные электроны.
Диаграммы Льюиса для водорода и хлора:
Обратите внимание на одиночный неспаренный электрон (выделен синим) на каждом атоме. Это не означает, что этот электрон отличается, мы используем здесь выделение, чтобы помочь вам увидеть неспаренный электрон.
Расположите электроны так, чтобы крайний энергетический уровень каждого атома был заполнен.
Хлористый водород представлен ниже.
Обратите внимание, как два неспаренных электрона (по одному от каждого атома) образуют ковалентную связь.
Точка и крестик между двумя атомами представляют пару электронов, которые связаны ковалентной связью. Мы также можем показать эту облигацию одной строкой:
Обратите внимание, как мы все еще показываем другие пары электронов вокруг хлора.
Из этого мы можем заключить, что любой электрон сам по себе попытается образовать пару с другим электроном. Таким образом, на практике атомы, у которых есть хотя бы один неспаренный электрон, могут образовывать связи с любым другим атомом, у которого также есть неспаренный электрон.{2} \). Каждый атом водорода имеет \ (\ text {1} \) валентный электрон, а атом углерода имеет \ (\ text {4} \) валентные электроны.
Помните, мы говорили, что можем размещать неспаренные электроны в любом месте (вверху, внизу, слева, справа) вокруг символа элемента.
Расположите электроны так, чтобы крайний энергетический уровень каждого атома был заполнен.
Молекула метана представлена ниже.
или:
Высокие оценки в науке — залог вашего успеха и будущих планов.Проверьте себя и узнайте больше о практике Сиявулы.
Зарегистрируйтесь и проверьте себя Упражнение 3.2.хлор (\ (\ text {Cl} _ {2} \))
трифторид бора (\ (\ text {BF} _ {3} \))
Случай 2: Атомы с неподеленными парами
В качестве примера возьмем воду. Вода состоит из одного атома кислорода и двух атомов водорода. Водород имеет один неспаренный электрон. Кислород имеет два неспаренных электрона и две электронные пары. Из того, что мы узнали в первых примерах, мы видим, что неспаренные электроны могут образовывать пары.{4} \).
Каждый атом водорода имеет \ (\ text {1} \) валентный электрон, а атом кислорода имеет \ (\ text {6} \) валентные электроны.
Вода состоит из одного атома кислорода и двух атомов водорода. Водород имеет один неспаренный электрон. Кислород имеет два неспаренных электрона и две электронные пары. Из того, что мы узнали в первых примерах, мы видим, что неспаренные электроны могут образовывать пары.{4} \).
Каждый атом водорода имеет \ (\ text {1} \) валентный электрон, а атом кислорода имеет \ (\ text {6} \) валентные электроны.
Расположите электроны так, чтобы крайний энергетический уровень каждого атома был заполнен.
Молекула воды представлена ниже.
или
Обратите внимание, как в этом примере мы написали \ (\ text {2} \) перед водородом? Вместо того, чтобы писать диаграмму Льюиса для водорода дважды, мы просто пишем ее один раз и используем \ (\ text {2} \) перед ней, чтобы указать, что для каждого кислорода необходимы два атома водорода.
А теперь мы можем ответить на вопросы, которые мы задавали перед отработанным примером. Мы видим, что кислород образует две связи, по одной с каждым атомом водорода. Однако кислород сохраняет свои электронные пары и не делится ими. Мы можем обобщить это на любой атом. Если у атома есть электронная пара, он обычно не разделяет эту электронную пару.
Однако кислород сохраняет свои электронные пары и не делится ими. Мы можем обобщить это на любой атом. Если у атома есть электронная пара, он обычно не разделяет эту электронную пару.
Неподеленная пара — неподеленная электронная пара. Одинокая пара остается на атоме, которому она принадлежит.
Неподеленная пара может использоваться для образования дательной ковалентной связи.
В приведенном выше примере неподеленные пары на кислороде выделены красным цветом. Когда мы рисуем пары связей с помощью линий, гораздо легче увидеть неподеленные пары на кислороде.
Упражнение 3.3.аммиак (\ (\ text {NH} _ {3} \))
дифторид кислорода (\ (\ text {OF} _ {2} \))
Случай 3: Атомы с кратными связями
Мы будем использовать кислород и цианистый водород в качестве примеров.
Рабочий пример 4: Диаграммы Льюиса: Молекулы с кратными связями
Представьте кислород (\ (\ text {O} _ {2} \)), используя диаграмму Льюиса
Для каждого атома определите количество валентных электронов, которые атом имеет, исходя из его электронной конфигурации.
 {4} \). Кислород имеет \ (\ text {6} \) валентные электроны.
{4} \). Кислород имеет \ (\ text {6} \) валентные электроны.Расположите электроны в молекуле \ (\ text {O} _ {2} \) так, чтобы крайний энергетический уровень каждого атома был заполнен.
Молекула \ (\ text {O} _ {2} \) представлена ниже. Обратите внимание на две пары электронов между двумя атомами кислорода (выделены синим). Поскольку эти две ковалентные связи находятся между одними и теми же двумя атомами, это двойная связь , .
или
Каждый атом кислорода использует свои два неспаренных электрона для образования двух связей.{2} \). Водород имеет \ (\ text {1} \) валентный электрон, углерод имеет \ (\ text {4} \) валентные электроны, а азот имеет \ (\ text {5} \) валентные электроны.
Расположите электроны в молекуле \ (\ text {HCN} \) так, чтобы крайний энергетический уровень каждого атома был заполнен.
Молекула \ (\ text {HCN} \) представлена ниже. Обратите внимание на три пары электронов (выделены красным) между атомом азота и углерода. Поскольку эти три ковалентные связи находятся между одними и теми же двумя атомами, это тройная связь .
Поскольку эти три ковалентные связи находятся между одними и теми же двумя атомами, это тройная связь .
или
Как мы только что видели, углерод делит один электрон с водородом и три с азотом. Азот сохраняет свою электронную пару и делится своими тремя неспаренными электронами с углеродом.
Упражнение 3.4.ацетилен (\ (\ text {C} _ {2} \ text {H} _ {2} \))
формальдегид (\ (\ text {CH} _ {2} \ text {O} \))
Случай 4: Координатные или дативные ковалентные связи
- Дативная ковалентная связь
- Этот тип связи представляет собой описание ковалентной связи, которая возникает между двумя атомами, в которой оба электрона, общие для связи, происходят от одного и того же атома.{+} \) не содержит электронов, и поэтому электроны, которые находятся в связи, которая образуется между этим ионом и атомом азота, происходят только от азота.
Обратите внимание, что ион водорода заряжен и что этот заряд показан на ионе аммония с помощью квадратных скобок и знака «плюс» за пределами квадратных скобок.
 {+} \)).
{+} \)).Подведем итог тому, что мы узнали:
Любой электрон сам по себе попытается образовать пару с другим электроном. Таким образом, теоретически атомы, у которых есть хотя бы один неспаренный электрон, могут образовывать связи с любым другим атомом, у которого также есть неспаренный электрон. Это не ограничивается двумя атомами.
Если у атома есть электронная пара, он обычно не разделяет эту пару, образуя связь. Эта электронная пара известна как неподеленная пара.
Если у атома более одного неспаренного электрона, он может образовывать множественные связи с другим атомом.Таким образом образуются двойные и тройные связи.
Дательная ковалентная связь может быть образована между атомом без электронов и атомом с неподеленной парой.
Атомные связи и диаграммы Льюиса
Упражнение 3.5бром (\ (\ text {Br} _ {2} \))
двуокись углерода (\ (\ text {CO} _ {2} \))
азот (\ (\ text {N} _ {2} \))
ион гидроксония (\ (\ text {H} _ {3} \ text {O} ^ {+} \))
диоксид серы (\ (\ text {SO} _ {2} \))
количество валентных электронов для каждого из атомов, участвующих в реакции
Азот: \ (\ text {5} \), водород: \ (\ text {1} \) Углерод: \ (\ text {4} \), водород: \ (\ text {1} \)
Диаграмма Льюиса продукта, который образуется
\ (\ text {NH} _ {3} \)
\ (\ text {CH} _ {4} \)
\ (\ text {NH} _ {3} \): аммиак
\ (\ text {CH} _ {4} \): метан
Сколько валентных электронов у элемента Y?
\ (\ text {6} \).
 Вокруг элемента Y есть \ (\ text {6} \) точки, и из наших знаний диаграмм Льюиса мы знаем, что они представляют собой валентные электроны.
Вокруг элемента Y есть \ (\ text {6} \) точки, и из наших знаний диаграмм Льюиса мы знаем, что они представляют собой валентные электроны.Сколько валентных электронов у элемента X?
\ (\ text {1} \). X вносит один электрон (обозначенный крестиком) в связь, а X не имеет других электронов.
Сколько ковалентных связей в молекуле?
\ (\ text {2} \) одинарные облигации.Зная диаграммы Льюиса, мы смотрим, сколько пар крестиков и точек имеется в молекуле, и это дает нам количество ковалентных связей.
Это одинарные связи, так как между соседними атомами есть только одна точка и перекрестная пара.
Предложите название для элементов X и Y.
Наиболее вероятные атомы: Y: кислород и X: водород.
Обратите внимание, что Y также может быть серой и X водородом, и тогда молекула будет сероводородом (дигидридом серы).

Заполните следующую таблицу:
Соединение
\ (\ text {CO} _ {2} \)
\ (\ text {CF} _ {4} \)
\ (\ text { HI} \)
\ (\ text {C} _ {2} \ text {H} _ {2} \)
Диаграмма Льюиса
Общее количество пар склеивания
Общее количество несвязывающих пар
Одинарное, двойное или тройное соединение
Соединение
\ (\ text {CO} _ {2} \)
\ (\ text {CF} _ {4} \)
\ (\ text { HI} \)
\ (\ text {C} _ {2} \ text {H} _ {2} \)
Диаграмма Льюиса
Общее количество пар склеивания
\ (\ text {4} \)
\ (\ text {4} \)
\ (\ text {1} \)
\ (\ text {5} \)
Общее количество не связывающих пар
\ (\ text {4} \)
\ (\ text { 12} \)
\ (\ text {3} \)
\ (\ text {0} \)
Одинарные, двойные или тройные связи
Два двойных облигации
Четыре одинарные связи
Одна одинарная связь
Одна тройная связь и две одинарные связи
Построение периодической таблицы
Электронная конфигурация Расположение электронов элемента на его атомных орбиталях.
 элемента — это расположение его электронов на его атомных орбиталях. Зная электронную конфигурацию элемента, мы можем предсказать и объяснить большую часть его химического состава.
элемента — это расположение его электронов на его атомных орбиталях. Зная электронную конфигурацию элемента, мы можем предсказать и объяснить большую часть его химического состава.Принцип Aufbau
Мы строим периодическую таблицу, следуя принципу aufbau: процесс, используемый для построения таблицы Менделеева, добавляя протоны один за другим к ядру и добавляя соответствующие электроны к орбитали с наименьшей энергией, доступной без нарушения принципа исключения Паули.(от немецкого, что означает «наращивание»). Сначала мы определяем количество электронов в атоме; затем мы добавляем электроны по одному к доступной орбитали с наименьшей энергией, не нарушая принцип Паули . Мы используем диаграмму орбитальной энергии на Рисунке 6.29 «Диаграмма уровней орбитальной энергии для типичного многоэлектронного атома», признавая, что каждая орбиталь может содержать два электрона, один со спином вверх ↑, что соответствует м s = + ½, который произвольно записывается первым, а один со спином вниз ↓, что соответствует m s = −½.
 Заполненная орбиталь обозначена ↑ ↓, в которой спины электронов называются спаренными . Вот схематическая диаграмма орбиты атома водорода в основном состоянии:
Заполненная орбиталь обозначена ↑ ↓, в которой спины электронов называются спаренными . Вот схематическая диаграмма орбиты атома водорода в основном состоянии:Из орбитальной диаграммы мы можем записать электронную конфигурацию в сокращенной форме, в которой занятые орбитали идентифицируются своим главным квантовым числом n и их значением l ( s , p , d , или f ), причем количество электронов в подоболочке указывается надстрочным индексом.Таким образом, для водорода одиночный электрон размещается на орбитали 1 s , которая является орбиталью с наименьшей энергией (Рисунок 6.29 «Диаграмма уровней орбитальной энергии для типичного многоэлектронного атома»), а конфигурация электронов записывается как 1 s 1 и читать как «один-с-один».
Нейтральный атом гелия с атомным номером 2 ( Z = 2) имеет два электрона.
. Мы помещаем один электрон на орбиталь с наименьшей энергией, орбиталь 1 s .Из принципа исключения Паули мы знаем, что орбиталь может содержать два электрона с противоположным спином, поэтому мы помещаем второй электрон на ту же орбиталь, что и первый, но направленным вниз, так что электроны спарены. Таким образом, орбитальная диаграмма атома гелия равна
Мы помещаем один электрон на орбиталь с наименьшей энергией, орбиталь 1 s .Из принципа исключения Паули мы знаем, что орбиталь может содержать два электрона с противоположным спином, поэтому мы помещаем второй электрон на ту же орбиталь, что и первый, но направленным вниз, так что электроны спарены. Таким образом, орбитальная диаграмма атома гелия равназаписывается как 1 s 2 , где верхний индекс 2 означает спаривание спинов. В противном случае наша конфигурация нарушила бы принцип Паули.
Следующим элементом является литий с Z = 3 и тремя электронами в нейтральном атоме.Мы знаем, что орбиталь 1 s может удерживать два электрона с парными спинами. Рисунок 6.29 «Орбитальная диаграмма уровней энергии для типичного многоэлектронного атома» говорит нам, что следующая орбиталь с наименьшей энергией — 2 с , поэтому орбитальная диаграмма для лития равна
.
Эта электронная конфигурация записывается как 1 s 2 2 s 1 .
Следующий элемент — бериллий с Z = 4 и четырьмя электронами.Мы заполняем обе орбитали 1 s и 2 s , чтобы получить 1 s 2 2 s 2 конфигурация электронов:
Когда мы достигаем бора с Z = 5 и пятью электронами, мы должны поместить пятый электрон на одну из 2-х орбиталей p . Поскольку все три орбитали 2 p вырождены, не имеет значения, какую из них мы выберем. Электронная конфигурация бора: 1 с 2 2 с 2 2 p 1 :
У углерода, с Z = 6 и шестью электронами, мы стоим перед выбором.Следует ли разместить шестой электрон на той же орбите 2 p , на которой уже есть электрон, или он должен пойти на одну из пустых орбиталей 2 p ? Если он войдет на пустую орбиталь 2 p , будет ли у шестого электрона спин совпадать со спином пятого электрона или быть противоположным ему? Короче говоря, какая из следующих трех орбитальных диаграмм верна для углерода, учитывая, что орбитали 2 p вырождены?
Из-за электрон-электронного отталкивания для электрона энергетически более выгодно находиться на незанятой орбитали, чем на уже занятой; следовательно, мы можем исключить вариант a.
 Точно так же эксперименты показали, что вариант b немного выше по энергии (менее стабилен), чем вариант c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться в линию с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда — правило, согласно которому электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. (названный в честь немецкого физика Фридриха Х. Хунда, 1896–1997), который сегодня говорит, что электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях.По правилу Хунда электронная конфигурация углерода, которая равна 1 s 2 2 s 2 2 p 2 , считается соответствующей орбитальной диаграмме, показанной в c. Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
Точно так же эксперименты показали, что вариант b немного выше по энергии (менее стабилен), чем вариант c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться в линию с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда — правило, согласно которому электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. (названный в честь немецкого физика Фридриха Х. Хунда, 1896–1997), который сегодня говорит, что электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях.По правилу Хунда электронная конфигурация углерода, которая равна 1 s 2 2 s 2 2 p 2 , считается соответствующей орбитальной диаграмме, показанной в c. Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
Когда мы переходим к азоту ( Z = 7, с семью электронами), правило Хунда говорит нам, что расположение с наименьшей энергией составляет
с тремя неспаренными электронами.Электронная конфигурация азота, таким образом, 1 s 2 2 s 2 2 p 3 .
У кислорода с Z = 8 и восемью электронами у нас нет выбора. Один электрон должен быть спарен с другим на одной из 2 орбиталей p , что дает нам два неспаренных электрона и электронную конфигурацию 1 s 2 2 s 2 2 p 4 . Поскольку все орбитали 2 p вырождены, не имеет значения, какая из них имеет пару электронов.
Аналогично, фтор имеет электронную конфигурацию 1 s 2 2 s 2 2 p 5 :
Когда мы дойдем до неона с Z = 10, мы заполнили подоболочку 2 p , получив 1 s 2 2 s 2 2 p 6 конфигурация электронов:
Обратите внимание, что для неона, как и для гелия, все орбитали через уровень 2 p полностью заполнены.
 Этот факт очень важен для определения как химической активности, так и связи гелия и неона, как вы увидите.
Этот факт очень важен для определения как химической активности, так и связи гелия и неона, как вы увидите.Валентные электроны
По мере того, как мы продолжаем таким образом через периодическую таблицу, записывая электронные конфигурации все больших и больших атомов, становится утомительно копировать конфигурации заполненных внутренних подоболочек. На практике химики упрощают обозначения, используя символ благородного газа в квадратных скобках, чтобы представить конфигурацию благородного газа из предыдущей строки, потому что все орбитали в благородном газе заполнены.Например, [Ne] представляет собой 1 s 2 2 s 2 2 p 6 электронную конфигурацию неона ( Z = 10), поэтому электронная конфигурация натрия, с Z = 11, что составляет 1 s 2 2 s 2 2 p 6 3 s 1 , записывается как [Ne] 3 s 1 :
Неон Z = 10 1 с 2 2 с 2 2 п 6 Натрий Z = 11 1 s 2 2 s 2 2 p 6 3 s 1 = [Ne] 3 s 1 Поскольку электроны на заполненных внутренних орбиталях расположены ближе к ядру и более тесно связаны с ним, они редко участвуют в химических реакциях.
 Это означает, что химический состав атома в основном зависит от электронов в его внешней оболочке, которые называются валентными электронами. Электроны на внешней оболочке атома. Упрощенные обозначения позволяют нам легче увидеть конфигурацию валентных электронов. Используя эти обозначения для сравнения электронных конфигураций натрия и лития, мы имеем:
Это означает, что химический состав атома в основном зависит от электронов в его внешней оболочке, которые называются валентными электронами. Электроны на внешней оболочке атома. Упрощенные обозначения позволяют нам легче увидеть конфигурацию валентных электронов. Используя эти обозначения для сравнения электронных конфигураций натрия и лития, мы имеем:Натрий 1 с 2 2 с 2 2 p 6 3 s 1 = [Ne] 3 s 1 Литий 1 с 2 2 с 1 = [He] 2 с 1 Совершенно очевидно, что и натрий, и литий имеют по одному электрону s на валентной оболочке.
 Таким образом, мы можем предсказать, что у натрия и лития очень похожий химический состав, что действительно так.
Таким образом, мы можем предсказать, что у натрия и лития очень похожий химический состав, что действительно так.По мере того, как мы продолжаем строить восемь элементов периода 3, 3 орбитали s и 3 p заполняются, по одному электрону за раз. Этот ряд завершается благородным газом аргоном, который имеет электронную конфигурацию [Ne] 3 s 2 3 p 6 , соответствующую заполненной валентной оболочке.
Пример 8
Нарисуйте орбитальную диаграмму и используйте ее, чтобы получить электронную конфигурацию фосфора, Z = 15.Какова его валентная электронная конфигурация?
Дано: атомный номер
Запрошены: орбитальная диаграмма и конфигурация валентных электронов для фосфора
Стратегия:
A Найдите ближайший благородный газ перед фосфором в периодической таблице.
 Затем вычтите его количество электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре.
Затем вычтите его количество электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре.B Ссылаясь на рисунок 6.29 «Диаграмма уровней орбитальной энергии для типичного многоэлектронного атома», нарисуйте орбитальную диаграмму для представления этих валентных орбиталей. Следуя правилу Хунда, поместите валентные электроны на доступные орбитали, начиная с орбитали с наименьшей энергией. Напишите конфигурацию электронов из вашей орбитальной диаграммы.
C Не обращайте внимания на внутренние орбитали (те, которые соответствуют электронной конфигурации ближайшего благородного газа) и запишите конфигурацию валентных электронов для фосфора.
Решение:
A Поскольку фосфор находится в третьей строке периодической таблицы, мы знаем, что он имеет замкнутую оболочку [Ne] с 10 электронами.
 Начнем с вычитания 10 электронов из 15 в фосфоре.
Начнем с вычитания 10 электронов из 15 в фосфоре.B Дополнительные пять электронов размещаются на следующих доступных орбиталях, которые, как показывает рис. 6.29 «Диаграмма уровней орбитальной энергии для типичного многоэлектронного атома», — это 3 s и 3 p орбитали:
Поскольку орбиталь 3 s имеет меньшую энергию, чем орбитали 3 p , мы заполняем ее первой:
Правило Хунда говорит нам, что оставшиеся три электрона займут вырожденные 3 p орбитали отдельно, но со своими спинами выровненными:
Электронная конфигурация [Ne] 3 s 2 3 p 3 .
C Мы получаем конфигурацию валентных электронов, игнорируя внутренние орбитали, что для фосфора означает, что мы игнорируем закрытую оболочку [Ne].
 Это дает конфигурацию валентных электронов 3 s 2 3 p 3 .
Это дает конфигурацию валентных электронов 3 s 2 3 p 3 .Упражнение
Нарисуйте орбитальную диаграмму и используйте ее для определения электронной конфигурации хлора, Z = 17. Какова его валентная электронная конфигурация?
Ответ: [Ne] 3 s 2 3 p 5 ; 3 с 2 3 с 5
Общий порядок заполнения орбиталей показан на рисунке 6.32 «Предсказание порядка заполнения орбиталей в многоэлектронных атомах». Подоболочки, соответствующие каждому значению n , записываются слева направо на последовательных горизонтальных строках, где каждая строка представляет строку в периодической таблице. Порядок заполнения орбиталей обозначен диагональными линиями, идущими от верхнего правого угла до нижнего левого угла. Соответственно, орбиталь 4 s заполняется раньше орбитали 3 d из-за эффектов экранирования и проникновения.
 Следовательно, электронная конфигурация калия, которая начинается четвертый период, равна [Ar] 4 s 1 , а конфигурация кальция — [Ar] 4 s 2 . Пять 3 орбиталей d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последний член этой строки — это благородный газ криптон ( Z = 36), [Ar] 4 s 2 3 d 10 4 p 6 = [Kr], который заполнил 4 s , 3 d и 4 p орбиталей.Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что 5 s , 4 d и 5 p орбиталей заполняются последовательно.
Следовательно, электронная конфигурация калия, которая начинается четвертый период, равна [Ar] 4 s 1 , а конфигурация кальция — [Ar] 4 s 2 . Пять 3 орбиталей d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последний член этой строки — это благородный газ криптон ( Z = 36), [Ar] 4 s 2 3 d 10 4 p 6 = [Kr], который заполнил 4 s , 3 d и 4 p орбиталей.Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что 5 s , 4 d и 5 p орбиталей заполняются последовательно.Рис. 6.32. Предсказание порядка заполнения орбиталей многоэлектронными атомами
Если вы напишете подоболочки для каждого значения главного квантового числа в последовательных строках, наблюдаемый порядок, в котором они заполняются, будет обозначен серией диагональных линий, идущих от верхнего правого до нижнего левого.

Шестая строка периодической таблицы будет отличаться от двух предыдущих, потому что 4 орбитали f , которые могут содержать 14 электронов, заполнены между 6 орбиталями s и 5 орбиталями d . Элементы, содержащие в своей валентной оболочке 4 f орбиталей, являются лантаноидами. Когда 6 орбиталей p окончательно заполнены, мы достигли следующего (и последнего известного) благородного газа, радона ( Z = 86), [Xe] 6 s 2 4 f 14 5 d 10 6 p 6 = [Rn].В последней строке 5 орбиталей f заполнены между 7 орбиталями s и 6 орбиталями d , что дает 14 актинидных элементов. Поскольку большое количество протонов делает их ядра нестабильными, все актиниды радиоактивны.
Пример 9
Запишите электронную конфигурацию ртути ( Z = 80), указав все внутренние орбитали.

Дано: атомный номер
Запрошено: Полная электронная конфигурация
Стратегия:
Используя орбитальную диаграмму на Рисунке 6.32 «Предсказание порядка заполнения орбиталей в многоэлектронных атомах» и периодическая таблица в качестве руководства заполняют орбитали до тех пор, пока не будут размещены все 80 электронов.
Решение:
Размещая электроны на орбиталях в порядке, показанном на рис. 6.32 «Прогнозирование порядка заполнения орбиталей многоэлектронными атомами» и используя периодическую таблицу в качестве руководства, мы получаем
1 с 2 ряд 1 2 электрона 2 с 2 2 с 6 ряд 2 8 электронов 3 с 2 3 с 6 ряд 3 8 электронов 4 с 2 3 d 10 4 п 6 ряд 4 18 электронов 5 с 2 4 d 10 5 п 6 ряд 5 18 электронов ряд 1–5 54 электронов После заполнения первых пяти строк у нас все еще остается 80 — 54 = 26 электронов, которые нужно разместить.
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 03 907 6 4 d p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 10 d = [Xe] 6 s 2 4 f 14 5 d 10 Согласно рис. 6.33 «Периодическая таблица, показывающая, как элементы сгруппированы в соответствии с типом подоболочки (», нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. Результат — электронная конфигурация ртути:
Согласно рис. 6.33 «Периодическая таблица, показывающая, как элементы сгруппированы в соответствии с типом подоболочки (», нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. Результат — электронная конфигурация ртути:с заполненной подоболочкой 5 d , 6 s 2 4 f 14 5 d 10 конфигурация валентной оболочки и всего 80 электронов.
 (Вы всегда должны проверять, чтобы убедиться, что общее число электронов равно атомному номеру.)
(Вы всегда должны проверять, чтобы убедиться, что общее число электронов равно атомному номеру.)Упражнение
Хотя элемент 114 недостаточно стабилен, чтобы встречаться в природе, два изотопа элемента 114 были впервые созданы в ядерном реакторе в 1999 году группой российских и американских ученых. Напишите полную электронную конфигурацию элемента 114.
Ответ: 1 с 2 2 с 2 2 p 6 3 s 2 3 p 6 4 s 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f
10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 2Электронная конфигурация элементов представлена на рисунке 6.
 34 «Электронные конфигурации элементов», в котором орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от тех, что предсказаны на рис. 6.32 «Прогнозирование порядка заполнения орбиталей в многоэлектронных атомах». Некоторые из этих аномалий возникают при заполнении орбиталей 3 d . Например, наблюдаемая электронная конфигурация хрома в основном состоянии [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 d 4 .Точно так же наблюдаемая электронная конфигурация меди — [Ar] 4 s 1 3 d 10 вместо [Ar] s 2 3 d 9 . Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( нс, 1 , np 3 , nd 5 , nf 7 ) или с ( нс 2 , np 6 , nd 10 , nf 14 ) подоболочка.
34 «Электронные конфигурации элементов», в котором орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от тех, что предсказаны на рис. 6.32 «Прогнозирование порядка заполнения орбиталей в многоэлектронных атомах». Некоторые из этих аномалий возникают при заполнении орбиталей 3 d . Например, наблюдаемая электронная конфигурация хрома в основном состоянии [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 d 4 .Точно так же наблюдаемая электронная конфигурация меди — [Ar] 4 s 1 3 d 10 вместо [Ar] s 2 3 d 9 . Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( нс, 1 , np 3 , nd 5 , nf 7 ) или с ( нс 2 , np 6 , nd 10 , nf 14 ) подоболочка. Учитывая небольшие различия между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы сместить электрон с одной орбитали на другую. В более тяжелых элементах могут быть важны и другие более сложные эффекты, приводящие к некоторым дополнительным аномалиям, показанным на Рисунке 6.34 «Электронные конфигурации элементов». Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами.Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий.
Учитывая небольшие различия между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы сместить электрон с одной орбитали на другую. В более тяжелых элементах могут быть важны и другие более сложные эффекты, приводящие к некоторым дополнительным аномалиям, показанным на Рисунке 6.34 «Электронные конфигурации элементов». Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами.Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий.Обратите внимание на узор
Дополнительная устойчивость связана с наполовину заполненными или заполненными подоболочками.
Clicker # 1 Сколько неспаренных электронов и валентных электронов у Se? А) 0; 14 Б) 2; 6 C) 2; 14 D) 0; 6 E) 2; ppt скачать
Презентация на тему: «Кликер №1 Сколько неспаренных электронов и валентных электронов у Se? A) 0; 14 B) 2; 6 C) 2; 14 D) 0; 6 E) 2; 4.
 »- стенограмма презентации:
»- стенограмма презентации:1 Clicker # 1 Сколько неспаренных электронов и валентных электронов у Se? А) 0; 14 Б) 2; 6 C) 2; 14 D) 0; 6 E) 2; 4
2 Атомные тенденции Атомный радиус: размер орбитали H F Fr уменьшается, увеличивается
3 Атомные тенденции Атомный радиус: размер орбиты H F Fr уменьшается, увеличивается Больше протонов = больше притяжения и меньший радиус Орбитали становятся больше и дальше от ядра
4 Кликер №2 Какой из следующих элементов имеет наибольший атомный радиус? A) Ca B) Al C) N D) Sr E) F
5 Атомные тенденции Энергия ионизации H F Fr возрастает убывает
6 Атомные тенденции Энергия ионизации H F Fr увеличивается уменьшается Электрон находится в самом низком энергетическом состоянии, когда он находится ближе всего к ядру требует больше энергии, чтобы унести электрон, когда он ближе к ядру
7 Кликер №3 Какой из следующих элементов имеет самую большую энергию ионизации? A) P B) Al C) Cl D) Ba E) K
8 Изоэлектронная серия Такое же количество электронов Пример: что больше Na + или Ne?
9 Изоэлектронная серия Такое же количество электронов Пример: что больше Na + или Ne? Такое же количество электронов, но у Na + 11 протонов, а у Ne 10 протонов.

10 Пример Что больше Cl- или Ar? Что имеет более высокую энергию ионизации Cl- или Ar?
11 Пример Что больше Cl- или Ar? Что имеет более высокую энергию ионизации Cl- или Ar?
12 СВЯЗЬ «Силы» Что подразумевается под «химической связью»? Почему атомы связываются, образуя молекулы? Как атомы связываются, образуя молекулы?
13 СВЯЗЬ Два типа связи внутримолекулярная (внутри молекулы) Межмолекулярная (между молекулами)
14 Ионные соединения между металлом и неметаллом Пример: NaCl Na: [Ne] 3s 1 Cl: [Ne] 3s 2 3p 5
15 Ионные соединения между металлом и неметаллом Пример: NaCl Na: [Ne] 3s 1 Na +: [Ne] Cl: [Ne] 3s 2 3p 5 Cl -: [Ne] 3s 2 3p 6
16 Mg -> Mg + -> Mg 2+ Энергии ионизации атомов сильно эндотермичны, ОДНАКО… Требуется больше энергии для удаления 2-го электрона.
 Как только вы получаете Mg 2+ (конфигурация благородного газа), выделяет энергию В целом = ЭКЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
Как только вы получаете Mg 2+ (конфигурация благородного газа), выделяет энергию В целом = ЭКЗОТЕРМИЧЕСКИЙ ПРОЦЕСС17 Связь в H 2 Это ионно?
18 Связь в H 2 Ковалентная связь Обмен электронами Водороды разделяют электроны и имеют конфигурацию благородного газа. Почему He не двухатомный?
19 Связь в H 2 Ковалентная связь Обмен электронами Водороды разделяют электроны и имеют конфигурацию благородного газа. Почему He не двухатомный? Уже есть конфигурация с благородным газом
20 Следовательно … Ковалентная связь имеет ту же идею, что и ионная связь … Но ни один атом не является «достаточно сильным», чтобы удалить электрон от другого атома.
21 год А как насчет CO?
Точечные структуры Льюиса | Grandinetti Group
Во время химической связи валентные электроны перемещаются между различными атомами.
 Чтобы отслеживать валентные электроны для каждого атома и то, как они могут быть разделены при связывании, мы используем точечную структуру Льюиса для атомов и молекул. В этом подходе мы представляем валентные электроны в виде точек вокруг символа элемента. Например, кислород имеет 6 валентных электронов, поэтому мы пишем символ O для кислорода и окружаем его 6 точками:
Чтобы отслеживать валентные электроны для каждого атома и то, как они могут быть разделены при связывании, мы используем точечную структуру Льюиса для атомов и молекул. В этом подходе мы представляем валентные электроны в виде точек вокруг символа элемента. Например, кислород имеет 6 валентных электронов, поэтому мы пишем символ O для кислорода и окружаем его 6 точками:Неспаренные электроны представлены одиночными точками, а спаренные электроны — двойными точками. Размещение одинарных или двойных точек вокруг символа не критично.В качестве альтернативы мы можем представить спаренные электроны в виде линии. То есть мы заменяем двойные точки, как показано ниже:
Рассмотрим другие примеры. У атома натрия 11 электронов, но только один является валентным электроном. Остальные 10 находятся внутри закрытой оболочки с электронной конфигурацией неона. Таким образом, мы рисуем структуру Льюиса для атома натрия как символ Na с единственной точкой:
У атома хлора 17 электронов, но только 7 из них валентные.
 Таким образом, мы рисуем структуру Льюиса как:
Таким образом, мы рисуем структуру Льюиса как:В ионных связях валентных электрона полностью переносятся (не разделяются).Таким образом, мы запишем структуру Льюиса для NaCl как:
Как вы можете видеть, теперь хлор окружен 8 электронами в оболочке с n = 3, а натрий потерял свой один валентный электрон в оболочке с n = 3. Конечно, натрий все еще окружен 8 электронами оболочки n = 2, но мы не показываем электроны во внутренних замкнутых оболочках.
Для элементов периода 2, где все валентные электроны атома находятся на s- и p-орбиталях, мы обнаруживаем, что точечная структура молекул Льюиса часто подчиняется правилу Октета:
Правило октетов — Атомы имеют тенденцию приобретать, терять или делиться электронами, пока они не окружены восемью электронами (4 пары электронов).
Используя точечные структуры Льюиса и правило октетов, мы можем предсказать и представить электронную структуру ковалентно связанных молекул.
 Например, когда два атома хлора, каждый с 7 валентными электронами, объединяются, чтобы сформировать двухатомную молекулу хлора, структура Льюиса показывает, что будет разделение двух электронов между двумя атомами хлора, что позволяет окружать оба атома хлора 8 электроны.
Например, когда два атома хлора, каждый с 7 валентными электронами, объединяются, чтобы сформировать двухатомную молекулу хлора, структура Льюиса показывает, что будет разделение двух электронов между двумя атомами хлора, что позволяет окружать оба атома хлора 8 электроны.Конечно, водород — это элемент с периодом 1, с орбиталью всего в 1 с, поэтому он имеет максимум два электрона, разрешенных в его валентной оболочке.Когда два атома водорода объединяются в двухатомную молекулу H 2 , структура Льюиса показывает, что два электрона разделяются между двумя атомами водорода, что позволяет окружить оба атома водорода замкнутой n = 1 оболочкой из 2 электронов:
Мы можем представить электронную структуру и реакцию атомов водорода и хлора с образованием HCl с помощью структур Льюиса:
Для двухатомного кислорода точечная структура Льюиса предсказывает двойную связь.
Хотя диаграмма Льюиса правильно предсказывает наличие двойной связи между атомами O, она неверно предсказывает, что все валентные электроны спарены ( i.
 е. , он предсказывает, что каждый валентный электрон находится на орбитали с другим электроном противоположного спина). Позже мы рассмотрим более продвинутый теоретический подход под названием «Теория молекулярных орбиталей», который правильно предсказывает как двойную связь O 2 , так и его неспаренные валентные электроны. Как правило, точечные структуры Льюиса имеют то преимущество, что с ними легко работать, и они часто дают хорошее представление об электронной структуре. Рассмотрим другой пример. Для двухатомного азота структура точек Льюиса правильно предсказывает наличие тройной связи между атомами азота:
е. , он предсказывает, что каждый валентный электрон находится на орбитали с другим электроном противоположного спина). Позже мы рассмотрим более продвинутый теоретический подход под названием «Теория молекулярных орбиталей», который правильно предсказывает как двойную связь O 2 , так и его неспаренные валентные электроны. Как правило, точечные структуры Льюиса имеют то преимущество, что с ними легко работать, и они часто дают хорошее представление об электронной структуре. Рассмотрим другой пример. Для двухатомного азота структура точек Льюиса правильно предсказывает наличие тройной связи между атомами азота:Эта тройная связь очень сильна.Прочность тройной связи делает молекулу N 2 очень устойчивой к химическим изменениям, и, фактически, N 2 считается химически инертным газом . Существует взаимосвязь между количеством общих электронных пар. и длина связи.
Соединение Длина соединения Н-Н 1,47 Å N = N 1,24 Å NN 1.  10 Å
10 ÅРасстояние между связанными атомами уменьшается с увеличением количества общих электронных пар.
Демо:- Модели с шаром и рукоятью NH 2 -NH 2 , NH = NH, Конструкции N≡N
Практический тест 5Примечание. Эти вопросы являются репрезентативными для типов вопросов, которые вы можете ожидать от теста. Воспользуйтесь таблицами потенциалов редукции из учебника. Фактический тест будет более длинным, обычно между 20-40 вопросами.На каждый тест нужно будет приносить лист ответов СКАНТРОН.
1. Электронная конфигурация иона Fe 2+ :
a. [Ar] 4s 2 4d 4
б. [Ar] 4s 2 3d 6
c. [Ар] 3d 3
d. [Ар] 3d 5
е. [Ar] 3d 62. Сколько 3d-электронов имеет ион Mn 2+ ?
а. 1
б. 2
c. 3
3
d. 4
е. 53. Какой из следующих лигандов дает самое слабое кристаллическое поле?
а. Br —
б. Класс —
c. H 2 O
d. NH 3
е. CN —4. В комплексном ионе [Fe (CN) 6 ] 4- степень окисления Fe составляет:
a. +1
б. +2
c. +3
d. — 4
е. +65.Что из следующего является бидентатным лигандом?
а. КН —
б. NH 3
c. CO
d. H 2 NCH 2 CH 2 NH 2 (этилендиамин)
е. EDTA6. Лучшее название для [Ru (NH 3 ) 2 (en)] (NO 3 ) 2 :
a. (этилендиамин) диамминерутения (II) нитрат
б. диамминбис (этилендиамин) нитрат рутения (III)
c.диаммин (этилендиамин) нитрат рутения (II)
d. диаммин (этилендиамин) нитраторутений (III)
e. бис (этилен) диаминенитратораутенат (II)
бис (этилен) диаминенитратораутенат (II)7. В комплексном ионе ML 6 n + , Mn + имеет семь d-электронов, а L является лигандом со слабым полем. Согласно теории кристаллического поля магнитные свойства комплексного иона соответствуют сколько неспаренных электронов?
а. 0
б. 1
c. 2
d.3
е. 58. Комплексный ион [Cr (CN) 6 ] 4- обладает магнитными свойствами, которые соответствуют сколько неспаренных электронов?
а. 0
б. 1
c. 2
d. 3
е. 49. Ион [Co (NH 3 ) 6 ] 2+ является октаэдрическим и высокоспиновым. Это комплекс:
а. парамагнитный, с 1 неспаренным электроном.
б. парамагнитный, с 3 неспаренными электронами.
c.парамагнитный, с 4 неспаренными электронами.
d. парамагнитный, с 5 неспаренными электронами.
е. диамагнитный10. Какую геометрию демонстрирует [CoF 6 ] 3-?
а.
 четырехгранный
четырехгранный
б. восьмигранный
c. квадратный плоский
d. тригонально-бипирамидный11. Какая формула соответствует сульфату тетрамминмеди (II)?
а. [Cu (NH 3 )] SO 4
б. [Cu (NH 3 ) 4 ] SO 4
c.[Cu (NH 3 ) 5 ] SO 4
d. [Cu 2 (NH 2 ) 2 ] SO 4
е. [Cu 2 (NH 3 ) 4 ] SO 412. Бета-частицы идентичны:
a. протоны
б. атомы гелия
c. атомы водорода
d. ядра гелия
e электроны13. Радиоизотоп распадается с образованием альфа-частицы и Pb-208. Что было оригинальным элементом?
а.Se
б. Би
c. Po
d. Hg
е. Rn14. Какой символ отсутствует в этой реакции деления плутония?
а. барий-148
б. бета-частица
c. ксенон-143
d.


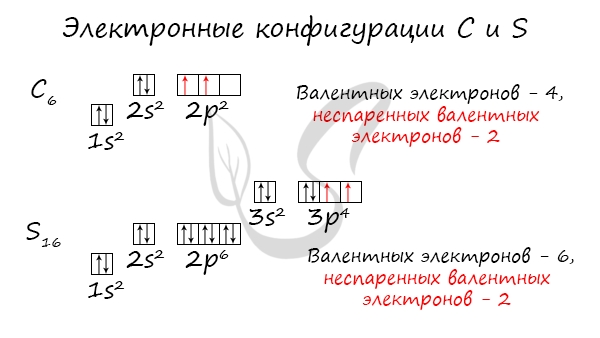 Поисковые системы предлагают спам.
Прочиталa тыщу страниц
Поисковые системы предлагают спам.
Прочиталa тыщу страниц
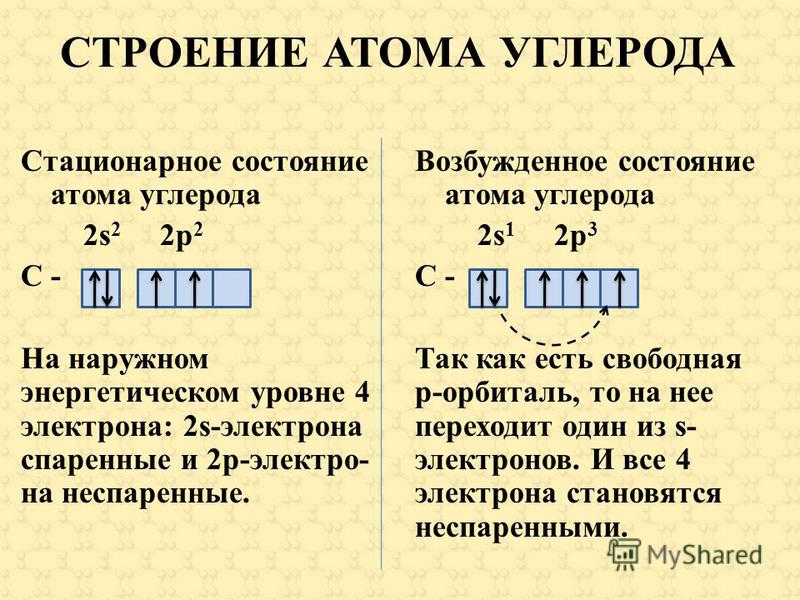 .. в) кальция с водородом; г) алюминия с фтором; д) алюминия с кислородом. …
.. в) кальция с водородом; г) алюминия с фтором; д) алюминия с кислородом. … .. А9. Электронная формула, отображающая строение иона Mg2+ …
.. А9. Электронная формула, отображающая строение иона Mg2+ … {+} \)).
{+} \)).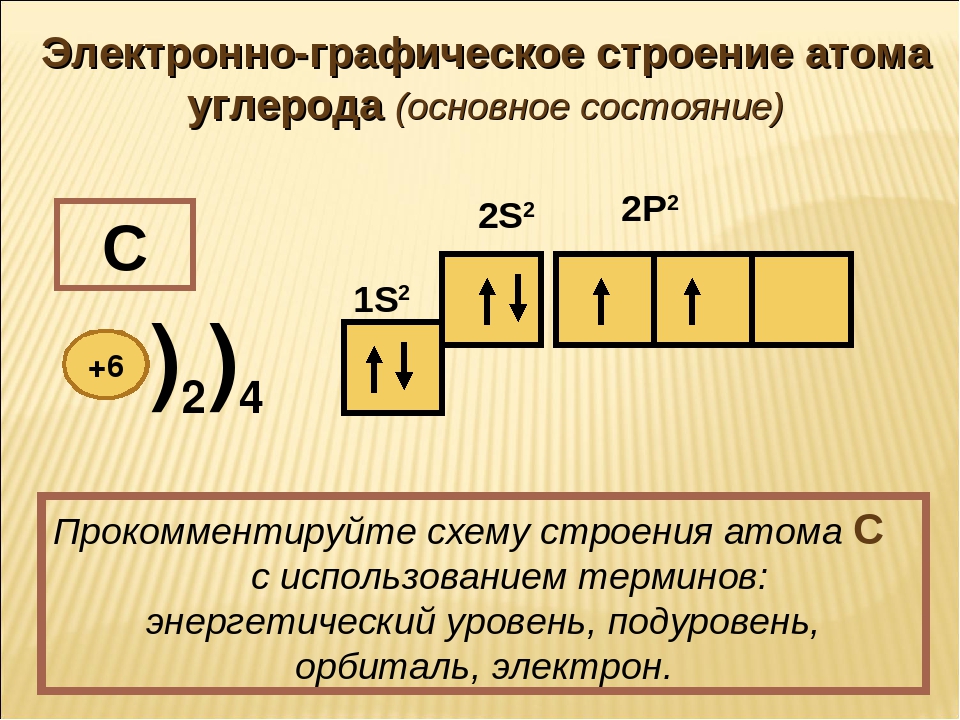 Вокруг элемента Y есть \ (\ text {6} \) точки, и из наших знаний диаграмм Льюиса мы знаем, что они представляют собой валентные электроны.
Вокруг элемента Y есть \ (\ text {6} \) точки, и из наших знаний диаграмм Льюиса мы знаем, что они представляют собой валентные электроны.
 элемента — это расположение его электронов на его атомных орбиталях. Зная электронную конфигурацию элемента, мы можем предсказать и объяснить большую часть его химического состава.
элемента — это расположение его электронов на его атомных орбиталях. Зная электронную конфигурацию элемента, мы можем предсказать и объяснить большую часть его химического состава.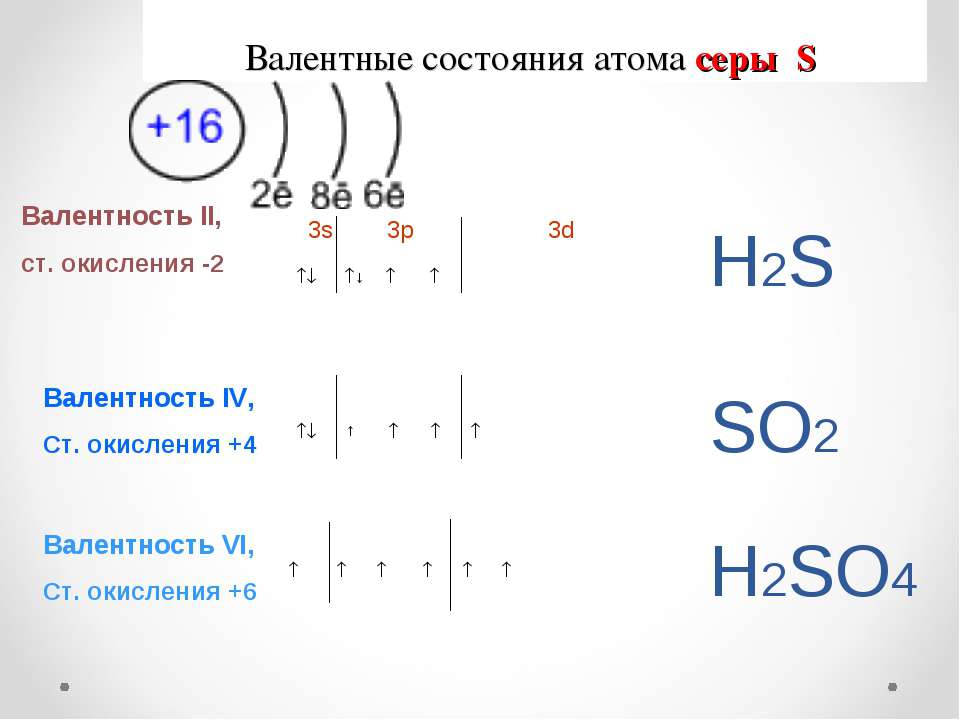 Заполненная орбиталь обозначена ↑ ↓, в которой спины электронов называются спаренными . Вот схематическая диаграмма орбиты атома водорода в основном состоянии:
Заполненная орбиталь обозначена ↑ ↓, в которой спины электронов называются спаренными . Вот схематическая диаграмма орбиты атома водорода в основном состоянии: Мы помещаем один электрон на орбиталь с наименьшей энергией, орбиталь 1 s .Из принципа исключения Паули мы знаем, что орбиталь может содержать два электрона с противоположным спином, поэтому мы помещаем второй электрон на ту же орбиталь, что и первый, но направленным вниз, так что электроны спарены. Таким образом, орбитальная диаграмма атома гелия равна
Мы помещаем один электрон на орбиталь с наименьшей энергией, орбиталь 1 s .Из принципа исключения Паули мы знаем, что орбиталь может содержать два электрона с противоположным спином, поэтому мы помещаем второй электрон на ту же орбиталь, что и первый, но направленным вниз, так что электроны спарены. Таким образом, орбитальная диаграмма атома гелия равна
 Точно так же эксперименты показали, что вариант b немного выше по энергии (менее стабилен), чем вариант c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться в линию с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда — правило, согласно которому электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. (названный в честь немецкого физика Фридриха Х. Хунда, 1896–1997), который сегодня говорит, что электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях.По правилу Хунда электронная конфигурация углерода, которая равна 1 s 2 2 s 2 2 p 2 , считается соответствующей орбитальной диаграмме, показанной в c. Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
Точно так же эксперименты показали, что вариант b немного выше по энергии (менее стабилен), чем вариант c, потому что электроны на вырожденных орбиталях предпочитают выстраиваться в линию с параллельными спинами; таким образом, мы можем исключить вариант b. Вариант c иллюстрирует правило Хунда — правило, согласно которому электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях. (названный в честь немецкого физика Фридриха Х. Хунда, 1896–1997), который сегодня говорит, что электронная конфигурация атома с наименьшей энергией — это та, которая имеет максимальное количество электронов с параллельными спинами на вырожденных орбиталях.По правилу Хунда электронная конфигурация углерода, которая равна 1 s 2 2 s 2 2 p 2 , считается соответствующей орбитальной диаграмме, показанной в c. Экспериментально установлено, что основное состояние нейтрального атома углерода действительно содержит два неспаренных электрона.
 Этот факт очень важен для определения как химической активности, так и связи гелия и неона, как вы увидите.
Этот факт очень важен для определения как химической активности, так и связи гелия и неона, как вы увидите. Это означает, что химический состав атома в основном зависит от электронов в его внешней оболочке, которые называются валентными электронами. Электроны на внешней оболочке атома. Упрощенные обозначения позволяют нам легче увидеть конфигурацию валентных электронов. Используя эти обозначения для сравнения электронных конфигураций натрия и лития, мы имеем:
Это означает, что химический состав атома в основном зависит от электронов в его внешней оболочке, которые называются валентными электронами. Электроны на внешней оболочке атома. Упрощенные обозначения позволяют нам легче увидеть конфигурацию валентных электронов. Используя эти обозначения для сравнения электронных конфигураций натрия и лития, мы имеем: Таким образом, мы можем предсказать, что у натрия и лития очень похожий химический состав, что действительно так.
Таким образом, мы можем предсказать, что у натрия и лития очень похожий химический состав, что действительно так. Затем вычтите его количество электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре.
Затем вычтите его количество электронов из количества электронов в фосфоре, чтобы получить количество валентных электронов в фосфоре. Начнем с вычитания 10 электронов из 15 в фосфоре.
Начнем с вычитания 10 электронов из 15 в фосфоре. Это дает конфигурацию валентных электронов 3 s 2 3 p 3 .
Это дает конфигурацию валентных электронов 3 s 2 3 p 3 . Следовательно, электронная конфигурация калия, которая начинается четвертый период, равна [Ar] 4 s 1 , а конфигурация кальция — [Ar] 4 s 2 . Пять 3 орбиталей d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последний член этой строки — это благородный газ криптон ( Z = 36), [Ar] 4 s 2 3 d 10 4 p 6 = [Kr], который заполнил 4 s , 3 d и 4 p орбиталей.Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что 5 s , 4 d и 5 p орбиталей заполняются последовательно.
Следовательно, электронная конфигурация калия, которая начинается четвертый период, равна [Ar] 4 s 1 , а конфигурация кальция — [Ar] 4 s 2 . Пять 3 орбиталей d заполнены следующими 10 элементами, переходными металлами, за которыми следуют три орбитали 4 p . Обратите внимание, что последний член этой строки — это благородный газ криптон ( Z = 36), [Ar] 4 s 2 3 d 10 4 p 6 = [Kr], который заполнил 4 s , 3 d и 4 p орбиталей.Пятая строка периодической таблицы по существу такая же, как и четвертая, за исключением того, что 5 s , 4 d и 5 p орбиталей заполняются последовательно.

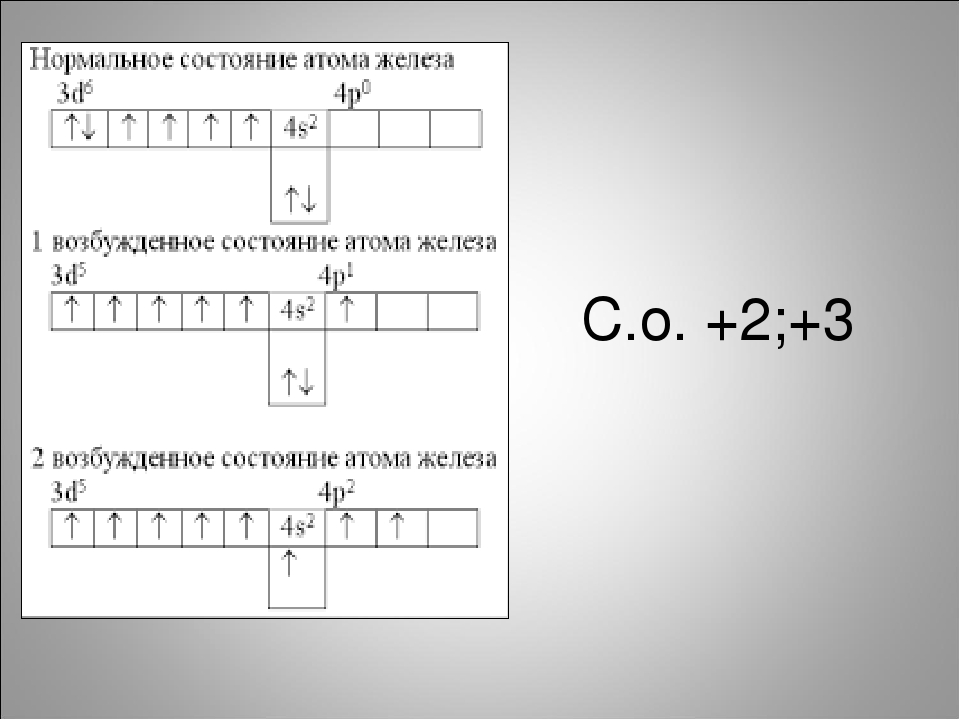 Согласно рис. 6.33 «Периодическая таблица, показывающая, как элементы сгруппированы в соответствии с типом подоболочки (», нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. Результат — электронная конфигурация ртути:
Согласно рис. 6.33 «Периодическая таблица, показывающая, как элементы сгруппированы в соответствии с типом подоболочки (», нам нужно заполнить 6 s (2 электрона), 4 f (14 электронов) и 5 d (10 электронов) орбиталей. Результат — электронная конфигурация ртути: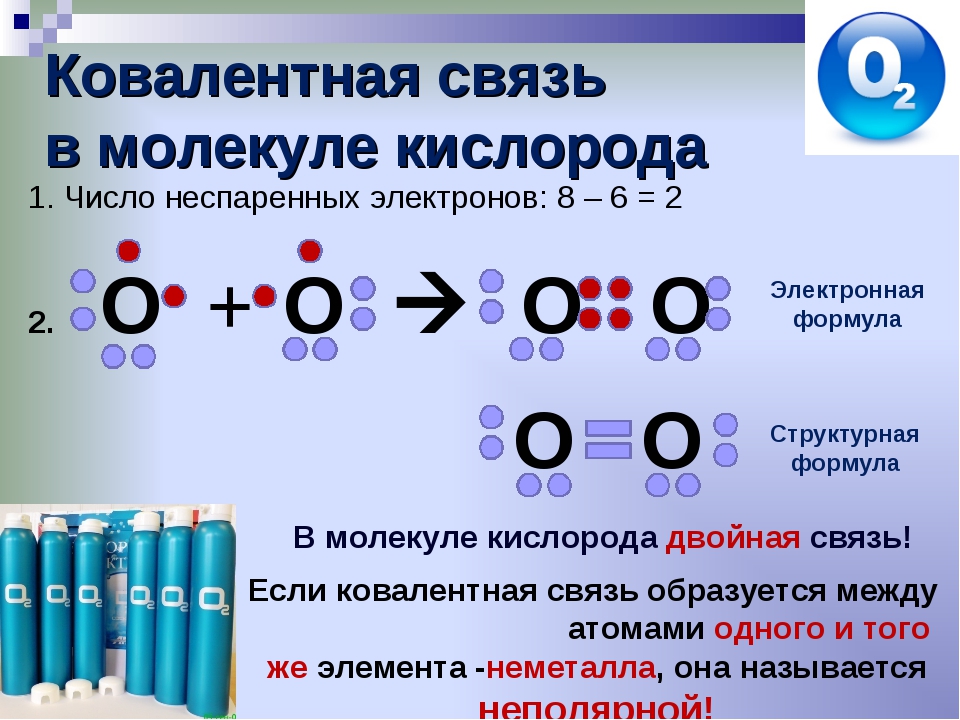 (Вы всегда должны проверять, чтобы убедиться, что общее число электронов равно атомному номеру.)
(Вы всегда должны проверять, чтобы убедиться, что общее число электронов равно атомному номеру.)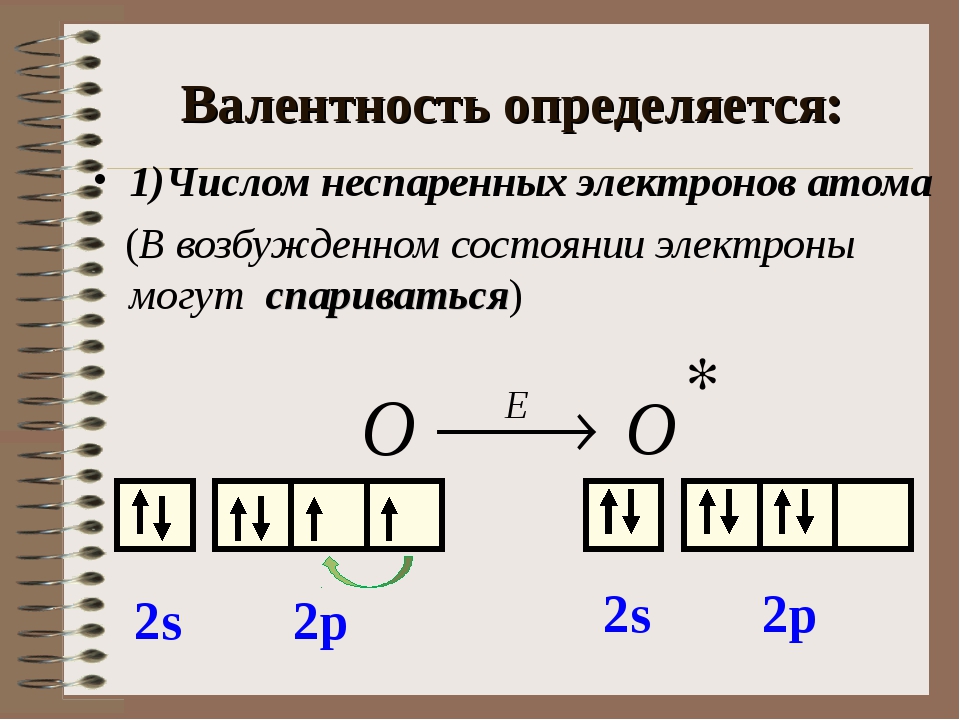 34 «Электронные конфигурации элементов», в котором орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от тех, что предсказаны на рис. 6.32 «Прогнозирование порядка заполнения орбиталей в многоэлектронных атомах». Некоторые из этих аномалий возникают при заполнении орбиталей 3 d . Например, наблюдаемая электронная конфигурация хрома в основном состоянии [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 d 4 .Точно так же наблюдаемая электронная конфигурация меди — [Ar] 4 s 1 3 d 10 вместо [Ar] s 2 3 d 9 . Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( нс, 1 , np 3 , nd 5 , nf 7 ) или с ( нс 2 , np 6 , nd 10 , nf 14 ) подоболочка.
34 «Электронные конфигурации элементов», в котором орбитали перечислены в порядке их заполнения. В некоторых случаях электронные конфигурации в основном состоянии отличаются от тех, что предсказаны на рис. 6.32 «Прогнозирование порядка заполнения орбиталей в многоэлектронных атомах». Некоторые из этих аномалий возникают при заполнении орбиталей 3 d . Например, наблюдаемая электронная конфигурация хрома в основном состоянии [Ar] 4 s 1 3 d 5 , а не предсказанная [Ar] 4 s 2 3 d 4 .Точно так же наблюдаемая электронная конфигурация меди — [Ar] 4 s 1 3 d 10 вместо [Ar] s 2 3 d 9 . Фактическая электронная конфигурация может быть рационализирована с точки зрения дополнительной стабильности, связанной с наполовину заполненным ( нс, 1 , np 3 , nd 5 , nf 7 ) или с ( нс 2 , np 6 , nd 10 , nf 14 ) подоболочка.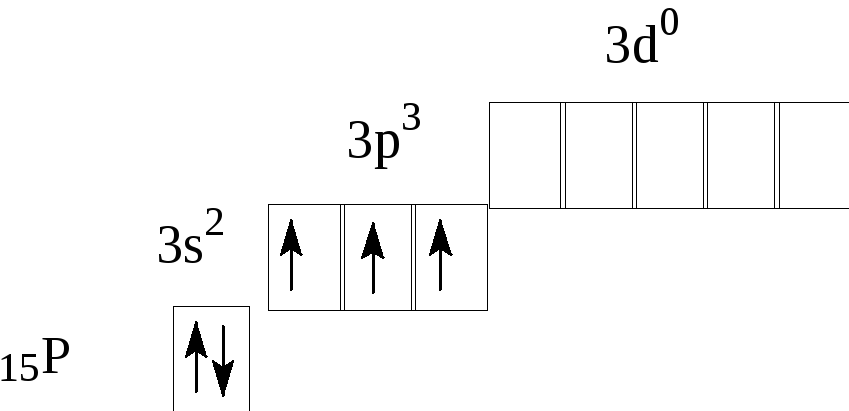 Учитывая небольшие различия между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы сместить электрон с одной орбитали на другую. В более тяжелых элементах могут быть важны и другие более сложные эффекты, приводящие к некоторым дополнительным аномалиям, показанным на Рисунке 6.34 «Электронные конфигурации элементов». Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами.Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий.
Учитывая небольшие различия между более высокими энергетическими уровнями, этой дополнительной стабильности достаточно, чтобы сместить электрон с одной орбитали на другую. В более тяжелых элементах могут быть важны и другие более сложные эффекты, приводящие к некоторым дополнительным аномалиям, показанным на Рисунке 6.34 «Электронные конфигурации элементов». Например, церий имеет электронную конфигурацию [Xe] 6 s 2 4 f 1 5 d 1 , что невозможно объяснить простыми словами.Однако в большинстве случаев эти очевидные аномалии не имеют важных химических последствий. »- стенограмма презентации:
»- стенограмма презентации: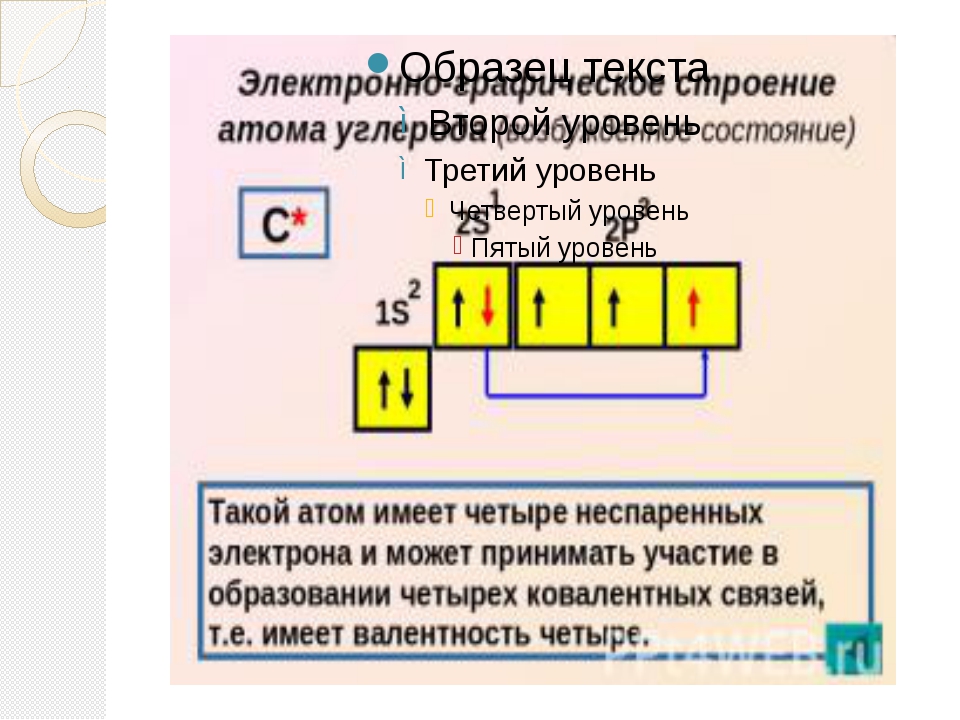
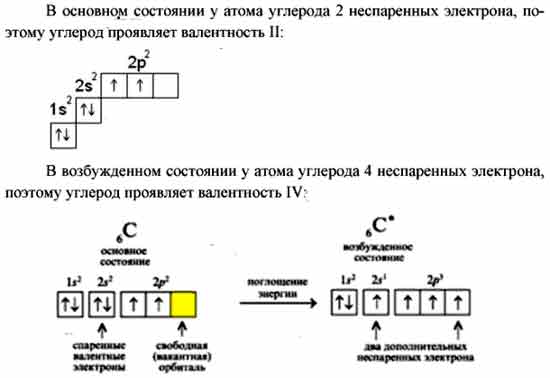 Как только вы получаете Mg 2+ (конфигурация благородного газа), выделяет энергию В целом = ЭКЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
Как только вы получаете Mg 2+ (конфигурация благородного газа), выделяет энергию В целом = ЭКЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Чтобы отслеживать валентные электроны для каждого атома и то, как они могут быть разделены при связывании, мы используем точечную структуру Льюиса для атомов и молекул. В этом подходе мы представляем валентные электроны в виде точек вокруг символа элемента. Например, кислород имеет 6 валентных электронов, поэтому мы пишем символ O для кислорода и окружаем его 6 точками:
Чтобы отслеживать валентные электроны для каждого атома и то, как они могут быть разделены при связывании, мы используем точечную структуру Льюиса для атомов и молекул. В этом подходе мы представляем валентные электроны в виде точек вокруг символа элемента. Например, кислород имеет 6 валентных электронов, поэтому мы пишем символ O для кислорода и окружаем его 6 точками: Таким образом, мы рисуем структуру Льюиса как:
Таким образом, мы рисуем структуру Льюиса как: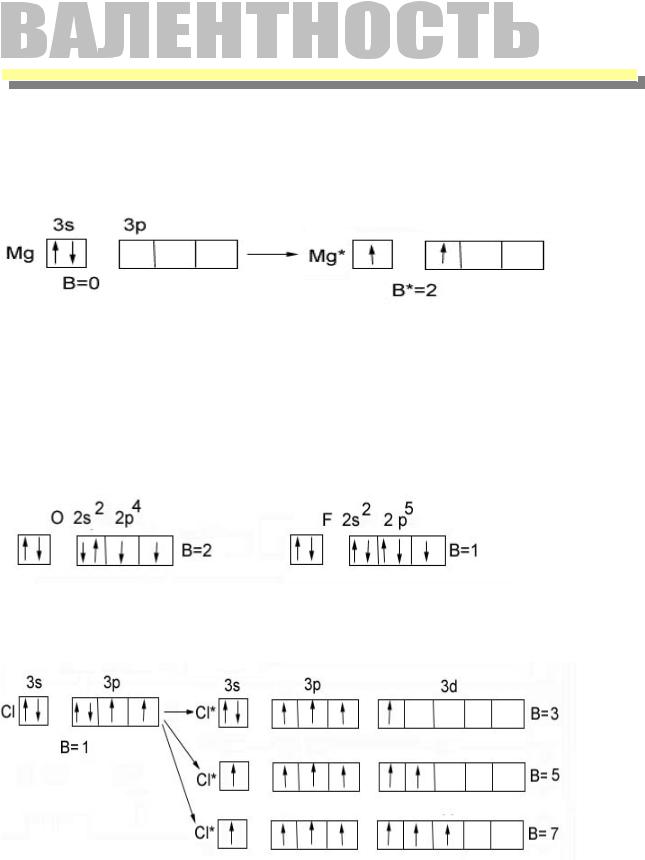 Например, когда два атома хлора, каждый с 7 валентными электронами, объединяются, чтобы сформировать двухатомную молекулу хлора, структура Льюиса показывает, что будет разделение двух электронов между двумя атомами хлора, что позволяет окружать оба атома хлора 8 электроны.
Например, когда два атома хлора, каждый с 7 валентными электронами, объединяются, чтобы сформировать двухатомную молекулу хлора, структура Льюиса показывает, что будет разделение двух электронов между двумя атомами хлора, что позволяет окружать оба атома хлора 8 электроны. е. , он предсказывает, что каждый валентный электрон находится на орбитали с другим электроном противоположного спина). Позже мы рассмотрим более продвинутый теоретический подход под названием «Теория молекулярных орбиталей», который правильно предсказывает как двойную связь O 2 , так и его неспаренные валентные электроны. Как правило, точечные структуры Льюиса имеют то преимущество, что с ними легко работать, и они часто дают хорошее представление об электронной структуре. Рассмотрим другой пример. Для двухатомного азота структура точек Льюиса правильно предсказывает наличие тройной связи между атомами азота:
е. , он предсказывает, что каждый валентный электрон находится на орбитали с другим электроном противоположного спина). Позже мы рассмотрим более продвинутый теоретический подход под названием «Теория молекулярных орбиталей», который правильно предсказывает как двойную связь O 2 , так и его неспаренные валентные электроны. Как правило, точечные структуры Льюиса имеют то преимущество, что с ними легко работать, и они часто дают хорошее представление об электронной структуре. Рассмотрим другой пример. Для двухатомного азота структура точек Льюиса правильно предсказывает наличие тройной связи между атомами азота: 10 Å
10 Å 3
3  бис (этилен) диаминенитратораутенат (II)
бис (этилен) диаминенитратораутенат (II) четырехгранный
четырехгранный 
Leave A Comment