Дубы | Экология, лес и почва
Posted on 03.11.2012
На территории нашего государства вид распространен в Амурской области, Хабаровском и Приморском краях. Растет на южных инсолируемых склонах, на равнине и в долинах, поднимается в горы, где может произрастать на каменистых склонах, являясь одним из пионеров процесса первичной сукцессии.
В благоприятных условиях это дерево первой величины (первого яруса), до 30 метров высоты. В неблагоприятных же (в горах, на приморских побережьях, в условиях тундры) деревья малорослые, величиной с небольшой кустарник. Отличительной особенностью дуба монгольского является его долговечность и способность переносить низкие температуры. Целесообразно изучить этот дуб на возможность использования генов устойчивости. Число хромосом у данного вида 2n = 24.
Этот вид дуба легко отличить по очень плотным листьям на коротком черешке, длиной до 15 см и шириной до 7 — 8 см, обратно-яйцевидной формы.
Дуб монгольский — очень перспективная порода для скрещиванием с дубом черешчатым и создания засухоустойчивого сорта для лесоразведения в засушливых условий Европейской части РФ.
|
|
|
Для увеличения — кликните по фото или картинке.
Posted in Древесные породы, Дубы
Posted on 03.11.2012
Дерево второй (третьей) величины, обычно с извилистым, сильно сбежистым стволом, покрытом пепельно-серой трещиноватой корой. Весьма светолюбив и засухоустойчив (ксерофит). Произрастает почти исключительно на карбонатных почвах (высокое содержание извести). На очень сухих почвах южных склонов высота его группировок не превышает 8 — 10 м; на более влажных почвах известняковых плато иногда достигает производительности второго класса бонитета и высоты 20 — 25 м (Майкопский ботанический округ).
В пределах бывшего СССР распространен в Крыму и Закавказье. Максимальная высота, на которой зафиксировано произрастание растений этого вида — чуть более 400 м над уровнем моря.
Большой полиморфизм у дуба пушистого проявляется по величине, форме, рассеченности, опушению листьев и т. п. Число хромосом 2n = 24. Растение обладает чрезвычайно полезным свойством — его сеянцы используются в качестве подвоя для других пород дуба, менее ксерофитных и более теплолюбивых.
п. Число хромосом 2n = 24. Растение обладает чрезвычайно полезным свойством — его сеянцы используются в качестве подвоя для других пород дуба, менее ксерофитных и более теплолюбивых.
Свое название предположительно получил от того, что молодые побеги сильно опушены, то же можно сказать и о желудях.
Posted in Древесные породы, Дубы
Posted on 03.11.2012
Многие люди, далекие от науки ботаники, когда речь идет о дубе, даже не представляют, что на самом деле видов этого растения много. У нас произрастает лишь один, но и, к примеру, с описываемым дубом крупнопыльниковым может познакомиться каждый, достаточно только заинтересоваться и вбить в поисковике куплю бонсай, одним из предложенных удивительных по красоте растеньиц будет именно этот вид. В природе же это — дерево первой величины.
Свое название растение получило благодаря пыльниковым серёжкам длина которых составляет 10 — 15 см, с густо опушённым стержнем; пыльники крупные, до 1,5 мм длиной. Это нехарактерно для всех остальных дубов.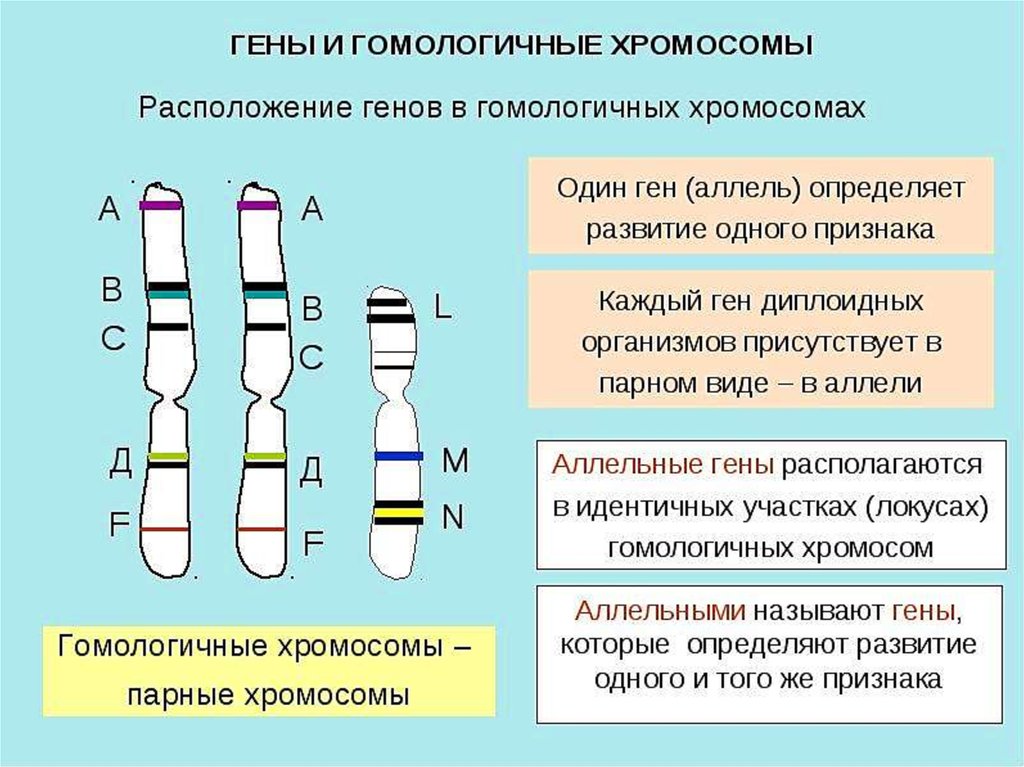 Желуди же внешне очень похожи на привычные нам желуди дуба черешчатого.
Желуди же внешне очень похожи на привычные нам желуди дуба черешчатого.
Распространен этот вид дуба на Кавказе и в Малой Азии. Очень засухоустойчив, при этом — самый холодостойкий из всех кавказских дубов. Может расти на самом разнообразном субстрате, начиная от скал и кончая почвами мощностью до 1,0 — 1,5 м. На скальных местообитаниях в возрасте около 200 лет его высота достигает 10 — 12 м, на более плодородных почвах развивается в мощное дерево высотой 25 — 30 м и диаметром 1,5 м. Таким образом, этот вид — один из самых высокогорных (до 2500 м над уровнем моря).
По качеству древесины он не уступает дубу черешчатому. Выделяются формы по рассеченности и опушению листовых пластинок. Представляет интерес для отдаленной межвидовой гибридизации в качестве материнской особи. Самые ценные гибриды были получены при скрещивании дуба крупнопыльникового с другими видами. У этого вида встречаются формы, имеющие как 2n = 24, так и 2n = 22 хромосомы.
Posted in Древесные породы, Дубы
Posted on 03.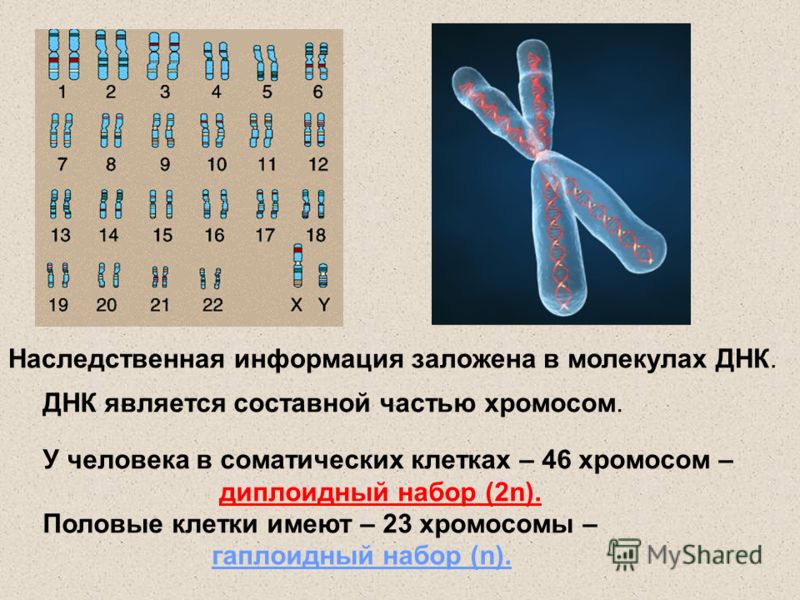
Дерево первой величины (30 — 38 м), стройное с характерным малосбежистым стволом. Его особая структура давно замечена человеком и используется в декоративных целях, в частности, именно из этой породы можно чаще всего бонсай купить, при этом растение формируется десятилетиями.
По морфологическим признакам дуб скальный близок к самому распространенному из рода дубу черешчатому, но имеет некоторые отличия по форме кроны, коре, листьям, плодам (желудям). Более требователен к теплу, более теневынослив, менее требователен к богатству и влажности почвы. Экологическим оптимум его являются легкие, бурые, достаточно глубокие почвы. Естественный ареал дуба скального распространяется значительно южнее дуба черешчатого, и в нашей стране почти не встречается в естественной природе, хотя и имеется зона интрогрессии (Кавказ, побережье Черного моря). В своем роде эта порода уникальна, поскольку экземпляры способны выживать на очень сухих участках южных склонов, формируя уникальную экосистему.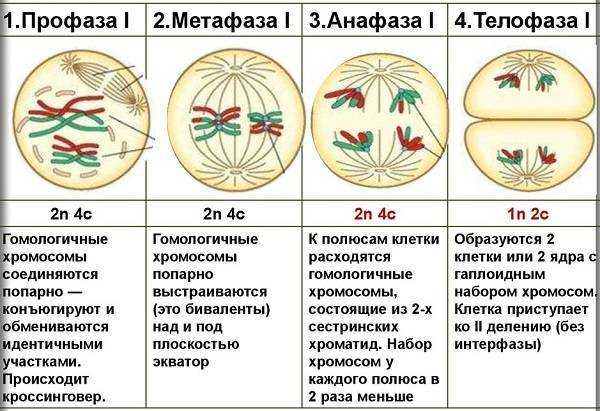
Другие распространенные видовые названия растения — зимний, сидячецветный, каменный.
Дуб скальный — ценное лекарственное растение (кора оказывает вяжущее, противовоспалительное воздействие, настой убивает болезнетворных простейших). Настой коры применяется при отравлениях.
Как и у дуба черешчатого, у дуба скального описано множество форм, которые могут использоваться в селекции (вопросами селекции занимались следующие ученые: С.С. Пятницкий, 1954; Н.И. Давыдова, 1982; И. Добринов, 1983; Л.Ф. Семериков, 1986). Число хромосом у дуба скального 2п=24.
Posted in Древесные породы, Дубы
Posted on 03.11.2012
Дуб — пожалуй, одно из самых почитаемых в нашей культуре растений. Сколько поэтических произведений посвящено этому долгожителю, в скольких сказках он фигурирует. Дуб издавна славился своей ценной древесиной и лечебными свойствами.
Дуб черешчатый — это одна из главных лесообразующих пород лесостепи. Распространен в европейской части России (доходит до Санкт-Петербурга), на Кавказе, Украине и в Западной Европе. Представляет собой мощное красивое дерево первой величины высотой до 30 м. Однодомное ветро-опыляемое растение. Умеренно теплолюбивая, очень засухоустойчивая, светолюбивая, ветроустойчивая и одна из наиболее долговечных лиственных пород. Дуб черешчатый требователен к почвам. Лучше всего растет на свежих глубоких серых лесных суглинках и деградированных черноземах, где формирует мощную, сильноразветвленную корневую систему. Может также расти на слабооподзоленных почвах и солонцах.
Широкий географический и особенно экологический ареал произрастания дуба черешчатого свидетельствует о его большой экологической пластичности. Он отличается большим внутривидовым разнообразием, включающем климатические и эдафические экотипы, множество ареальных и безареальных наследственных форм, а также отклонений, наследственная природа которых еще слабо изучена. У него встречаются формы с различным числом хромосом: 2n=22, 2n=24 и 2n=36.
Дополнительную информацию о разведении дуба можно посмотреть здесь, о хранении желудей здесь.
Posted in Древесные породы, Дубы
Размножение и деление клеток » Детская энциклопедия (первое издание)
Клетки животных
Что такое наследственность и как она изменяется
Итак, тела растений и животных состоят из многих клеток, межклеточных веществ и более сложных соединений клеток. Но различные клетки в организме приспособлены к различным видам жизнедеятельности. Однако живой организм — не простая совокупность клеток. Все клетки, ткани и органы тесно связаны между собой и составляют единое целое. Именно потому, что различные клетки специализированы в различных направлениях, они не могут жить без других клеток. Мускульное волокно или нервная клетка, как и многие другие клетки организма, не могут питаться непосредственно. Пища переваривается в кишечнике, оттуда поступает в кровь и кровью доставляется клеткам мускулов и нервов в усвояемом виде. Клетки корня и многих других органов зеленого растения не могли бы жить без зеленых клеток мякоти листа. Вот почему клетки многоклеточных животных и растений, выделенные из организма, не могут долго жить и неизбежно погибают. В этом их отличие от одноклеточных и некоторых низших многоклеточных растений и животных (см. ст. «Простейшие животные»).
Но различные клетки в организме приспособлены к различным видам жизнедеятельности. Однако живой организм — не простая совокупность клеток. Все клетки, ткани и органы тесно связаны между собой и составляют единое целое. Именно потому, что различные клетки специализированы в различных направлениях, они не могут жить без других клеток. Мускульное волокно или нервная клетка, как и многие другие клетки организма, не могут питаться непосредственно. Пища переваривается в кишечнике, оттуда поступает в кровь и кровью доставляется клеткам мускулов и нервов в усвояемом виде. Клетки корня и многих других органов зеленого растения не могли бы жить без зеленых клеток мякоти листа. Вот почему клетки многоклеточных животных и растений, выделенные из организма, не могут долго жить и неизбежно погибают. В этом их отличие от одноклеточных и некоторых низших многоклеточных растений и животных (см. ст. «Простейшие животные»).
РАЗМНОЖЕНИЕ КЛЕТОК
Строение ядра клетки: п —протоплазма, яо — ядерная оболочка, я — ядрышко.
Сколько клеток в теле взрослого человека или крупного животного? Сколько их у дуба или липы? Многие миллионы. Но и человек, и собака, и дуб начали свое существование с одной оплодотворенной яйцевой клетки. Пока организм растет и развивается, размножаются и его клетки, да и позже, когда организм достигнет предельного роста, размножение клеток не останавливается, так как молодые клетки необходимы для замены отмирающих. Многолетние растения обладают, кроме того, неограниченным ростом. Множество клеток сбрасывает дерево в опадающих осенью листьях, но еще больше клеток появляется весной в новой листве.
Это возможно только потому, что клетки размножаются. Однако к размножению способны далеко не все клетки многоклеточного организма. Многие из них приспособлены к определенным ограниченным видам жизнедеятельности и утратили способность размножаться. У животных не размножаются, например, нервные и мускульные клетки, эритроциты крови. Новые же такие клетки образуются из особых неспециализированных клеток.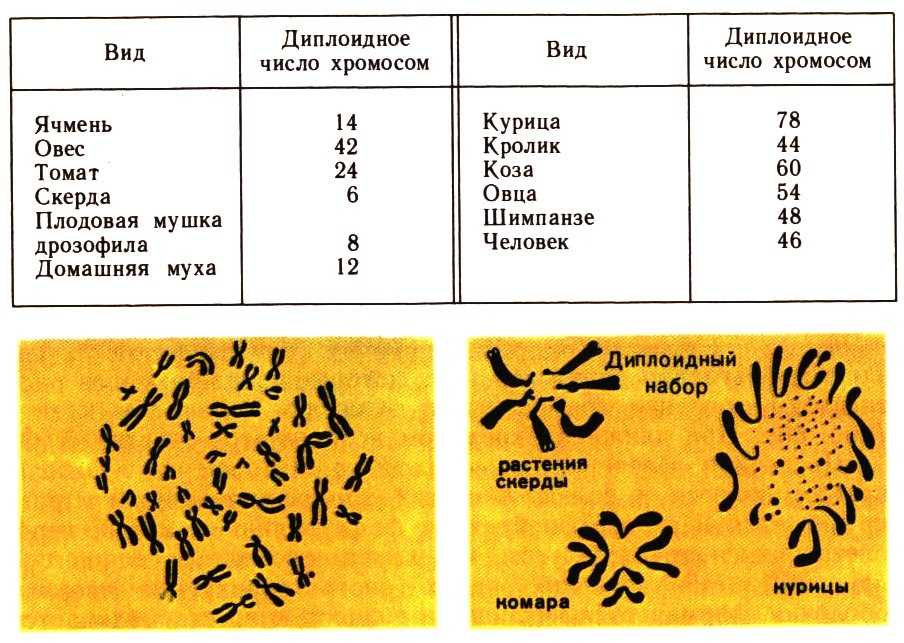
У красных кровяных телец — эритроцитов нет ядра, и размножаться они не способны. В крови человека они живут всего около 30 дней, а затем погибают. Между тем эритроциты нужны организму в огромном количестве, так как они доставляют кислород из легких во все части тела. Достаточно сказать, что в кубическом миллиметре крови здорового человека около 5 млн. эритроцитов.
Как же пополняется число эритроцитов в крови? Эритроциты образуются в так называемых кровотворных органах, а именно в костном мозгу, в результате размножения особых клеток, имеющих ядра.
У высших растений делящиеся клетки сосредоточены преимущественно в определенных местах растений или в определенных тканях. Так, например, почки и новые побеги образуются размножением клеток только в точке роста растения: корень растет в длину размножением клеток кончика корня, стебель утолщается за счет размножения клеток особой ткани — камбия.
ДЕЛЕНИЕ КЛЕТОК
Чтобы понять процесс размножения клеток, необходимо ознакомиться подробнее со строением клеточного ядра, так как его роль в делении клетки особенно велика.
Ядро и протоплазма есть в каждой живой полноценной клетке. Многочисленные опыты расчленения клеток показали, что ни протоплазма без ядра, ни ядро без протоплазмы существовать не могут и погибают.
Понятно поэтому, что на строение ядра ученые обращали особое внимание.
Изучение ядра показало, что на различных этапах жизни клетки оно выглядит неодинаково. У ядра в неделящейся, но растущей клетке иное строение, чем во время деления. Строение ядер неделящихся клеток довольно разнообразно. В наиболее типичных случаях различают в ядре ядерную оболочку и жидкое содержимое ядра, в котором часто заметны одно или несколько плотных телец — ядрышек. Кроме того, в ядре можно иногда наблюдать тончайшую сеть переплетающихся нитей.
Фазы деления клетки
По-другому выглядит строение ядра перед началом деления клетки. В ядре происходит ряд изменений, закономерно следующих одно за другим, и, что особенно важно, эти изменения происходят очень сходно у всех растений и животных.
Под микроскопом в начале деления клетки можно различить в ядре нити, спутанные в плотный клубок (1).
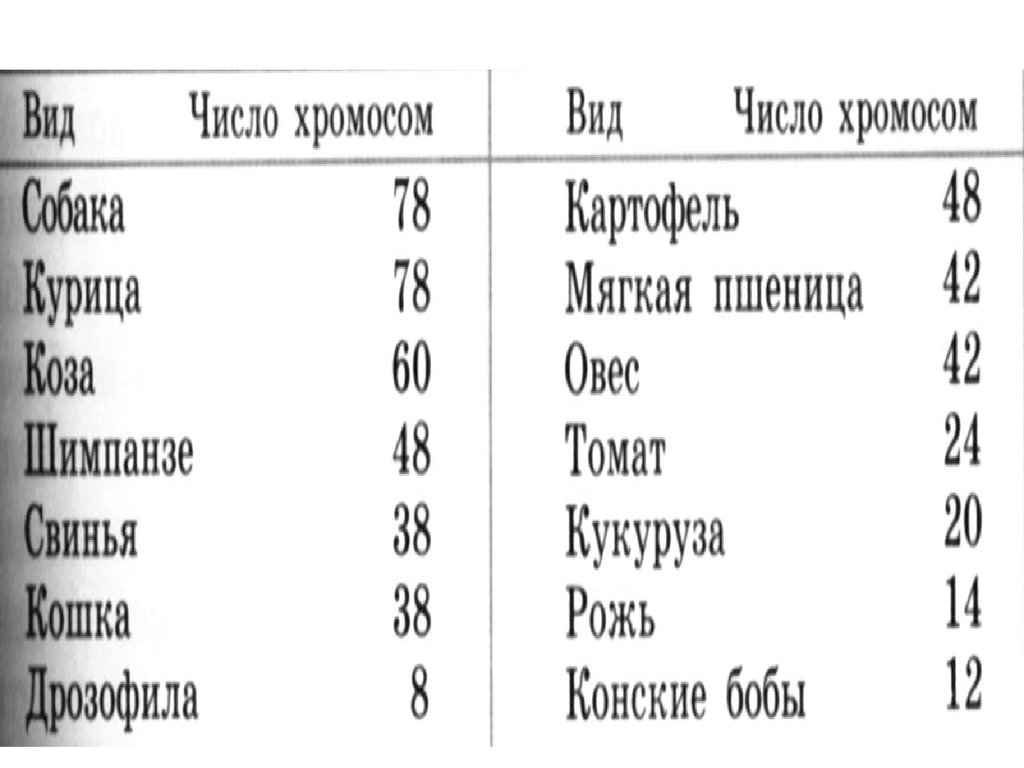
Немного позже клубок становится более рыхлым, и отчетливо видно, что он действительно состоит из отдельных нитей (2). Эти нити получили название хромосом, что в переводе с греческого означает «окрашивающиеся тельца». (Следует сказать, что при изучении ядра применяют особые краски, которые по-разному окрашивают разные части ядра.) На следующей стадии деления клетки хромосомы становятся короче и толще (3, 4). При этом обнаружено замечательное явление. В клетке каждого вида растения или животного определенное количество хромосом. Так, например, в клетке червя аскариды 4 хромосомы, в клетке ржи — 14, в клетке человека — 48 хромосом. В одной и той же клетке хромосомы могут отличаться друг от друга формой и величиной. Но во всех делящихся клетках определенного вида животного или растения набор хромосом одинаков.
Индивидуальные различия между хромосомами дали возможность установить, что для каждой хромосомы есть в клетке парная ей. В клетках ржи 14 хромосом — семь пар; у человека в клетке 48 хромосом — 24 пары.
На следующей стадии деления клетки оболочка ядра растворяется. К этому времени в протоплазме образуется так называемое веретено деления. Оно состоит из тончайших протоплазматических нитей, сходящихся к двум противоположным полюсам клетки. Хромосомы располагаются по экватору веретена (5). В это время становится заметным, что каждая из хромосом начинает расщепляться продольно на две дочерние. Расщепившиеся хромосомы прикрепляются к нитям веретена и расходятся к полюсам, так что из каждых двух дочерних хромосом одна отходит к одному полюсу, а другая — к другому (6). В результате к каждому полюсу отходит столько хромосом, сколько их было в материнской клетке. Если в ней было 48 хромосом, то к каждому полюсу веретена отойдет также 48 хромосом. Другими словами, каждому размножению клетки предшествует закономерное размножение хромосом.
Затем хромосомы удлиняются, становятся более тонкими и собираются в клубок. Одновременно вокруг хромосом формируются ядерные оболочки двух дочерних ядер (7), а там, где был экватор веретена, появляется перетяжка (5), делящая материнскую клетку на две дочерние (9).
Двойное и одинарное количество хромосом в клетках растения наяды.
Так происходит деление подавляющего большинства клеток растений и животных.
Изучение деления клеток показало:
1. Клеткам каждого вида животного или растения свойственно определенное число хромосом.
2. Хромосомы парны, т. е. в одном и том же ядре каждой клетки хромосомы представлены двумя подобными образованиями.
3. Перед делением клетки каждая хромосома размножается, расщепляясь продольно, в результате чего ядра дочерних клеток получают то же количество хромосом, какое было в материнской клетке.
Все это приводит к выводу, что хромосомы — очень важная часть клетки. Между протоплазмой и ядром происходит постоянное взаимодействие, связанное с обменом веществ и сложнейшими биохимическими процессами, происходящими в клетке. Размножение хромосом при делении клетки показывает, что в результате этого процесса в клетке формируются хромосомы, подобные существующим.
Многочисленные опыты дают основание полагать, что хромосомы представляют собой те части клеток, от которых зависят наследственные особенности каждого вида растений или животных.
Пожалуй, самое замечательное в органическом мире состоит в том, что всякое живое существо начинает свою жизнь с одной клетки — оплодотворенного яйца. И вот в тысячах тысяч поколений клеток сохраняется определенное количество хромосом и индивидуальность каждой из них.
Чем же объясняется парность хромосом в клетках? Почему каждая хромосома представлена в клетке двумя подобными образованиями? Каков биологический смысл этого явления? В живых организмах происходят и такие деления клеток, при которых число хромосом в дочерних клетках уменьшается вдвое — из каждой пары остается одна хромосома. Это происходит при созревании половых клеток. Поэтому в обычных условиях в зрелом яйце и в зрелом сперматозоиде животного имеется половинное количество хромосом — по одной из каждой пары. При оплодотворении, т. е. при слиянии двух созревших половых клеток, сливаются и их ядра. В результате в оплодотворенном яйце будет снова полное (парное) количество хромосом.
Значит, в оплодотворенном яйце половина хромосом — отцовские, а половина — материнские. Это соотношение сохраняется во всех клетках развивающегося организма, так как при всех делениях клеток хромосомы размножаются.
Это соотношение сохраняется во всех клетках развивающегося организма, так как при всех делениях клеток хромосомы размножаются.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Клетки животных
Что такое наследственность и как она изменяется
Расшифрован геном дуба | International Oak Society
Ниже приводится перевод пресс-релиза, выпущенного INRA 10 мая 2015 г. Доступен реферат предварительного документа, опубликованного в Molecular Ecology Resources на английском языке:
Исследовательские группы INRA и CEA только что завершили секвенирование генома дуба черешчатого ( Quercus robur ). Это первое секвенирование вида рода
Это первое секвенирование вида рода
Дуб черешчатый (Аверон, Франция), © INRA, А. Кремер |
Знаменитое дерево, дуб черешчатый ( Quercus robur ) является частью крупнейшей ботанической секции рода Quercus: Дуб белый, 200 видов которого произрастают в Европе, Азии и Америке. Благодаря консорциуму, возглавляемому INRA Bordeaux-Aquitaine в партнерстве с Национальным центром секвенирования CEA (Génoscope), был секвенирован геном дуба черешчатого. Три года работы позволили расшифровать всю генетическую информацию, которую несут его 12 пар хромосом. Консорциум охарактеризовал 50 000 генов и подсчитал, что половина из 1,5 миллиардов пар оснований генома состоит из повторяющихся элементов. Это первое подобное достижение для вида рода 9.0005 Quercus, , который имеет важное экономическое, экологическое, а также культурное значение во многих странах.
Три года работы позволили расшифровать всю генетическую информацию, которую несут его 12 пар хромосом. Консорциум охарактеризовал 50 000 генов и подсчитал, что половина из 1,5 миллиардов пар оснований генома состоит из повторяющихся элементов. Это первое подобное достижение для вида рода 9.0005 Quercus, , который имеет важное экономическое, экологическое, а также культурное значение во многих странах.
Секвенирование генома дуба черешчатого представляет собой уникальный подход к анализу и пониманию функции генов этого легендарного дерева. Таким образом, его геном будет эталоном для других видов белого дуба, а также для более отдаленных видов семейства Fagaceae (каштан или бук). Это позволит изучить внутреннюю регуляцию очень долгоживущих видов, подверженных сильным годовым колебаниям климата или даже экстремальным явлениям, пережитым в течение их жизни. Это исследование также облегчит идентификацию генов, участвующих в адаптации к окружающей среде или в симбиотических отношениях между корнями и микоризными грибами (такими как мицелий трюфелей). Они также позволят идентифицировать гены, ответственные за биосинтез древесных экстрактов, таких как дубильные вещества и лактон виски, которые придают аромат и вкус винам и спиртным напиткам. С точки зрения эволюции, последовательность генома дуба уже позволяет исследователям более тщательно анализировать местные процессы адаптации и видообразования, которые объясняют разнообразие этих деревьев, колонизировавших очень разные места обитания.
Они также позволят идентифицировать гены, ответственные за биосинтез древесных экстрактов, таких как дубильные вещества и лактон виски, которые придают аромат и вкус винам и спиртным напиткам. С точки зрения эволюции, последовательность генома дуба уже позволяет исследователям более тщательно анализировать местные процессы адаптации и видообразования, которые объясняют разнообразие этих деревьев, колонизировавших очень разные места обитания.
Эта работа представляет собой значительный прогресс в понимании биологии, генетики и эволюции деревьев и будет иметь неоценимое значение для будущих исследований структуры и функции генома этих многолетников. Помимо академических знаний, это исследование открывает возможности в более прикладных областях в ответ на многие социальные проблемы, связанные с эволюцией лесов.
Общие результаты В соответствии с Бермудскими островами (1998) и Форт-Лодердейл (2003 г. |
Проект ГЕНОАК Секвенирование, сборка и аннотация генома дуба является результатом проекта «ГЕНОАК» (секвенирование генома дуба и идентификация адаптивных генов в лесных деревьях), инициированного в октябре 2011 г. при софинансировании в течение 4 лет Национальным агентством исследований и объединения нескольких исследовательских групп INRA и CEA Génoscope. |
Перевод: Charles Snyers
Атлас экспрессии генов дуба: понимание эволюции генома Fagaceae и открытие генов, регулируемых во время выхода почек из покоя
Обзор Timacbal J, Aussen G. и лесоводство местных дубов во Франции.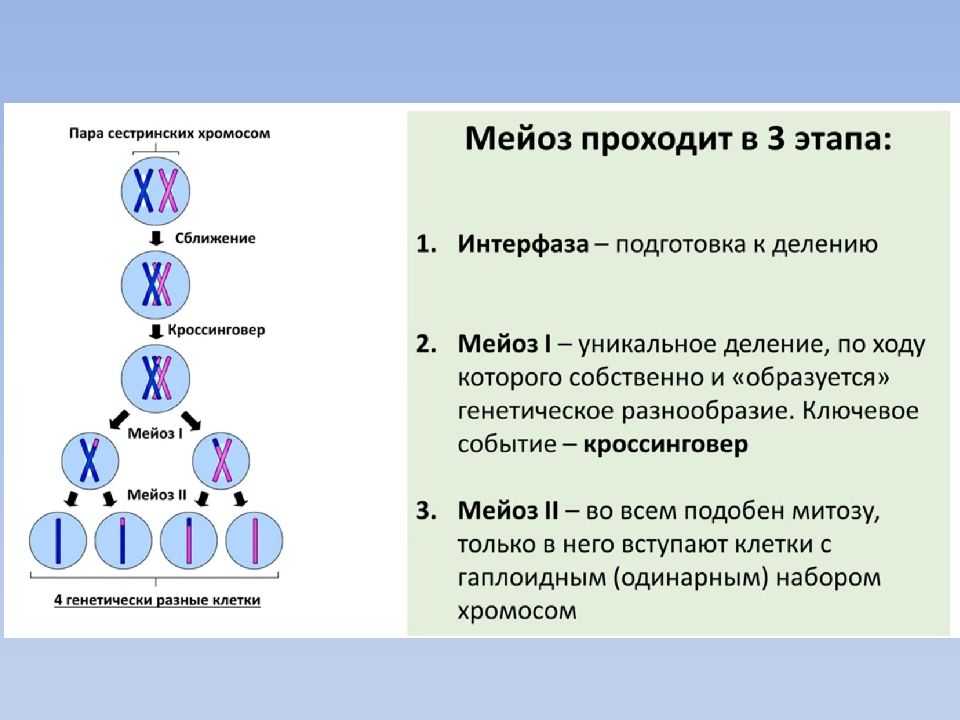 Энн Сай Фор. 1996; 53: 649–61. doi: 10.1051/forest:19960243. [CrossRef] [Google Scholar]
Энн Сай Фор. 1996; 53: 649–61. doi: 10.1051/forest:19960243. [CrossRef] [Google Scholar]
2. Кремер А., Седерофф Р., Уилер Н.С. Геномика здоровья леса и экосистемы Fagaceae. Деревья Генет Геномы. 2010;6:815–20. дои: 10.1007/s11295-010-0277-й. [CrossRef] [Google Scholar]
3. Goicoechea PG, Petit RJ, Kremer A. Обнаружение следов дивергентного отбора у дубов с помощью связанных маркеров. Наследственность. 2012; 109: 361–71. doi: 10.1038/hdy.2012.51. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Kremer A, Abbott AG, Carlson JE, Manos PS, Plomion C, Sisco P, et al. Геномика Fagaceae. Генетические геномы деревьев. 2012; 8: 583–610. doi: 10.1007/s11295-012-0498-3. [CrossRef] [Google Scholar]
5. Faivre Rampant P, Lesur I, Boussardon C, Bitton F, Martin-Magniette ML, Bodénès C, et al. Анализ концевых последовательностей BAC у дуба, ключевого вида лесных деревьев, дает представление о составе его генома. Геномика BMC. 2011;12:292. doi: 10.1186/1471-2164-12-292. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Durand J, Bodénès C, Chancerel E, Frigerio J-M, Vendramin G, Sebastiani F, et al. Быстрый и экономичный подход к разработке и картированию маркеров EST-SSR: дуб как пример. Геномика BMC. 2010;11:570. дои: 10.1186/1471-2164-11-570. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Bodénès C, Chancerel E, Gailing O, Vendramin GG, Bagnoli F, Durand J, et al. Сравнительное картирование Fagaceae и не только с помощью EST-SSR. BMC Растение Биол. 2012;12:153. дои: 10.1186/1471-2229-12-153. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Ueno S, Le Provost G, Léger V, Klopp C, Noirot C, Frigerio J-M, et al. Биоинформационный анализ EST, собранных Сэнгером, и методы пиросеквенирования ключевой породы лесных деревьев: дуба. Геномика BMC. 2010;11:650. дои: 10.1186/1471-2164-11-650. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Kersten B, Ghirardo A, Schnitzler J-P, Kanawati B, Schmitt-Kopplin P, Fladung M, et al. Комплексная транскриптомика и метаболомика расшифровывают различия в устойчивости дуба черешчатого к травоядным Tortrix viridana L. BMC Genomics. 2013;14:737. дои: 10.1186/1471-2164-14-737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Комплексная транскриптомика и метаболомика расшифровывают различия в устойчивости дуба черешчатого к травоядным Tortrix viridana L. BMC Genomics. 2013;14:737. дои: 10.1186/1471-2164-14-737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Van Verk MC, Hickman R, Pieterse CMJ, Van Wees SCM. RNA-Seq: выявление мессенджеров. Тенденции Растениевод. 2013;18:175–179. doi: 10.1016/j.tplants.2013.02.001. [PubMed] [CrossRef] [Google Scholar]
11. Zenoni S, Ferrarini A, Giacomelli E, Xumerle L, Fasoli M, Malerba G, et al. Характеристика сложности транскрипции при развитии ягоды у Vitis vinifera с использованием RNA-Seq. Завод Физиол. 2010; 152:1787–95. doi: 10.1104/стр.109.149716. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Kakumanu A, Ambavaram MMR, Klumas C, Krishnan A, Batlang U, Myers E, et al. Влияние засухи на экспрессию генов в репродуктивной ткани и меристеме листьев кукурузы, выявленное с помощью RNA-Seq. Завод Физиол. 2012; 160:846–67. doi: 10.1104/стр.112.200444. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Завод Физиол. 2012; 160:846–67. doi: 10.1104/стр.112.200444. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Young ND, Jex AR, Li B, Liu S, Yang L, Xiong Z, et al. Полногеномная последовательность Шистосома гематобиум . Нат Жене. 2012;44:221–5. doi: 10.1038/ng.1065. [PubMed] [CrossRef] [Google Scholar]
14. Юрьев А., Мулюков З., Котельникова Е., Маслов С., Егоров С., Никитин А. и др. Автоматическое построение путей в сетях биологических ассоциаций. Биоинформатика BMC. 2006; 7:171. дои: 10.1186/1471-2105-7-171. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Vignes M, Vandel J, Allouche D, Ramadan-Alban N, Cierco-Ayrolles C, Schiex T, et al. Реконструкция сети регуляции генов с использованием байесовских сетей, селектора Данцига, лассо и их метаанализа. ПЛОС Один. 2011;6:e29165. doi: 10.1371/journal.pone.0029165. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Stocker TF, Dahe Q, Plattner G-K.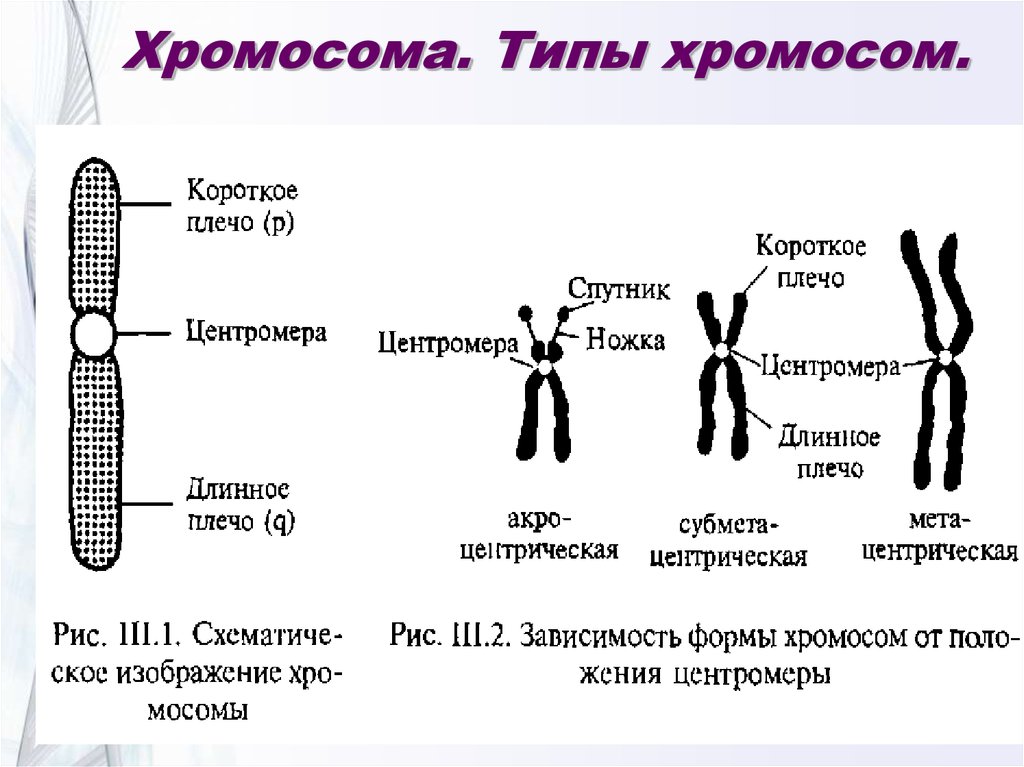 Изменение климата 2013: основы физической науки. Кембридж, Великобритания и Нью-Йорк, штат Нью-Йорк, США: Издательство Кембриджского университета; 2013. [Google Scholar]
Изменение климата 2013: основы физической науки. Кембридж, Великобритания и Нью-Йорк, штат Нью-Йорк, США: Издательство Кембриджского университета; 2013. [Google Scholar]
17. Pont C, Murat F, Confolent C, Balzergue S, Salse J. Секвенирование РНК в зерне раскрывает судьбу событий нео- и палеополиплоидизации мягкой пшеницы ( Triticum aestivum L.) Геном биол. 2011;12:R119. doi: 10.1186/gb-2011-12-12-r119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Cloonan N, Forrest ARR, Kolle G, Gardiner BBA, Faulkner GJ, Brown MK, et al. Профилирование транскриптома стволовых клеток с помощью крупномасштабного секвенирования мРНК. Нат Методы. 2008; 5: 613–9. doi: 10.1038/nmeth.1223. [PubMed] [CrossRef] [Google Scholar]
19. Salse J. In silico археогеномика представляет современную организацию генома растений, регуляцию и эволюцию. Curr Opin Plant Biol. 2012;15:122–30. doi: 10.1016/j.pbi.2012.01.001. [PubMed] [CrossRef] [Академия Google]
20. Мартин Дж. А., Ван З. Сборка транскриптома следующего поколения. Нат Рев Жене. 2011;12:671–82. doi: 10.1038/nrg3068. [PubMed] [CrossRef] [Google Scholar]
Мартин Дж. А., Ван З. Сборка транскриптома следующего поколения. Нат Рев Жене. 2011;12:671–82. doi: 10.1038/nrg3068. [PubMed] [CrossRef] [Google Scholar]
21. Cahais V, Gayral P, Tsagkogeorga G, Melo-Ferreira J, Ballenghien M, Weinert L, et al. Сборка транскриптома без ссылок на немодельных животных по данным секвенирования следующего поколения. Мол Эколь Ресурс. 2012;12:834–45. doi: 10.1111/j.1755-0998.2012.03148.x. [PubMed] [CrossRef] [Google Scholar]
22. Tarkka MT, Herrmann S, Wubet T, Feldhahn L, Recht S, Kurth F, et al. ДубContigDF159.1, справочная библиотека для изучения дифференциальной экспрессии генов в Quercus robur во время контролируемых биотических взаимодействий: использование для количественного транскриптомного профилирования корней дуба в эктомикоризном симбиозе. Новый Фитол. 2013; 199: 529–40. doi: 10.1111/nph.12317. [PubMed] [CrossRef] [Google Scholar]
23. Quang ND, Ikeda S, Harada K. Варианты нуклеотидов в Quercus crispula Blume. Наследственность. 2008; 101:166–74. doi: 10.1038/hdy.2008.42. [PubMed] [CrossRef] [Академия Google]
Наследственность. 2008; 101:166–74. doi: 10.1038/hdy.2008.42. [PubMed] [CrossRef] [Академия Google]
24. Мюллер Т., Энсмингер И., Шмид К.Ю. Каталог предполагаемых уникальных транскриптов пихты Дугласа ( Pseudotsuga menziesii ), основанный на секвенировании 454 транскриптомов генетически разнообразных сеянцев, пострадавших от засухи. Геномика BMC. 2012;13:673. дои: 10.1186/1471-2164-13-673. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Canales J, Bautista R, Label P, Gómez-Maldonado J, Lesur I, Fernández-Pozo N, et al. Сборка транскриптома морской сосны De novo : значение для лесной селекции и биотехнологии. Plant Biotechnol J. 2014; 12: 286–9.9. doi: 10.1111/pbi.12136. [PubMed] [CrossRef] [Google Scholar]
26. Barakat A, DiLoreto DS, Zhang Y, Smith C, Baier K, Powell WA, et al. Сравнение транскриптомов американского каштана ( Castanea dentata ) и китайского каштана ( Castanea mollissima ) в ответ на заражение фитофторой каштана. BMC Растение Биол. 2009; 9:51. дои: 10.1186/1471-2229-9-51. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
BMC Растение Биол. 2009; 9:51. дои: 10.1186/1471-2229-9-51. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Parchman TL, Geist KS, Grahnen JA, Benkman CW, Buerkle CA. Секвенирование транскриптома экологически важных видов деревьев: сборка, аннотация и обнаружение маркеров. Геномика BMC. 2010;11:180. дои: 10.1186/1471-2164-11-180. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Дерори Дж., Скотти-Сентань С., Бертокки Э., Ле Дантек Л., Грайник Н., Джоффрес А. и другие. Контрастные отношения между разнообразием генов-кандидатов и изменчивостью распускания почек в естественных и сегрегационных популяциях европейского дуба. Наследственность. 2010; 104: 438–48. doi: 10.1038/hdy.2009.134. [PubMed] [CrossRef] [Google Scholar]
29. Мотт Р. EST_GENOME: программа для сопоставления сплайсированных последовательностей ДНК с несплайсированными геномными ДНК. Компьютерное приложение Biosci CABIOS. 1997; 13: 477–8. [PubMed] [Академия Google]
30. Plomion C, Fievet V. Геномика дуба набирает обороты… и вступает в эру экологической геномики. Новый Фитол. 2013;199:308–10. doi: 10.1111/nph.12357. [PubMed] [CrossRef] [Google Scholar]
Plomion C, Fievet V. Геномика дуба набирает обороты… и вступает в эру экологической геномики. Новый Фитол. 2013;199:308–10. doi: 10.1111/nph.12357. [PubMed] [CrossRef] [Google Scholar]
31. Грин Р., Мартин Г. Розид есть розид есть розид… или нет. Adv Classif Res Online. 2013; 23:9–16. doi: 10.7152/acro.v23i1.14228. [CrossRef] [Google Scholar]
32. Ueno S, Klopp C, Leplé JC, Derory J, Noirot C, Léger V, et al. Транскрипционное профилирование индукции и высвобождения покоя почек у дуба с помощью секвенирования следующего поколения. Геномика BMC. 2013;14:236. дои: 10.1186/1471-2164-14-236. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Lepoittevin C, Chancerel E, Villate L, Bodenes C, Lang T, Lesur I, et al. Открытие однонуклеотидного полиморфизма и разработка массива SNP высокой плотности для генетического анализа европейских белых дубов. Мол Эколь Ресурс. 2015. Принято. [PubMed]
34. Degenhardt RF, Bonham-Smith PC. Профилирование транскрипта демонстрирует отсутствие дозовой компенсации у Arabidopsis после потери одного паралога RPL23a. Планта. 2008; 228: 627–40. doi: 10.1007/s00425-008-0765-6. [PubMed] [CrossRef] [Академия Google]
Планта. 2008; 228: 627–40. doi: 10.1007/s00425-008-0765-6. [PubMed] [CrossRef] [Академия Google]
35. Song Y, Zhang H, Chen C, Wang G, Zhuang K, Cui J и др. Протеомный анализ медь-связывающих белков в корнях риса с избытком меди с помощью аффинной хроматографии с иммобилизованным металлом и двумерного электрофореза. Biometals Int J Role Met Ions Biol Biochem Med. 2014; 27: 265–76. doi: 10.1007/s10534-014-9707-x. [PubMed] [CrossRef] [Google Scholar]
36. Ariz I, Asensio AC, Zamarreño AM, García-Mina JM, Aparicio-Tejo PM, Moran JF. Изменения в балансе C/N, вызванные увеличением внешней концентрации аммония, обусловлены наличием углерода и энергии во время аммиачного питания растений гороха: ключевая роль аспарагинсинтетазы и анаплеротических ферментов. Завод Физиол. 2013; 148: 522–37. дои: 10.1111/j.1399-3054.2012.01712.х. [PubMed] [CrossRef] [Google Scholar]
37. Guo Y, Xiong L, Ishitani M, Zhu J-K. Мутация Arabidopsis в факторе элонгации трансляции 2 вызывает супериндукцию генов факторов транскрипции CBF/DREB1, но блокирует индукцию их нижестоящих мишеней при низких температурах. Proc Natl Acad Sci U S A. 2002;99:7786–91. doi: 10.1073/pnas.112040099. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Proc Natl Acad Sci U S A. 2002;99:7786–91. doi: 10.1073/pnas.112040099. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Cantrel C, Vazquez T, Puyaubert J, Rezé N, Lesch M, Kaiser WM, et al. Оксид азота участвует в формировании холодочувствительных фосфосфинголипидов и экспрессии генов в Arabidopsis thaliana . Новый Фитол. 2011;189:415–27. doi: 10.1111/j.1469-8137.2010.03500.x. [PubMed] [CrossRef] [Google Scholar]
39. Da Silveira Falavigna V, Porto DD, Buffon V, Margis-Pinheiro M, Pasquali G, Revers LF. Дифференциальные профили транскрипции генов, связанных с состоянием покоя, в почках яблони. Отчет Plant Mol Biol. 2014; 32:796–813. doi: 10.1007/s11105-013-0690-0. [CrossRef] [Google Scholar]
40. Ensminger I, Busch F, Huner NPA. Фотостаз и холодовая акклиматизация: восприятие низкой температуры посредством фотосинтеза. Завод Физиол. 2006; 126: 28–44. дои: 10.1111/j.1399-3054.2006.00627.х. [CrossRef] [Google Scholar]
41. Goulas E, Schubert M, Kieselbach T, Kleczkowski LA, Gardeström P, Schröder W, et al.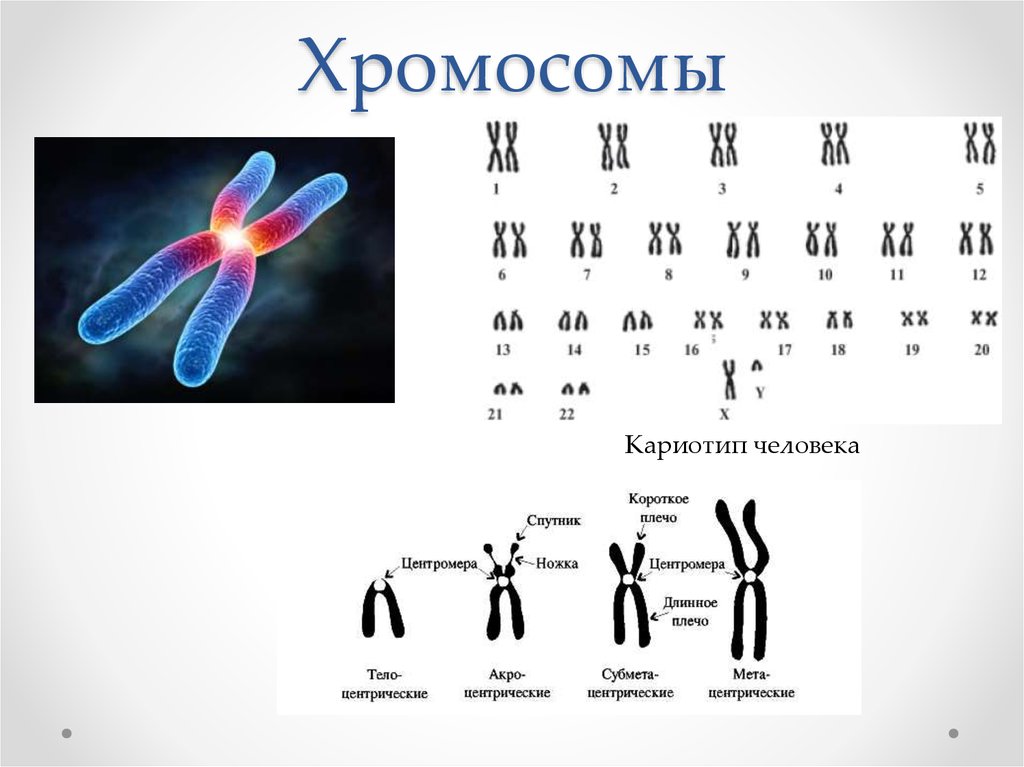 Люмен хлоропластов и стромальные протеомы Arabidopsis thaliana проявляют разную чувствительность к кратковременному и длительному воздействию низкой температуры. Растение J Cell Mol Biol. 2006; 47: 720–34. doi: 10.1111/j.1365-313X.2006.02821.x. [PubMed] [CrossRef] [Google Scholar]
Люмен хлоропластов и стромальные протеомы Arabidopsis thaliana проявляют разную чувствительность к кратковременному и длительному воздействию низкой температуры. Растение J Cell Mol Biol. 2006; 47: 720–34. doi: 10.1111/j.1365-313X.2006.02821.x. [PubMed] [CrossRef] [Google Scholar]
42. Исикава Т., Ватанабэ Н., Нагано М., Каваи-Ямада М., Лам Э. Ингибитор Bax-1: высококонсервативный супрессор гибели резидентных клеток эндоплазматического ретикулума. Смерть клеток 2011;18:1271–8. doi: 10.1038/cdd.2011.59. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. He L, Yang X, Wang L, Zhu L, Zhou T, Deng J, et al. Молекулярное клонирование и функциональная характеристика нового гена протеинкиназы, взаимодействующей с CBL хлопка (GhCIPK6), выявили его участие в устойчивости трансгенных растений к множественным абиотическим стрессам. Biochem Biophys Res Commun. 2013; 435:209–15. doi: 10.1016/j.bbrc.2013.04.080. [PubMed] [CrossRef] [Google Scholar]
44. Doğramaci M, Horvath DP, Chao WS, Foley ME, Christoffers MJ, Anderson JV. Низкие температуры влияют на состояние покоя, способность к цветению и профили транскрипции в почках листового молочая. Завод Мол Биол. 2010;73:207–26. doi: 10.1007/s11103-010-9621-8. [PubMed] [CrossRef] [Google Scholar]
Doğramaci M, Horvath DP, Chao WS, Foley ME, Christoffers MJ, Anderson JV. Низкие температуры влияют на состояние покоя, способность к цветению и профили транскрипции в почках листового молочая. Завод Мол Биол. 2010;73:207–26. doi: 10.1007/s11103-010-9621-8. [PubMed] [CrossRef] [Google Scholar]
45. Lee H, Suh S-S, Park E, Cho E, Ahn JH, Kim S-G и др. Белок домена MADS AGAMOUS-LIKE 20 интегрирует цветочные индуктивные пути в Arabidopsis . Гены Дев. 2000;14:2366–76. doi: 10.1101/gad.813600. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
46. Trainin T, Bar-Ya’akov I, Holland D. ParSOC1, ген MADS-box, тесно связанный с Arabidopsis AGL20/SOC1, является проявляется в листьях абрикоса суточным образом и связано с потребностью в охлаждении для выхода из состояния покоя. Генетические геномы деревьев. 2013;9: 753–66. doi: 10.1007/s11295-012-0590-8. [CrossRef] [Google Scholar]
47. Kang CH, Jung WY, Kang YH, Kim JY, Kim DG, Jeong JC и другие. AtBAG6, новый кальмодулин-связывающий белок, вызывает запрограммированную гибель клеток у дрожжей и растений. Смерть клеток 2006; 13:84–95. doi: 10.1038/sj.cdd.4401712. [PubMed] [CrossRef] [Google Scholar]
AtBAG6, новый кальмодулин-связывающий белок, вызывает запрограммированную гибель клеток у дрожжей и растений. Смерть клеток 2006; 13:84–95. doi: 10.1038/sj.cdd.4401712. [PubMed] [CrossRef] [Google Scholar]
48. Kobayashi M, Takato H, Fujita K, Suzuki S. HSG1, атаноген, связанный с Bcl-2 винограда, способствует цветочному переходу путем активации экспрессии CONSTANS в трансгенных Растение арабидопсис . Mol Biol Rep. 2012; 39:4367–74. doi: 10.1007/s11033-011-1224-1. [PubMed] [CrossRef] [Google Scholar]
49. Dresselhaus T, Srilunchang K-O, Leljak-Levanic D, Schreiber DN, Garg P. Индуцированный оплодотворением фактор репликации ДНК MCM6 кукурузы перемещается между цитоплазмой и ядром и имеет важное значение. для роста и развития растений. Завод Физиол. 2006; 140: 512–27. doi: 10.1104/стр.105.074294. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
50. Dang HQ, Tran NQ, Gill SS, Tuteja R, Tuteja N. Одна субъединица MCM6 из гороха повышает устойчивость к засолению, не влияя на урожайность. Завод Мол Биол. 2011;76:19–34. doi: 10.1007/s11103-011-9758-0. [PubMed] [CrossRef] [Google Scholar]
Завод Мол Биол. 2011;76:19–34. doi: 10.1007/s11103-011-9758-0. [PubMed] [CrossRef] [Google Scholar]
51. Springer PS, McCombie WR, Sundaresan V, Martienssen RA. Маркировка генной ловушкой PROLIFERA, основного MCM2-3-5-подобного гена в Arabidopsis . Наука. 1995; 268: 877–80. doi: 10.1126/science.7754372. [PubMed] [CrossRef] [Google Scholar]
52. Springer PS, Holding DR, Groover A, Yordan C, Martienssen RA. Незаменимый белок Mcm7 PROLIFERA локализуется в ядре делящихся клеток во время фазы G(1) и необходим матери в начале 9-летнего возраста.0005 Развитие арабидопсиса . Дев Кэмб англ. 2000; 127:1815–22. [PubMed] [Google Scholar]
53. Stevens R, Grelon M, Vezon D, Oh J, Meyer P, Perennes C, et al. Гомолог CDC45 в Arabidopsis необходим для мейоза, как показано сайленсингом генов, индуцированным РНК-интерференцией. Растительная клетка. 2004; 16:99–113. doi: 10.1105/tpc.016865. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
54. Zou L, Stillman B. Сборка комплекса, содержащего Cdc45p, репликационный белок A и Mcm2p в точках начала репликации, контролируемых циклин-зависимыми киназами S-фазы и киназа Cdc7p-Dbf4p. Мол Селл Биол. 2000; 20:3086–9.6. doi: 10.1128/MCB.20.9.3086-3096.2000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Zou L, Stillman B. Сборка комплекса, содержащего Cdc45p, репликационный белок A и Mcm2p в точках начала репликации, контролируемых циклин-зависимыми киназами S-фазы и киназа Cdc7p-Dbf4p. Мол Селл Биол. 2000; 20:3086–9.6. doi: 10.1128/MCB.20.9.3086-3096.2000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Horvath DP, Anderson JV, Chao WS, Foley ME. Знать, когда расти: сигналы, регулирующие состояние покоя почек. Тенденции Растениевод. 2003; 8: 534–40. doi: 10.1016/j.tplants.2003.09.013. [PubMed] [CrossRef] [Google Scholar]
56. Anderson JV, Doğramacı M, Horvath DP, Foley ME, Chao WS, Suttle JC, et al. Ауксин и АБК действуют как центральные регуляторы сетей развития, связанных с парадормантностью у канадского чертополоха (9).0005 Cirsium arvense ) Функция Integr Genomics. 2012;12:515–31. doi: 10.1007/s10142-012-0280-5. [PubMed] [CrossRef] [Google Scholar]
57. Aubert D, Chevillard M, Dorne AM, Arlaud G, Herzog M. Паттерны экспрессии генов GASA в Arabidopsis thaliana : ген GASA4 активен. регулируется гиббереллинами в меристематических областях. Завод Мол Биол. 1998; 36: 871–83. doi: 10.1023/A:1005938624418. [PubMed] [CrossRef] [Google Scholar]
регулируется гиббереллинами в меристематических областях. Завод Мол Биол. 1998; 36: 871–83. doi: 10.1023/A:1005938624418. [PubMed] [CrossRef] [Google Scholar]
58. Horvath DP, Chao WS, Anderson JV. Молекулярный анализ сигналов, контролирующих покой и рост в подземных адвентивных почках листового молочая. Завод Физиол. 2002;128:1439–46. doi: 10.1104/стр.010885. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Skirycz A, Radziejwoski A, Busch W, Hannah MA, Czeszejko J, Kwaśniewski M, et al. Транскрипционный фактор DOF OBP1 участвует в регуляции клеточного цикла у Arabidopsis thaliana . Растение J Cell Mol Biol. 2008; 56: 779–92. doi: 10.1111/j.1365-313X.2008.03641.x. [PubMed] [CrossRef] [Google Scholar]
60. Derory J, Léger P, Garcia V, Schaeffer J, Hauser MT, Salin F, et al. Транскриптомный анализ распускания почек дуба скального ( Quercus petraea ) Новый фитол. 2006; 170:723–38. doi: 10.1111/j.1469-8137.2006.01721.x. [PubMed] [CrossRef] [Google Scholar]
61. Перет Б., Сваруп К., Фергюсон А., Сет М., Ян И., Дондт С. и др. Гены AUX / LAX кодируют семейство переносчиков притока ауксина, которые выполняют различные функции во время развития Arabidopsis . Растительная клетка. 2012;24:2874–85. doi: 10.1105/tpc.112.097766. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Перет Б., Сваруп К., Фергюсон А., Сет М., Ян И., Дондт С. и др. Гены AUX / LAX кодируют семейство переносчиков притока ауксина, которые выполняют различные функции во время развития Arabidopsis . Растительная клетка. 2012;24:2874–85. doi: 10.1105/tpc.112.097766. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Бенцинк Л., Коорнниф М. Покой семян и прорастание. Арабская книга Am Soc Plant Biol. 2008;6:e0119. doi: 10.1199/таб.0119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Нефф М.М., Нгуен С.М., Маланчарувил Э.Дж., Фудзиока С., Ногучи Т., Сето Х. и др. BAS1 : ген, регулирующий уровни брассиностероидов и реакцию на свет у Arabidopsis . Proc Natl Acad Sci U S A. 1999; 96:15316–23. doi: 10.1073/pnas.96.26.15316. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Карлберг А., Энглунд М., Петтерле А., Молнар Г., Шодин А., Бако Л. и соавт. Анализ глобальных изменений в экспрессии генов во время цикла активности-покоя у верхушки гибридной осины. Биотехнология растений. 2010; 27:1–16. doi: 10.5511/plantbiotechnology.27.1. [CrossRef] [Google Scholar]
Биотехнология растений. 2010; 27:1–16. doi: 10.5511/plantbiotechnology.27.1. [CrossRef] [Google Scholar]
65. Riou-Khamlichi C, Menges M, Healy JM, Murray JA. Сахарный контроль клеточного цикла растений: дифференциальная регуляция экспрессии гена циклина Arabidopsis D-типа. Мол Селл Биол. 2000;20:4513–21. doi: 10.1128/MCB.20.13.4513-4521.2000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Hanson J, Hanssen M, Wiese A, Hendriks MMWB, Smeekens S. Регулируемый сахарозой фактор транскрипции bZIP11 влияет на метаболизм аминокислот, регулируя экспрессию аспарагинсинтетазы1 и пролиндегидрогеназы2. Растение J Cell Mol Biol. 2008;53:935–49. doi: 10.1111/j.1365-313X.2007.03385.x. [PubMed] [CrossRef] [Google Scholar]
67. Gao F, Jordan MC, Ayele BT. Транскрипционные программы, регулирующие покой семян и их высвобождение путем дозревания мягкой пшеницы ( Triticum aestivum L.) Plant Biotechnol J. 2012;10:465–76. doi: 10.1111/j.1467-7652.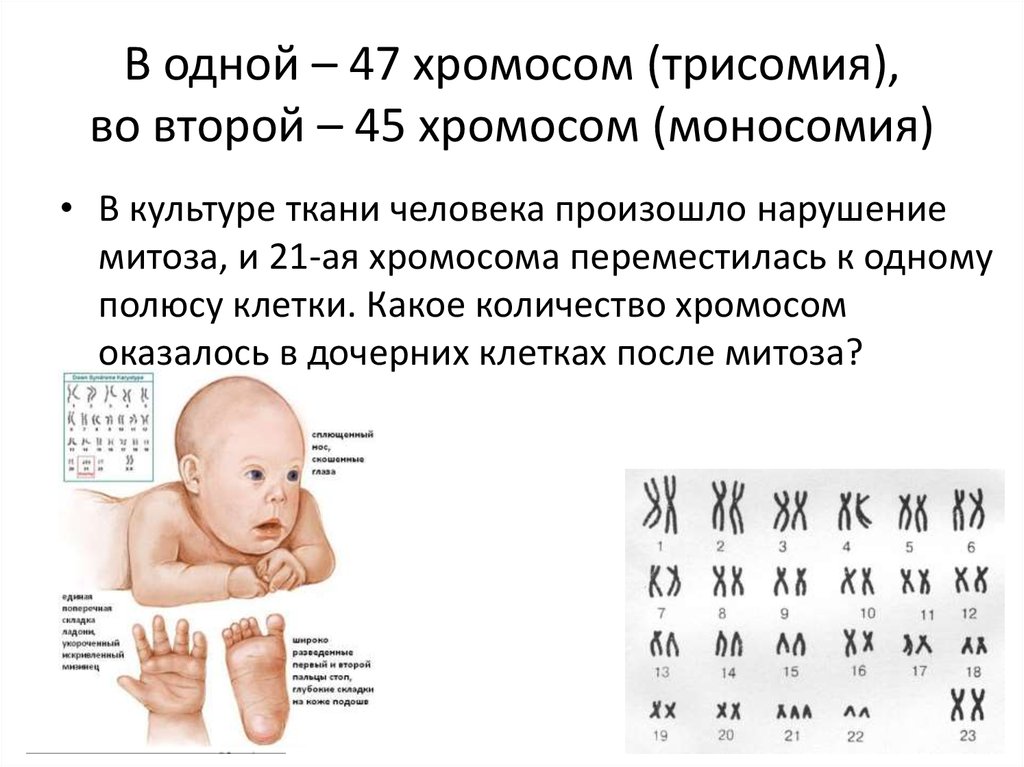 2012.00682.x. [PubMed] [CrossRef] [Google Scholar]
2012.00682.x. [PubMed] [CrossRef] [Google Scholar]
68. Gonzali S, Loreti E, Solfanelli C, Novi G, Alpi A, Perata P. Идентификация генов, модулирующих сахар, и доказательства in vivo восприятия сахара у Arabidopsis . J Завод Res. 2006; 119:115–23. doi: 10.1007/s10265-005-0251-1. [PubMed] [CrossRef] [Google Scholar]
69. Huang X, Madan A. CAP3: программа сборки последовательности ДНК. Геном Res. 1999;9:868–77. doi: 10.1101/gr.9.9.868. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Le Provost G, Herrera R, Paiva JA, Chaumeil P, Salin F, Plomion C. Микрометод для высокопроизводительной экстракции РНК из лесных деревьев. Биол Рез. 2007;40:291–7. doi: 10.4067/S0716-97602007000400003. [PubMed] [CrossRef] [Google Scholar]
71. Ewing B, Hillier L, Wendl MC, Green P. Базовый вызов следов автоматического секвенсора с использованием phred. I Оценка точности. Геном Res. 1998; 8: 175–85. doi: 10.1101/gr.8.3.175. [PubMed] [CrossRef] [Академия Google]
72. Тарайло-Граовац М., Чен Н. Использование повторного маскирования для идентификации повторяющихся элементов в геномных последовательностях. Курр Проток Биоинформа. 2009;4:4.10.1-4.10.14. [Google Scholar]
Тарайло-Граовац М., Чен Н. Использование повторного маскирования для идентификации повторяющихся элементов в геномных последовательностях. Курр Проток Биоинформа. 2009;4:4.10.1-4.10.14. [Google Scholar]
73. Falgueras J, Lara AJ, Fernández-Pozo N, Cantón FR, Pérez-Trabado G, Claros MG. SeqTrim: конвейер с высокой пропускной способностью для предварительной обработки считанных последовательностей любого типа. Биоинформатика BMC. 2010;11:38. дои: 10.1186/1471-2105-11-38. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Zerbino DR, Birney E. Velvet: алгоритмы для новой сборки коротких чтений с использованием графов де Брейна. Геном Res. 2008; 18: 821–9.. doi: 10.1101/gr.074492.107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Pertea G, Huang X, Liang F, Antonescu V, Sultana R, Karamycheva S, et al. Инструменты кластеризации генных индексов TIGR (TGICL): программная система для быстрой кластеризации больших наборов данных EST. Биоинформа Oxf англ. 2003; 19: 651–2. doi: 10.1093/биоинформатика/btg034. [PubMed] [CrossRef] [Google Scholar]
2003; 19: 651–2. doi: 10.1093/биоинформатика/btg034. [PubMed] [CrossRef] [Google Scholar]
76. Chevreux B, Pfisterer T, Drescher B, Driesel AJ, Müller WEG, Wetter T, et al. Использование ассемблера miraEST для надежной и автоматизированной сборки транскриптов мРНК и обнаружения SNP в секвенированных EST. Геном Res. 2004; 14:1147–59.. doi: 10.1101/gr.1917404. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Chevreux B, Wetter T, Suhai S. Сборка последовательности генома с использованием сигналов трассировки и дополнительной информации о последовательности. Ганновер, Германия: Учеб. Немецкая конференция по биоинформатике GCB’99 GCB; 1999. С. 45–56. [Google Scholar]
78. Li W, Jaroszewski L, Godzik A. Кластеризация высоко гомологичных последовательностей для уменьшения размера больших баз данных белков. Биоинформа Oxf англ. 2001; 17: 282–3. дои: 10.1093/биоинформатика/17.3.282. [PubMed] [CrossRef] [Google Scholar]
79. Fu L, Niu B, Zhu Z, Wu S, Li W. CD-HIT: ускорено для кластеризации данных секвенирования следующего поколения. Биоинформа Oxf англ. 2012;28:3150–2. doi: 10.1093/биоинформатика/bts565. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
CD-HIT: ускорено для кластеризации данных секвенирования следующего поколения. Биоинформа Oxf англ. 2012;28:3150–2. doi: 10.1093/биоинформатика/bts565. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Brown CT, Howe A, Zhang Q, Pyrkosz AB, Brom TH. Алгоритм без ссылок для вычислительной нормализации данных секвенирования дробовика. ArXiv12034802. Q-Био. 2012. http://arxiv.org/abs/1203.4802.
81. Байрох А., Бекманн Б., Ферро С., Гастайгер Э. Swiss-Prot: жонглирование между эволюцией и стабильностью. Кратко Биоинформ. 2004; 5:39–55. doi: 10.1093/наг/5.1.39. [PubMed] [CrossRef] [Google Scholar]
82. Международная инициатива по геному персика. Verde I, Abbott AG, Scalabrin S, Jung S, Shu S, et al. Высококачественный проект генома персика ( Prunus persica ) идентифицирует уникальные закономерности генетического разнообразия, одомашнивания и эволюции генома. Нат Жене. 2013;45:487–94. doi: 10.1038/ng.2586. [PubMed] [CrossRef] [Академия Google]
83. Tuskan GA, Difazio S, Jansson S, Bohlmann J, Grigoriev I, Hellsten U, et al. Геном тополя черного, Populus trichocarpa (Torr. & Grey) Science. 2006; 313:1596–604. doi: 10.1126/science.1128691. [PubMed] [CrossRef] [Google Scholar]
Tuskan GA, Difazio S, Jansson S, Bohlmann J, Grigoriev I, Hellsten U, et al. Геном тополя черного, Populus trichocarpa (Torr. & Grey) Science. 2006; 313:1596–604. doi: 10.1126/science.1128691. [PubMed] [CrossRef] [Google Scholar]
84. Jaillon O, Aury J-M, Noel B, Policriti A, Clepet C, Casagrande A, et al. Последовательность генома виноградной лозы предполагает наследственную гексаплоидизацию в основных типах покрытосеменных растений. Природа. 2007; 449: 463–7. doi: 10.1038/nature06148. [PubMed] [CrossRef] [Академия Google]
85. Myburg AA, Grattapaglia D, Tuskan GA, Hellsten U, Hayes RD, Grimwood J, et al. Последовательность генома Eucalyptus grandis : глобальная древесная культура для получения клетчатки и энергии. Природа. 2014; 510:356–62. [PubMed] [Google Scholar]
86. Swarbreck D, Wilks C, Lamesch P, Berardini TZ, Garcia-Hernandez M, Foerster H, et al. Информационный ресурс Arabidopsis (TAIR): аннотация структуры и функций генов. Нуклеиновые Кислоты Res. 2008; 36 (выпуск базы данных): D1009–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2008; 36 (выпуск базы данных): D1009–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Camacho C, Coulouris G, Avagyan V, Ma N, Papadopoulos J, Bealer K, et al. BLAST+: архитектура и приложения. Биоинформатика BMC. 2009;10:421. doi: 10.1186/1471-2105-10-421. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
88. Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, et al. Онтология генов: инструмент для объединения биологии: Консорциум онтологий генов. Нат Жене. 2000; 25:25–9. дои: 10.1038/75556. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Camon E, Barrell D, Brooksbank C, Magrane M, Apweiler R. Проект аннотации генной онтологии (GOA) – применение GO в SWISS-PROT, TreMBL и InterPro. Comp Funct Genomics. 2003; 4:71–4. doi: 10.1002/cfg.235. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Hunter S, Apweiler R, Attwood TK, Bairoch A, Bateman A, Binns D, et al. InterPro: интегративная база данных сигнатур белков. Нуклеиновые Кислоты Res. 2009; 37 (выпуск базы данных): D211–5. doi: 10.1093/nar/gkn785. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нуклеиновые Кислоты Res. 2009; 37 (выпуск базы данных): D211–5. doi: 10.1093/nar/gkn785. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Finn RD, Mistry J, Tate J, Coggill P, Heger A, Pollington JE, et al. База данных семейств белков Pfam. Нуклеиновые Кислоты Res. 2010; 38 (выпуск базы данных): D211–22. doi: 10.1093/nar/gkp985. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
92. Conesa A, Götz S, García-Gómez JM, Terol J, Talón M, Robles M. Blast2GO: универсальный инструмент для аннотирования, визуализации и анализа в исследованиях функциональной геномики. Биоинформа Oxf англ. 2005;21:3674–6. doi: 10.1093/биоинформатика/bti610. [PubMed] [CrossRef] [Академия Google]
93. Томпсон Дж. Д., Хиггинс Д. Г., Гибсон Т. Дж. CLUSTAL W: повышение чувствительности прогрессивного множественного выравнивания последовательностей за счет взвешивания последовательностей, штрафов за пробелы для конкретных позиций и выбора матрицы весов. Нуклеиновые Кислоты Res. 1994; 22:4673–80. doi: 10.1093/нар/22.22.4673. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1994; 22:4673–80. doi: 10.1093/нар/22.22.4673. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
94. Ян З. PAML 4: филогенетический анализ методом максимального правдоподобия. Мол Биол Эвол. 2007; 24:1586–91. doi: 10.1093/molbev/msm088. [PubMed] [CrossRef] [Академия Google]
95. Herrmann S, Munch J-C, Buscot F. Система культивирования гнотобиотиков с микрочеренками дуба для изучения специфического воздействия микобионтов на морфологию растений до и на ранней стадии образования эктомикоризы с помощью Paxillus involutus и Piloderma croceum . Новый Фитол. 1998; 138: 203–12. doi: 10.1046/j.1469-8137.1998.00105.x. [CrossRef] [Google Scholar]
96. Ward JH, Jr Иерархическая группировка для оптимизации целевой функции. J Am Stat Assoc. 1963; 58: 236–44. дои: 10.1080/01621459.1963.10500845. [CrossRef] [Google Scholar]
97. Suzuki R, Shimodaira H. Pvclust: пакет R для оценки неопределенности в иерархической кластеризации. Биоинформа Oxf англ. 2006; 22:1540–2. doi: 10.1093/биоинформатика/btl117. [PubMed] [CrossRef] [Google Scholar]
2006; 22:1540–2. doi: 10.1093/биоинформатика/btl117. [PubMed] [CrossRef] [Google Scholar]
98. Stekel DJ, Git Y, Falciani F. Сравнение экспрессии генов из нескольких библиотек кДНК. Геном Res. 2000;10:2055–61. doi: 10.1101/gr.GR-1325RR. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
99. Андерс С., Хубер В. Анализ дифференциальной экспрессии для данных подсчета последовательностей. Геном биол. 2010;11:R106. doi: 10.1186/gb-2010-11-10-r106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
100. Robinson MD, McCarthy DJ, Smyth GK. edgeR: пакет Bioconductor для анализа дифференциальной экспрессии цифровых данных экспрессии генов. Биоинформа Oxf англ. 2010;26:139–40. doi: 10.1093/биоинформатика/btp616. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
101. Mootha VK, Lindgren CM, Eriksson K-F, Subramanian A, Sihag S, Lehar J, et al. Гены, реагирующие на PGC-1альфа, участвующие в окислительном фосфорилировании, скоординированно подавлены при диабете человека.

 ) международных соглашений и более позднем Заявлении Торонто (2009 г.), данные секвенирования генома дуба предоставляются научному сообществу в свободный доступ ( www.oakgenome.fr ) до публикации, запланированной в в ближайшие месяцы научная работа будет завершена консорциумом.
) международных соглашений и более позднем Заявлении Торонто (2009 г.), данные секвенирования генома дуба предоставляются научному сообществу в свободный доступ ( www.oakgenome.fr ) до публикации, запланированной в в ближайшие месяцы научная работа будет завершена консорциумом.
Leave A Comment